Fraturas em Crianças com Condições Ósseas Preexistentes
Quando falamos sobre “fraturas patológicas na criança”, é essencial esclarecer que a fratura em si não é patológica, mas sim o osso que pode apresentar uma série de alterações, tais como estruturais, metabólicas, displásicas ou infecciosas. Portanto, é mais preciso referir-se ao osso como patológico, não a própria fratura. Dentro deste contexto, nosso foco será nas fraturas que ocorrem em crianças com condições ósseas pré-existentes.
Este capítulo visa abordar de forma mais específica as fraturas que se desenvolvem em crianças com tais condições. É importante ressaltar que a amplitude desse tema é vasta, o que nos leva a delimitar os tópicos a serem discutidos.
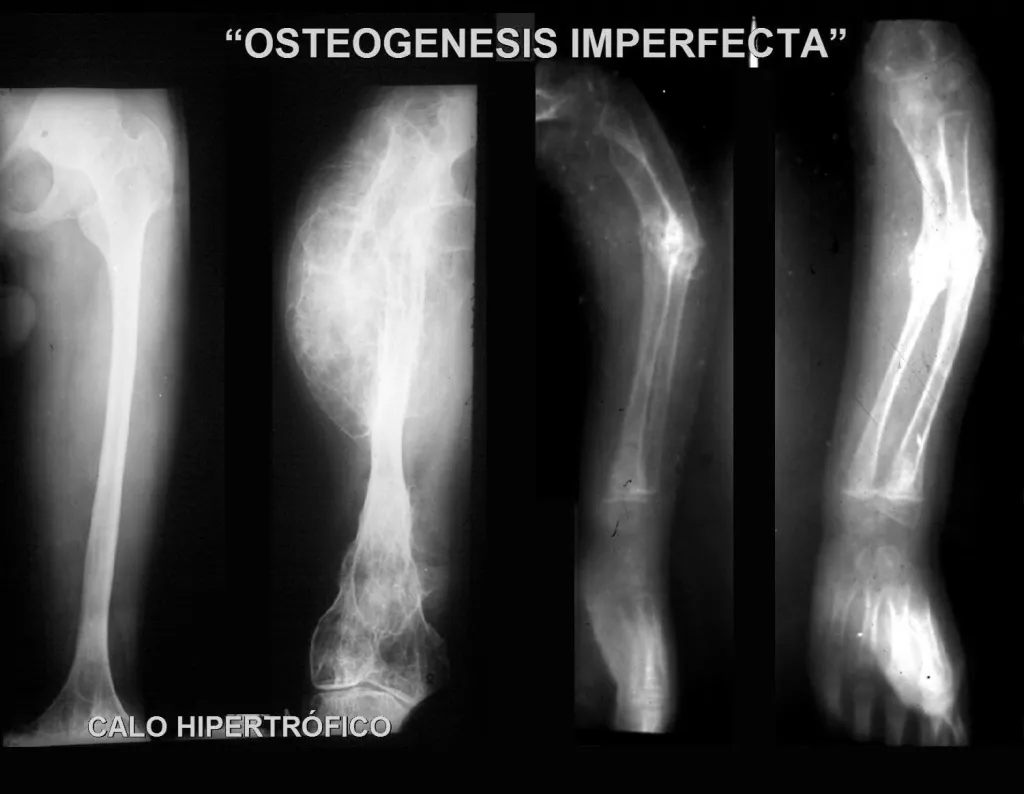
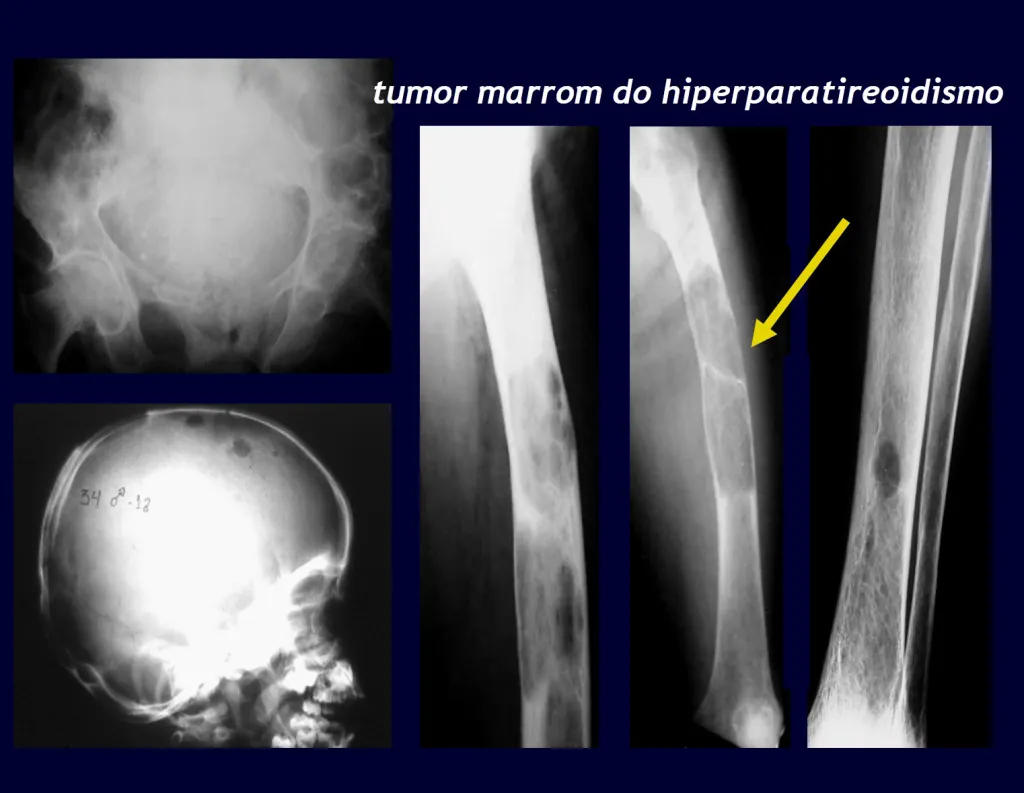
Decidimos não incluir fraturas relacionadas a processos infecciosos ou distúrbios metabólicos, como raquitismo ou osteopsatirose, neste capítulo. Em vez disso, nosso foco será nas fraturas por estresse, considerando o diagnóstico diferencial, bem como aquelas decorrentes de lesões ósseas tumorais ou pseudo-tumorais preexistentes.
Fraturas por estresse são particularmente relevantes devido à sua natureza e desafios associados ao diagnóstico e tratamento. Além disso, as fraturas decorrentes de lesões ósseas tumorais ou pseudo-tumorais requerem uma abordagem especializada para garantir o manejo adequado e o melhor prognóstico possível.
Dessa forma, ao delinear este capítulo, buscamos fornecer uma visão abrangente das fraturas em crianças com condições ósseas pré-existentes, destacando os aspectos mais relevantes para sua compreensão e manejo clínico.
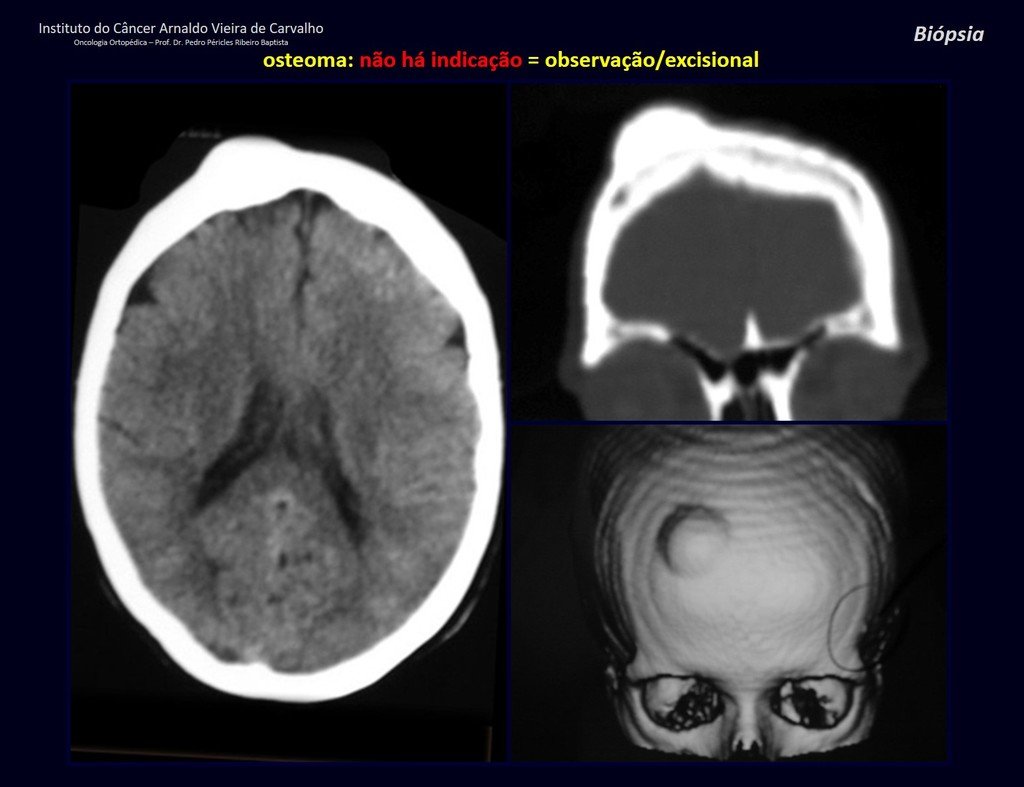
Tumores Ósseos Benignos:
Dentre as lesões tumorais benignas da infância, que mais frequentemente podem ocasionar fratura, destacamos o osteoblastoma e o condroblastoma.
Osteoblastoma –
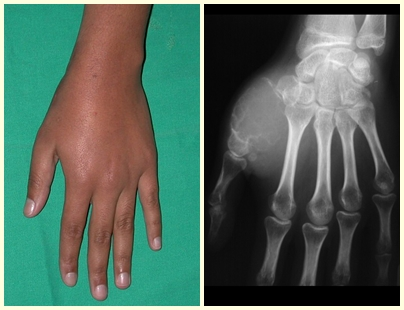
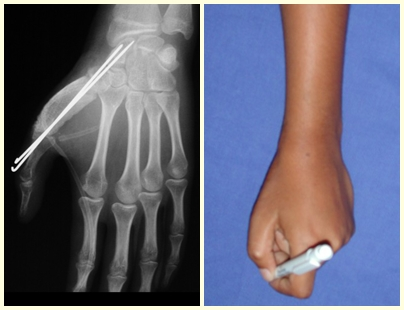
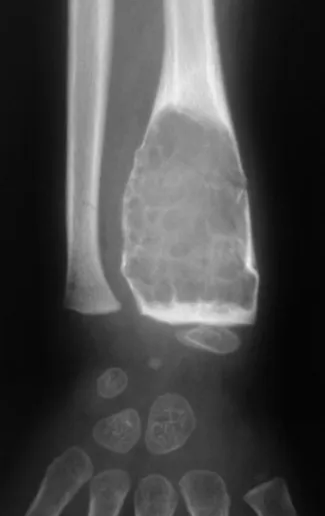
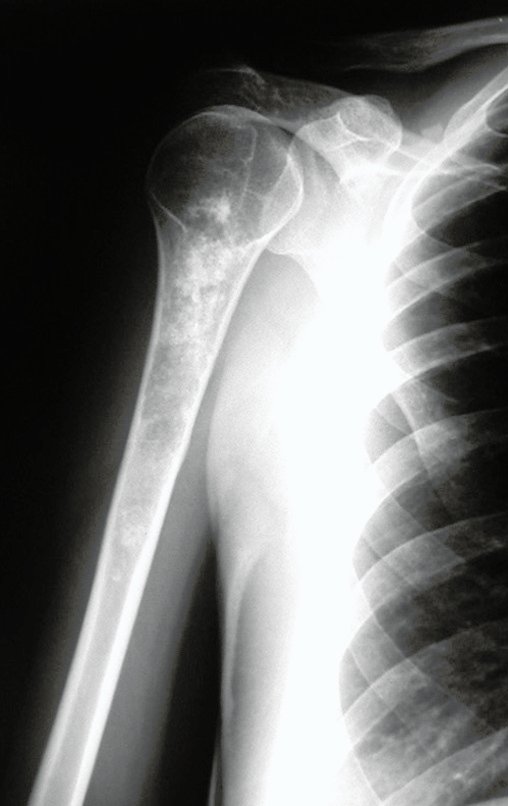
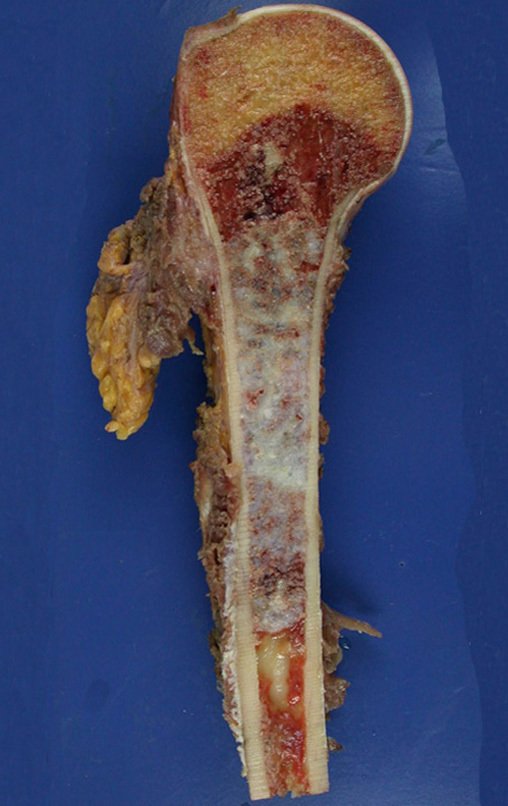
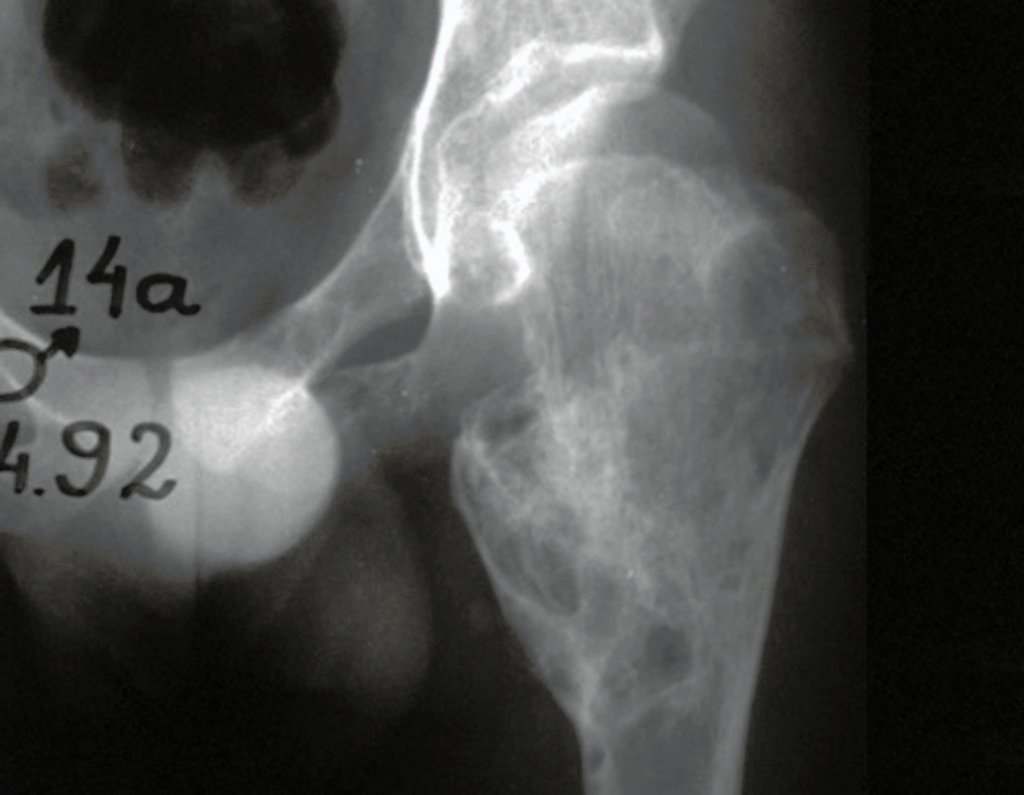
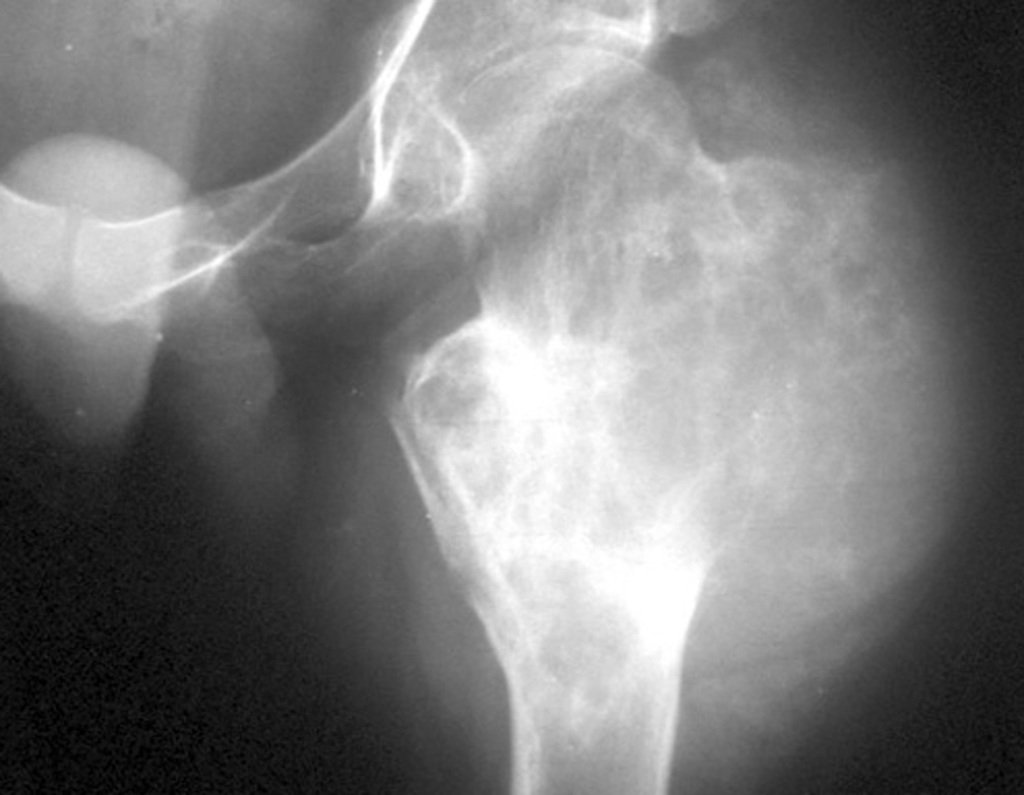
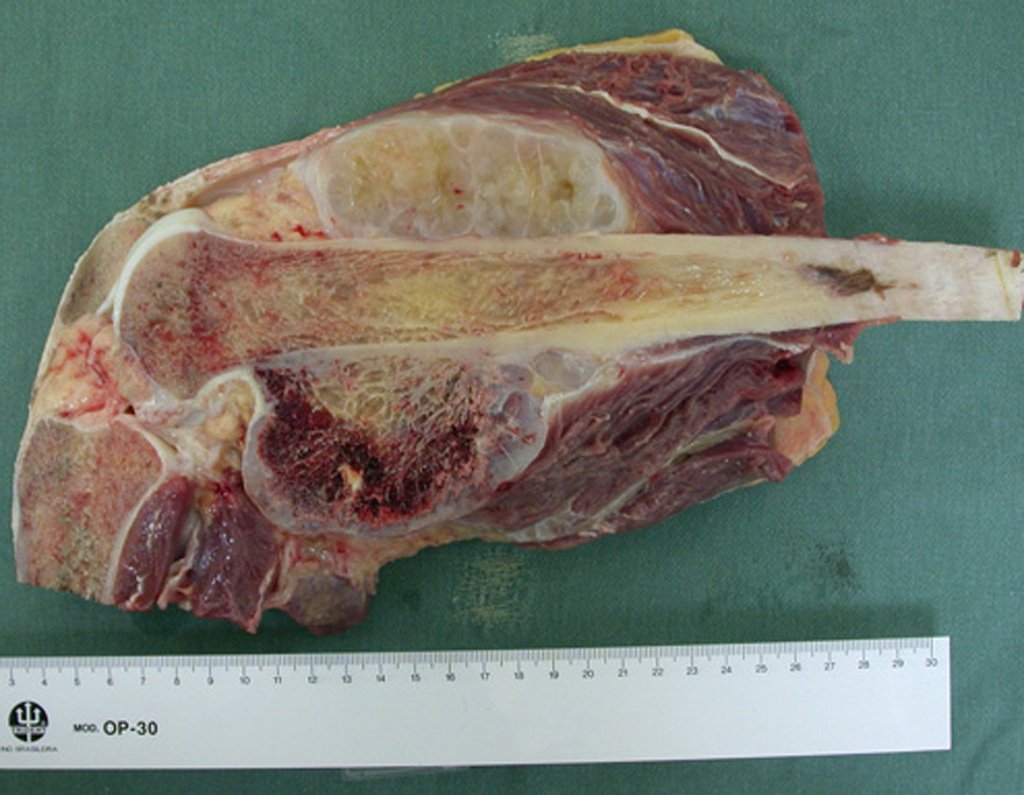
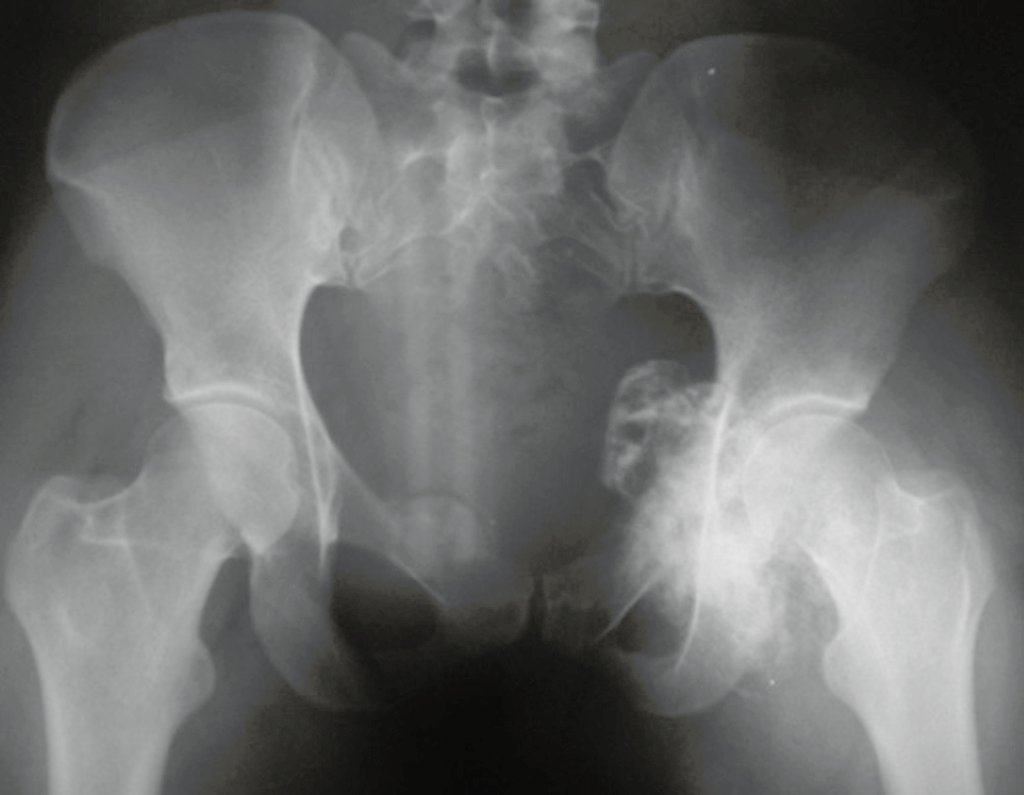
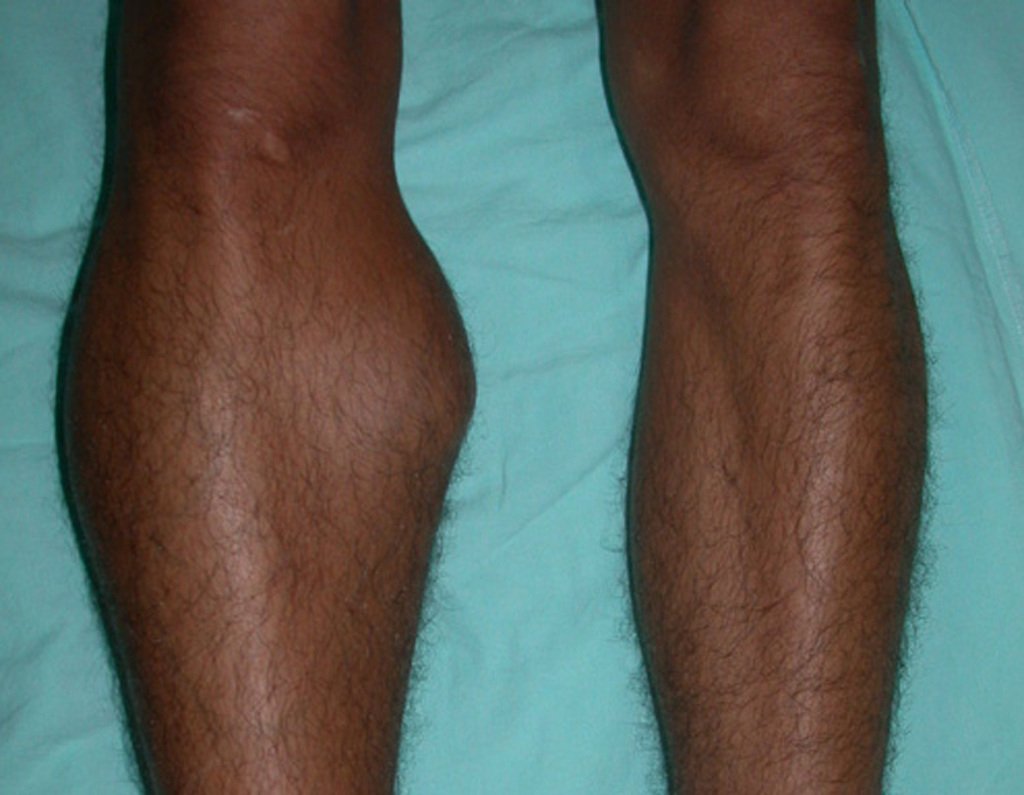
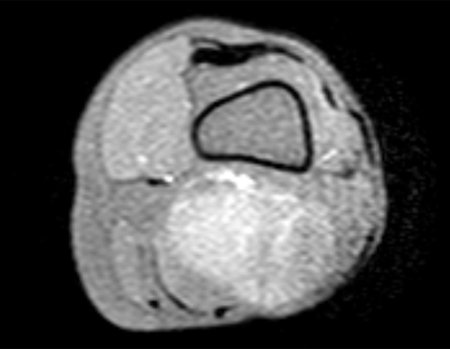
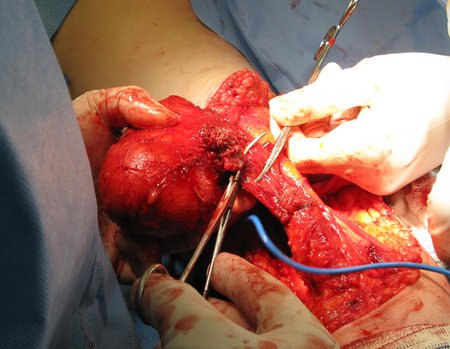
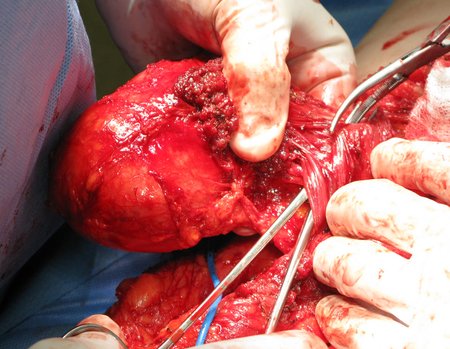
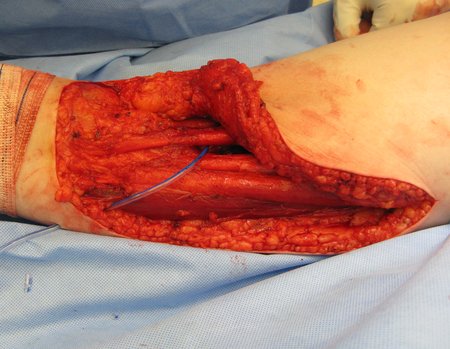
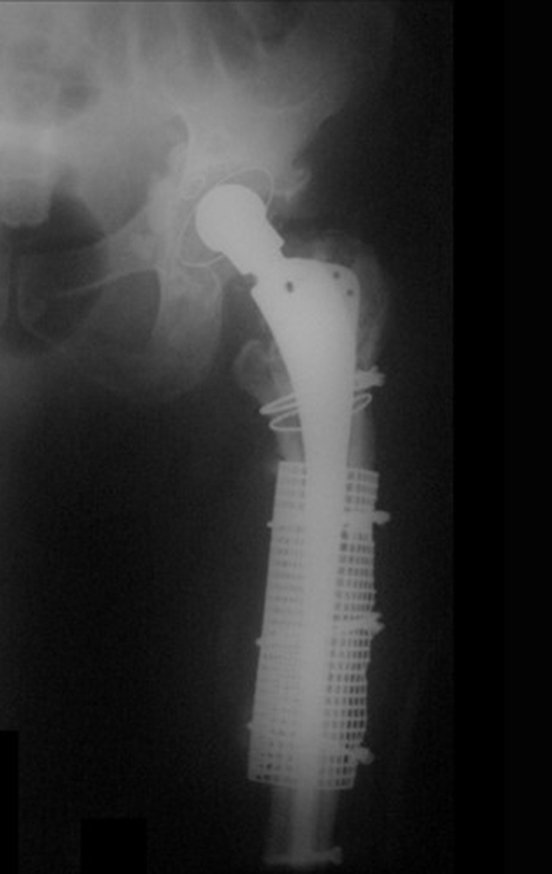
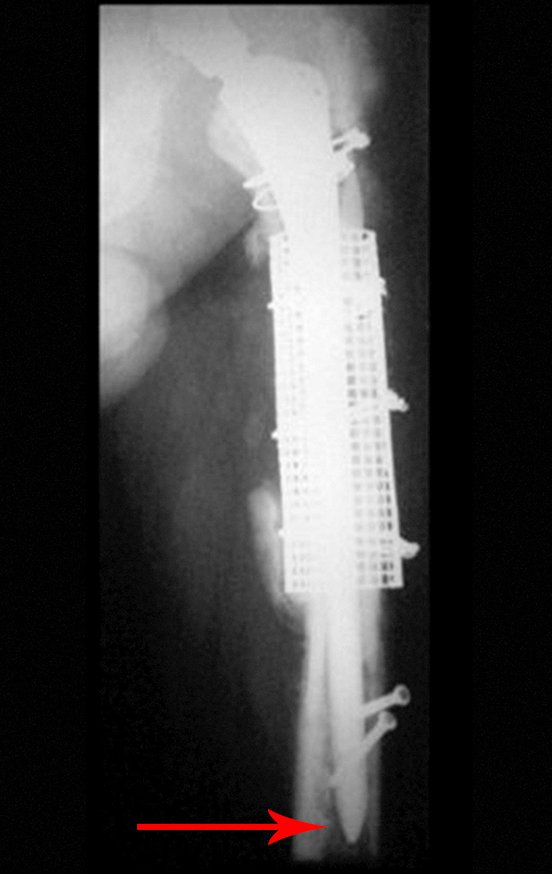
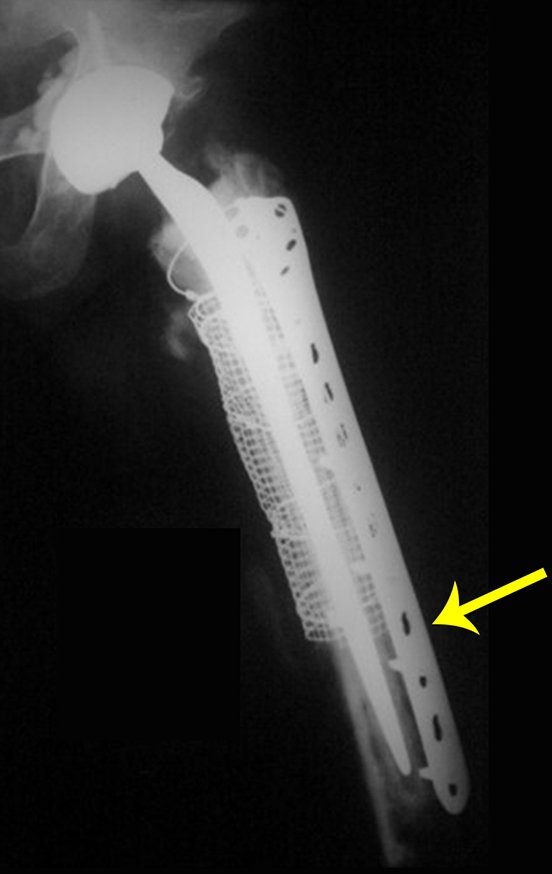
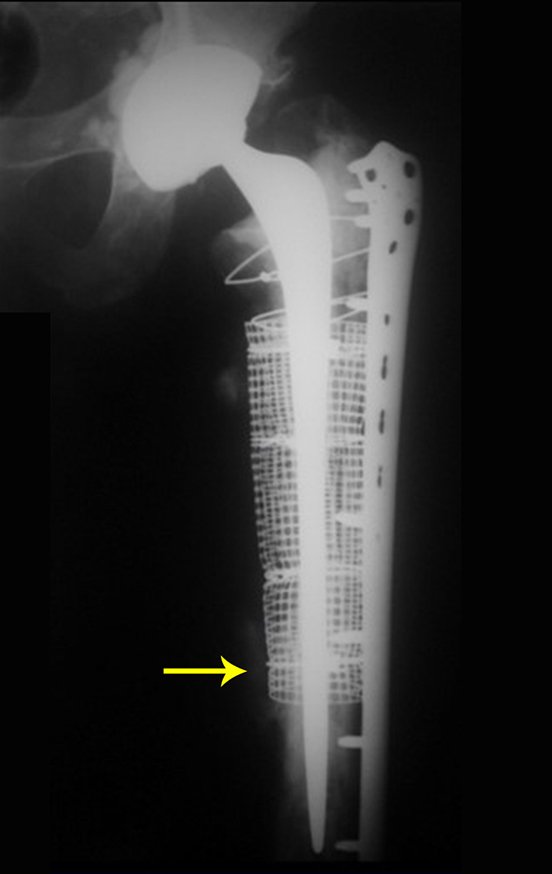
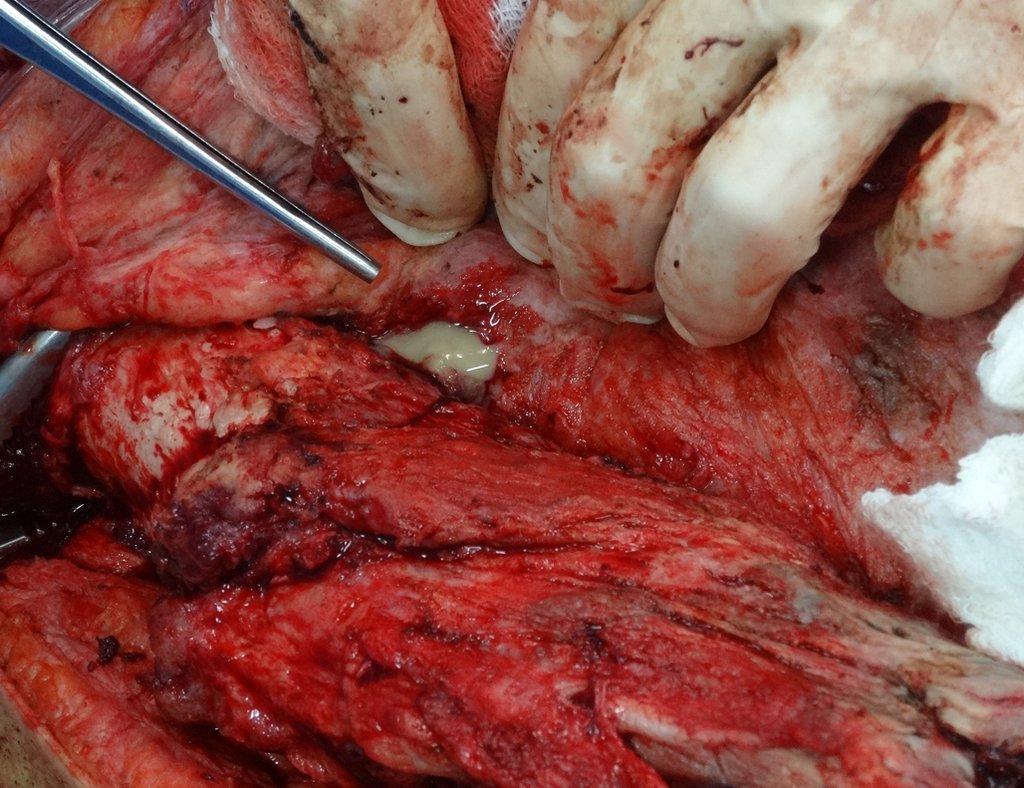
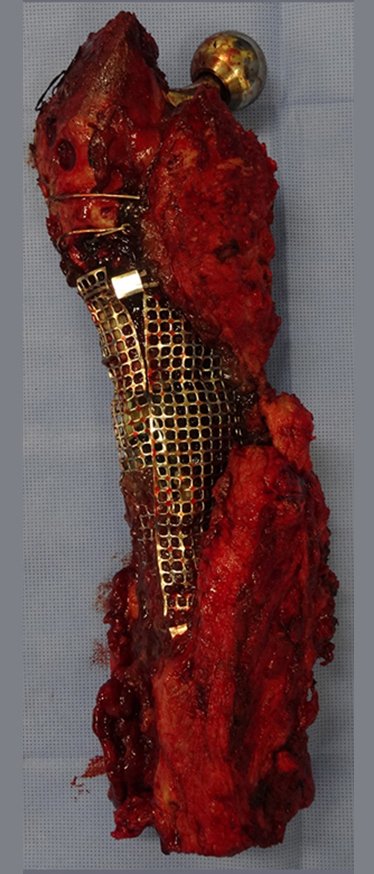
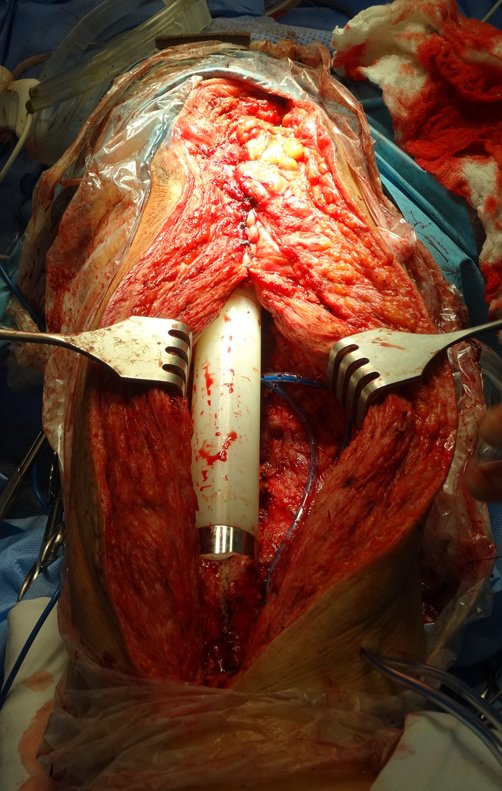
O osteoblastoma é um tumor ósseo localmente agressivo que nos ossos longos apresenta localização metafisária, de localização inicialmente cortical e excêntrica. Esta lesão, por ser localmente agressiva, com grande destruição do arcabouço ósseo, provoca micro fraturas, devido a erosão da cortical óssea (figs. 1 e 2). A progressiva destruição da cortical predispõe à fratura completa, quando o acometimento ultrapassa cinqüenta por cento da circunferência óssea. A fratura desta lesão facilita a disseminação local, dificultando o tratamento oncológico que requer reconstruções elaboradas e há limitação na recuperação funcional (figs. 3 e 4).
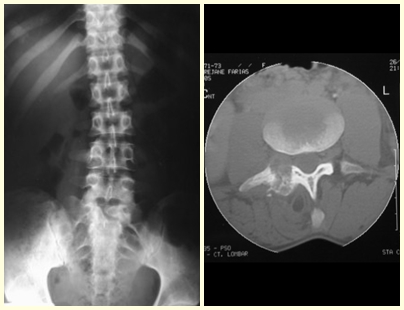
O osteoblastoma do pedículo da coluna vertebral pode ocasionar escoliose antálgica, pela dor do processo tumoral ou pela fratura (fig. 5 e 6).
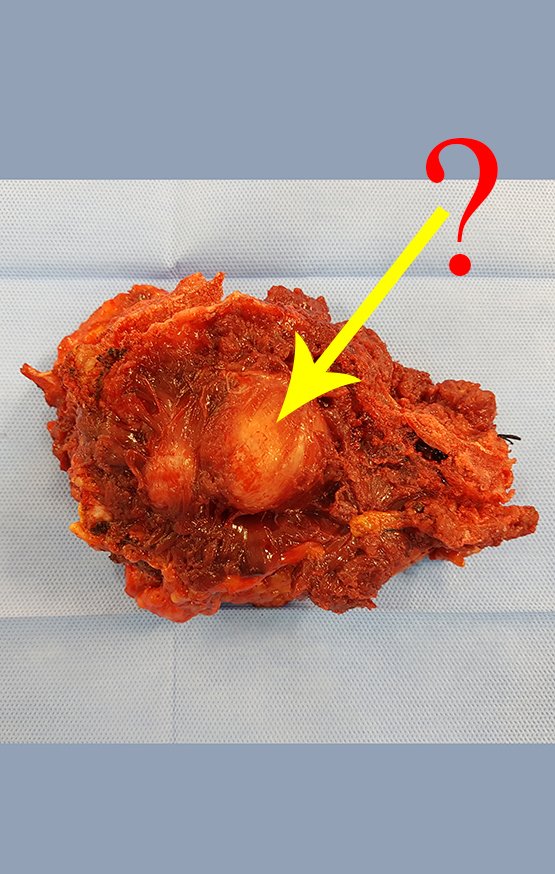
Condroblastoma –
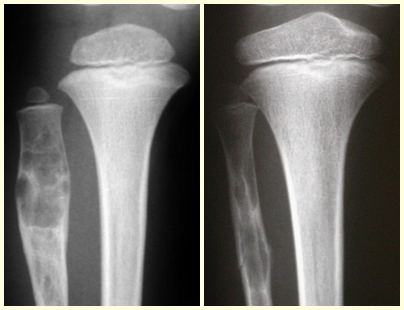
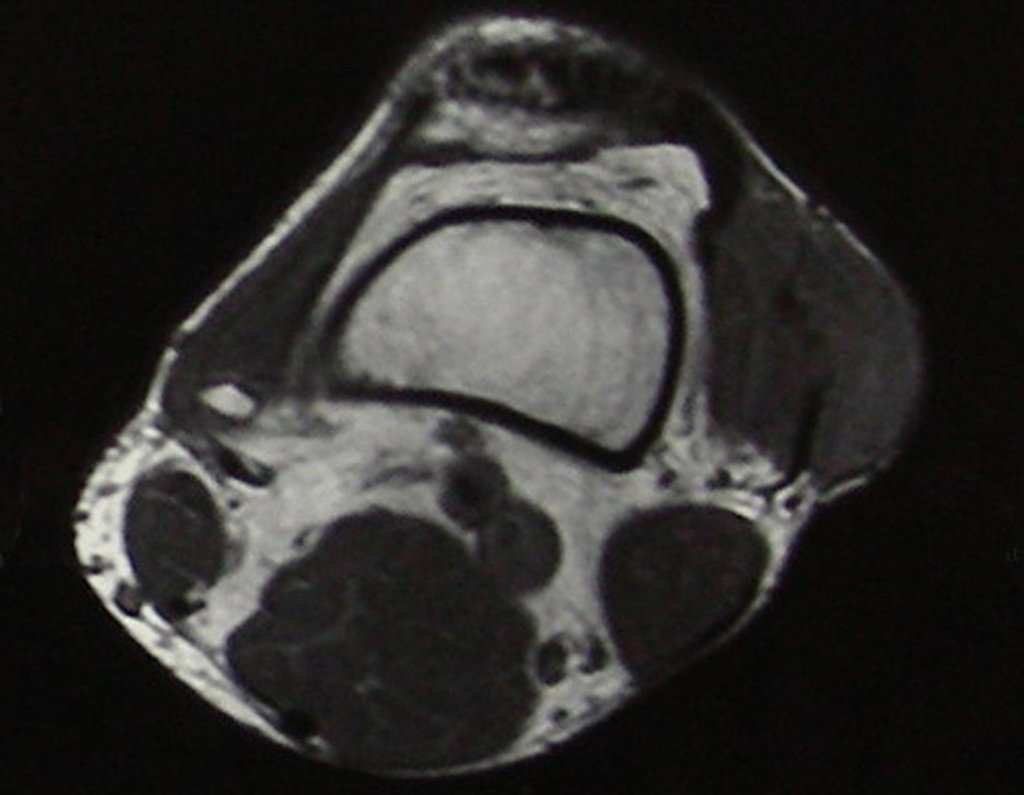
O condroblastoma afeta a região epifisária dos ossos longos em crescimento (figs. 7 e 8) e, em menor freqüência, a porção apofisária (figs 9 e 10).
Este tumor ósseo provoca reabsorção da epífise (ou da apófise), erosão da cortical óssea e invasão articular, levando a quadro de artralgia, podendo ocasionar deformidade e fratura afundamento articular.
O tratamento tanto do osteoblastoma quanto do condroblastoma é cirúrgico e deve ser efetuado o mais breve possível, pois estas lesões, apesar de histologicamente benignas, evoluem rapidamente para destruição do arcabouço ósseo local.
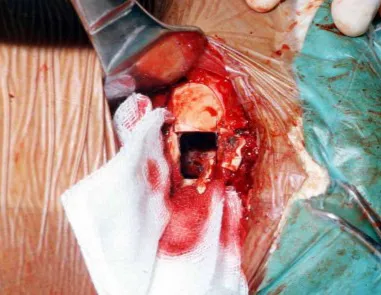
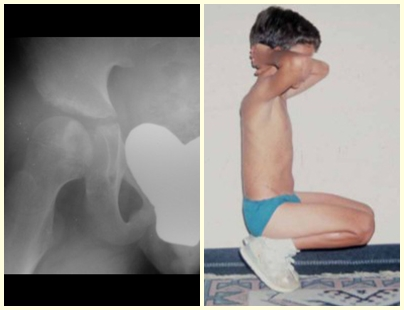
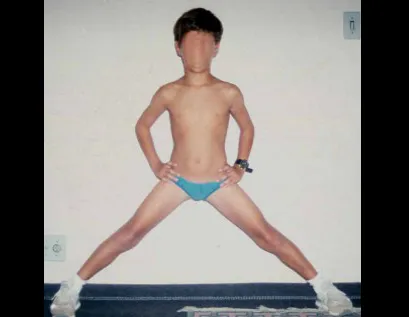
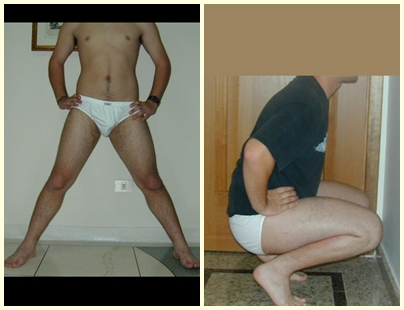
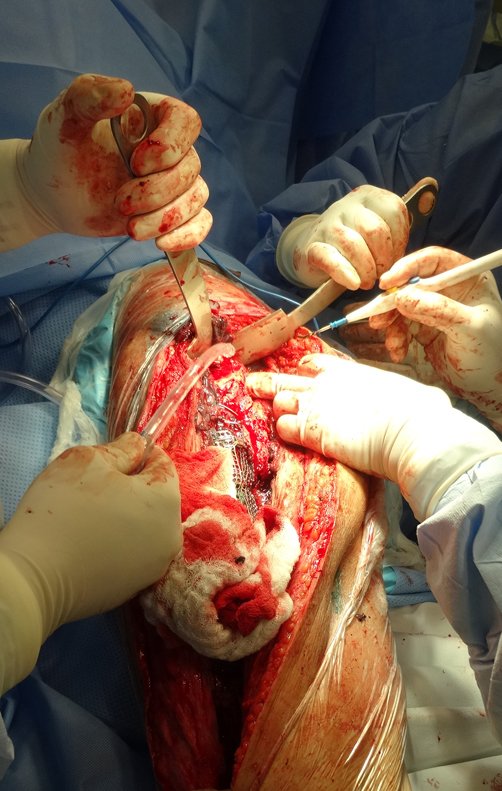
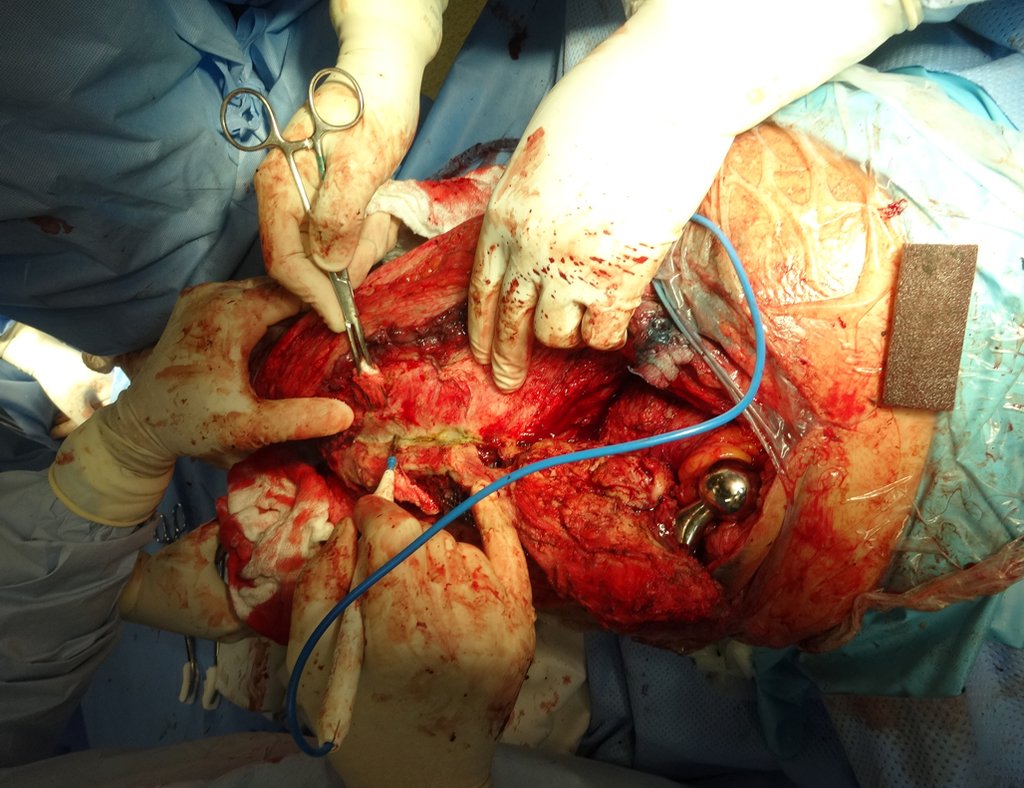
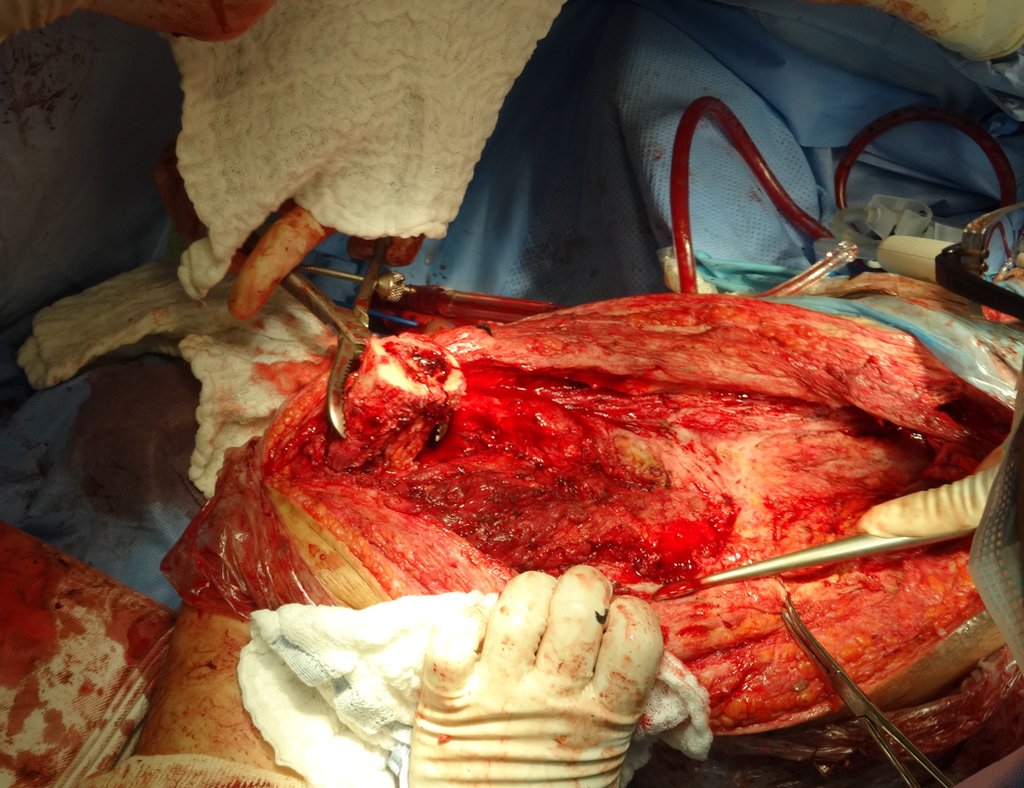
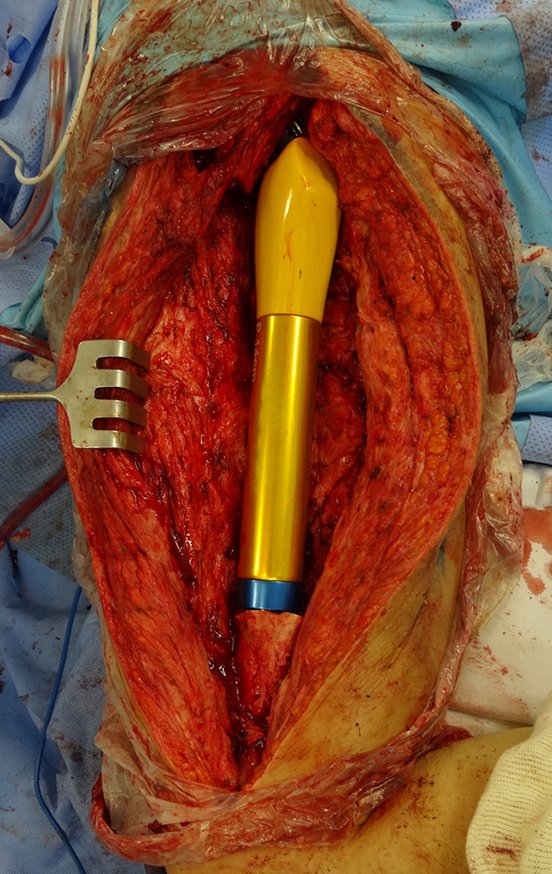
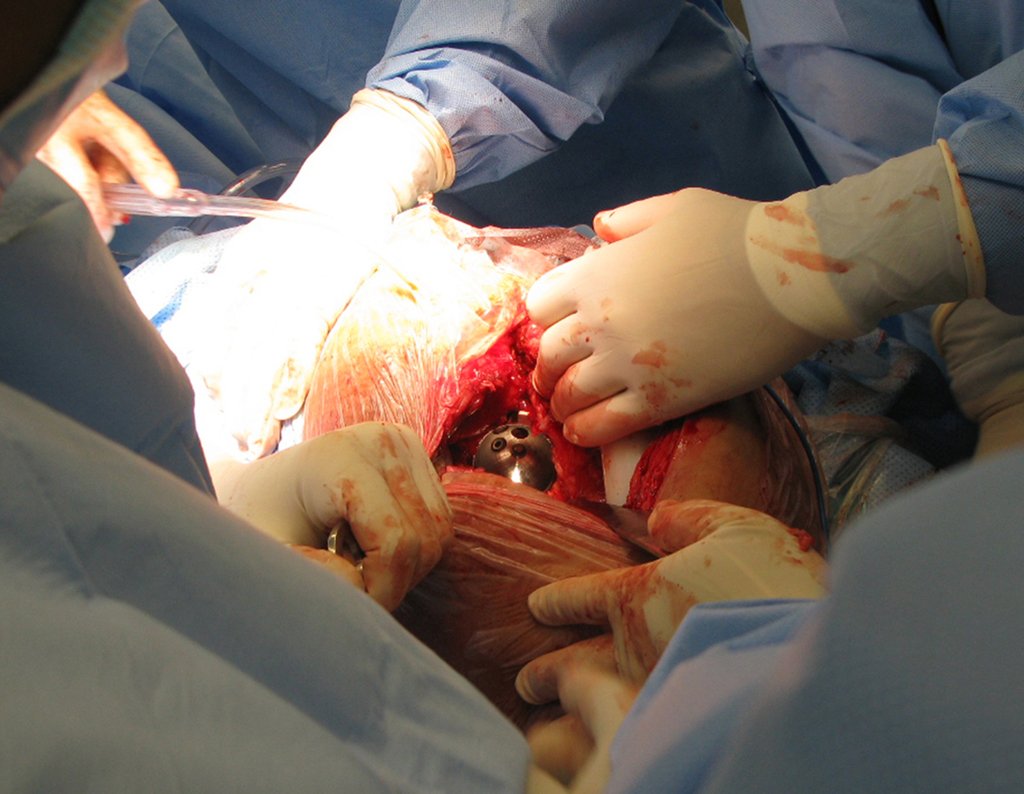
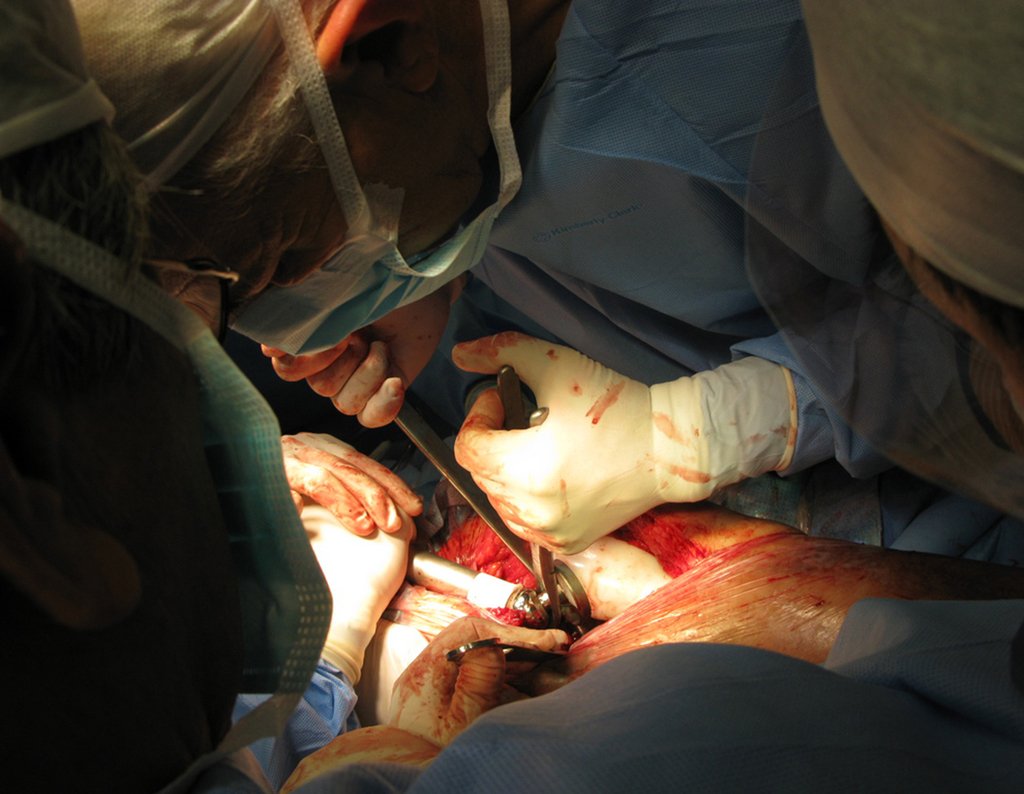
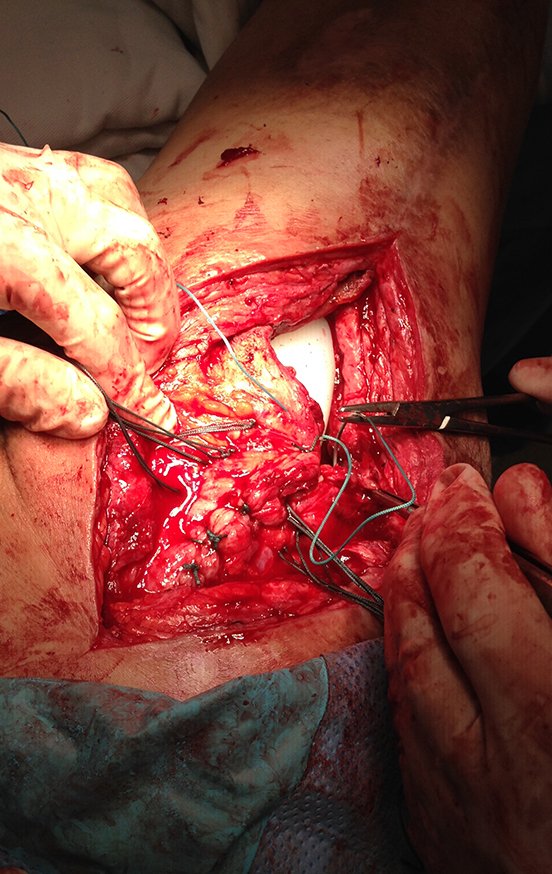
A melhor indicação, para se evitar a recorrência local, é a ressecção segmentar. Entretanto, devido à localização articular do condroblastoma é preferível fazer o acesso cirúrgico adequado à cada região, como neste exemplo que acomete a região póstero medial da cabeça femoral (fig. 11), realizar-se a curetagem intra lesional cuidadosa, seguida de adjuvante local, como fenol, nitrogênio líquido ou a eletrotermia (fig. 12), para o posterior preenchimento da cavidade com enxerto ósseo autólogo, restituindo a anatomia da região (fig. 13) e restabelecendo a função (figs 14 e 15).
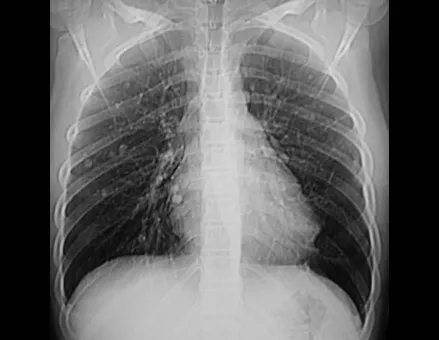
O condroblastoma, apesar de ser uma lesão benigna, além da recorrência local, pode evoluir com metástases pulmonares (fig. 16 e 17) que seguem sendo histologicamente benignas, sendo controversa a indicação de quimioterapia complementar.
Em nossa experiência tivemos dois casos de osteoblastoma e um caso de condroblastoma com doença secundária nos pulmões. Neste caso de condroblastoma foi realizada a toracotomia encontrando-se inúmeros nódulos pulmonares, que persistem até hoje. Este paciente, à época do diagnóstico das metástases, apresentou quadro de osteopatia pulmonar hipertrófica. Não realizou nenhum tratamento complementar e está assintomático até hoje, após treze anos (fig. 18 e `19) e com quinze anos da cirurgia (fig. 20 e 21).
Tumores Ósseos Malignos:
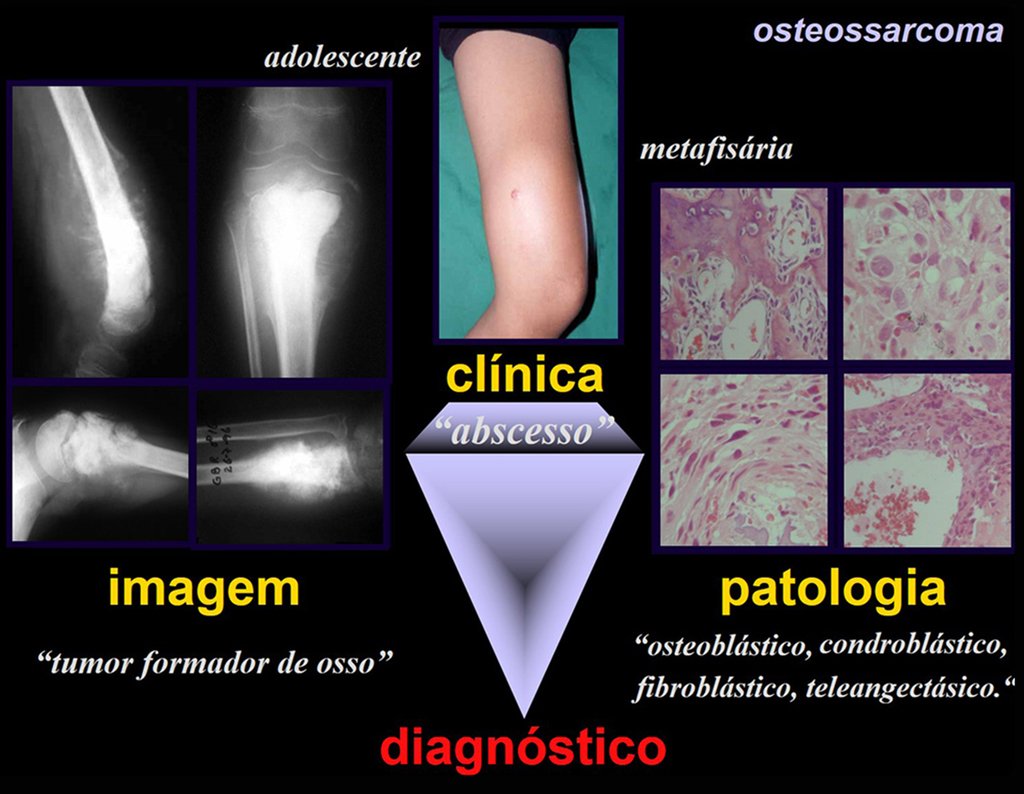
As neoplasias ósseas malignas mais freqüentes da infância são o osteossarcoma e o sarcoma de Ewing que devem ser diagnosticadas logo no início dos sintomas, pois causam dor e tumor palpável e precisam ser tratadas precocemente.
Osteossarcoma –
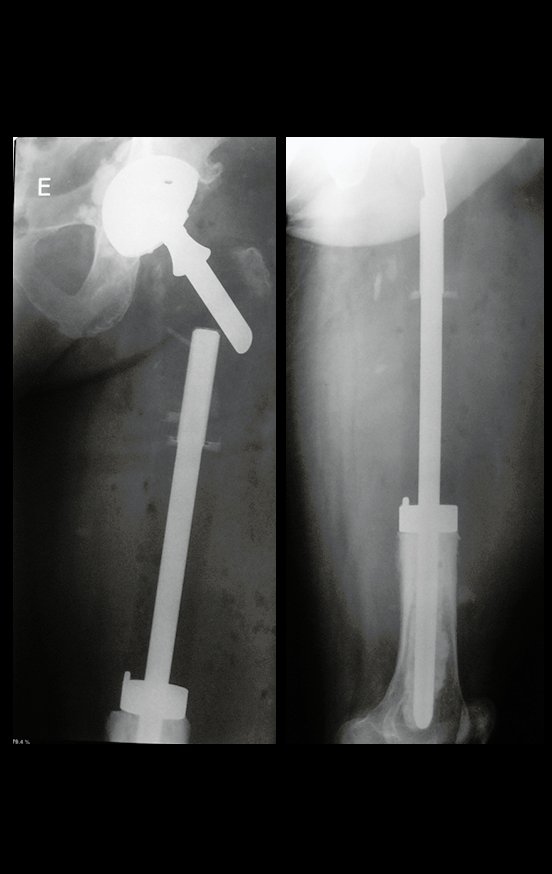
Em nosso meio não é incomum que o osteossarcoma já se apresente com fratura ao diagnóstico (figs. 22 e 23).
Nestas situações, o controle oncológico local pode requerer cirurgias ablativas, sendo a giroplastia de Van-Ness (figs. 24 e 25) uma alternativa a ser considerada.
Sarcoma de Ewing –
O Sarcoma de Ewing é um tumor ósseo maligno que pode confundir-se com a osteomielite e ser diagnosticado após fraturar-se (figs 30 à 36).
Clique aqui para ver o caso completo
Nas crianças, felizmente são raros os casos de neoplasias malignas que cursam com fraturas.
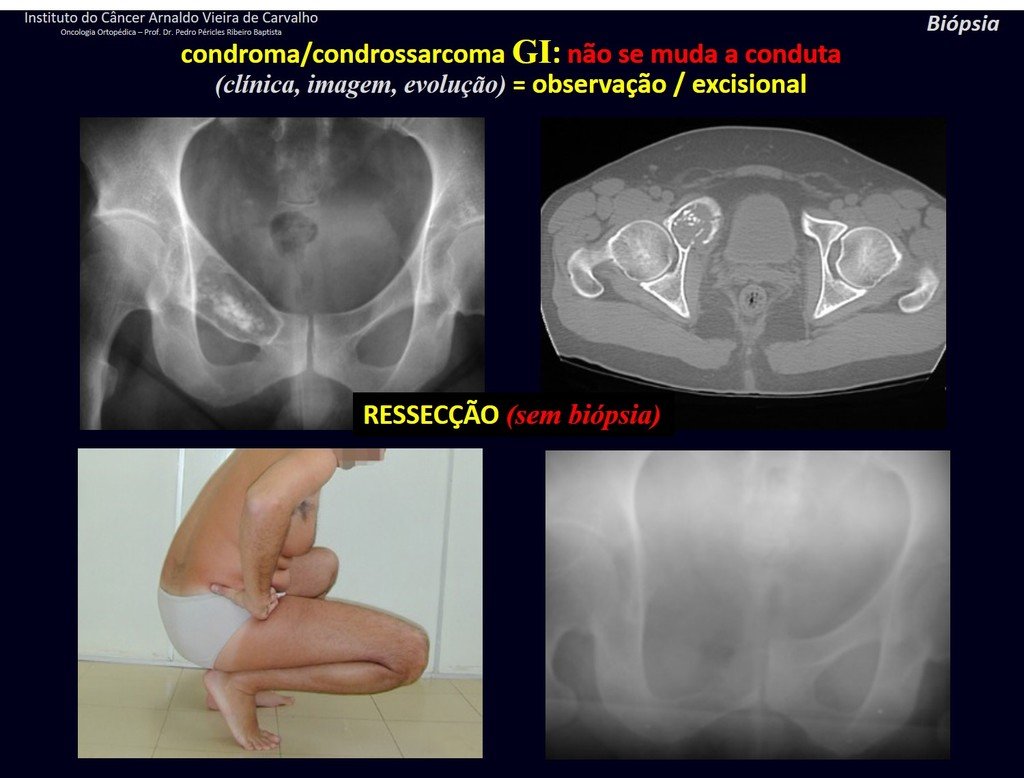
Lesões Ósseas Pseudo Tumorais:
As lesões ósseas que mais freqüentemente acompanham as fraturas nas crianças são as lesões pseudo-tumorais, destacando-se o cisto ósseo simples, o cisto ósseo aneurismático, a displasia fibrosa e o granuloma eosinófilo, nesta ordem de freqüência.
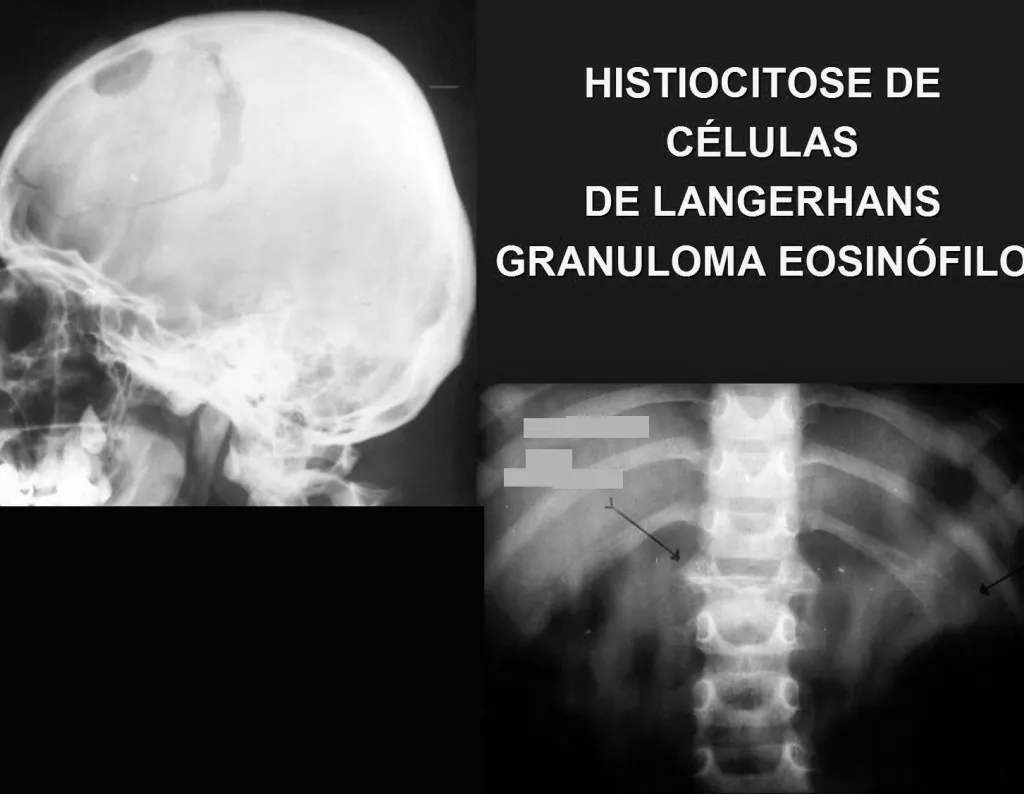
Granuloma Eosinófilo –
O granuloma eosinófilo apresenta-se como quadro inflamatório local e lesão com rarefação óssea acompanhada de reação periosteal lamelar grossa, que é uma característica radiográfica de benignidade. Outro aspecto do granuloma eosinófilo é apresentar área de rarefação do osso sem correspondente comprometimento extra-ósseo (fig. 37), distinguindo-o do sarcoma de Ewing, que é o tumor que mais precocemente apresenta tumor extra-cortical.
O granuloma eosinófilo pode apresentar-se com quadro clínico de fratura quando afeta a coluna vertebral em que ocorre a fratura acunhamento do corpo vertebral, descrita como vértebra plana de Calvé (fig. 38). Nesta situação, esta lesão pode evoluir para cura espontânea, podendo ocorrer inclusive a restauração do corpo da vértebra.
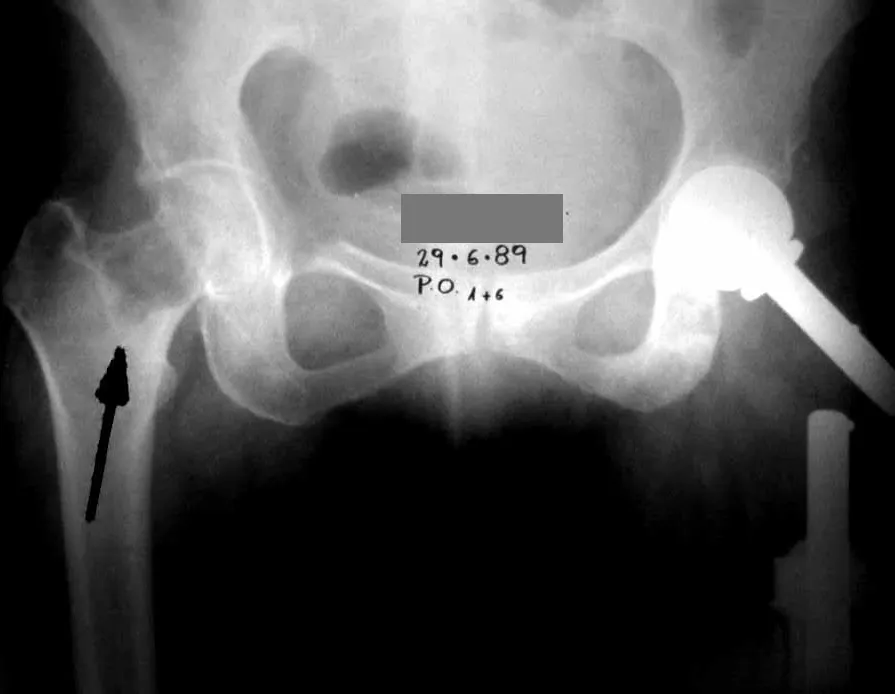
Outras localizações em que pode manifestar-se com quadro de micro-fraturas é quando acomete a região supra acetabular (fig. 39), ou em zonas de carga como a porção metafisária proximal do fêmur (fig. 40), devido a erosão da cortical medial.
Esta lesão responde bem ao tratamento cirúrgico de curetagem simples, sendo excepcional a necessidade de agregar-se enxerto ósseo.
Displasia Fibrosa –
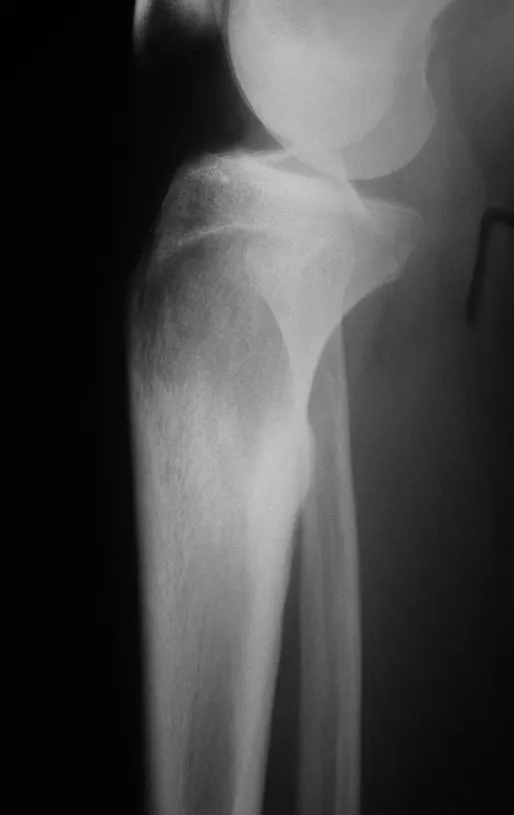
A displasia fibrosa é uma lesão pseudo-tumoral que leva a deformidade óssea mais freqüentemente. Entretanto, quando acomete o fêmur, pode ocasionar deformidade prévia, em cajado de pastor, característica desta afecção, com consequente fratura (fig. 41). A região do colo femoral com displasia fibrosa frequentemente evolui com fratura, mesmo sem deformidade prévia (fig. 42).
Para corrigir o defeito, há necessidade de curetagem da lesão, preenchimento com enxerto ósseo autólogo e osteotomias corretivas da deformidade (fig. 43). A fratura nesta localização pode ser de difícil solução, devido à dificuldade de consolidação pelo aspecto displásico do osso (fig. 44), levando à recidiva da doença e da deformidade.
Esta doença tende a estabilizar-se após a puberdade (fig. 48 e 49), mas por vezes são necessários vários procedimentos cirúrgicos durante o crescimento (fig. 50 e 51), para evitar-se deformidades compensatórias e obter-se o sucesso no tratamento.
A displasia fibrosa pode ainda fazer parte da pseudo-artrose congênita que acomete mais frequentemente o terço distal da tíbia, mas pode ocorrer em outras localizações como o terço proximal da tíbia (figuras 52, 53 e 54), com todas as dificuldades para alcançar-se a consolidação.
A pseudo-artrose congênita é uma afecção que merece ser estudada em capítulo à parte.
Cisto Ósseo Aneurismático –
O cisto ósseo aneurismático, também chamado de cisto hemático multilocular, é lesão de rarefação óssea insuflativa preenchida por líquido sero-sanguinolento, entremeada por espaços variáveis em tamanho e separados por septos de tecido conectivo contendo trabéculas de osso ou tecido osteóide e células gigantes ostoclásticas (fig. 55 e 56).
O paciente geralmente apresenta quadro de dor leve no local da lesão, quando o osso comprometido é superficial, podendo-se observar sinais inflamatórios como aumento de volume e calor. Geralmente o paciente correlaciona o início dos sintomas com algum traumatismo.
Na evolução pode haver aumento lento, progressivo ou rapidamente expansivo. Acomete qualquer osso, mais freqüentemente os membros inferiores, tíbia (figs. 57 e 58) e fêmur representando 35% dos casos.
As vértebras também são afetadas por esta lesão, inclusive o sacro. Na pelve o ramo iliopúbico é o mais frequentemente atingido. Podem mimetizar sintomas articulares quando atingem a epífise. O comprometimento na coluna vertebral pode ocasionar sintomas neurológicos compressivos, apesar de na maioria dos casos acometer as estruturas posteriores.
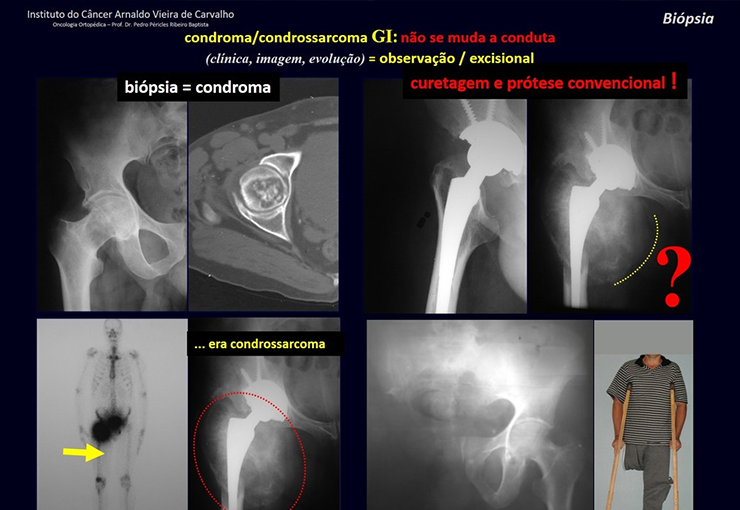
O tratamento de escolha tem sido a ressecção marginal ou curetagem intra lesional, seguida do preenchimento da cavidade com enxerto autólogo ou homólogo, quando necessário. Pode-se também preencher a cavidade com metilmetacrilato, embora nossa preferência seja por enxerto autólogo quando possível, por tratar-se de lesão benigna. Alguns autores associam tratamento adjuvante intra lesional como a aplicação de fenol, eletrotermia ou crioterapia. No cisto ósseo aneurismático clássico não vejo sentido para esta terapia, que entretanto deve ser aplicada quando o cirurgião encontra alguma área “suspeita” que não foi detectada no exame de imagem. Caso venha a tratar-se dos tumores benignos citados, que podem acompanhar-se de áreas de cisto ósseo aneurismático, a terapia adjuvante local será benéfica.
Alguns segmentos ósseos como as extremidades da fíbula, clavícula, costela, terço distal da ulna, proximal do rádio, etc podem ser ressecados, sem a necessidade de reconstrução.
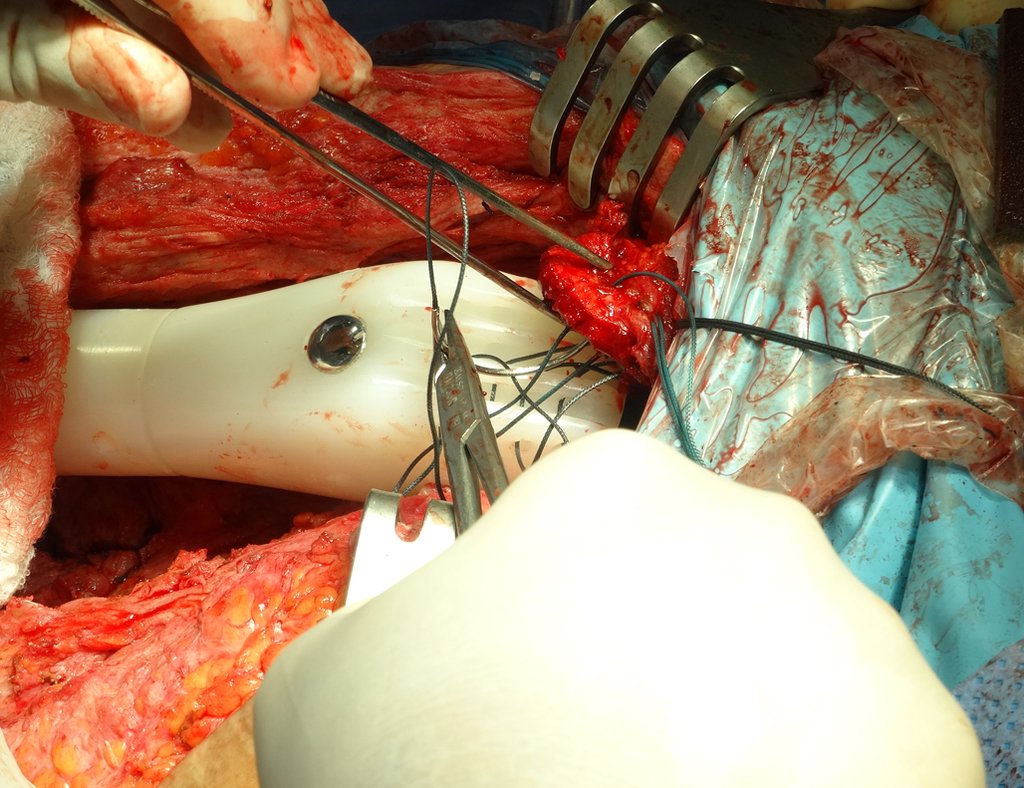
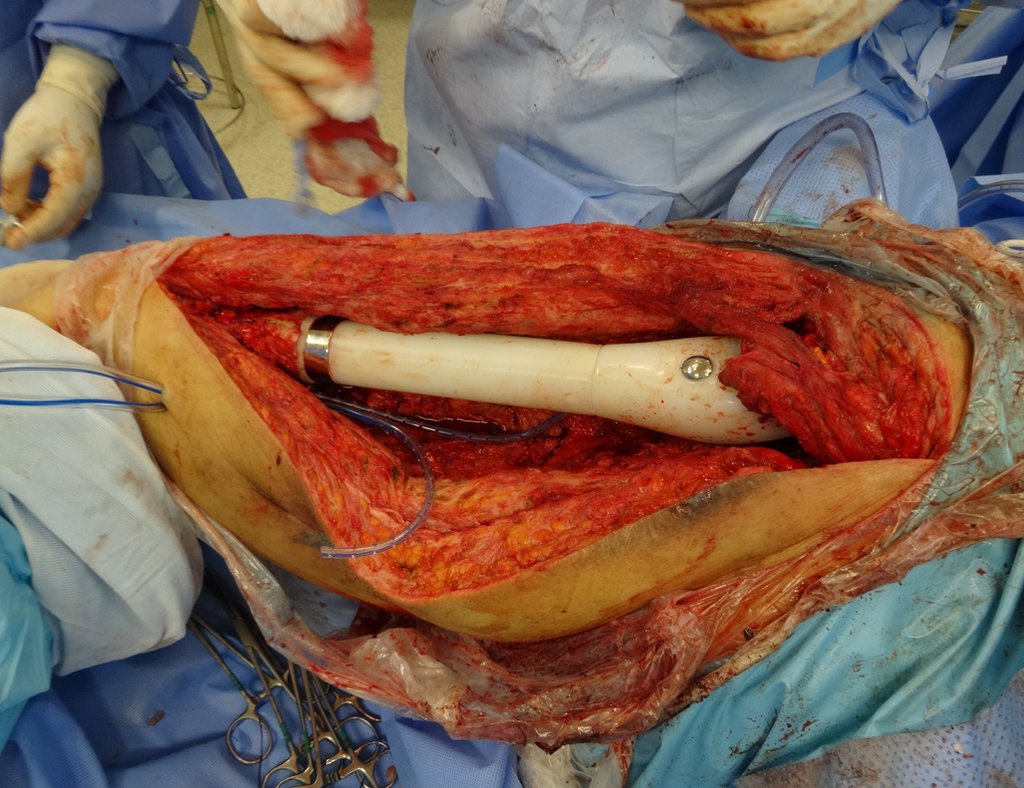
Em outras situações poderemos necessitar de reconstruções segmentares com enxerto ósseo livre ou até mesmo vascularizado ou ainda de reconstruções articulares com próteses nos casos avançados com grande comprometimento articular. Na coluna vertebral, após a ressecção da lesão, pode haver necessidade de artrodese, a fim de se evitar instabilidade.
A radioterapia deve ser evitada pelo risco de malignização, entretanto pode ter sua indicação reservada no controle evolutivo de lesões em locais de difícil acesso, como a coluna cervical por exemplo, ou outras situações em que a re-intervenção cirúrgica não é recomendada.
A embolização como terapia isolada é controversa. Pode entretanto ser empregada no pré-operatório visando minimizar o sangramento durante a cirurgia. Esta prática é mais utilizada em casos de difícil acesso, embora sua eficácia nem sempre é obtida. A infiltração com calcitonina tem sido relatada com resultado satisfatório em casos isolados.
A recidiva pode ocorrer, pois o fenômeno que originou o cisto é desconhecido e não podemos assegurar que a cirurgia o reparou. O índice de recorrência pode atingir trinta por cento dos casos.
Cisto Ósseo Simples –
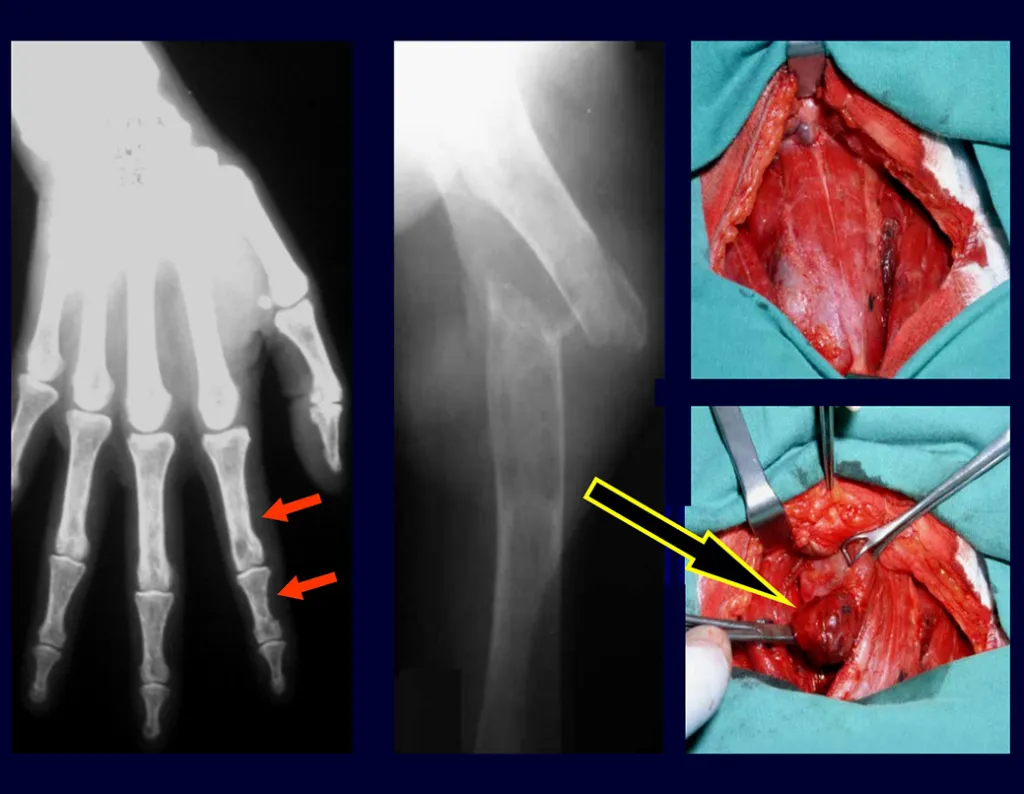
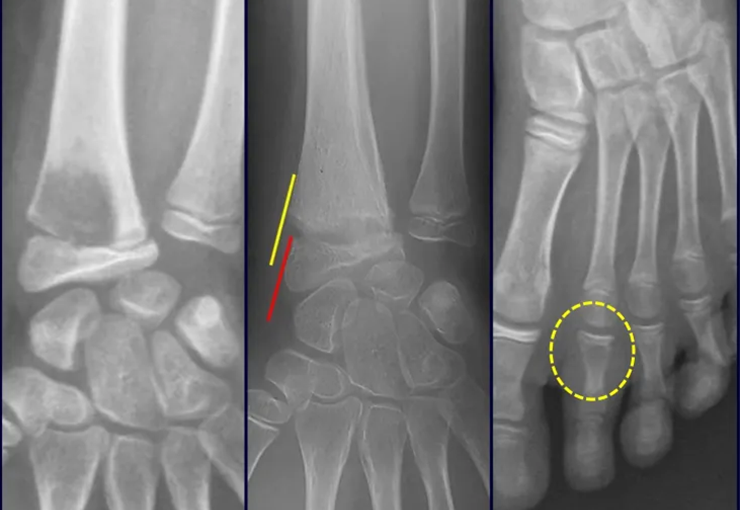
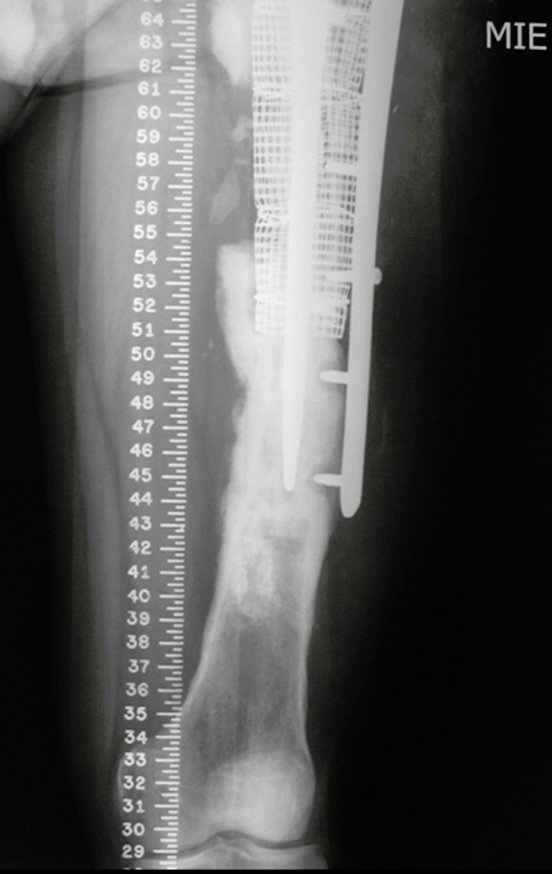
O cisto ósseo simples é a lesão pseudo-tumoral que pode ocorrer em qualquer parte do esqueleto e que mais freqüentemente apresenta fratura (figuras 59 à 64).
O cisto ósseo simples pode ser diagnosticado ocasionalmente devido a aumento de volume, mas quando apresenta sintoma doloroso este geralmente está relacionado com micro fraturas ou muitas vezes com fratura completa.
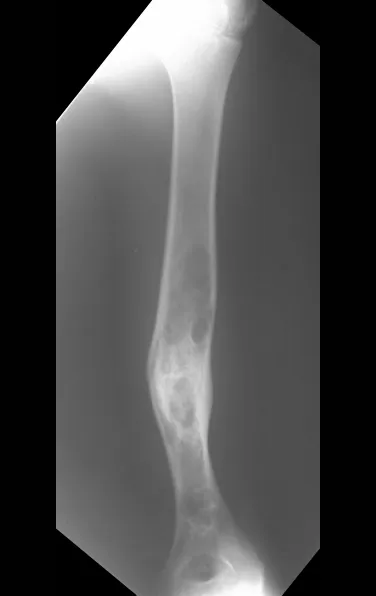
O úmero é o osso mais afetado. As micro-fraturas pode eventualmente propiciar a “cura” parcial, em algumas áreas do cisto e com o crescimento a metáfise distancia-se da lesão, que passa a ocupar a zona diafisária (fig. 65 e 66). Esta progressão para a diáfise pode ocorrer de maneira assintomática e nova manifestação clínica dolorosa vir a ocorrer de forma aguda a fratura (fig. 67).
Os cistos ósseos em crianças de maior idade e distantes à placa de crescimento são considerados cistos maduros, que podem cicatrizar com os diferentes métodos de tratamento, inclusive após a ocorrência de fratura (fig 68 à 71).
Nestas situações o tratamento adotado deverá ser o apropriado para o osso e a fratura em questão, podendo ser incruento ou cruento, ficando a indicação de preenchimento com enxerto ósseo dependente apenas da necessidade própria da fratura, quando for indicado o tratamento cirúrgico.
Nos cistos ósseos maduros a fratura completa ocasiona uma grande descompressão da lesão e pode-se obter a consolidação e a cicatrização da lesão simultaneamente. Entretanto, em alguns casos, há necessidade de tratamento complementar do cisto, após a consolidação da fratura, quando se optou por tratamento incruento (fig. 72 à 78).
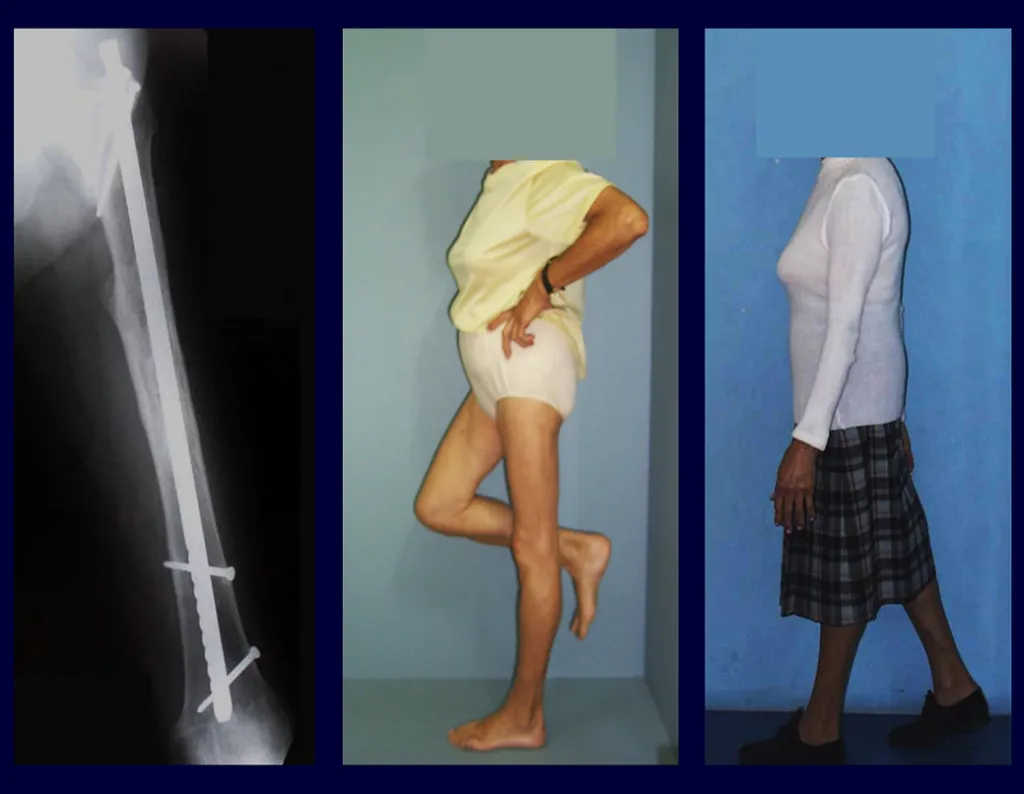
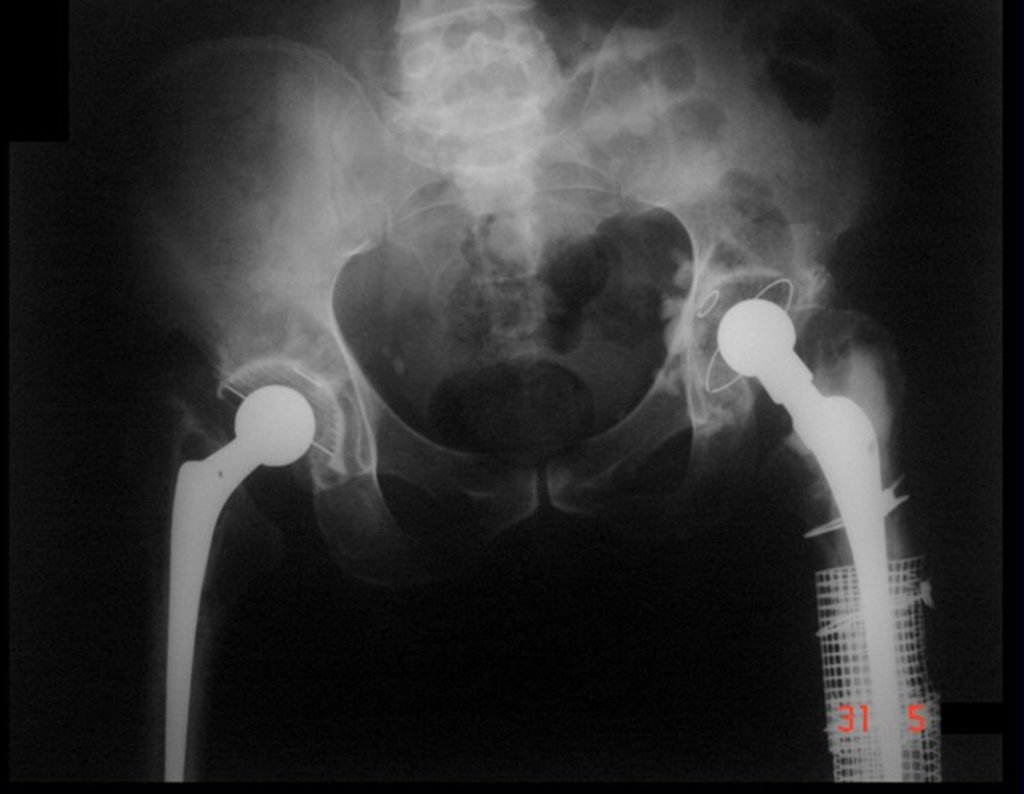
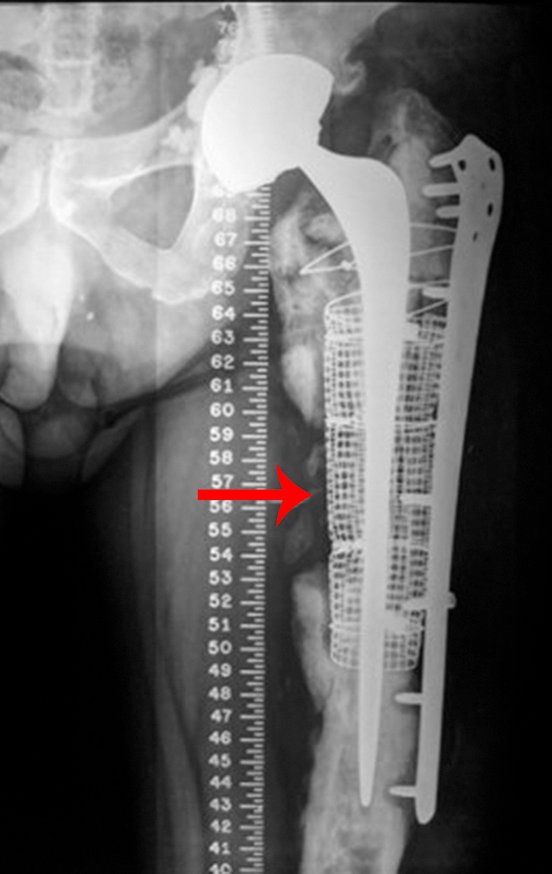
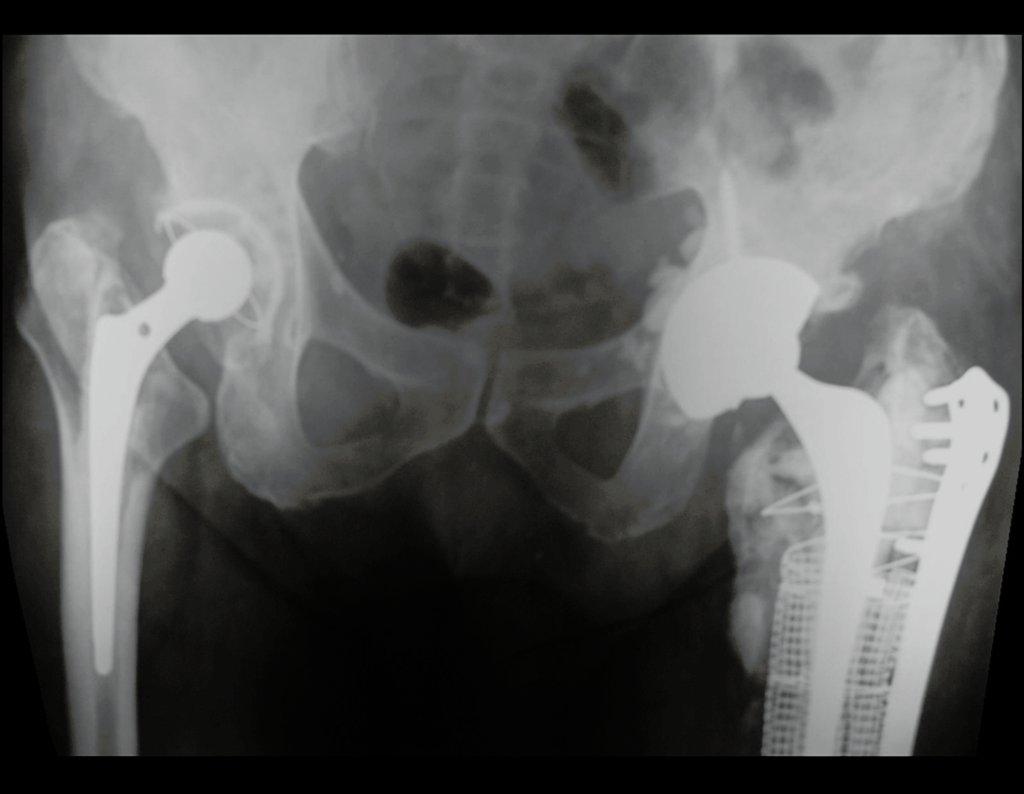
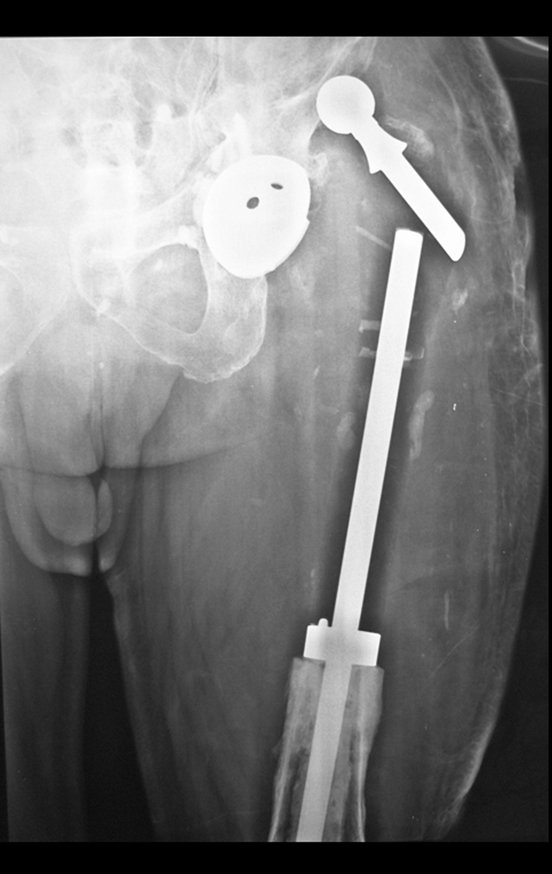
Algumas localizações, como a do colo femoral, merecem atenção especial, devendo ser preferencialmente operadas antes da ocorrência de fratura (fig. 87 e 88).
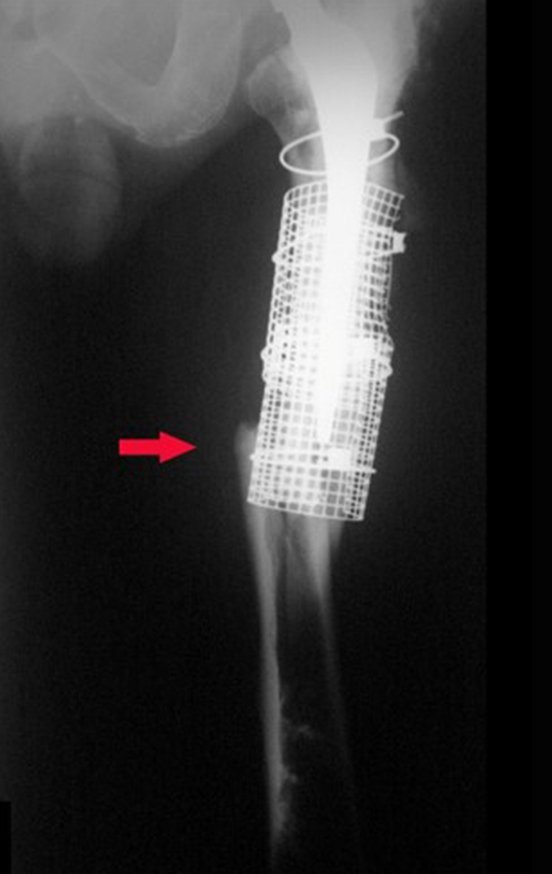
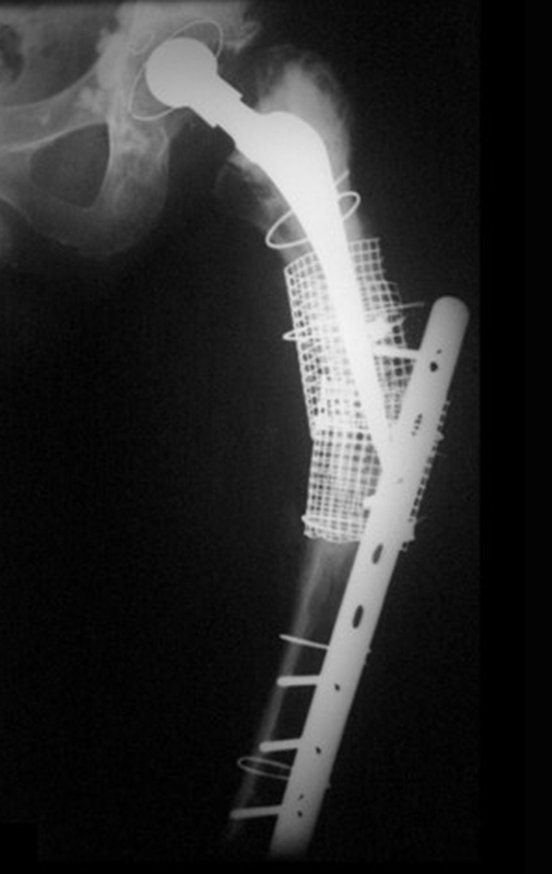
Tratar desta lesão após a ocorrência de fratura requer planejamento específico e complexo, para se obter êxito (fig. 89 à 94 ).
Clique aqui para ver o caso completo
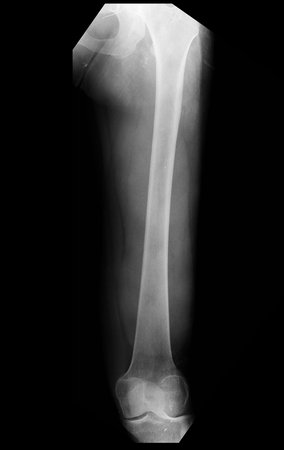
Fratura de Stress –
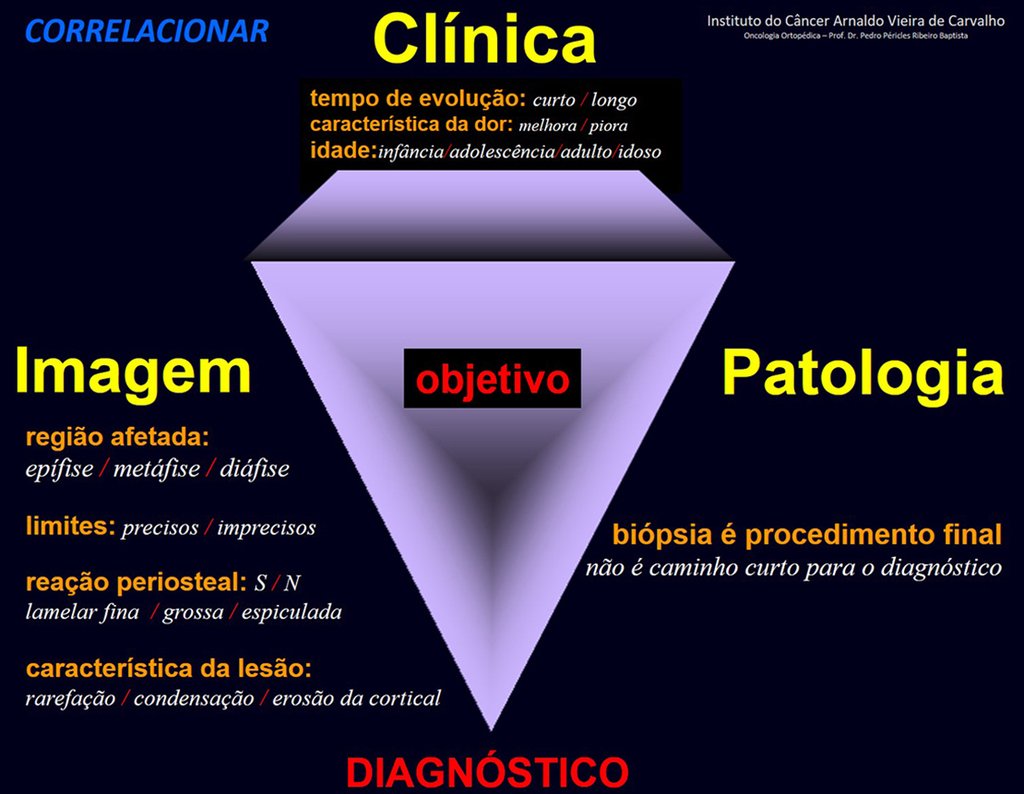
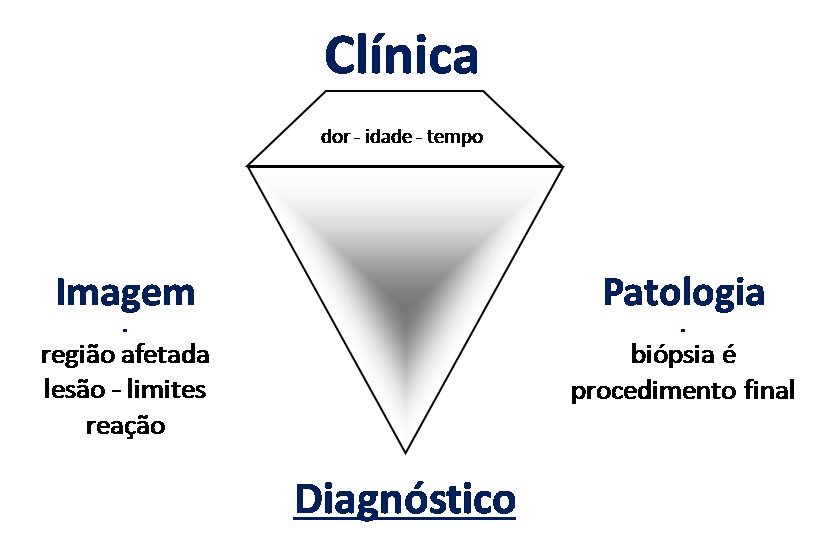
A fratura de stress merece atenção especial deste artigo tanto por ser mais freqüente do que relata a literatura, pois muitos casos passam despercebidos, quanto pelo aspecto florido que a propedêutica de imagem retrata, causando dificuldade para o diagnóstico diferencial.
A criança reclama de dor, geralmente após esforço físico, que por ser discreta acaba por resolver-se espontaneamente.
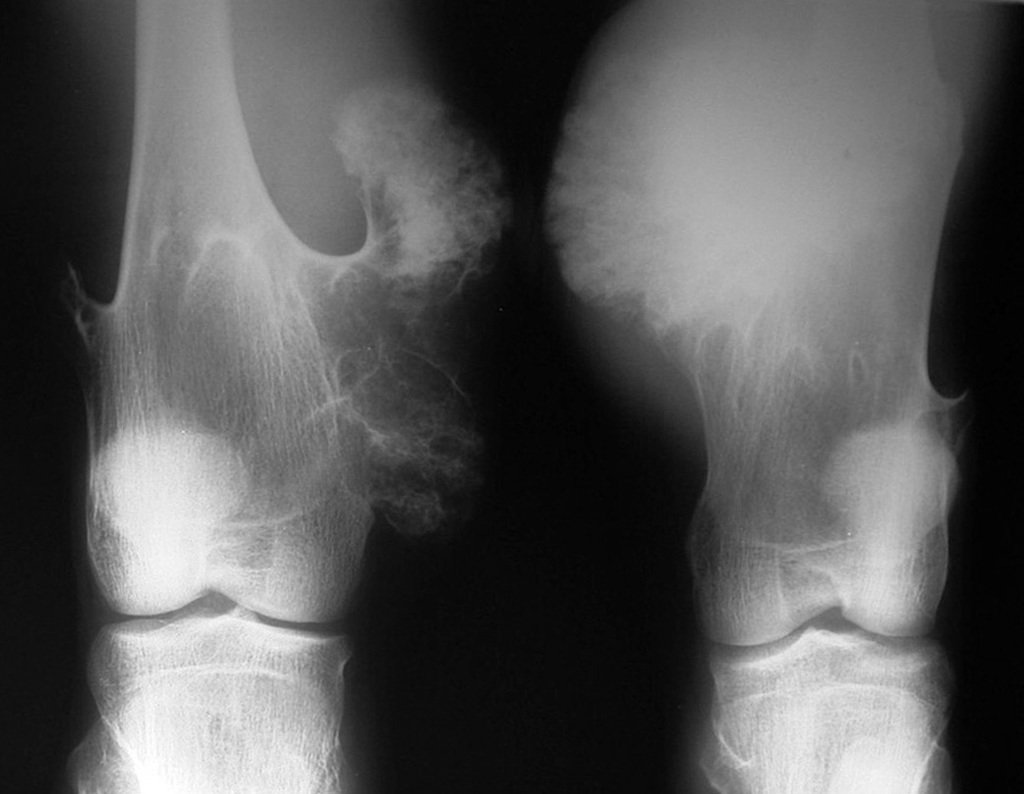
Entretanto, o ortopedista pode ser procurado e ao solicitar uma radiografia surpreender-se com uma reação periosteal em região metafisária num paciente em crescimento.
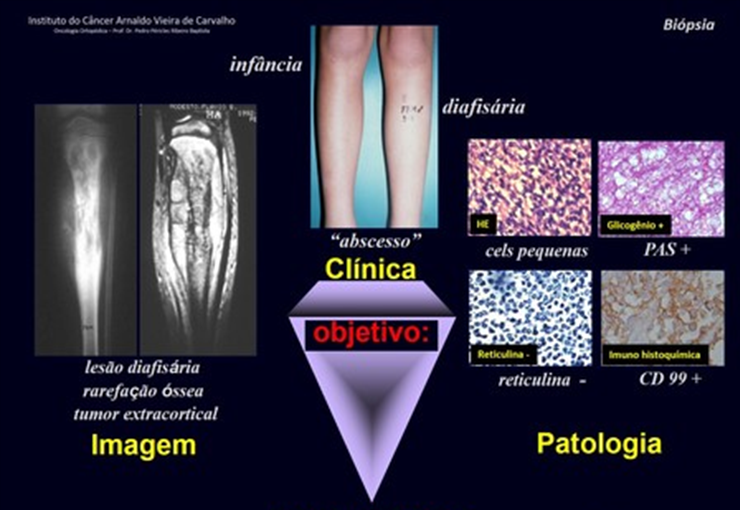
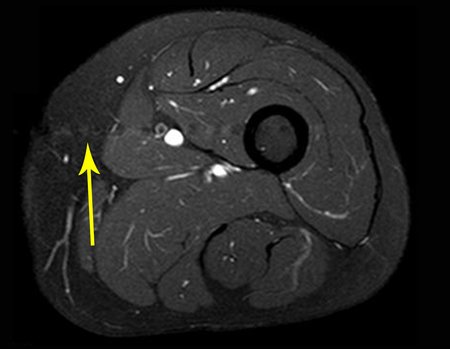
A preocupação com a possibilidade de uma osteomielite, granuloma eosinófilo, osteossarcoma ou sarcoma de Ewing é procedente, mas é preciso estar atento aos aspectos clínicos, como tempo de evolução, fatores de melhora, aspecto local, para não complicar este diagnóstico que é clínico-radiológico (fig. 96 e 97).
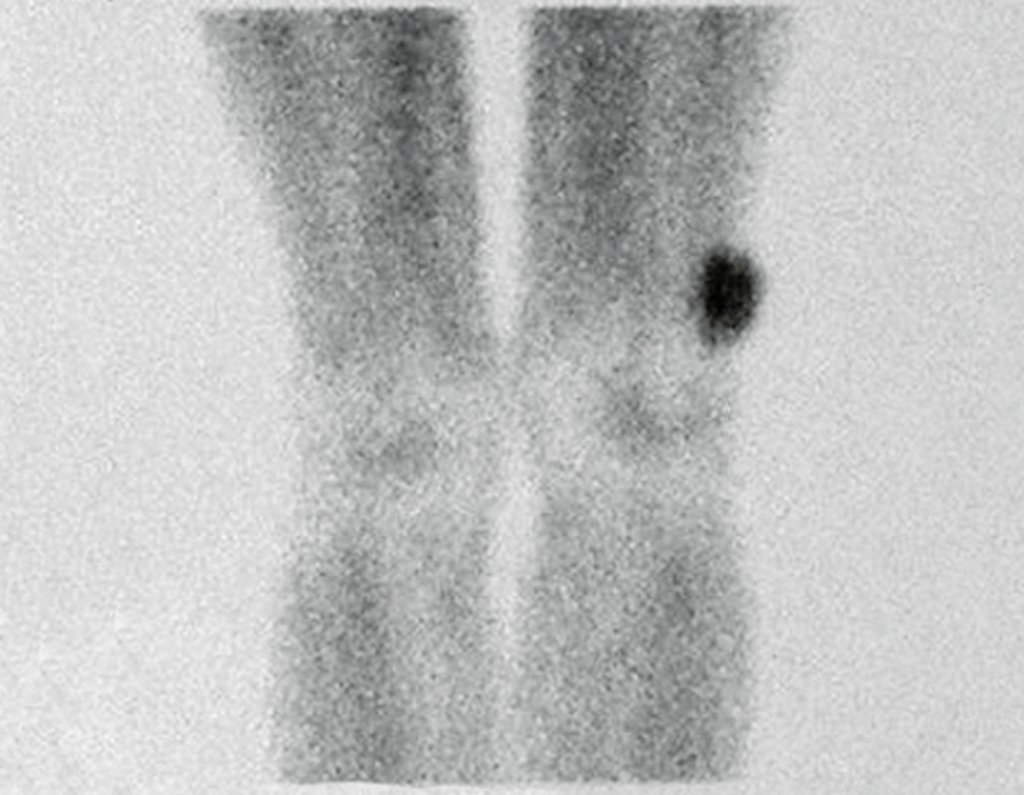
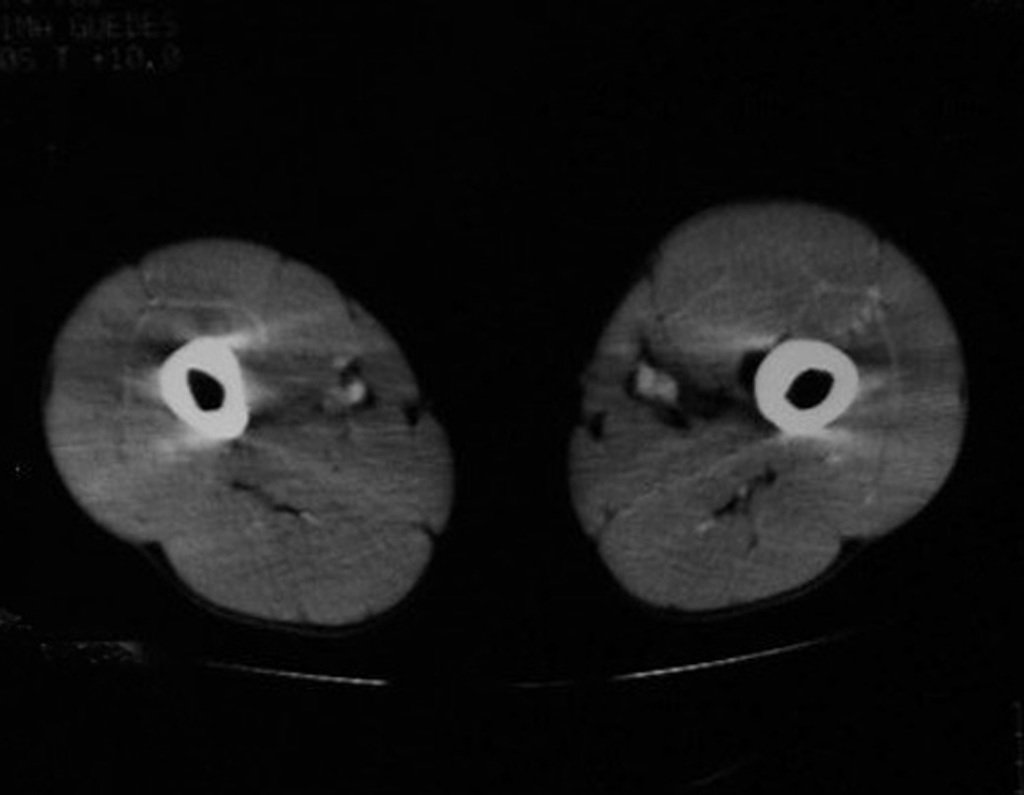
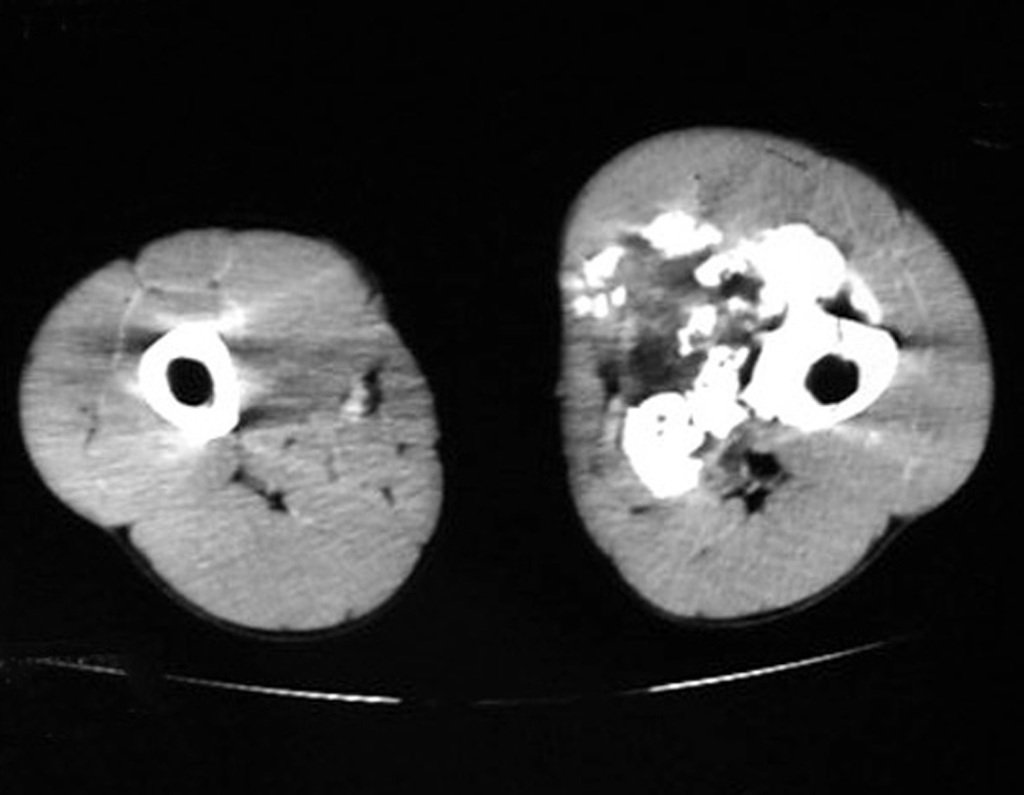
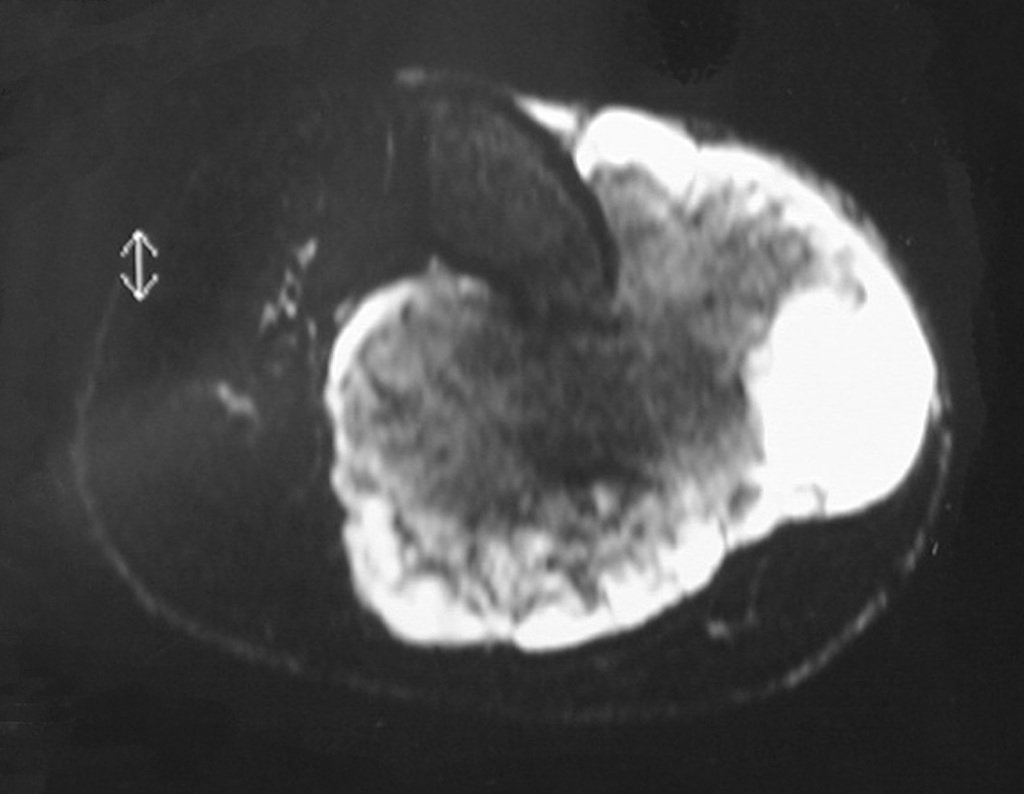
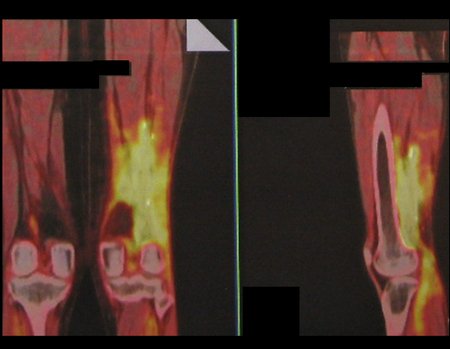
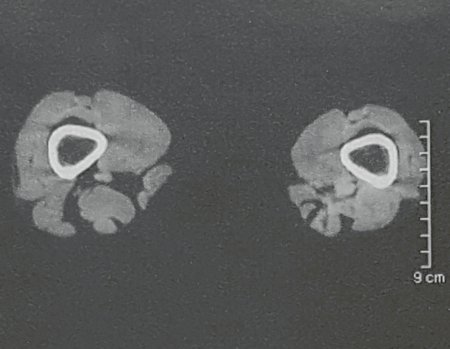
A realização de outros exames como o mapeamento ósseo (fig. 98) e da tomografia computadorizada (fig. 99) confirmam a existência da lesão, podendo não ser suficientes para esclarecer o diagnóstico.
É preciso avaliar e perguntar: no tempo que demorou para a realização destes exames não houve melhora clínica ?
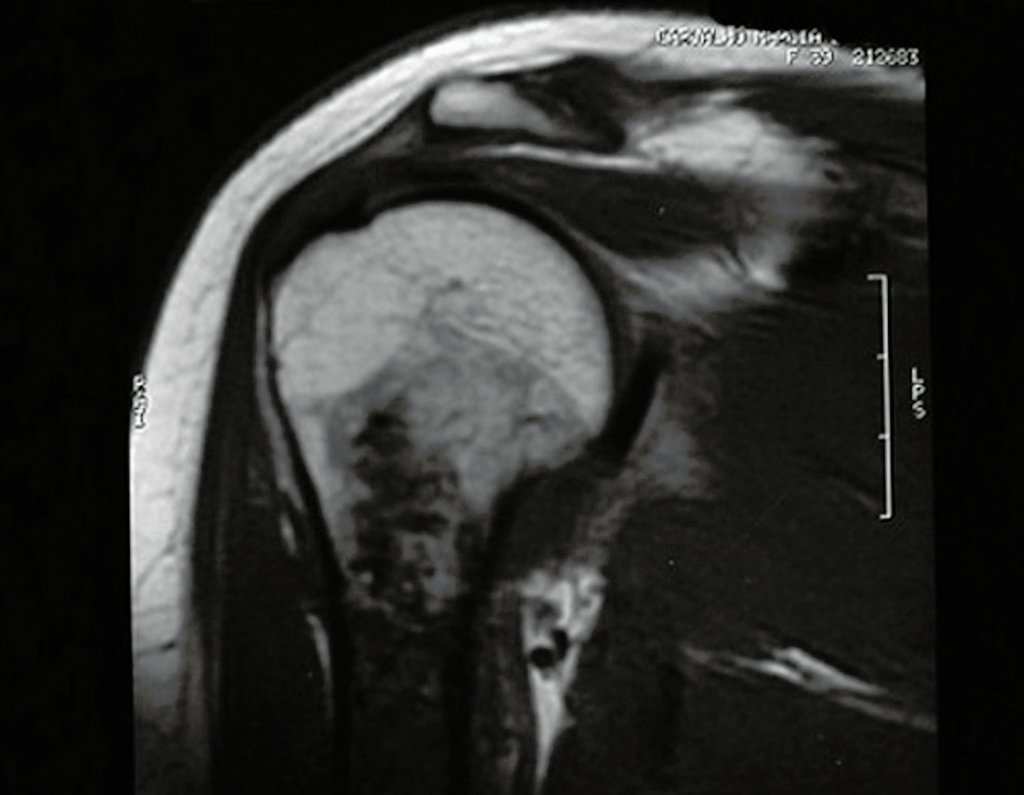
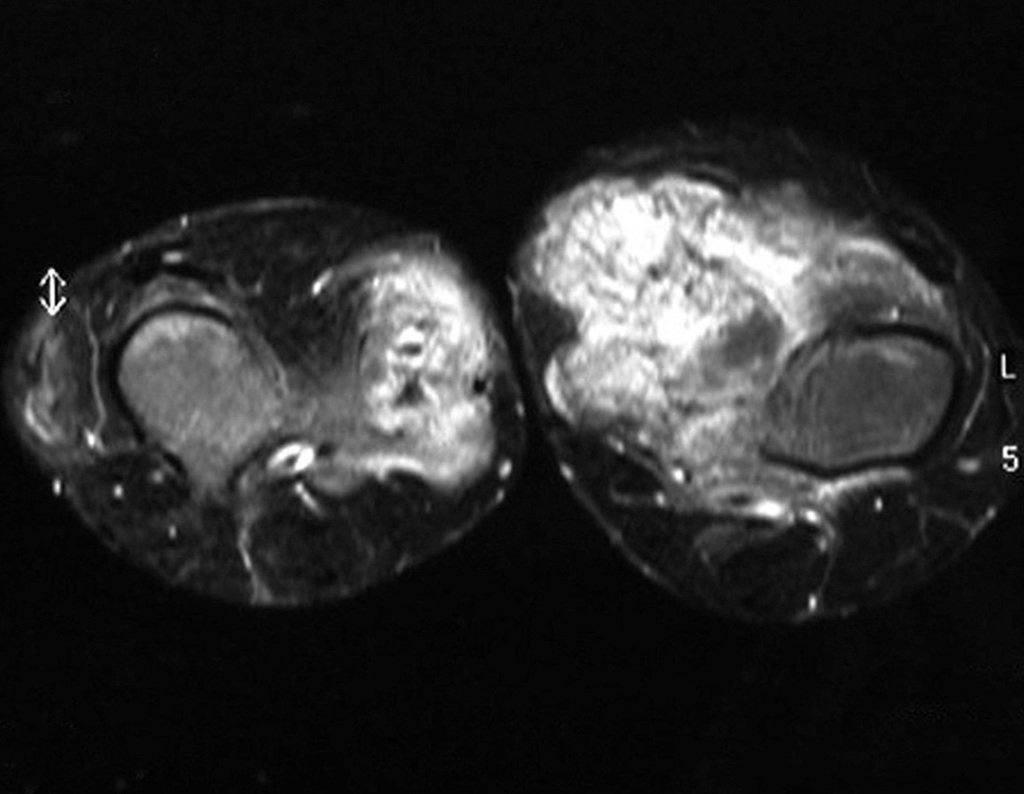
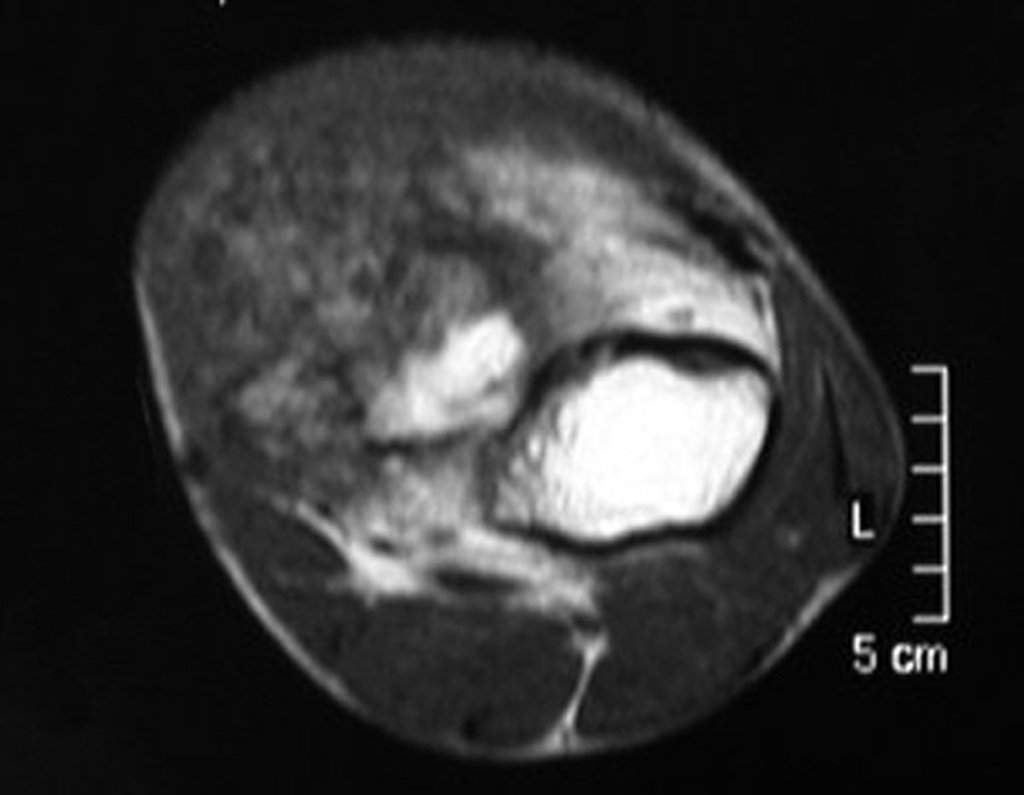
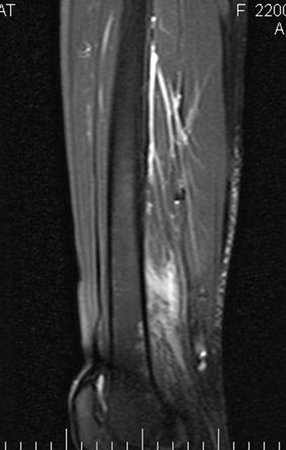
A ressonância magnética é um exame que precisa ser interpretado com muita atenção, pois a fratura provoca um edema intra e extra ósseo que pode assusta os menos experientes.
Devemos observar o detalhe dos dois pontos de baixo sinal do calo de fratura nas corticais lateral e medial da figura 100 bem como o ponto de baixo sinal do calo ósseo da cortical posterior na figura 101.
O processo inflamatório da fratura, com hemorragia e edema acentuados, apresenta uma extensão grande. A histologia do calo de fratura pode mimetizar o osteossarcoma. É conhecido caso de amputação por diagnóstico errôneo de osteossarcoma em paciente com fratura de stress.
A observação por duas à três semanas é fundamental para o diagnóstico preciso e não se considera má pratica, mesmo nas neoplasias. A radiografia realizada três semanas após evidencia a fratura de stress (fig. 102 e 103) e o quadro clínico com melhora dos sintomas e diminuição do edema reafirma o diagnóstico. A clínica é soberana.
Autor : Prof. Dr. Pedro Péricles Ribeiro Baptista
Oncocirurgia Ortopédica do Instituto do Câncer Dr. Arnaldo Vieira de Carvalho
Consultório: Rua General Jardim, 846 – Cj 41 – Cep: 01223-010 Higienópolis São Paulo – S.P.
Fone:+55 11 3231-4638 Cel:+55 11 99863-5577 Email: drpprb@gmail.com