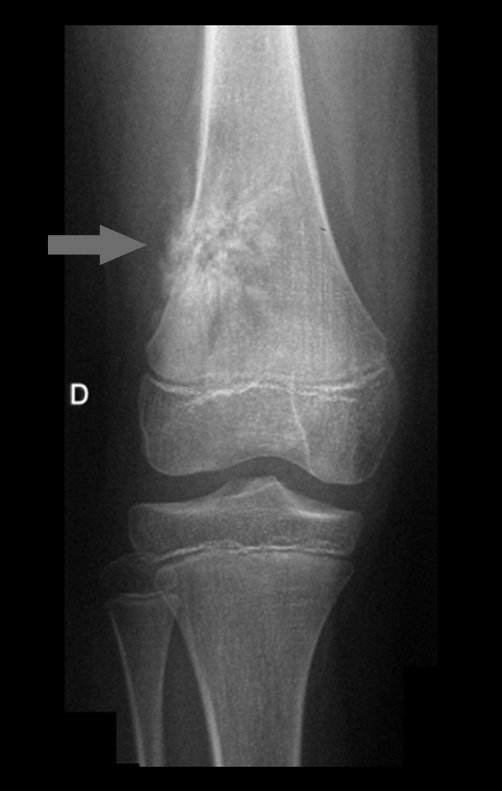
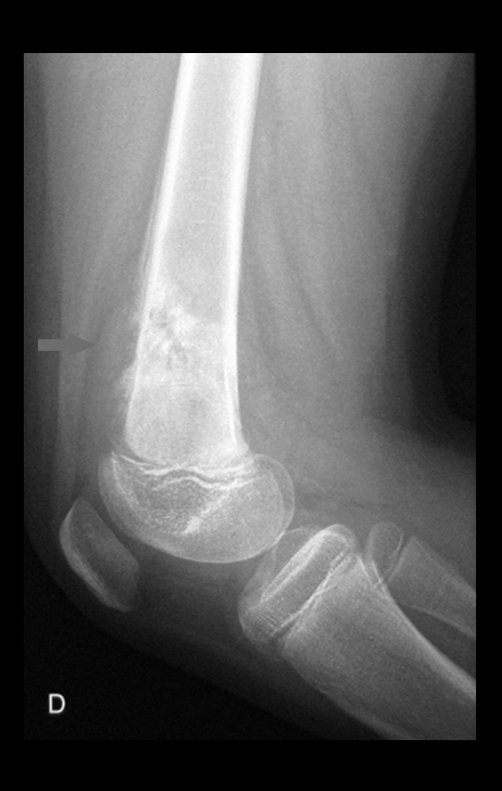
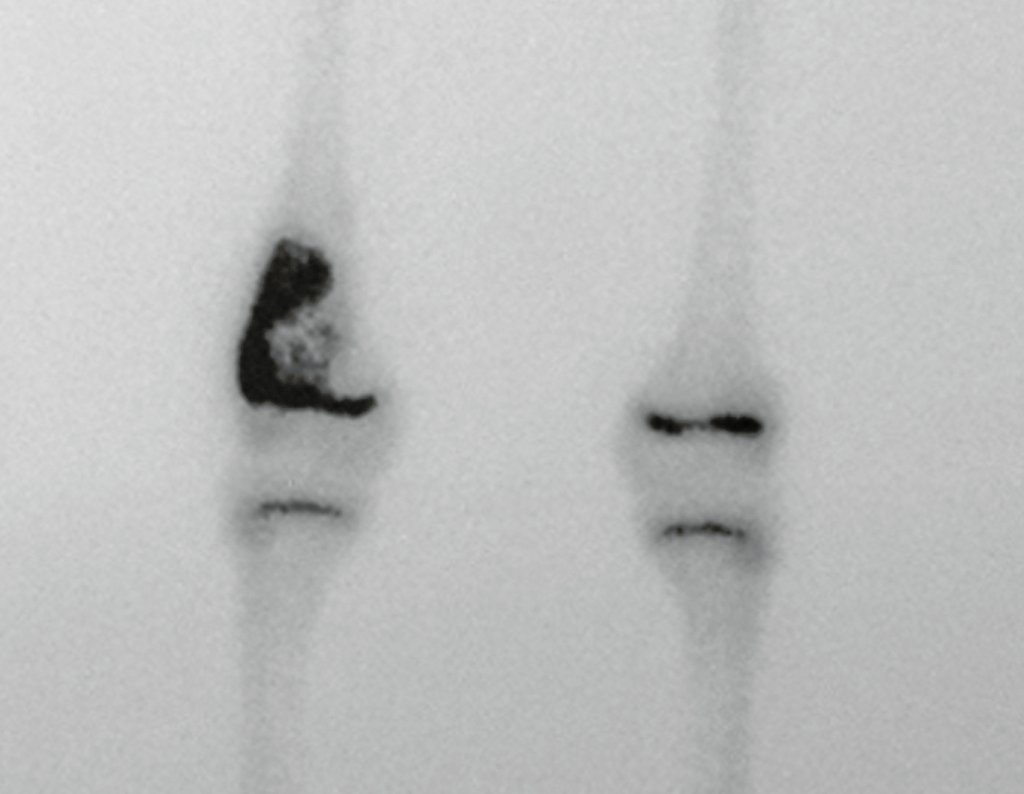
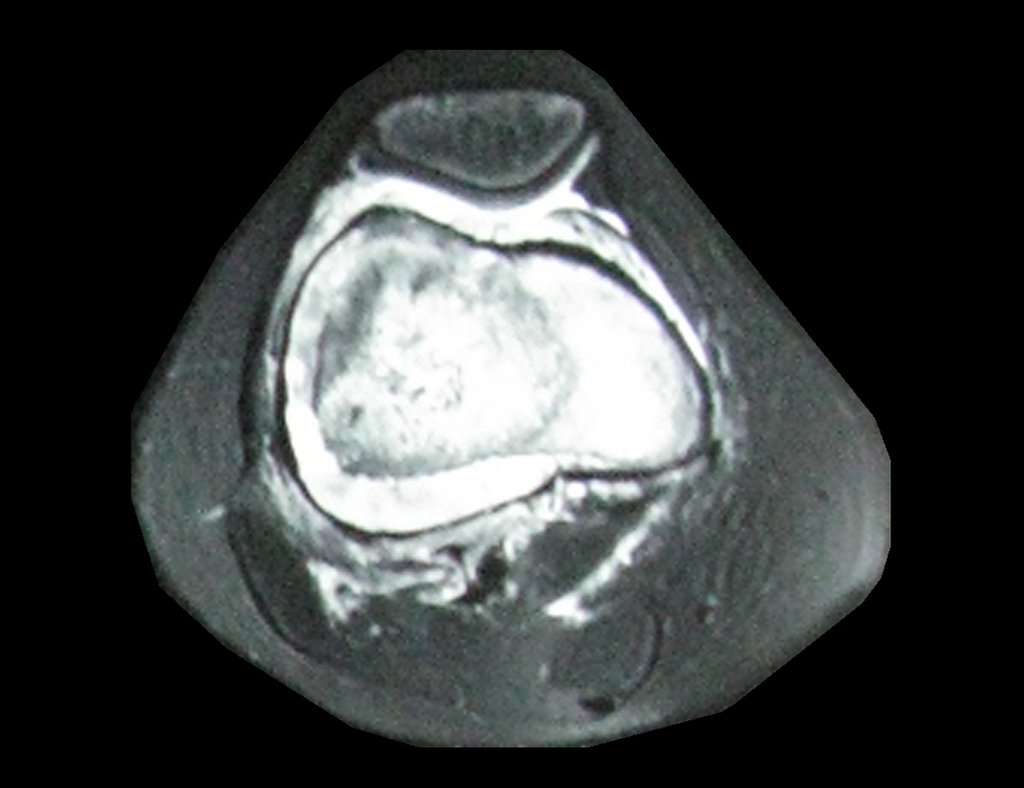
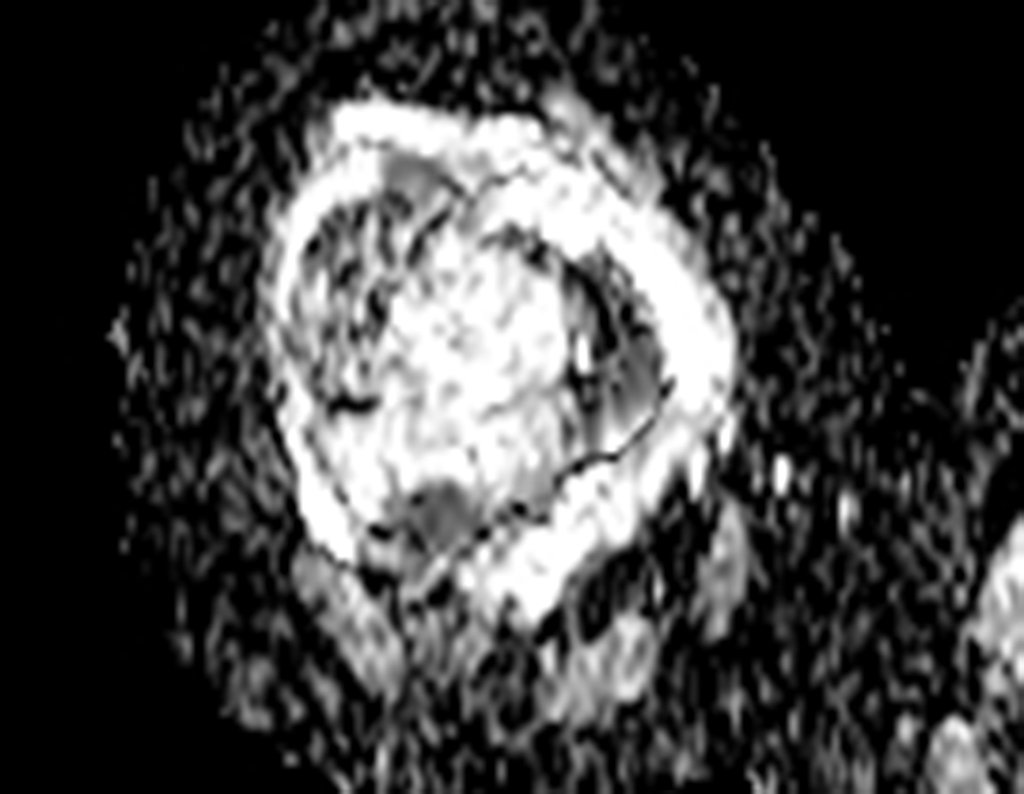
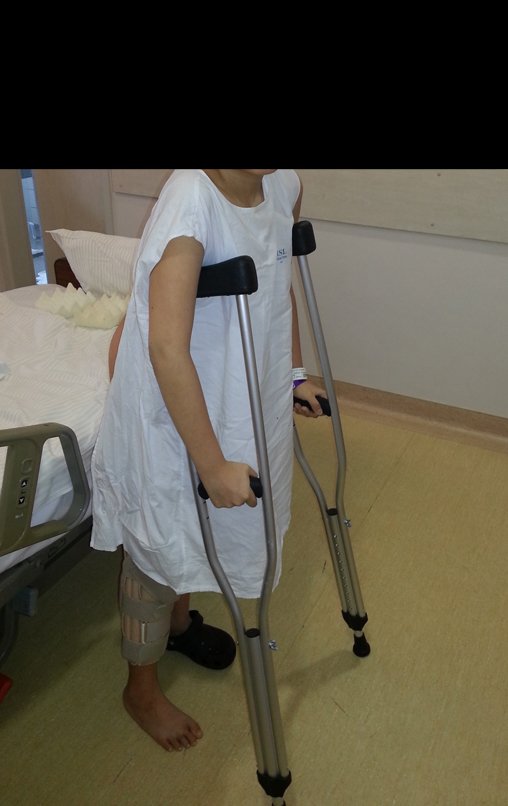
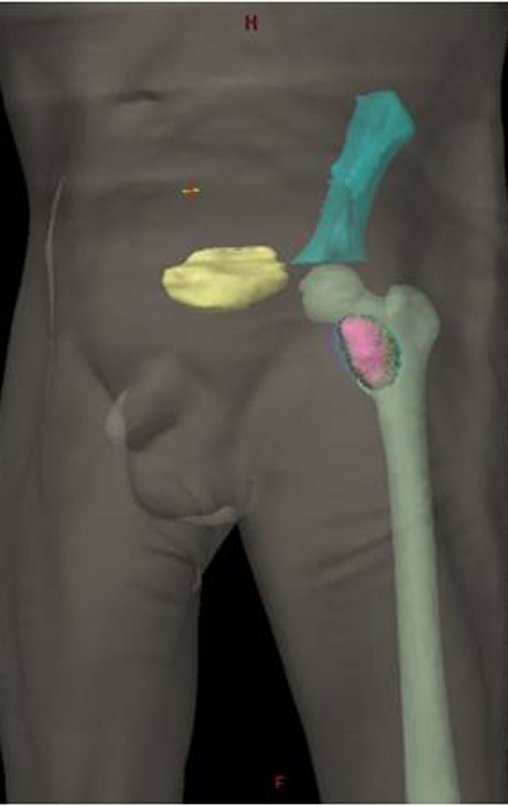
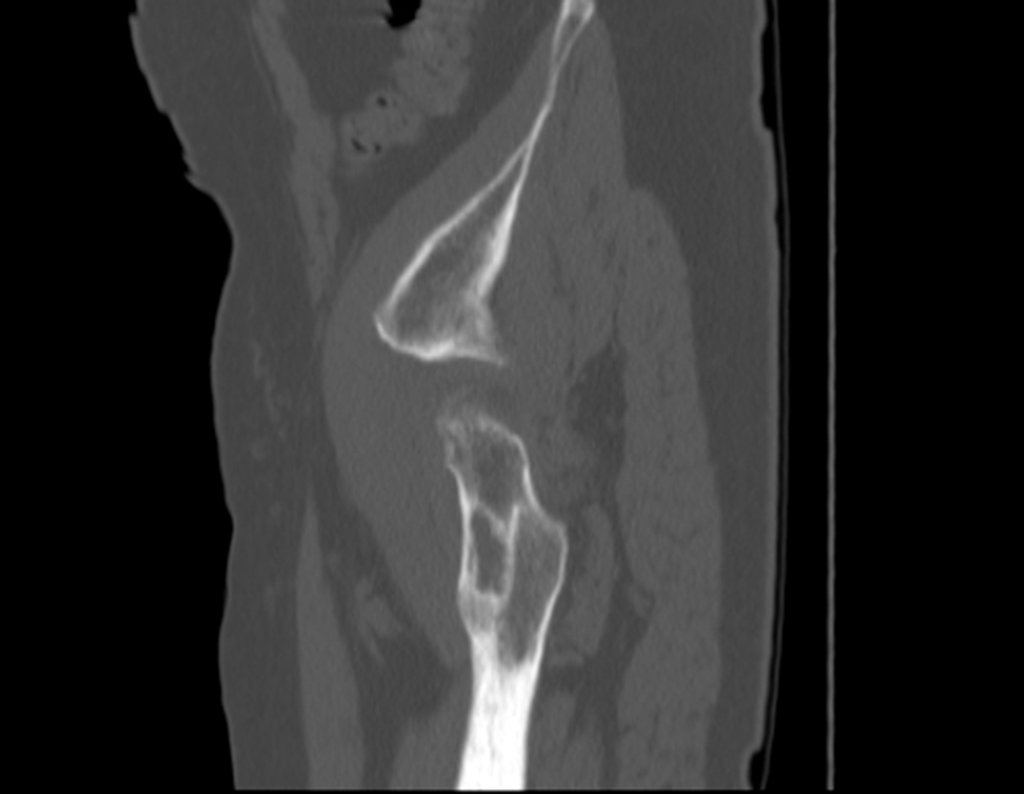
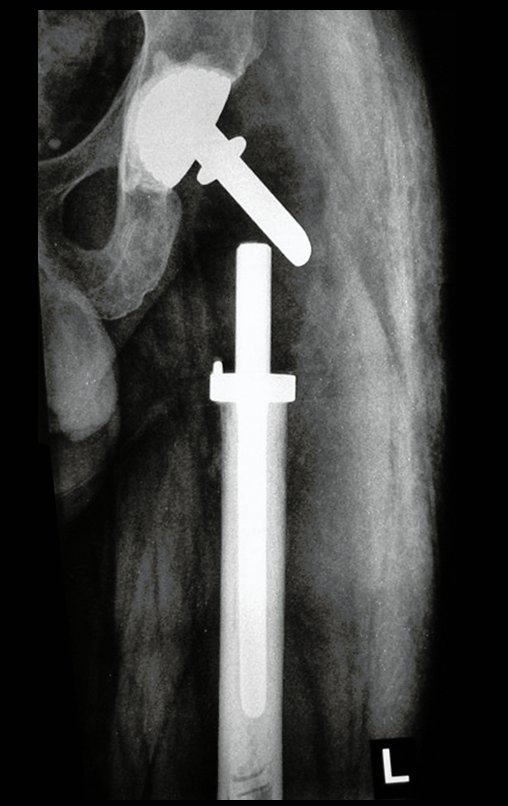
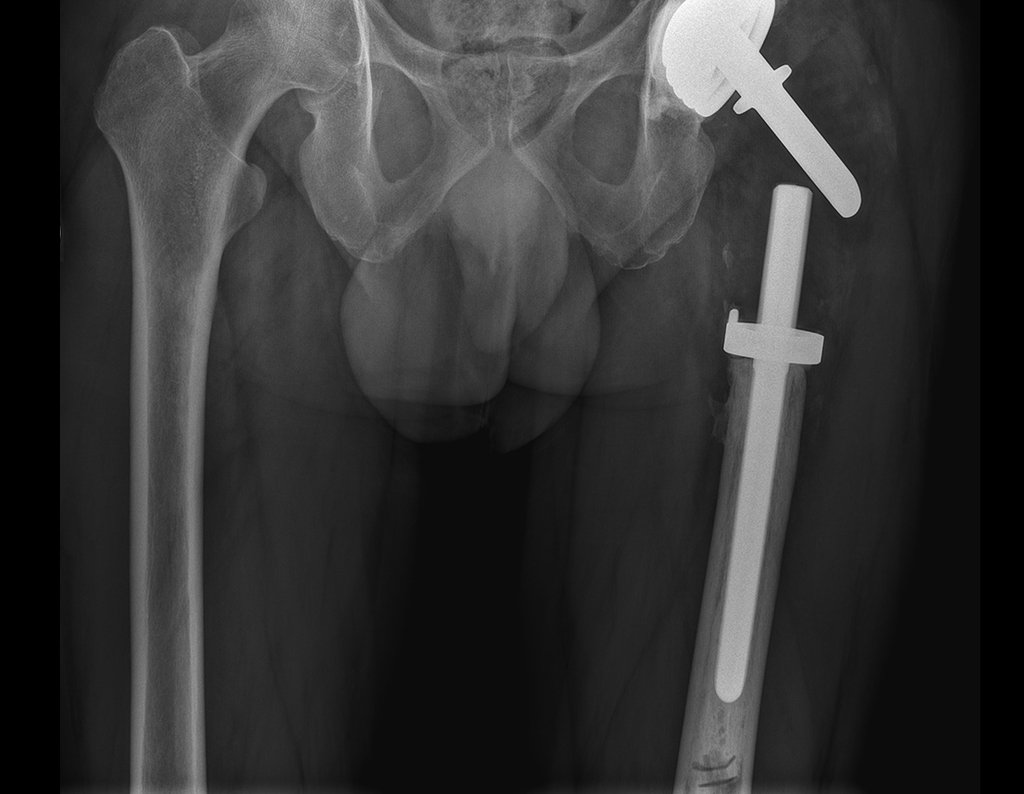
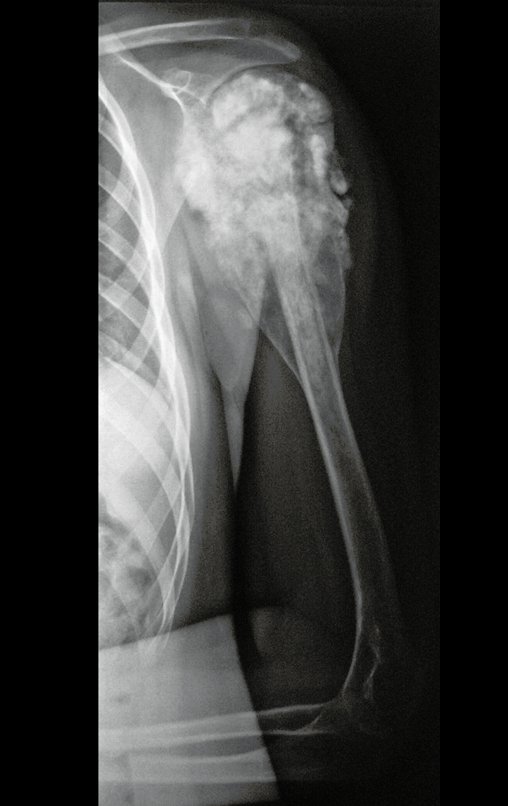
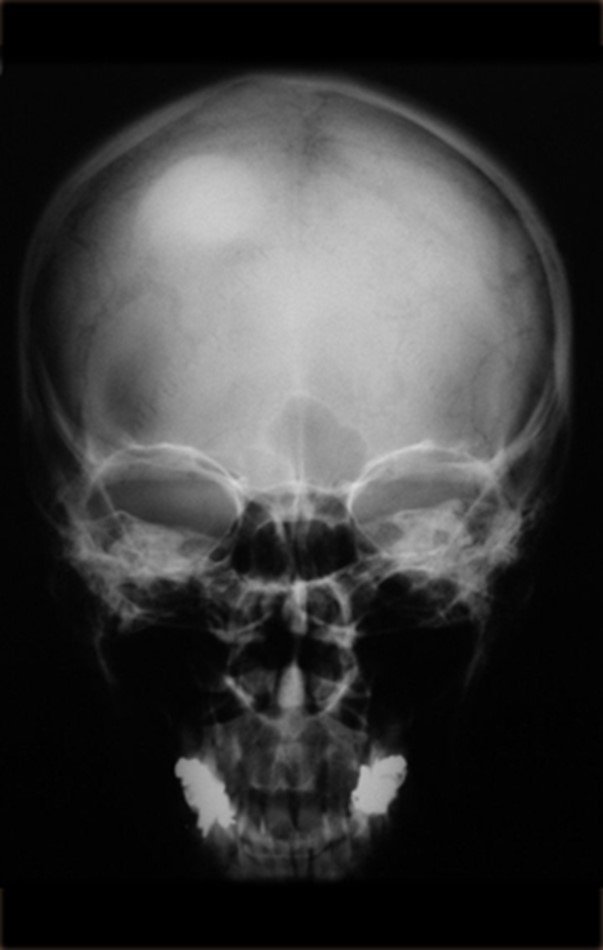
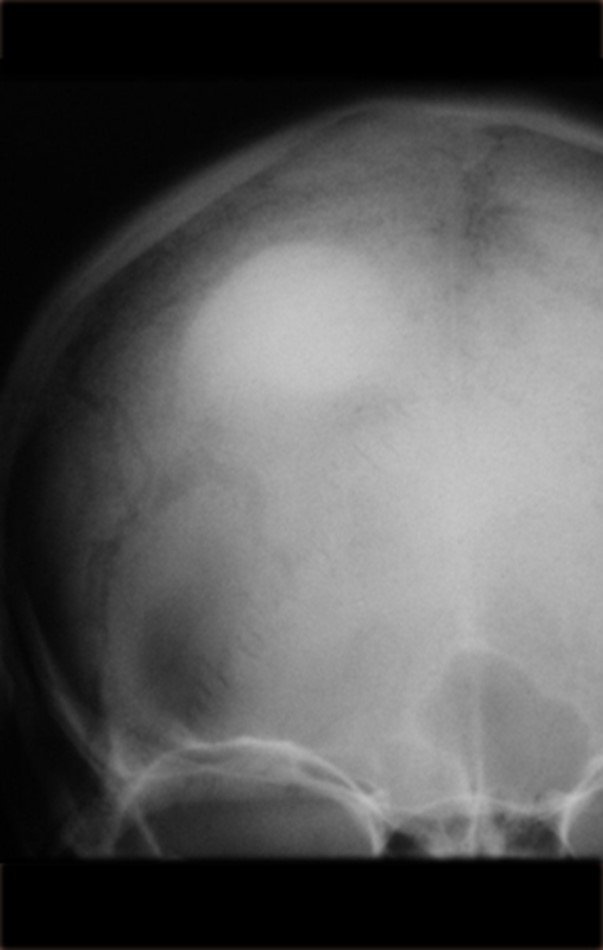
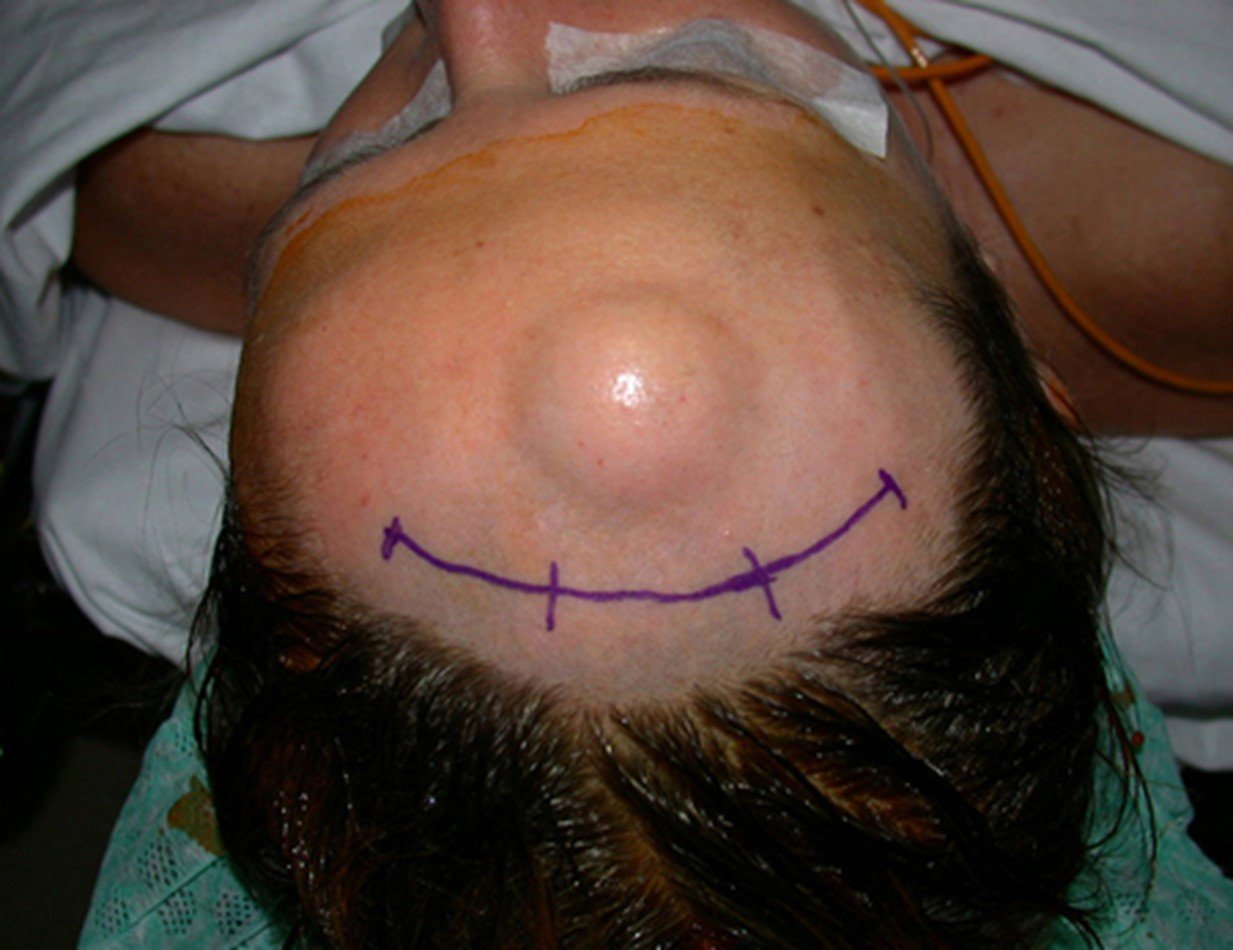
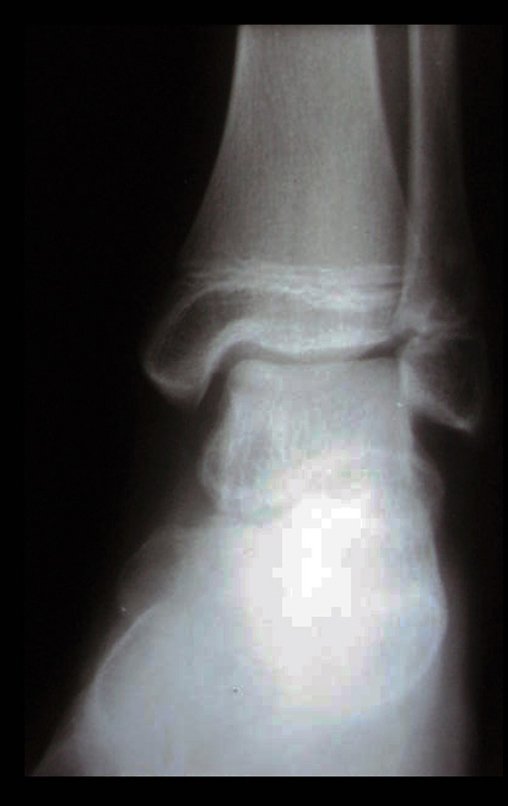
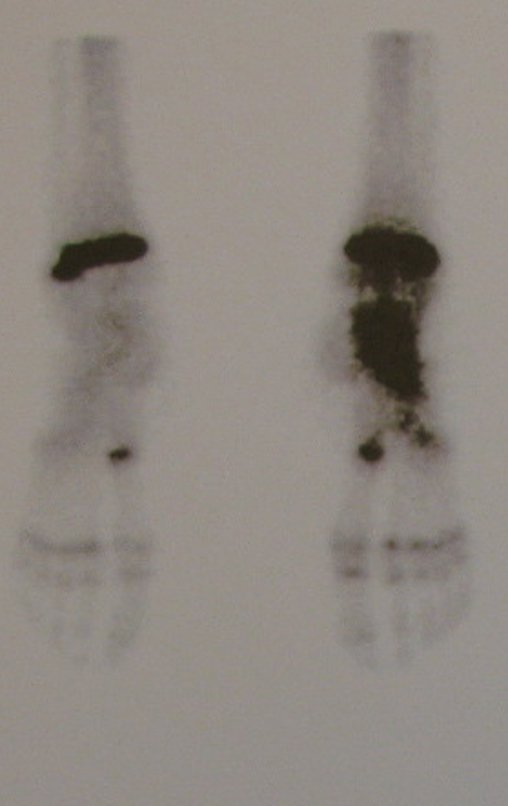
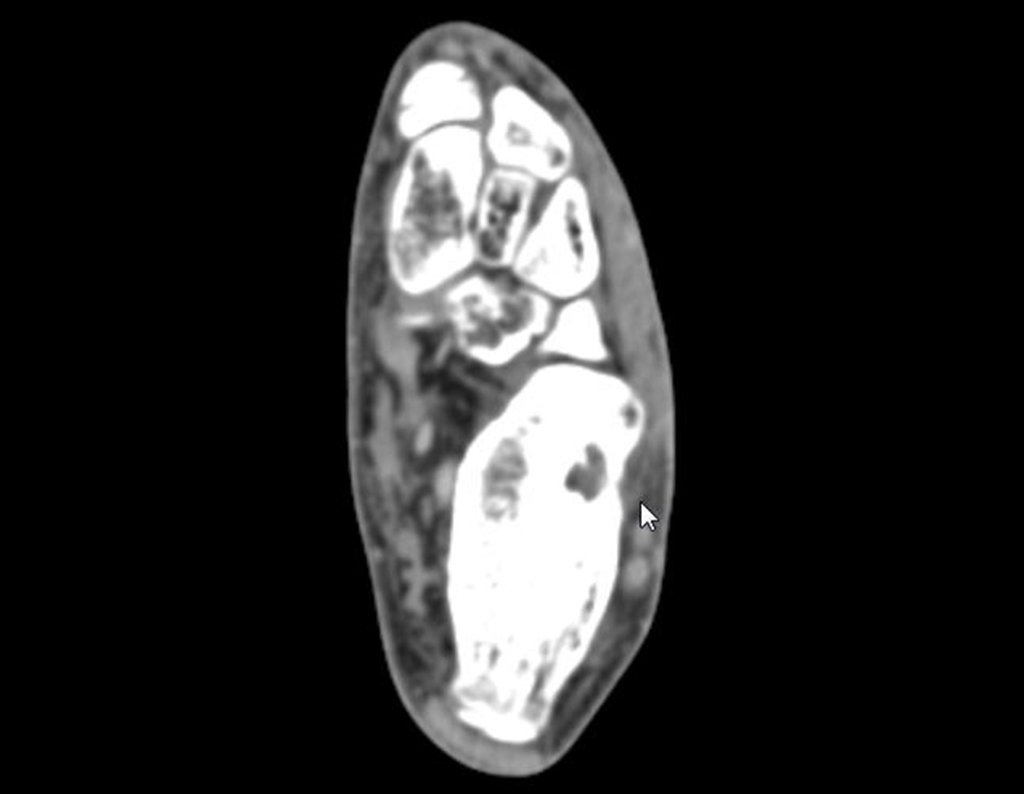
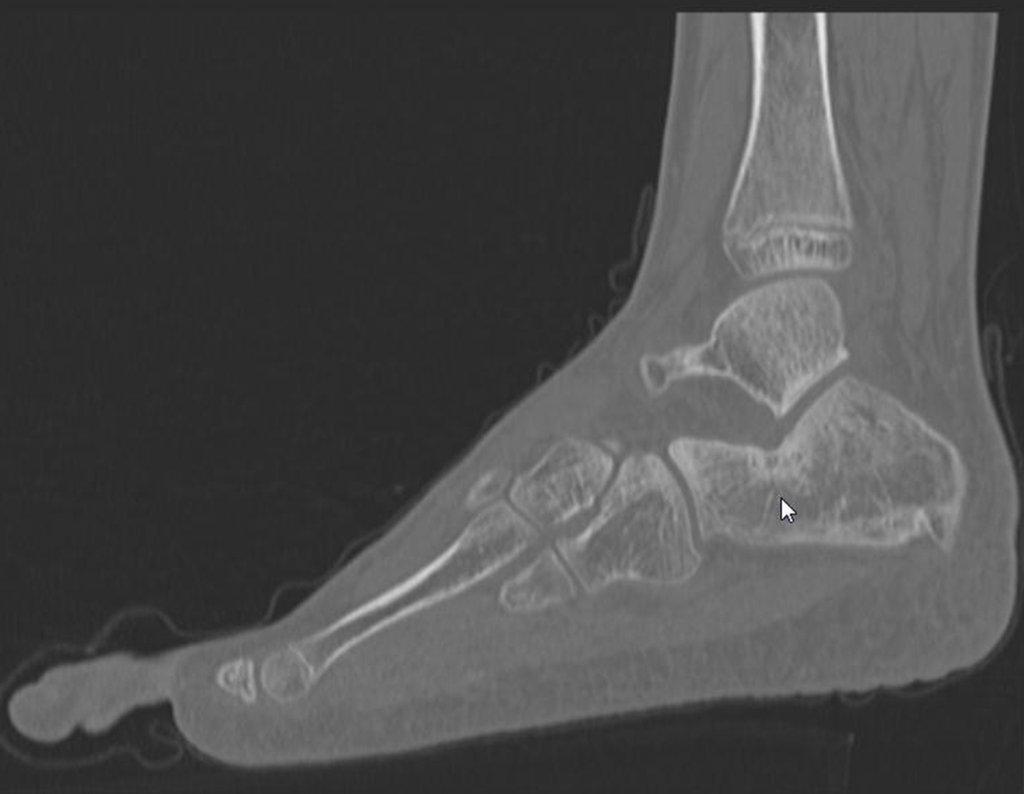
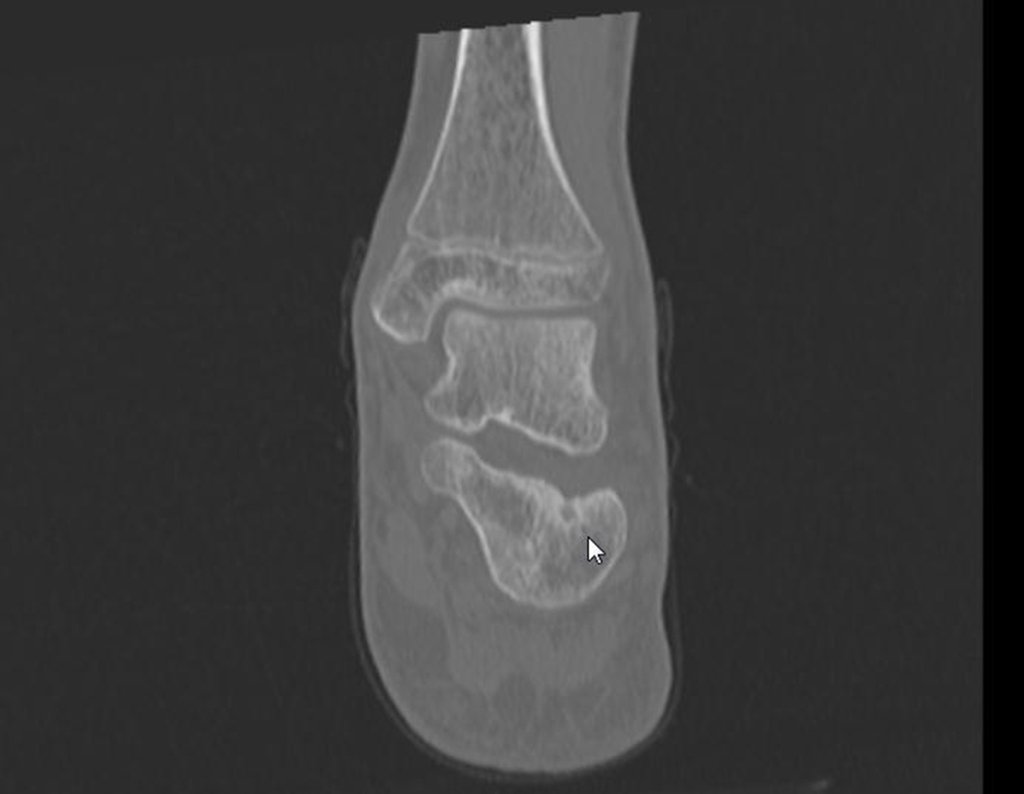
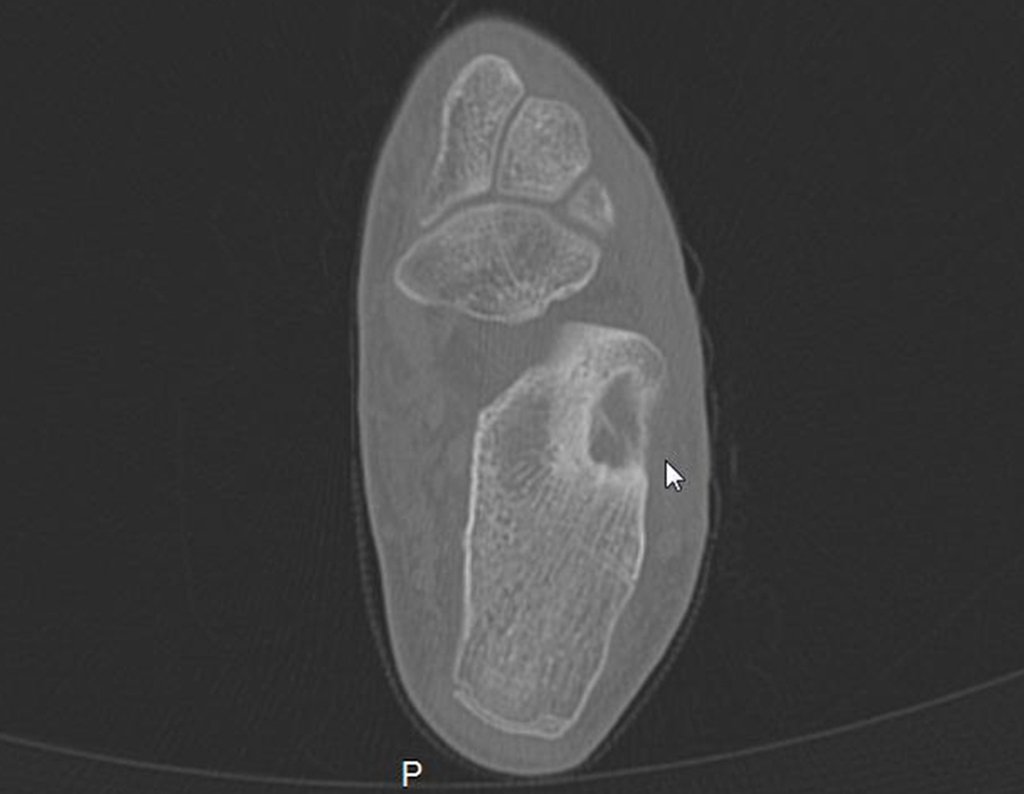
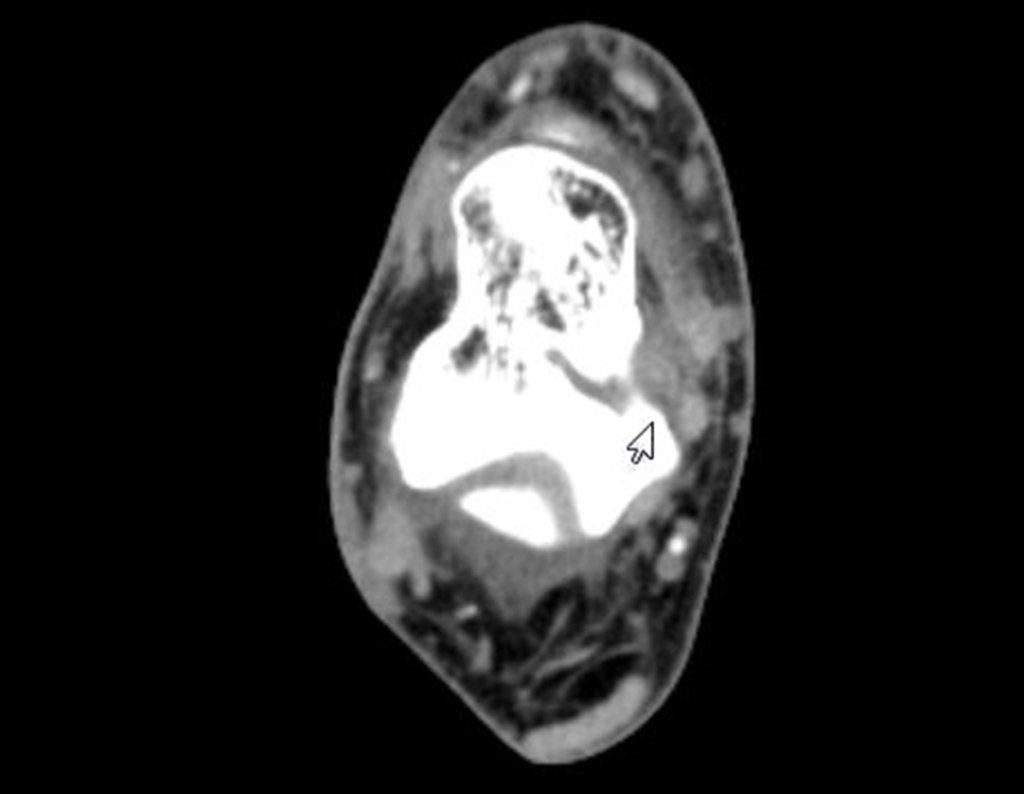
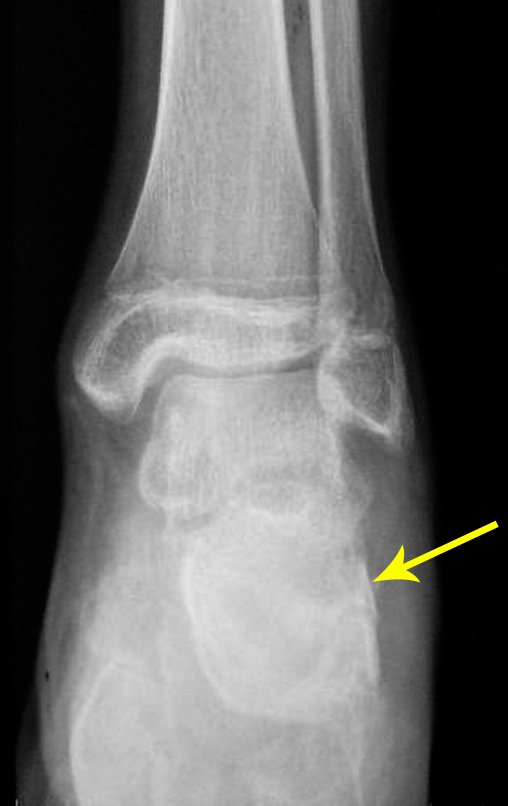
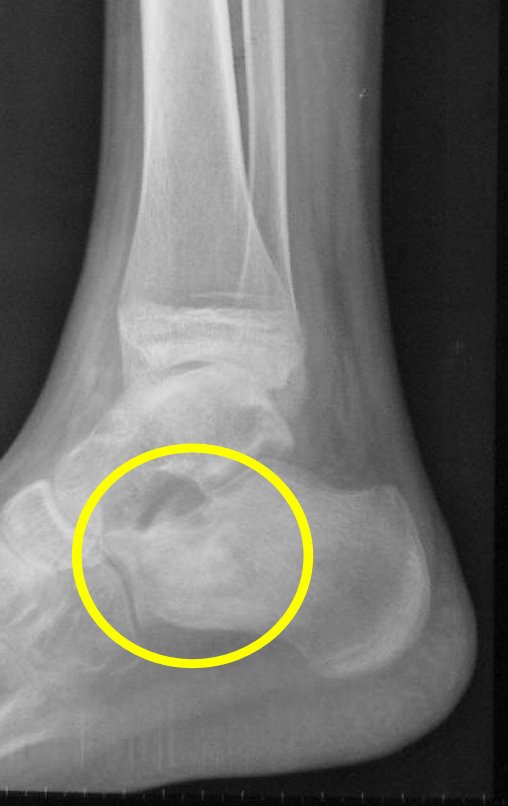
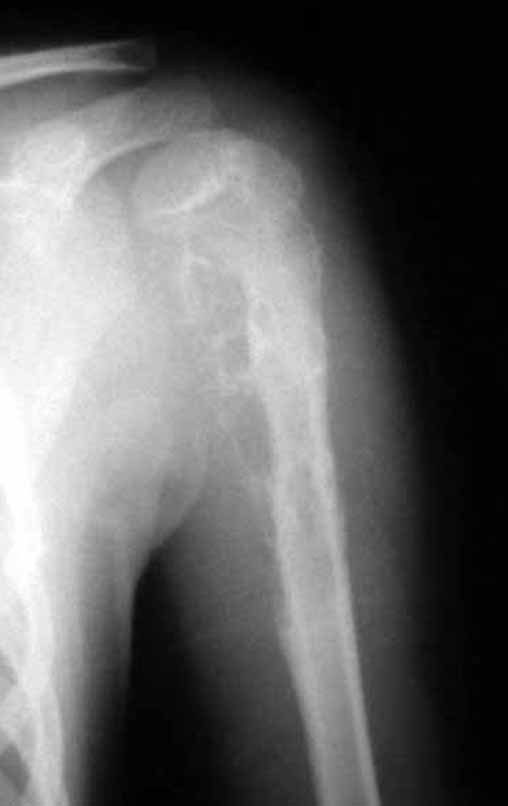
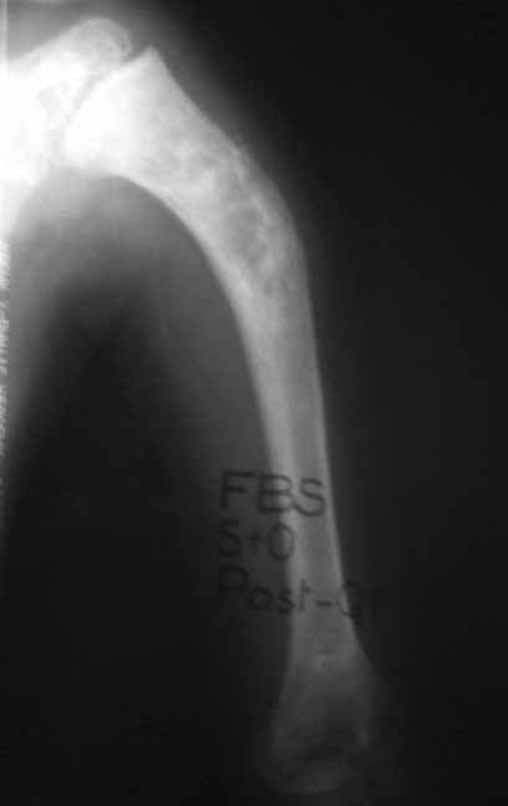
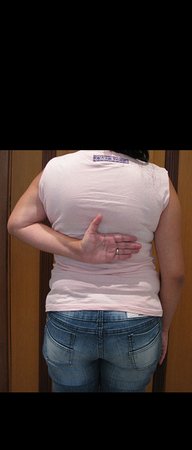
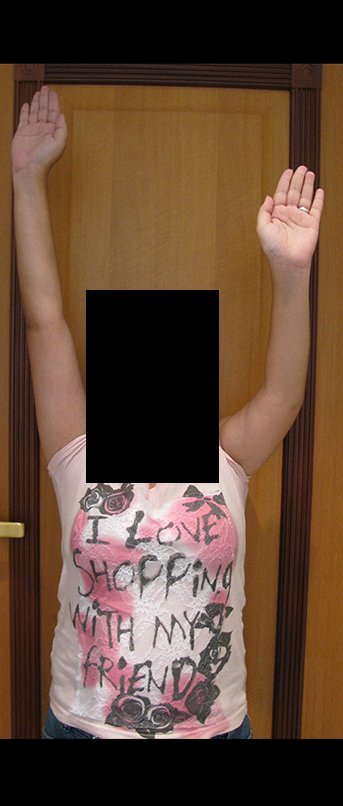
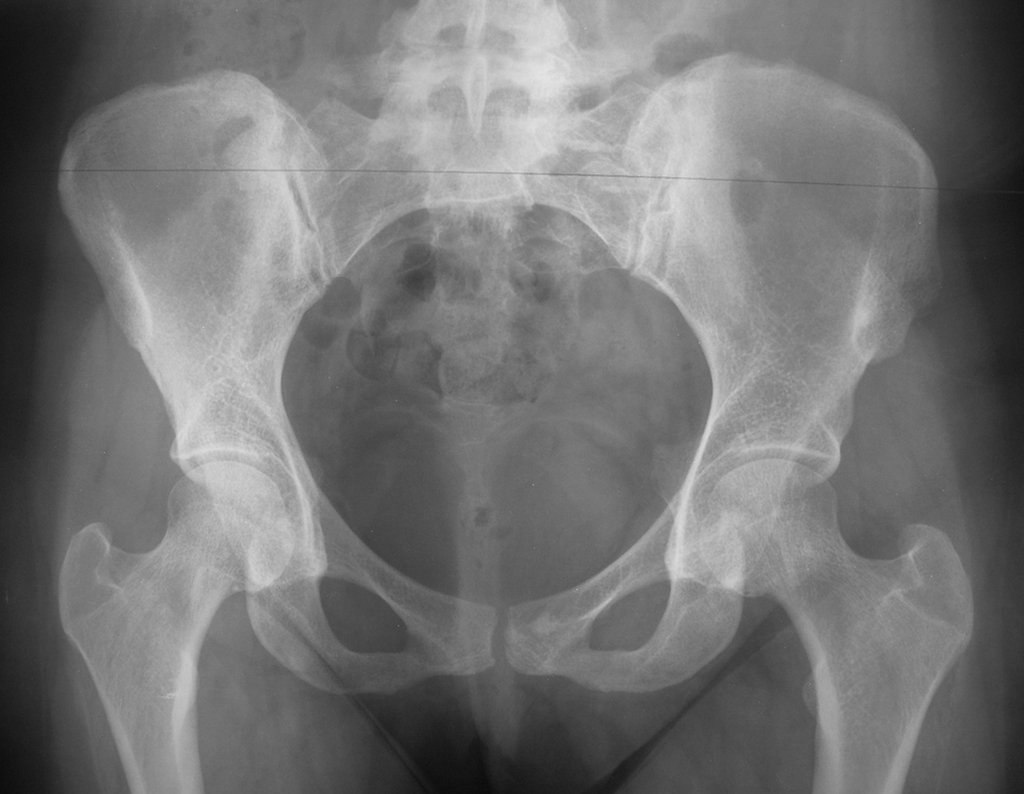
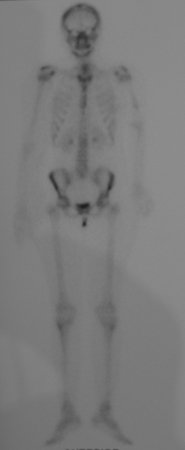
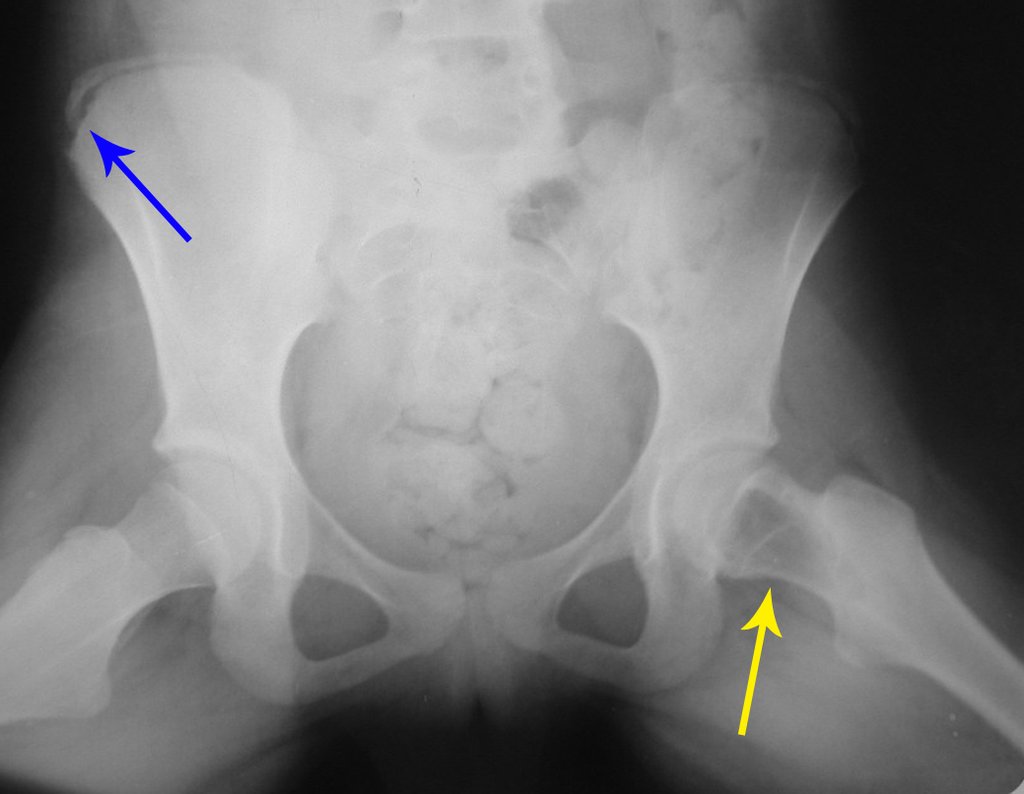
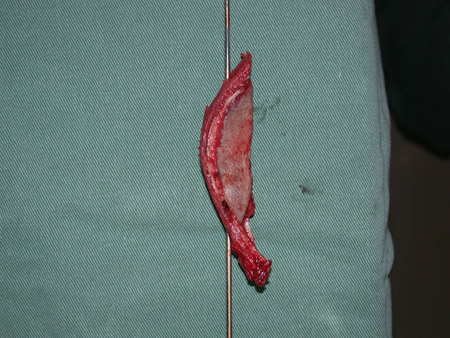
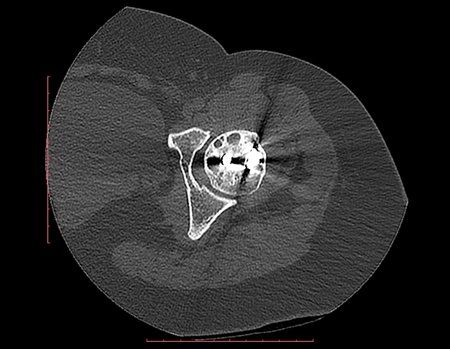
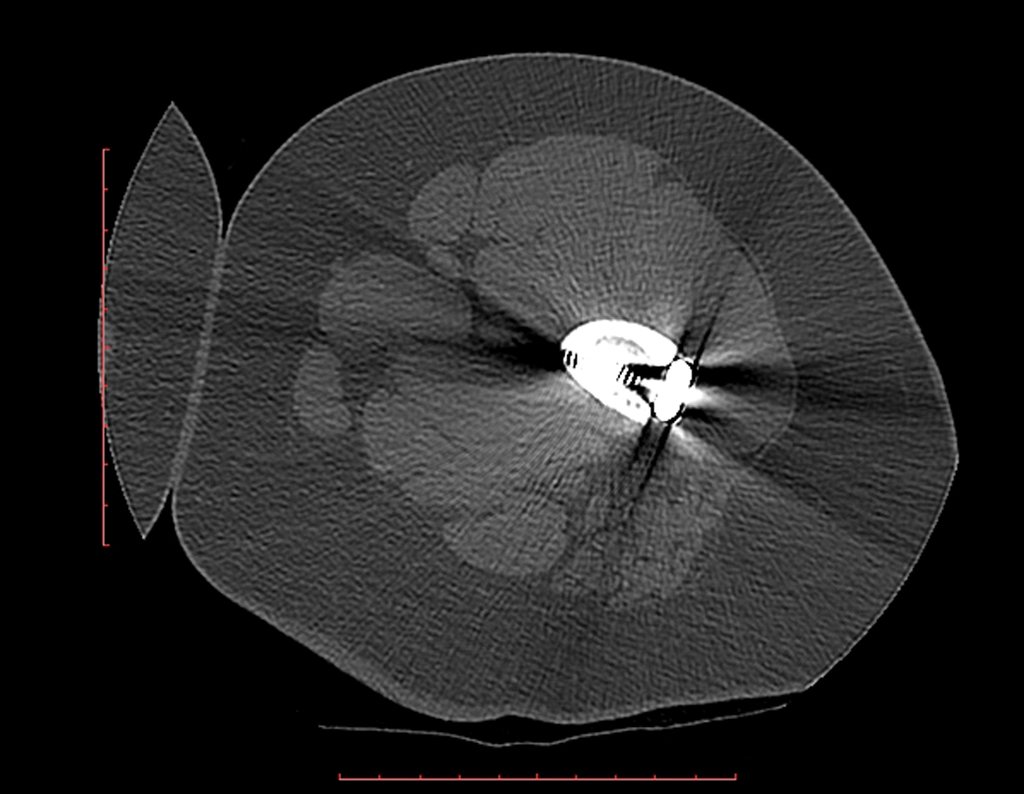
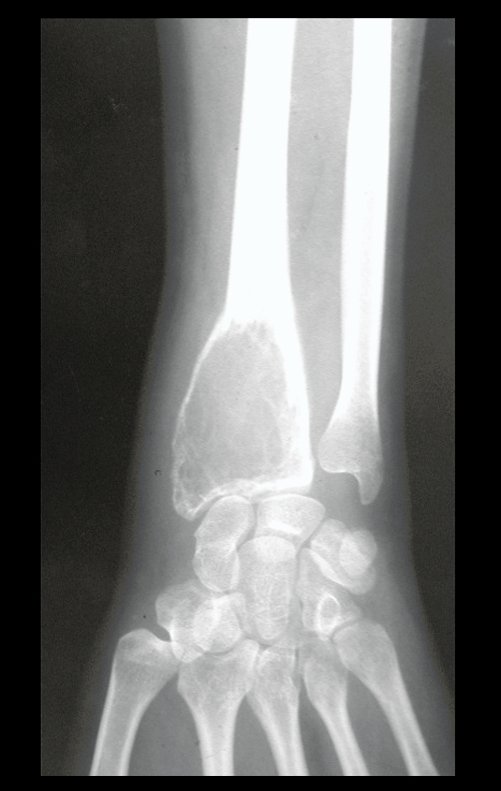
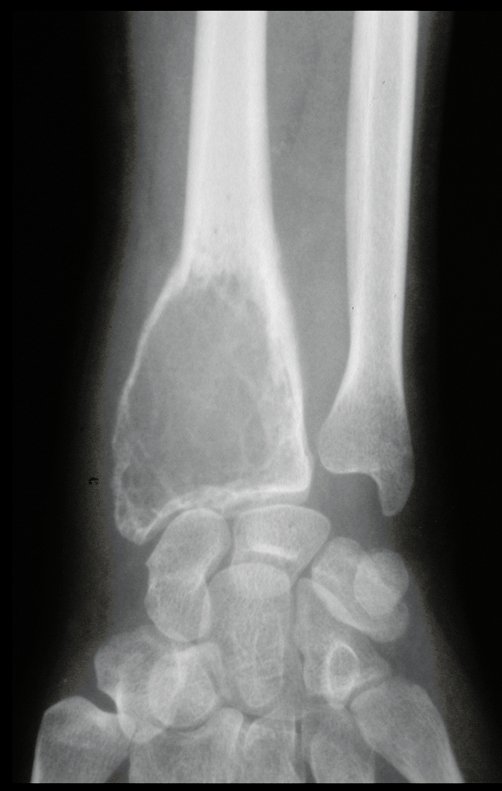
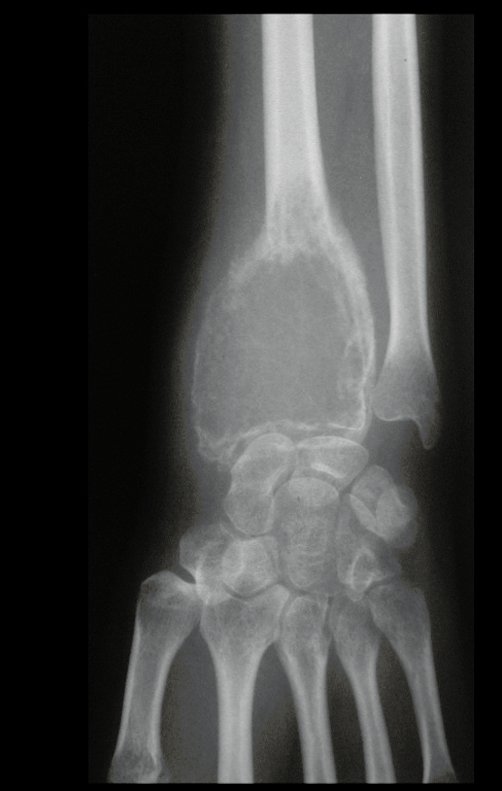
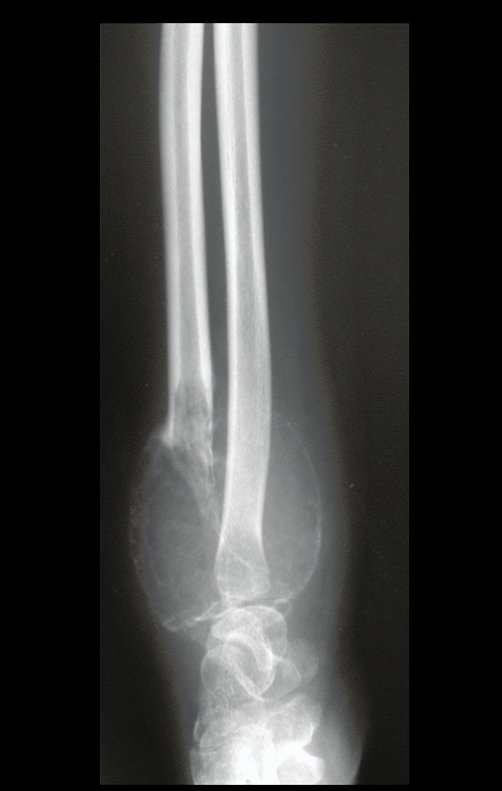
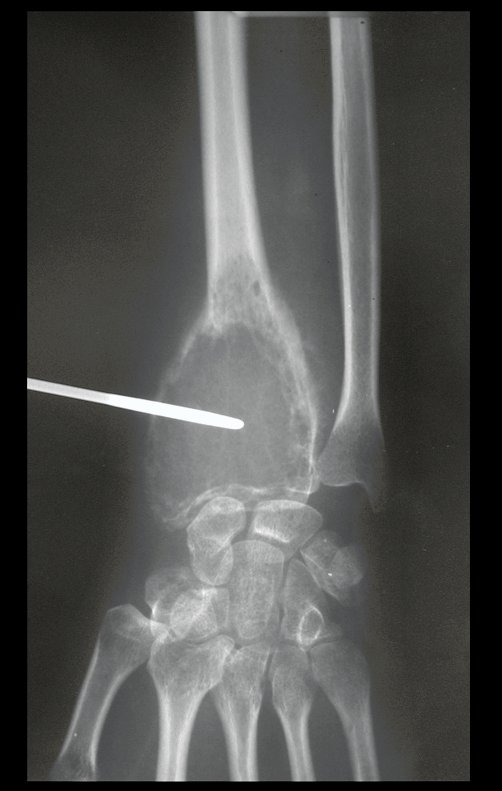
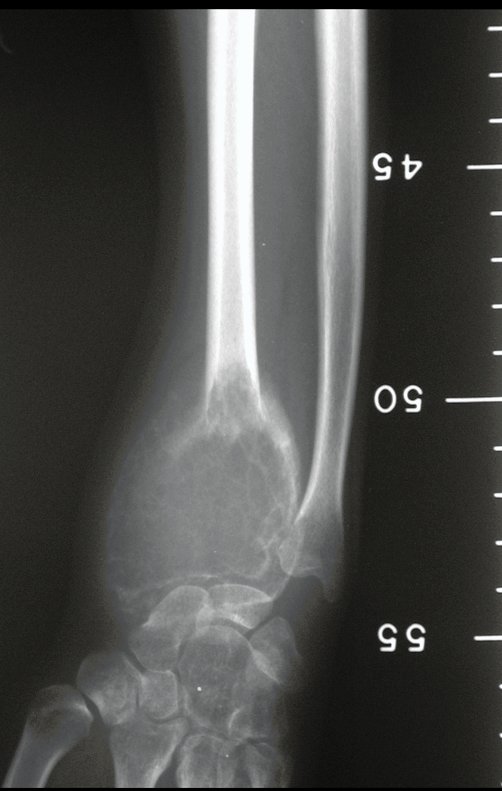
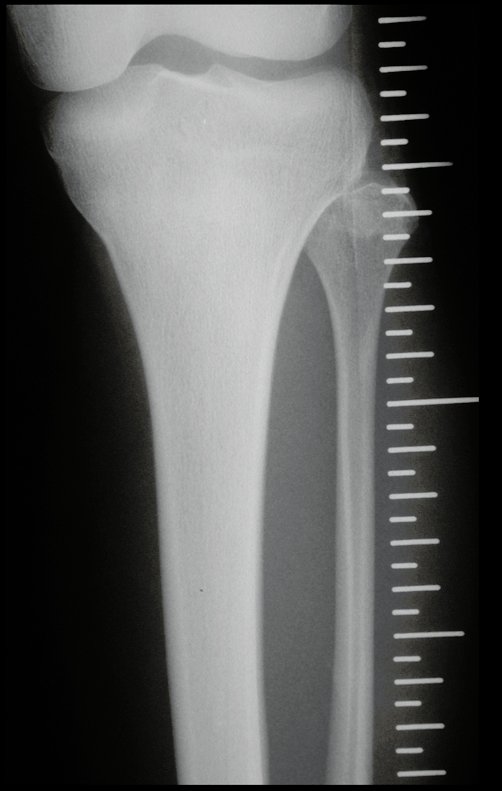
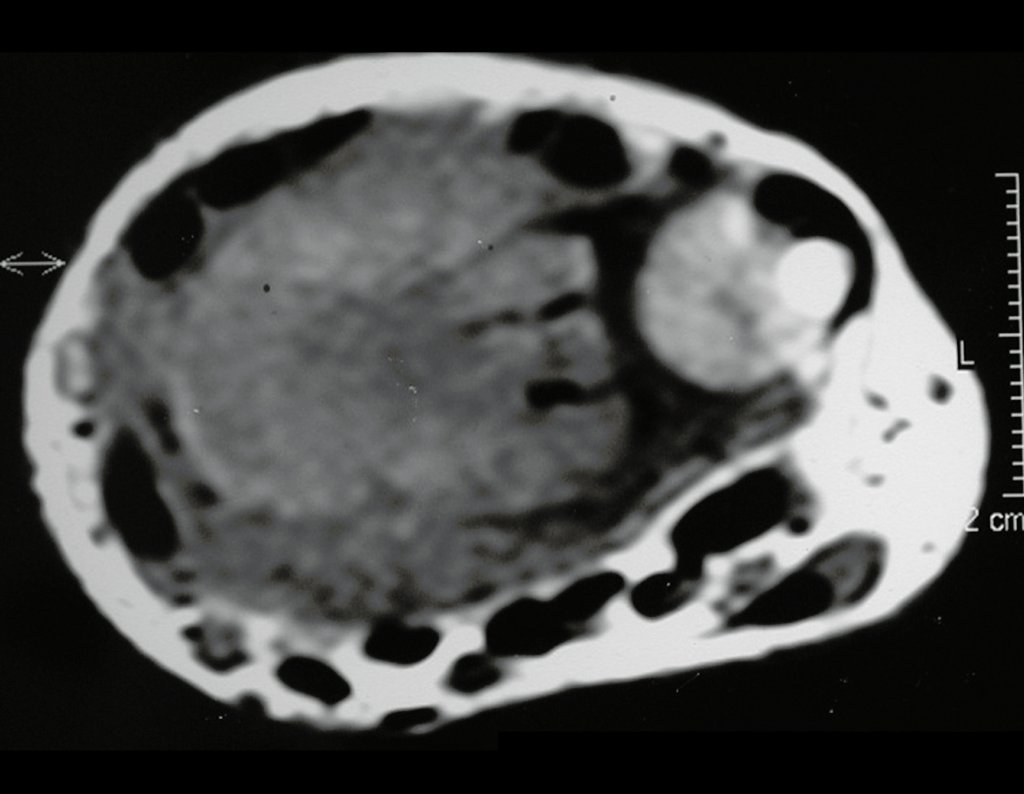
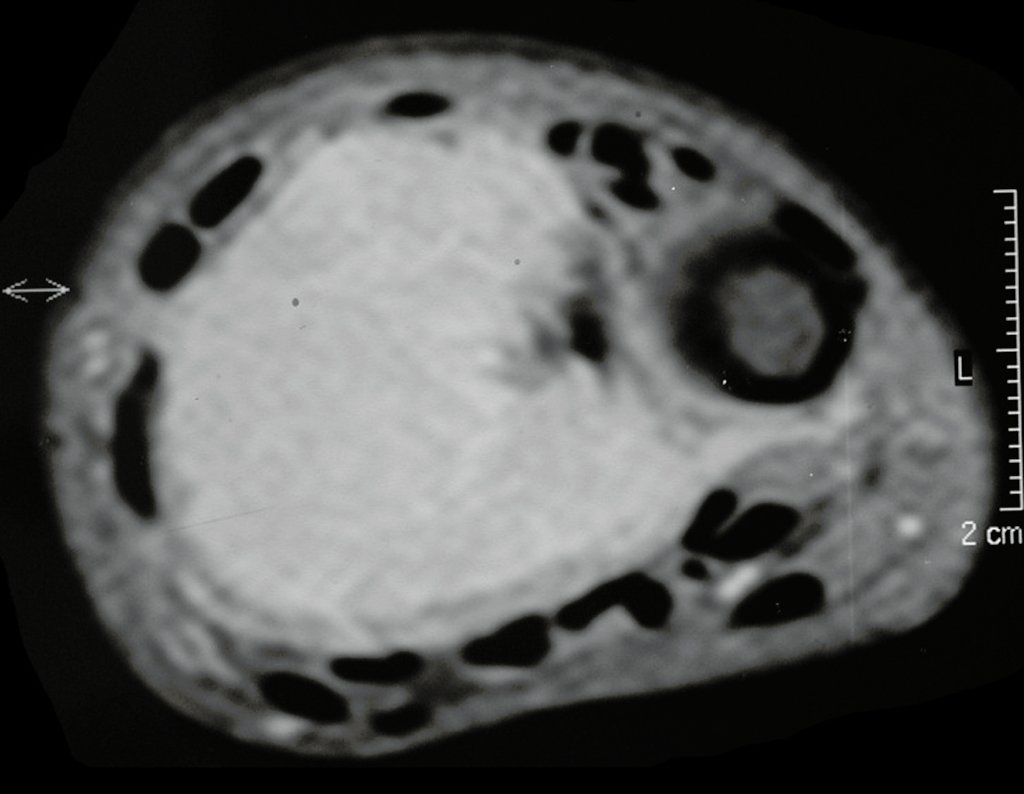
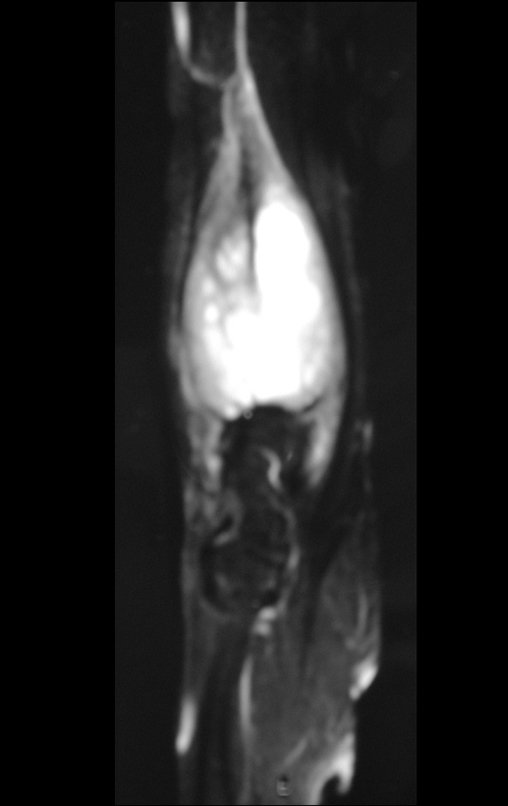
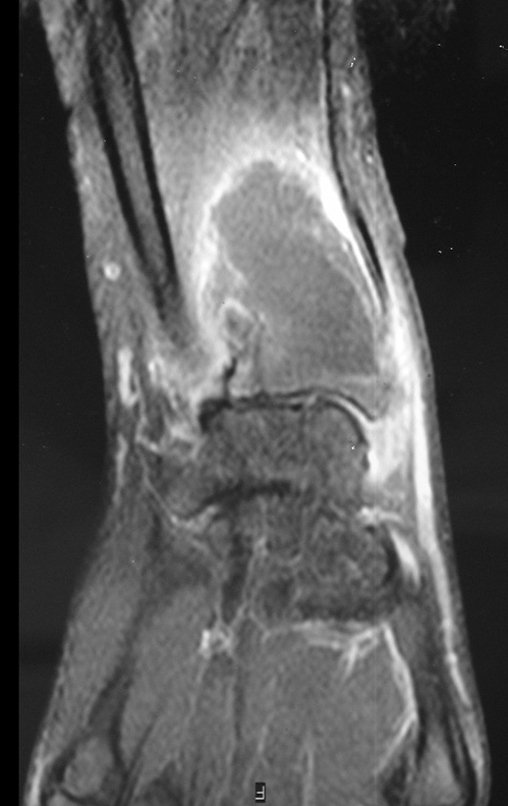
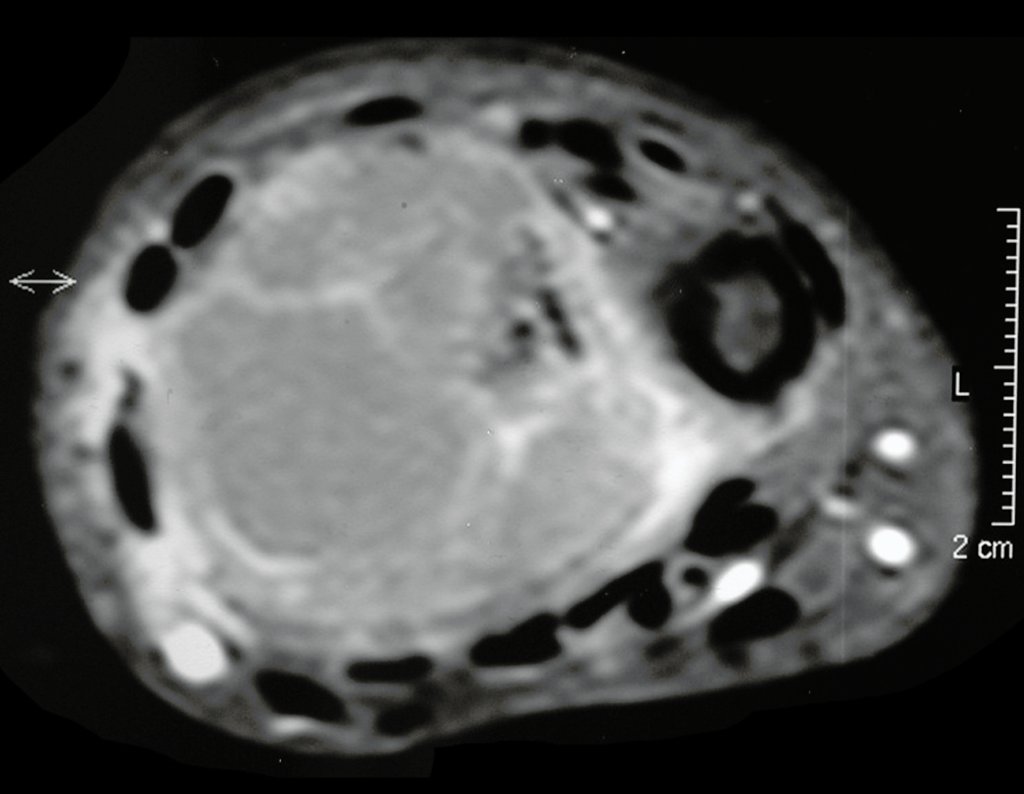
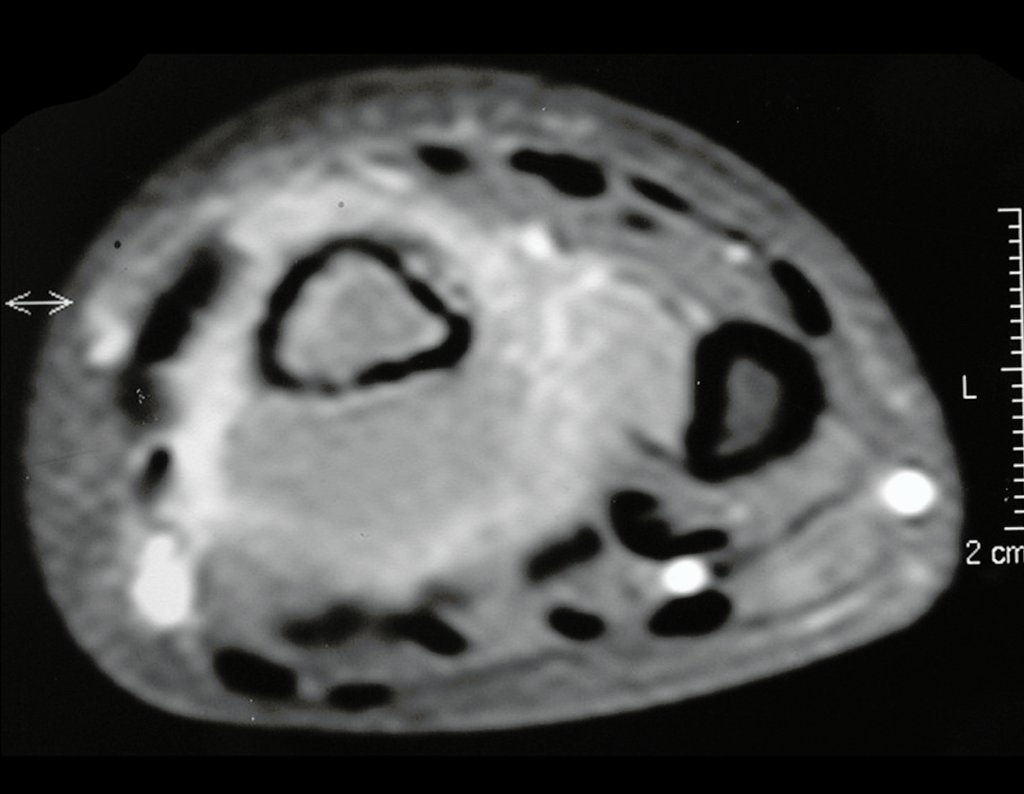
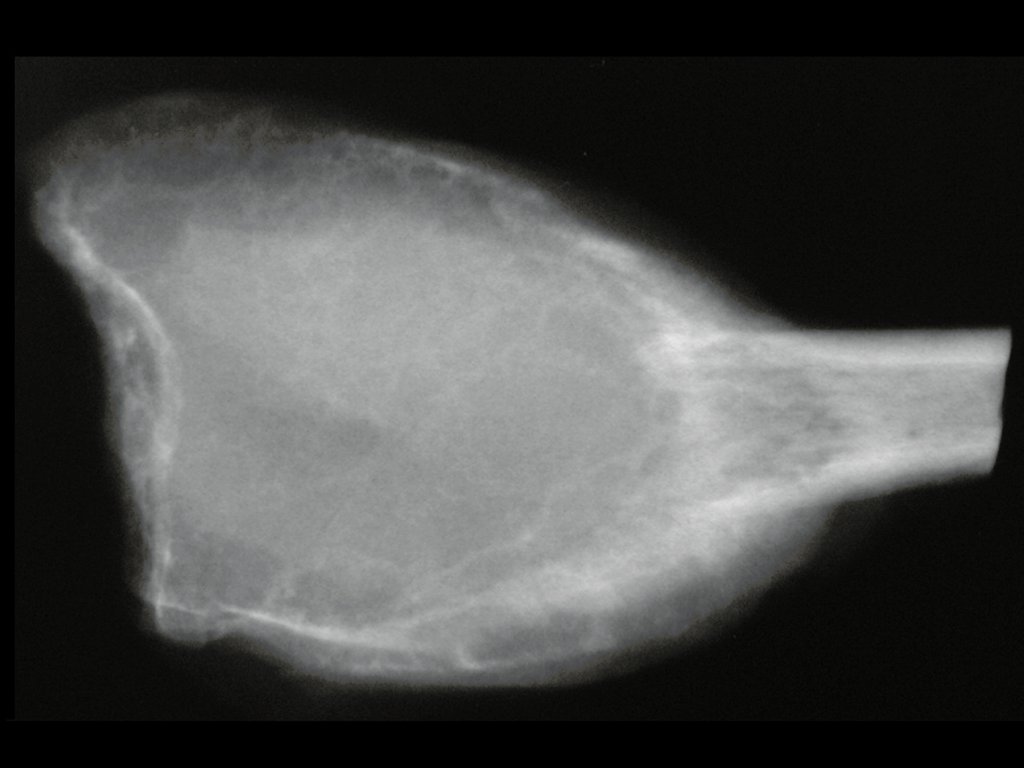
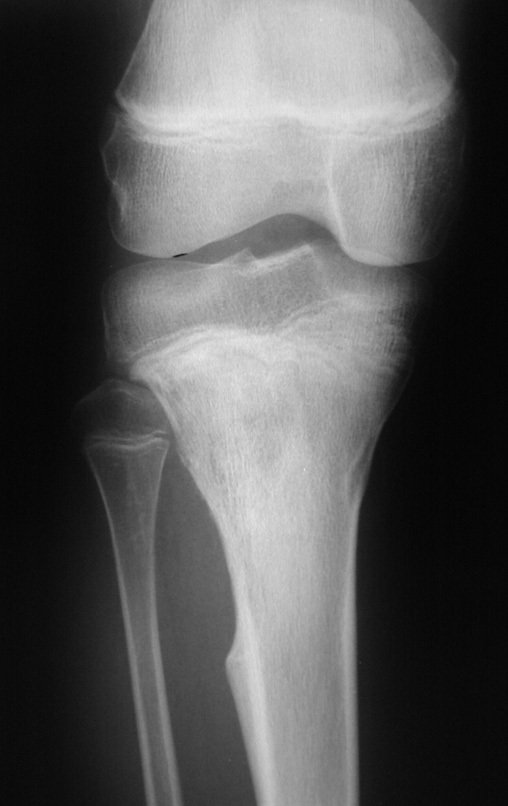
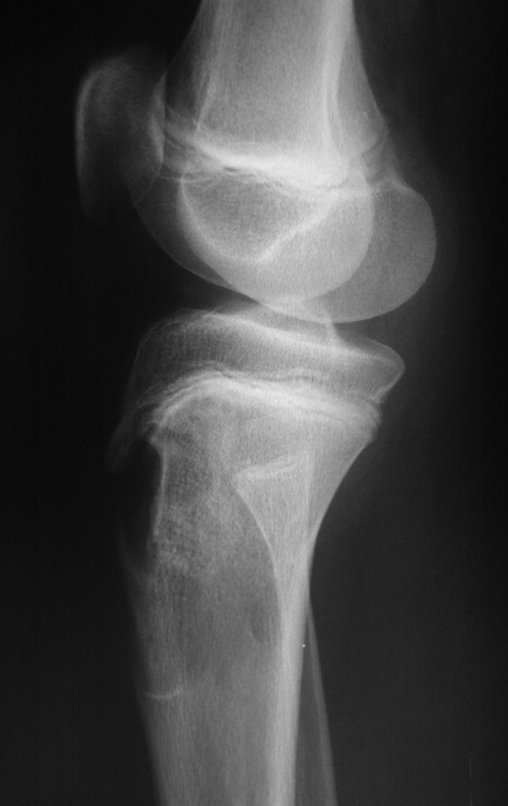
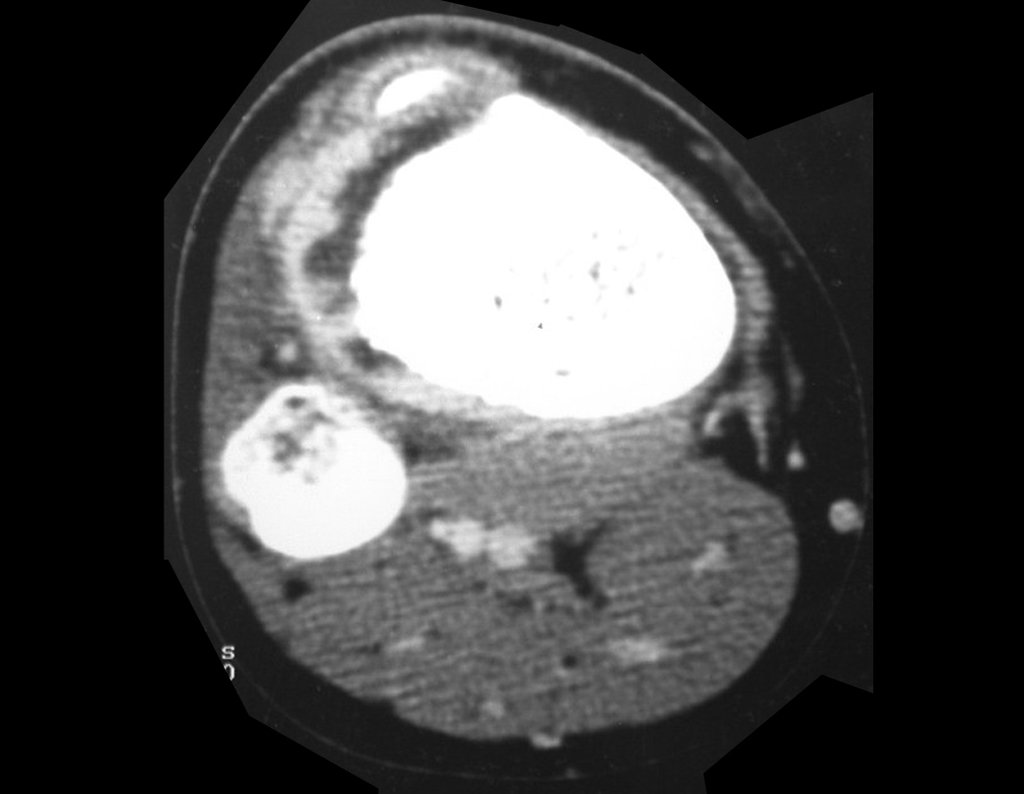
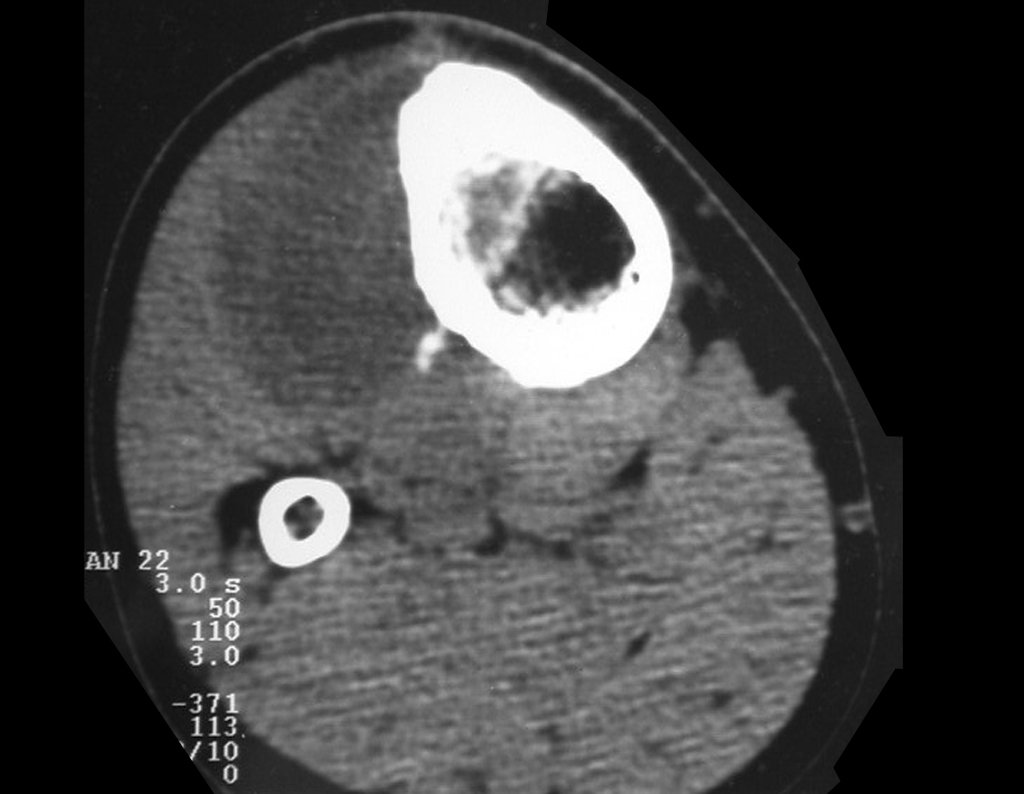
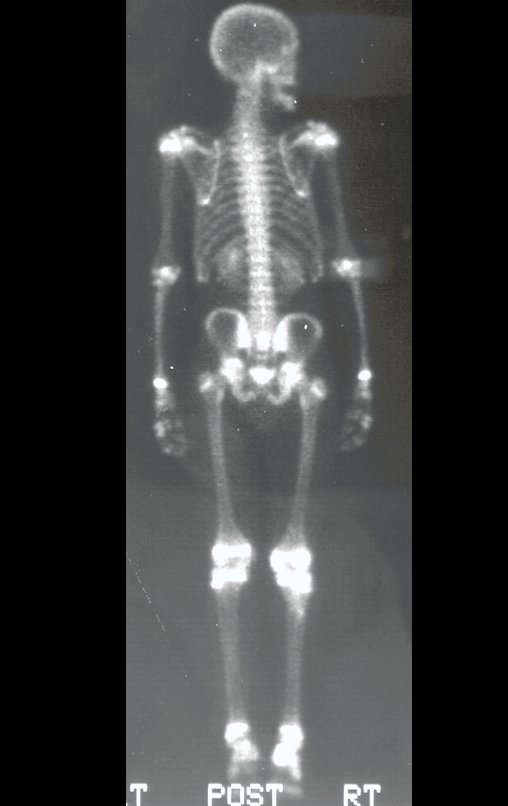
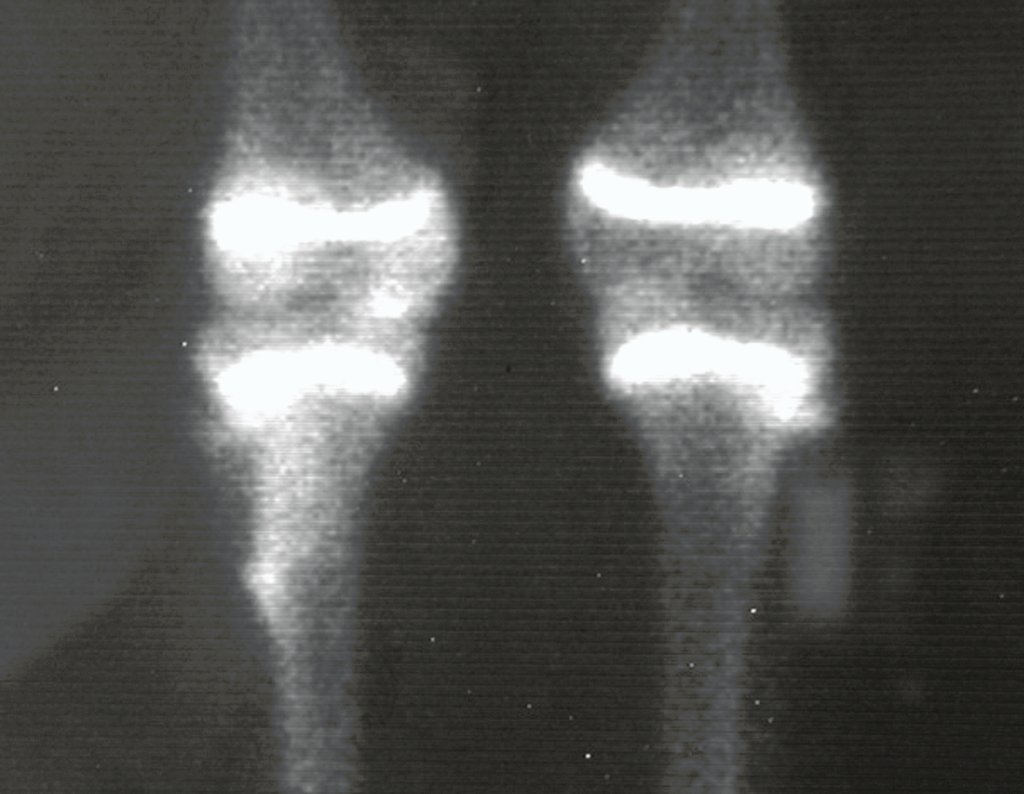
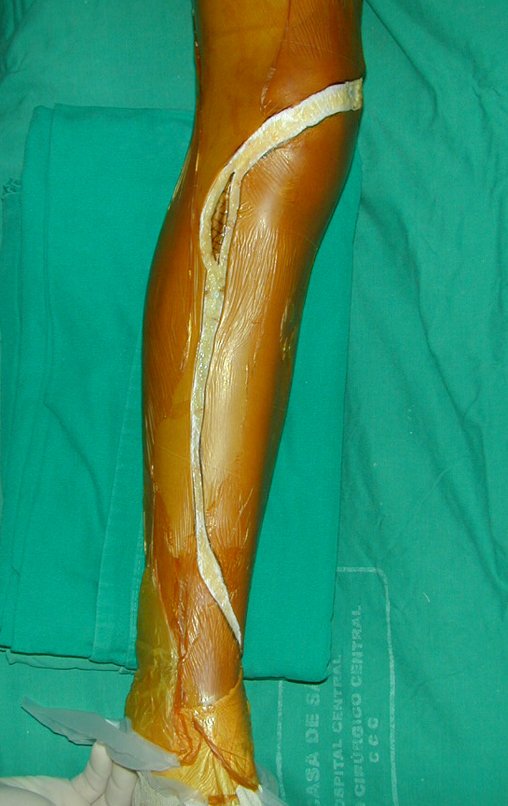
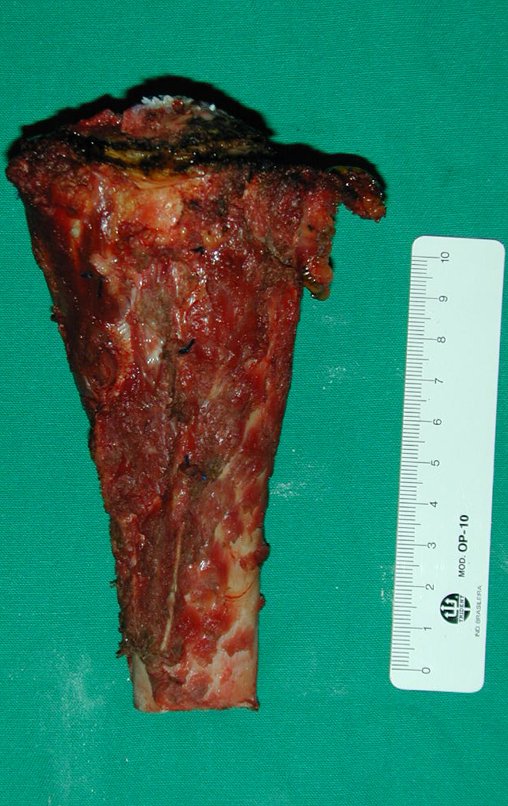
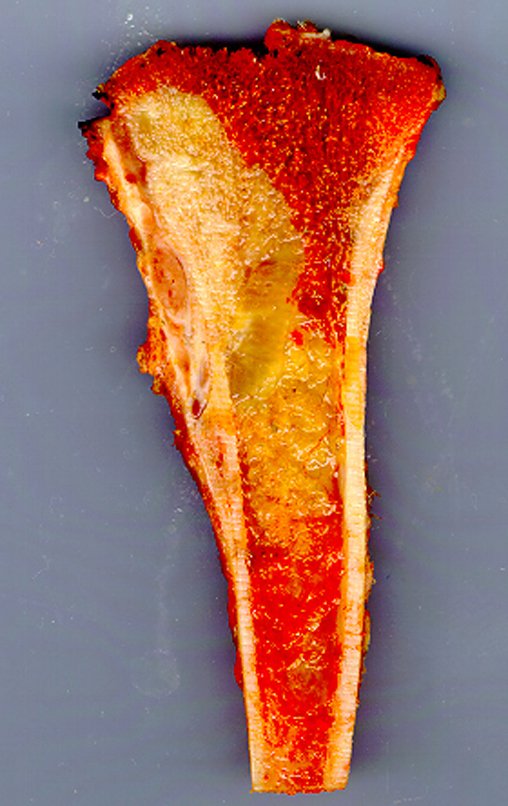
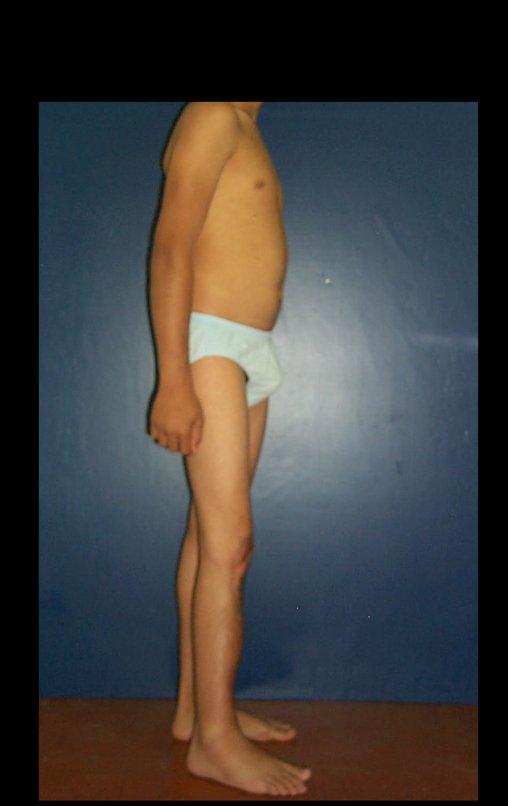
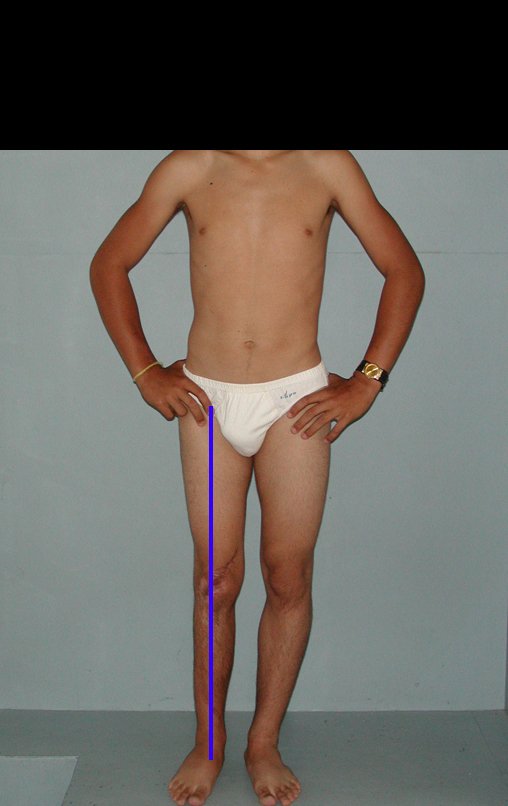
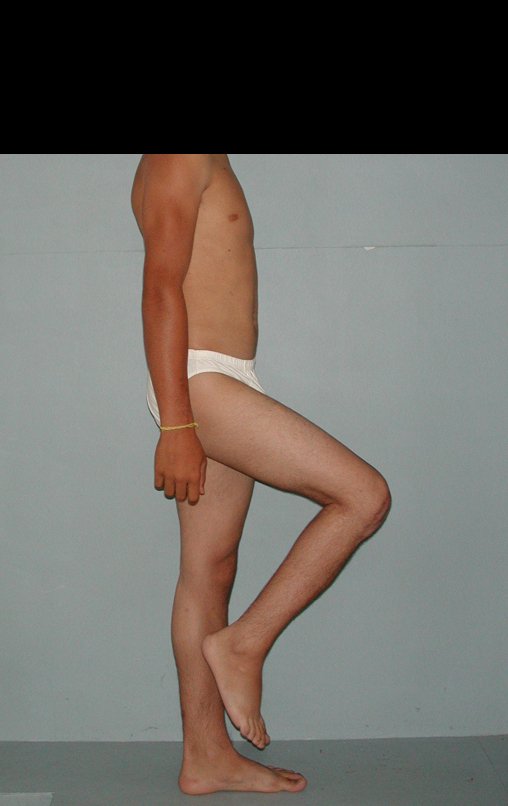
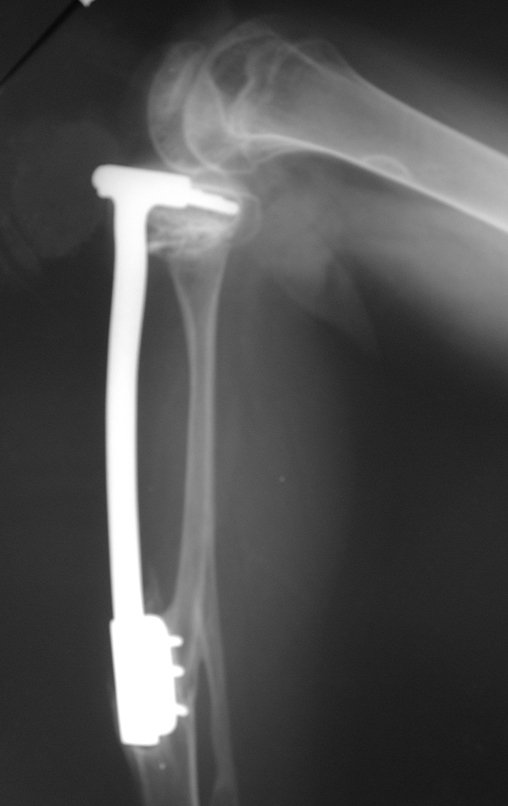
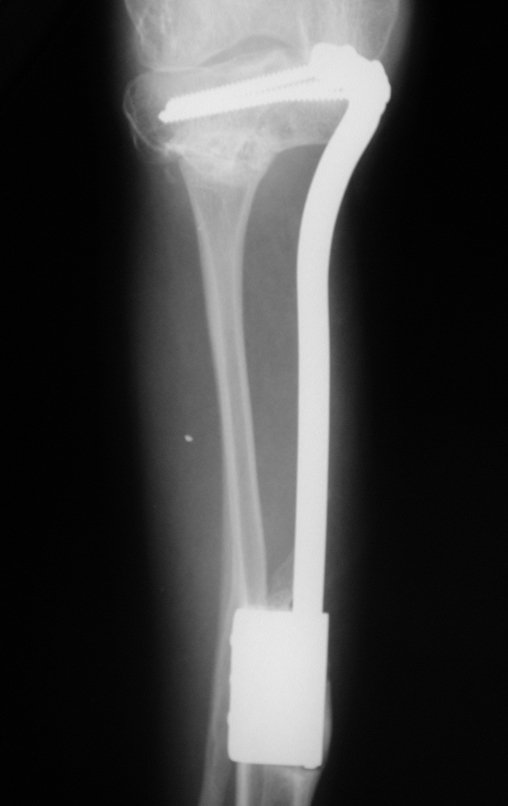
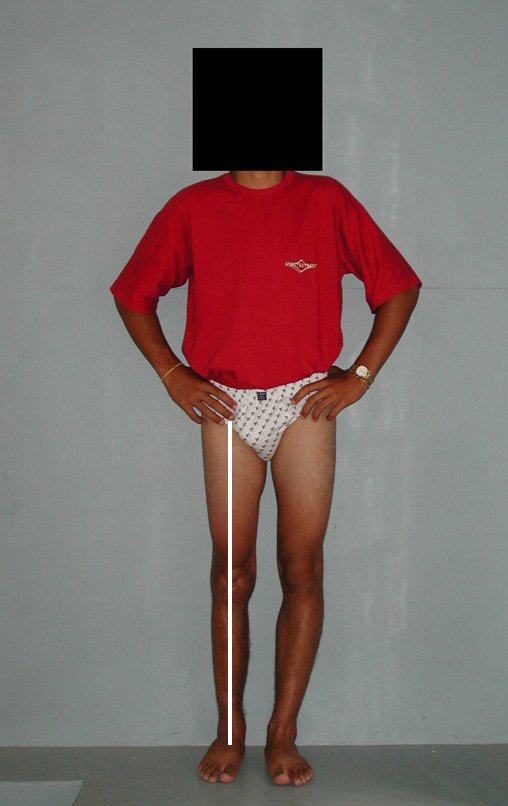
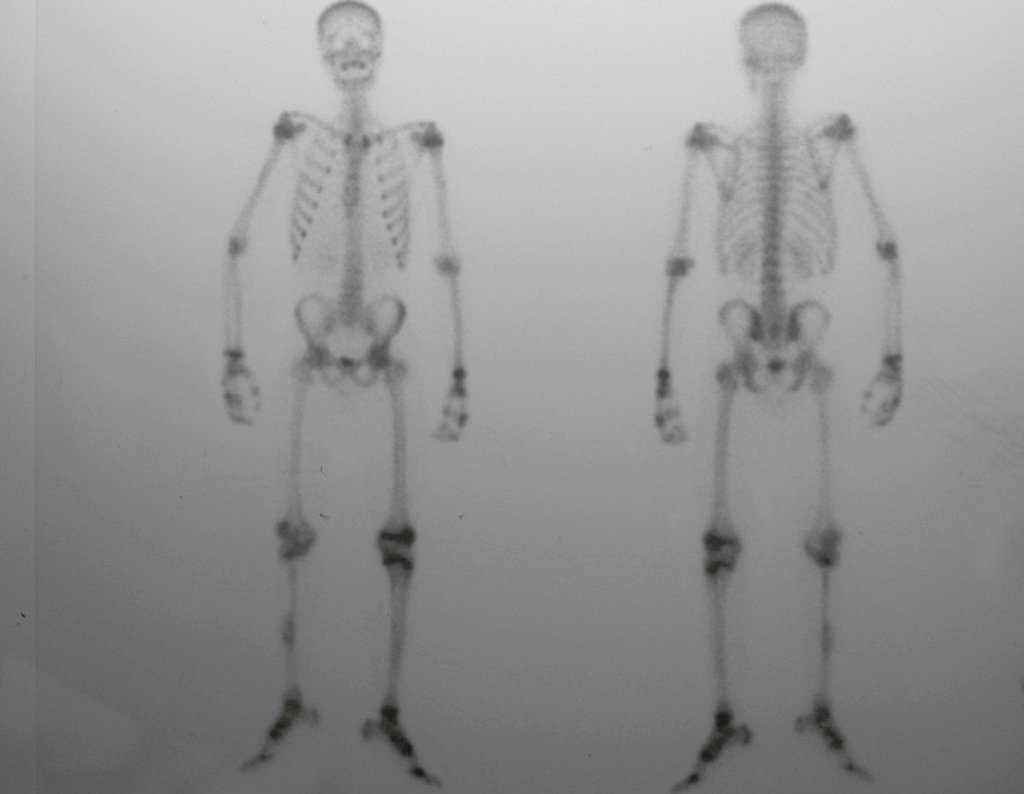
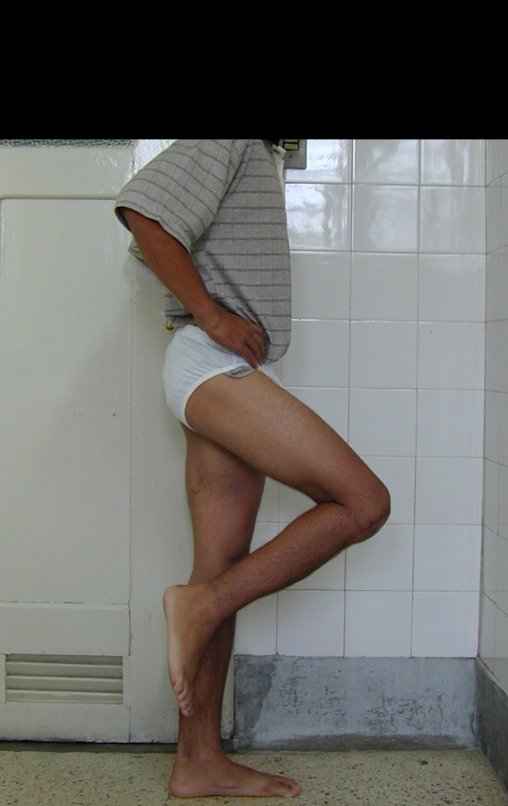
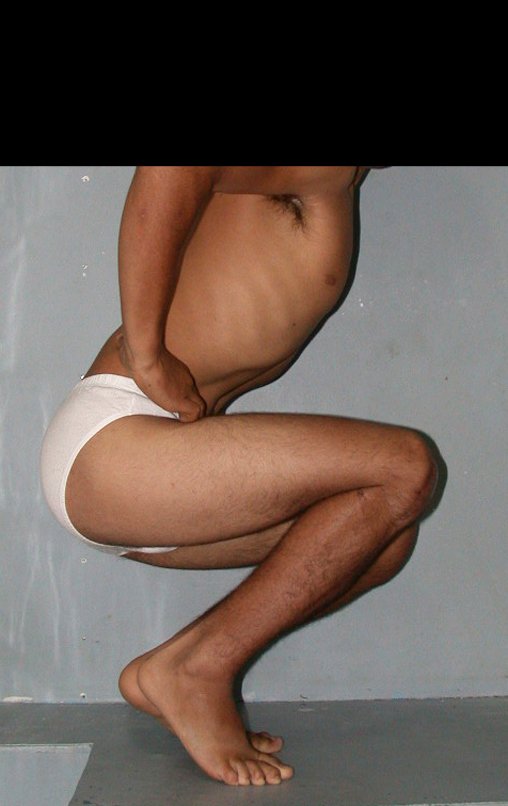
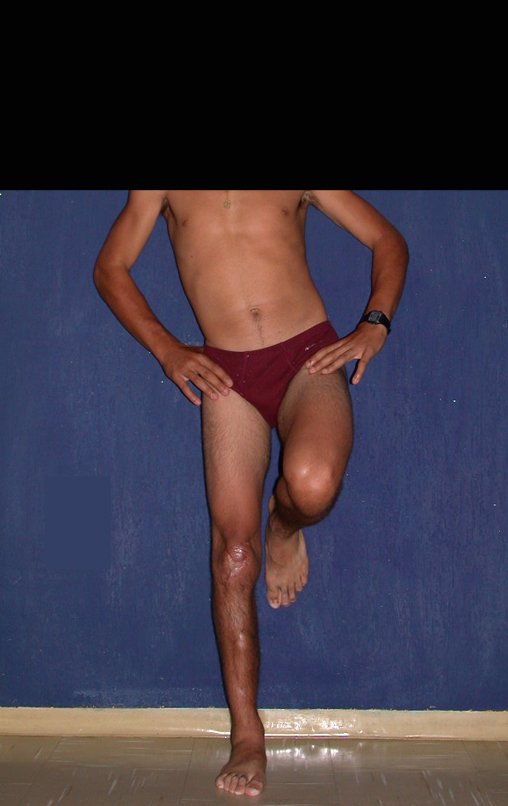
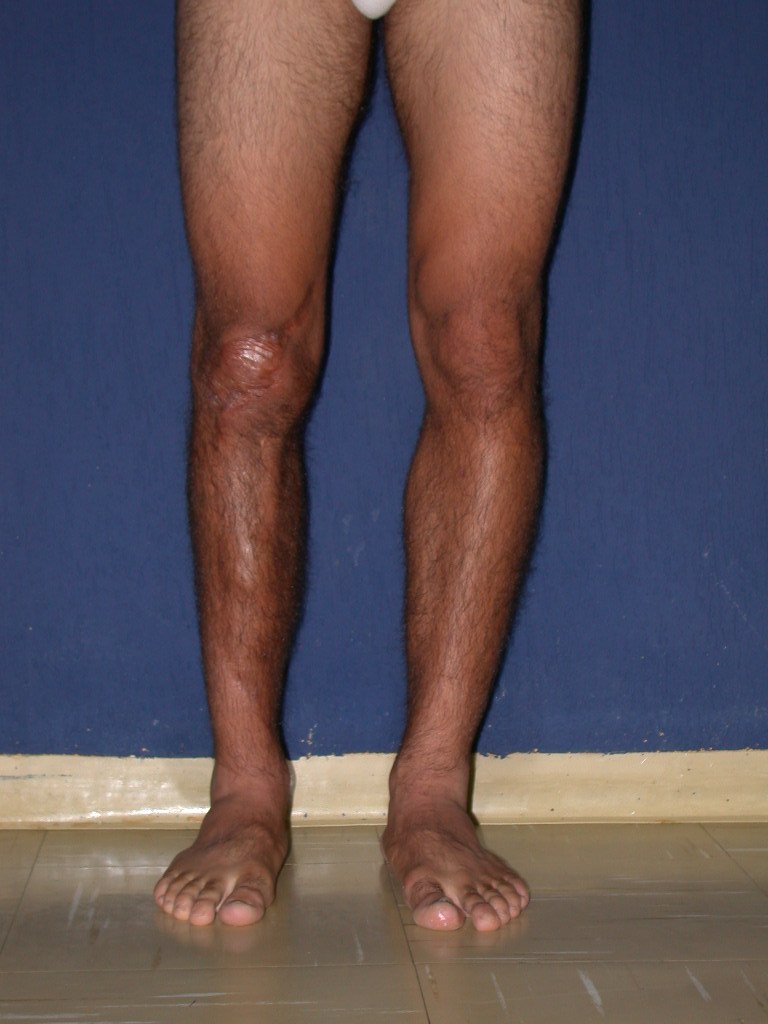
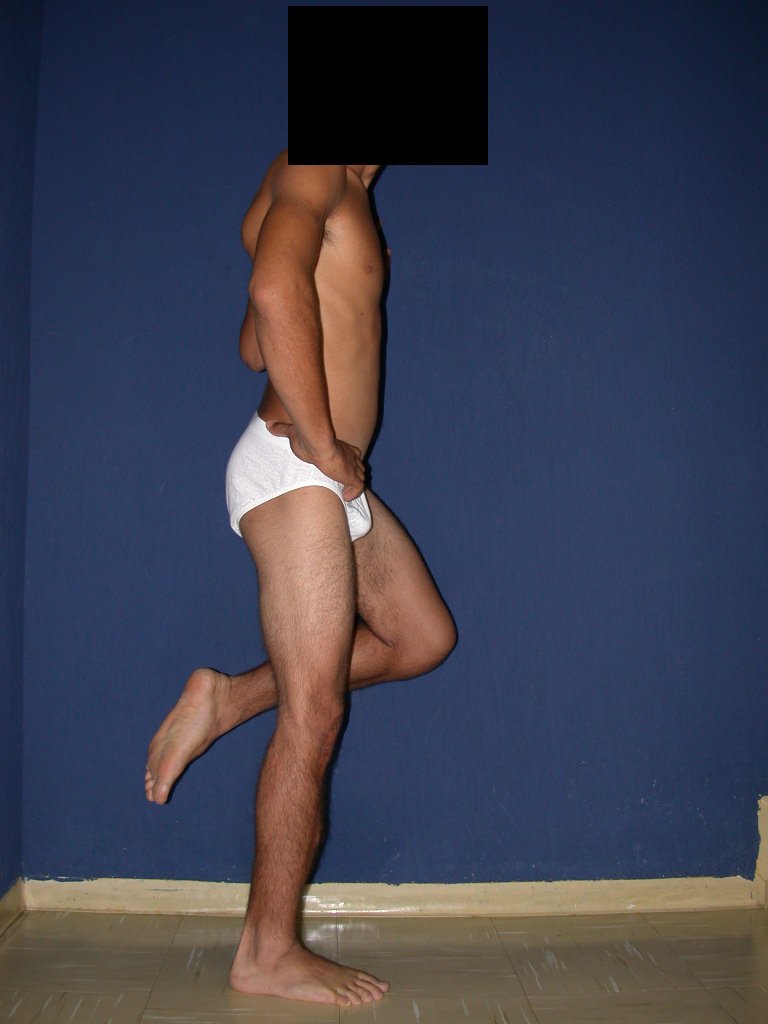
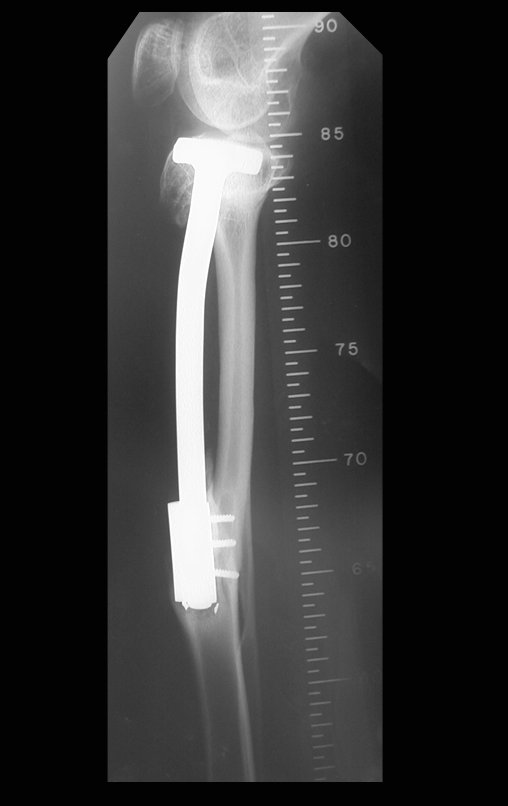
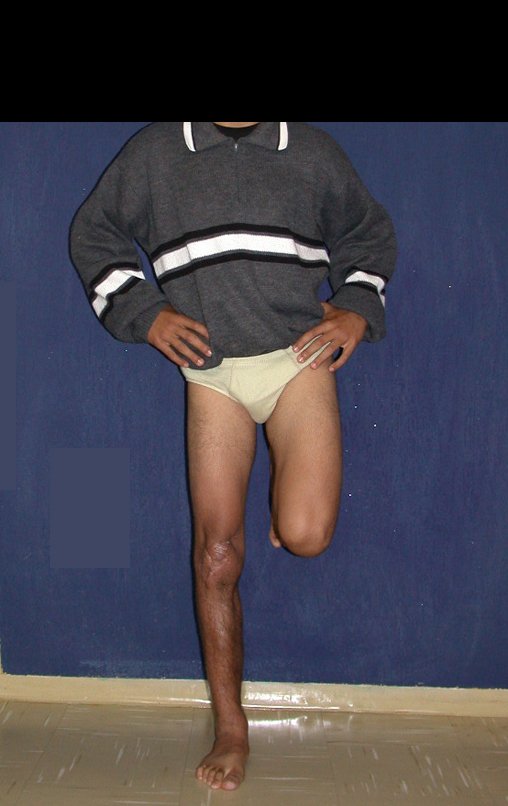
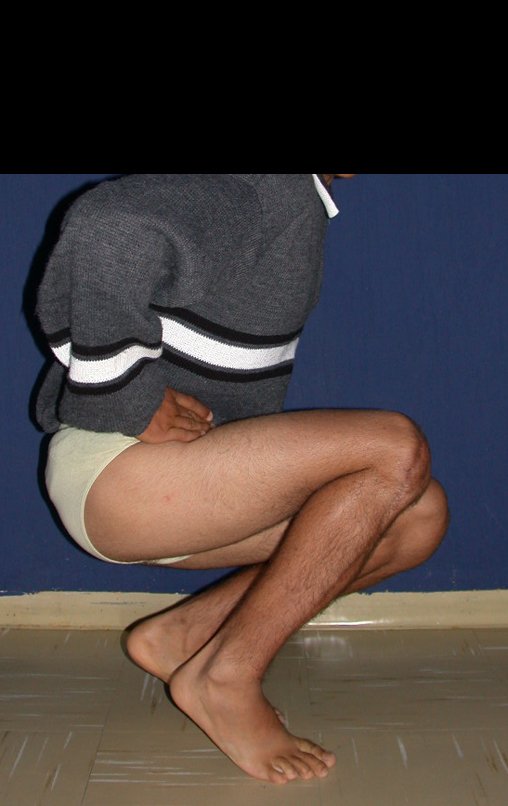
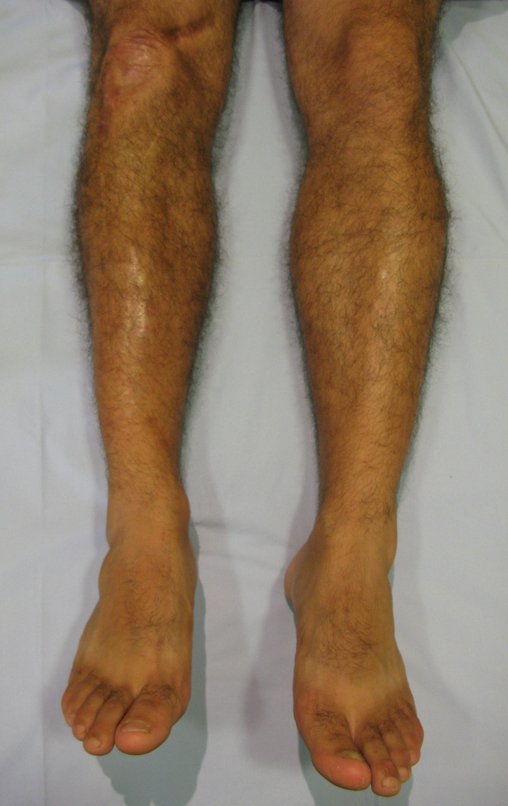
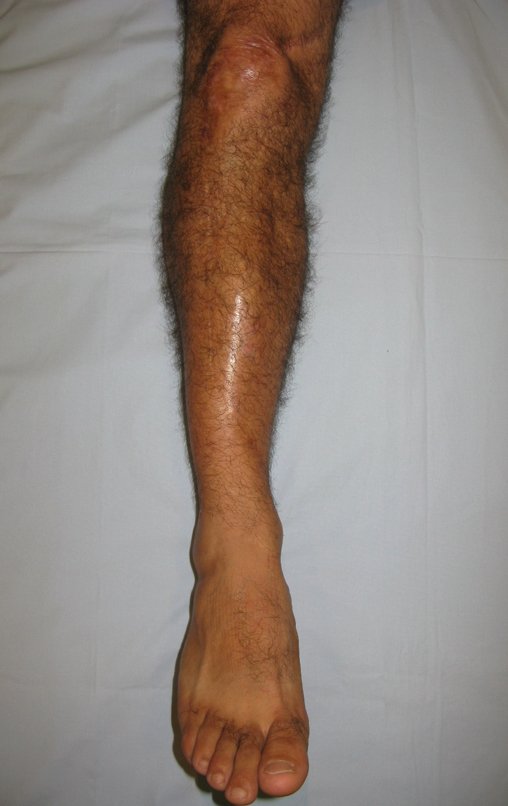
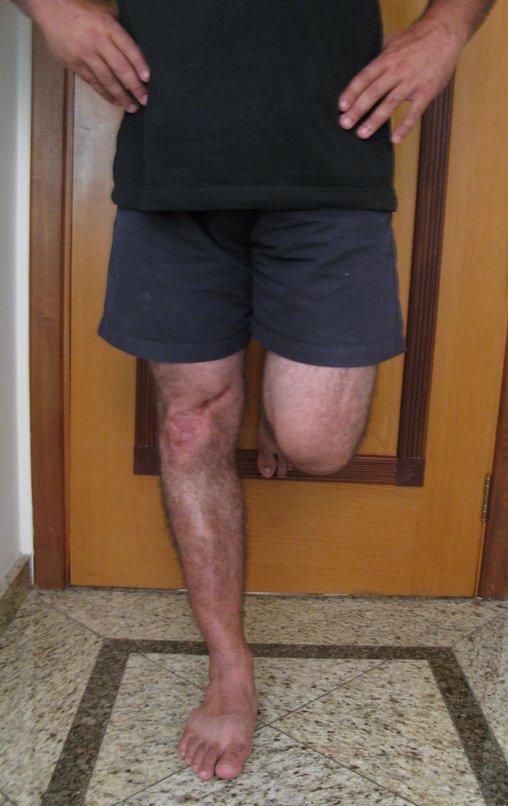
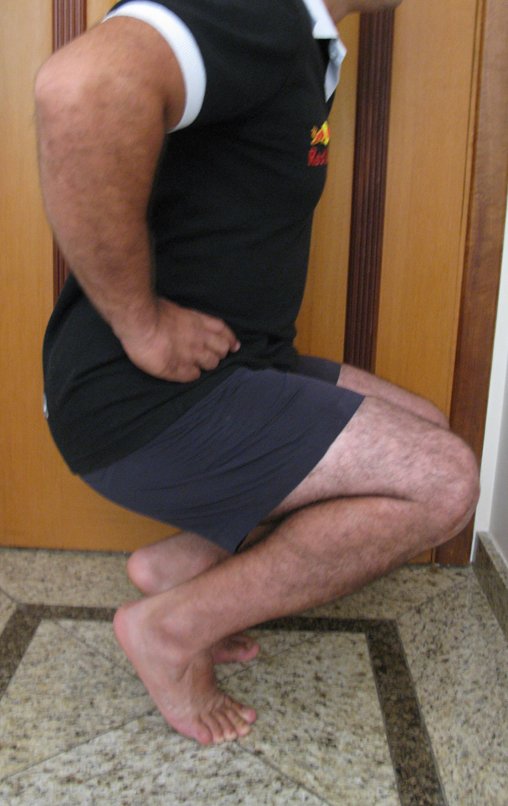
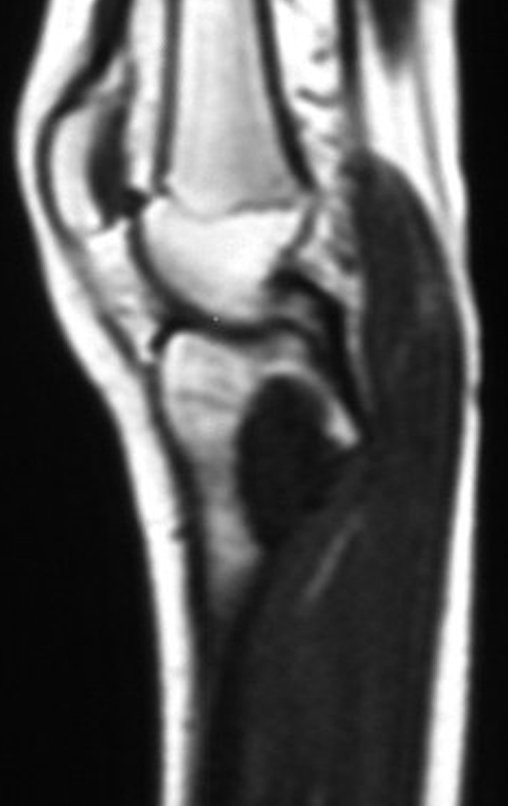
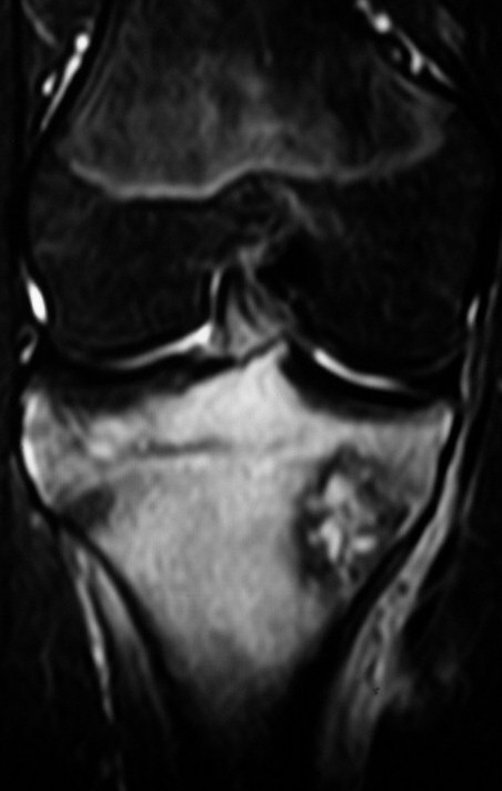
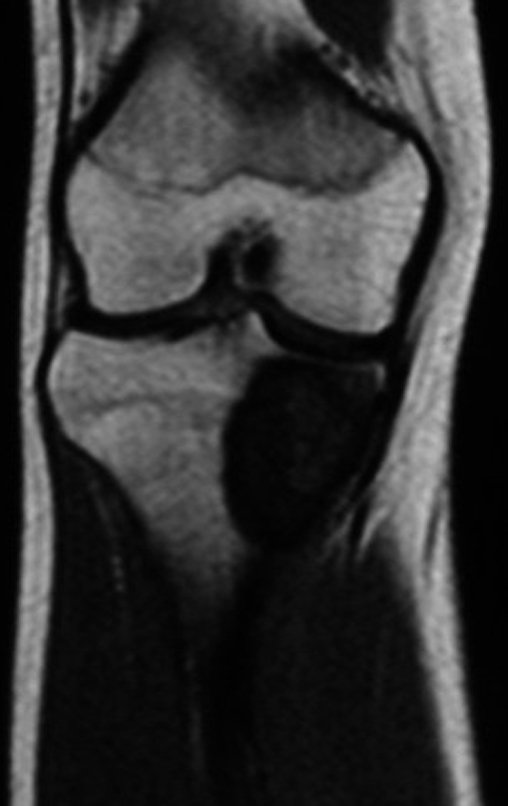
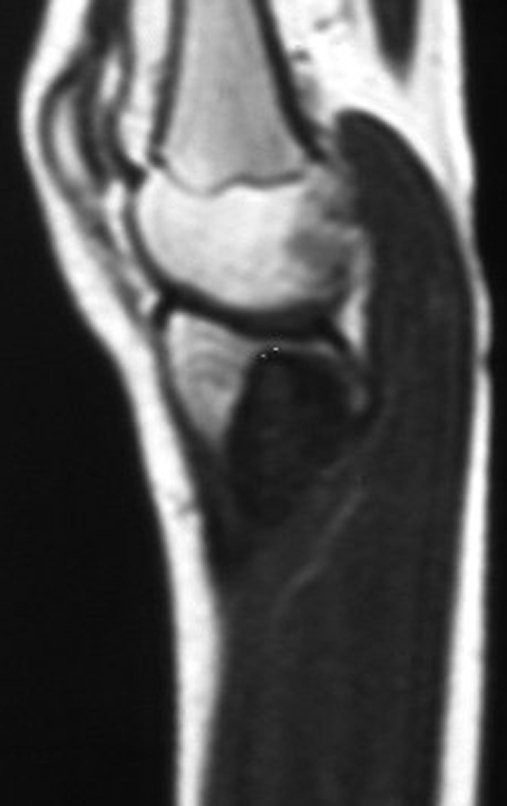
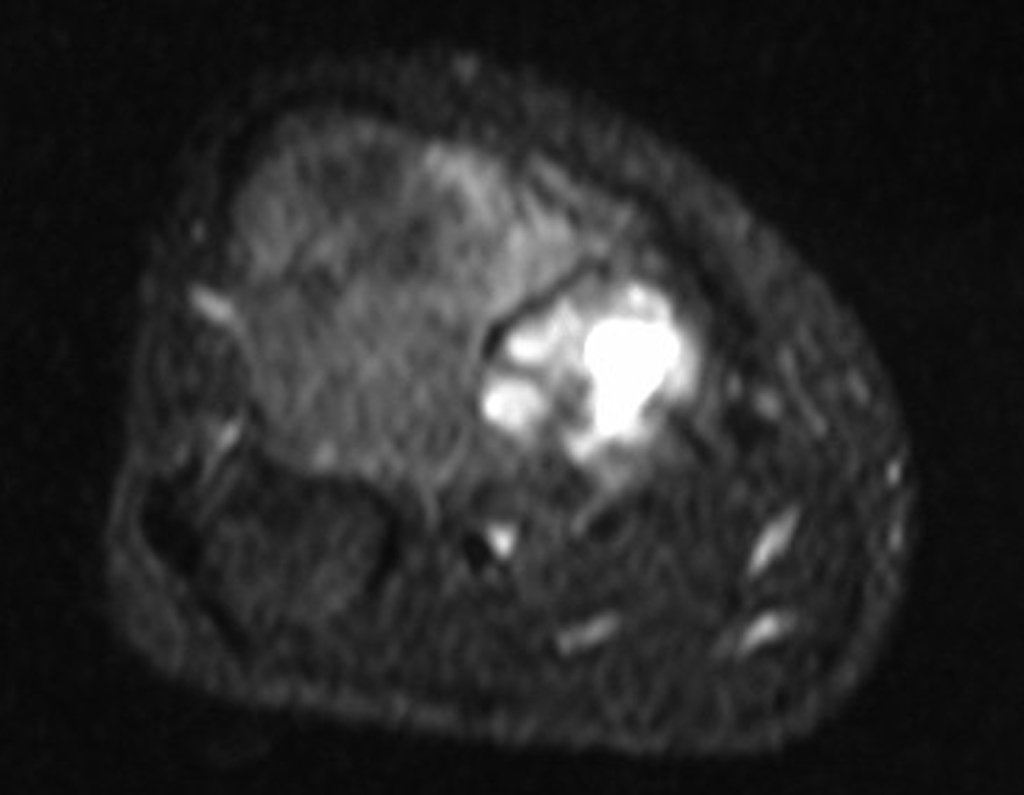
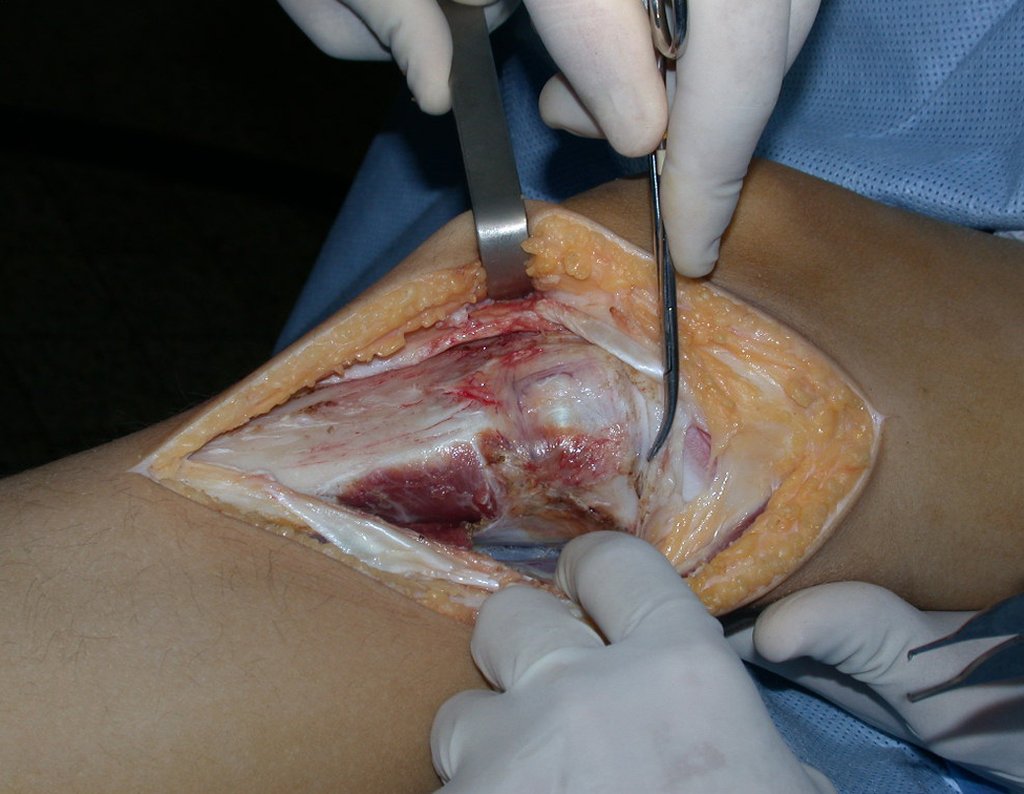
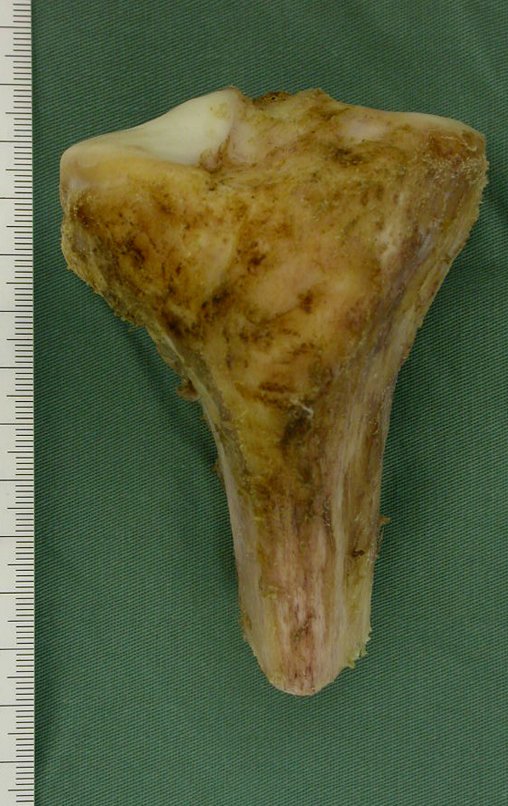
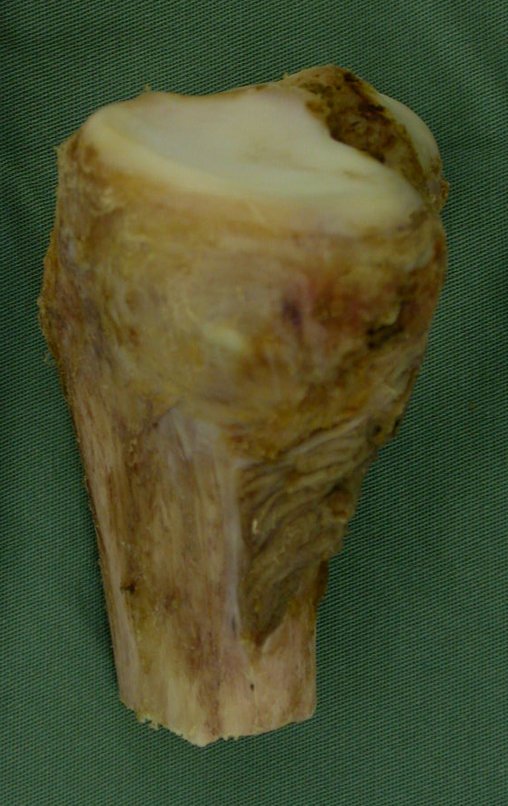
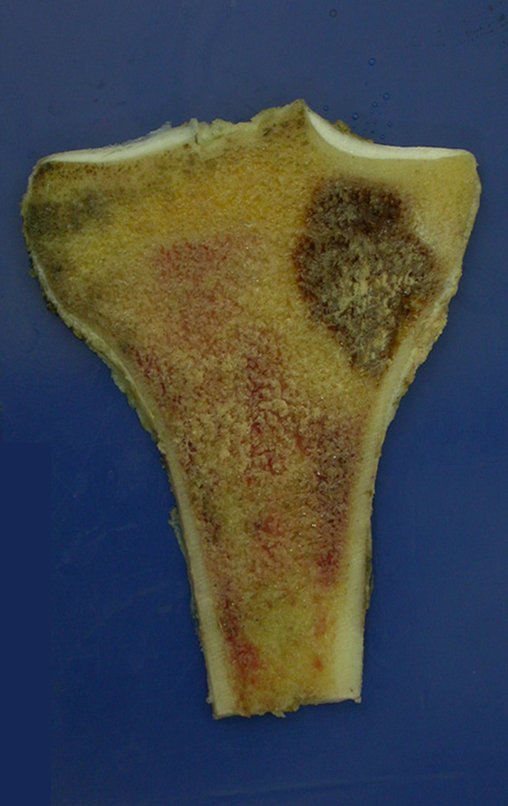
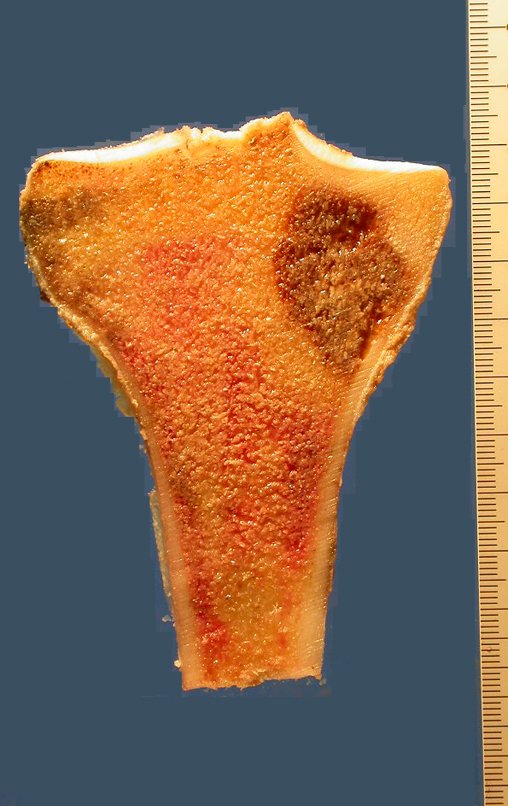
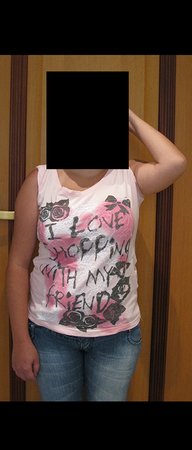Técnica de Epifisiodese e Prótese parcial rotatória. Paciente com 11 anos de idade, apresentando dor no joelho e aumento de volume no terço inferior do fêmur direito. as radiografias de fevereiro de 2014 evidenciaram lesão produtora de tecido ósseo na metáfise, figuras 1 e 2. A cintilografia constatou tratar-se de lesão única com intensa captação na região metafisária distal do fêmur, figuras 3 e 4.
15. Técnica de Epifisiodese e Prótese parcial rotatória, com preservação da fise de crescimento da tíbia, em osteossarcoma do fêmur.
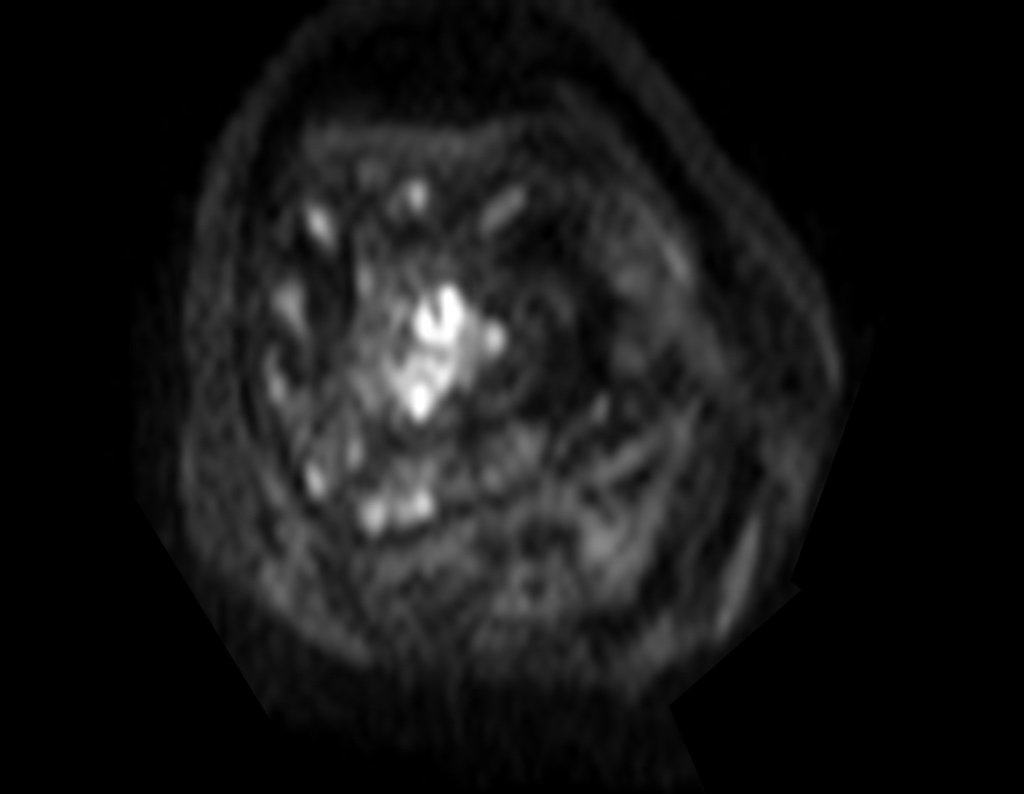
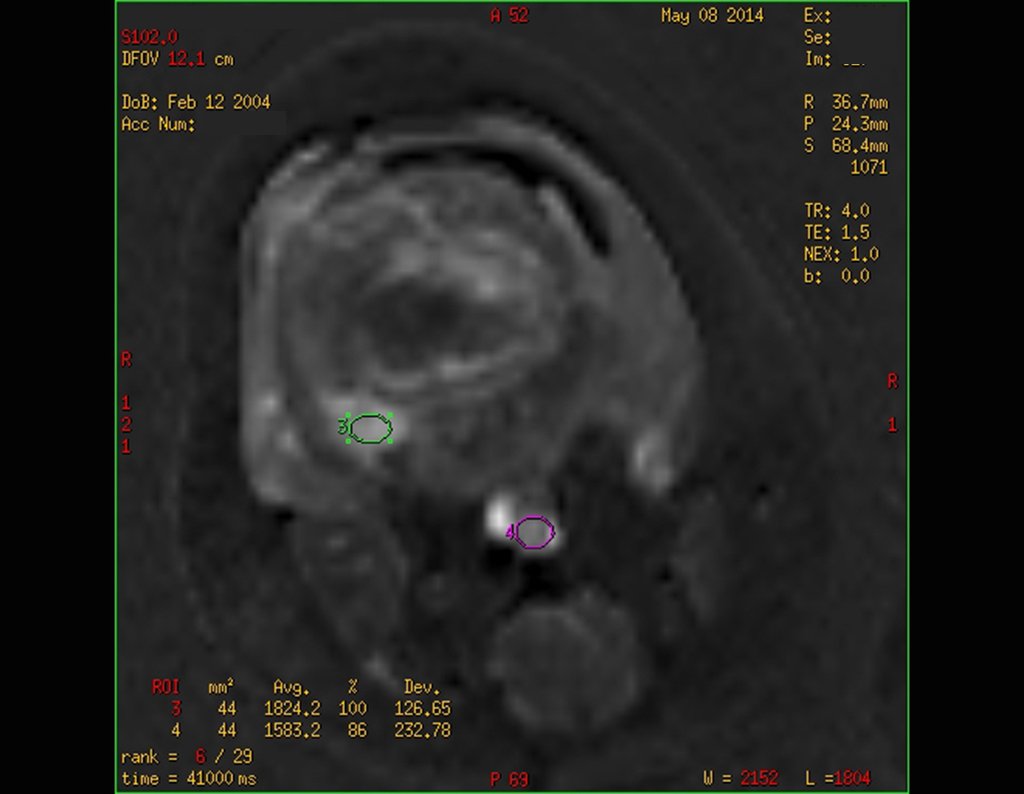
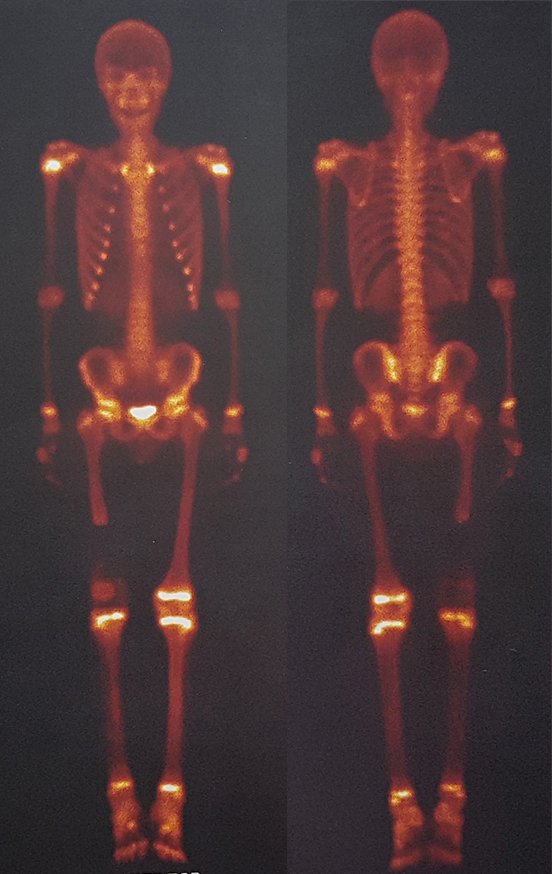
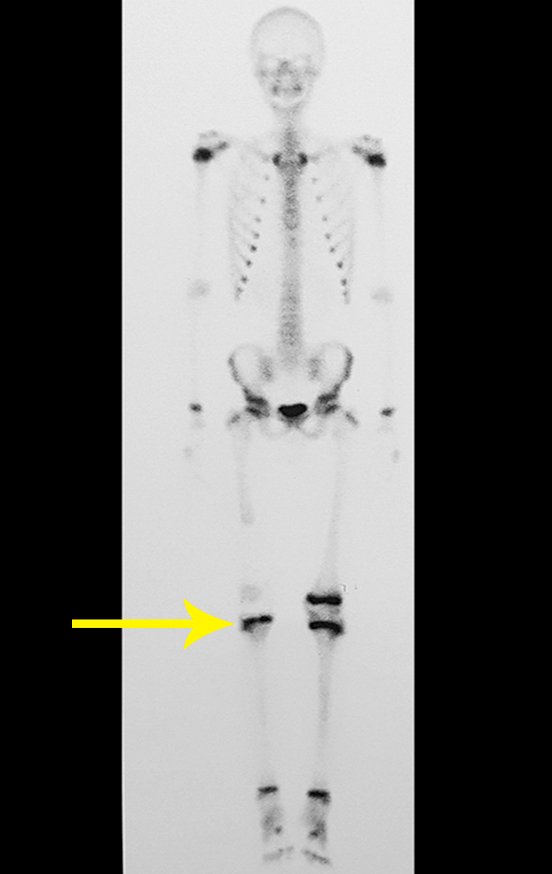
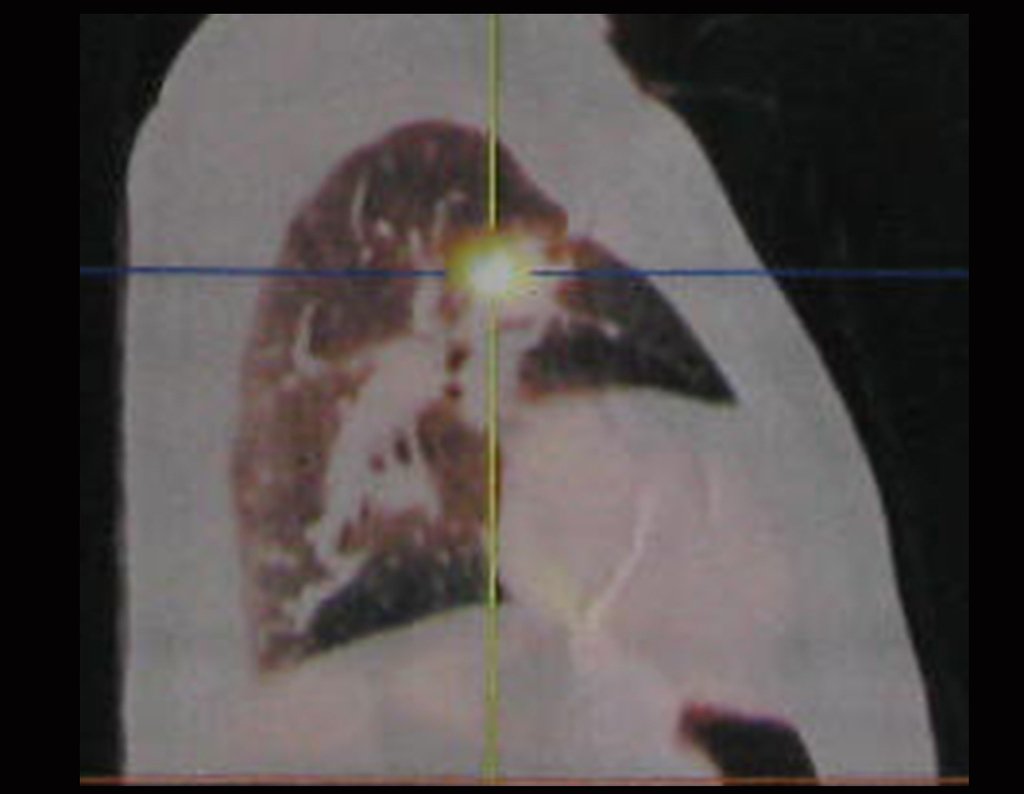
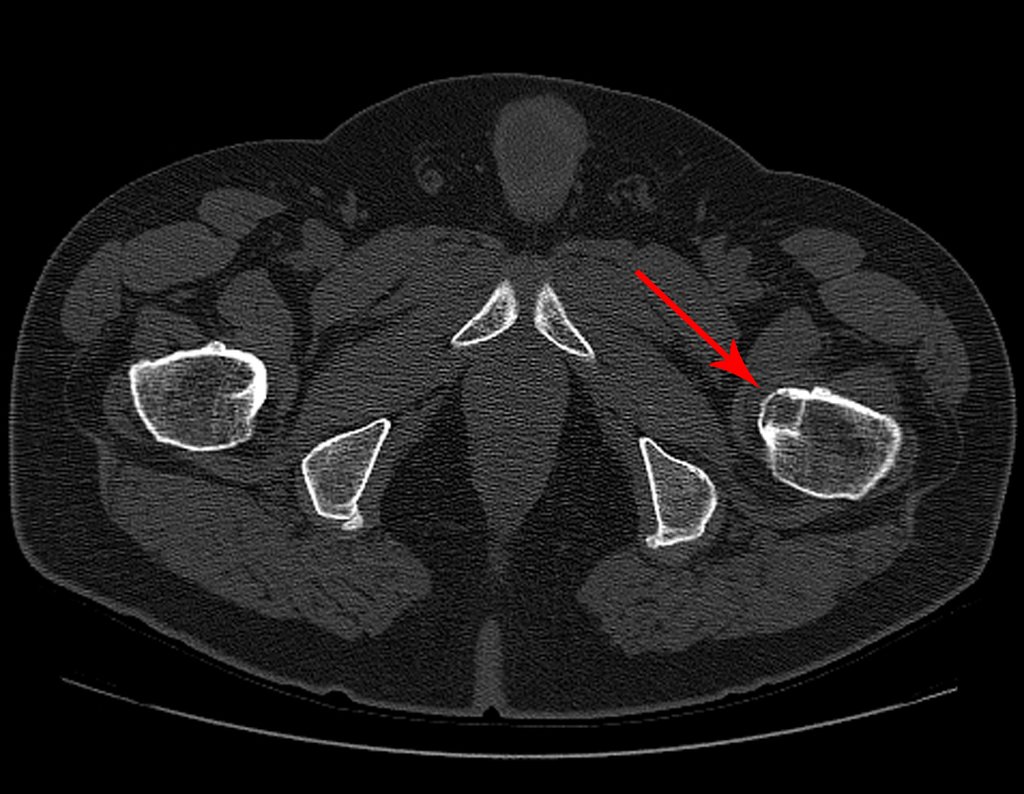
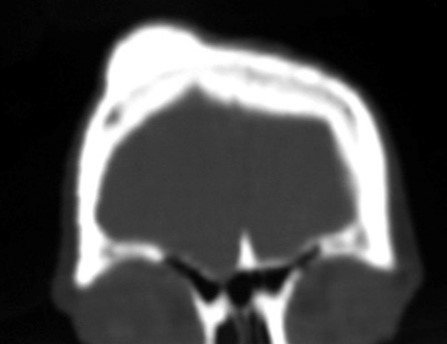
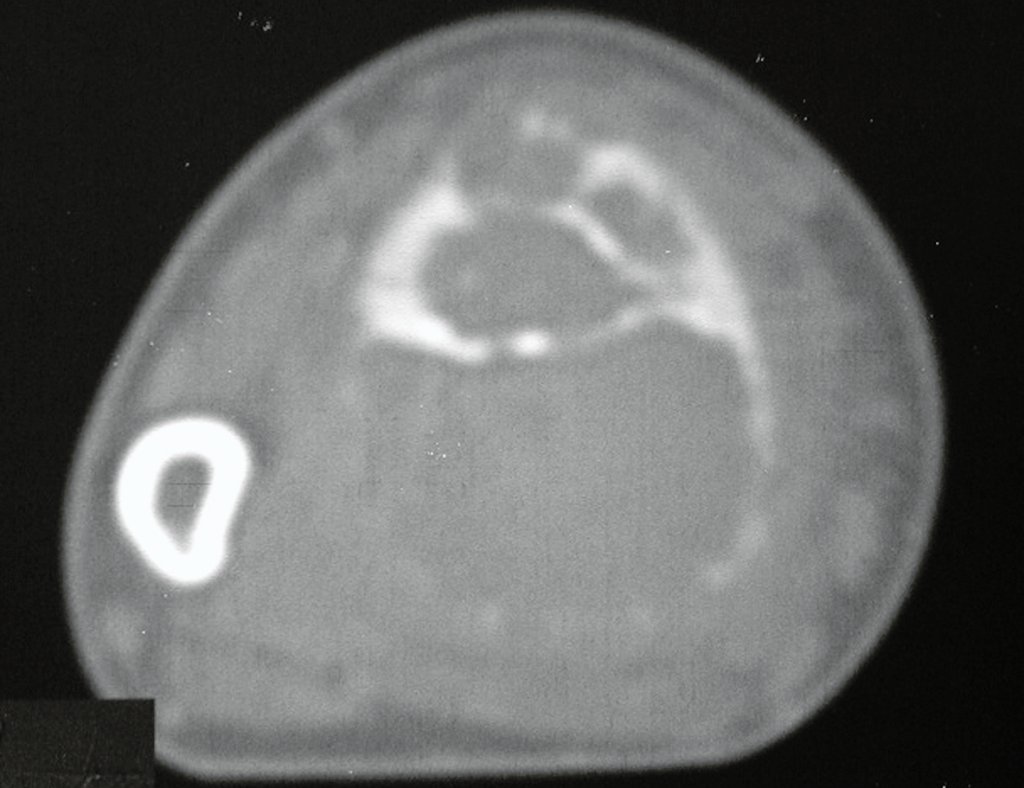
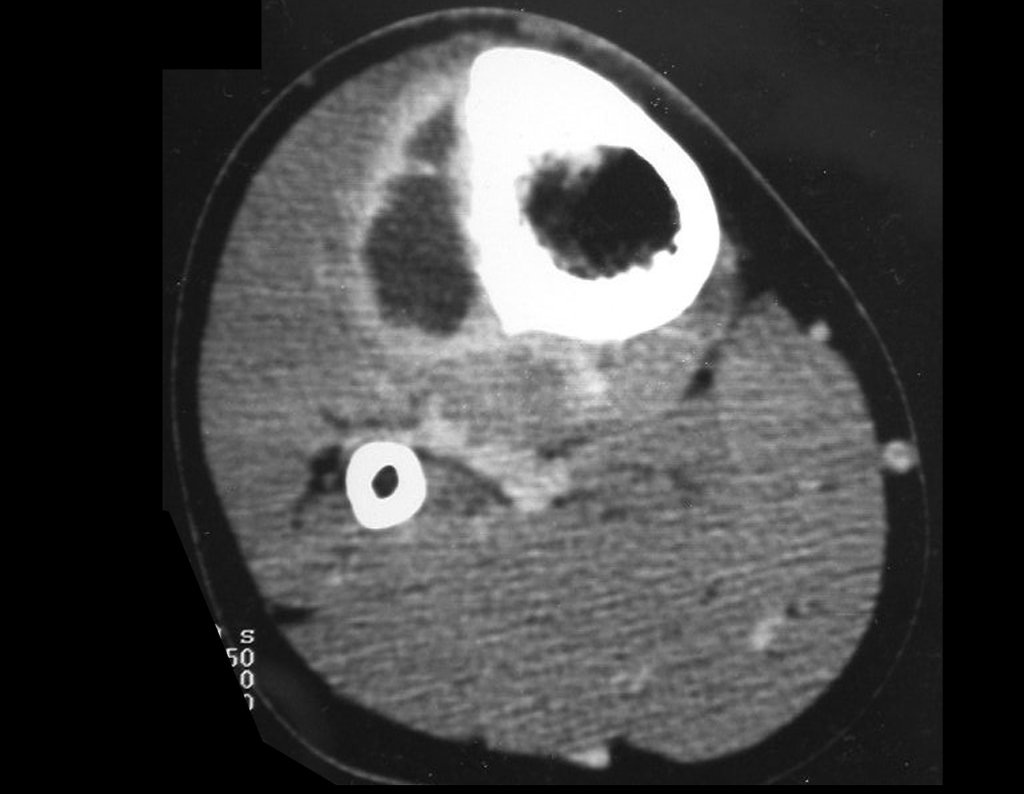
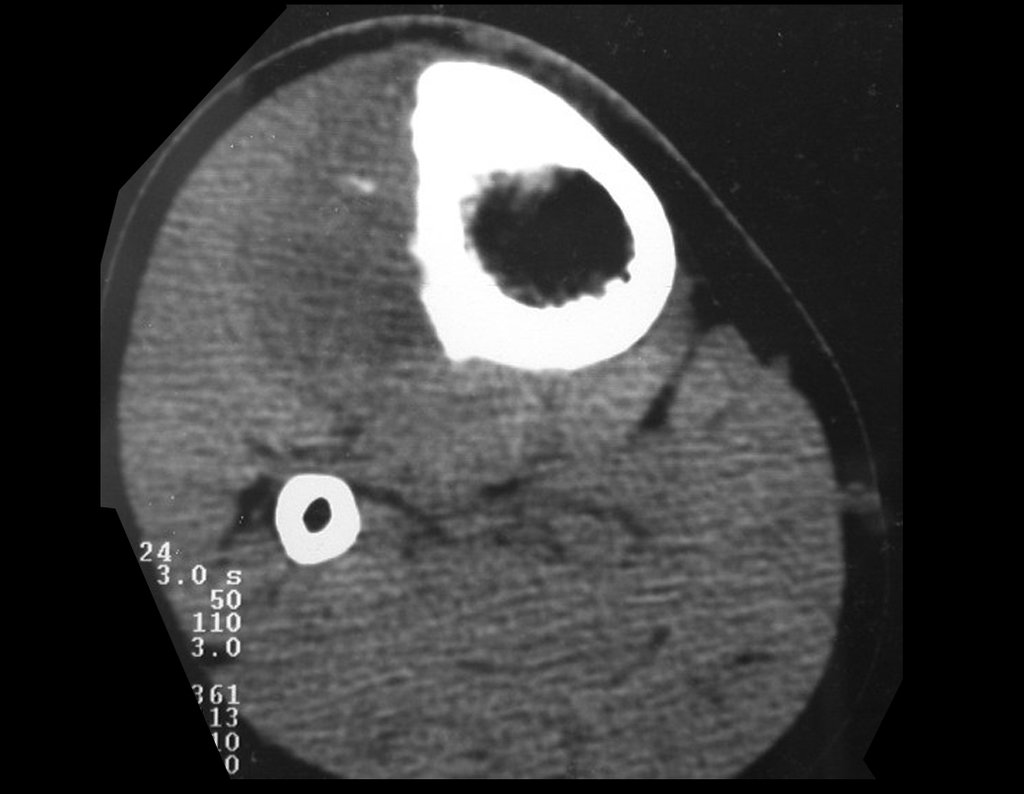
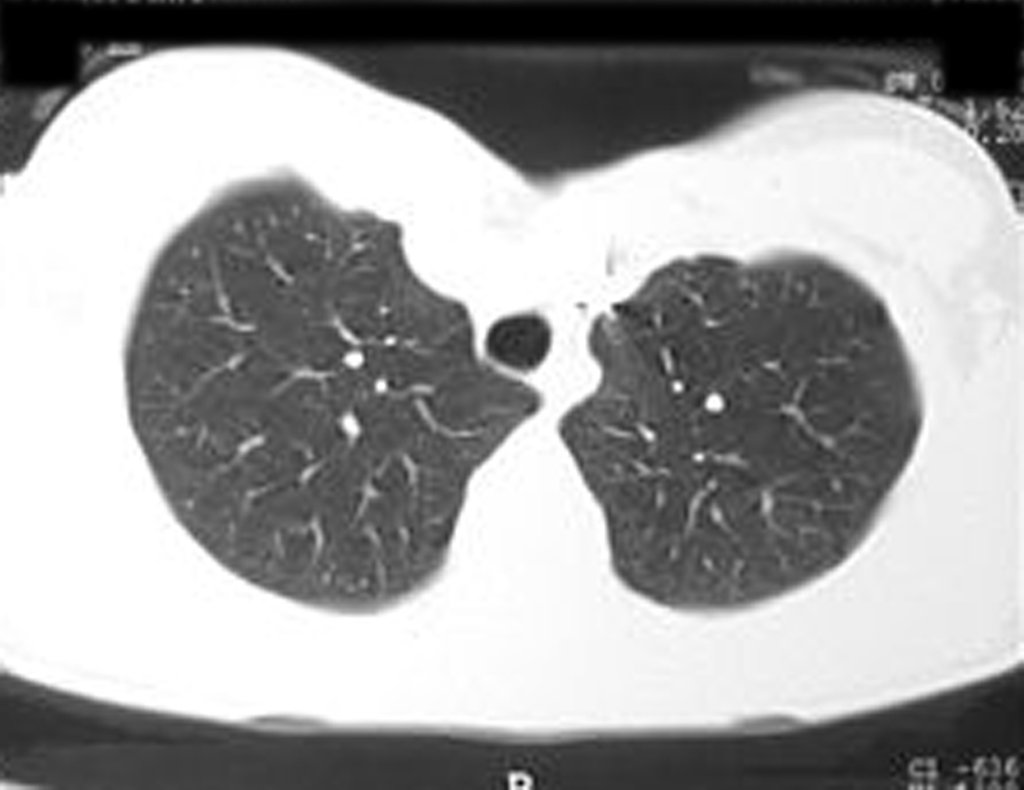
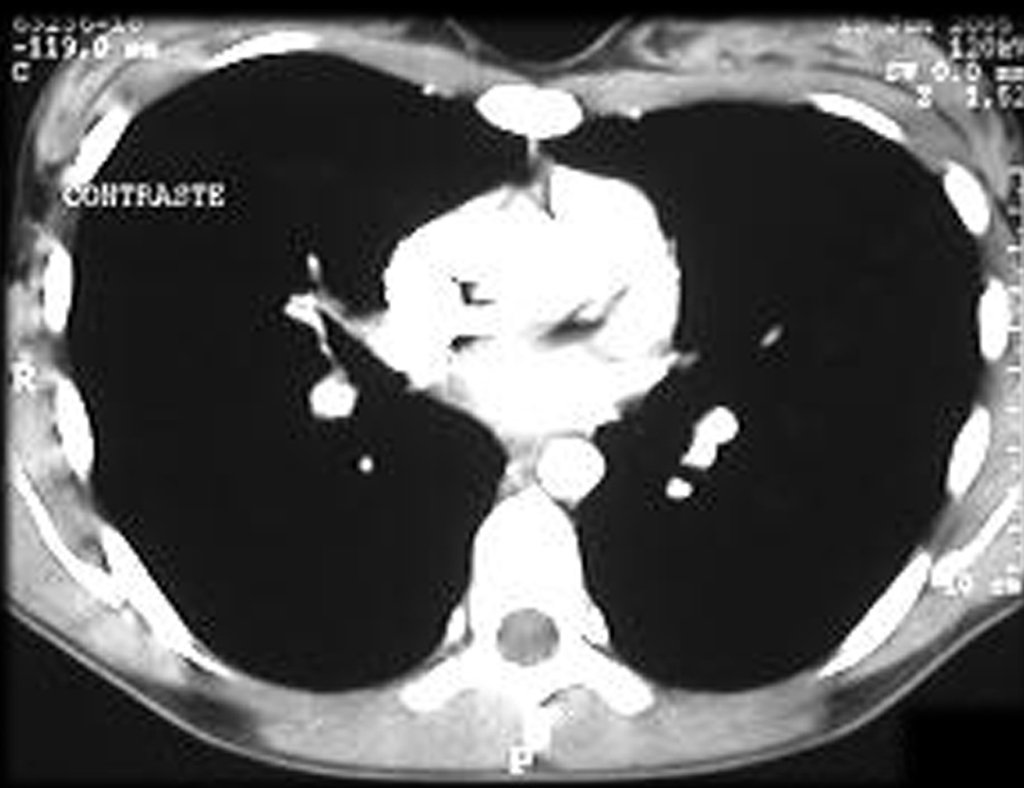
Para ampliar o estudo da lesão, foi realizado exame de Pet-Ct, figuras 5 a 8.
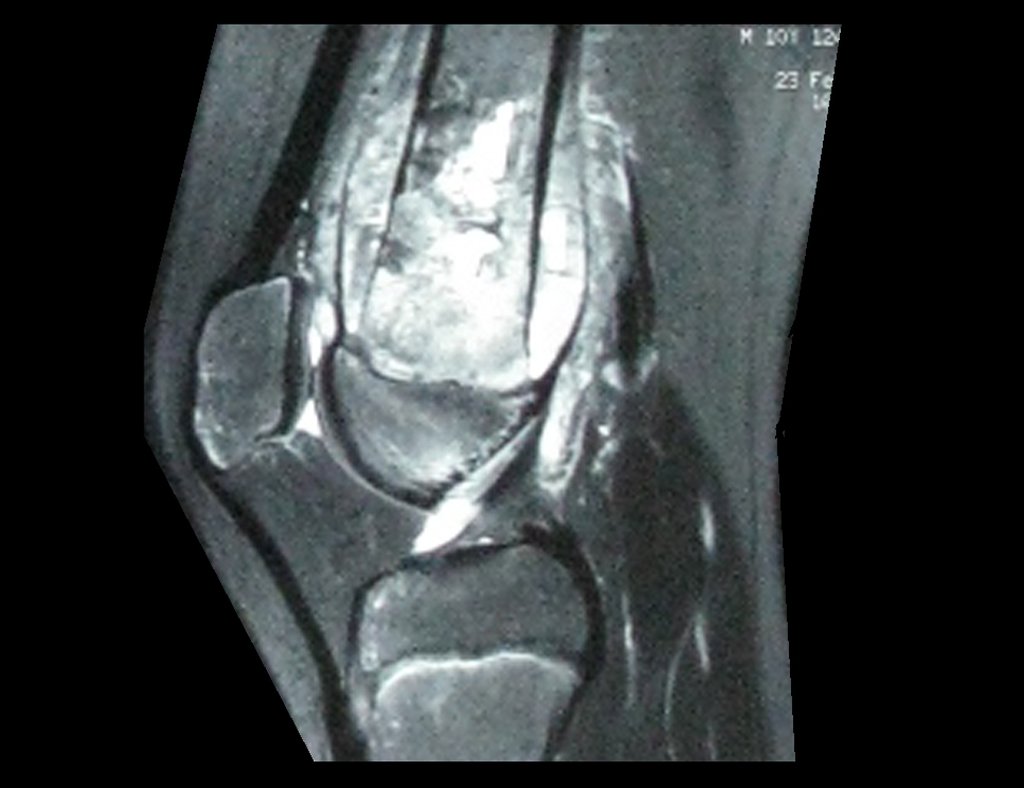
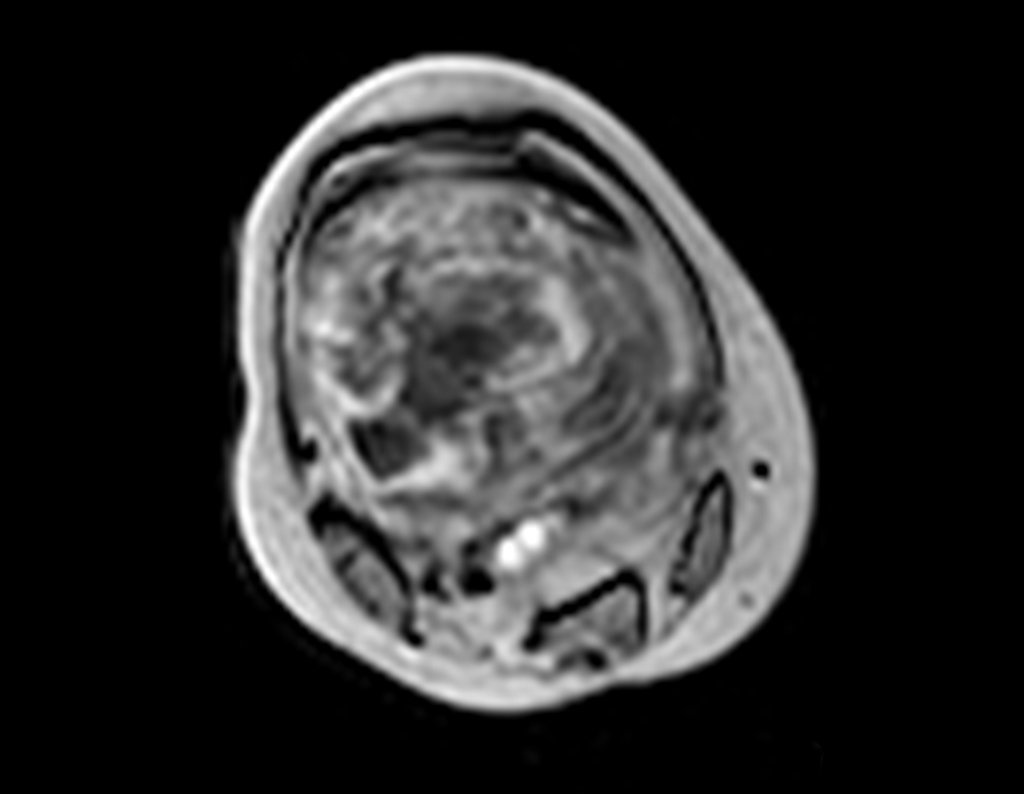
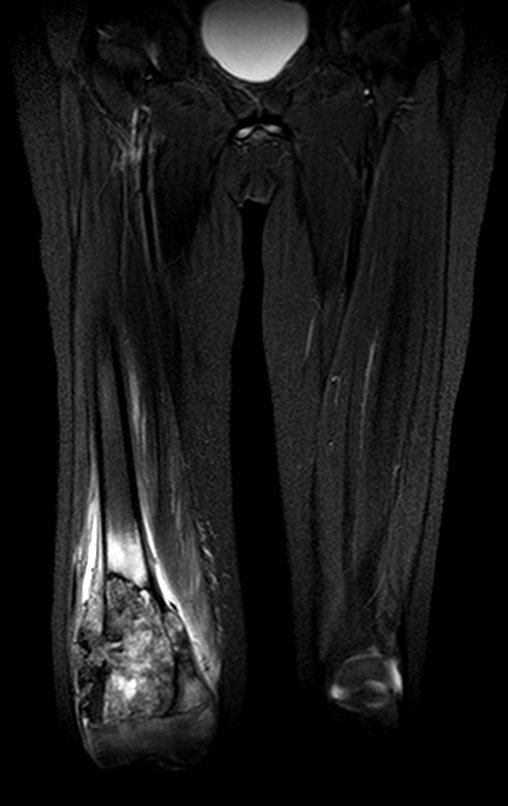
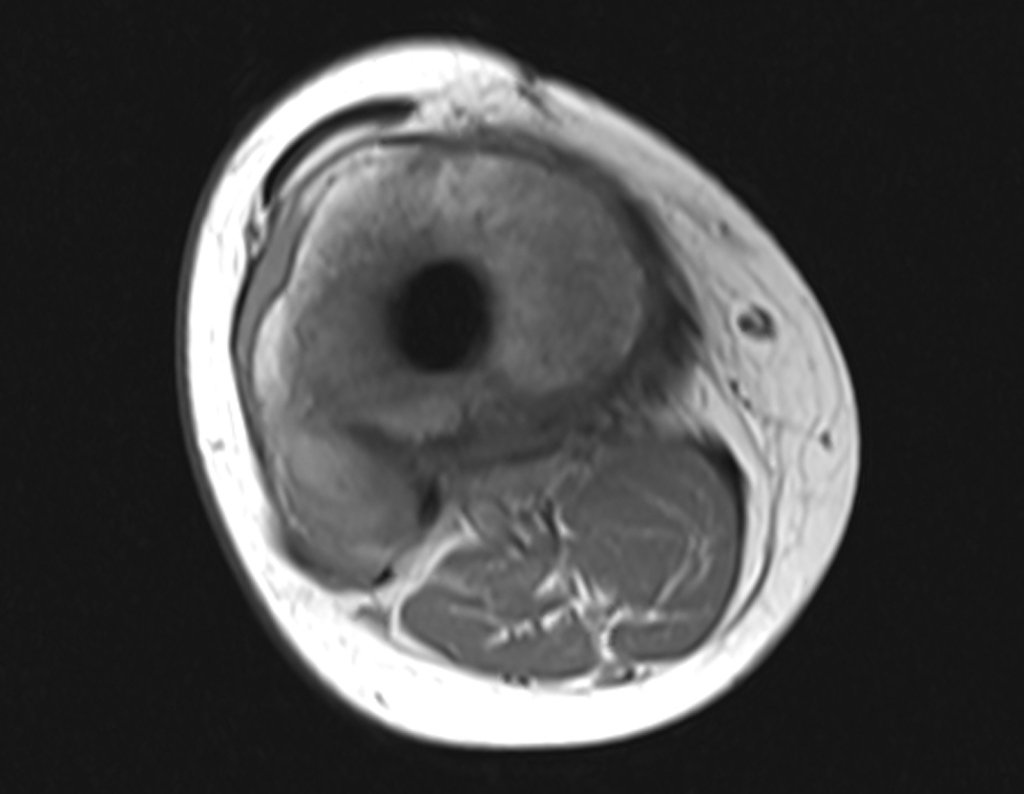
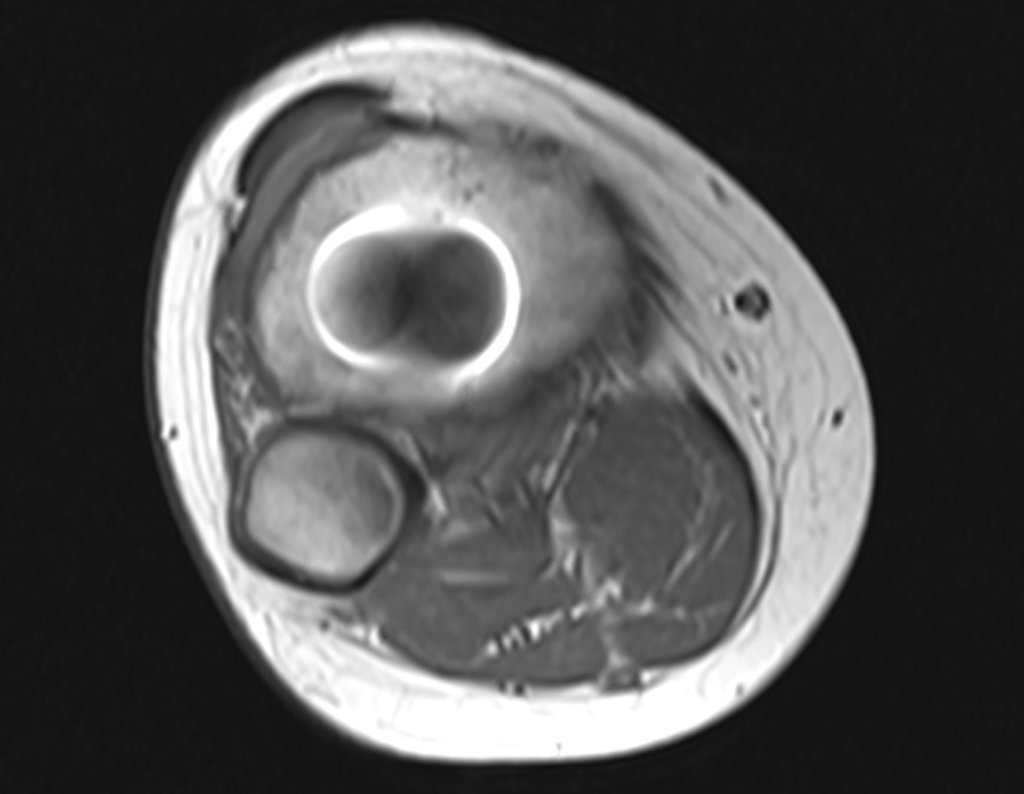
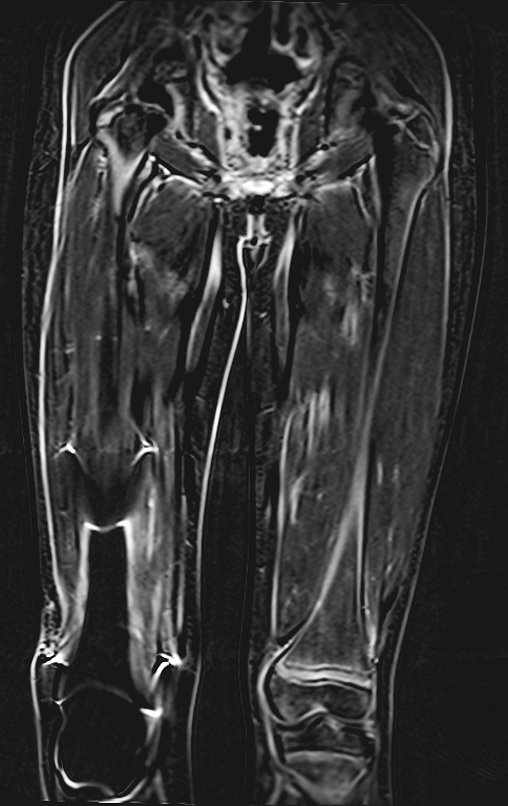
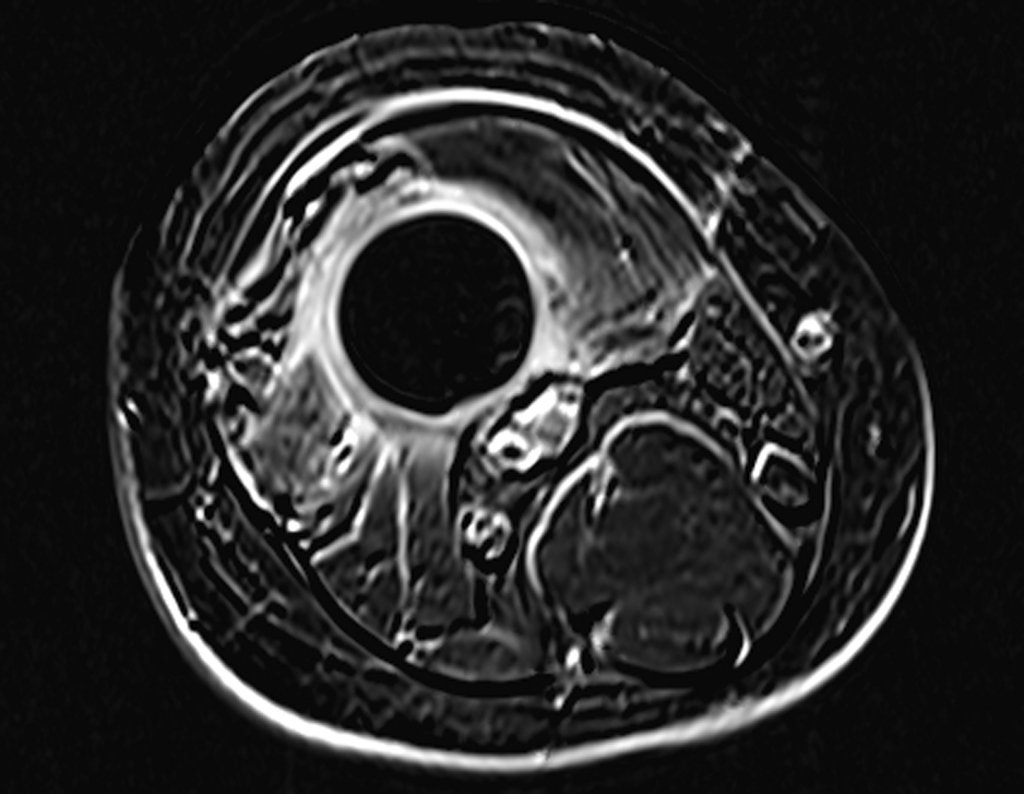
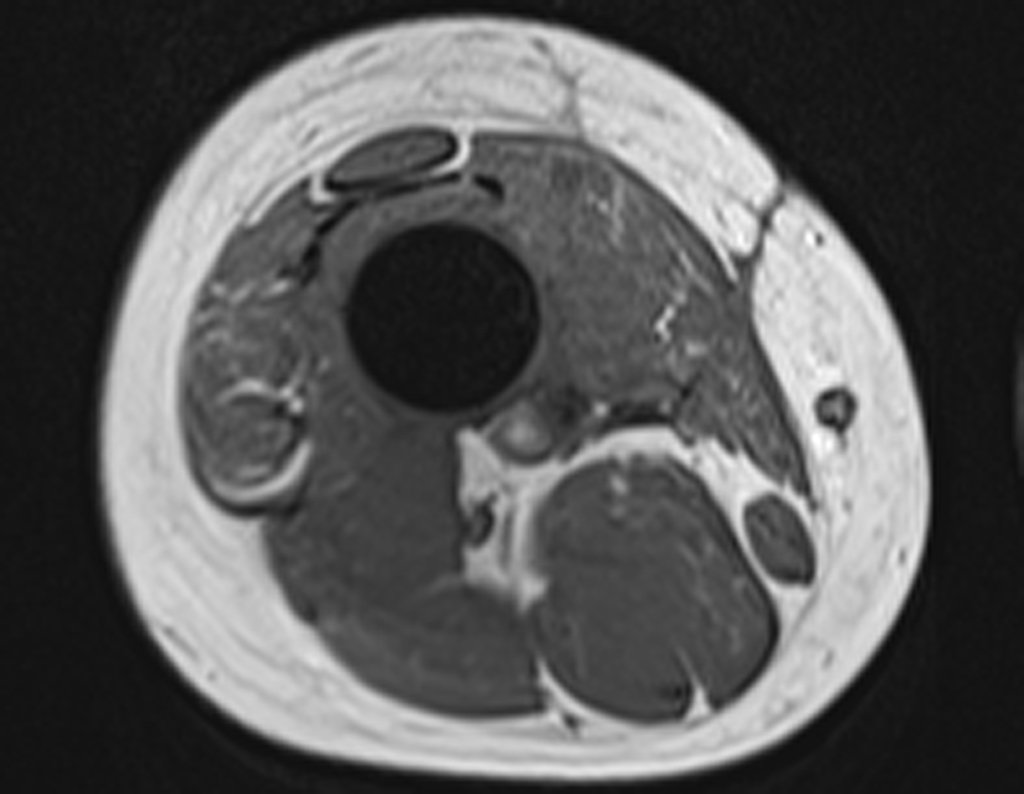
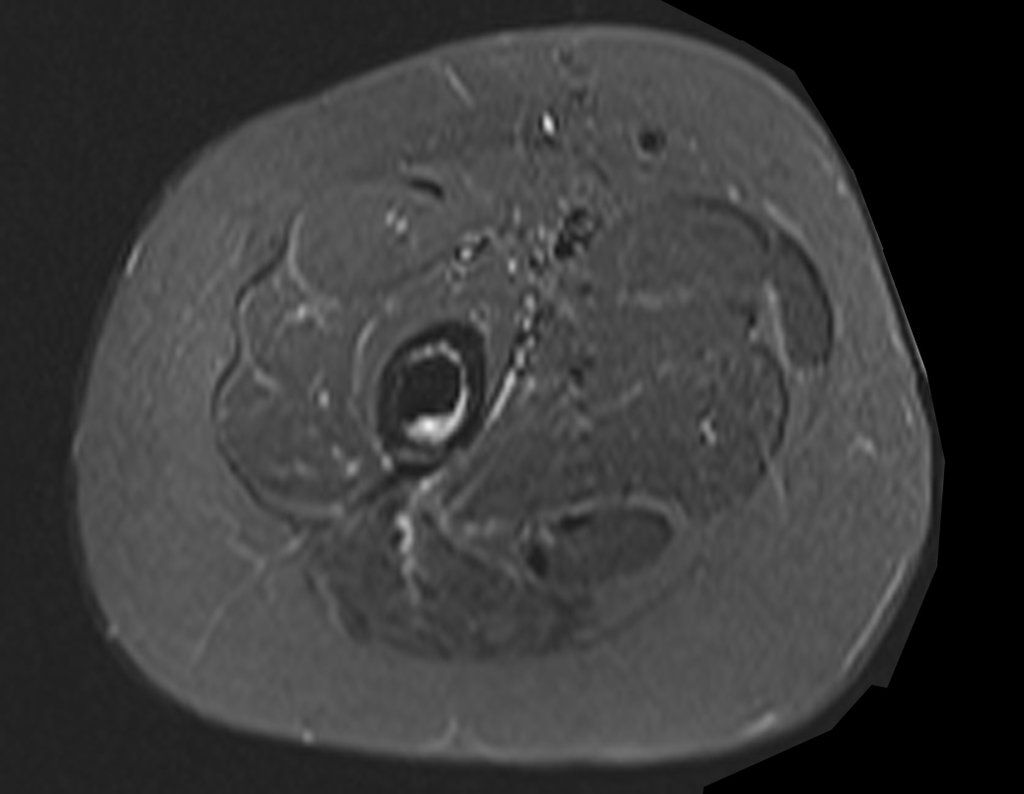
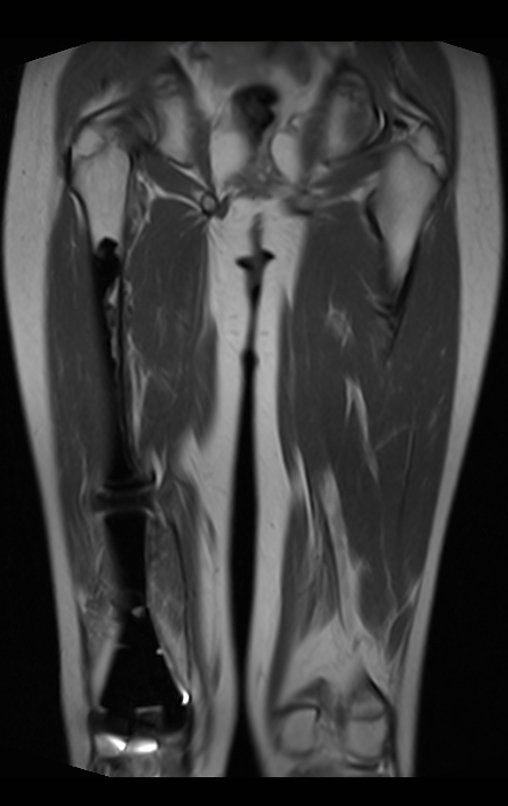
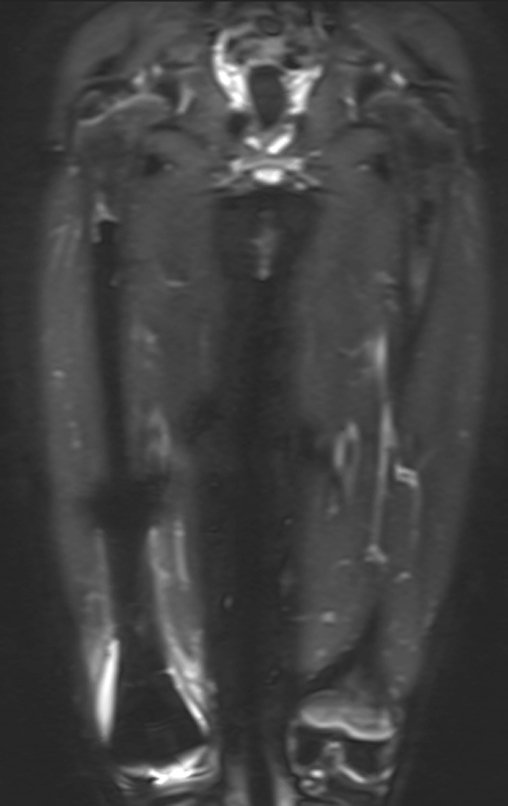
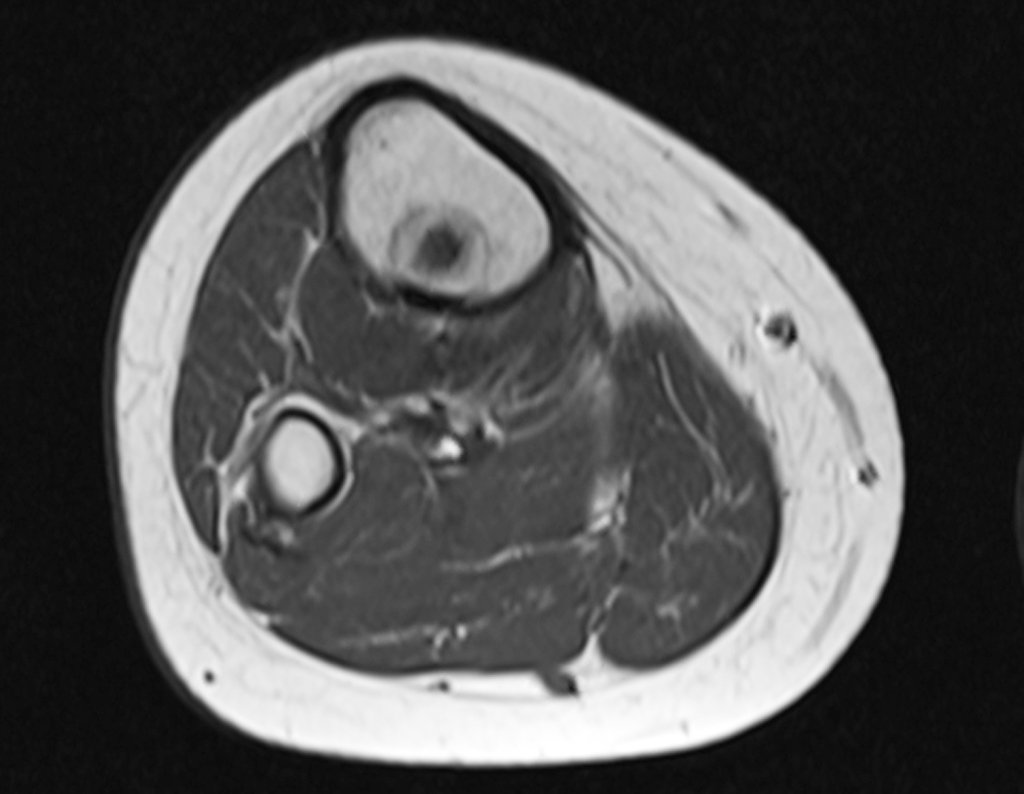
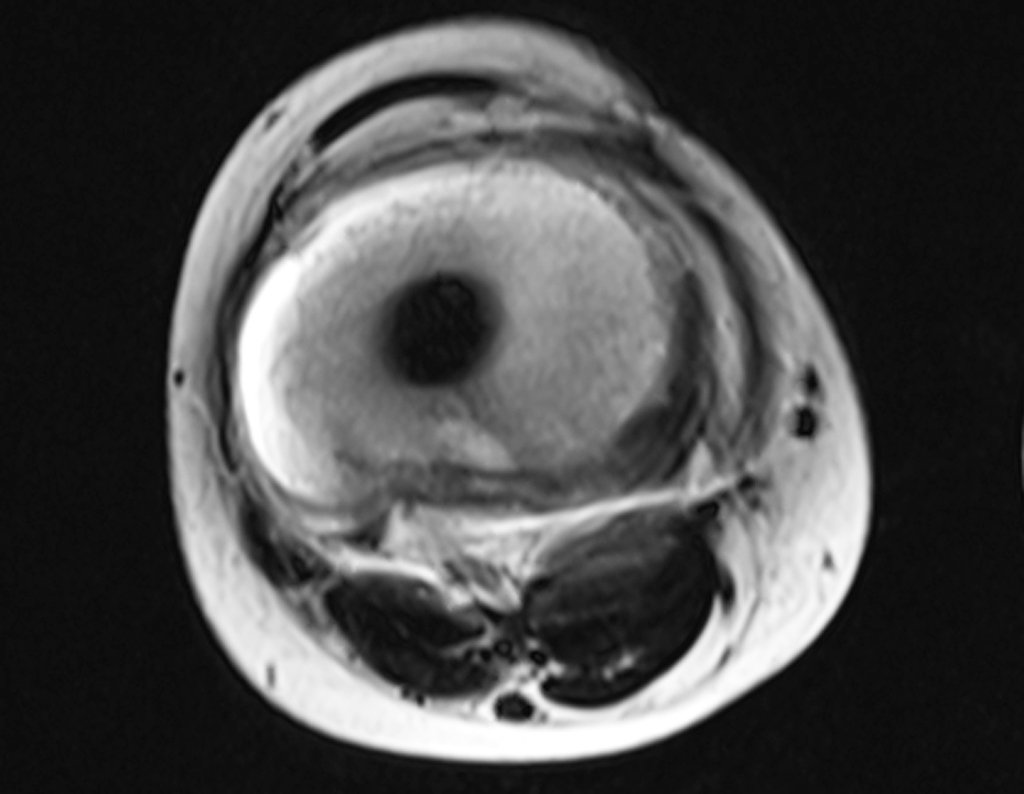
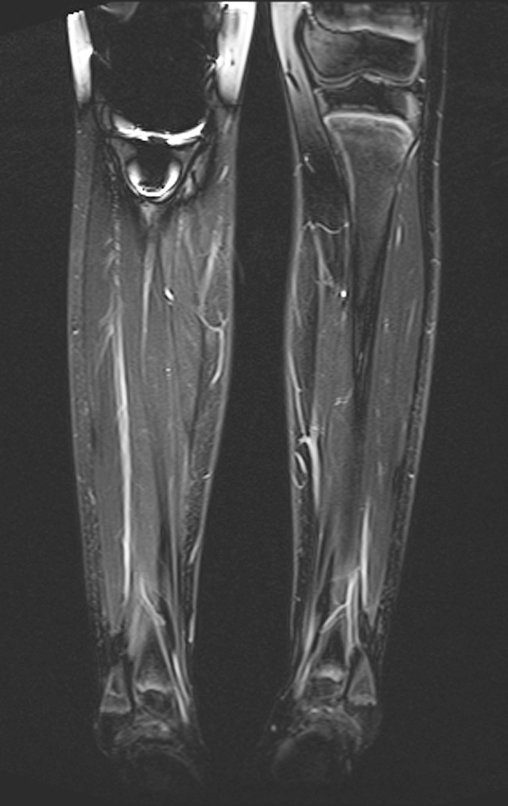
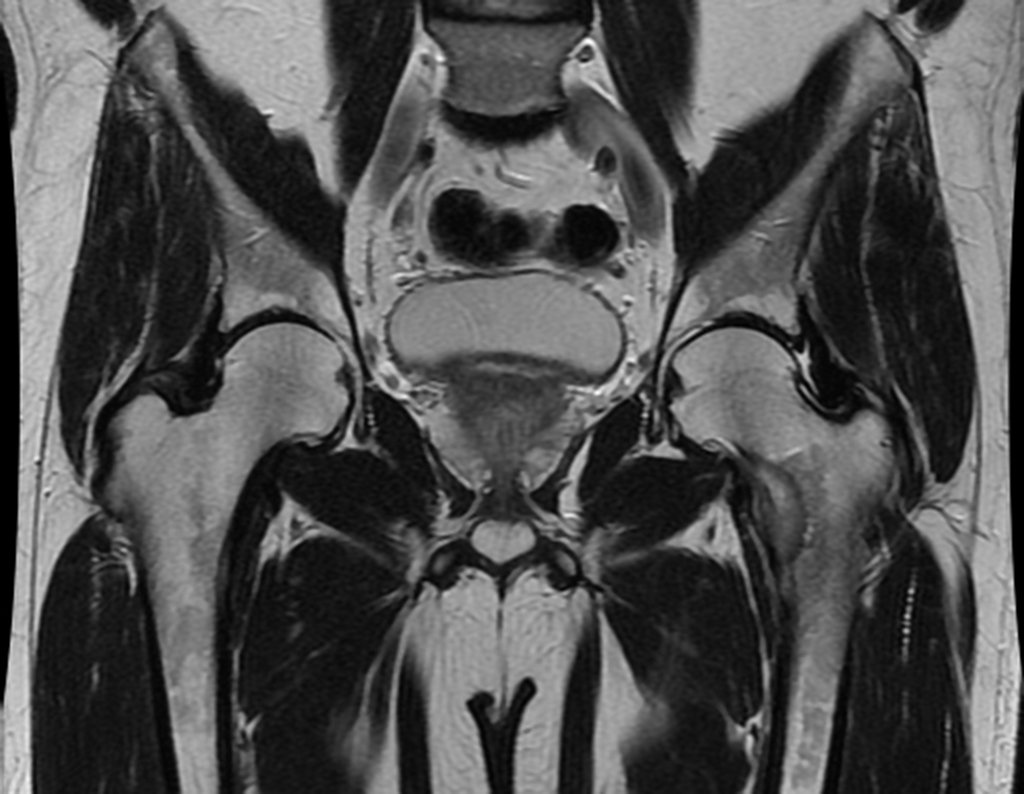
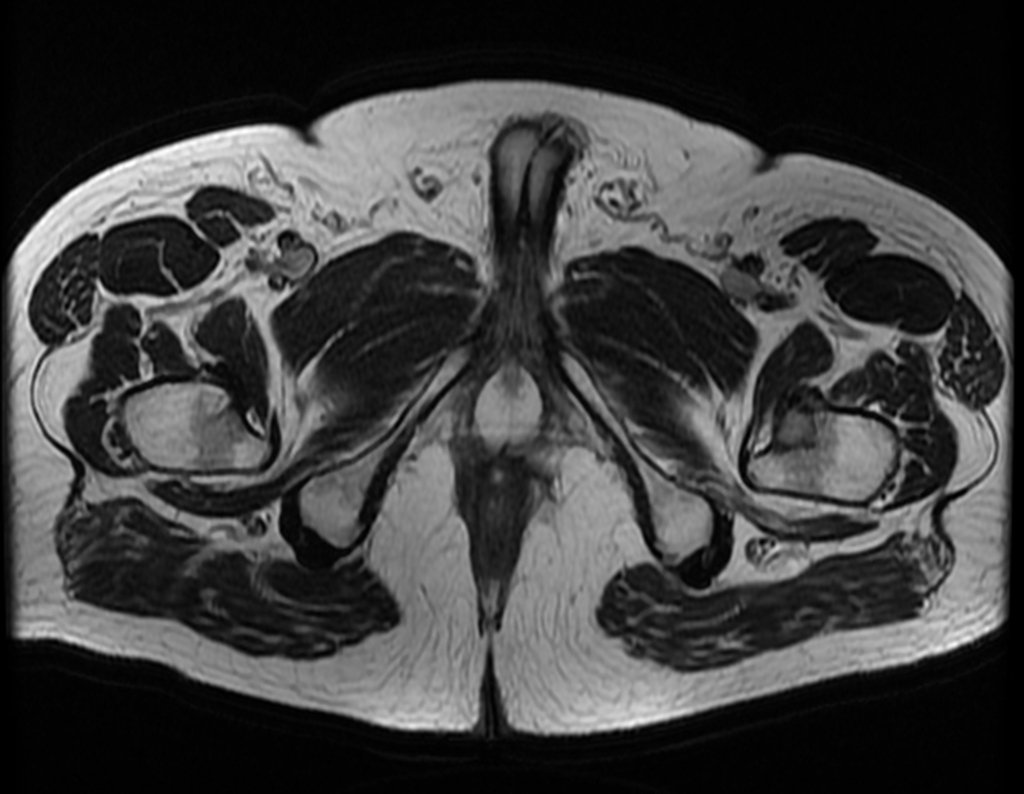
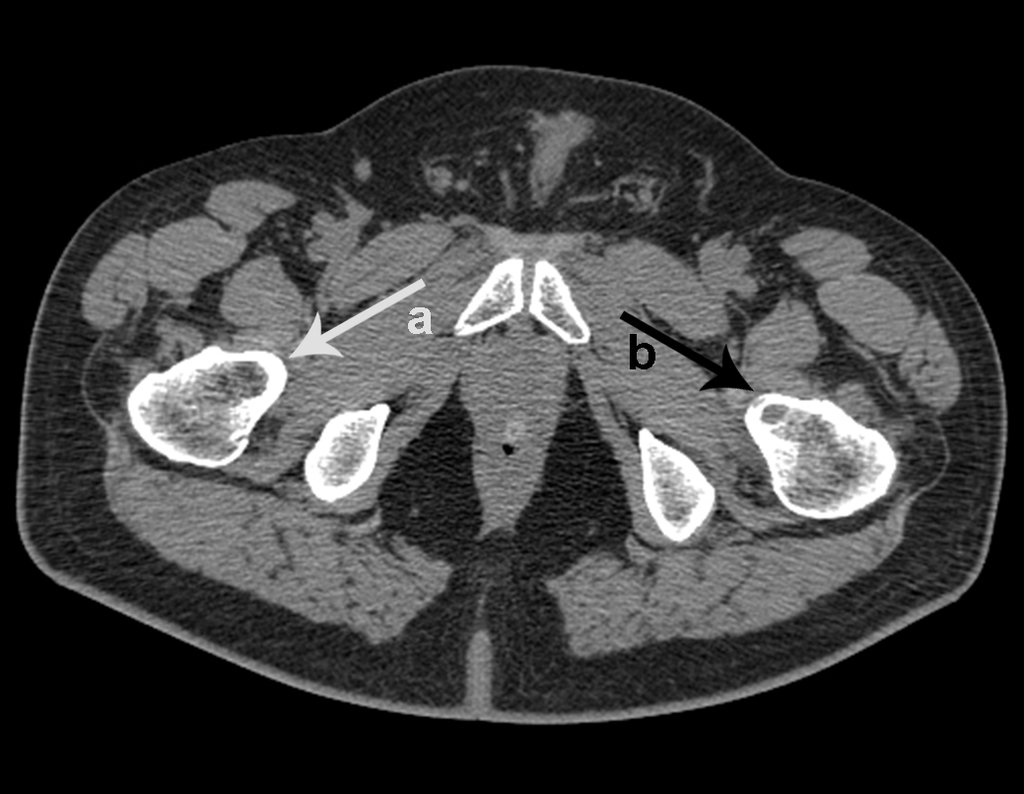
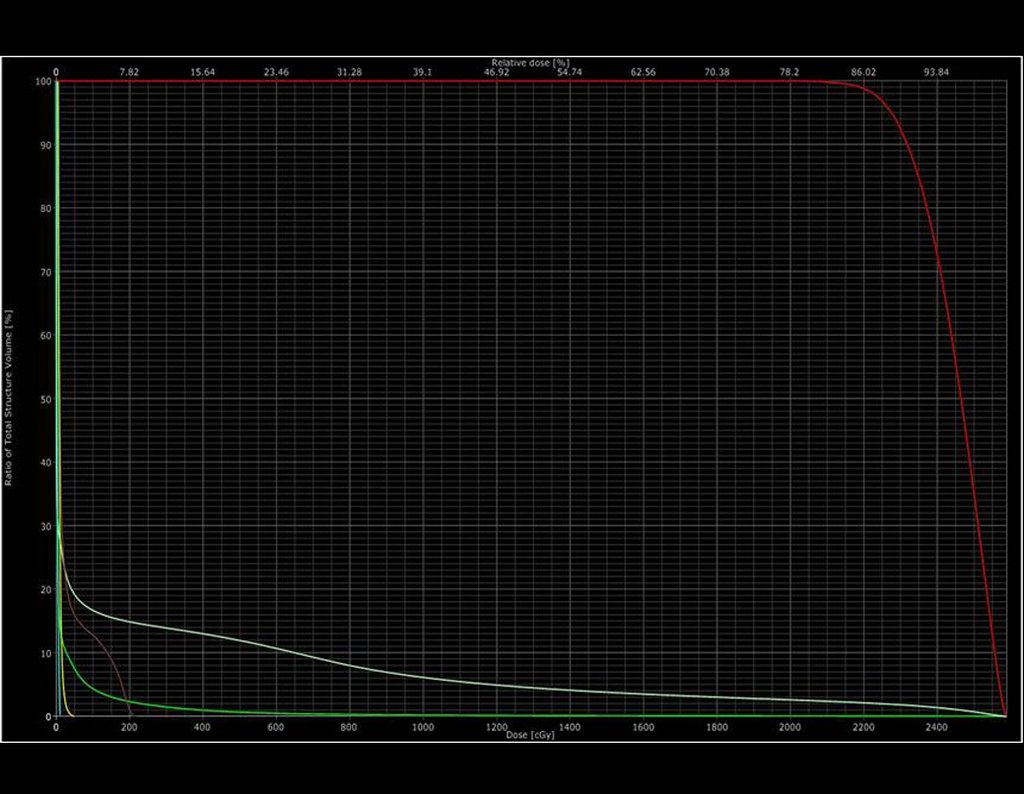
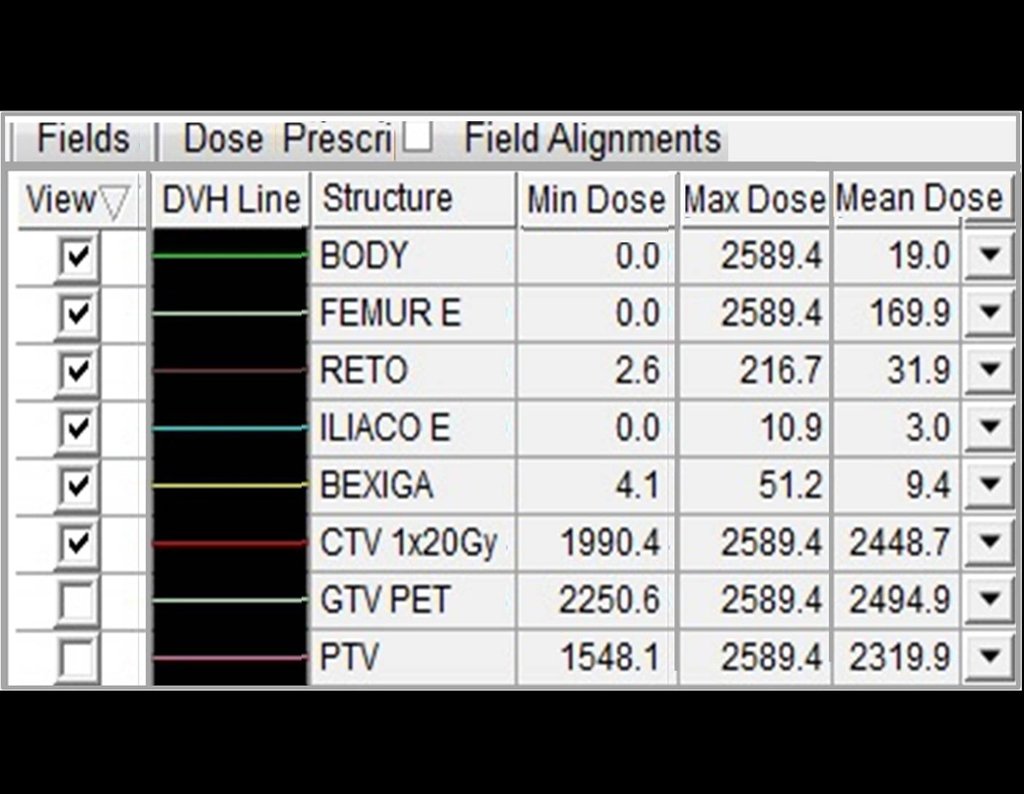
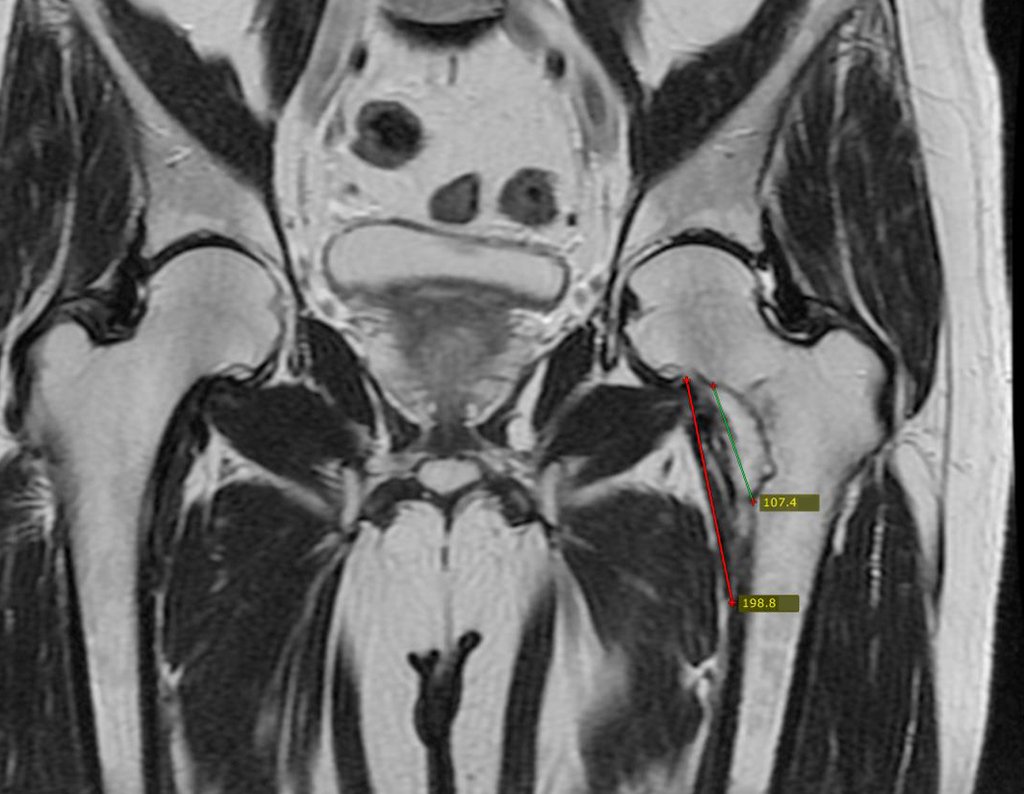
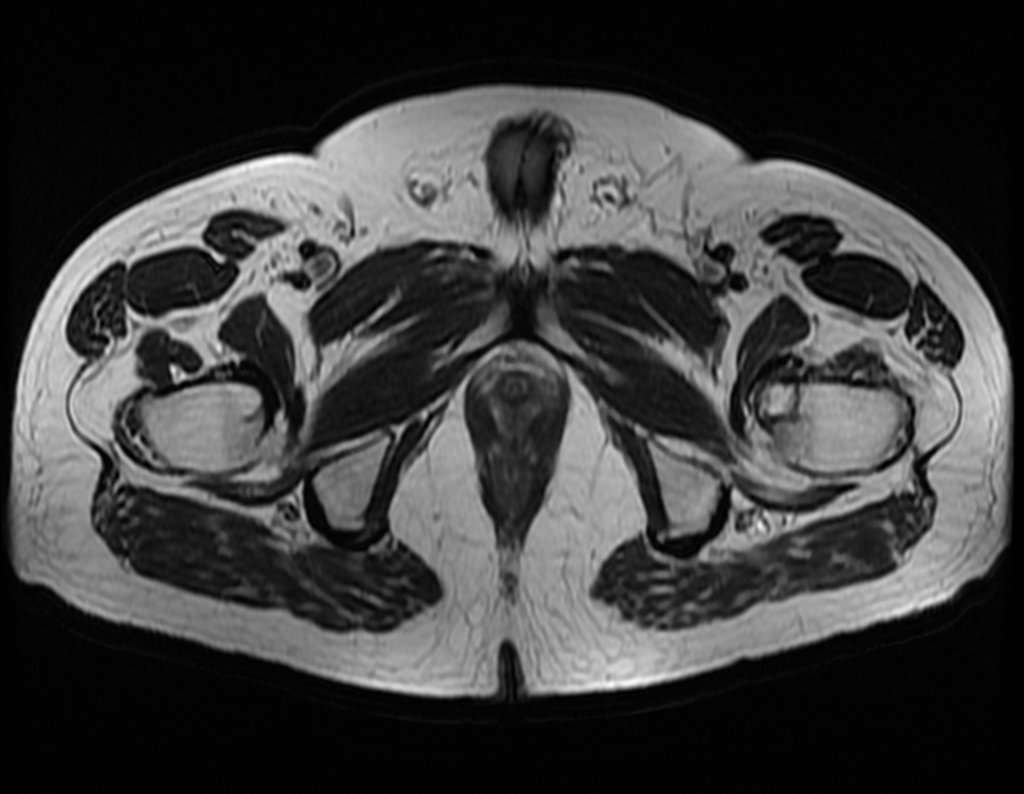
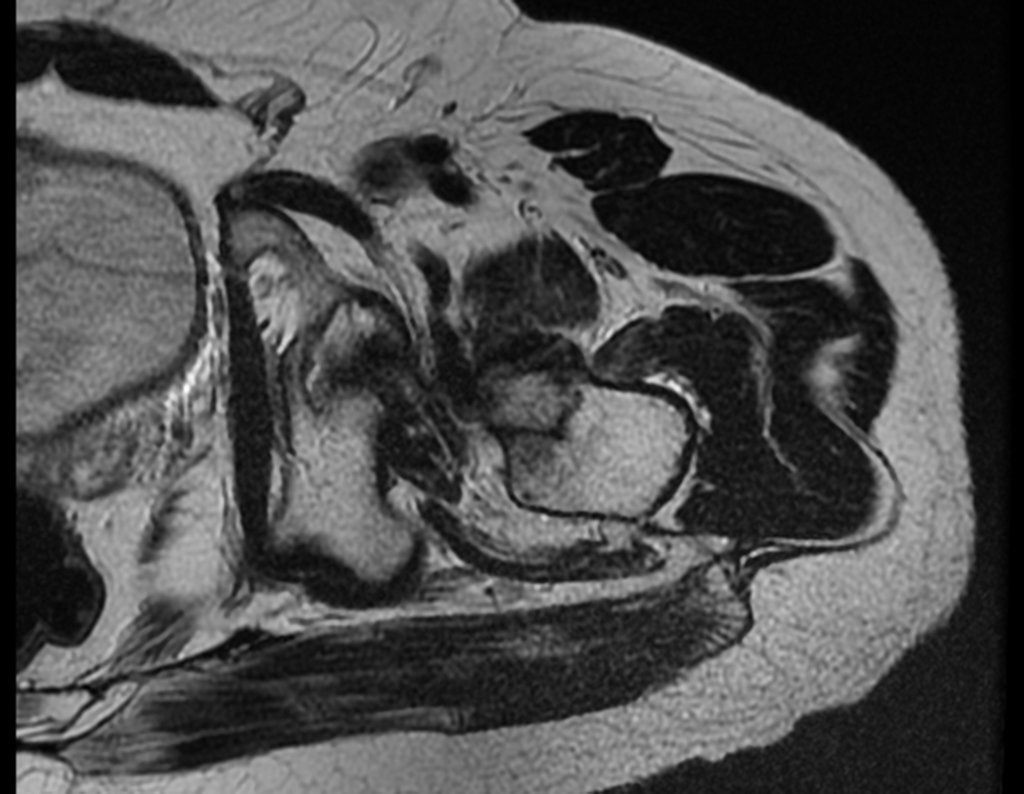
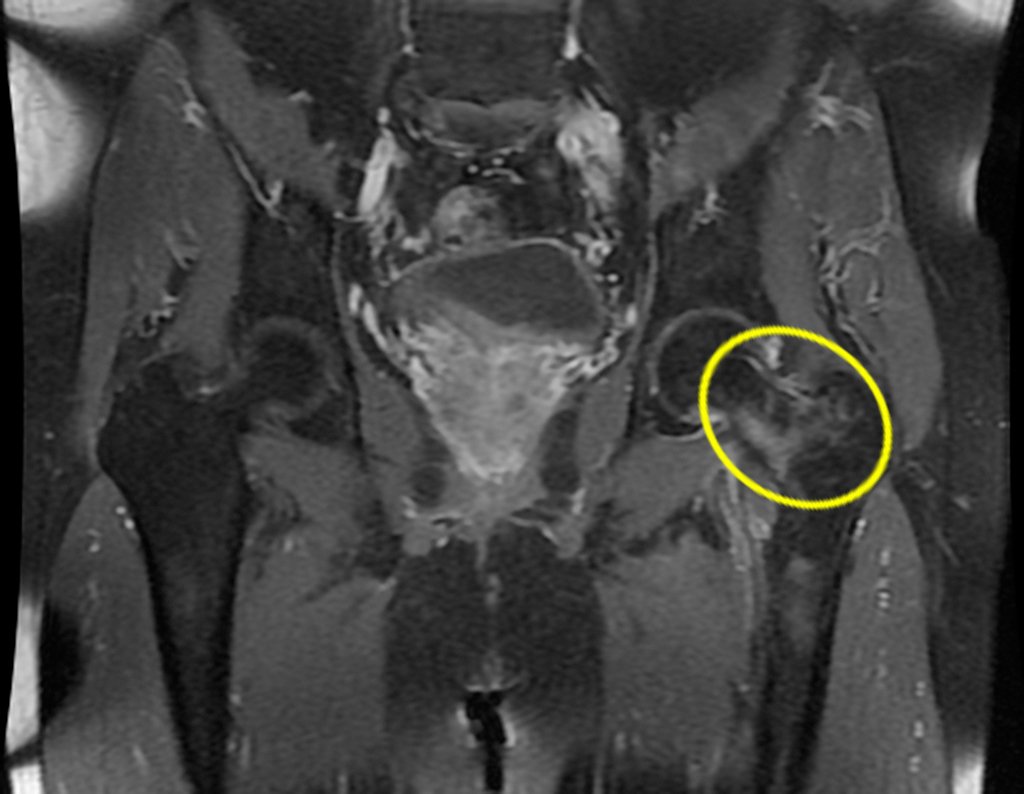
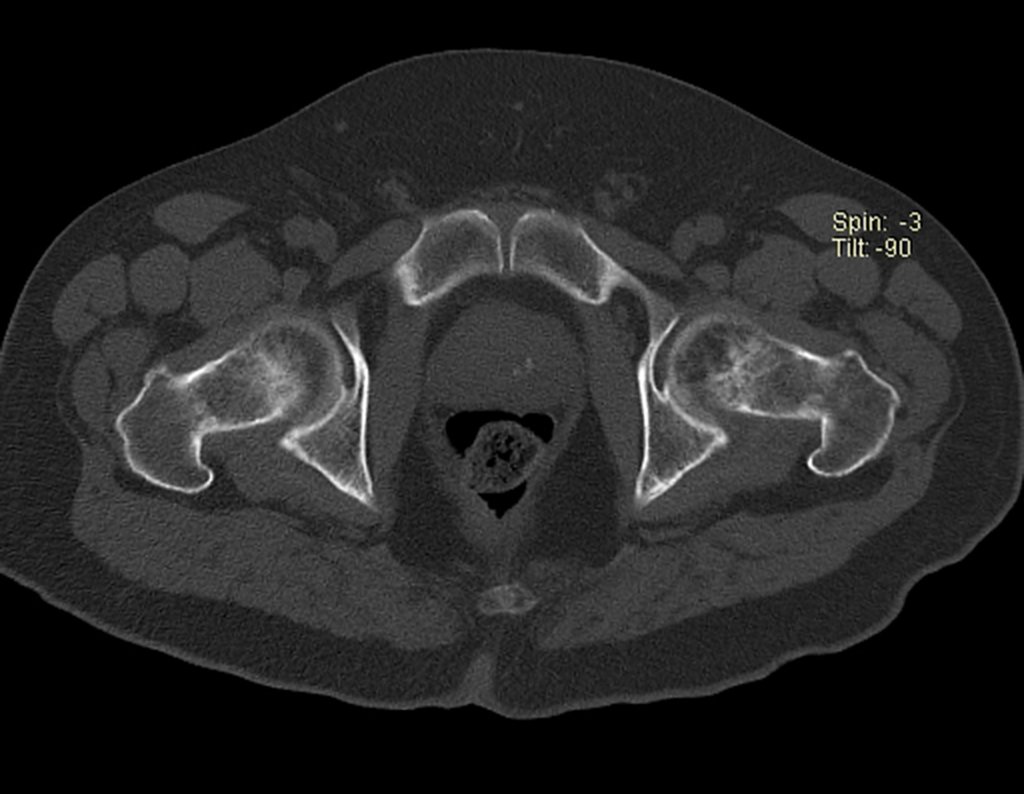
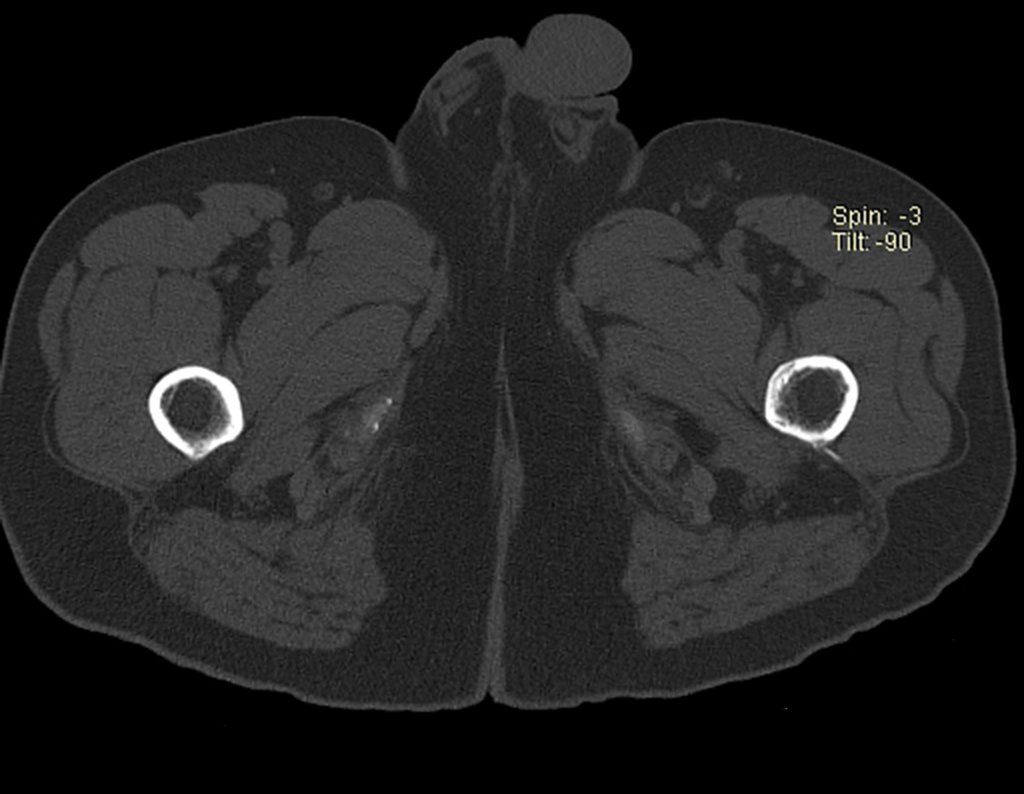
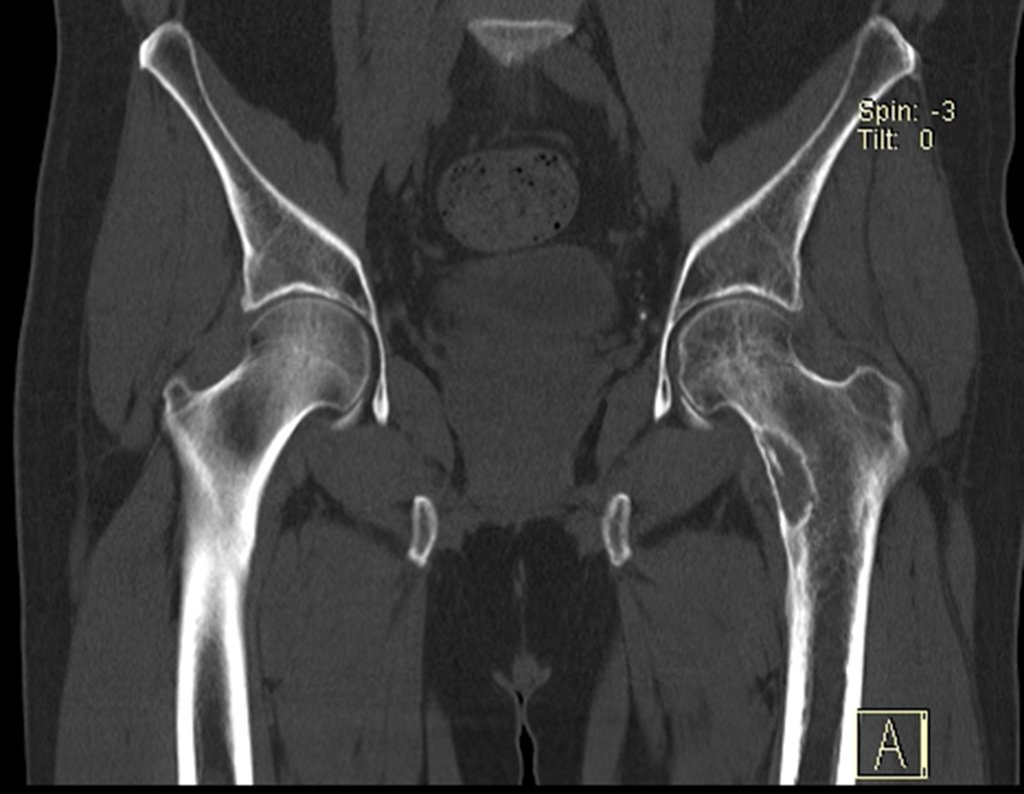
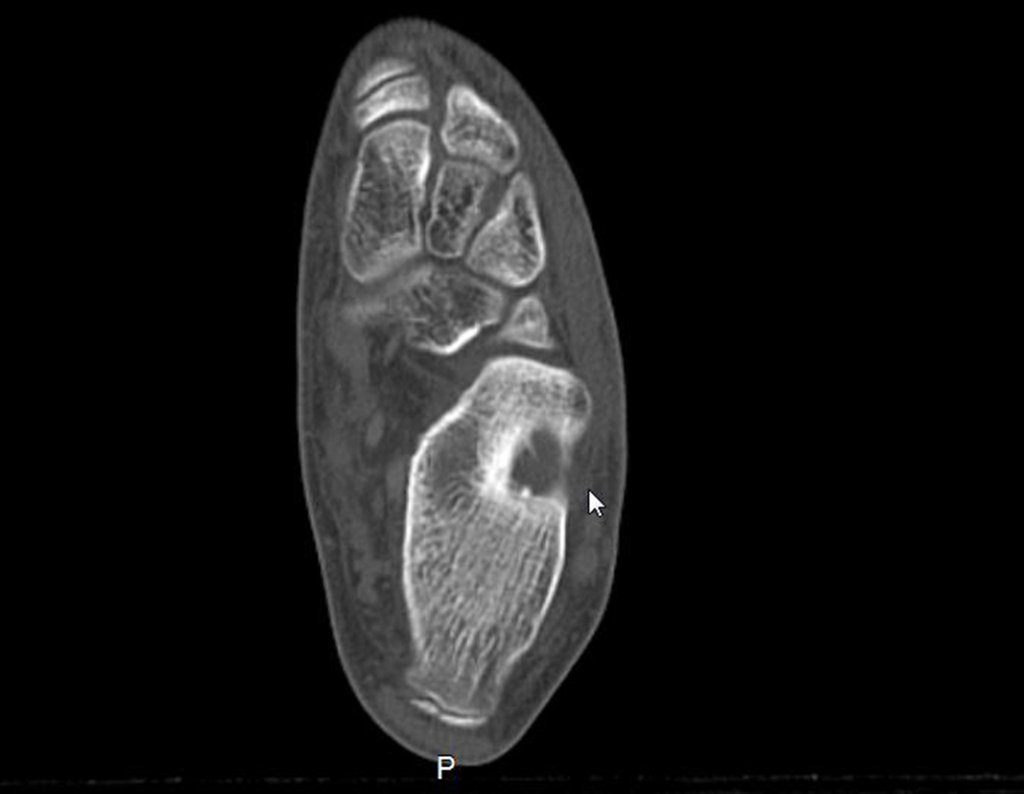
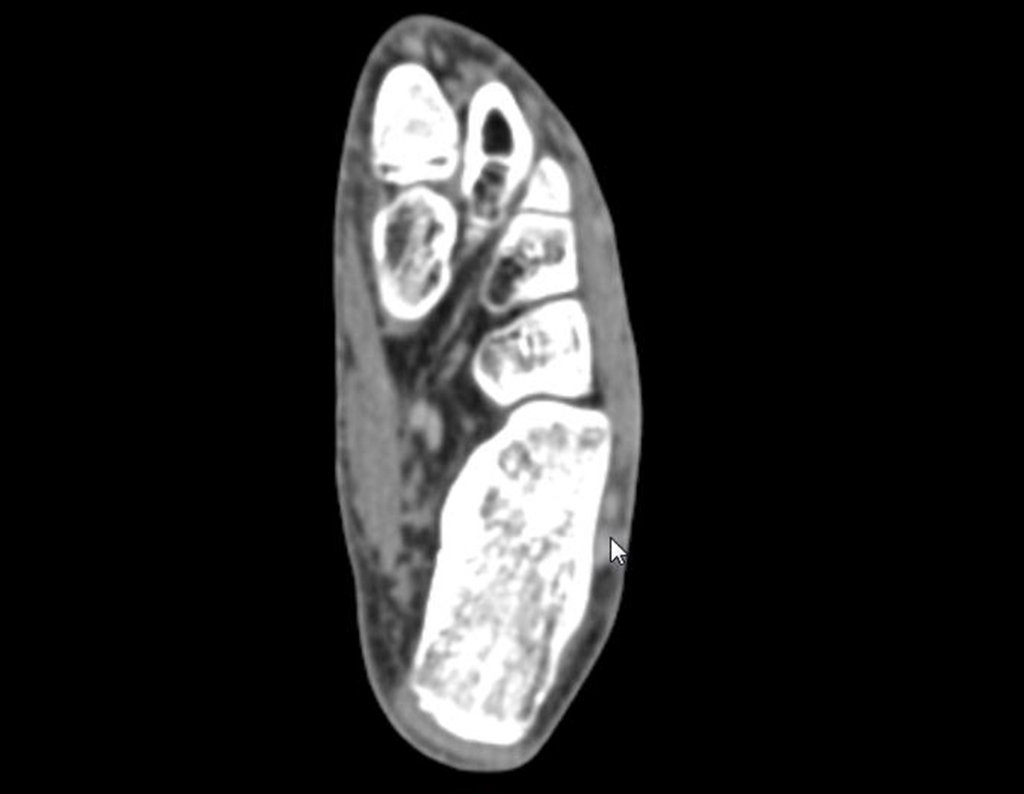
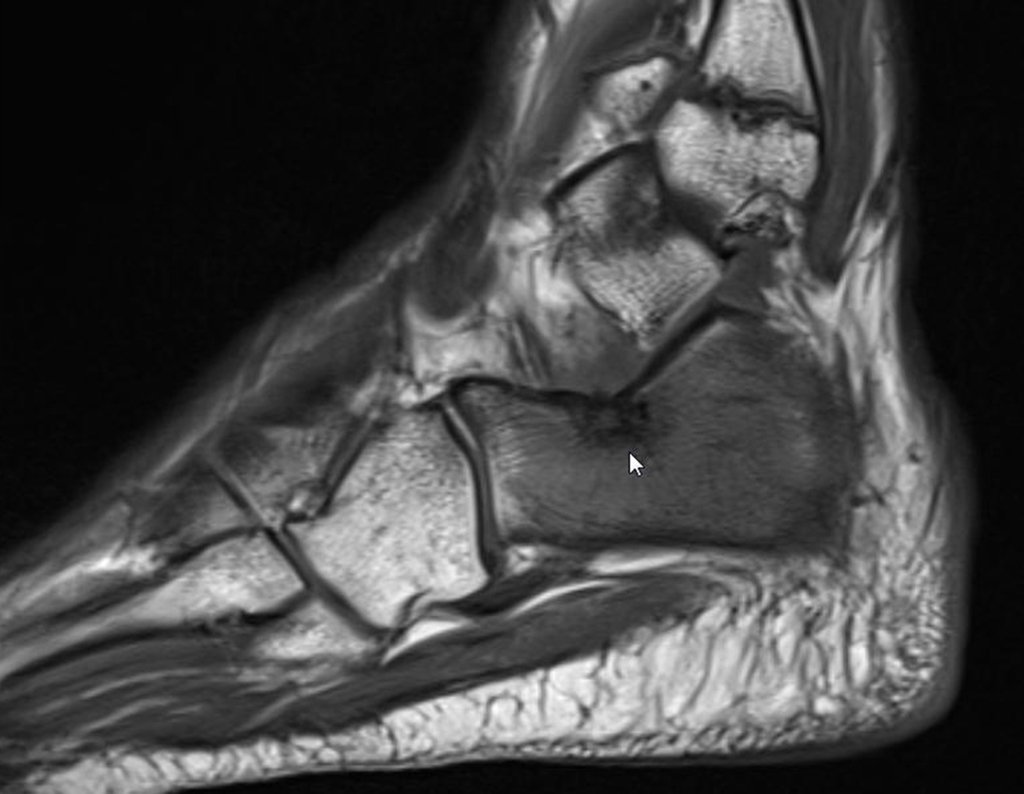
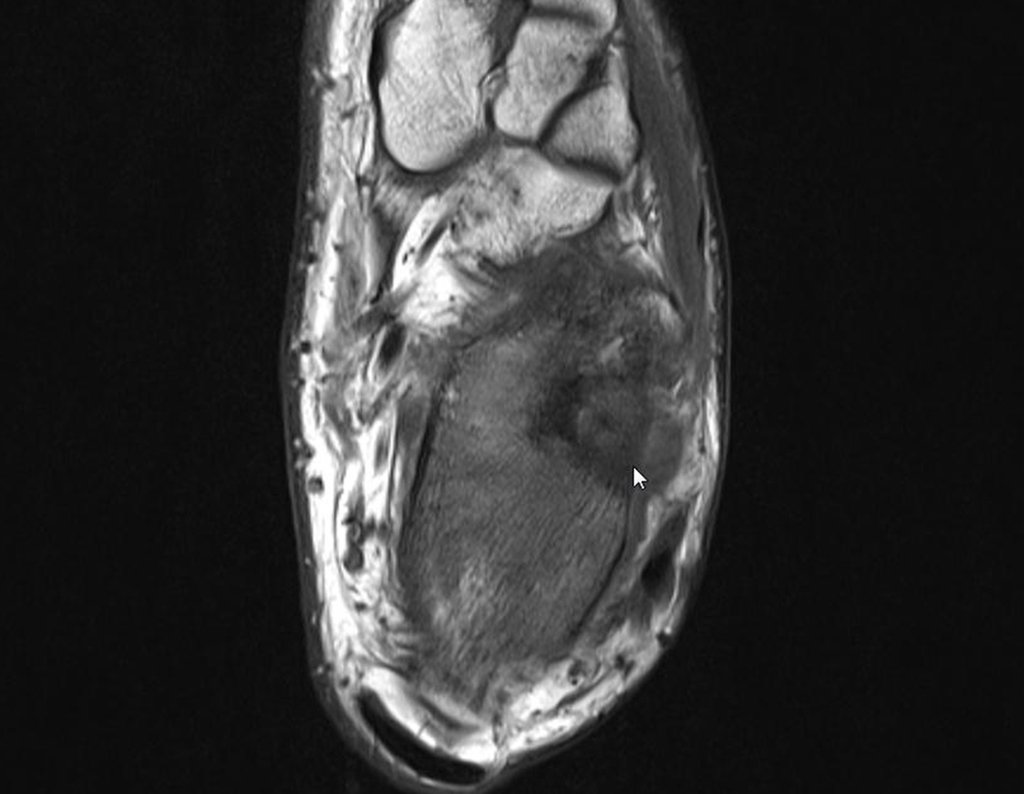
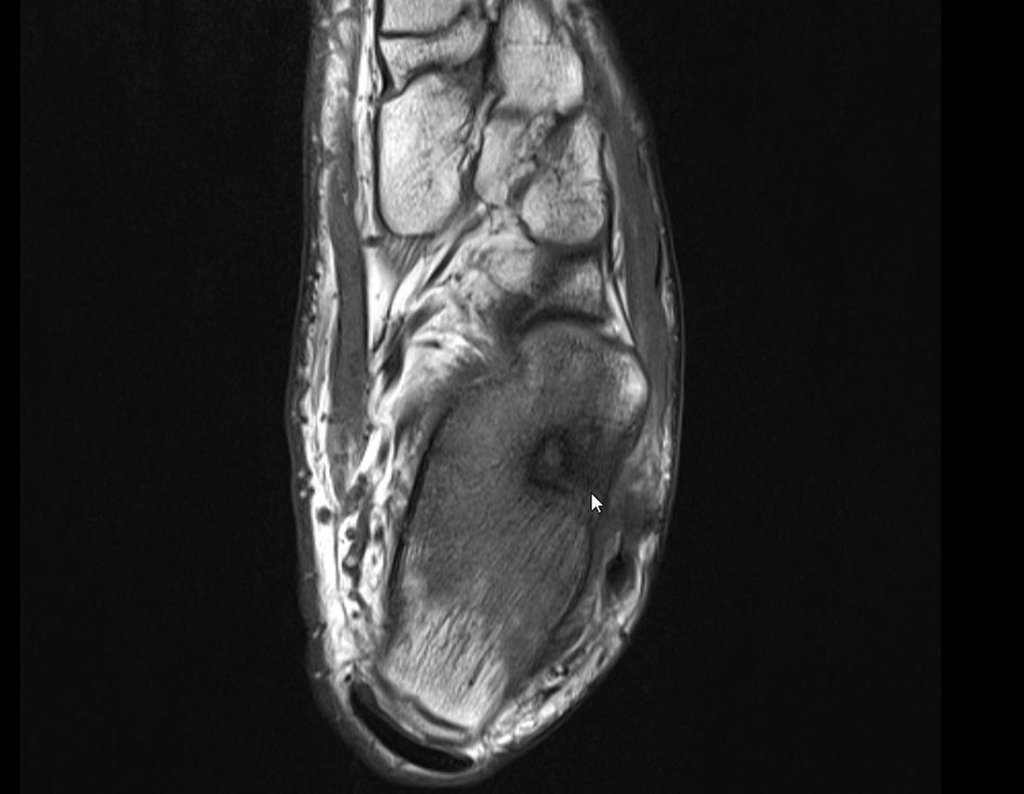
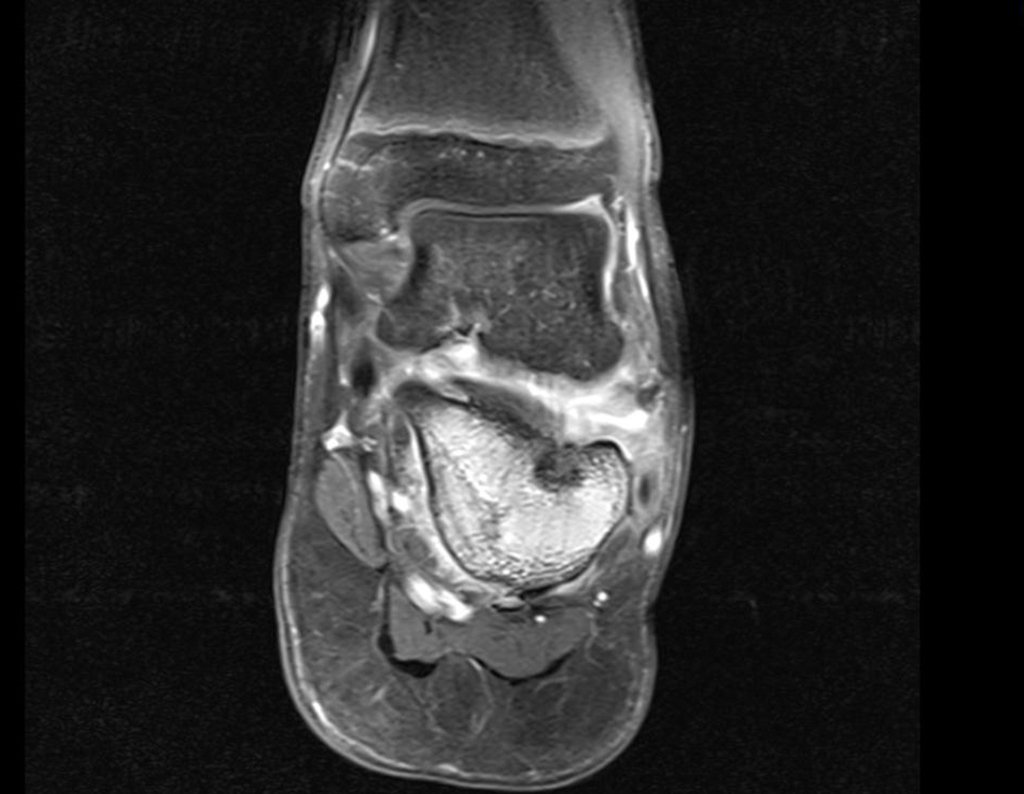
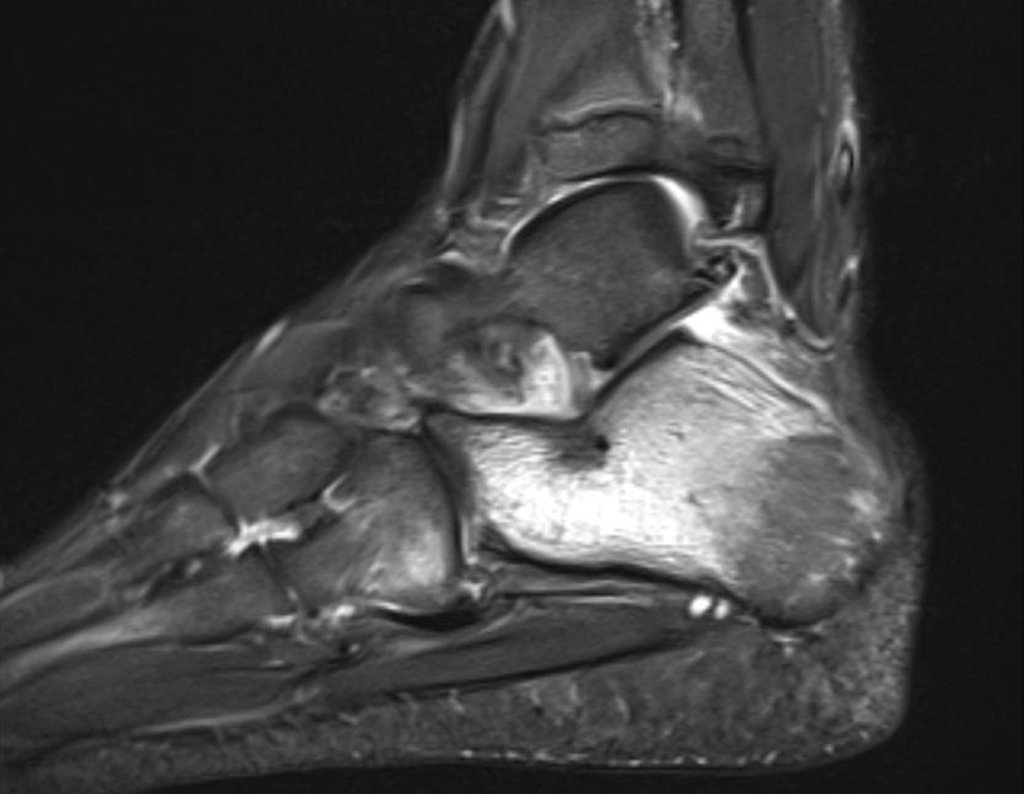
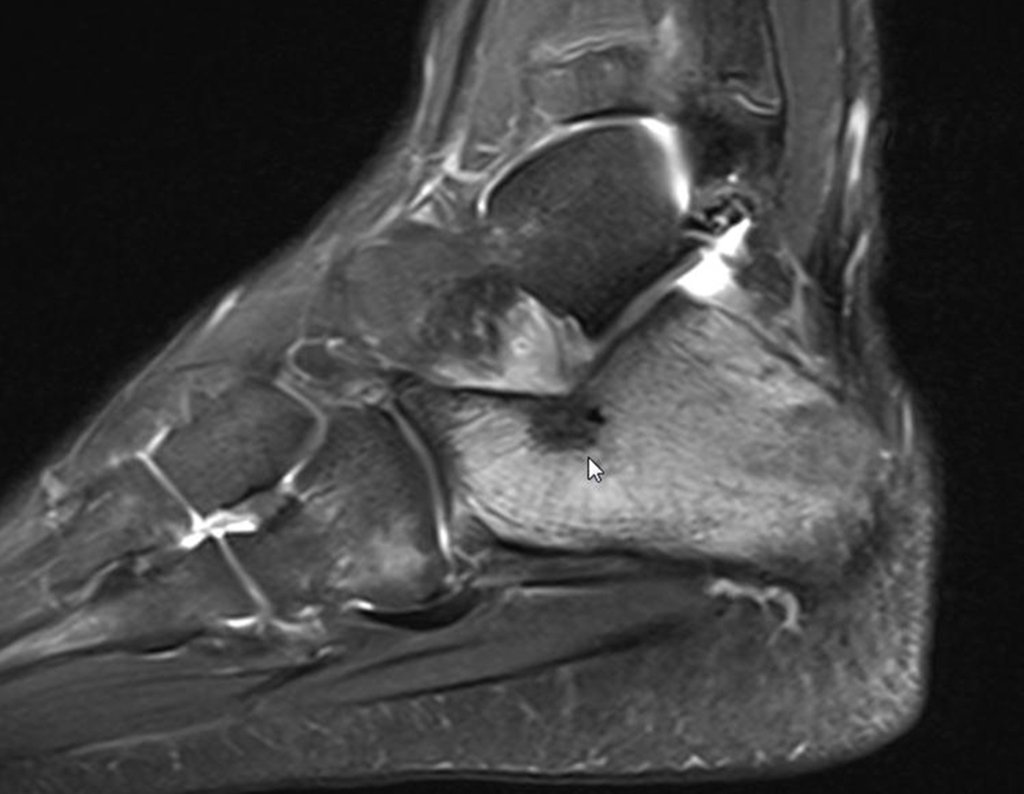
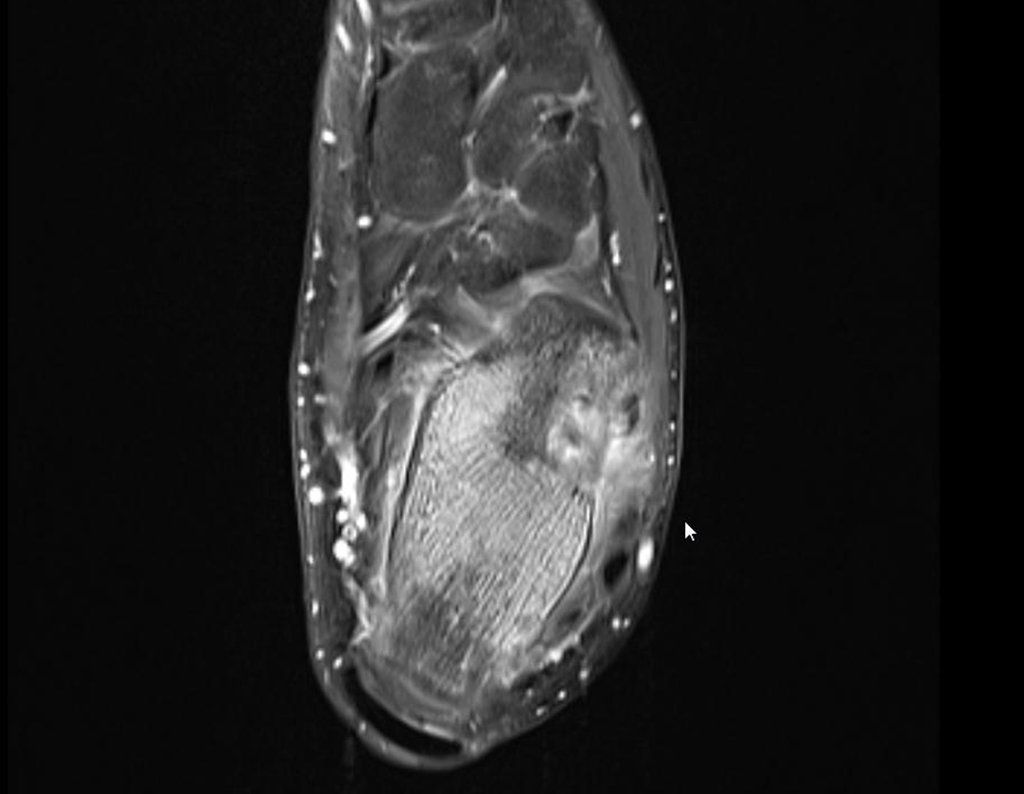
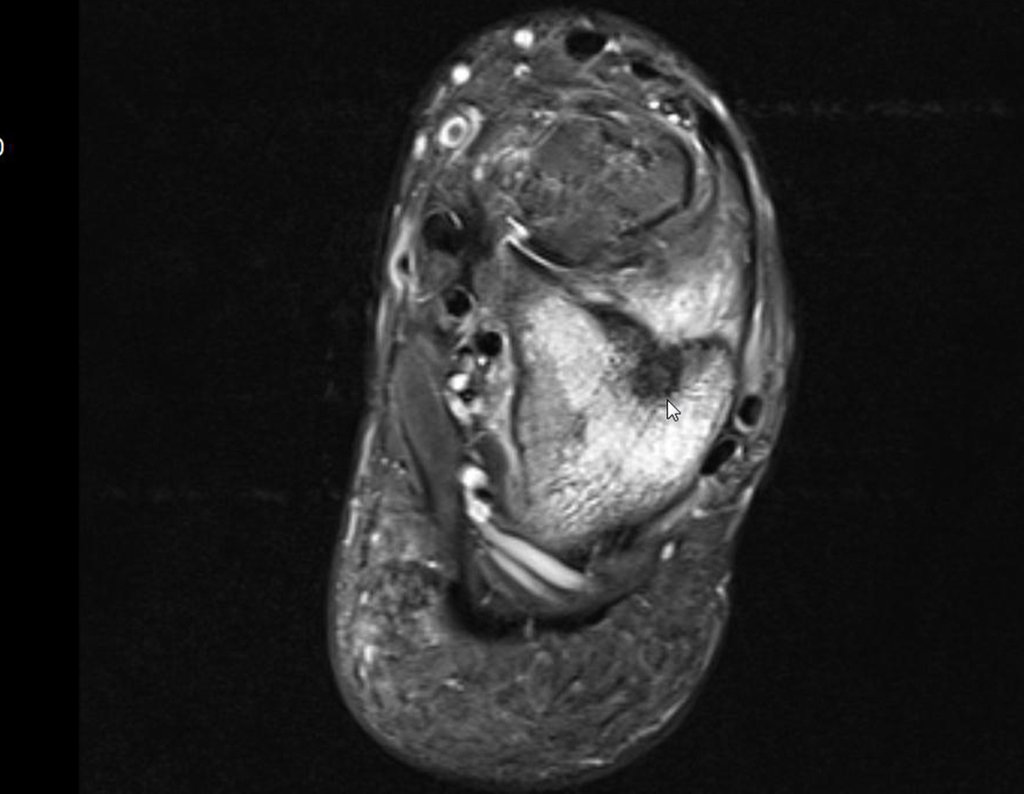
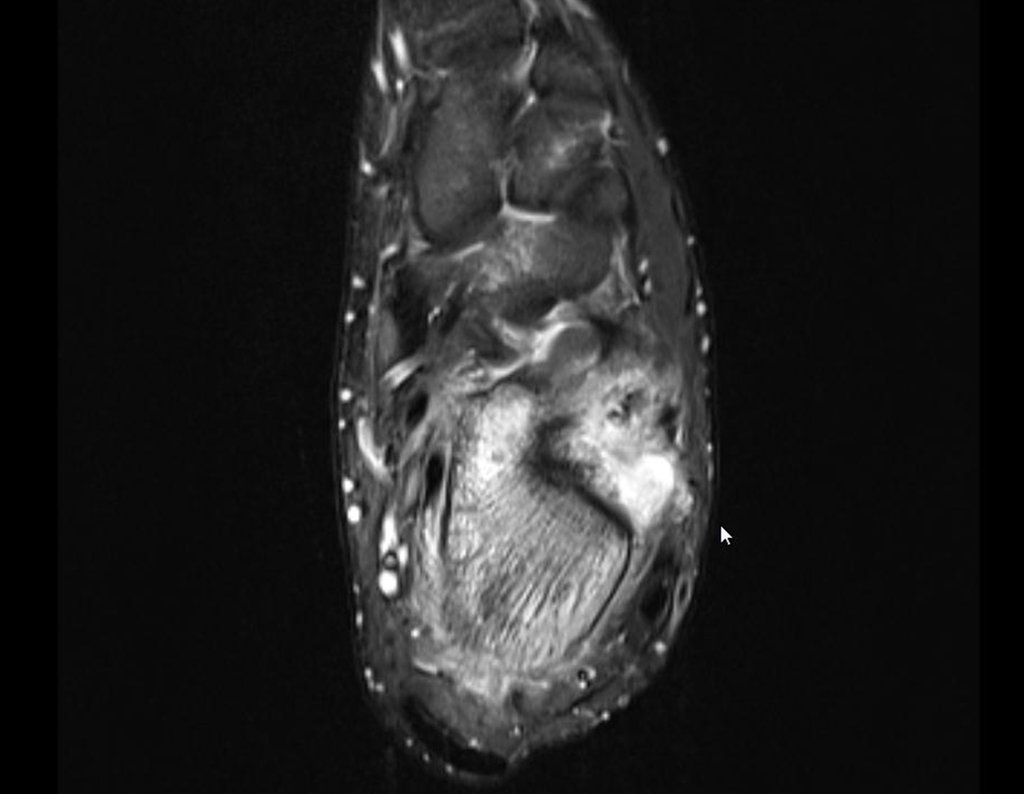
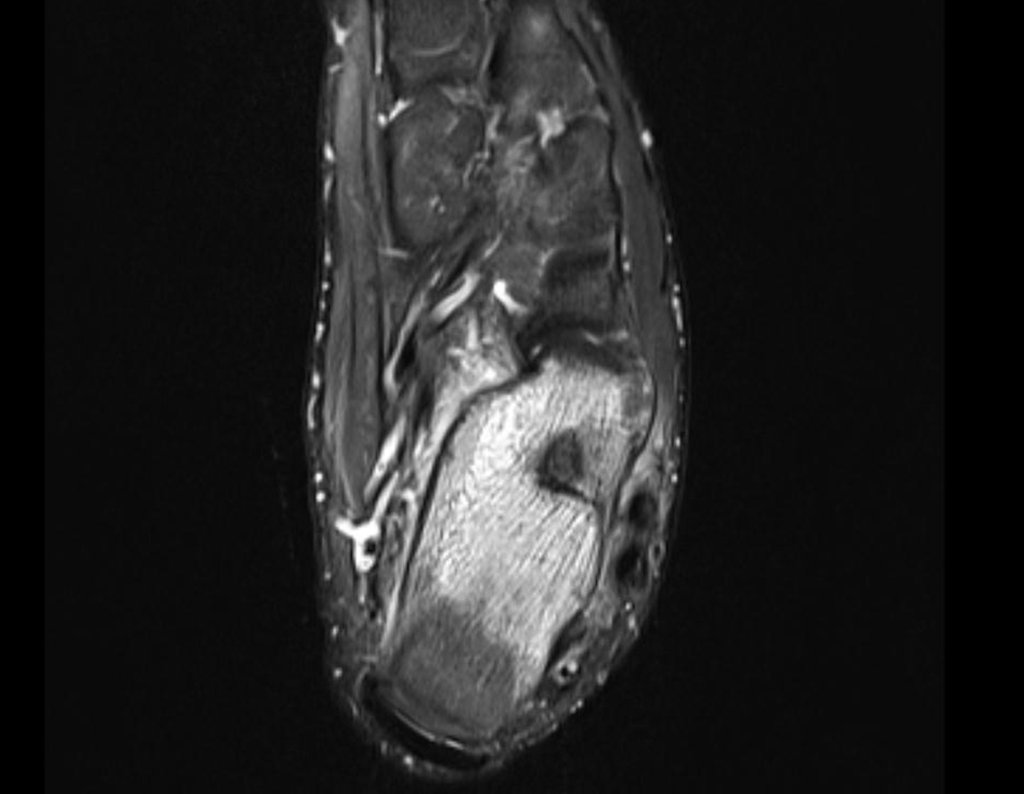
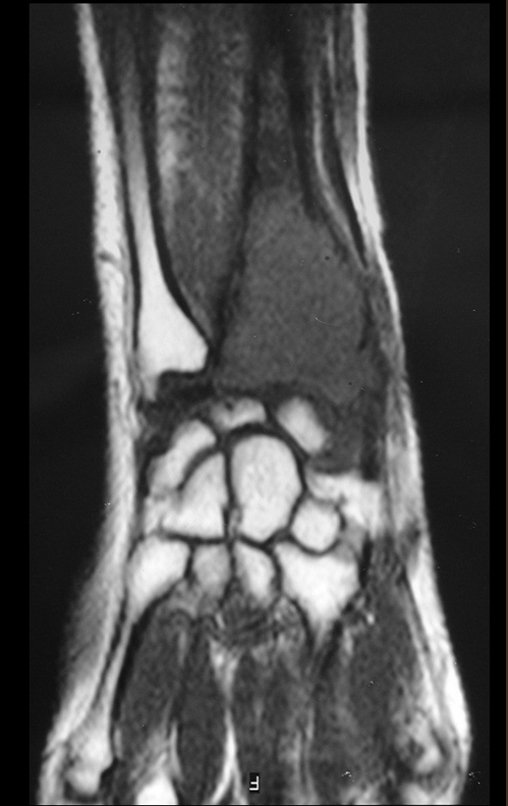
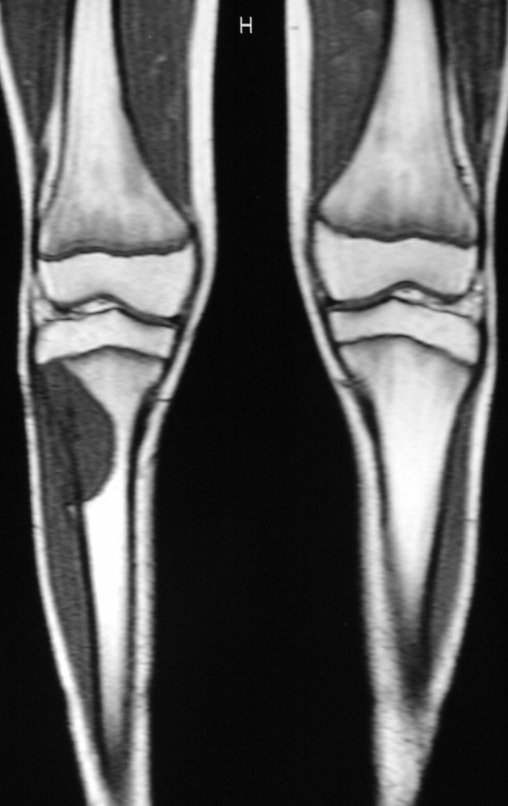
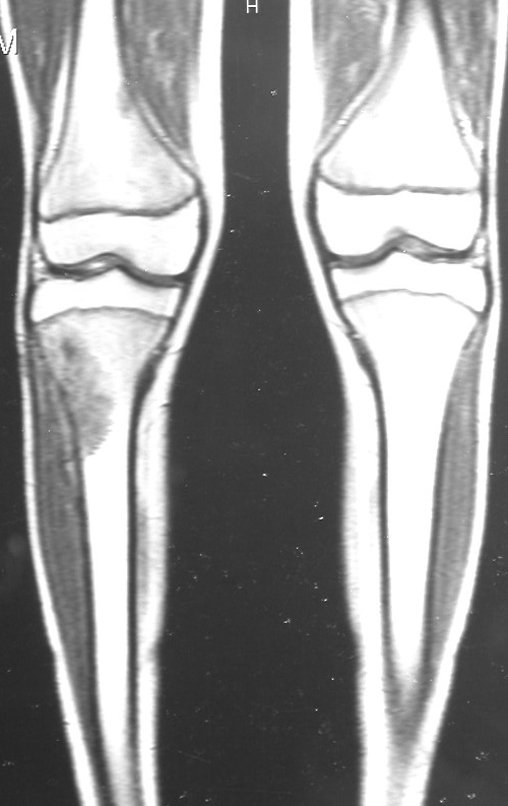
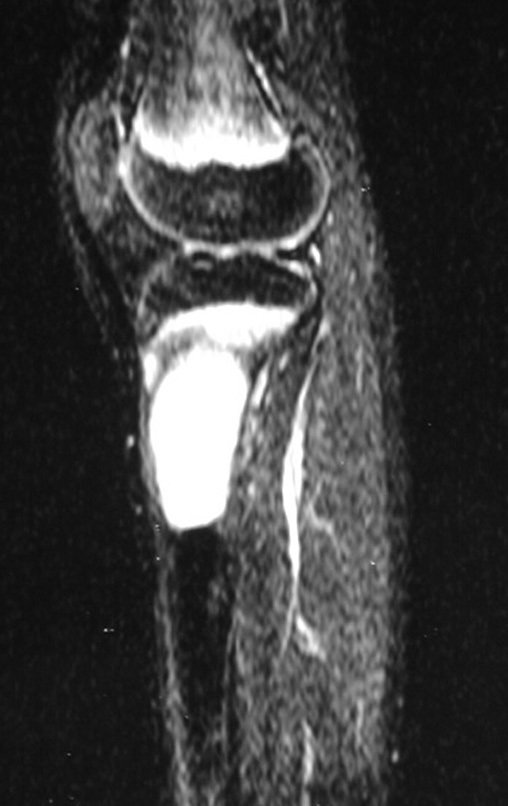
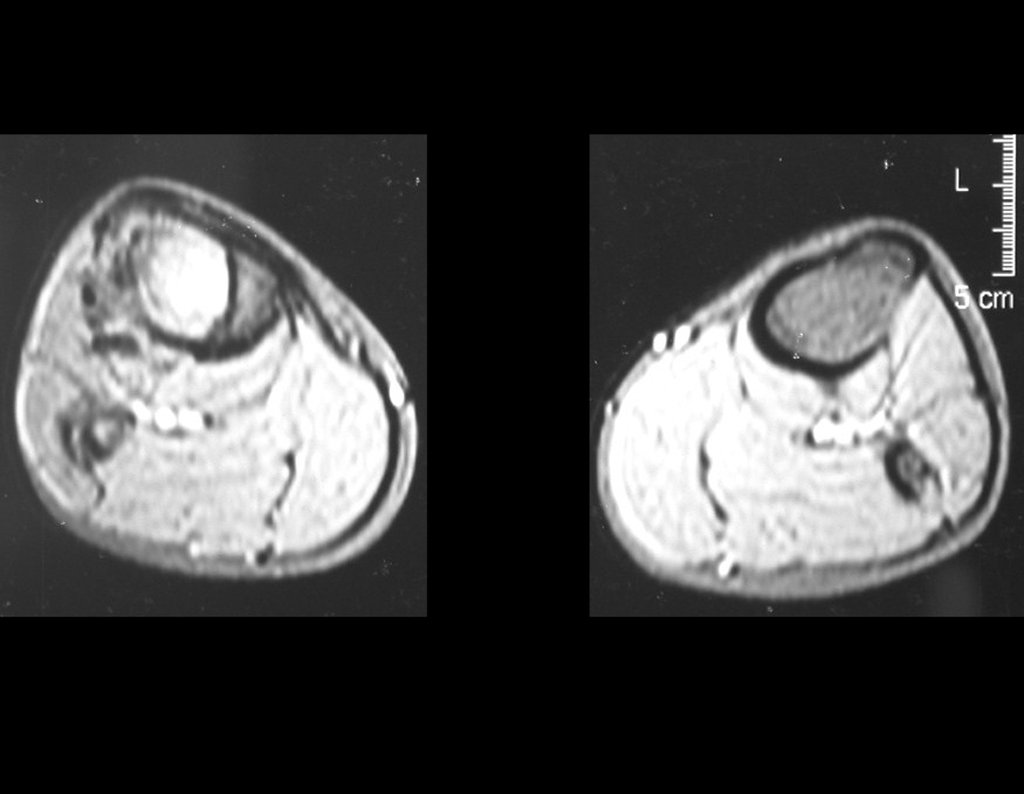
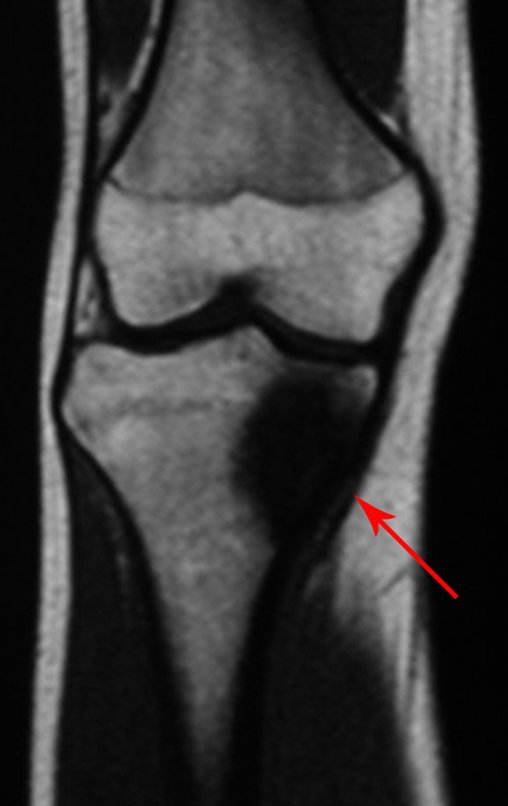
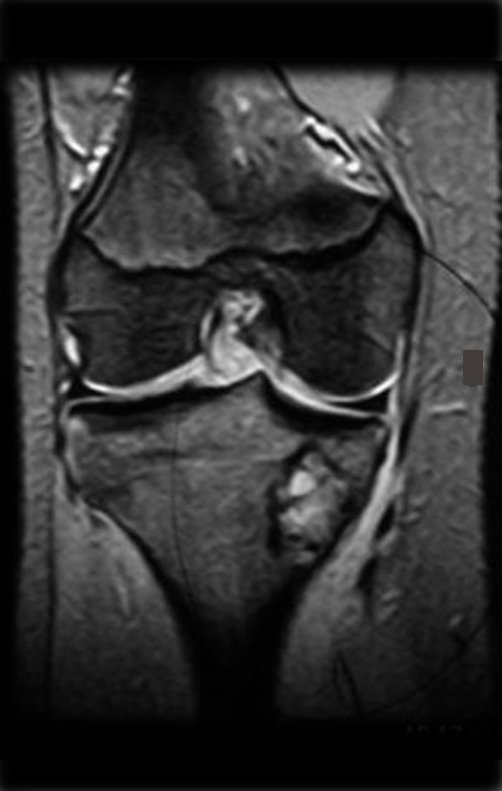
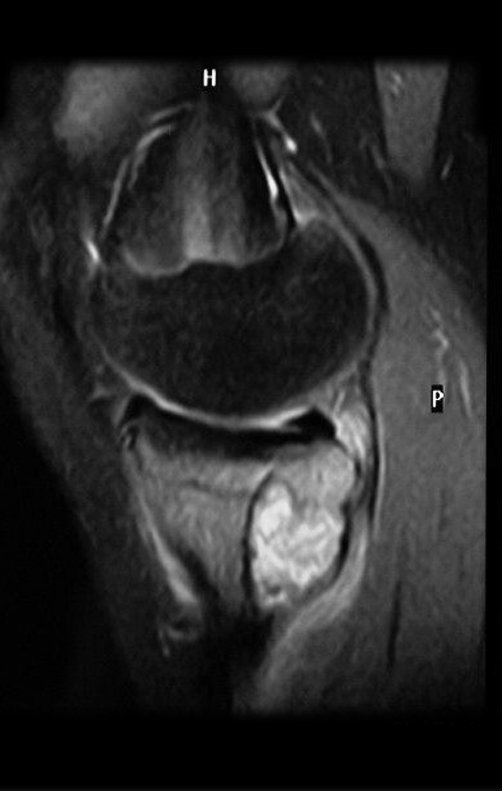
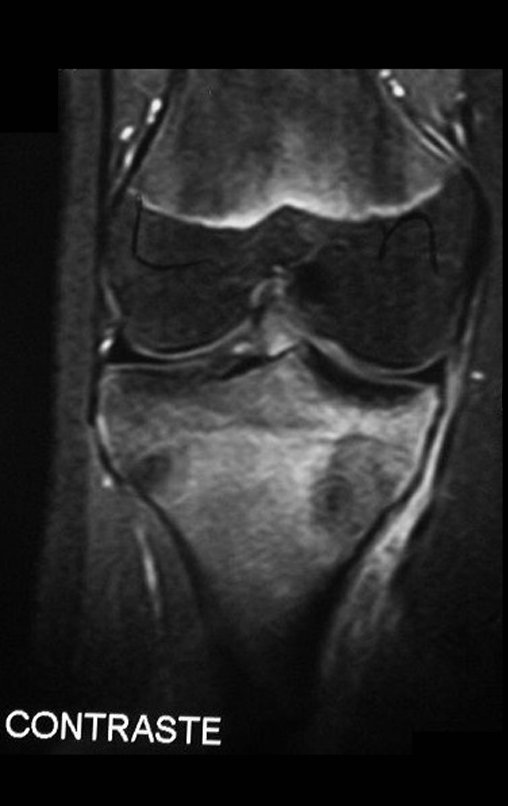
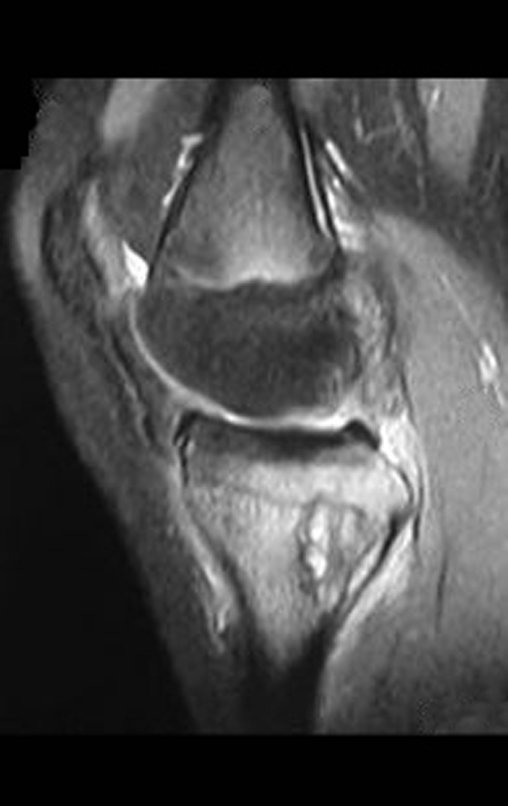
Continuando o estadiamento foi realizada a ressonância magnética, figuras 9 a 18.
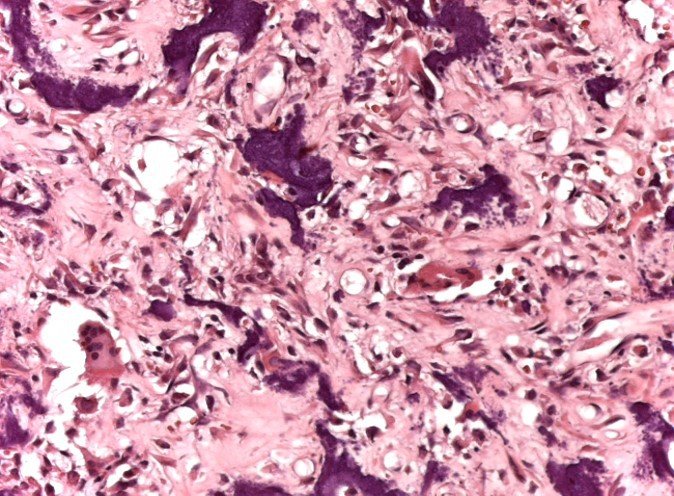
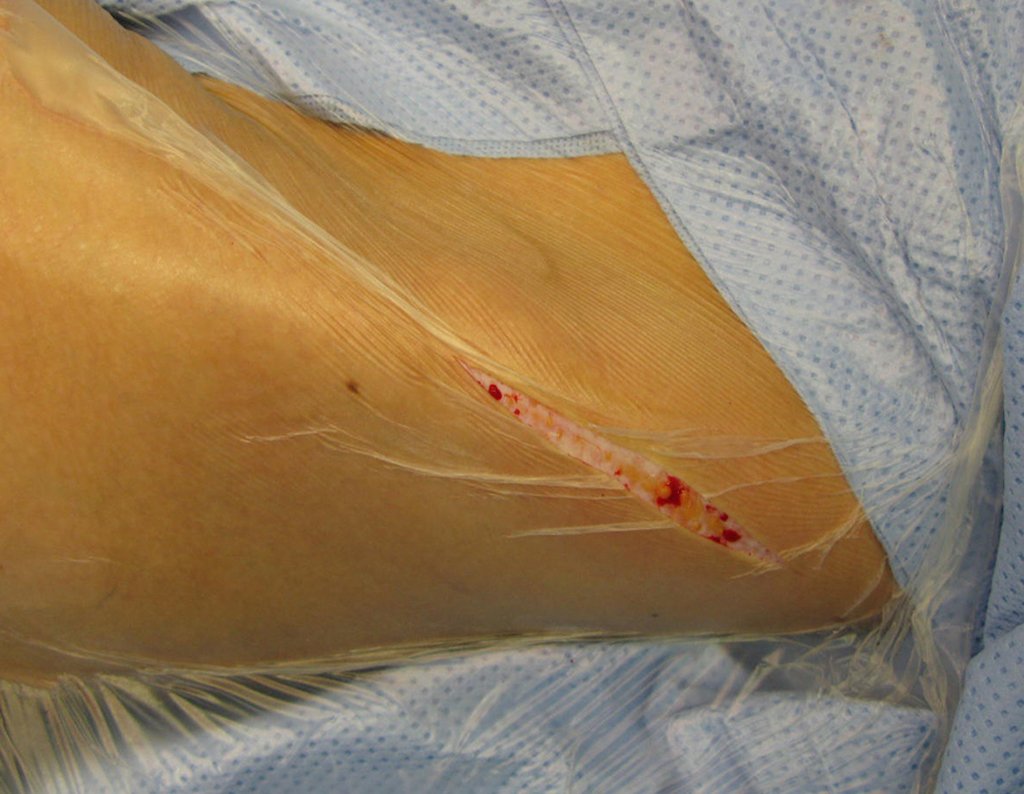
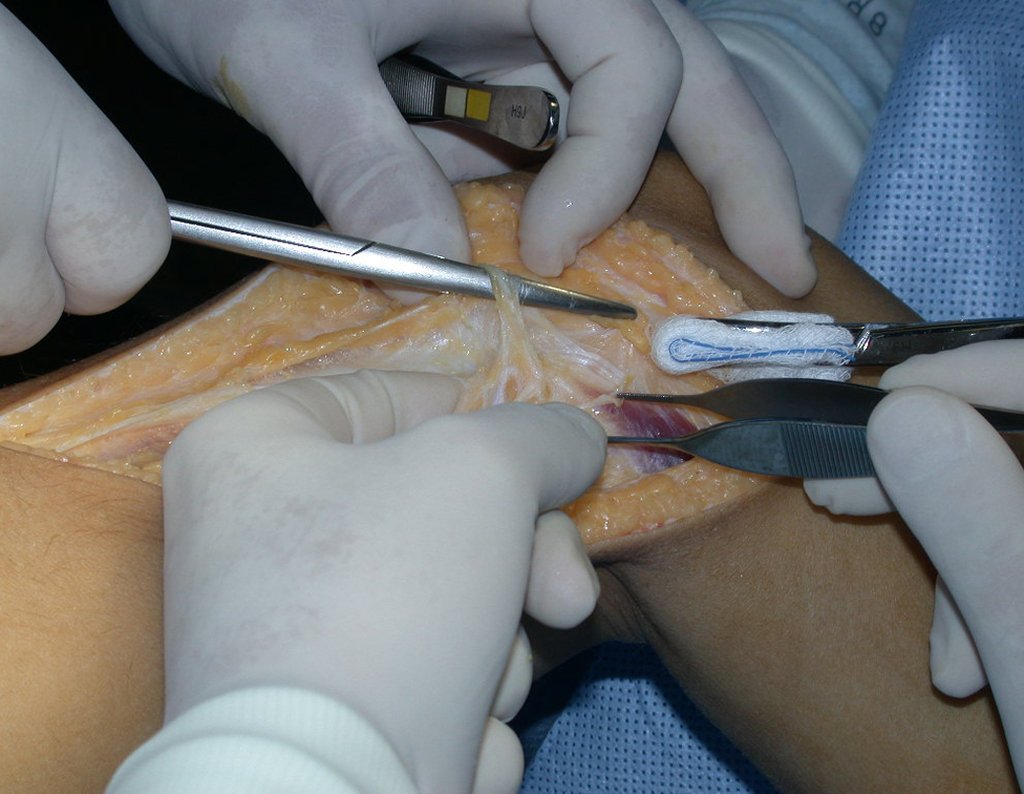
Foi realizada biópsia por punção, por via lateral, por outro profissional.
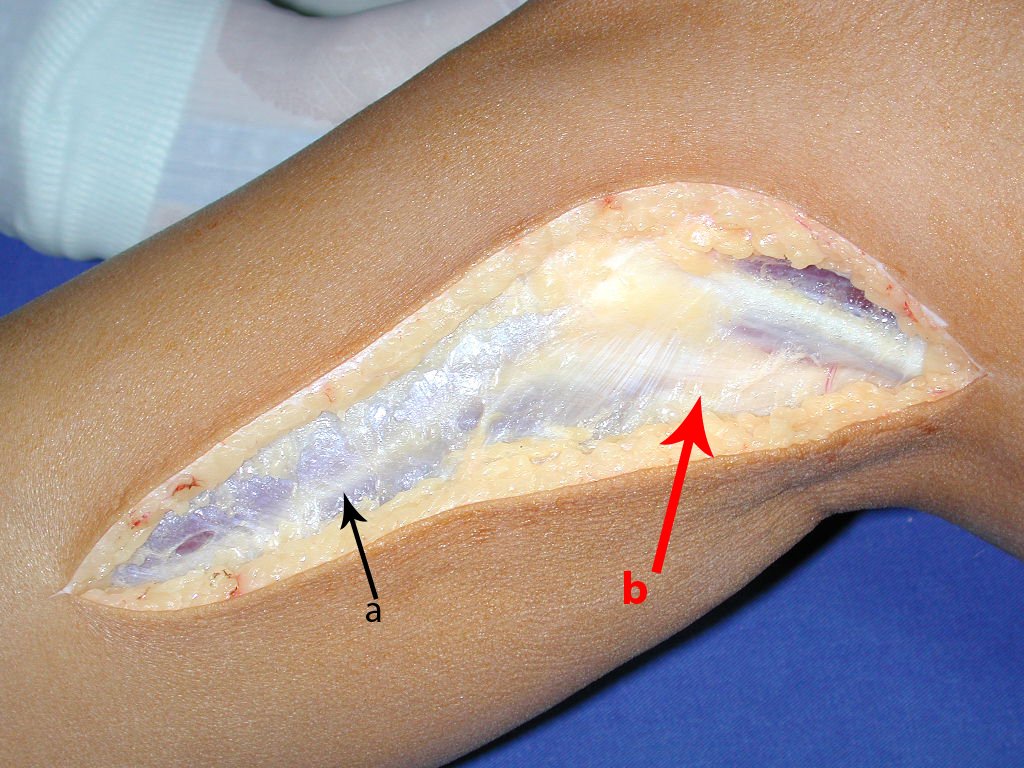
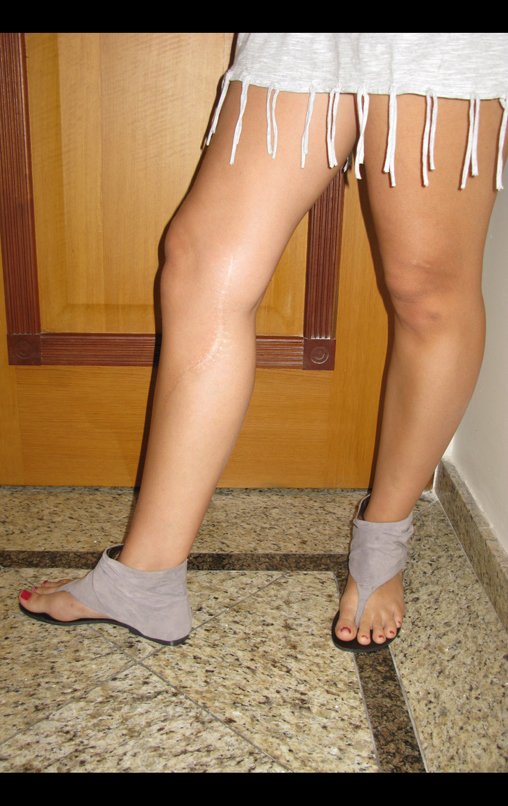
Observe que o local da biópsia, figura 20, é bem anterior, passando pelo meio da fáscia lata, dificultando a futura cobertura da cirurgia, pois o segmento inferior da fáscia ficaria seccionado tanto na área da biópsia, acima, quanto na borda abaixo.
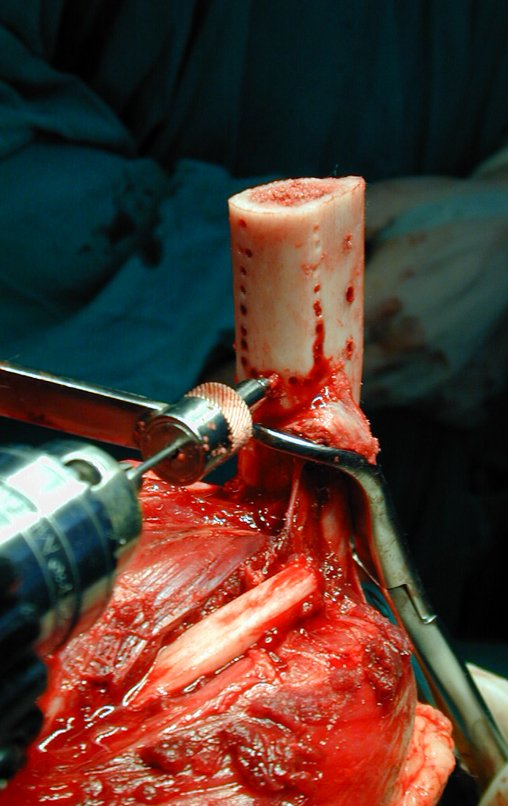
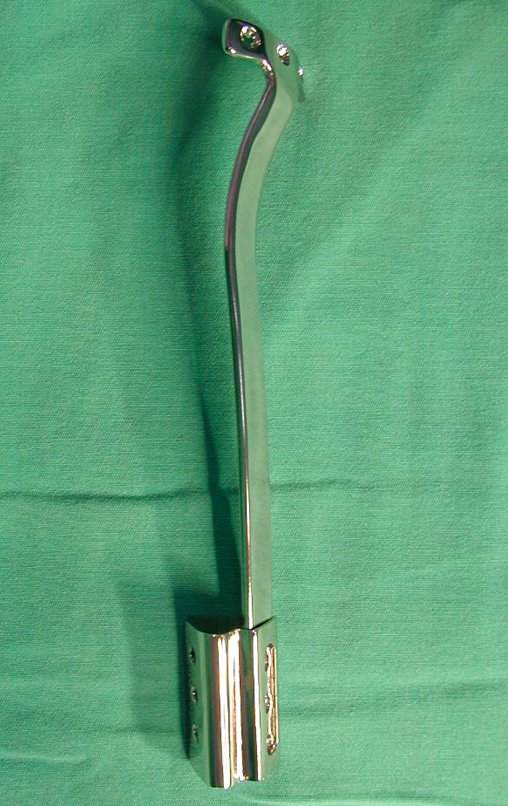
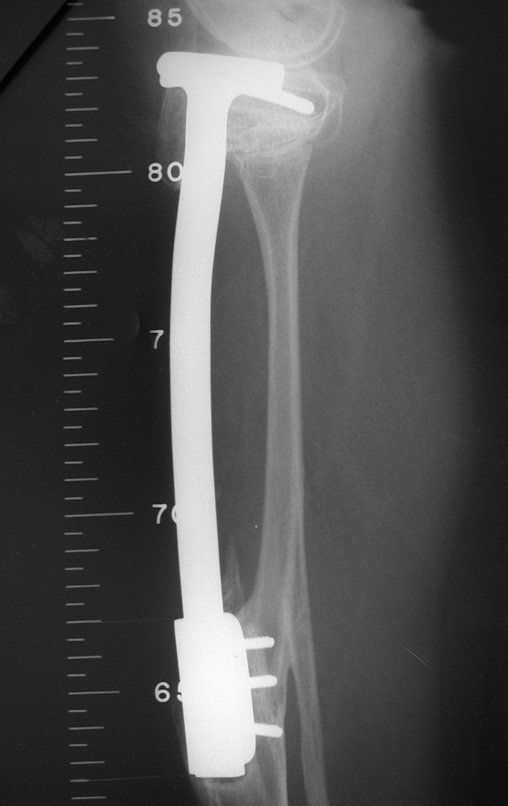
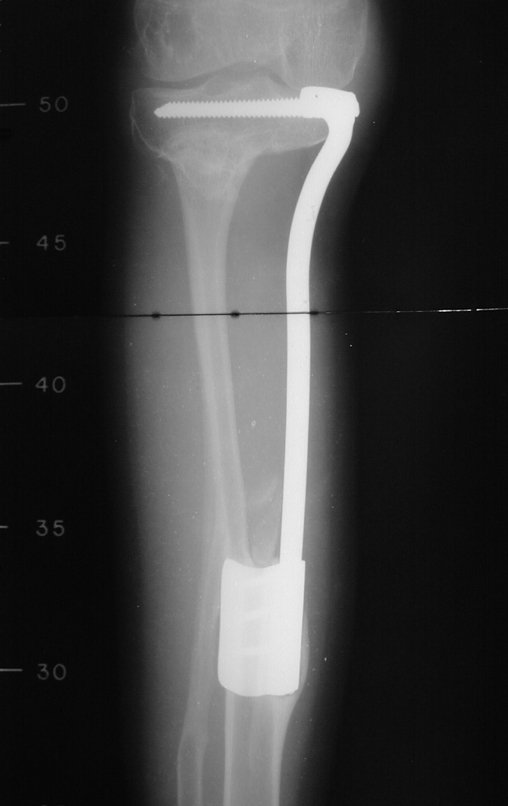
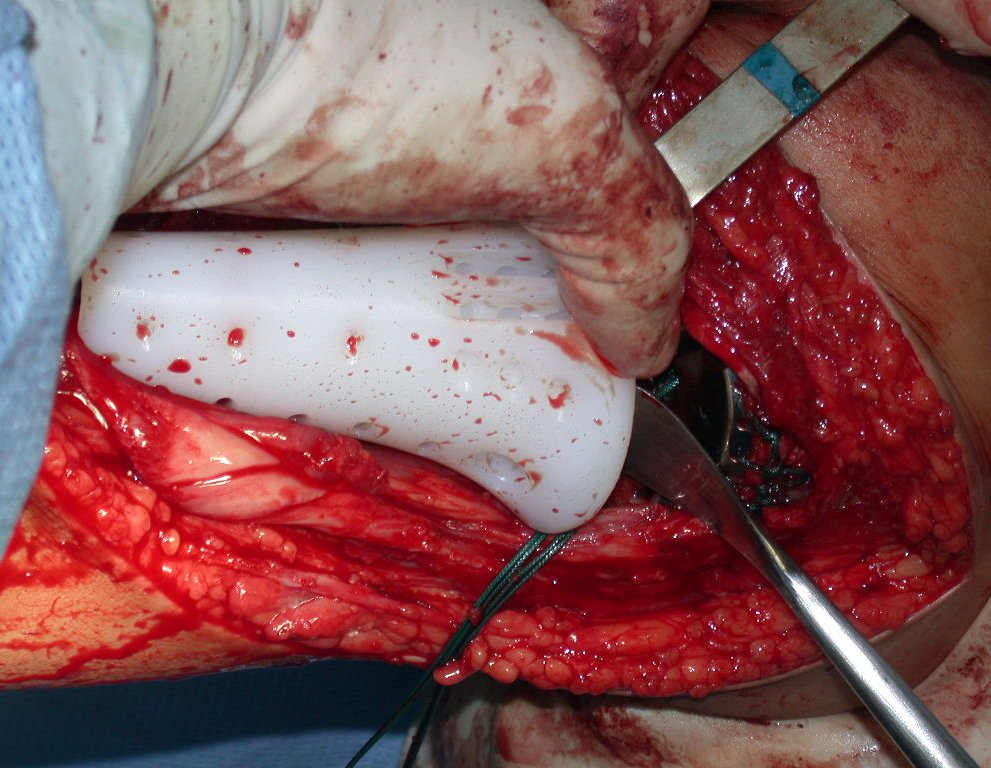
Antes da última etapa da quimioterapia neo-adjuvante, realizamos radiografias com régua do segmento a ser ressecado, para o planejamento da cirurgia e a confecção de prótese especial, quando necessária, figuras 23 e 24. Nas crianças em crescimento, este procedimento geralmente é necessário devido às diferentes larguras do canal medular, variados tamanhos dos côndilos femorais, além de dispositivos especiais que permitem preservar o potencial de crescimento da placa epifisial.
Nesta etapa realizamos também uma nova ressonância magnética para o estudo por imagem da evolução da lesão, figuras 26 a 41. É raro, mas o tumor pode ter aumentado durante a quimioterapia e precisará ser ressecado com margem oncológica. Entretanto, o segmento a ser removido com margem, nunca poderá ser menor do que o tamanho planejado com a ressonância inicial, dimensionado na incidência em T1.
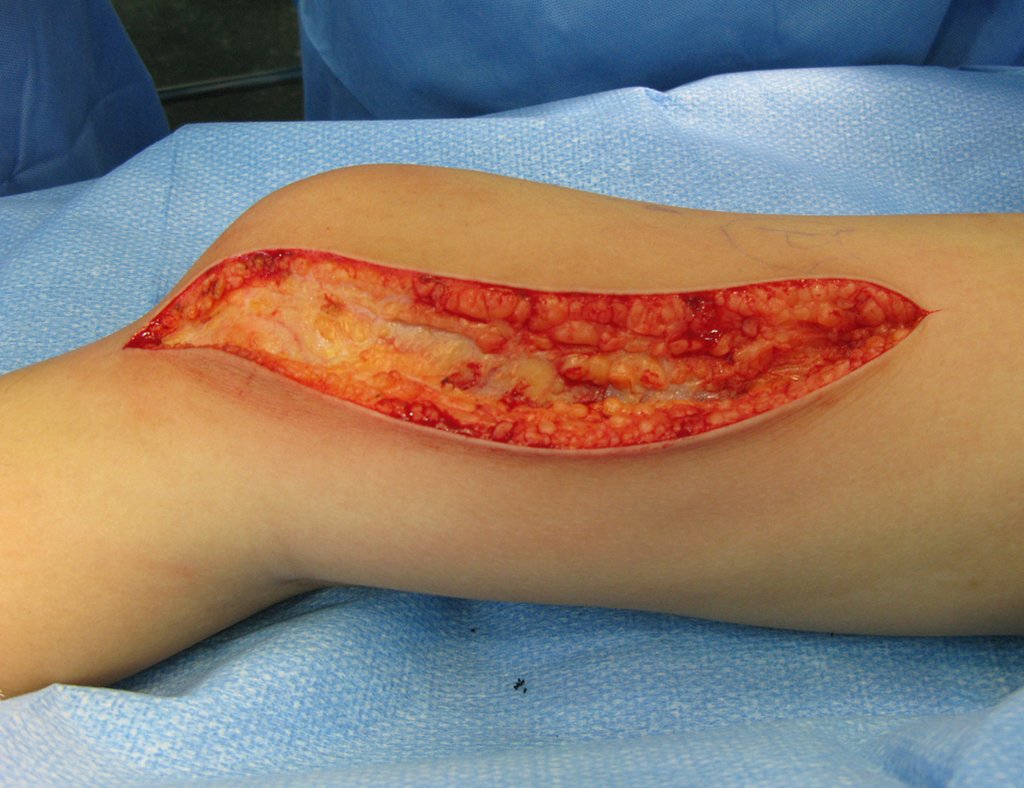
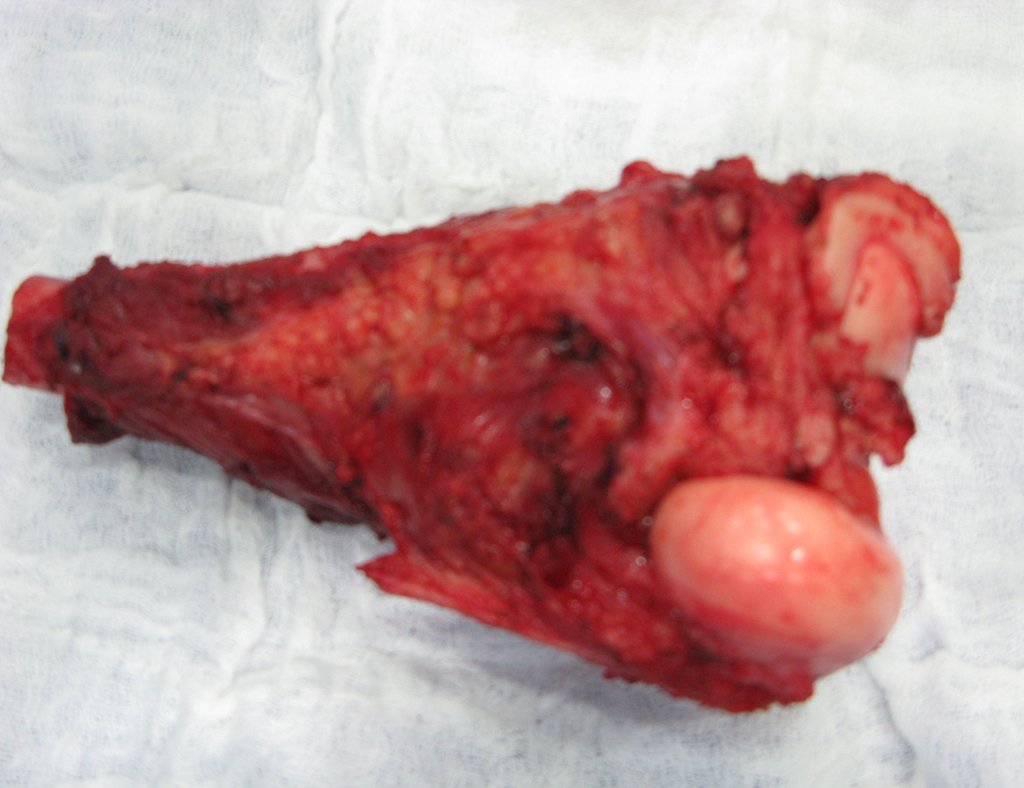
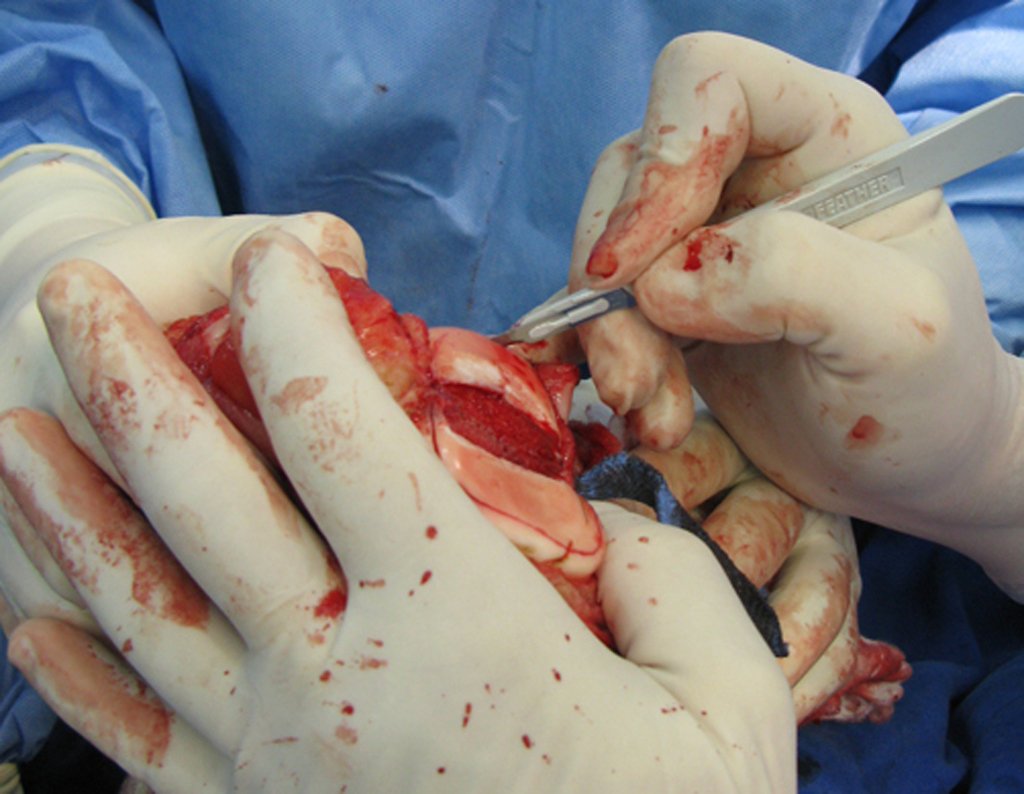
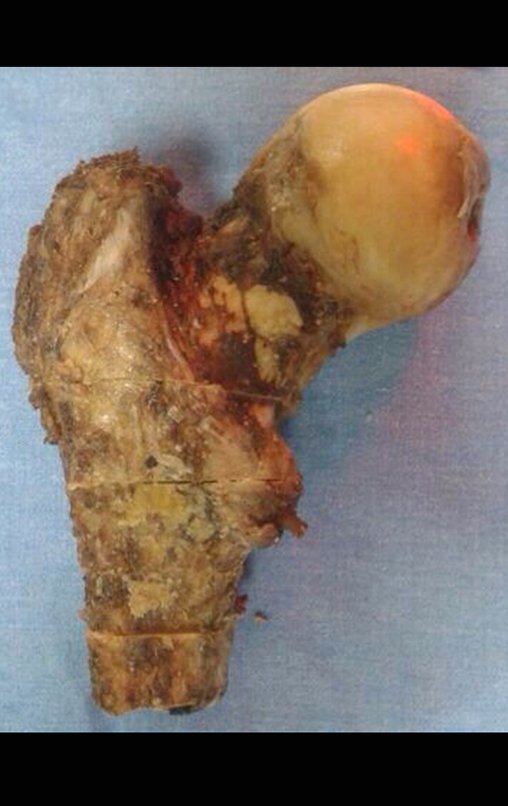
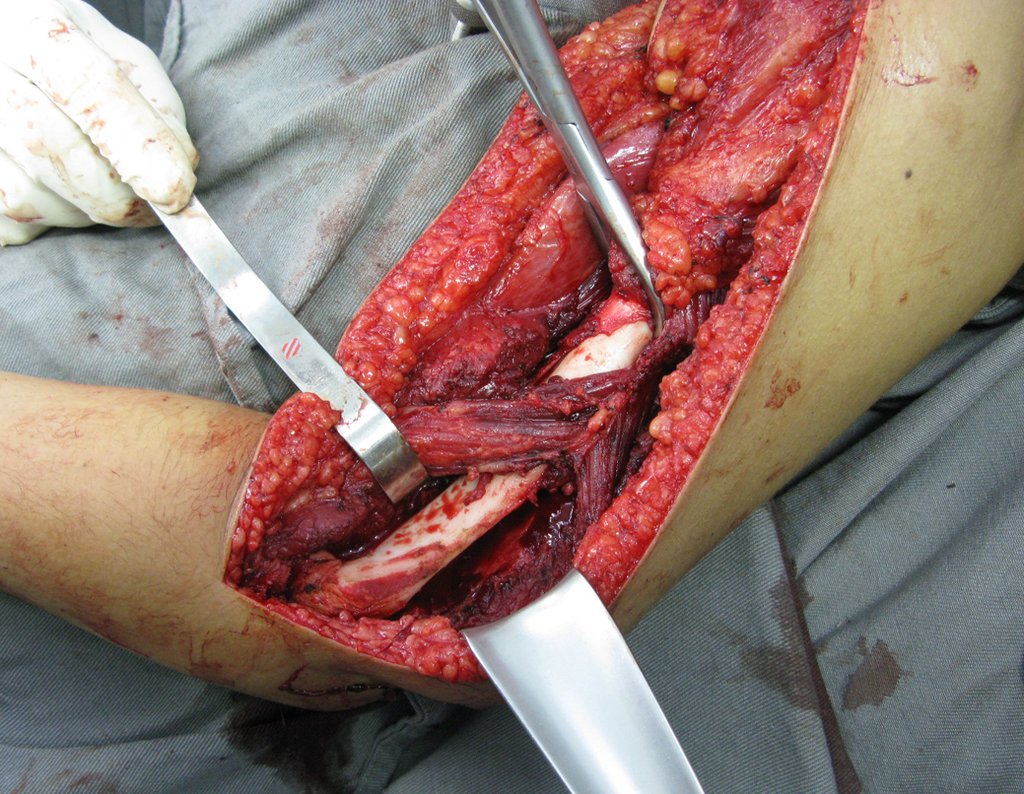
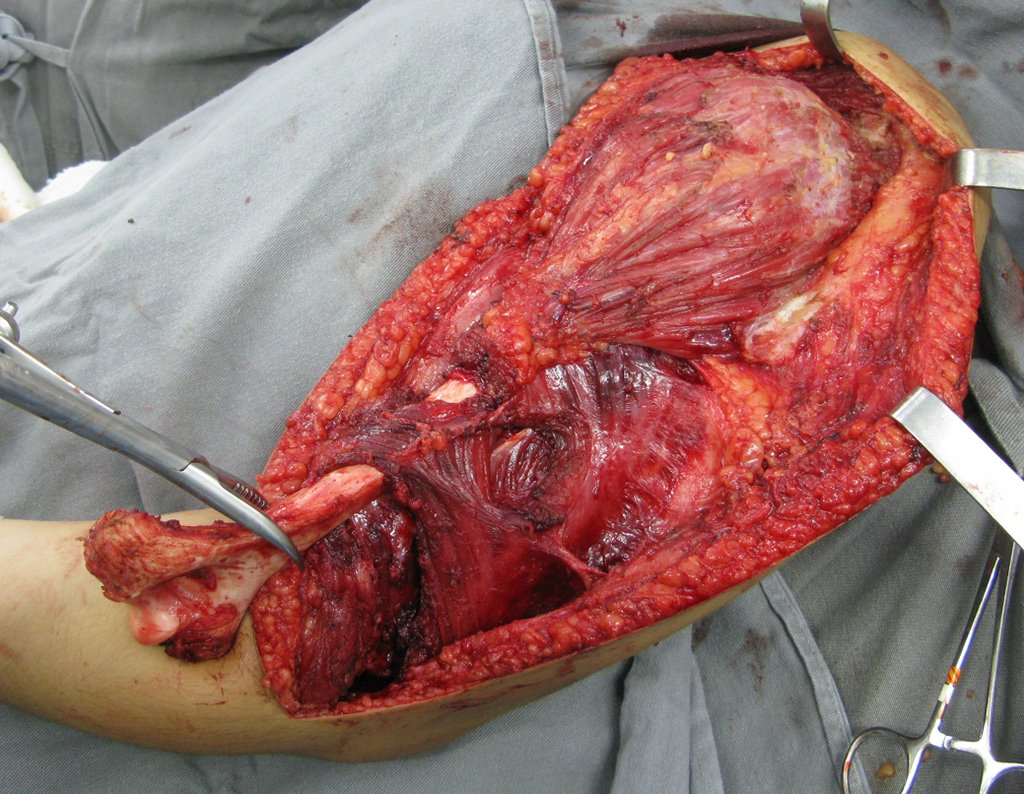
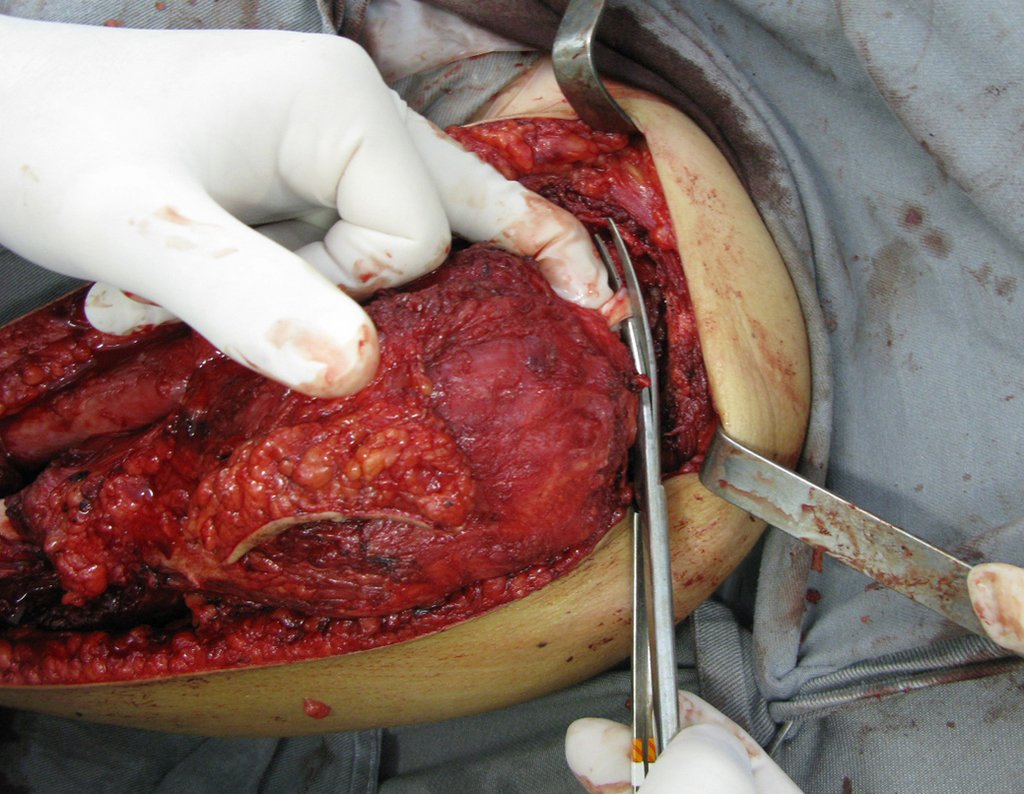
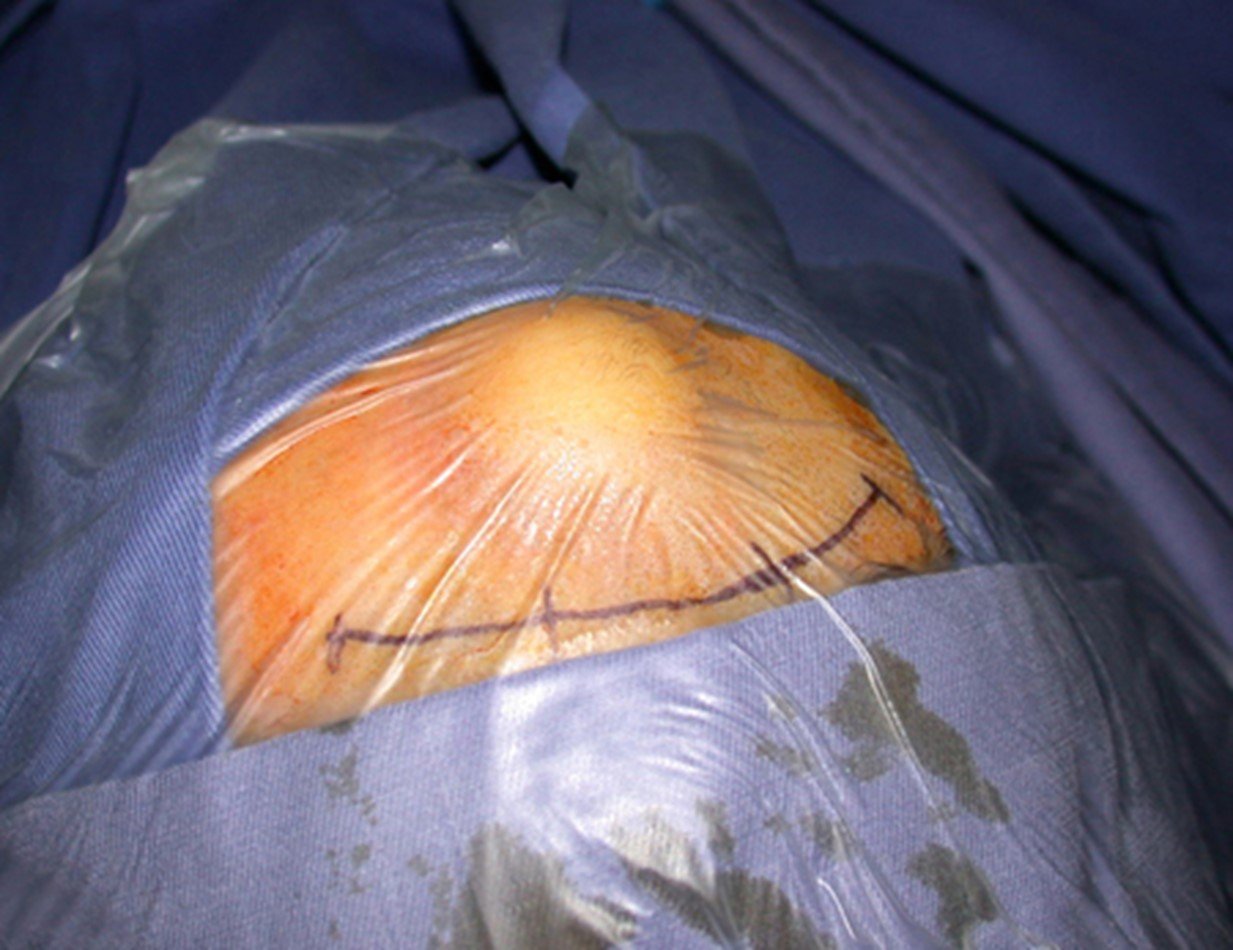
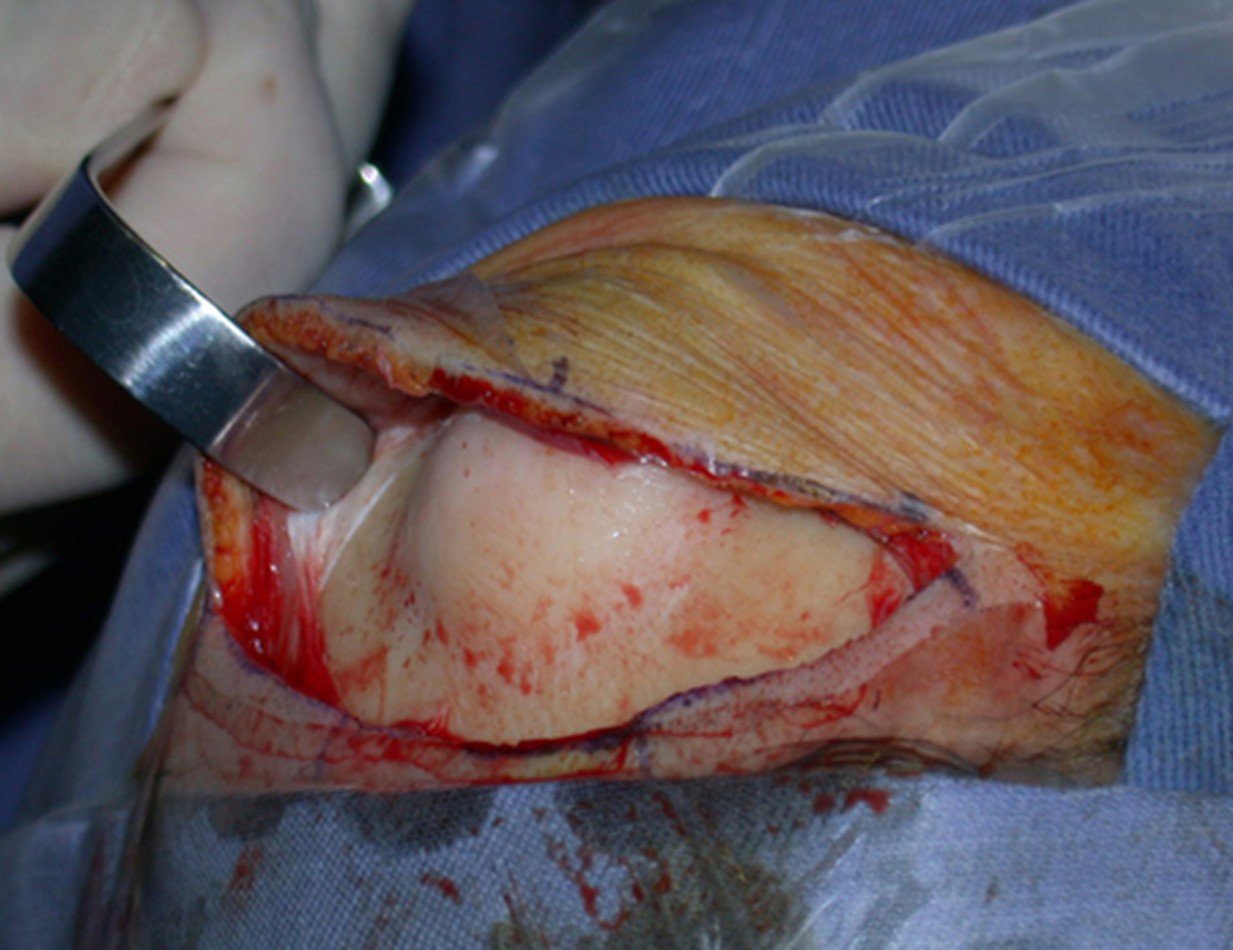
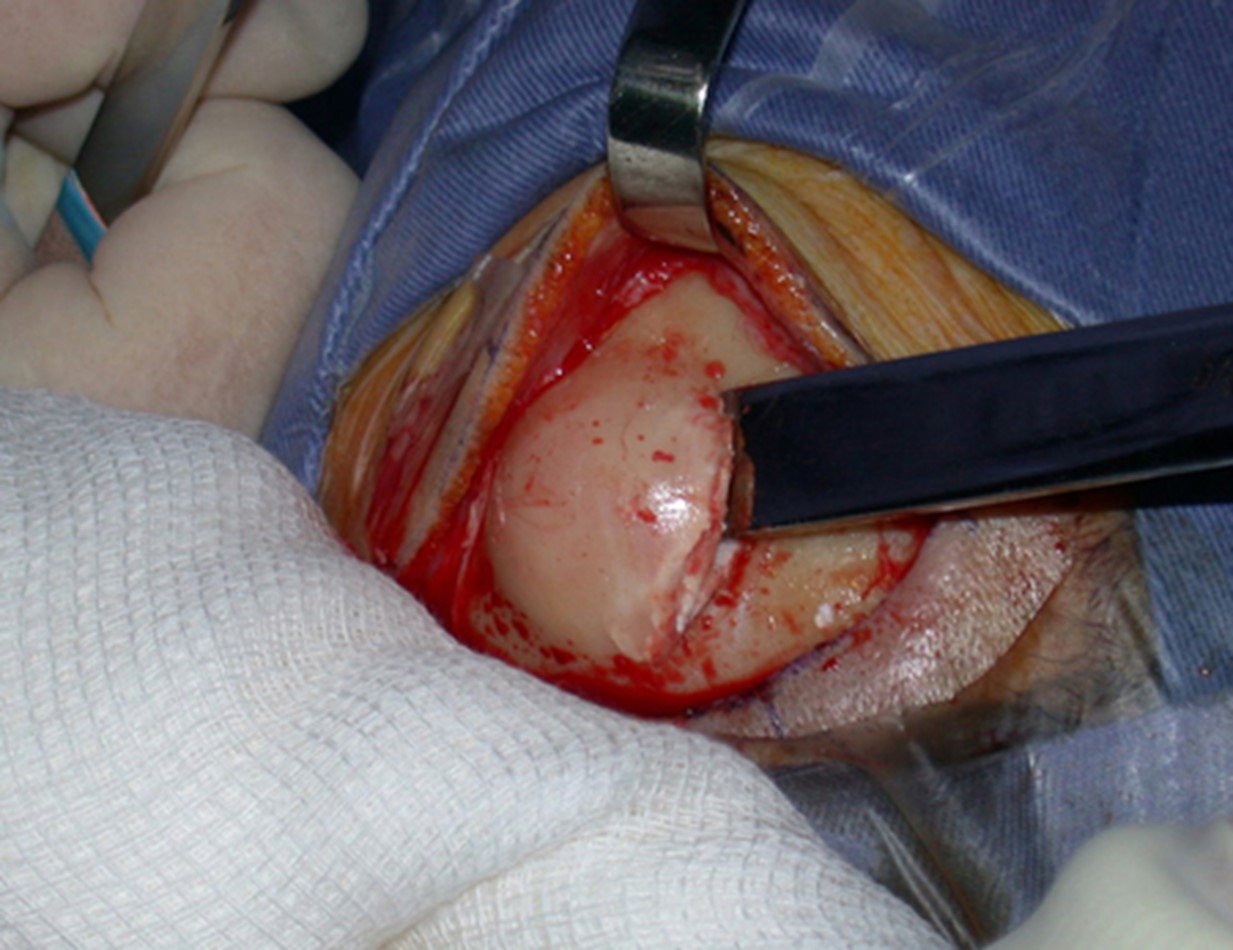
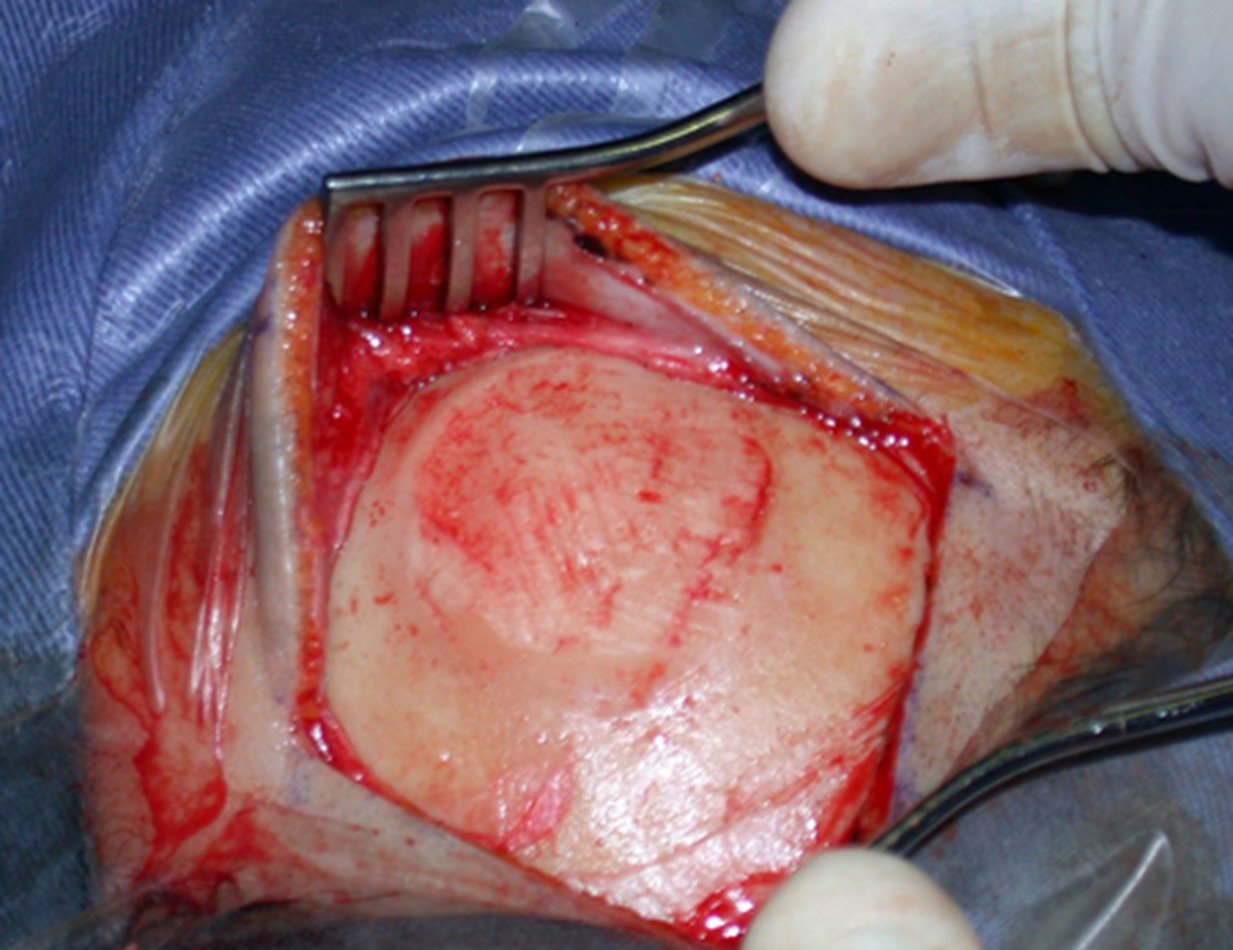
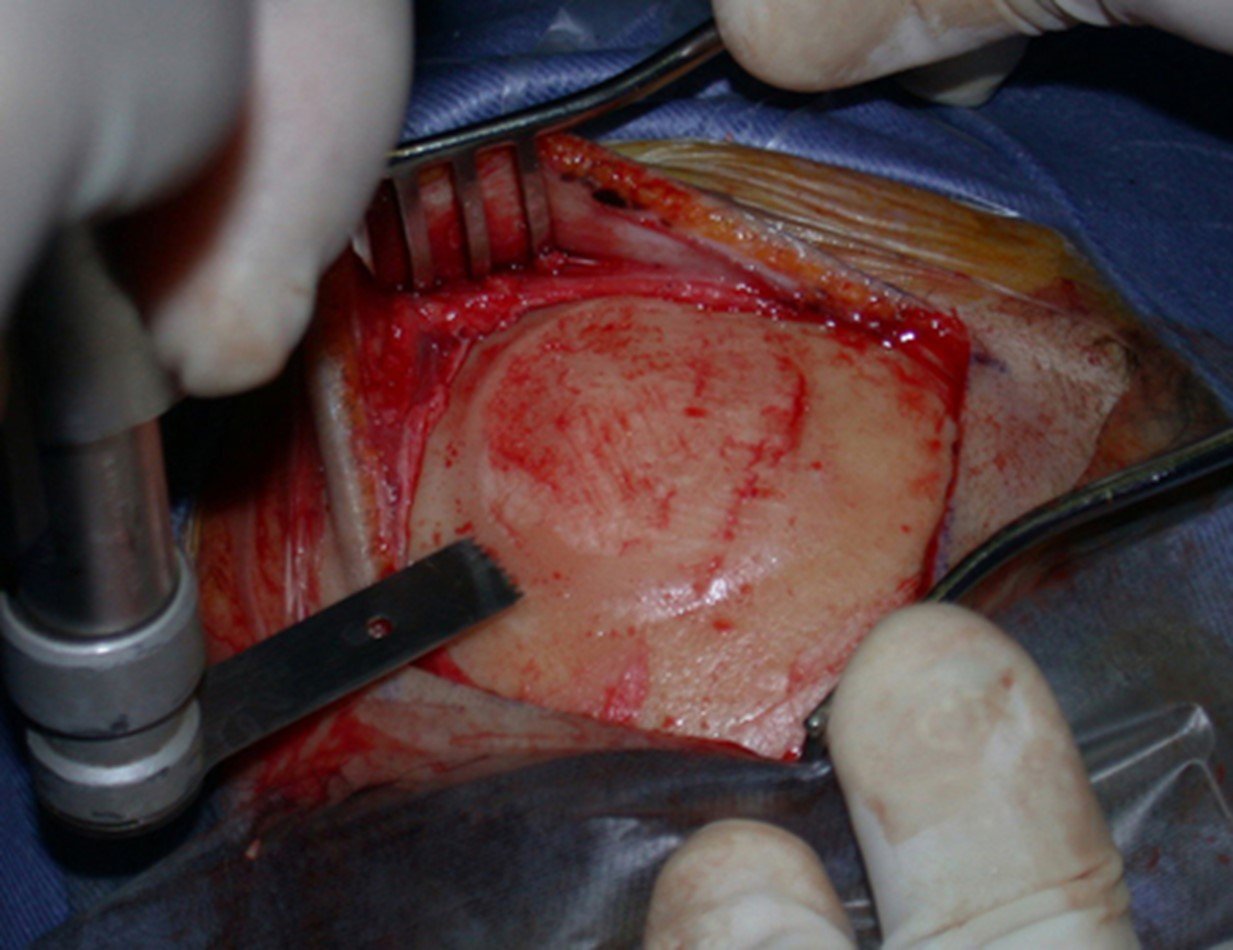
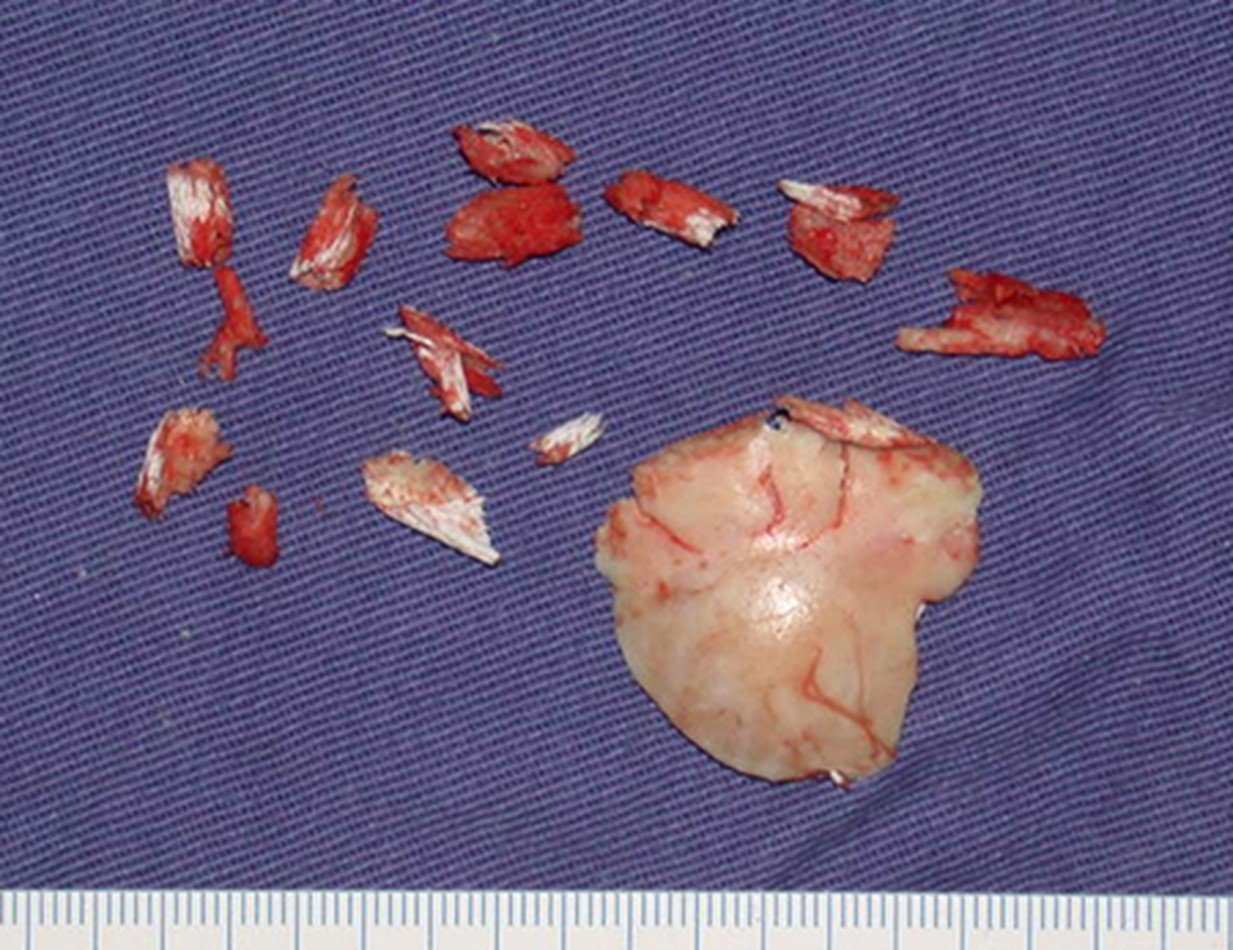
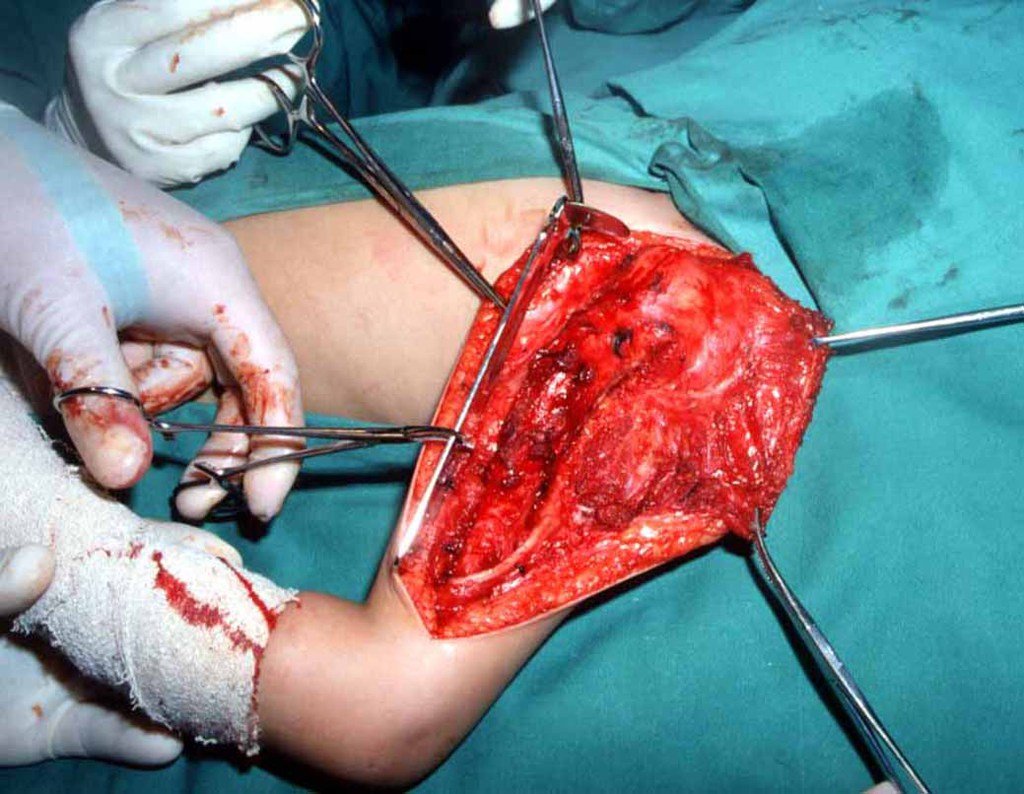
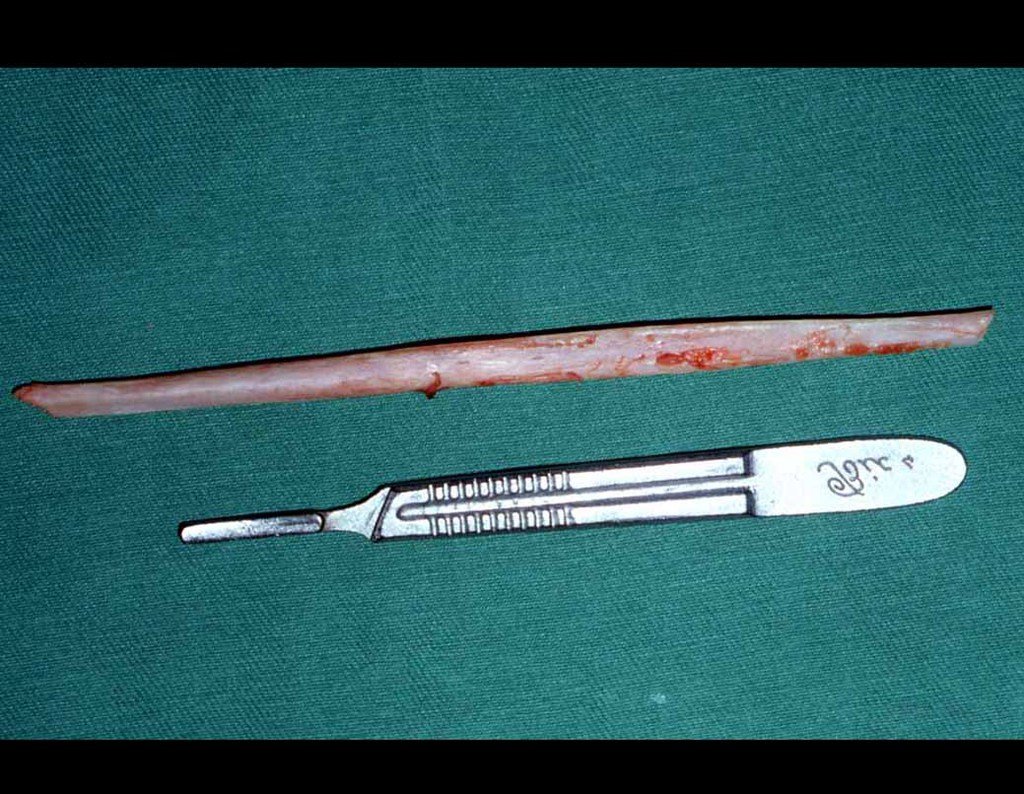
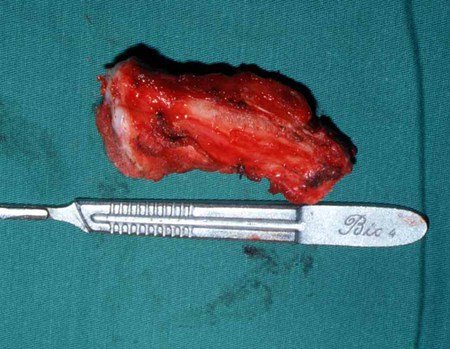
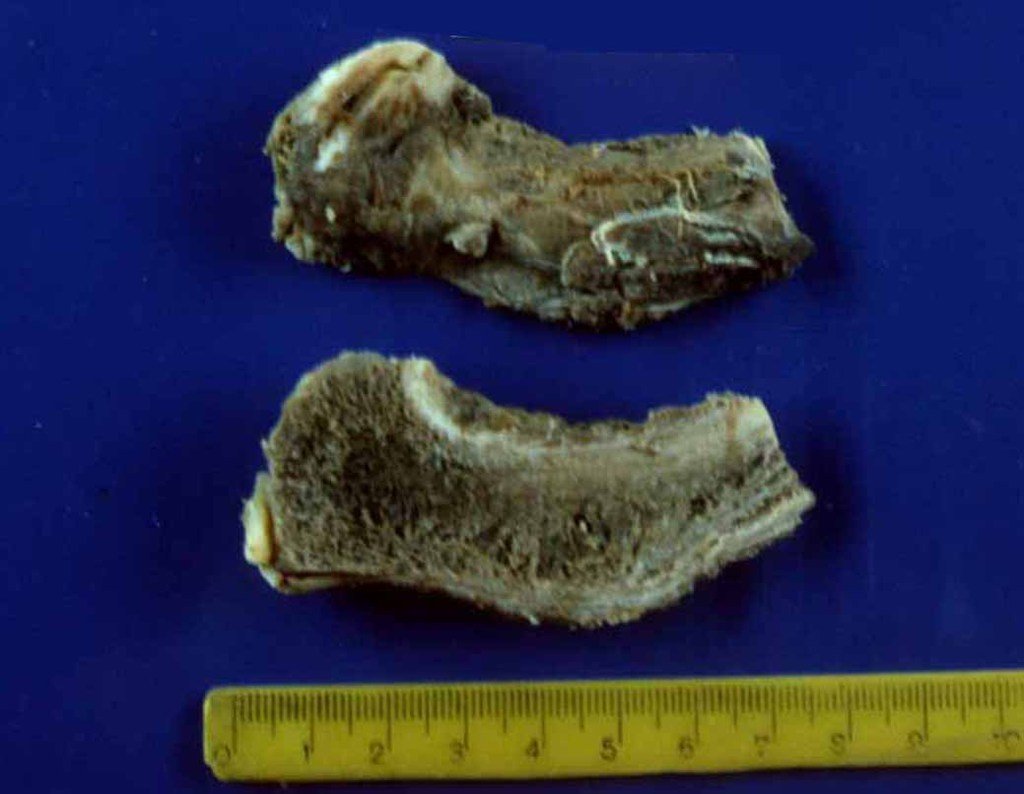
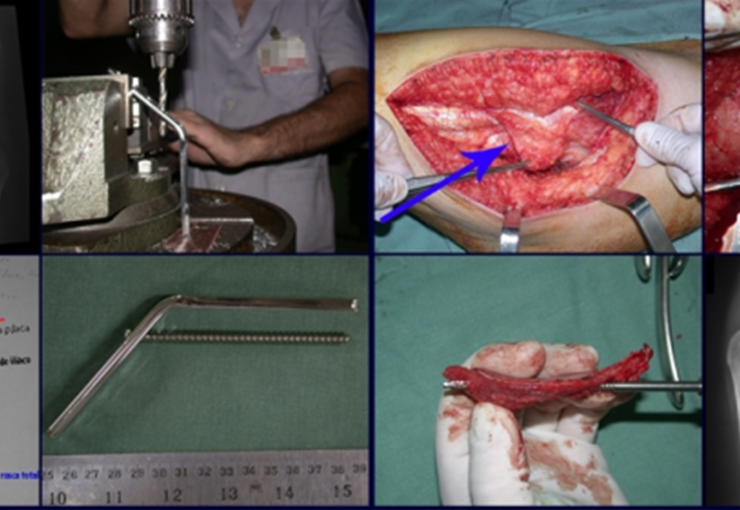
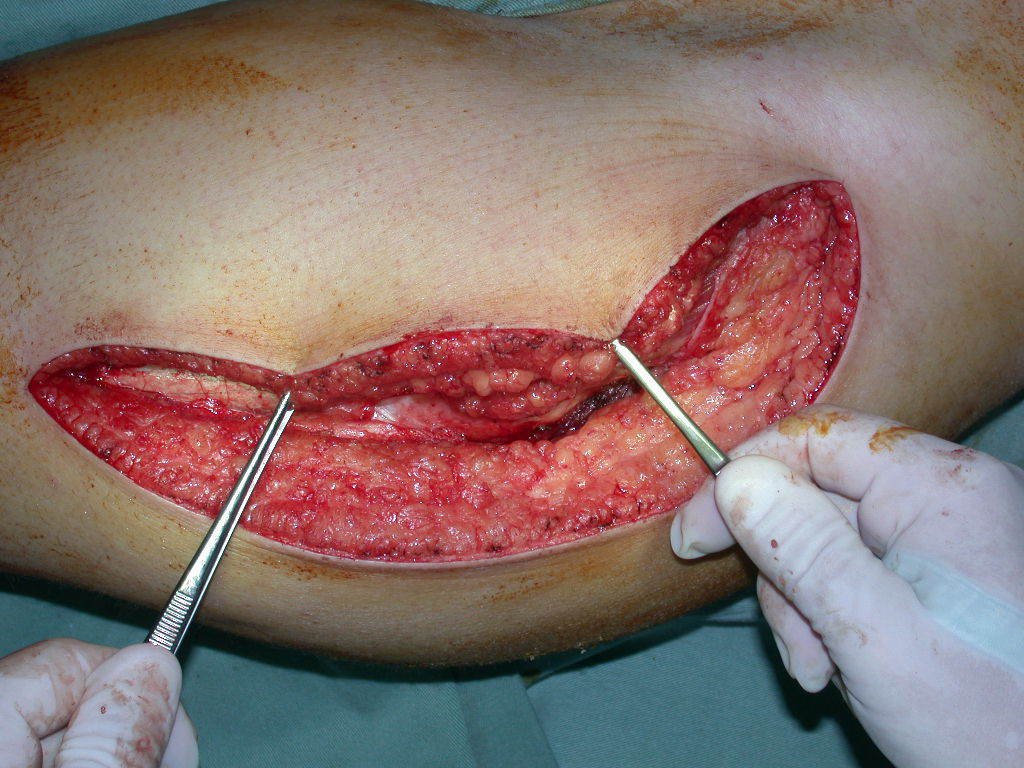
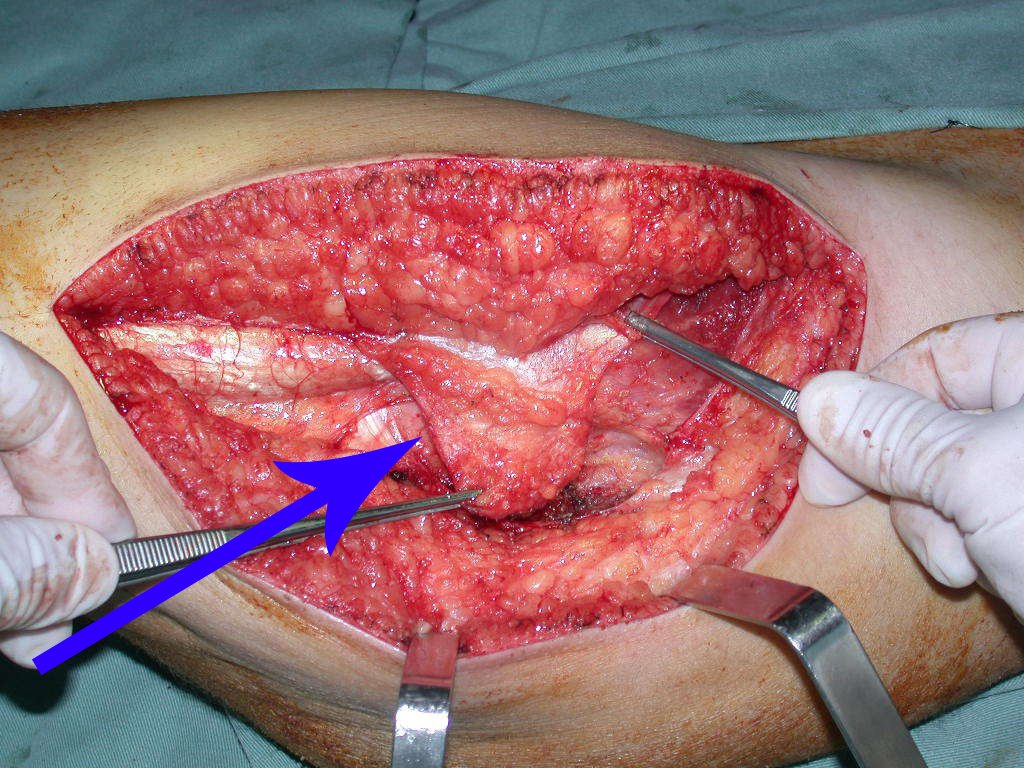
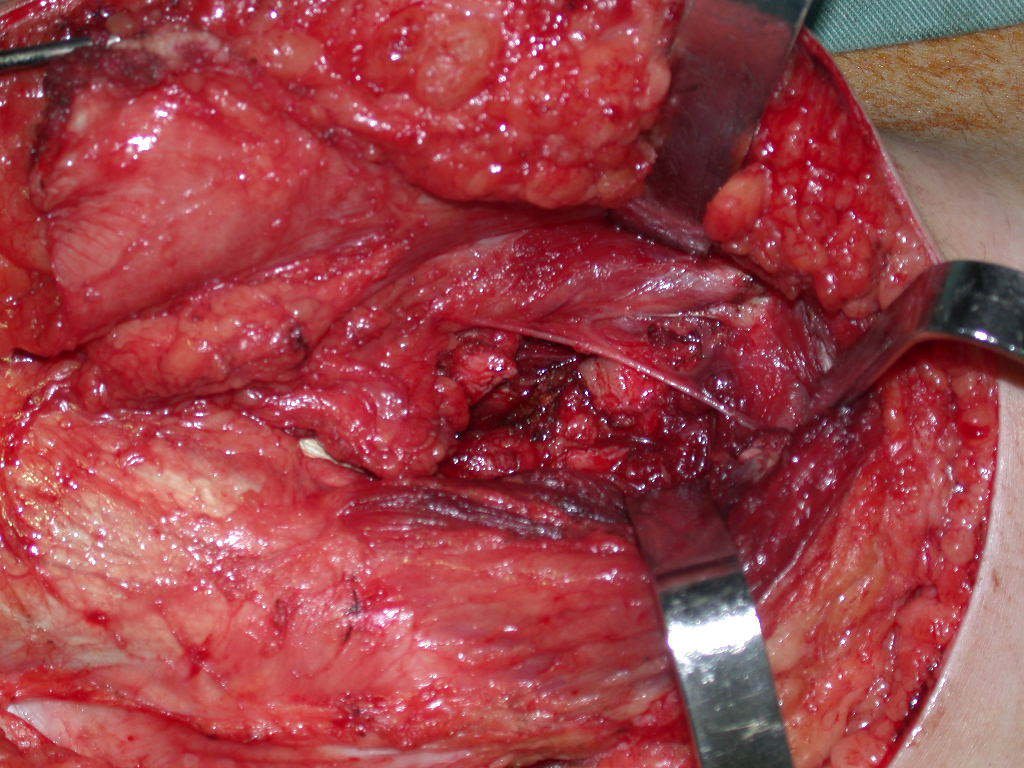
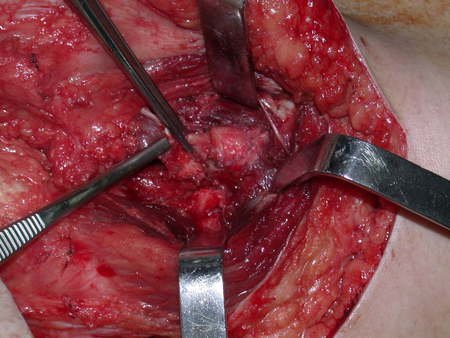
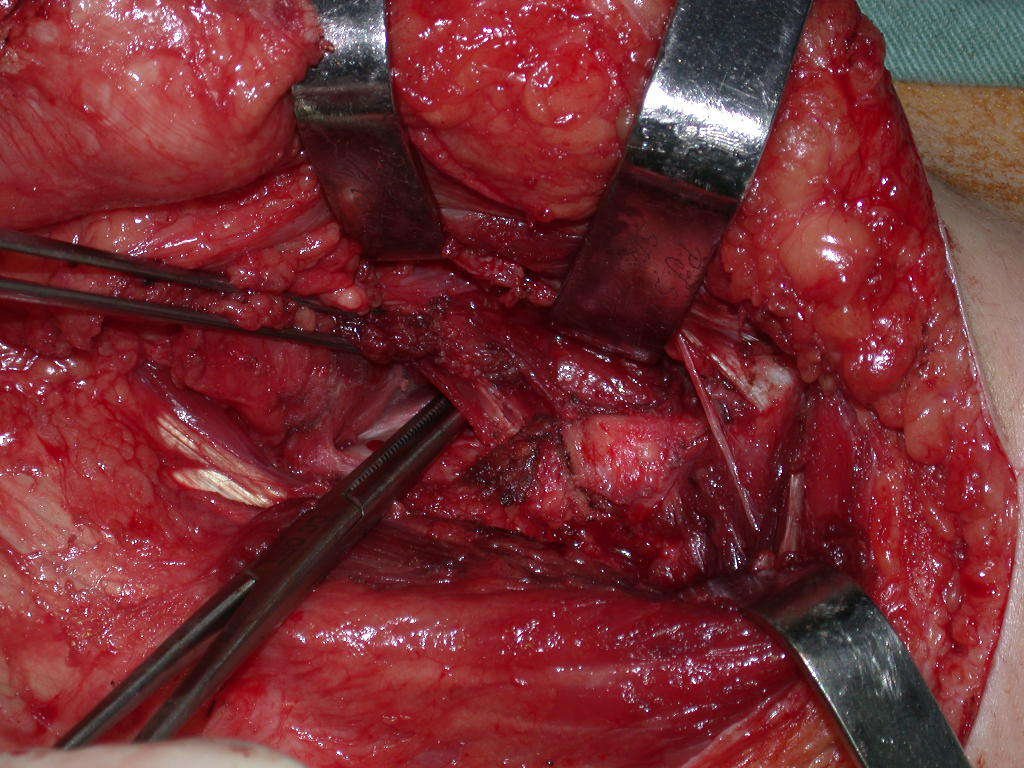
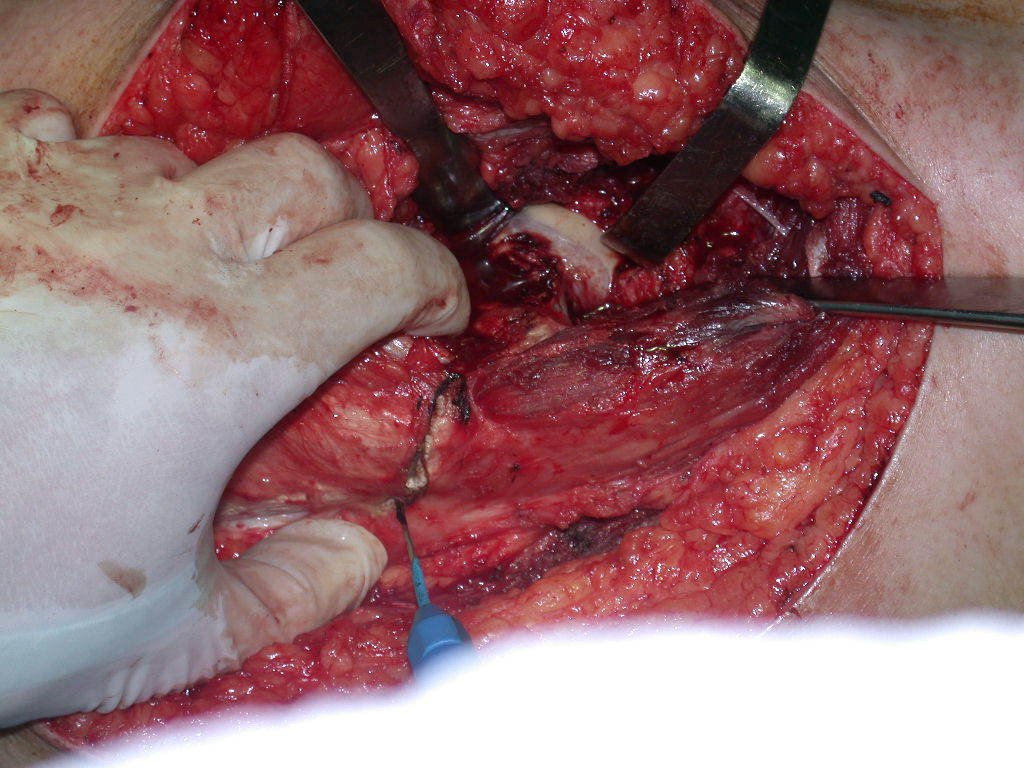
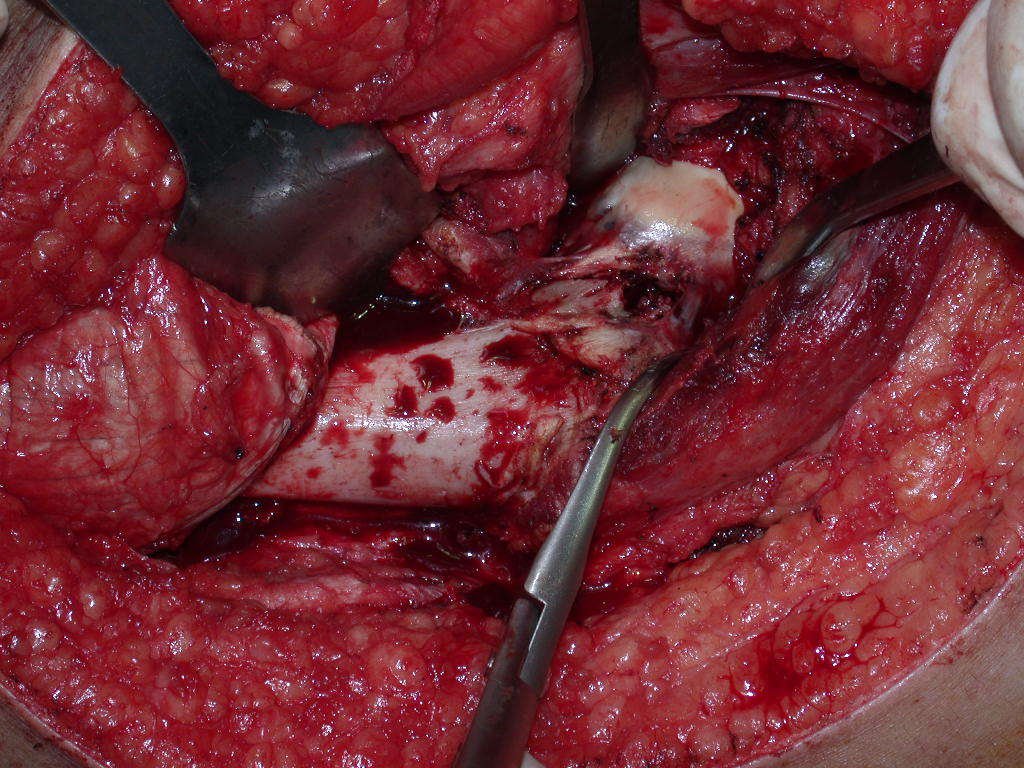
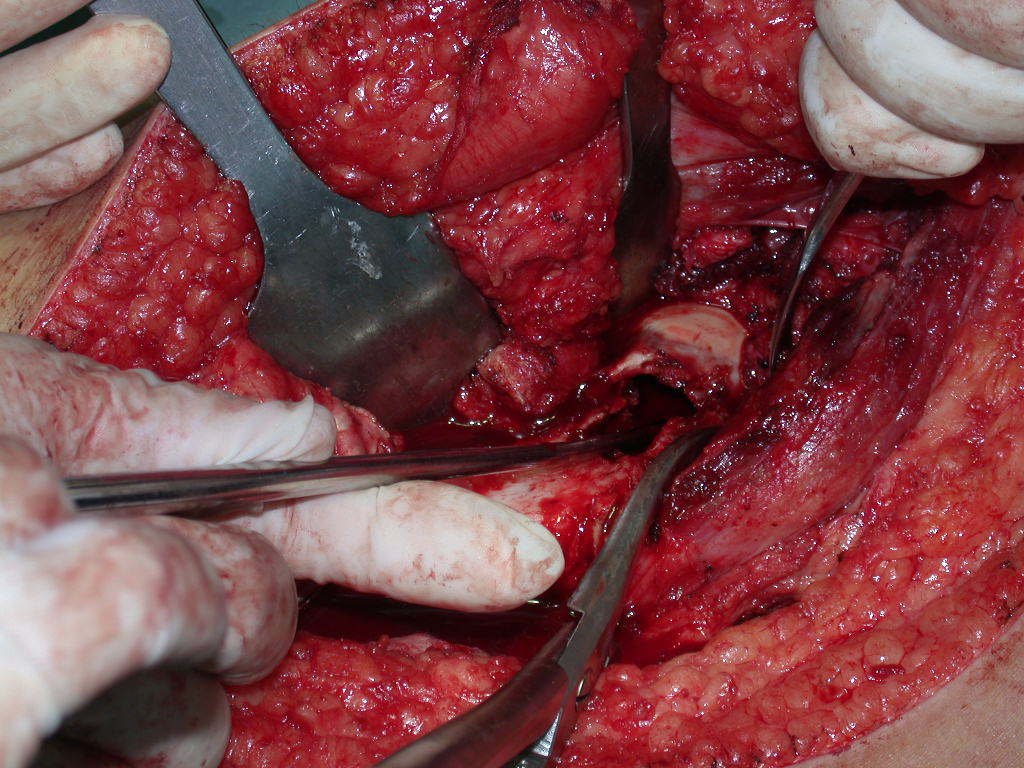
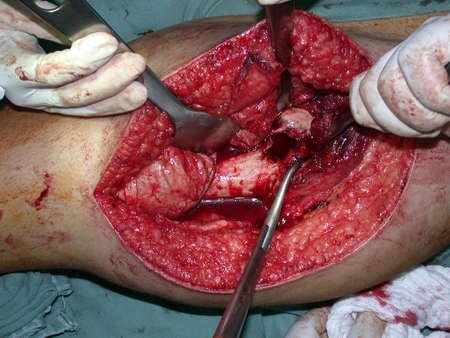
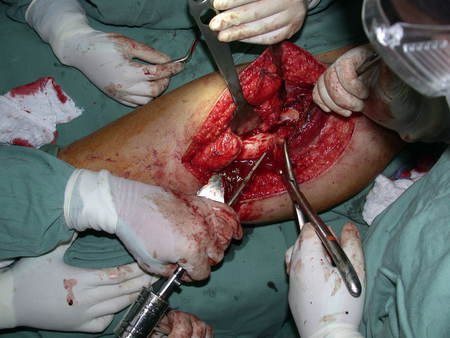
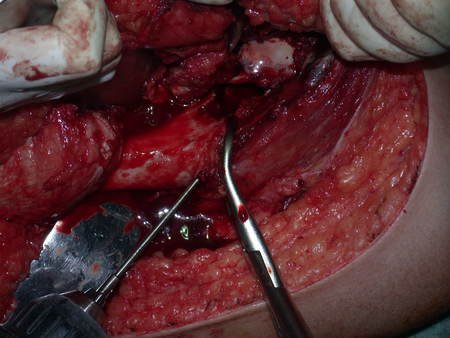
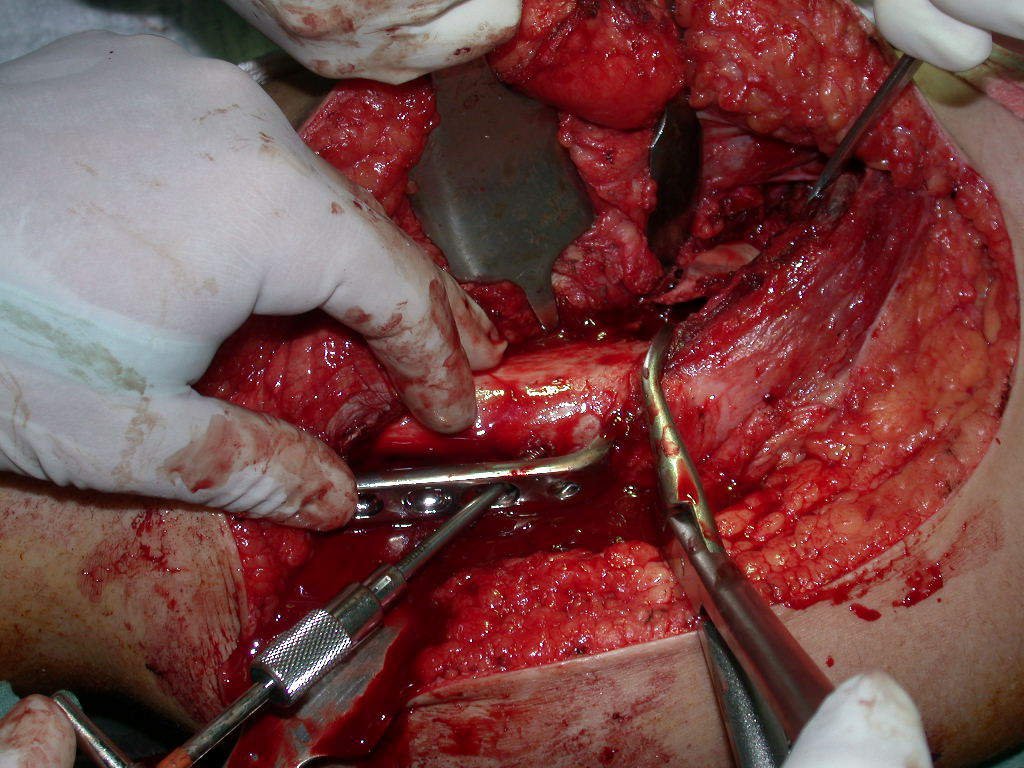
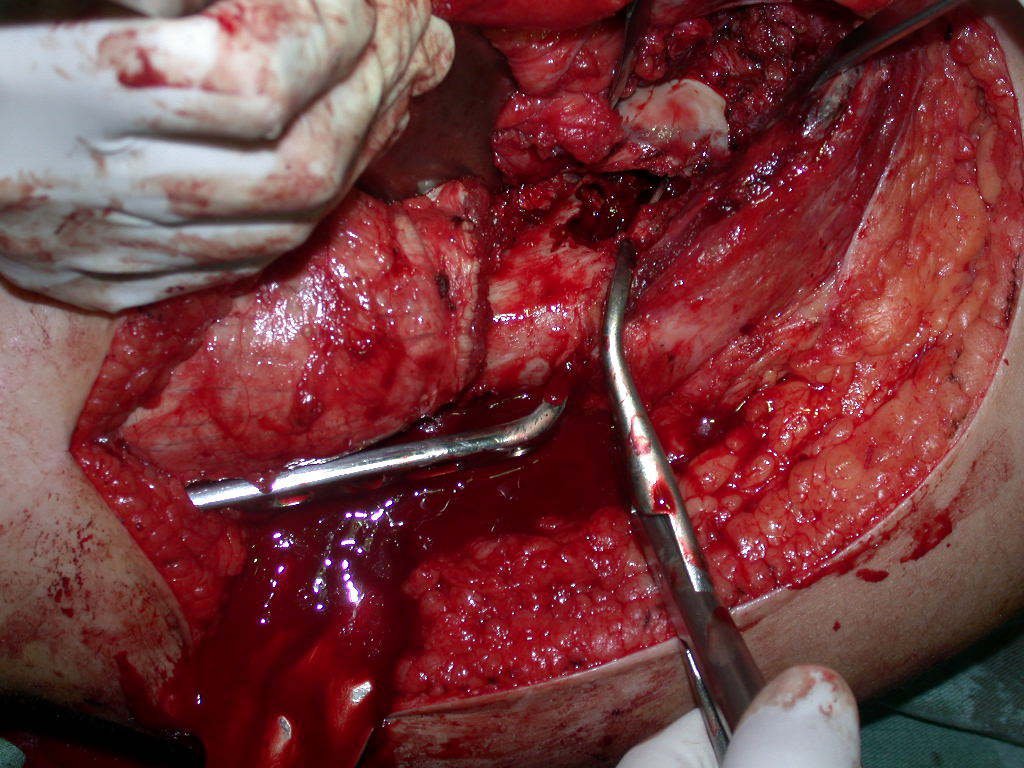
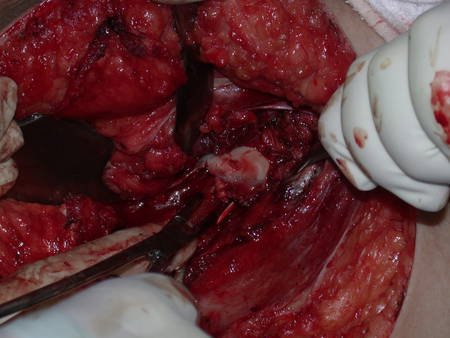
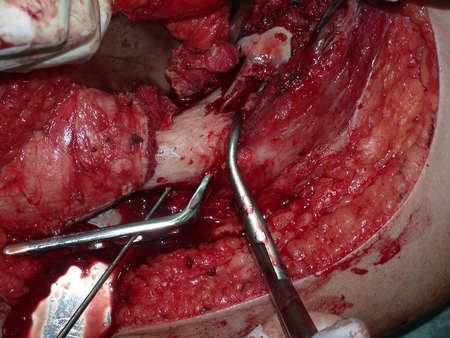
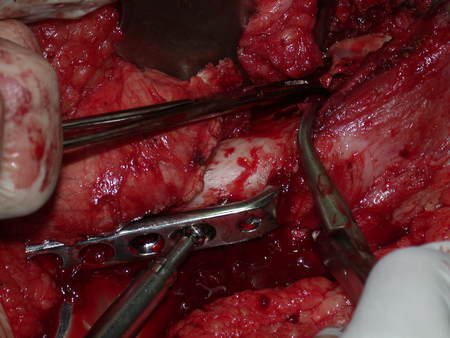
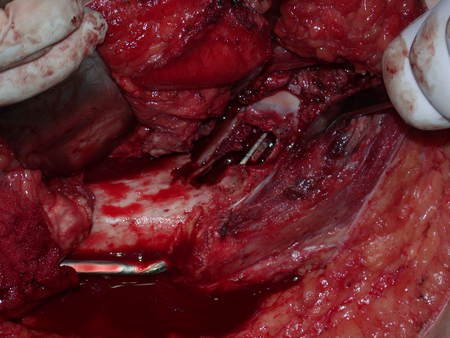
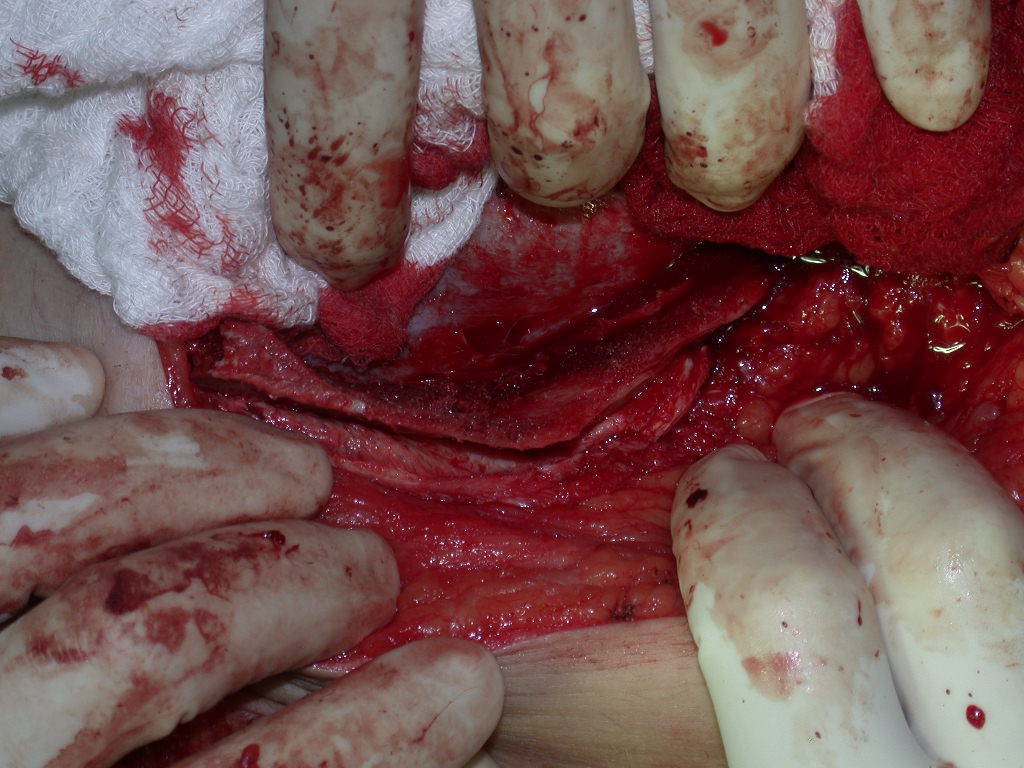
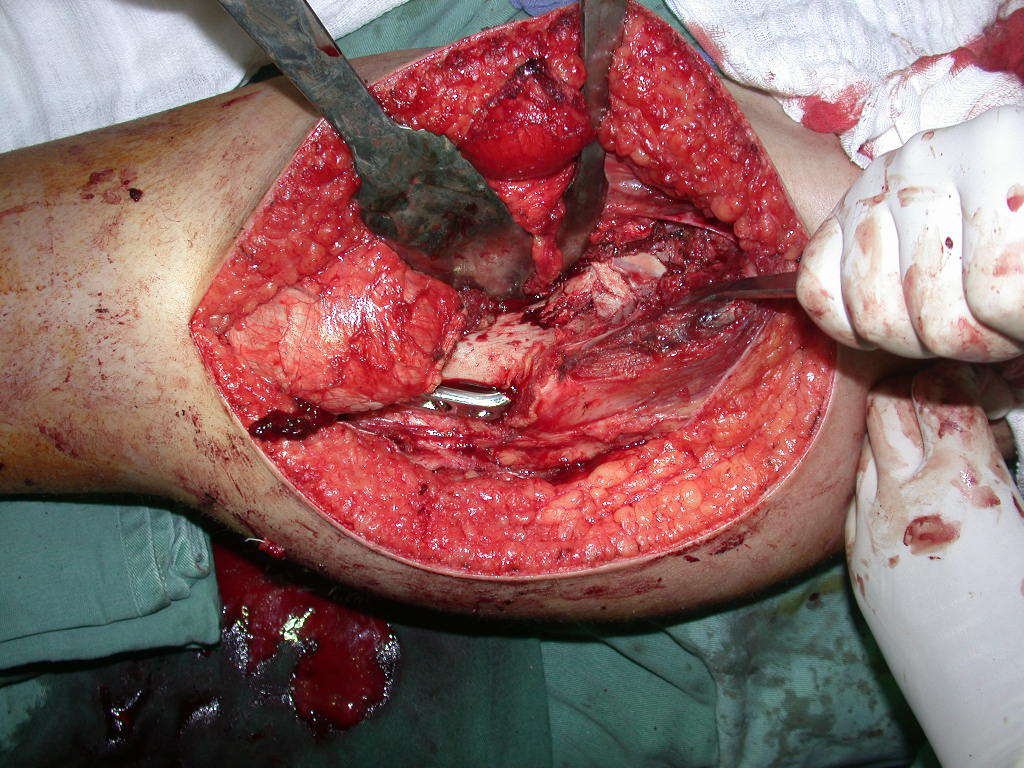
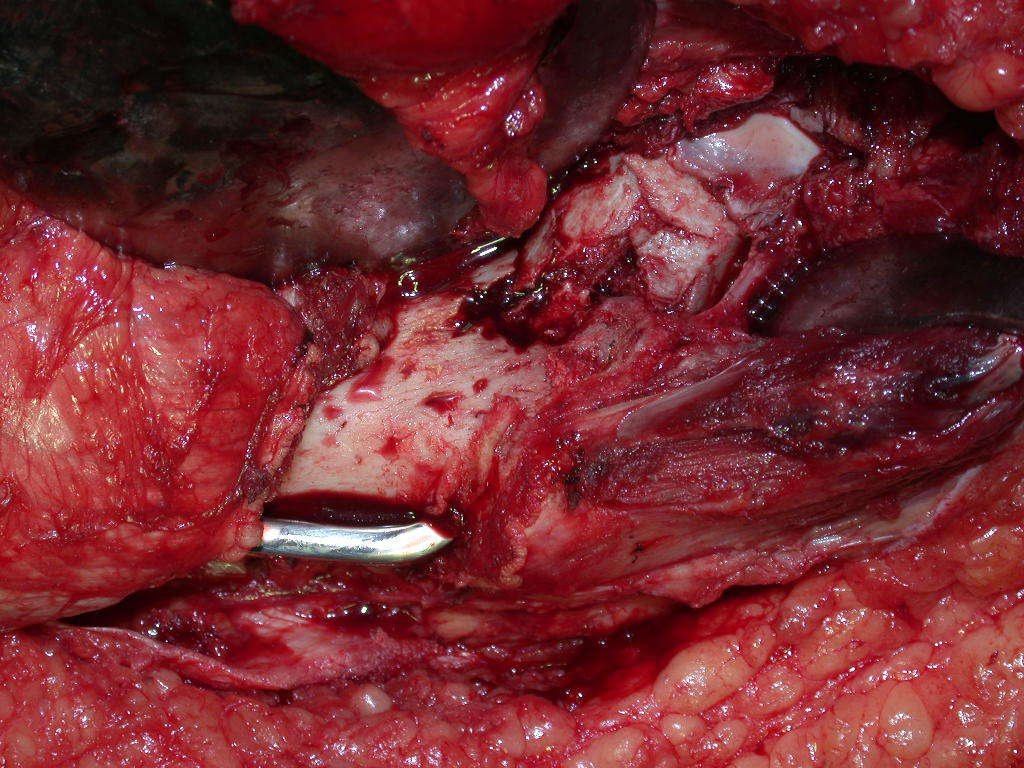
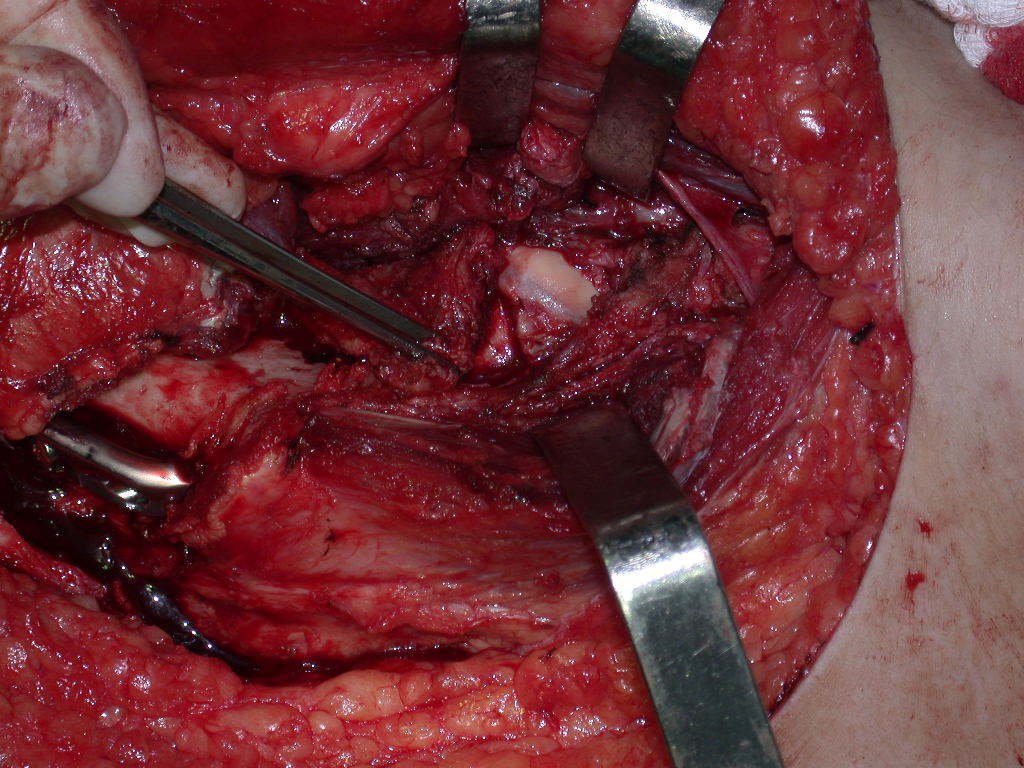
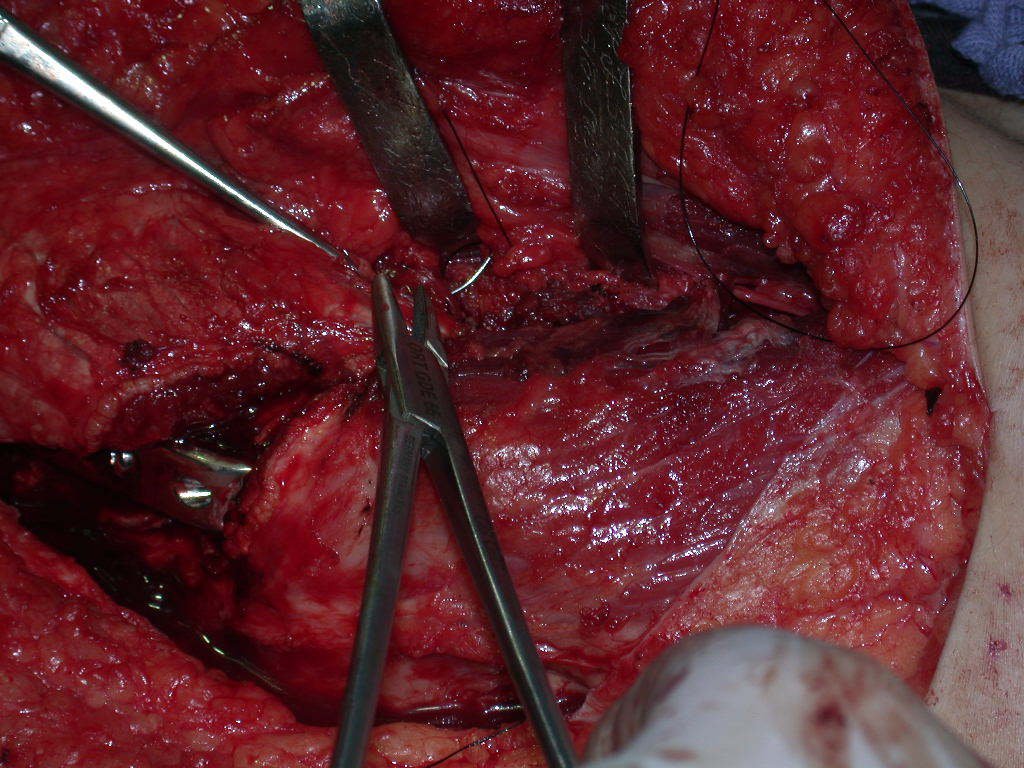
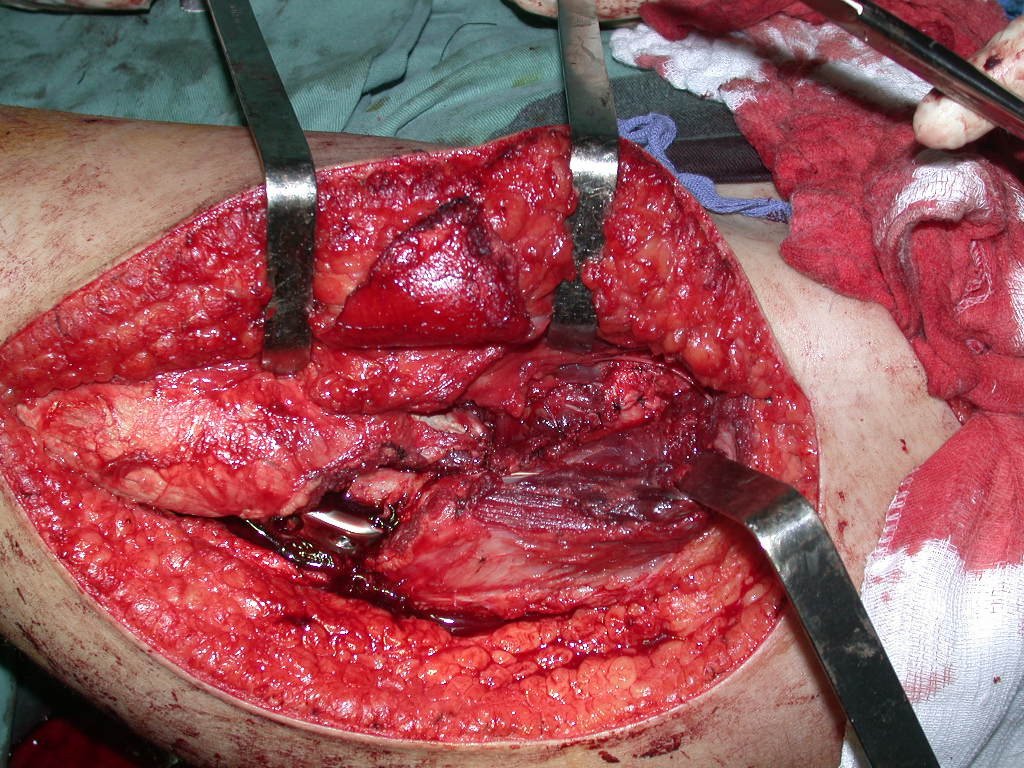
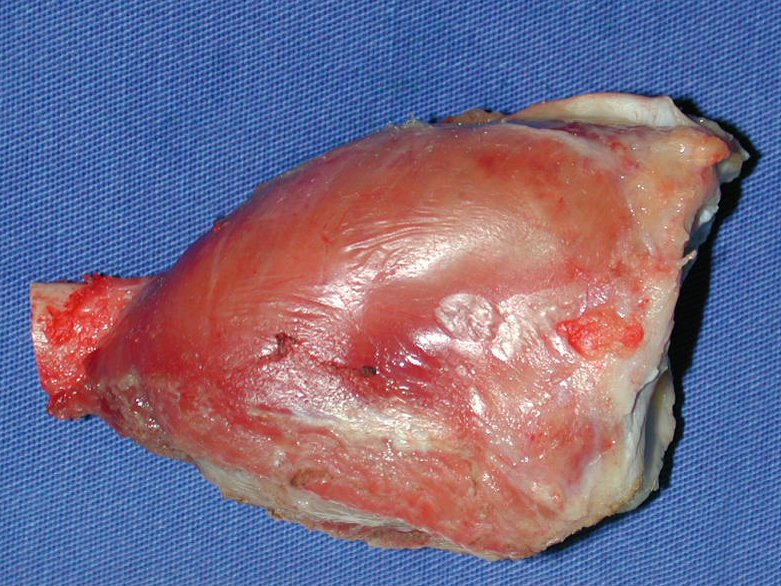
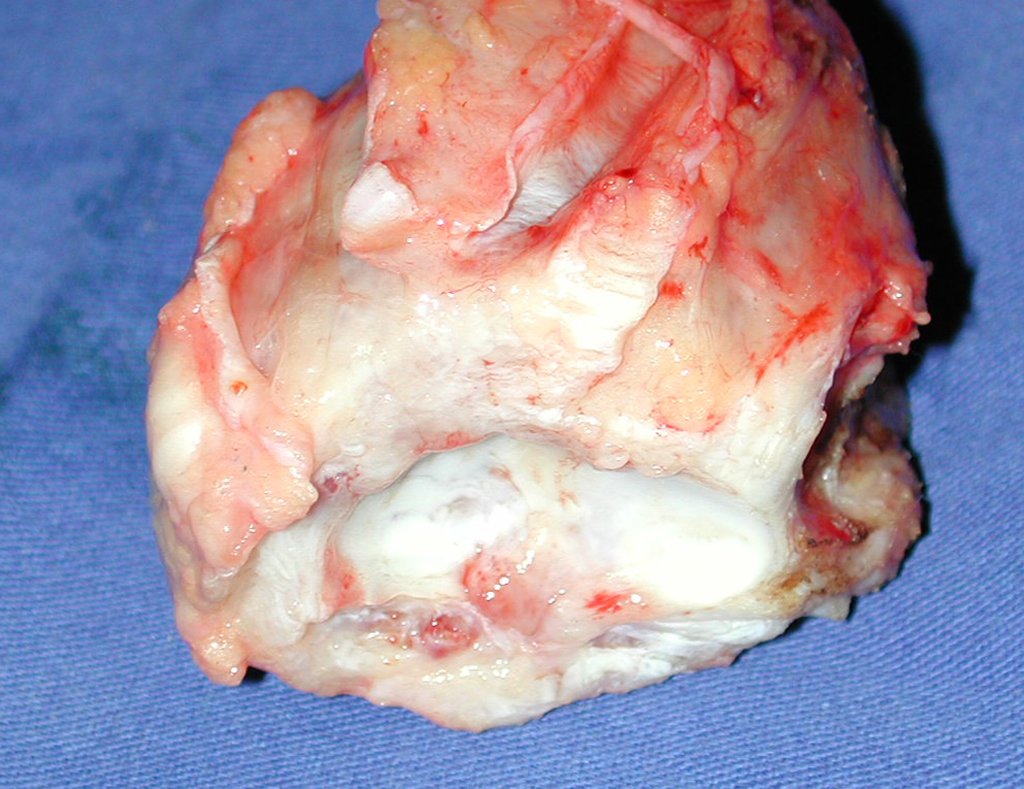
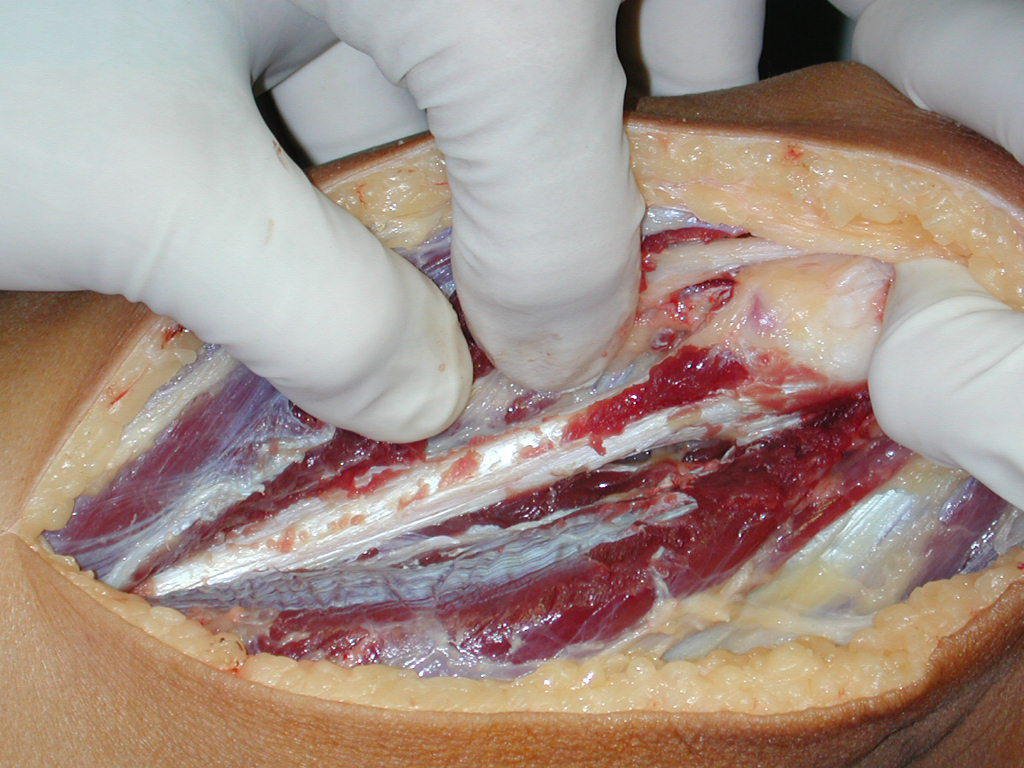
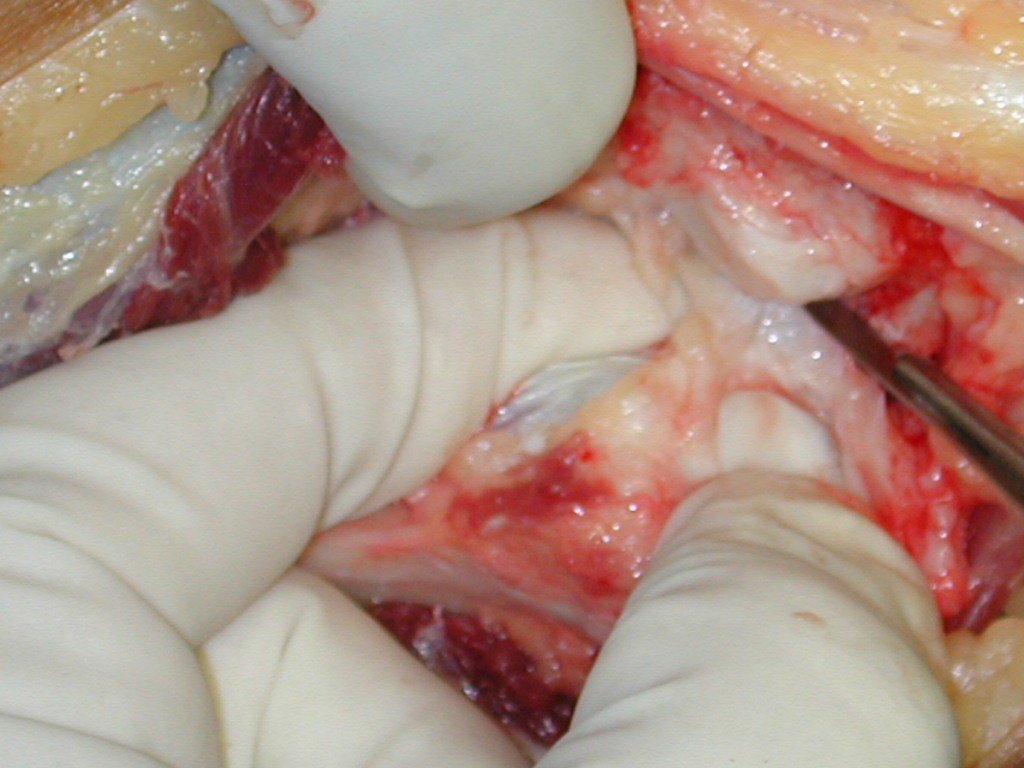
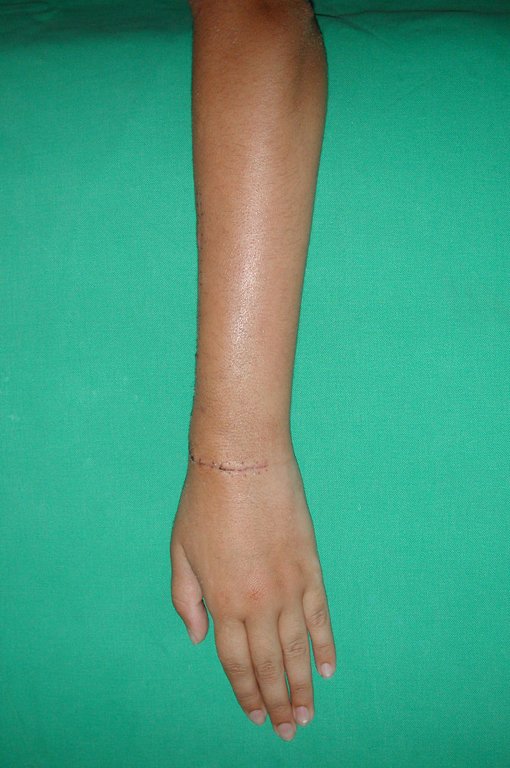
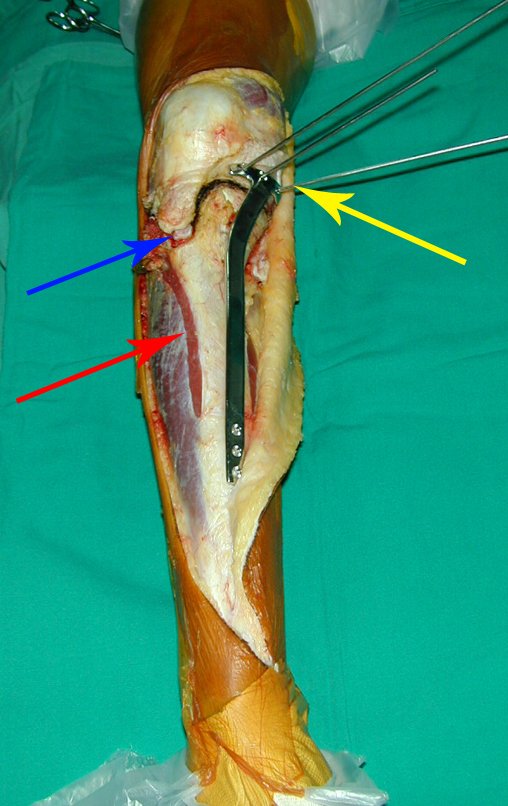
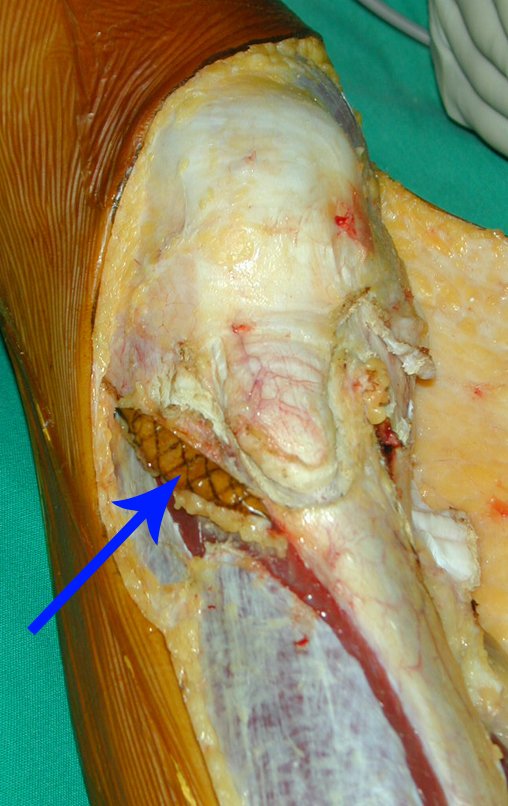
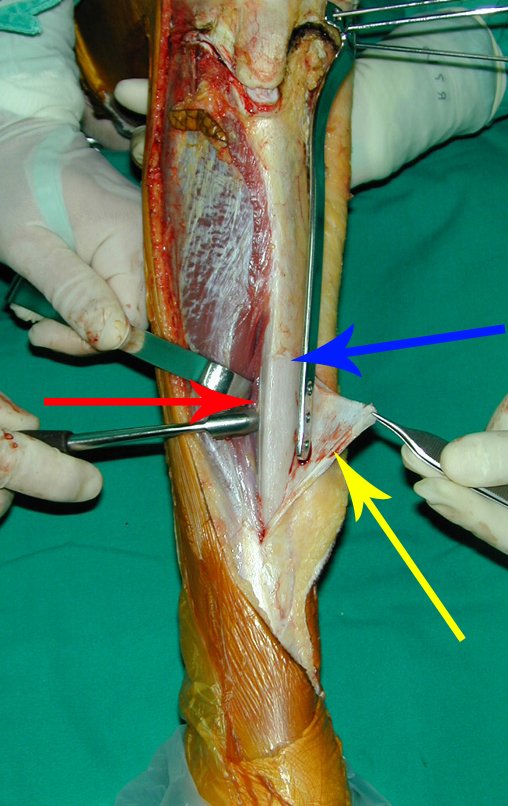
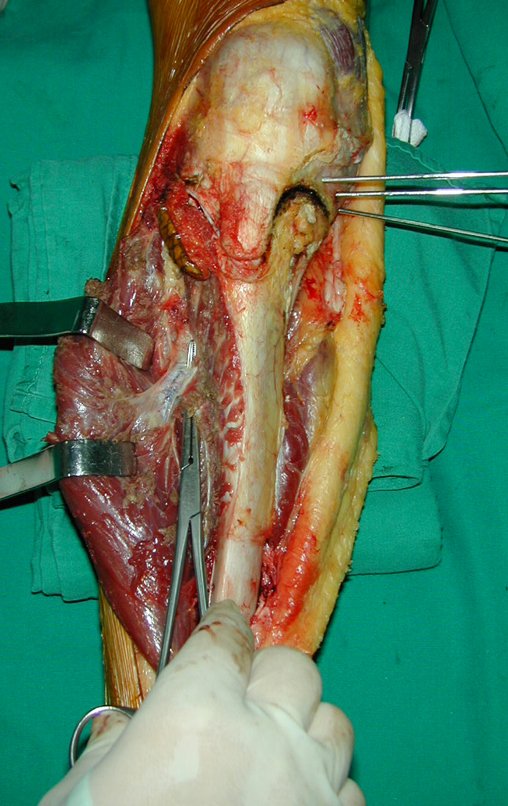
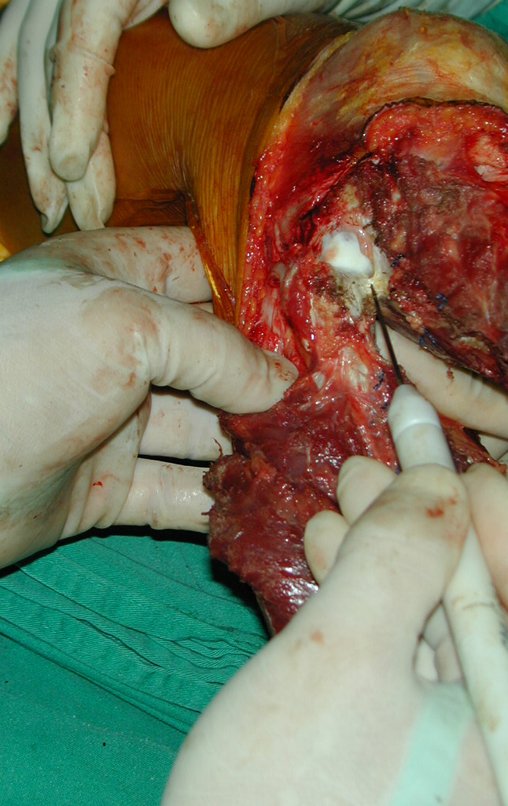
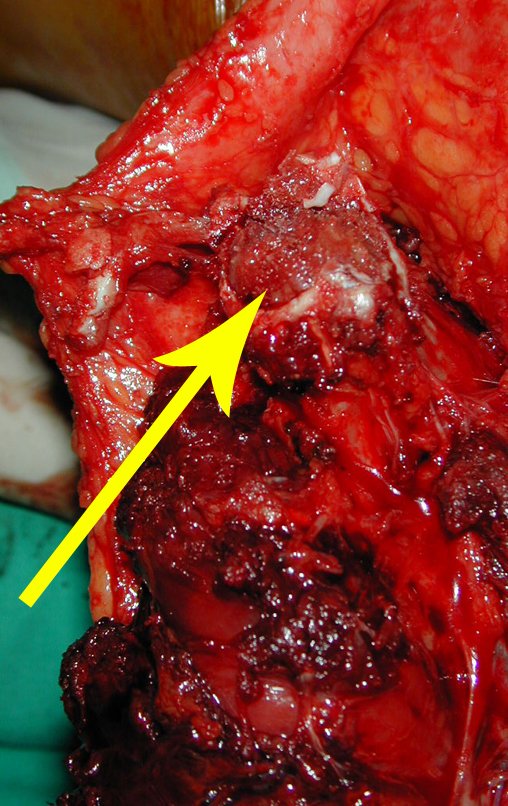
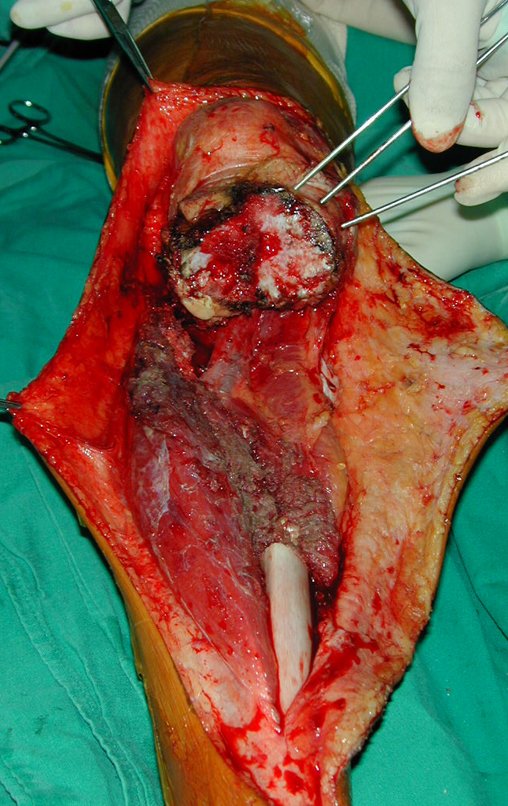
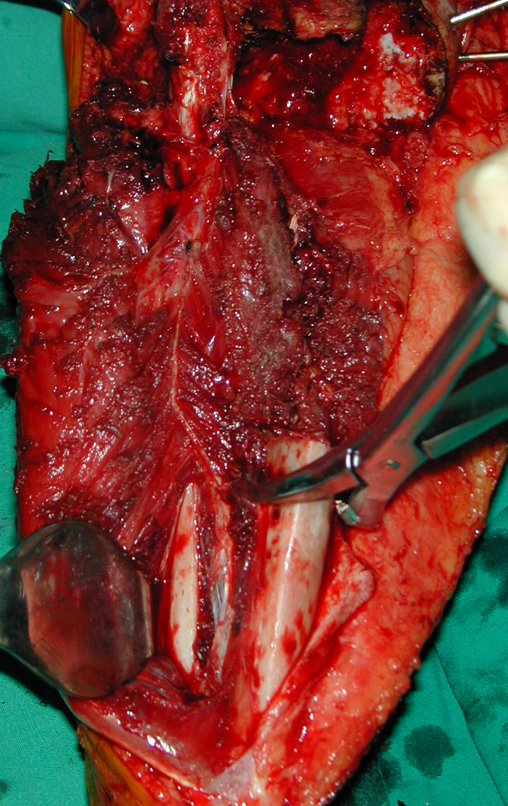
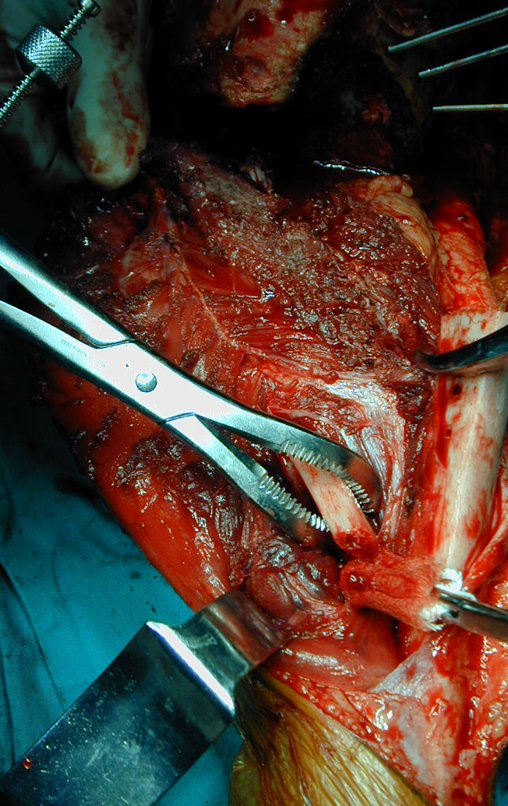
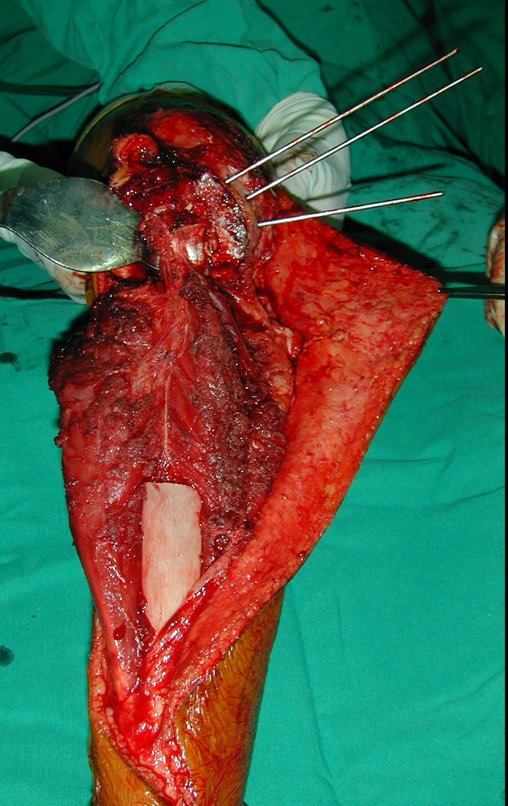
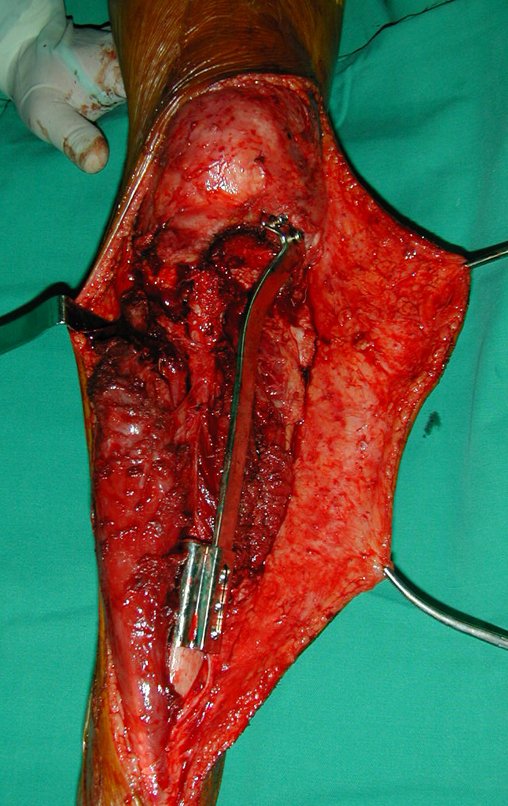
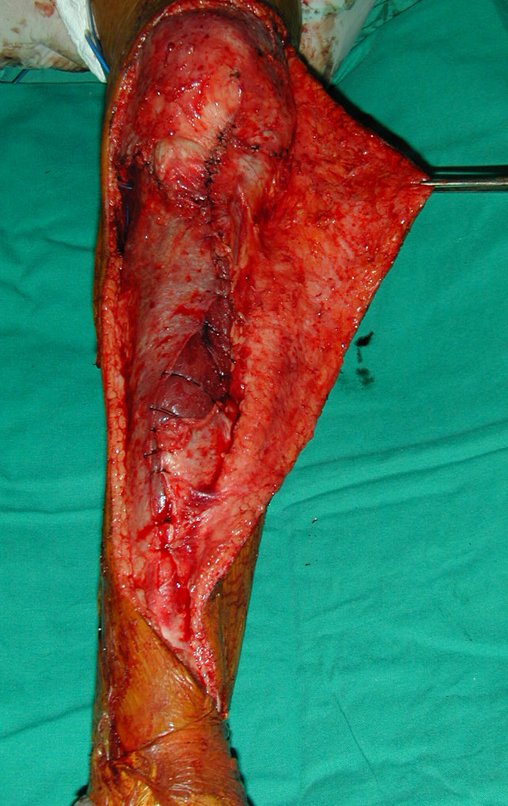
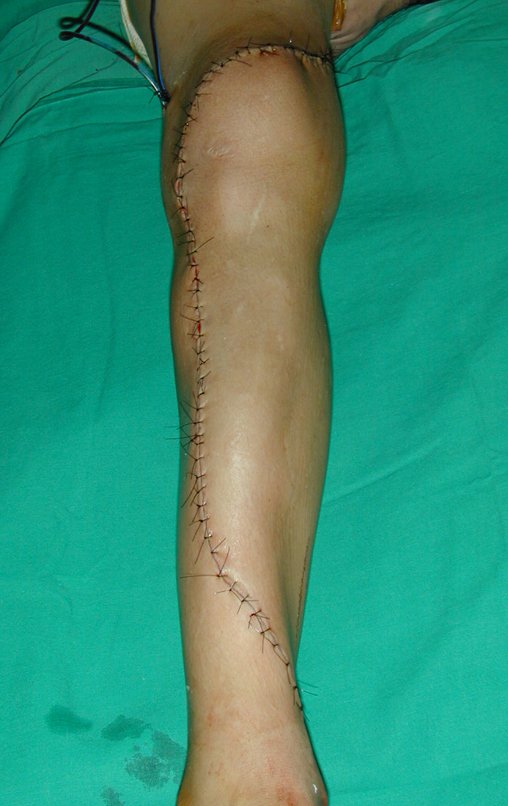
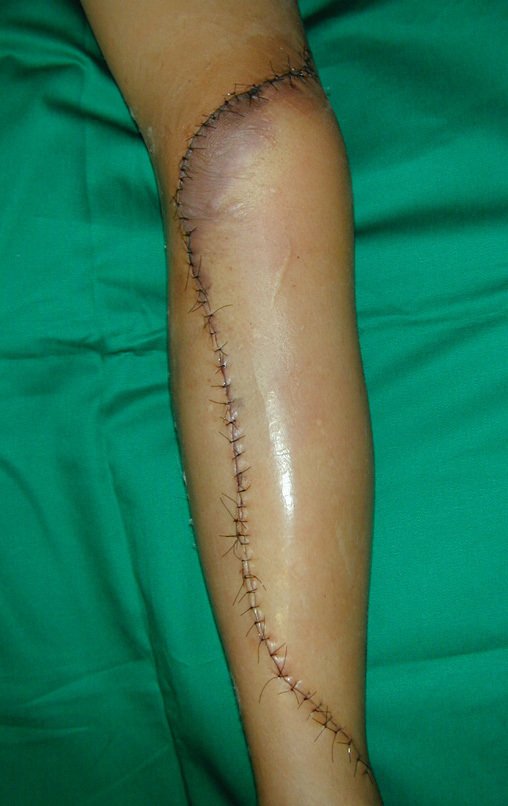
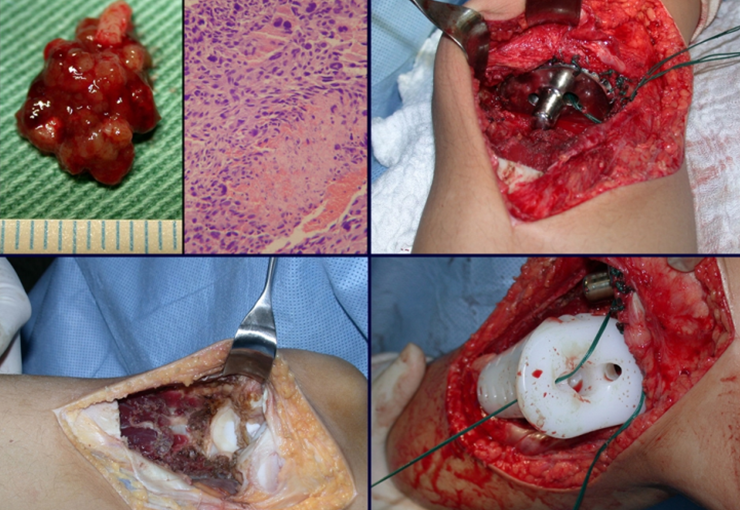
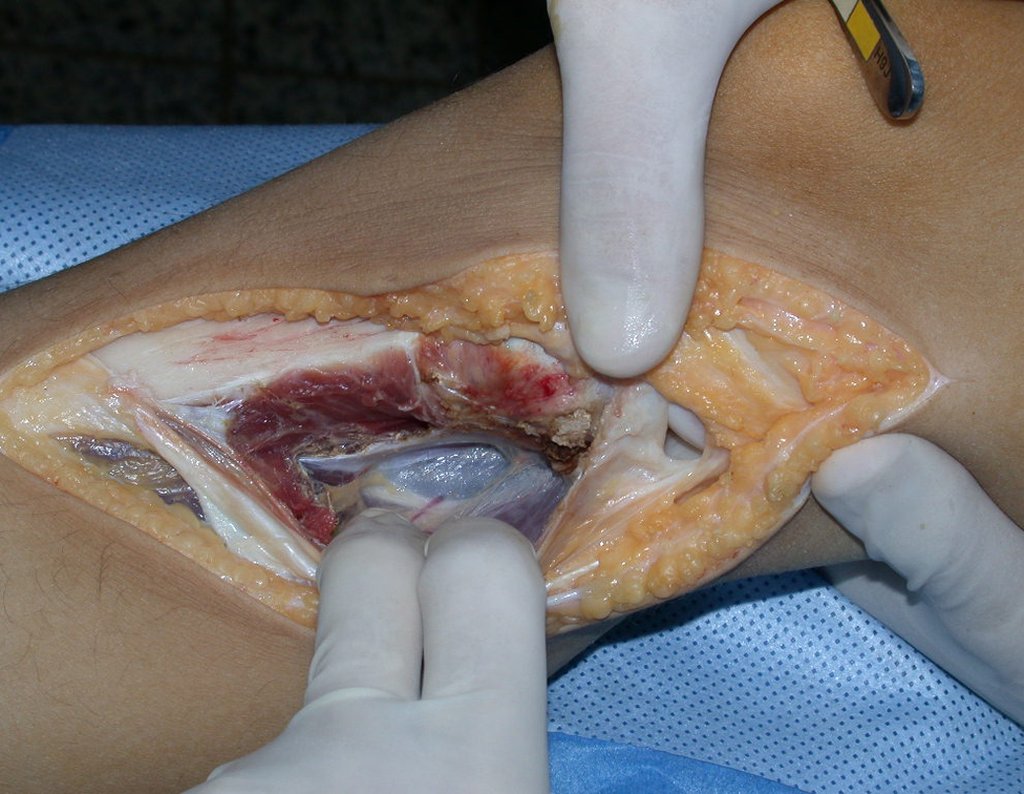
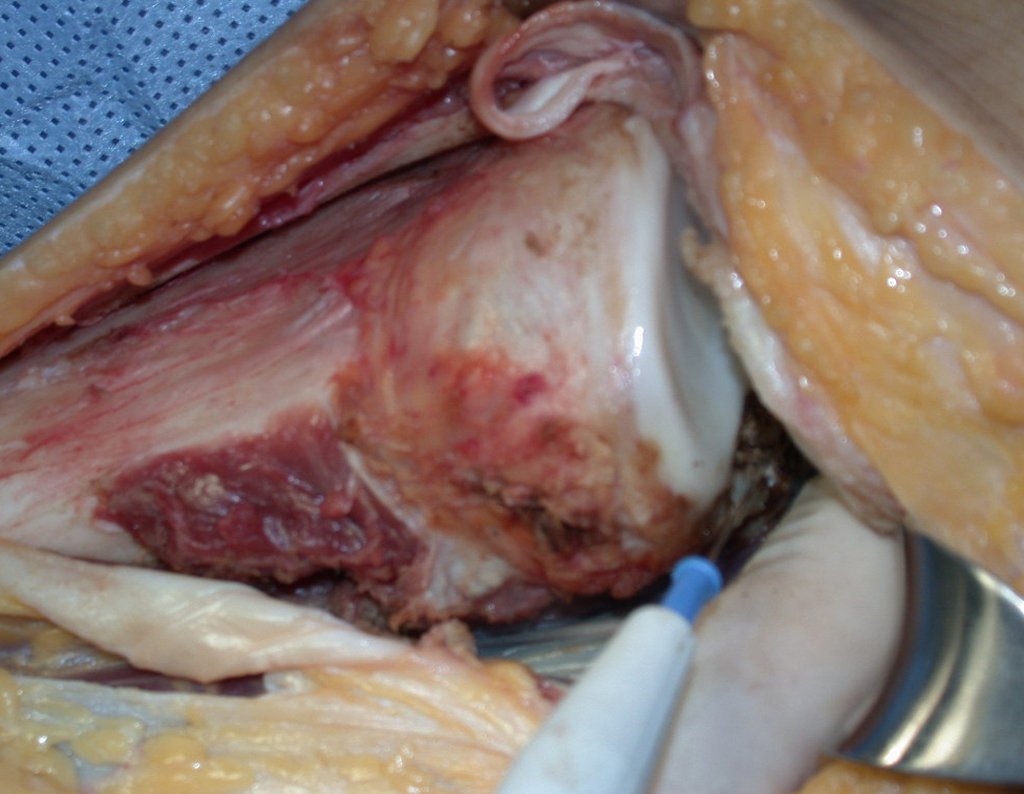
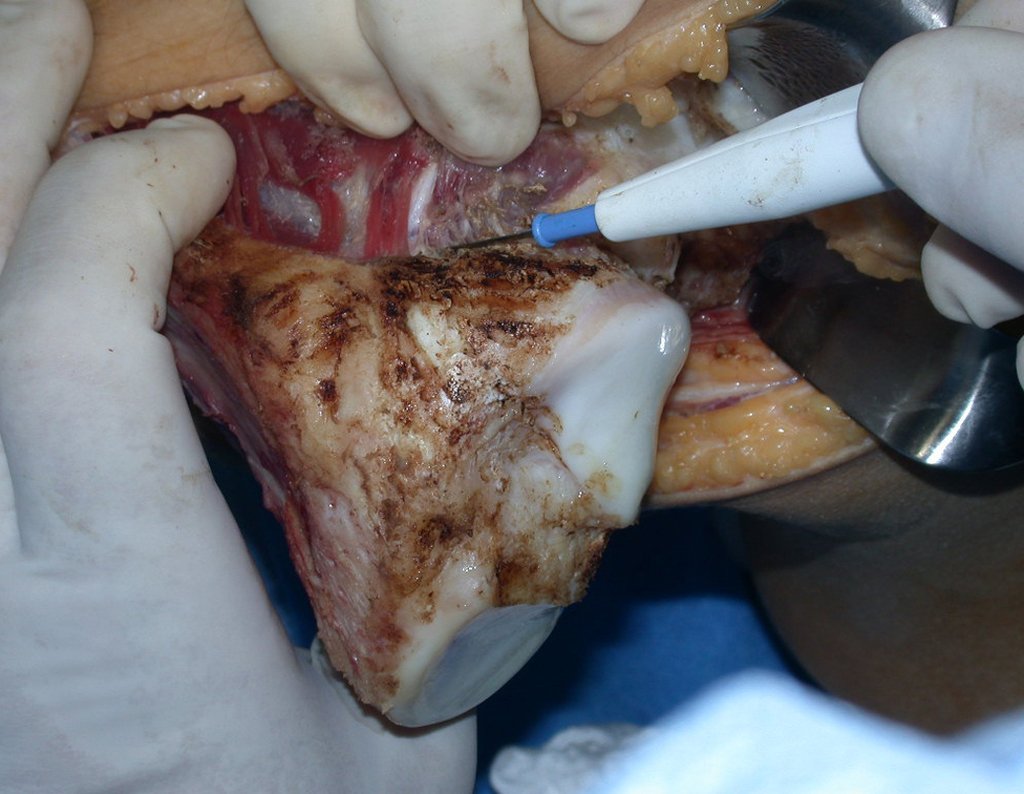
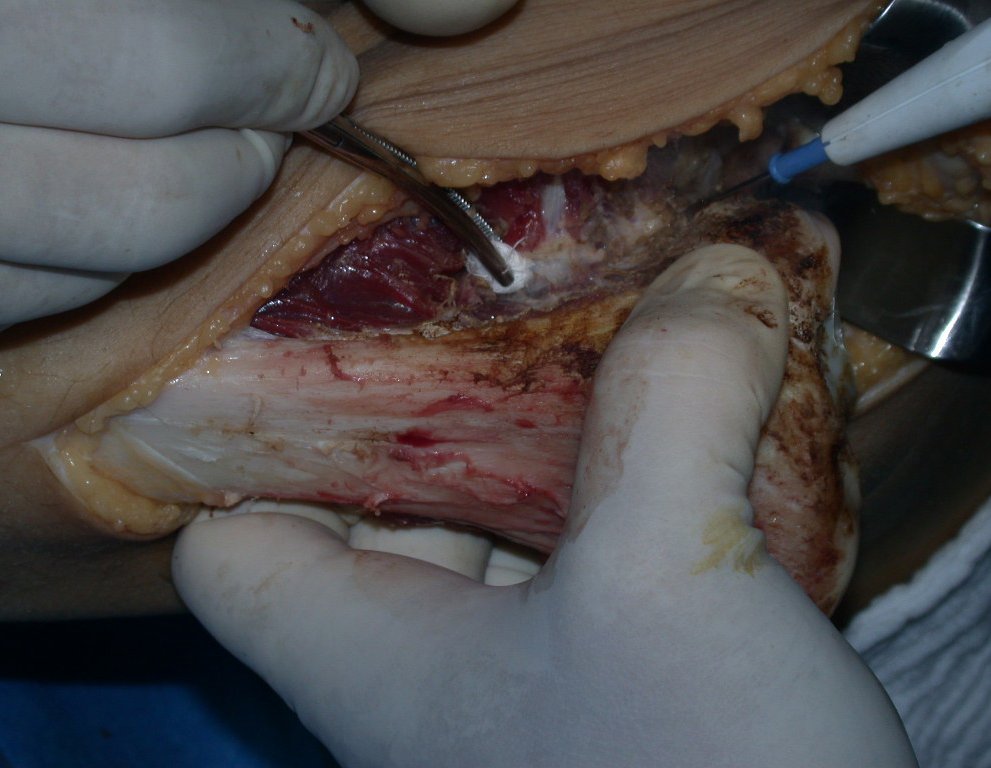
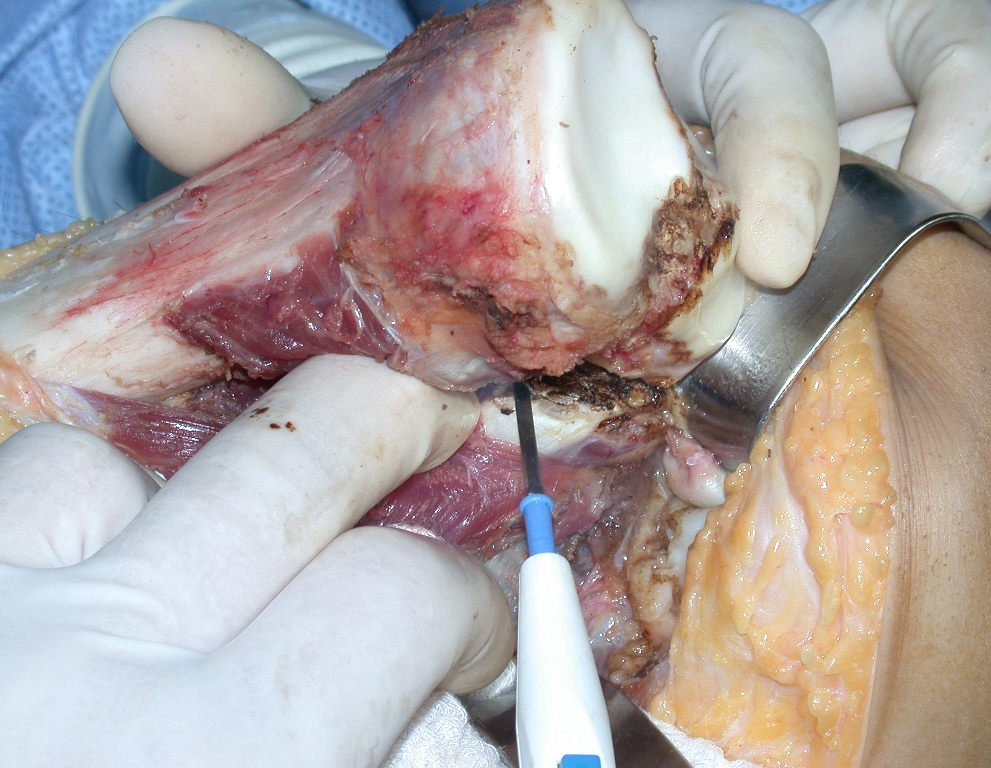
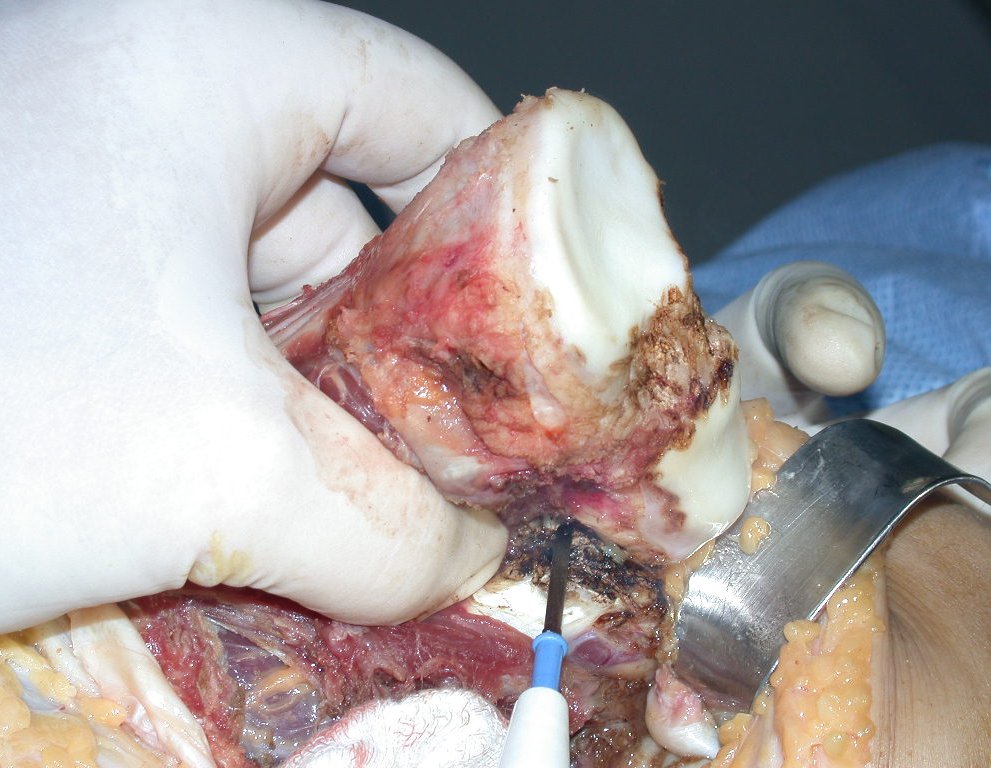
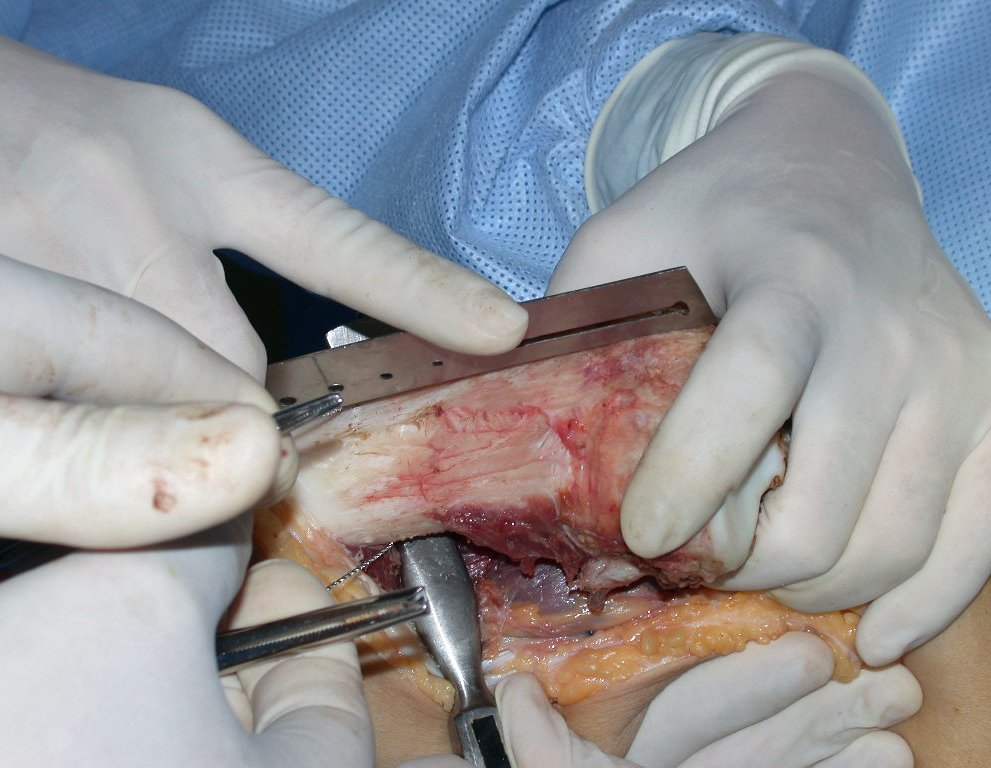
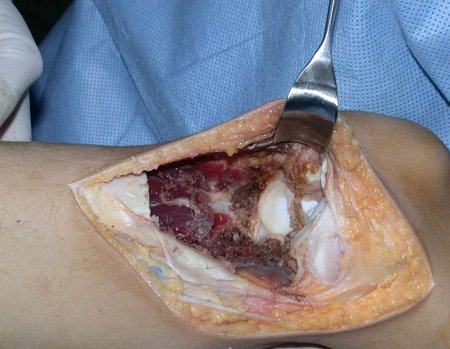
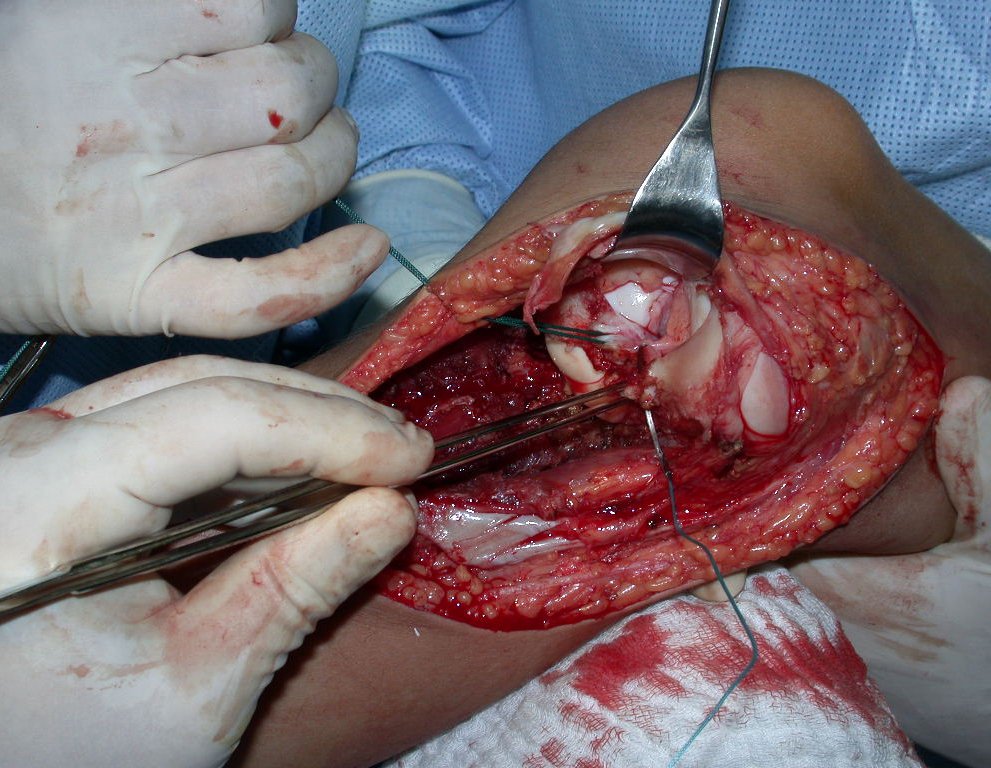
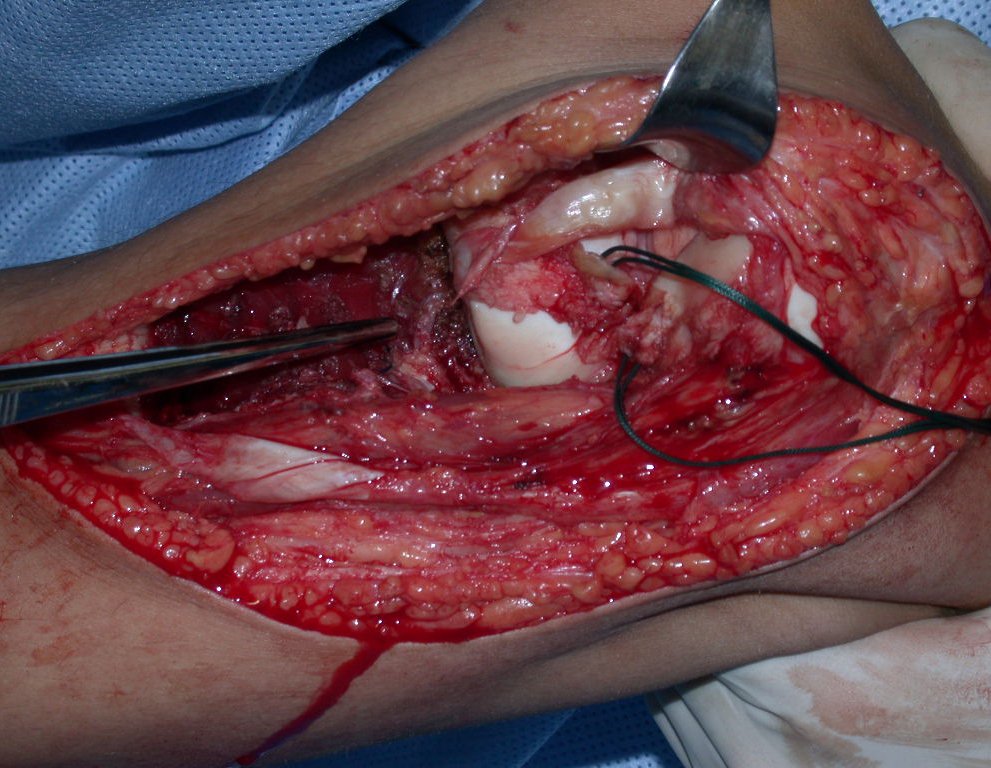
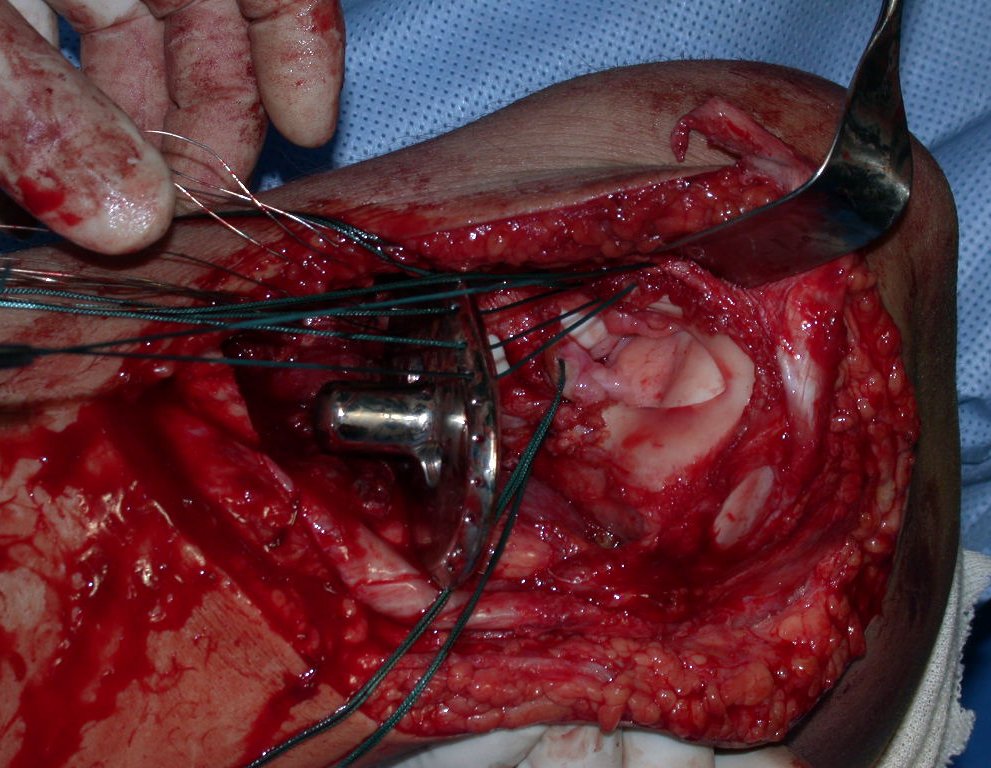
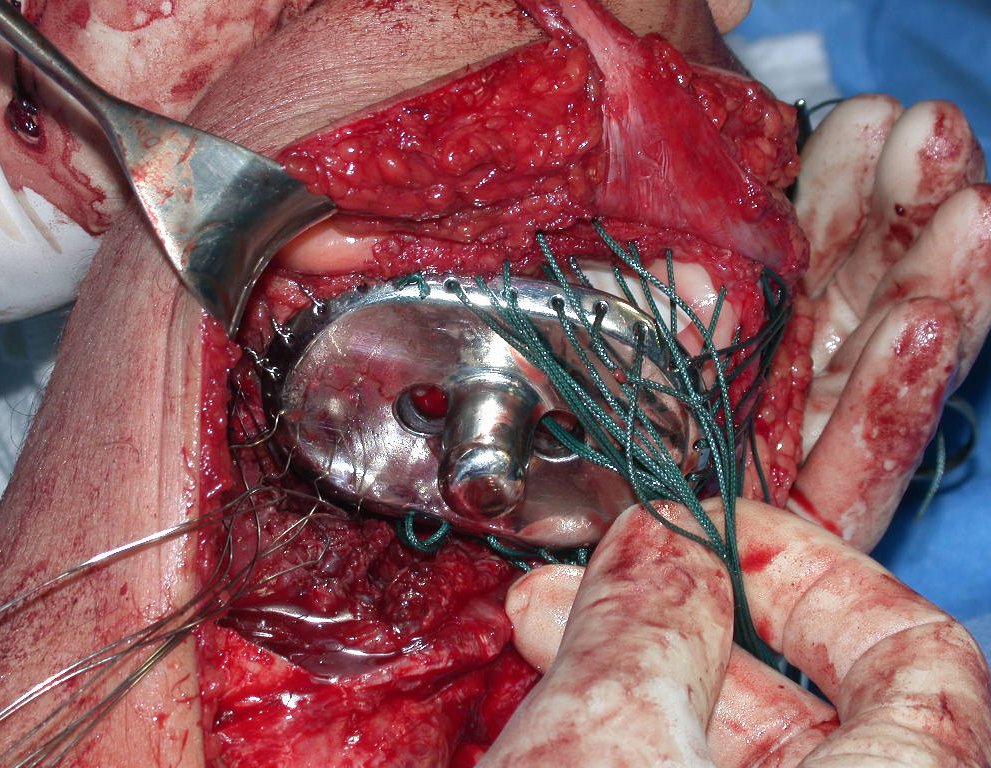
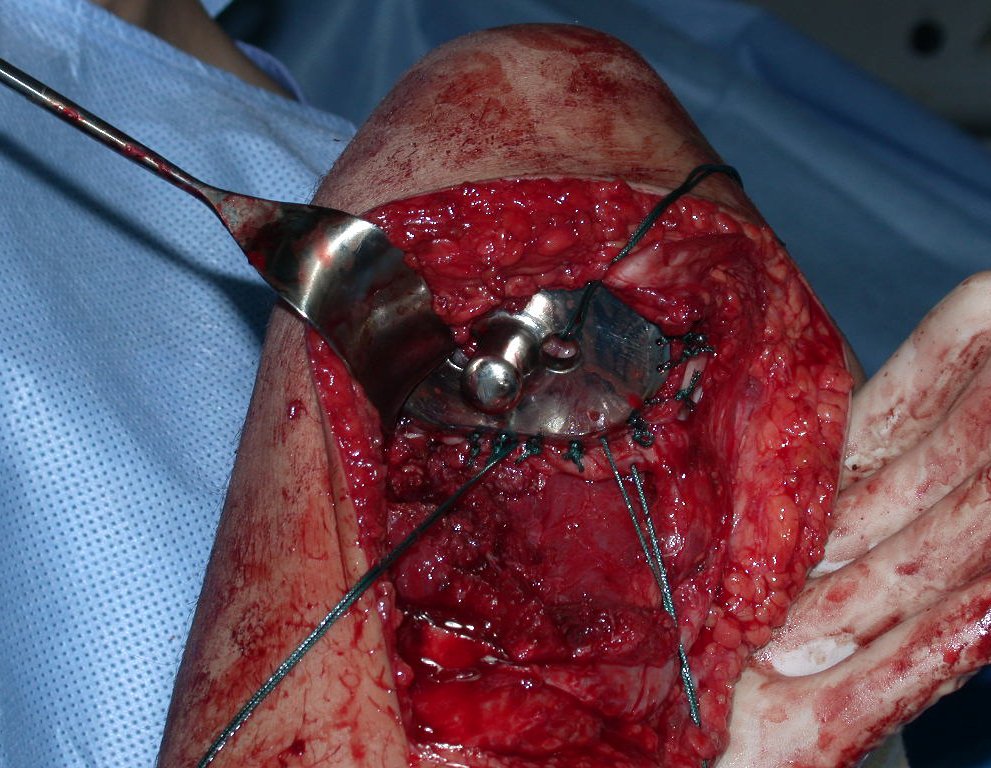
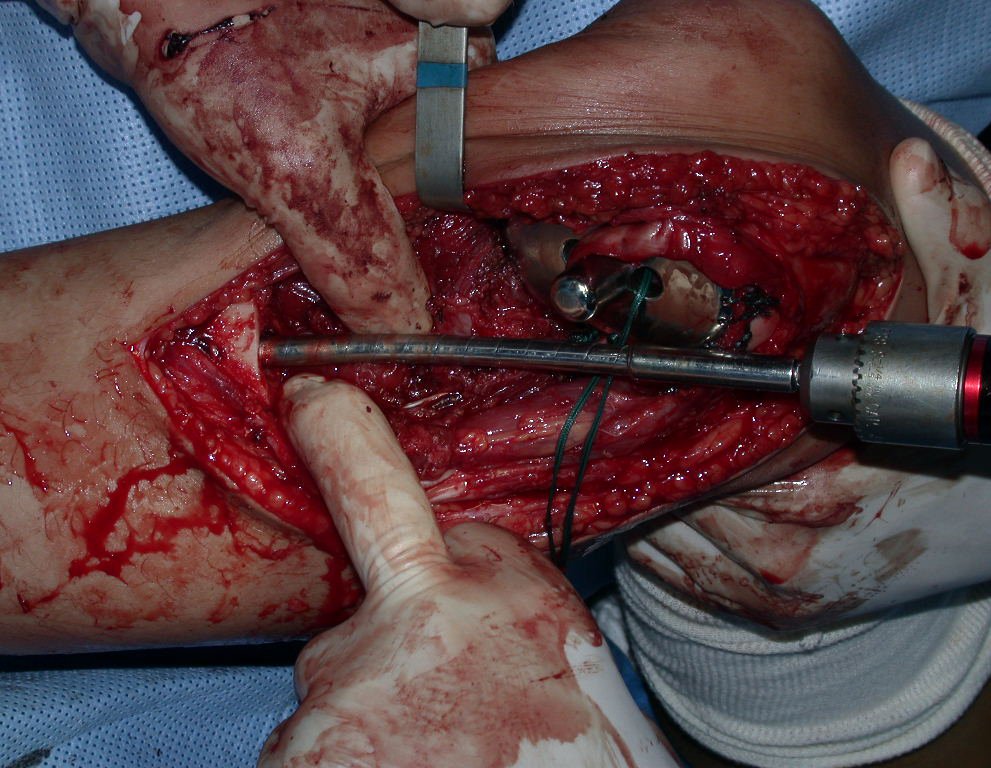
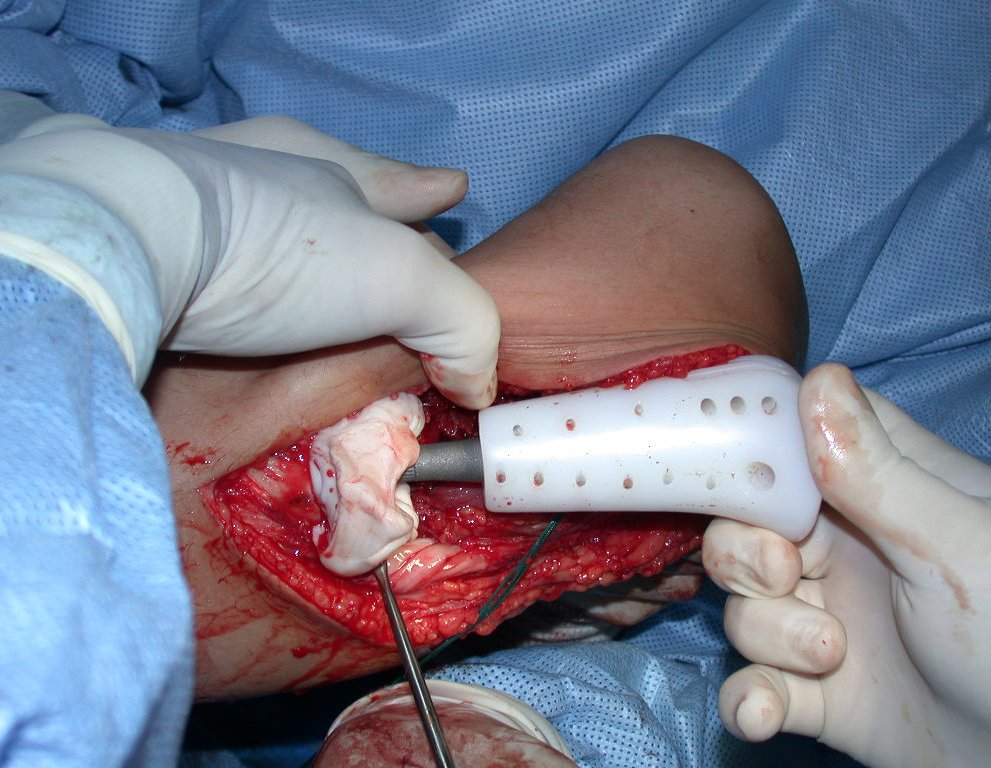
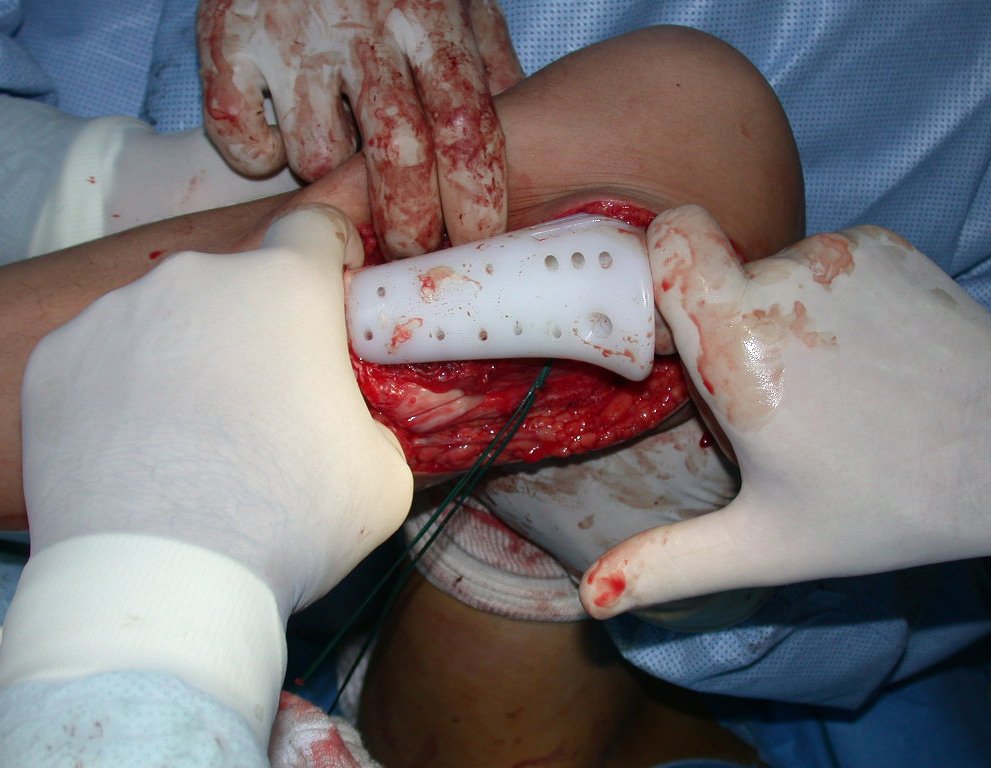
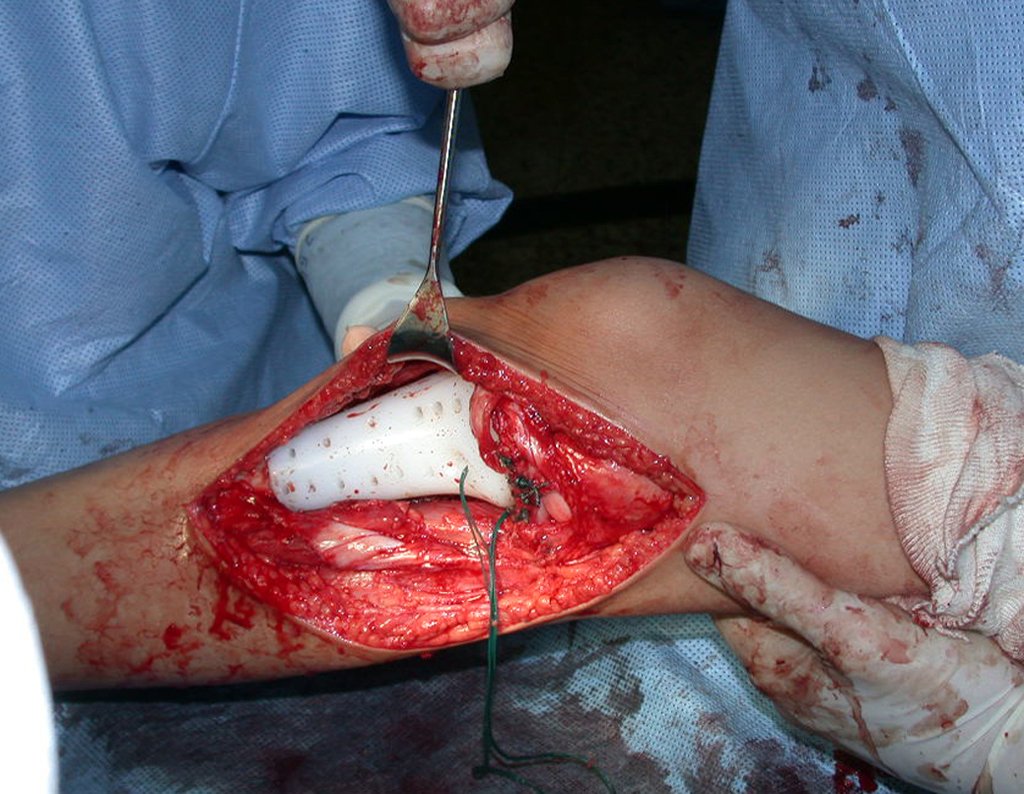
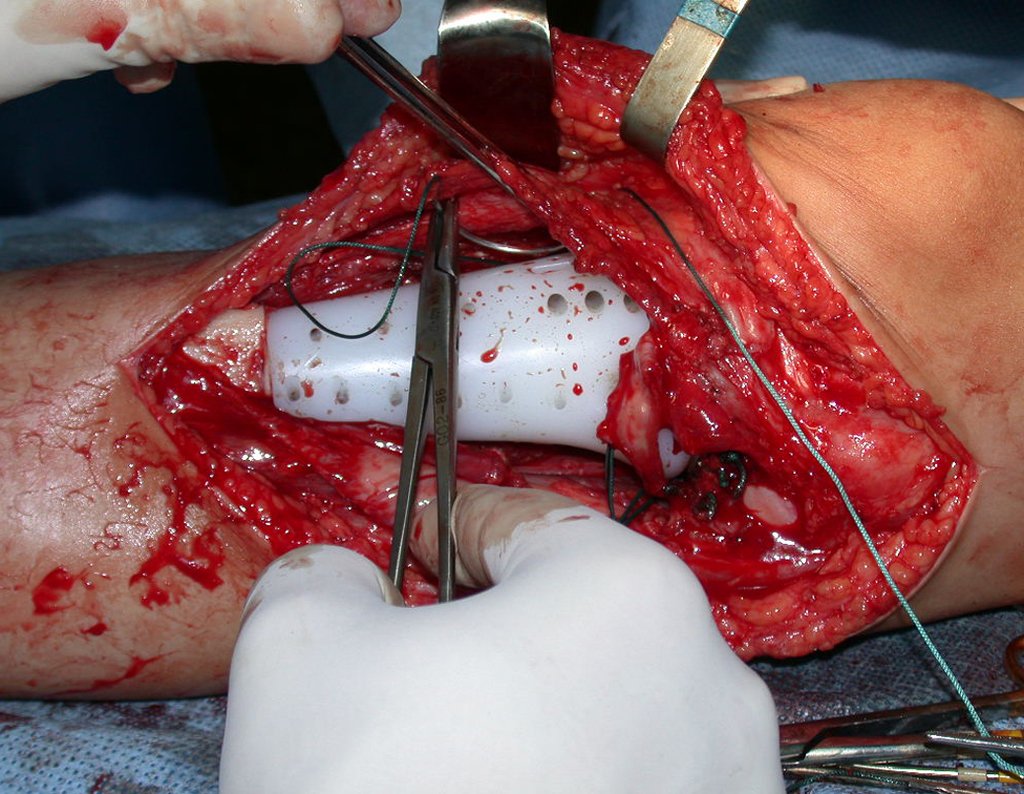
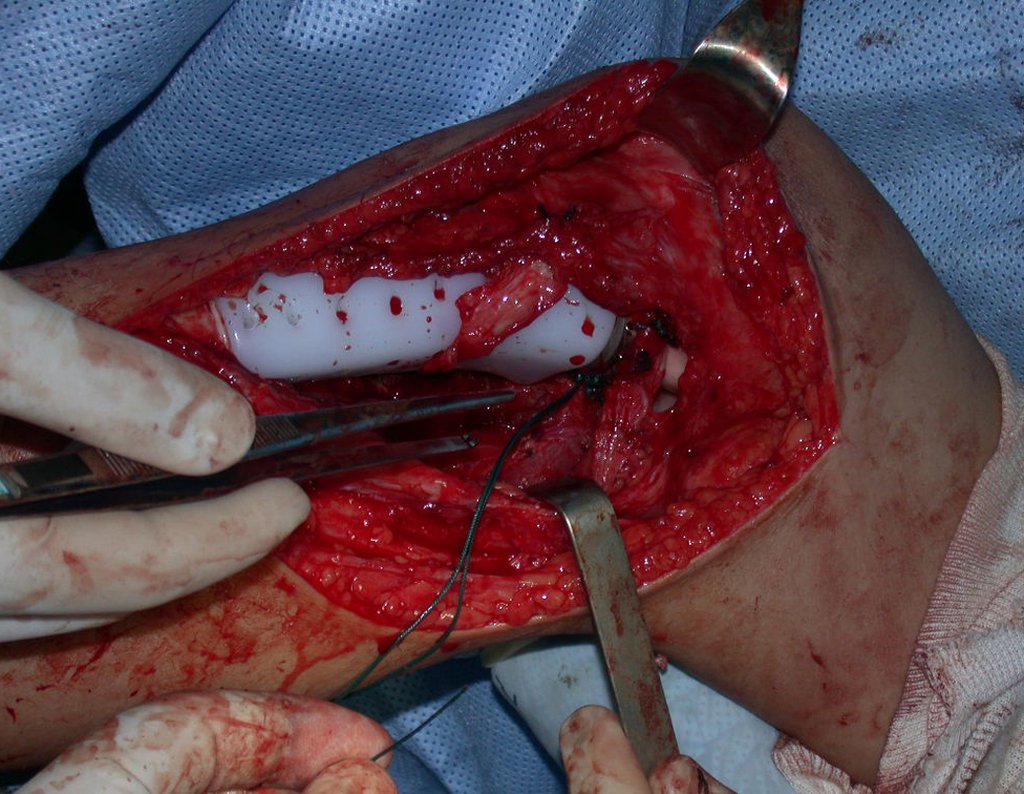
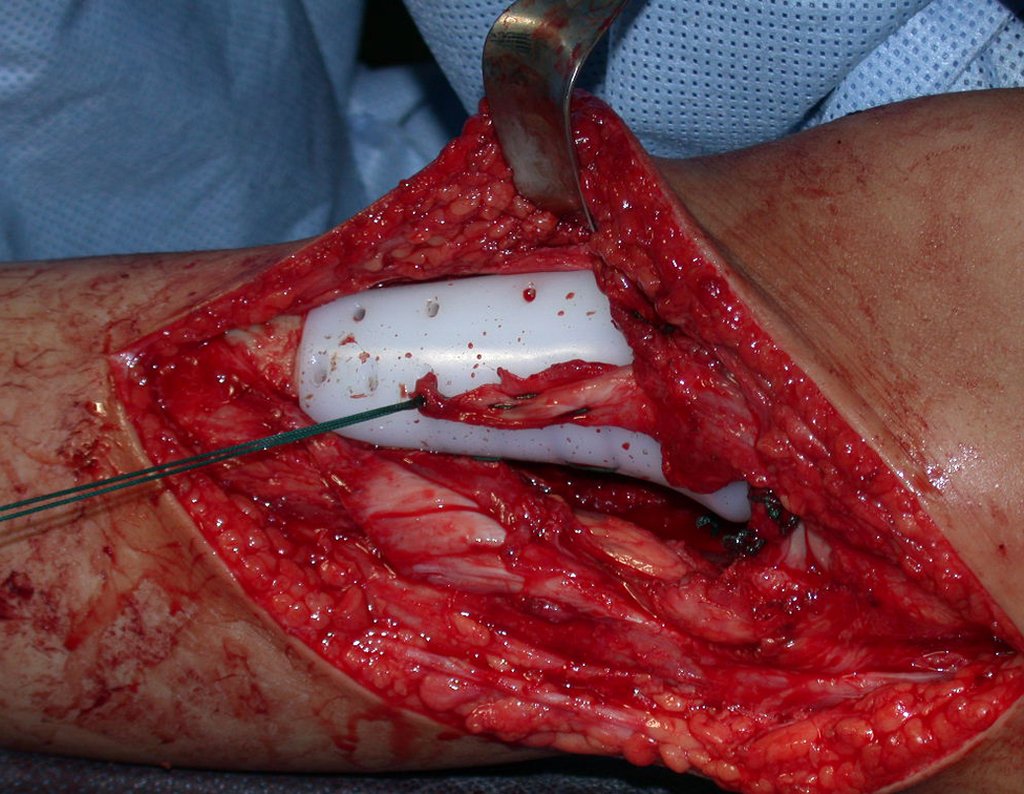
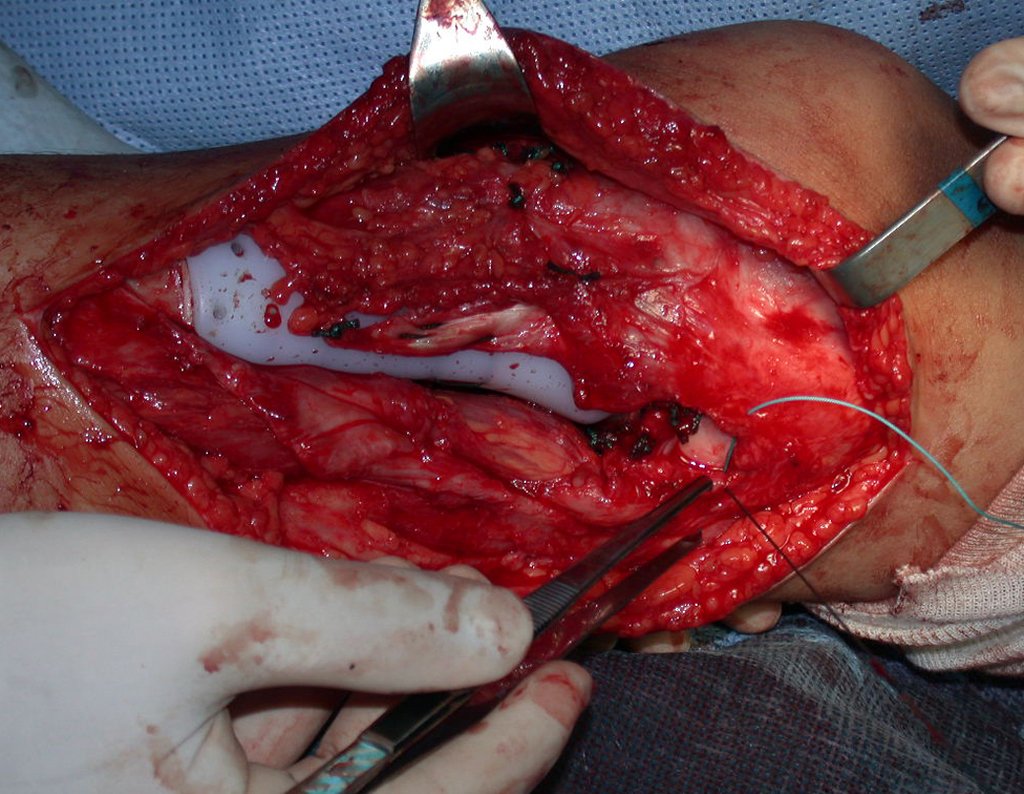
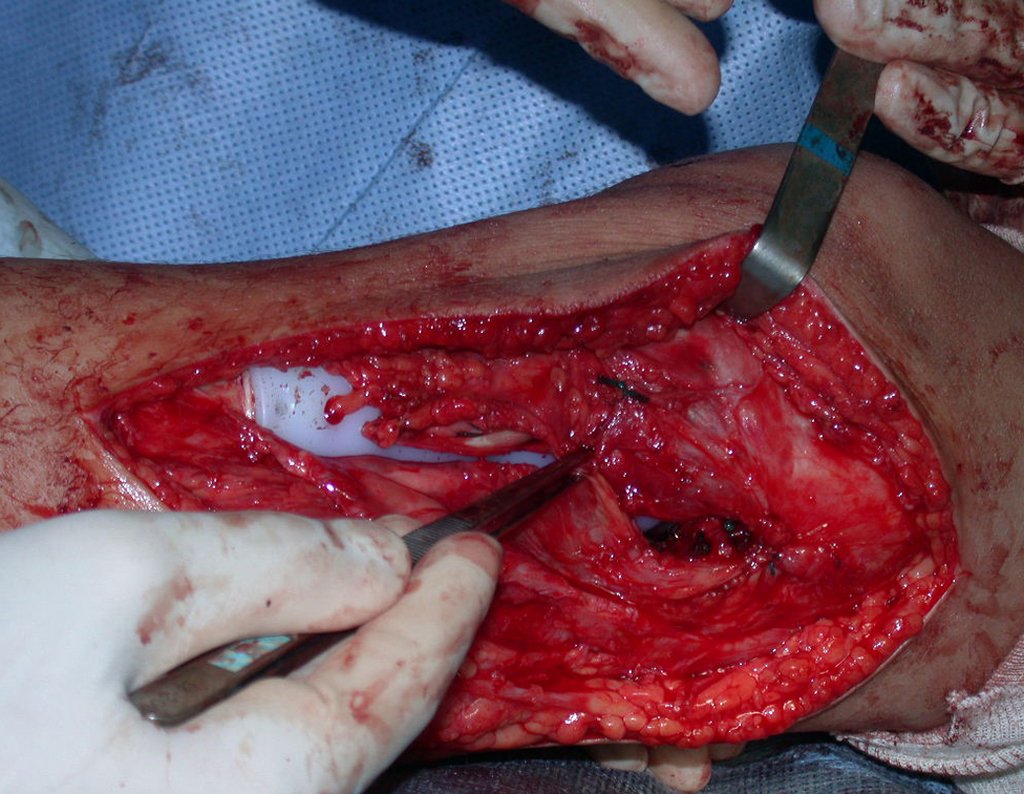
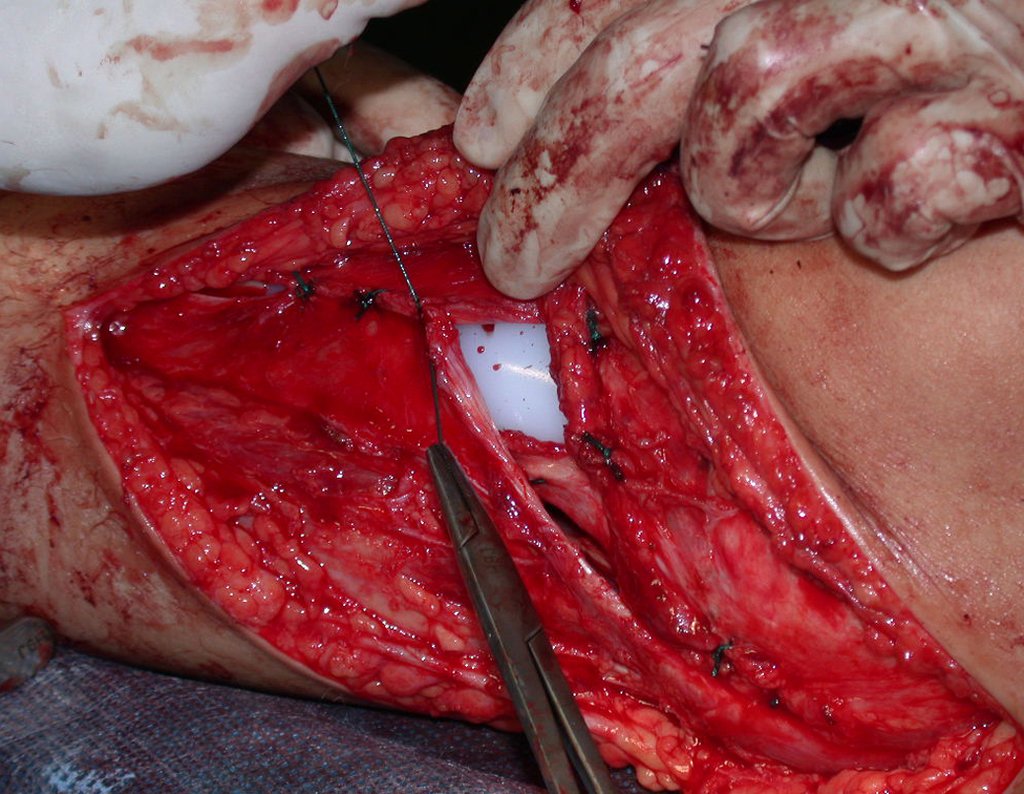
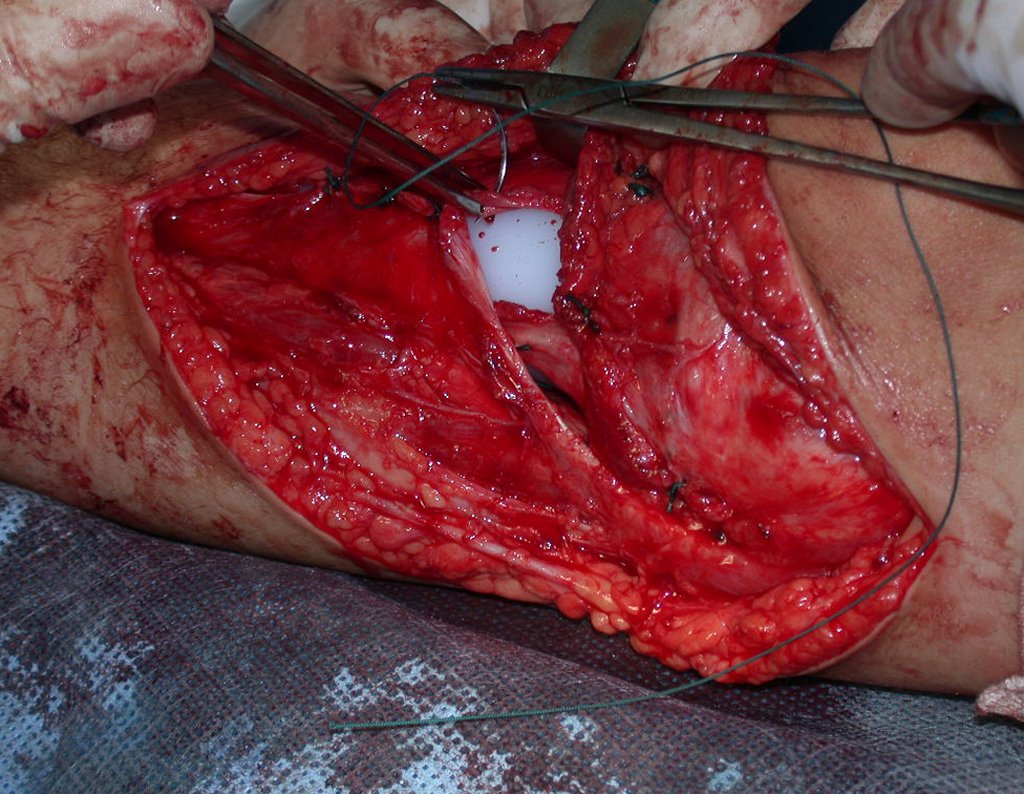
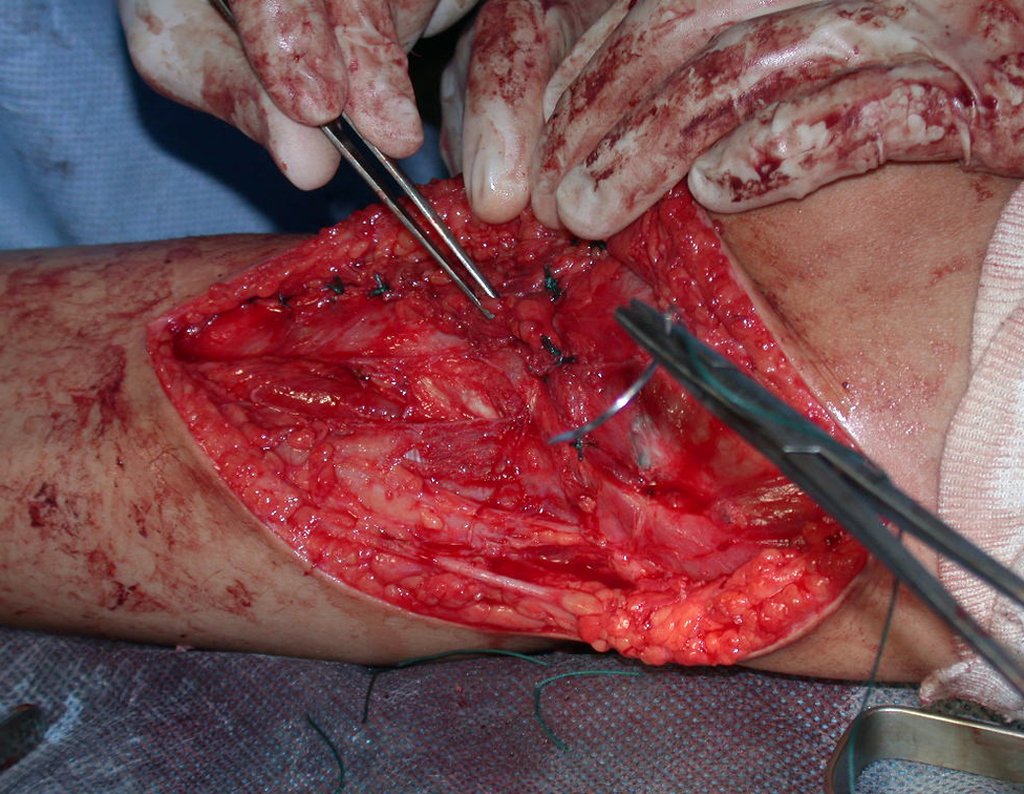
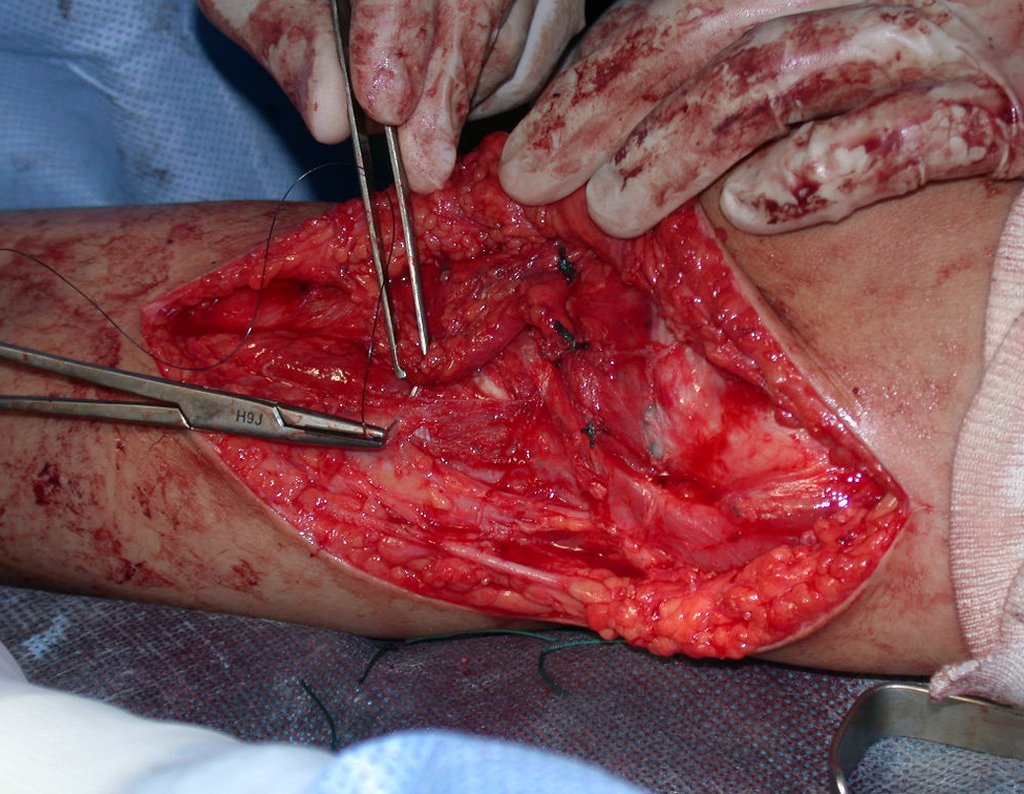
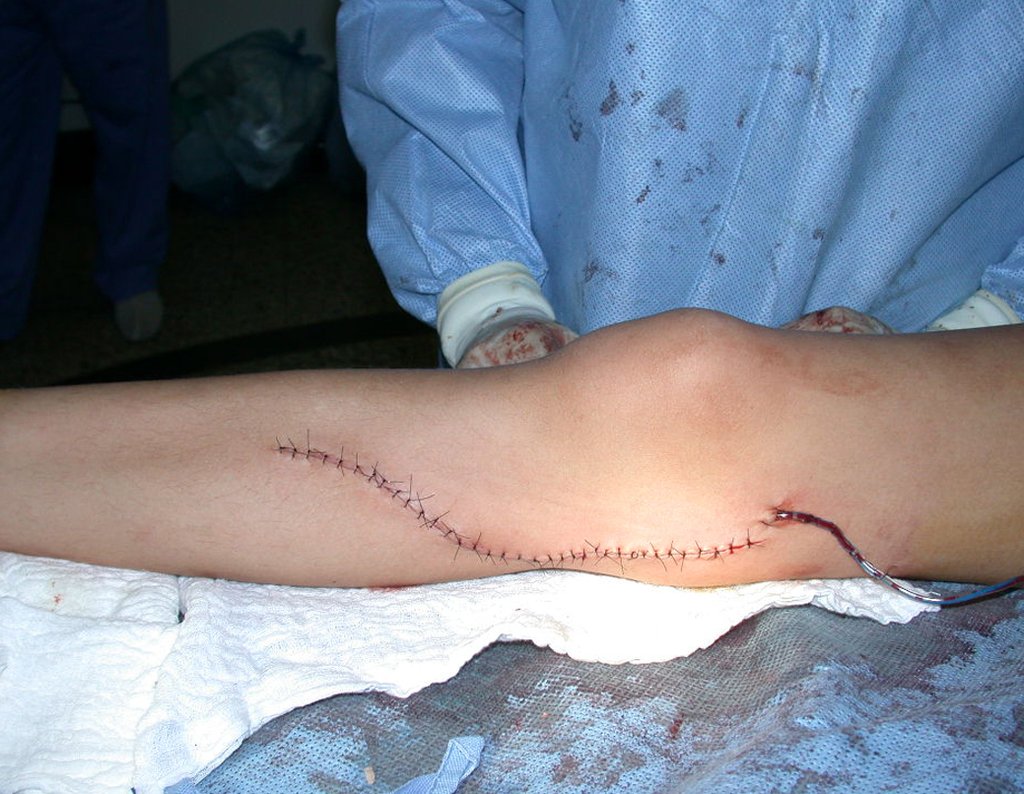
A cirurgia de ressecção do tumor foi realizada por via medial, retirando-se todo o trajeto da biópsia e a incisão da pele lateral juntamente com a peça cirúrgica. A técnica cirúrgica é explicada nas figuras 42 a 98.
A abordagem deve ser realizada sem garroteamento do membro e com uma criteriosa hemostasia, visando o mínimo de perda sanguínea em paciente imunodeprimido.
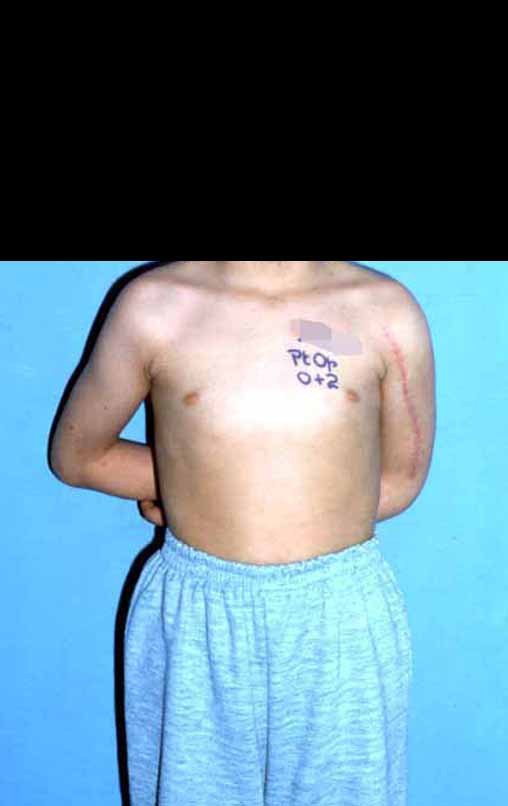
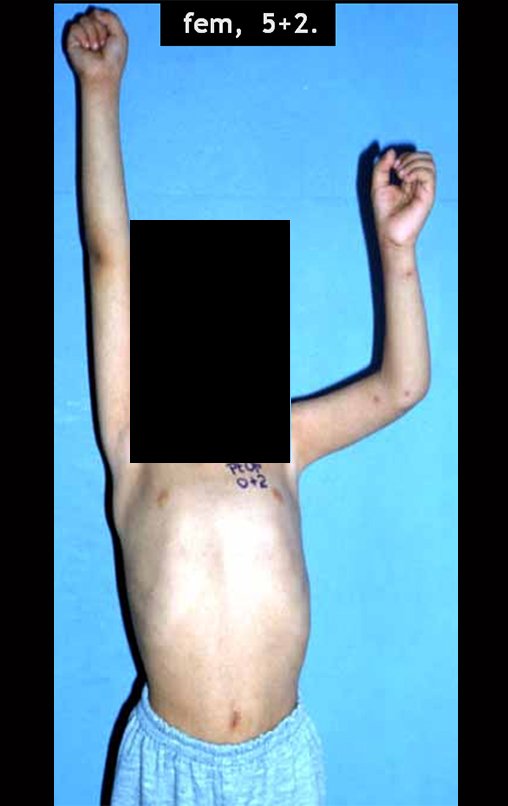
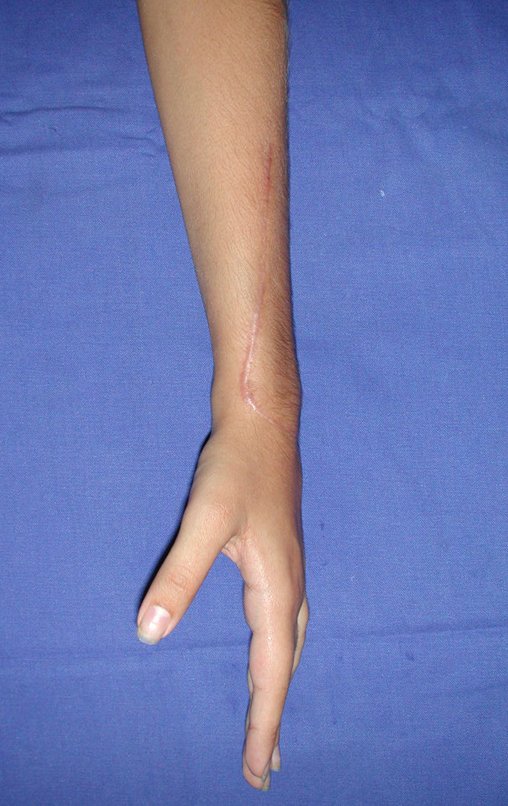
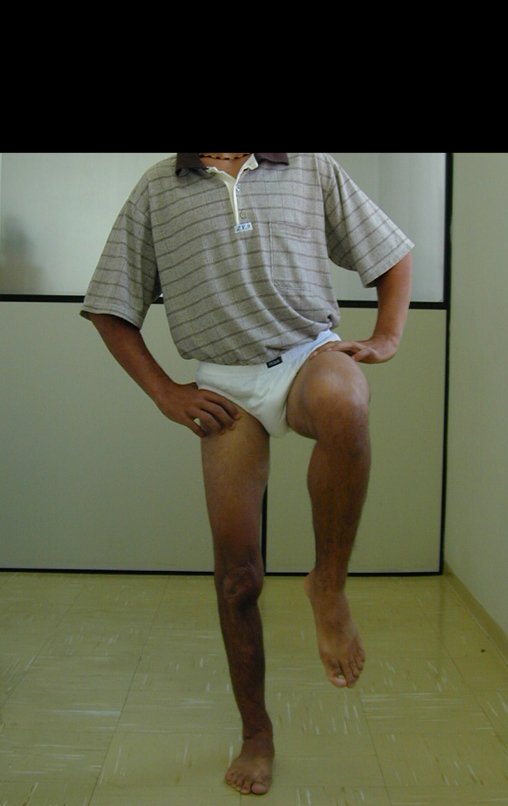
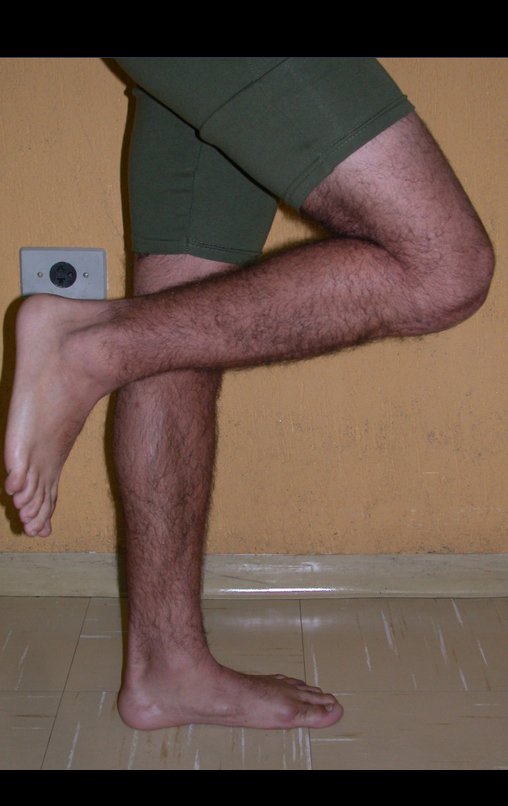
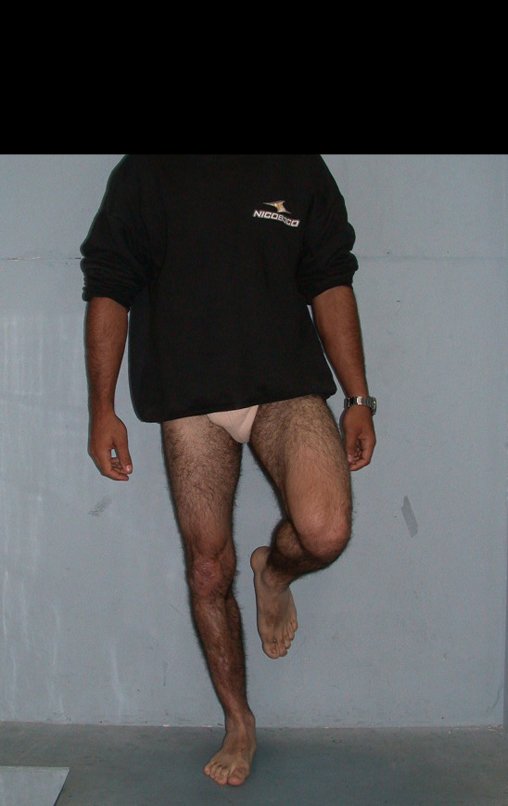
Vídeo 1: Flexão e extensão livres, sem limitação.
Vídeo 2: Colocação de hemostático de tecidos moles.
Vídeo 3: Paciente quimioterapia pós-operatória e em fisioterapia, boa extensão e boa flexão do joelho.
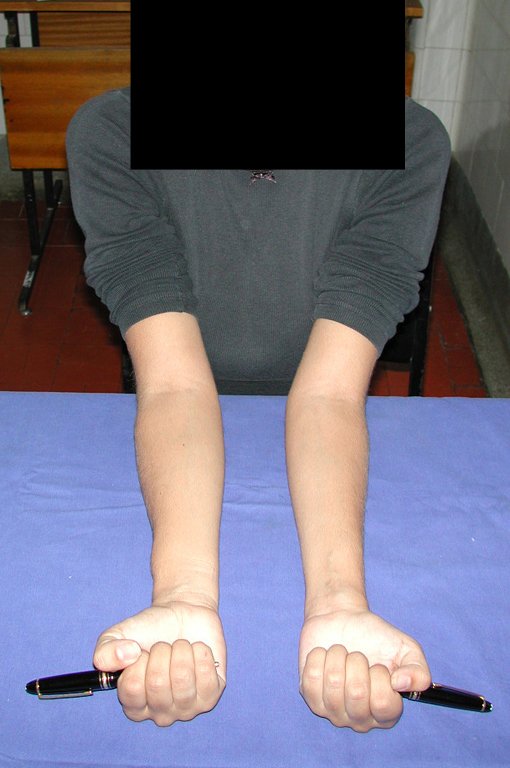
Vídeo 4: Paciente em quimioterapia e fisioterapia após onze meses da cirurgia. Função de flexão ativa, com carga, de aproximadamente 45 graus.
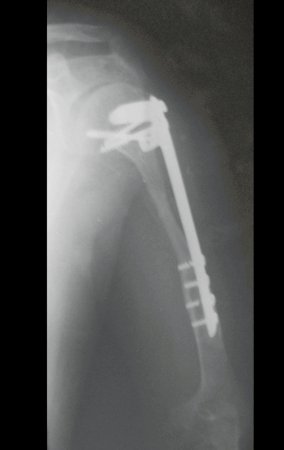
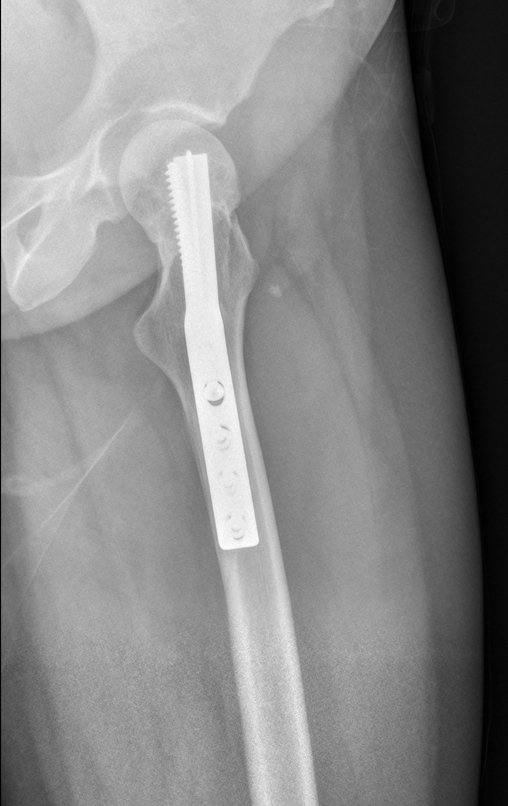
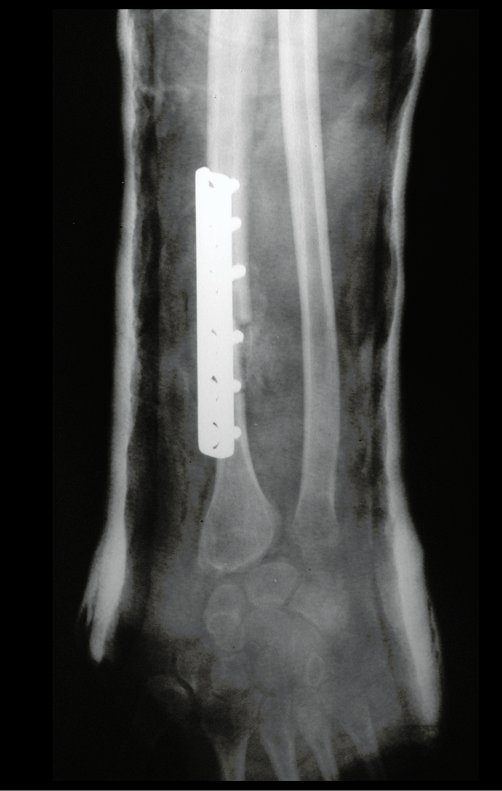
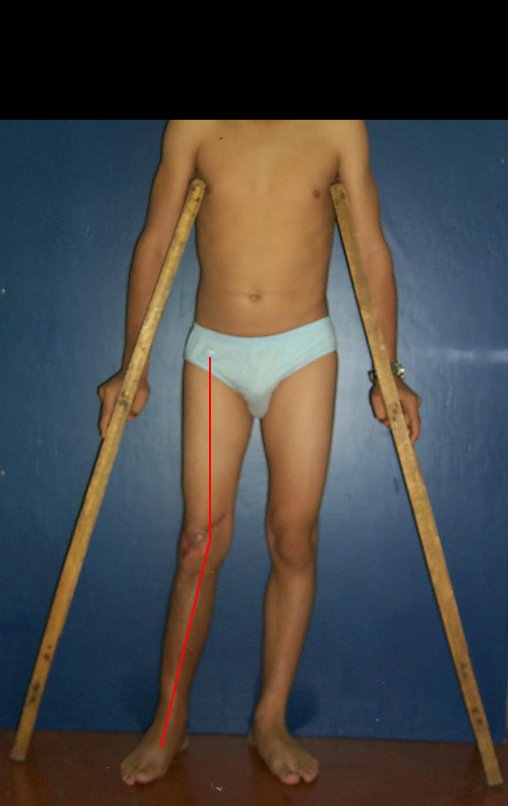
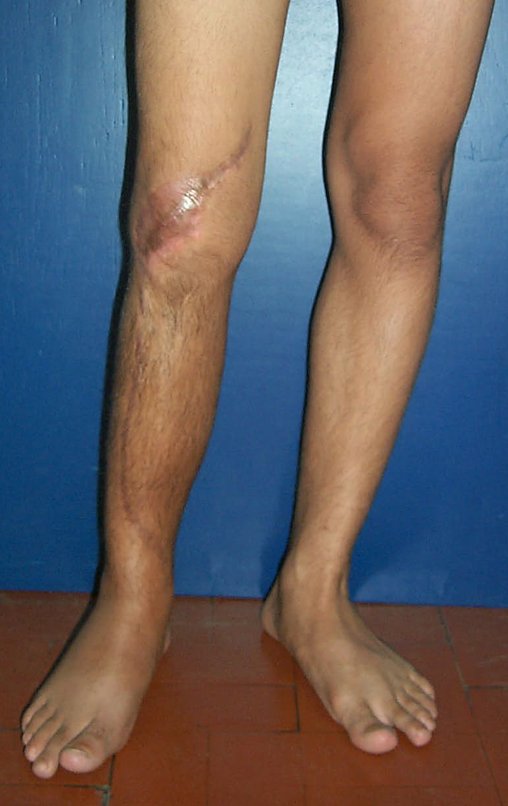
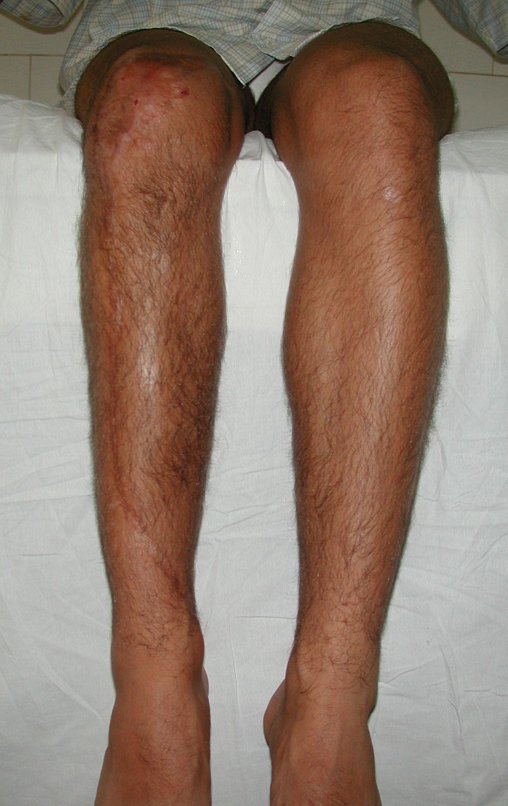
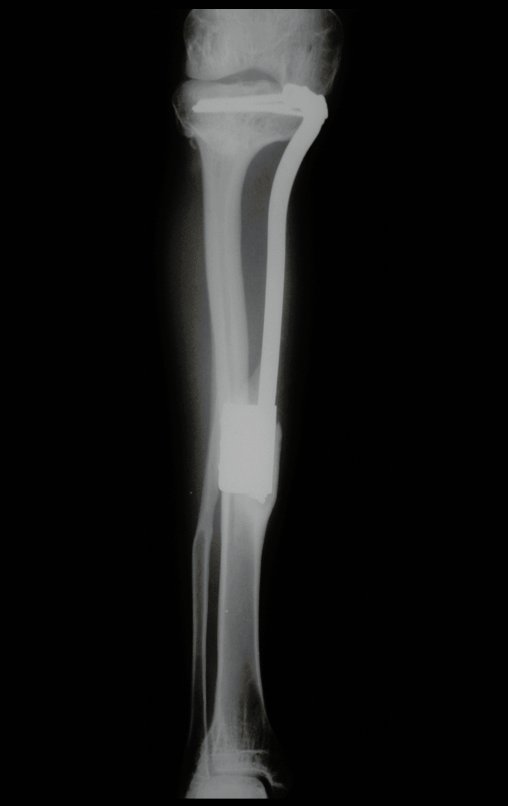
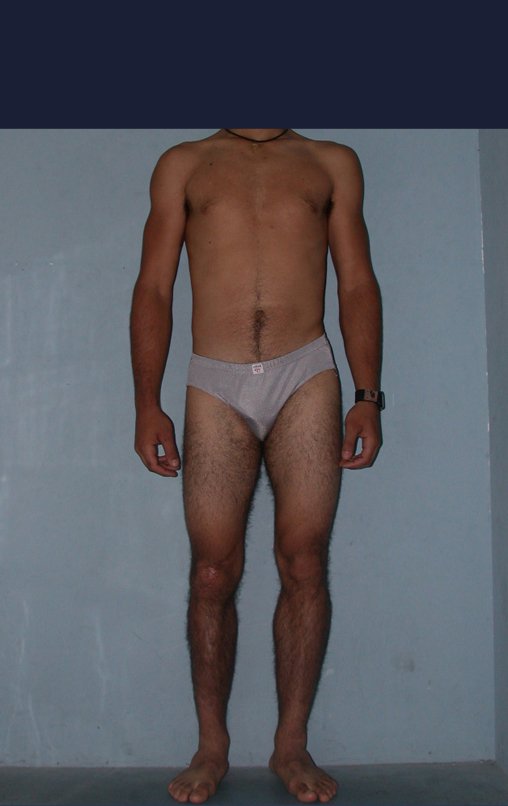
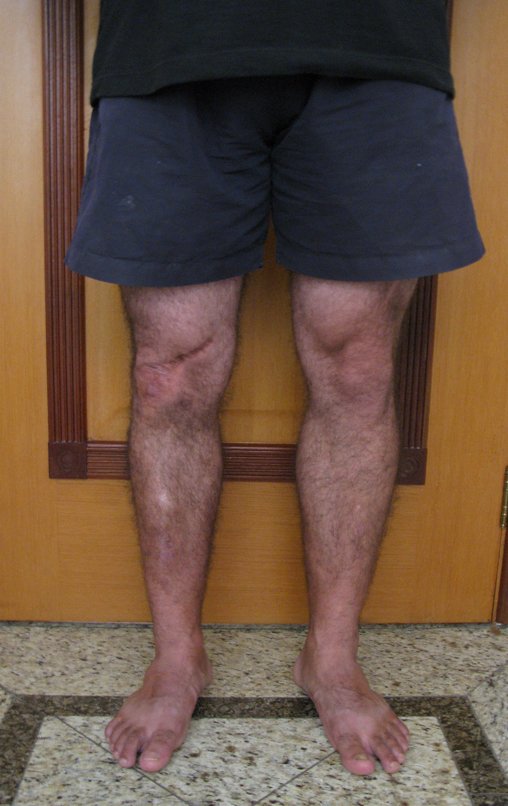
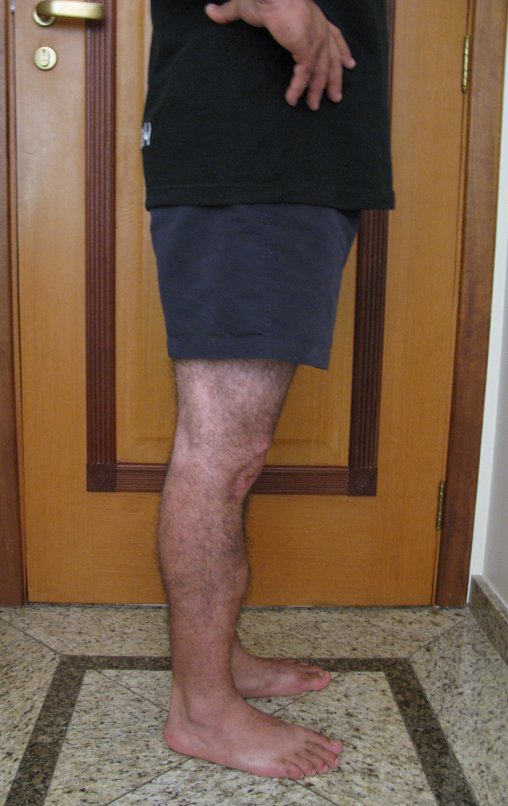
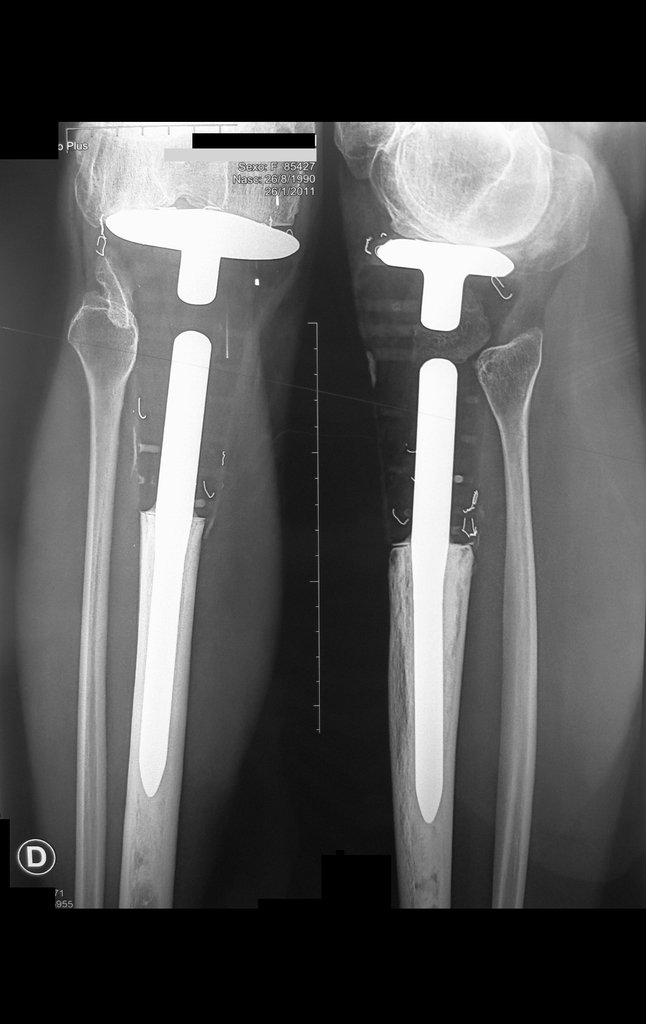
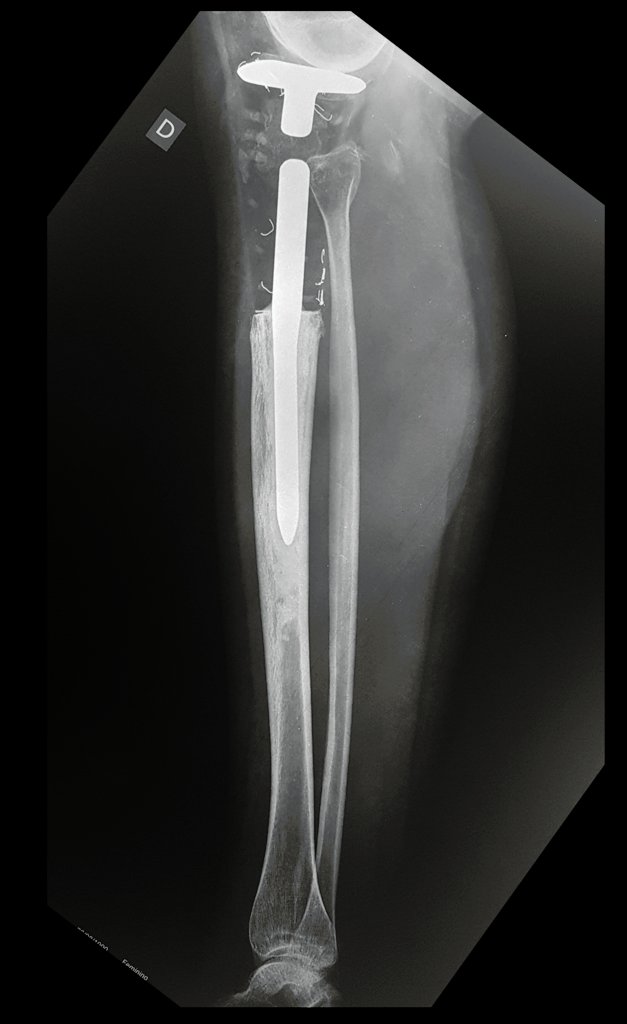
Observe que já houve crescimento da tíbia. A seta vermelha aponta a cicatriz onde se encontrava a placa de crescimento. A seta branca aponta a posição atual da placa de crescimento. A barra amarela marca o quanto este segmento ósseo cresceu, figura 130.
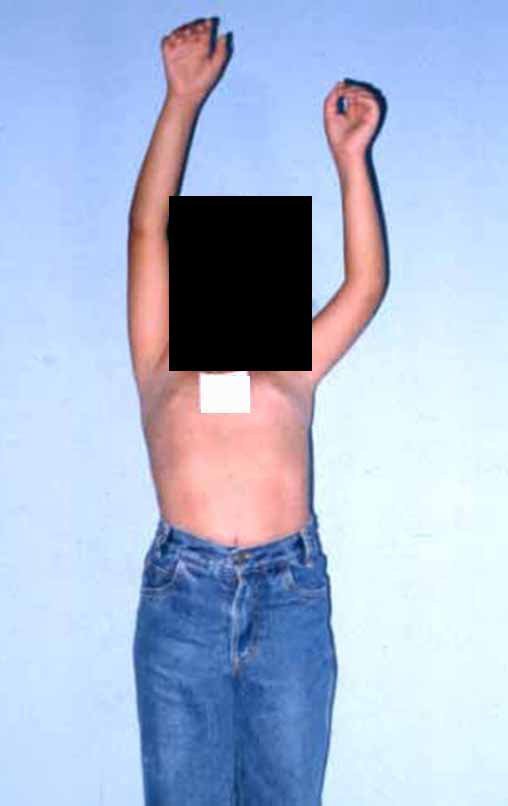
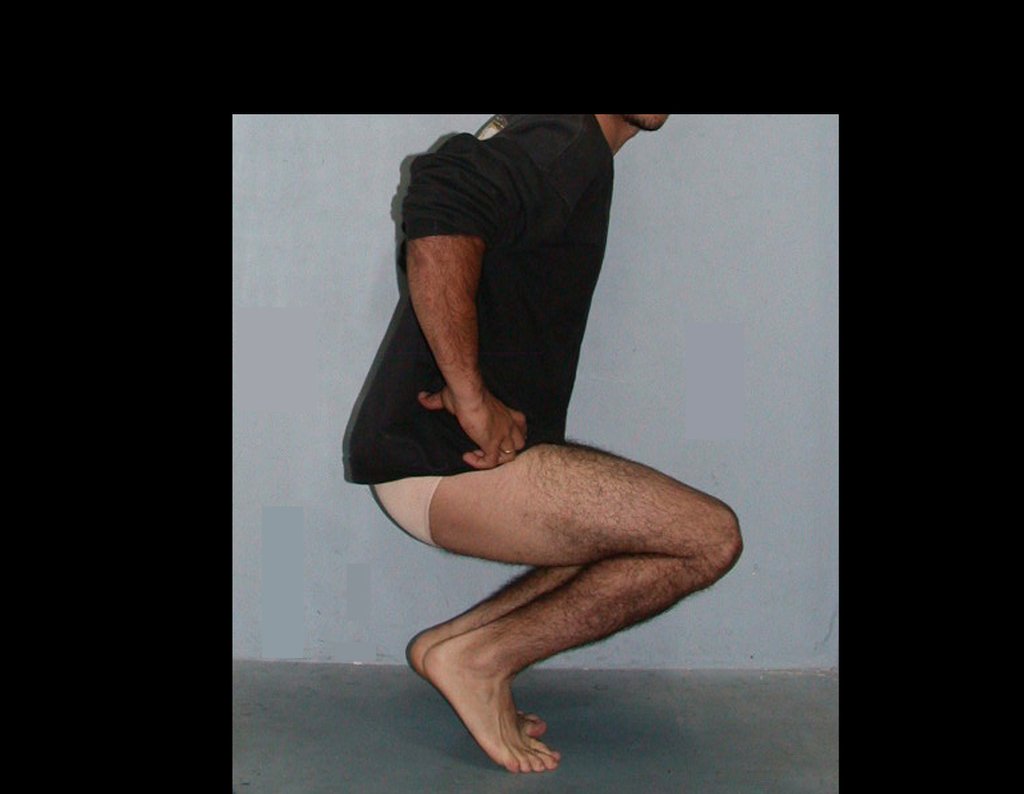
Vídeo 5: Extensão ativa de 180 graus e flexão de 90 graus, em 29/09/2015, após dezesseis meses da cirurgia.
Vídeo 6: Função de deambulação e flexão de 90 graus, ativa e com carga, após dezesseis meses da operação.
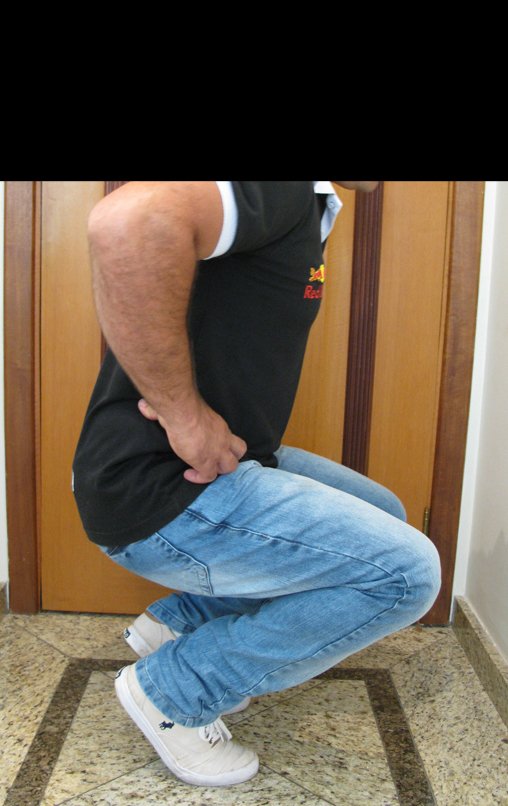
Vídeo 7: Bom equilíbrio e boa função para as atividades da vida diária.
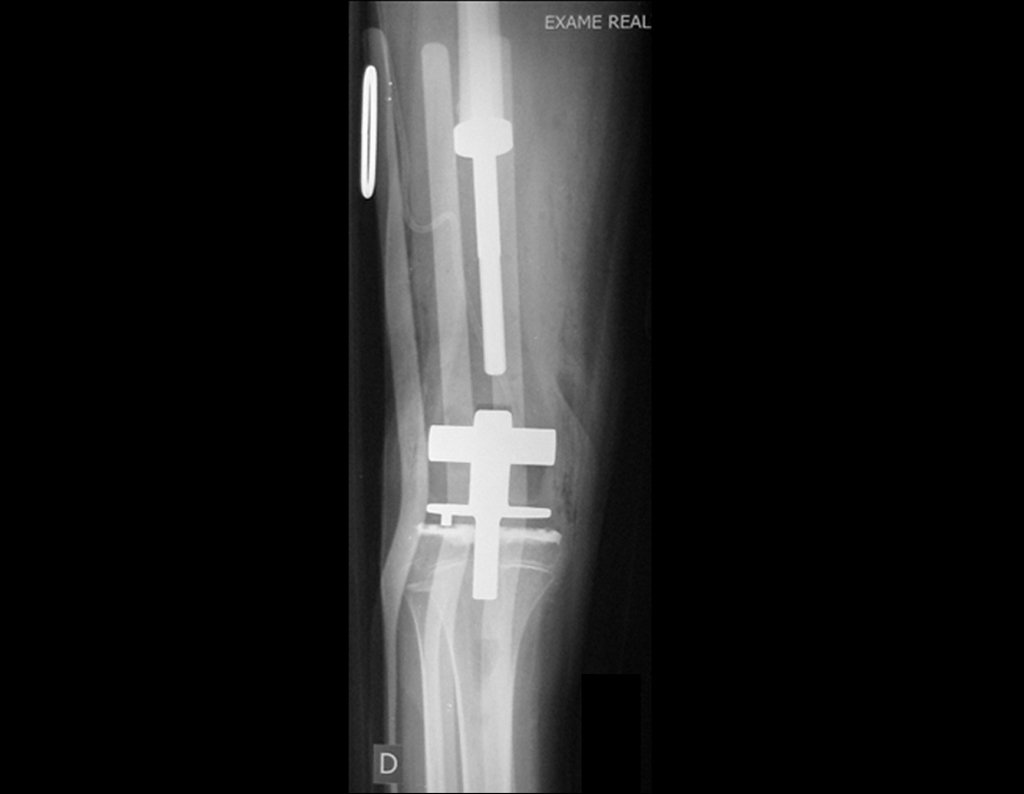
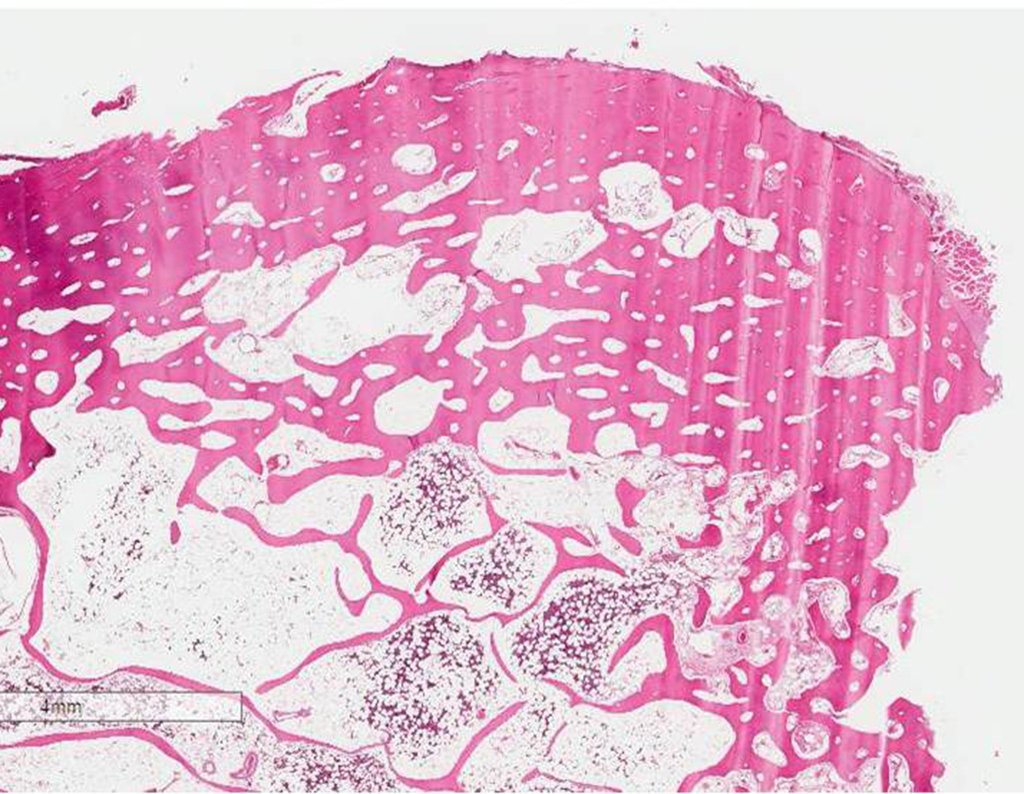
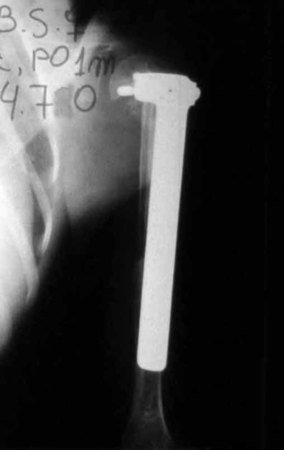
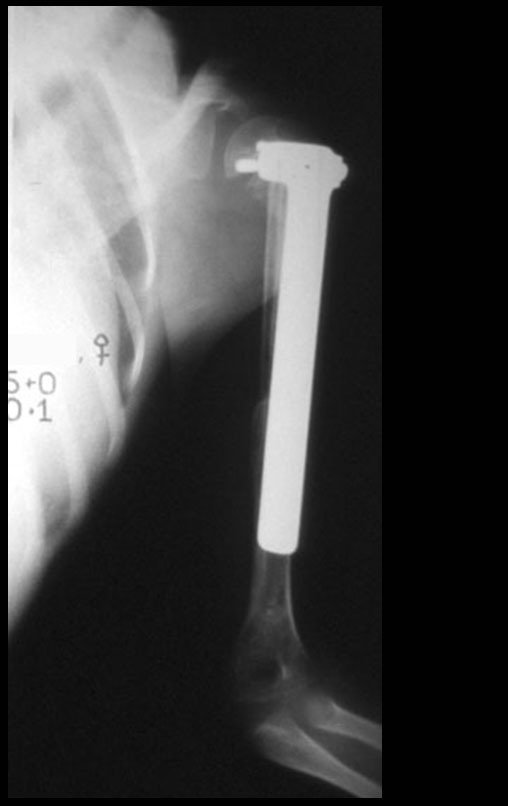
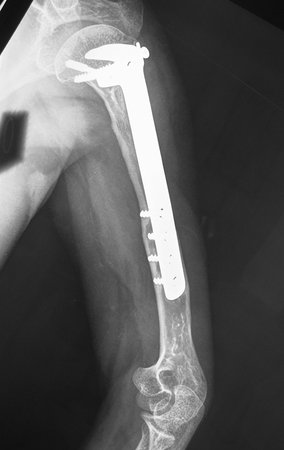
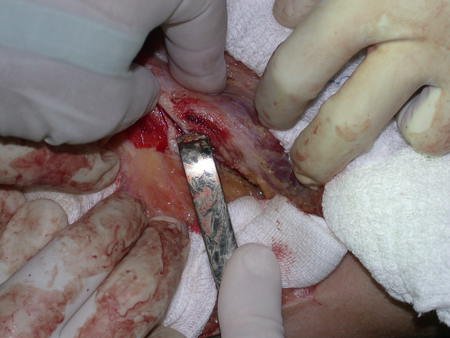
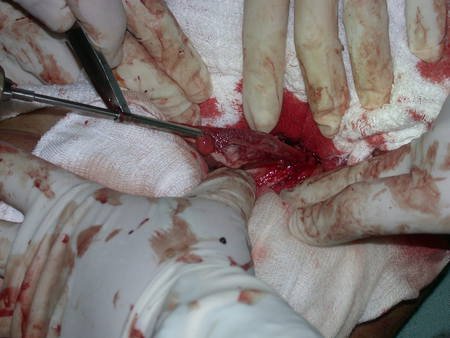
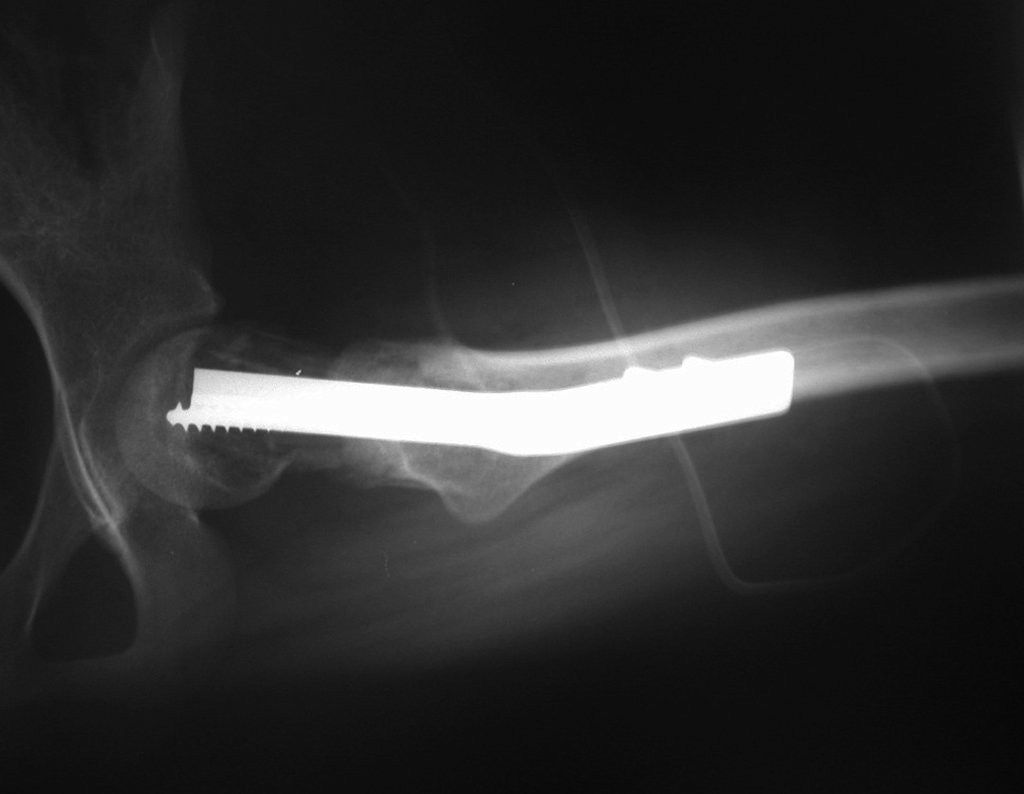
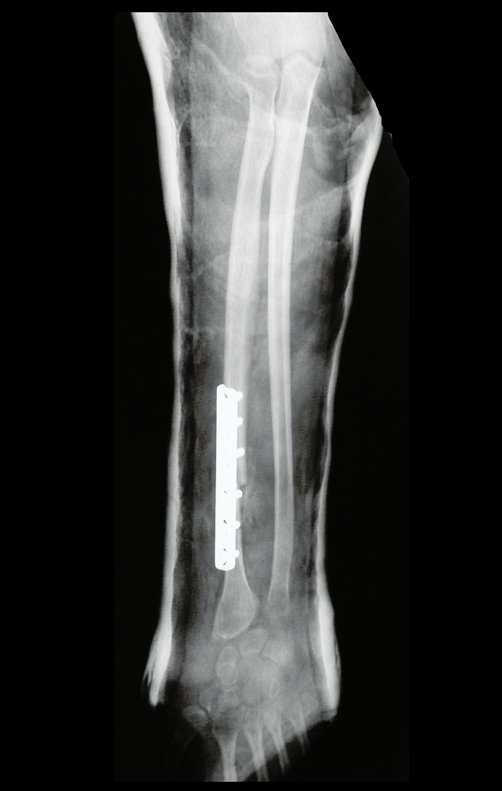
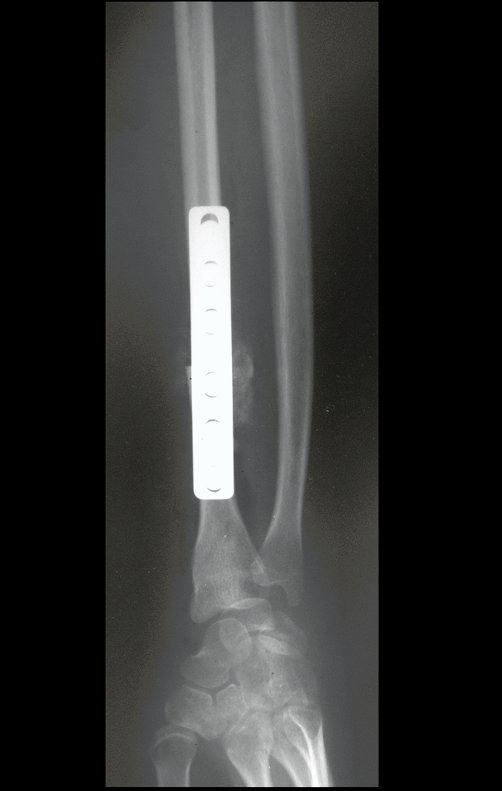
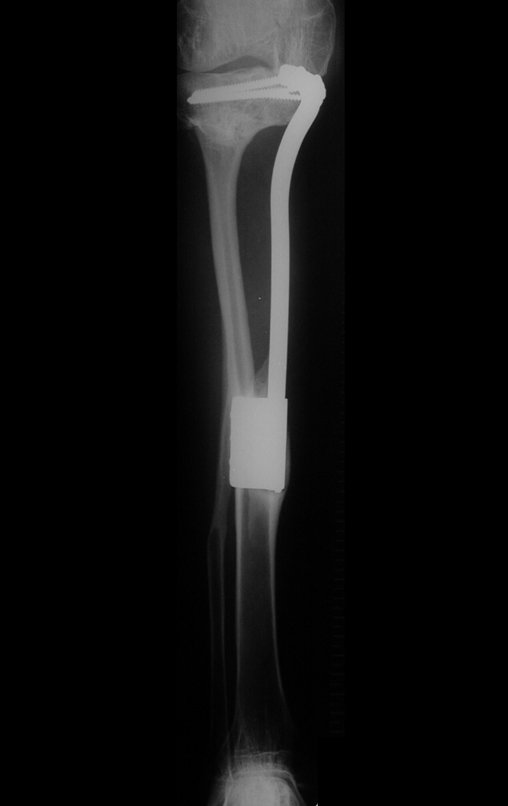
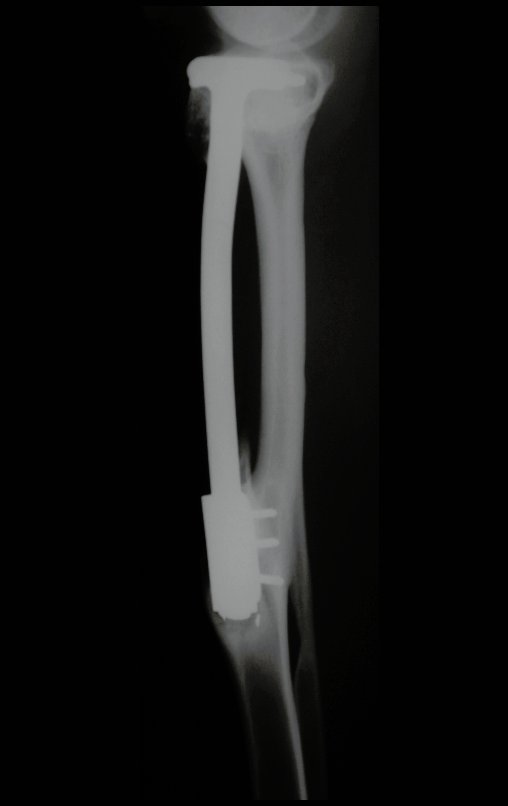
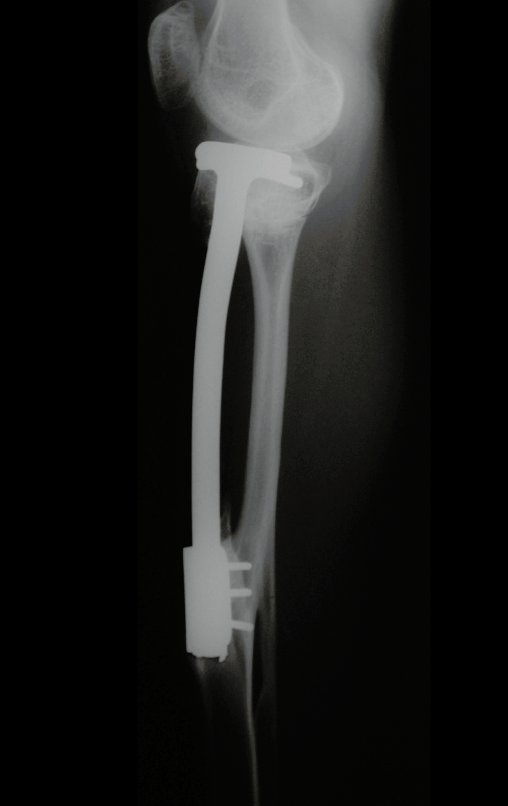
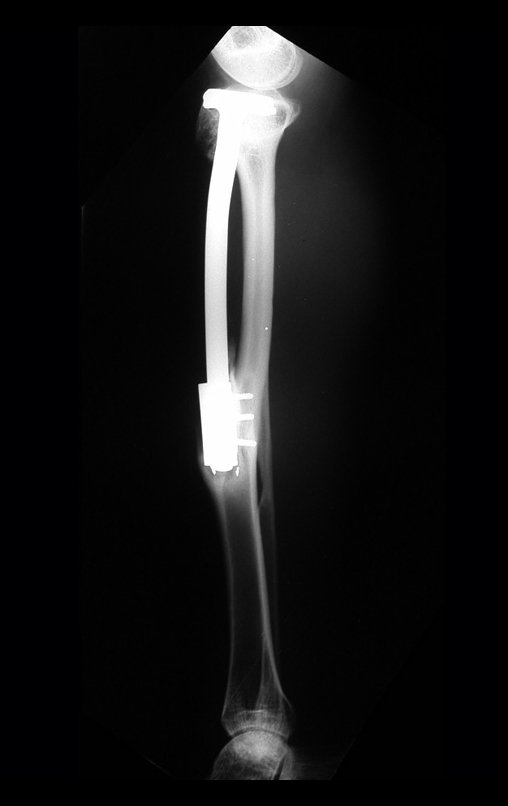
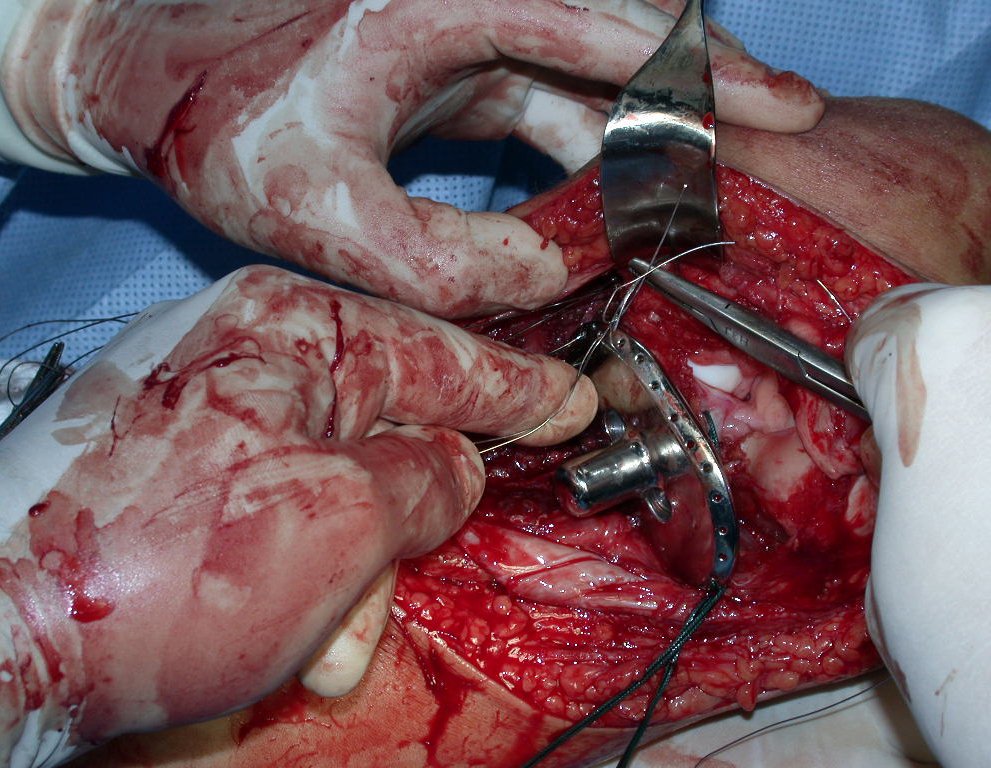
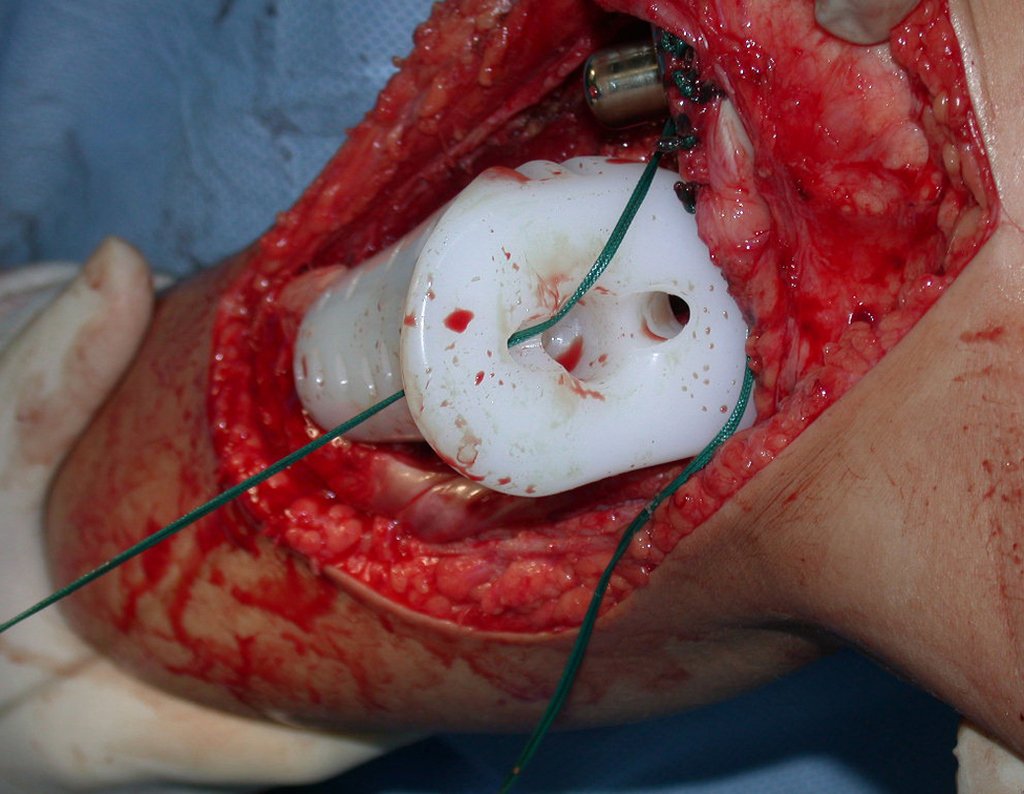
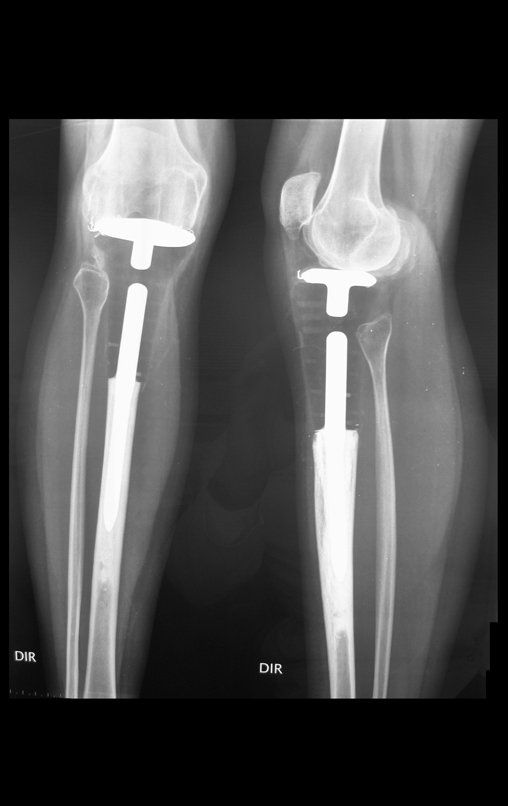
O trajeto da haste atravessando a linha epifisial é correto, e está de acordo com a técnica empregada. A presença da haste pode preocupar quanto a possibilidade de interferência no crescimento da fise, por tratar-se de técnica pouco conhecida, mas isto não ocorre.
A passagem cuidadosa desta haste de 1,0 cm de diâmetro, protegida por uma “camisa” de polietileno e não cimentada, não bloqueia a cartilagem de crescimento.
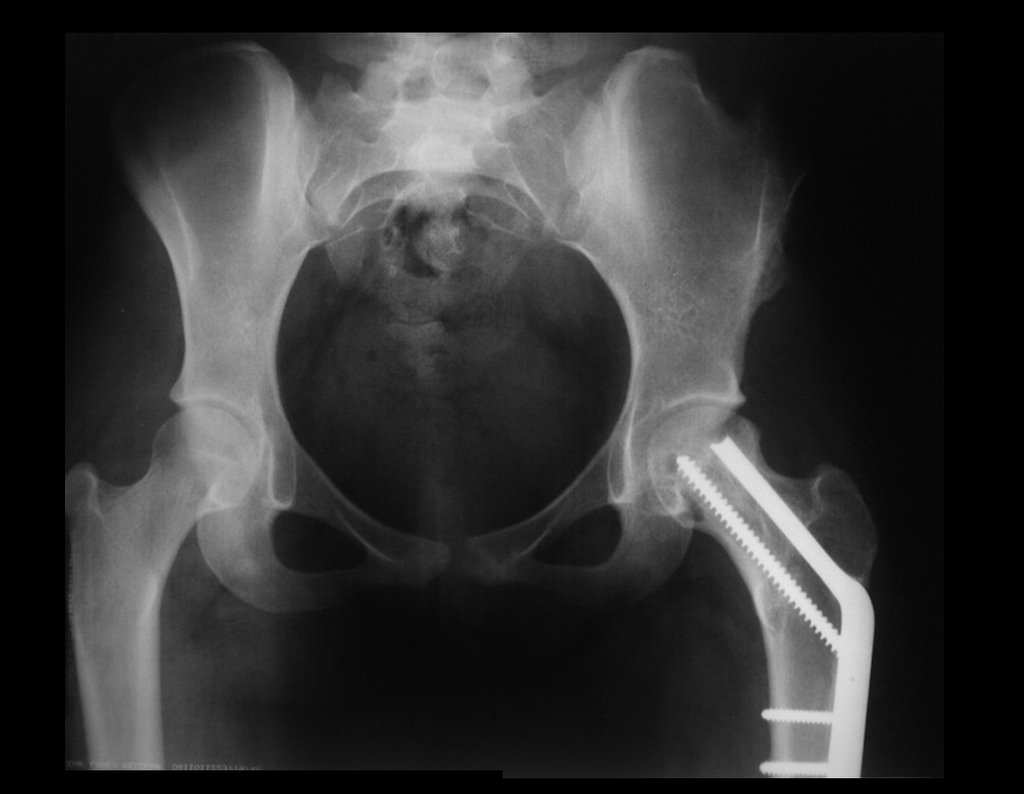
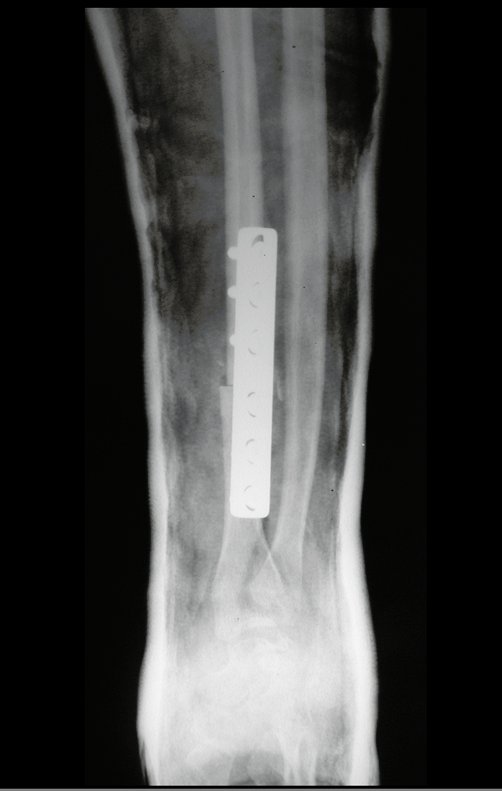
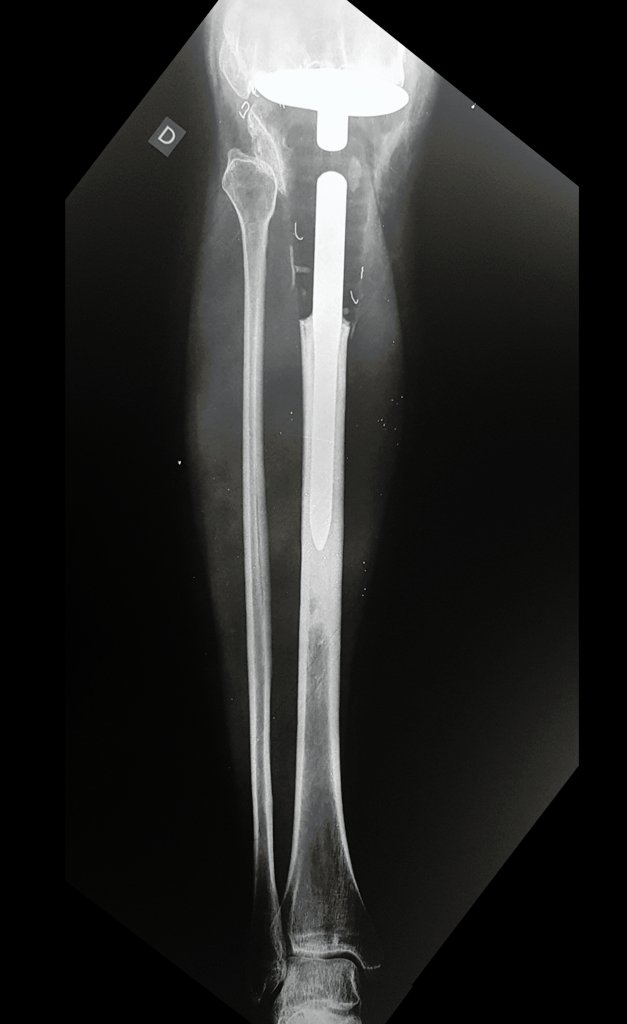
Pode-se certificar que a fise proximal da tíbia segue o seu crescimento, sem bloqueio, apesar de ter recebido no seu ponto central a passagem do componente tibial rotatório, protegido pela camisa de polietileno, figura 155.
É evidente este crescimento, principalmente se compararmos com a figura 130, de 16/06/2015, quatro meses antes.
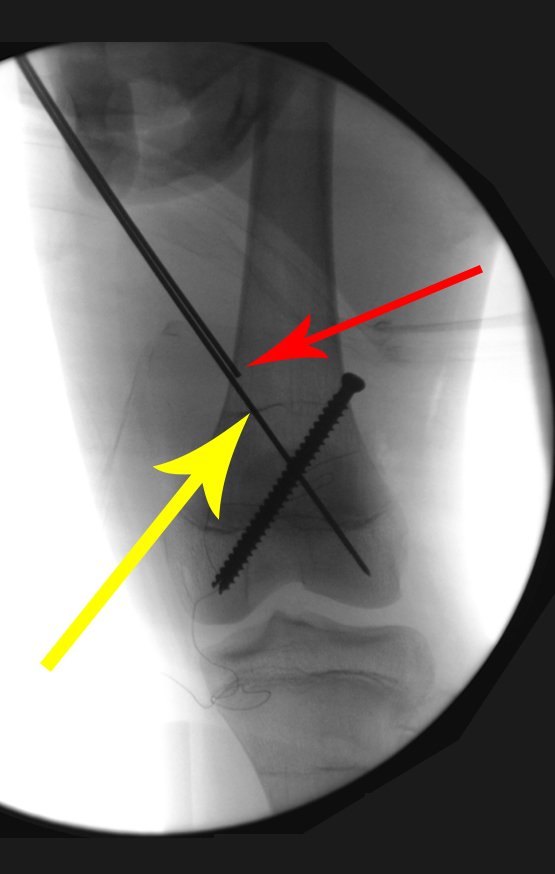
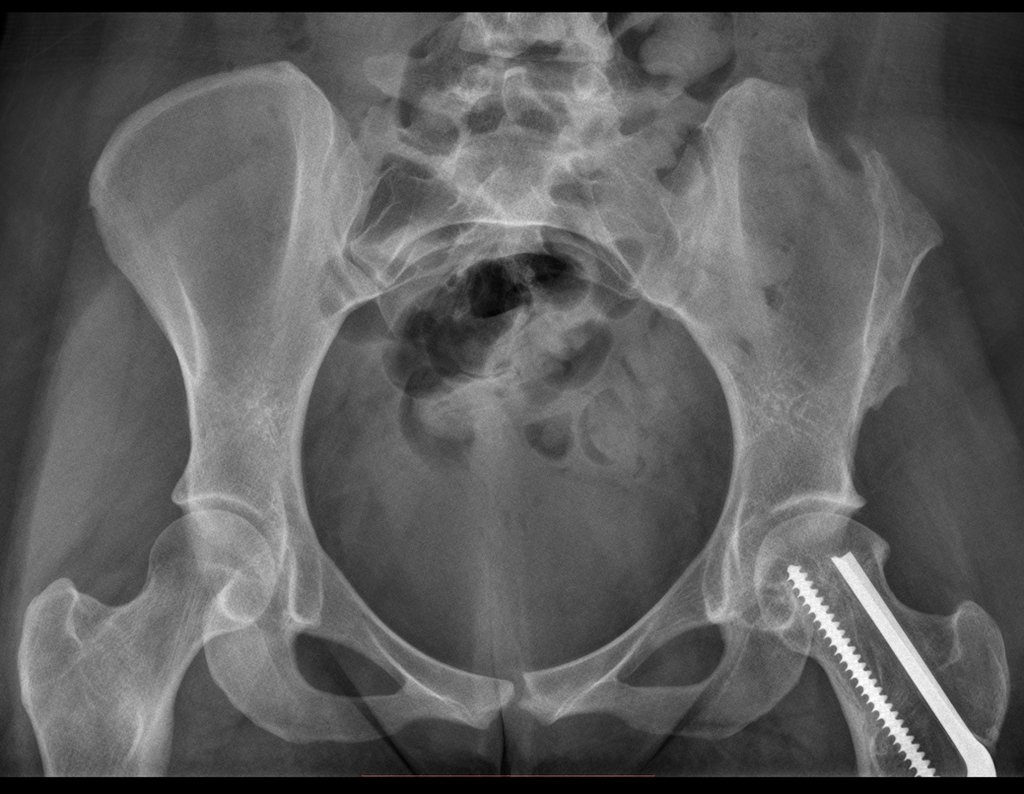
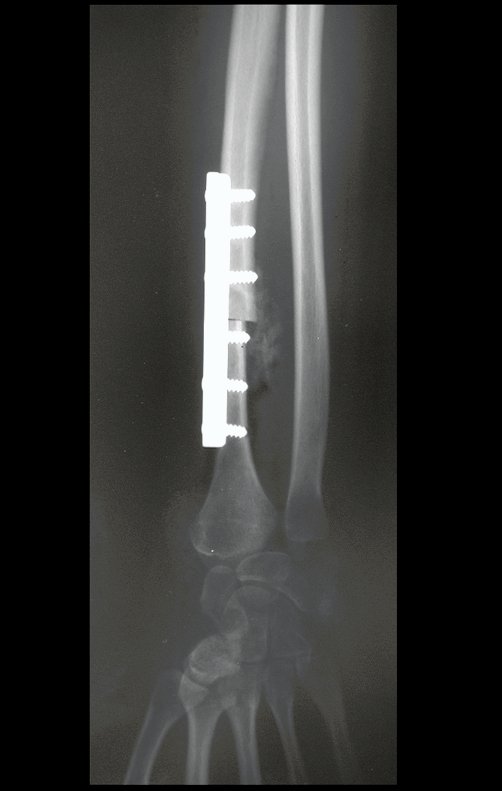
A seta vermelha aponta a cicatriz onde se encontrava a placa de crescimento. A seta branca aponta a posição atual da placa de crescimento. A barra amarela marca o quanto este segmento ósseo cresceu. Nesta ocasião indicamos a epifisiodese, para controlar a discrepância.
Vídeo 8: Função em dezembro de 2016, após dois anos da cirurgia. Marcha sem claudicação, boa função de flexão com carga.
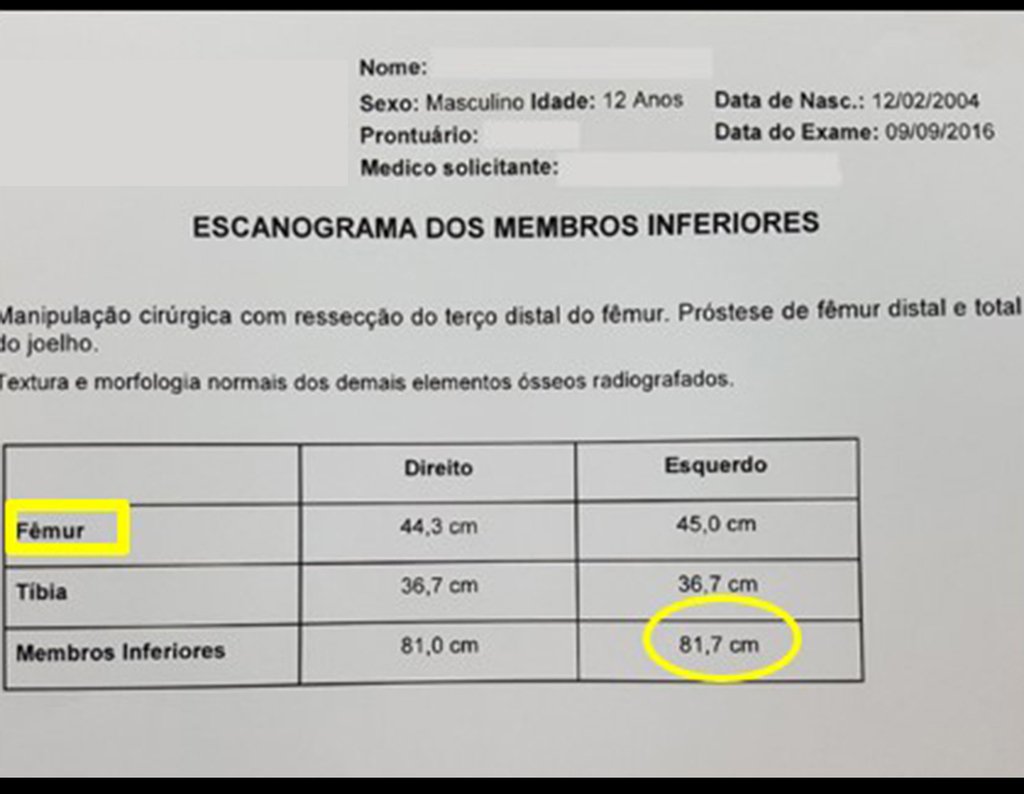
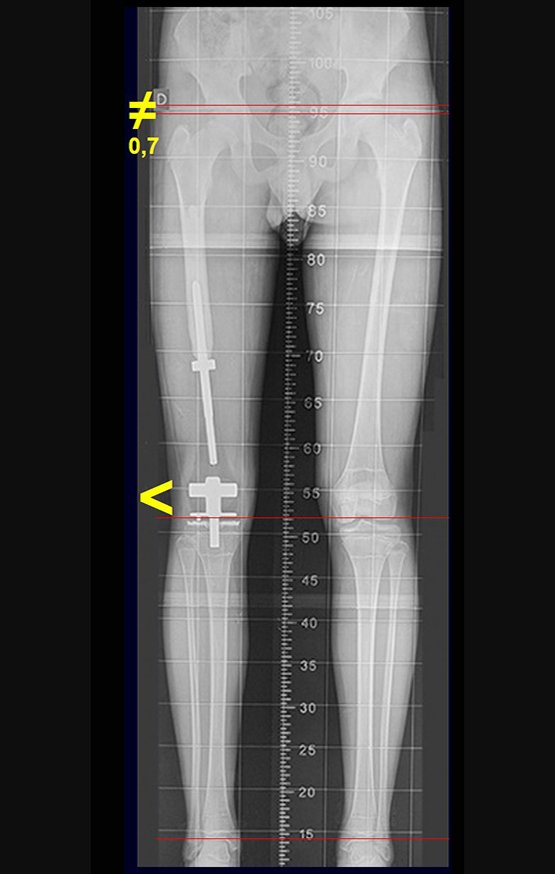
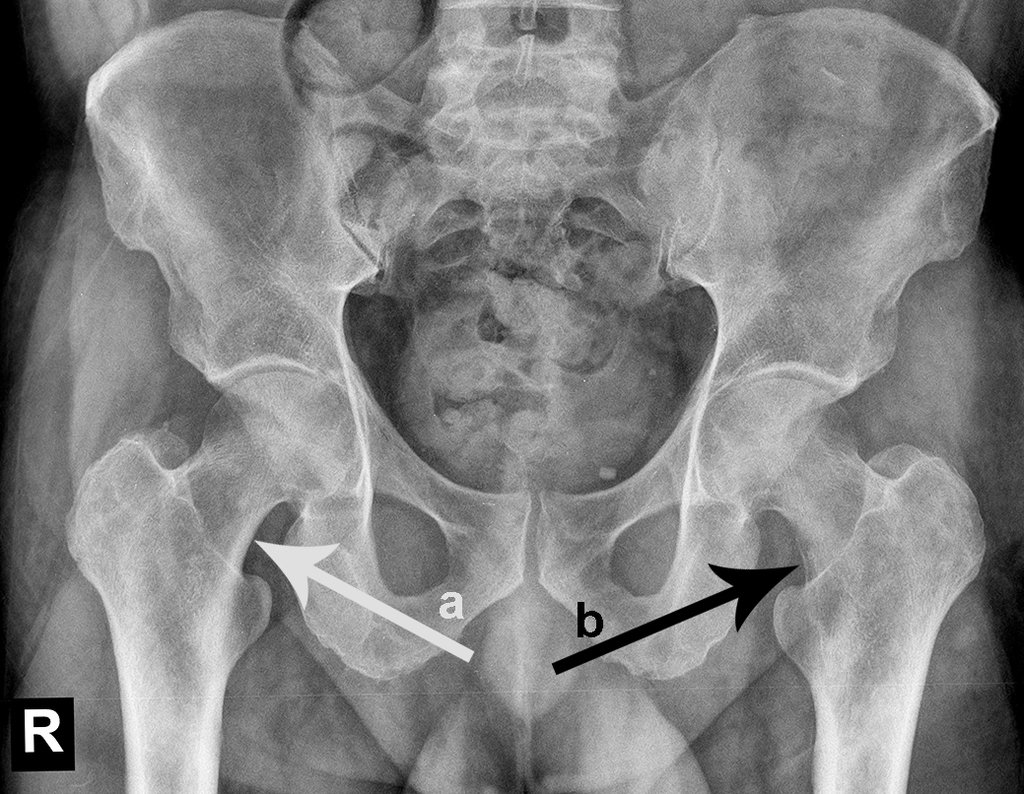
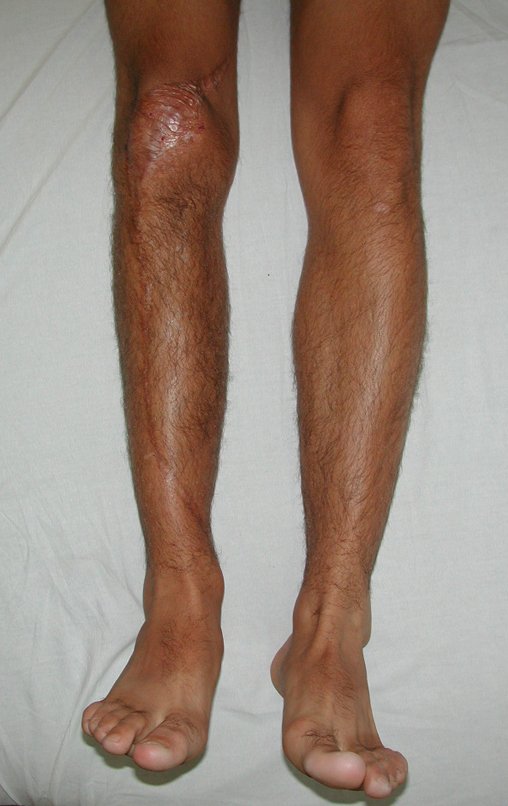
Entre a indicação da epiofisiodese e a sua realização passaram cinco meses. Neste período o paciente apresentou um estirão de crescimento significativo, aumentando a discrepância dos membros inferiores, passando agora para 1,5 cm. Escanograma de janeiro de 2017, figura 165.
Vídeo 9: Equilíbrio e função, em janeiro de 2017, após três anos da cirurgia.
Vídeo 10: Evidente discrepância dos membros inferiores.
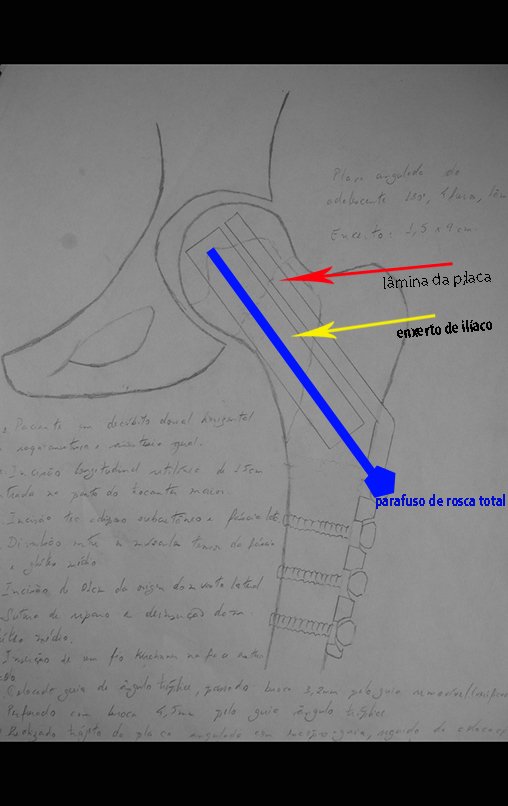
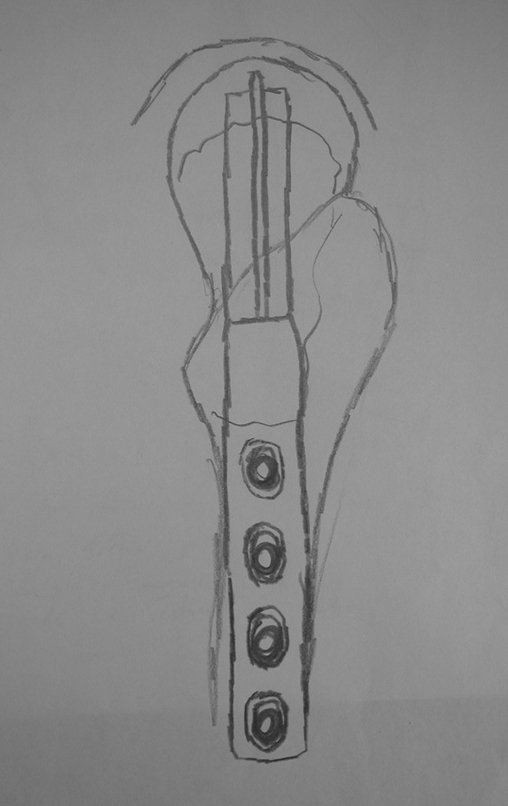
Programamos a epifisiodese para bloquear definitivamente apenas o crescimento da cartilagem de crescimento distal, do fêmur contralateral.
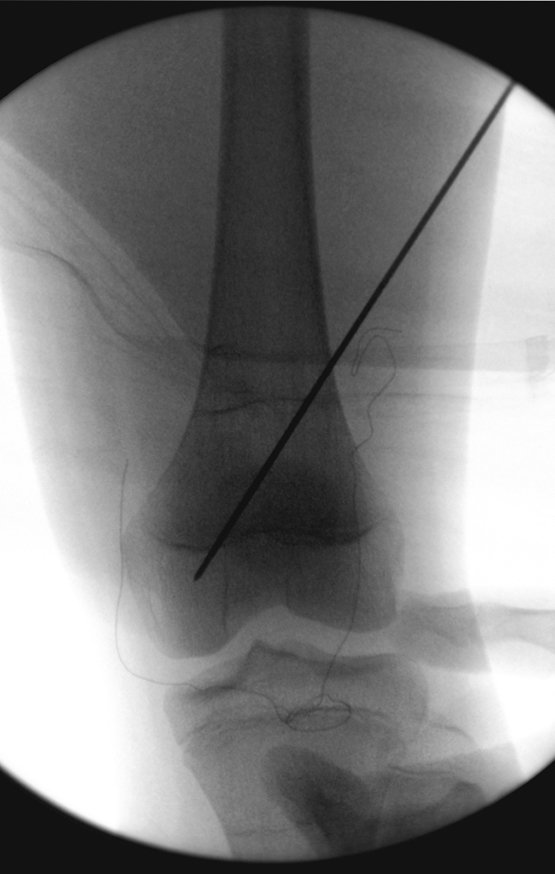
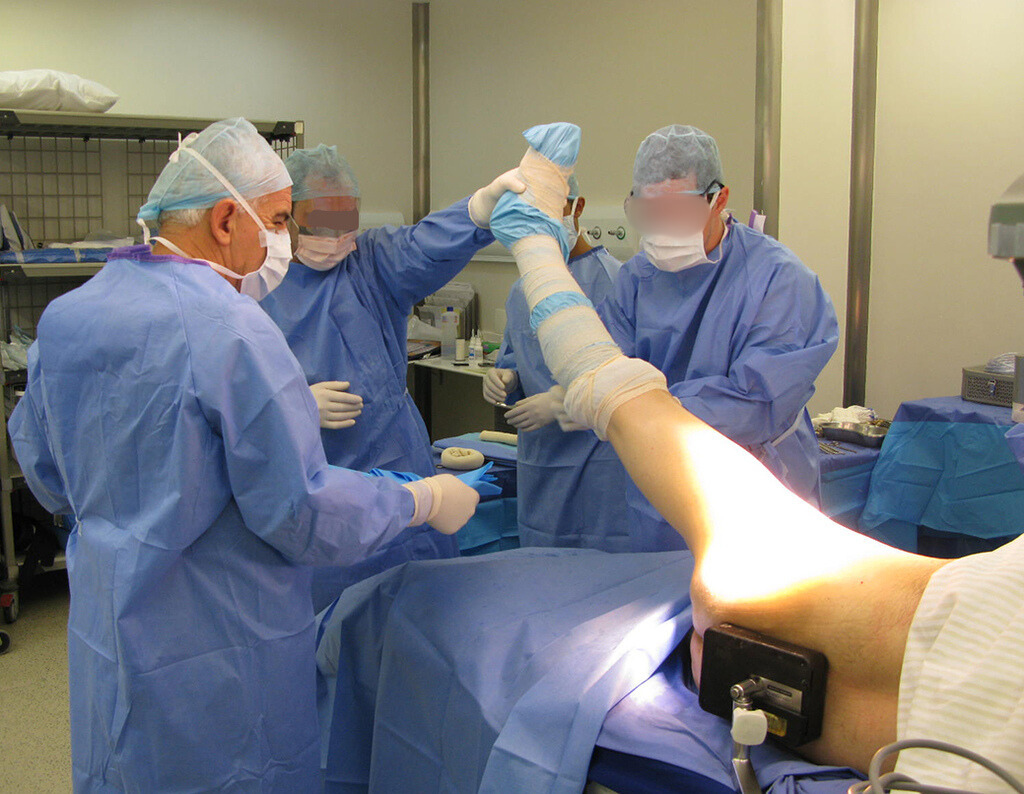
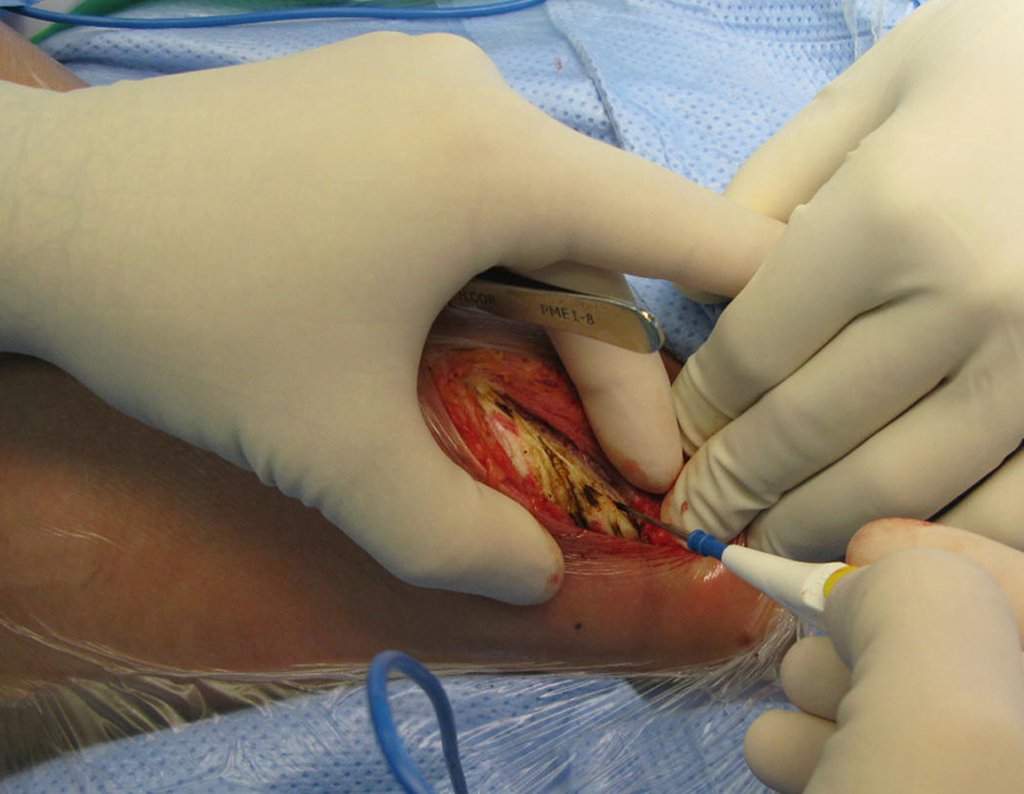
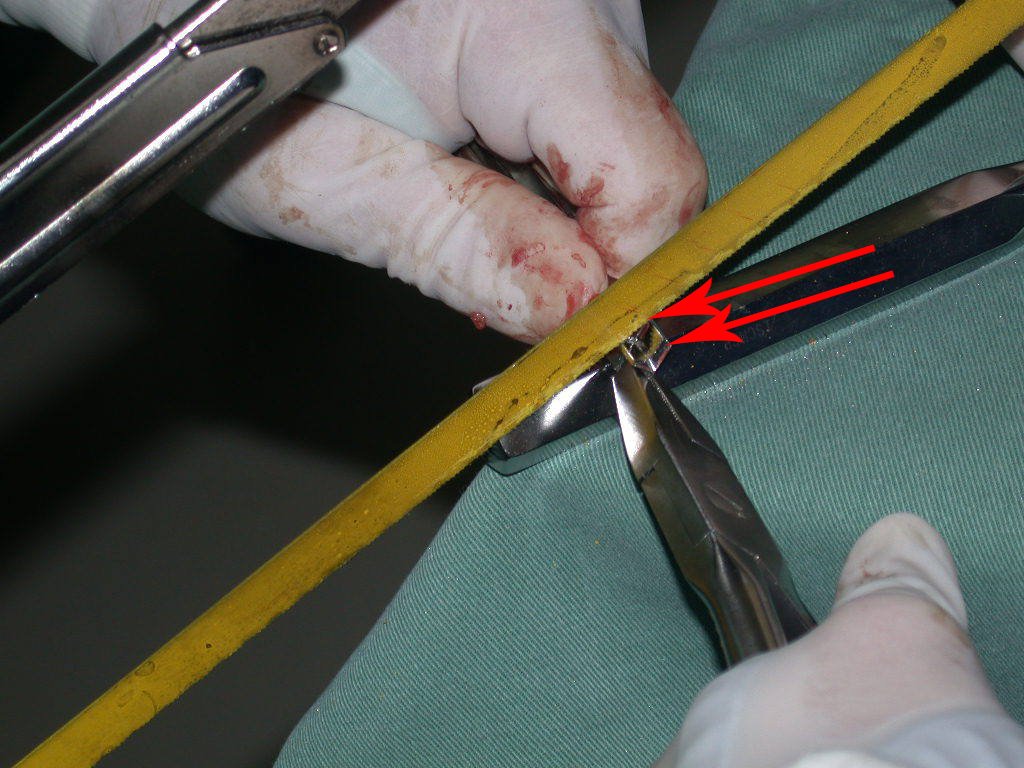
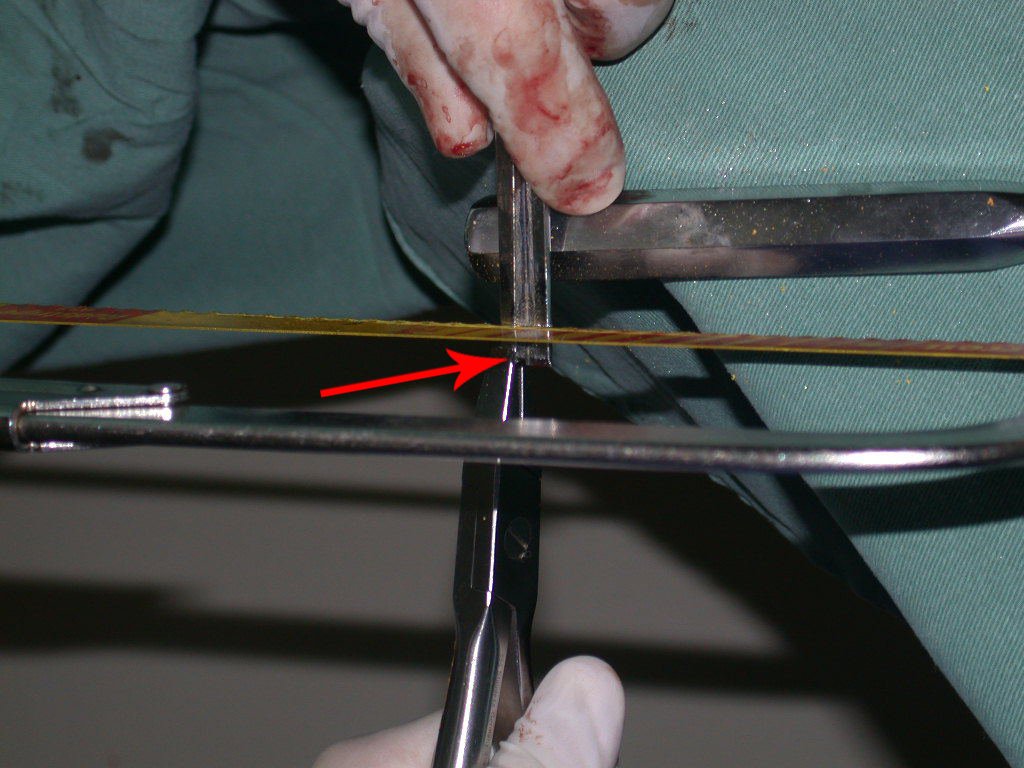
Este procedimento é realizado com o paciente anestesiado, sob controle de radioscopia, conforme descrito nas figuras abaixo.
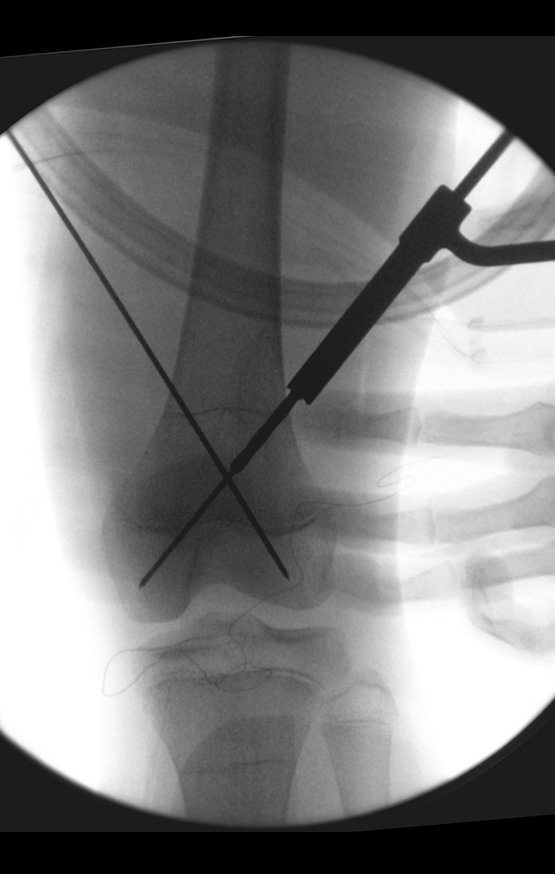
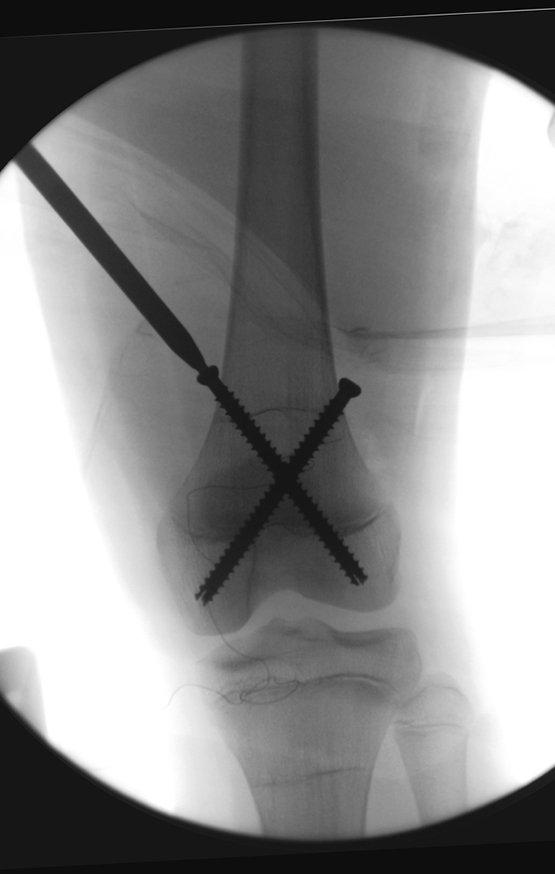
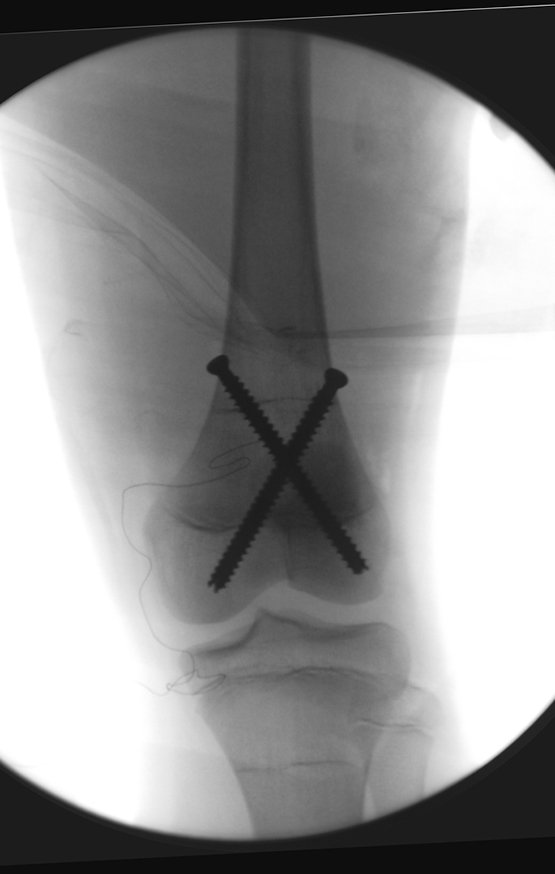
Repete-se o mesmo procedimento para o fio de medial para lateral, tomando-se o cuidado de conferir o paralelismo entre eles, deixando espaço para que não se choquem no cruzamento.
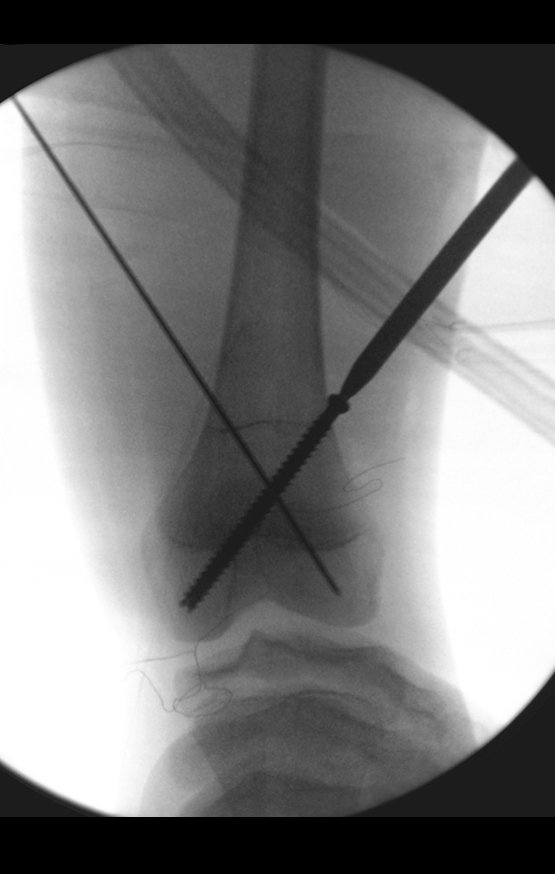
Inicia-se, a seguir, a perfuração da cortical com a broca calibrada para a passagem do parafuso canulado de rosca total.
Autor: Prof. Dr. Pedro Péricles Ribeiro Baptista
Oncocirurgia Ortopédica do Instituto do Câncer Dr. Arnaldo Vieira de Carvalho
Consultório: Rua General Jardim, 846 – Cj 41 – Cep: 01223-010 Higienópolis São Paulo – S.P.
Fone:+55 11 3231-4638 Cel.:+55 11 99863-5577 Email: drpprb@gmail.com