REVISÃO:
O condrossarcoma é o tumor maligno primário do osso mais freqüente depois do osteossarcoma 23,24). O subtipo central é o mais comum e incide cinco vezes mais que o periférico (3), sendo raros os subtipos de células claras e mesenquimal (2).
O condrossarcoma grau I não apresenta metástase e é chamado de sarcoma porque é de natureza mesenquimal, diferente do cancer, que é derivado do tecido ectodérmico. Ele é o terceiro dos tumores ósseos em frequencia depois do osteossarcoma e do Ewing.
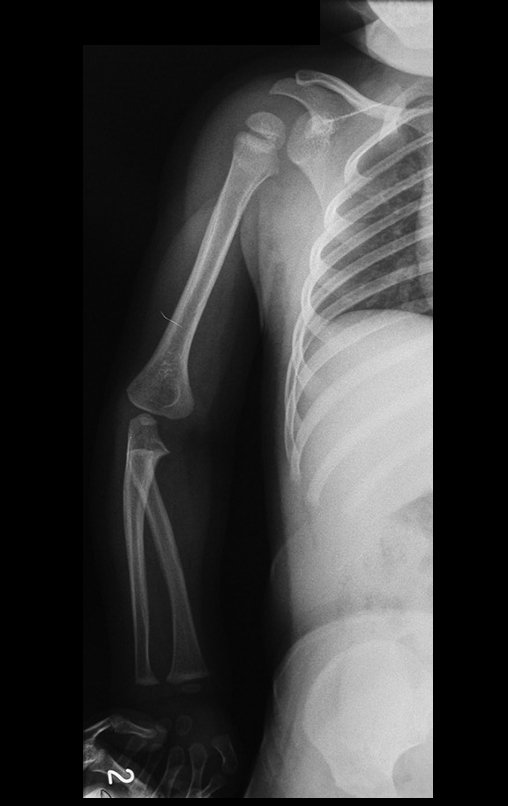
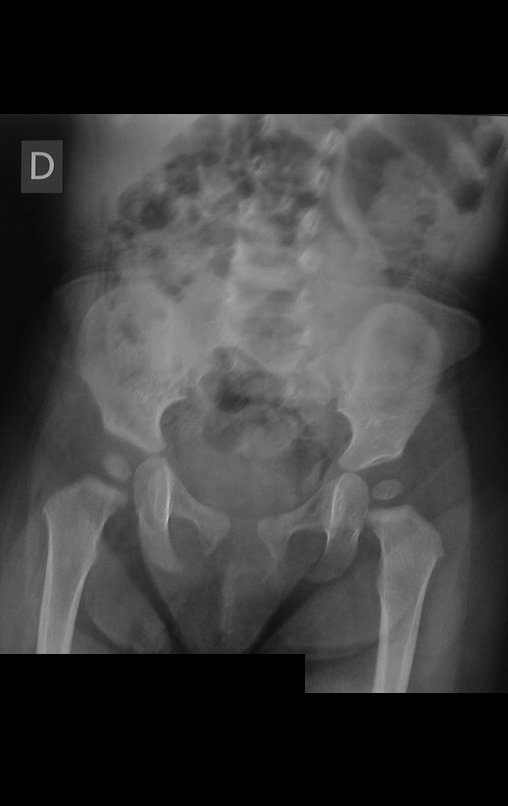
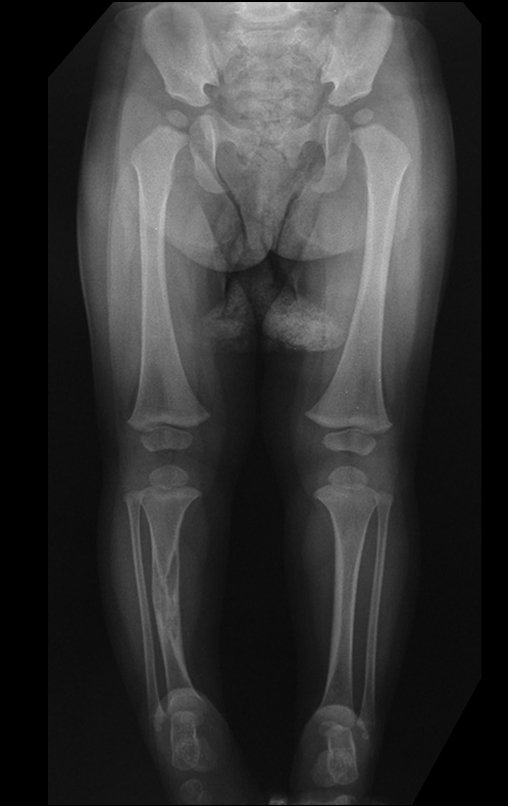
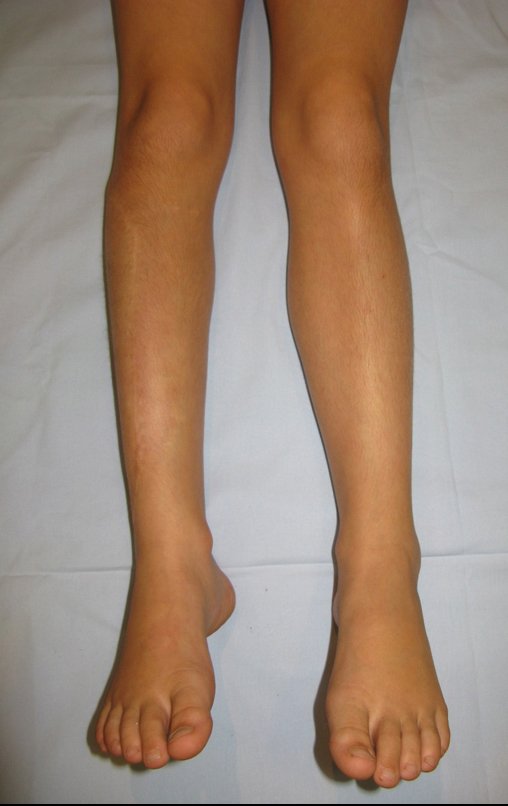
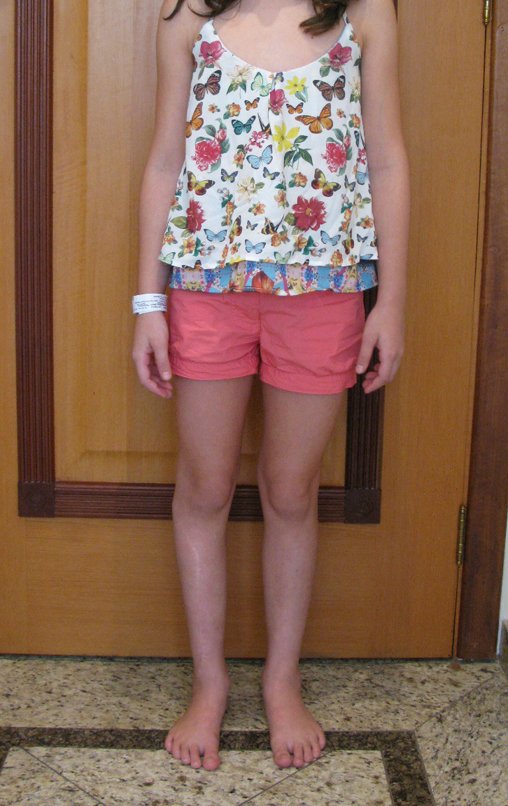
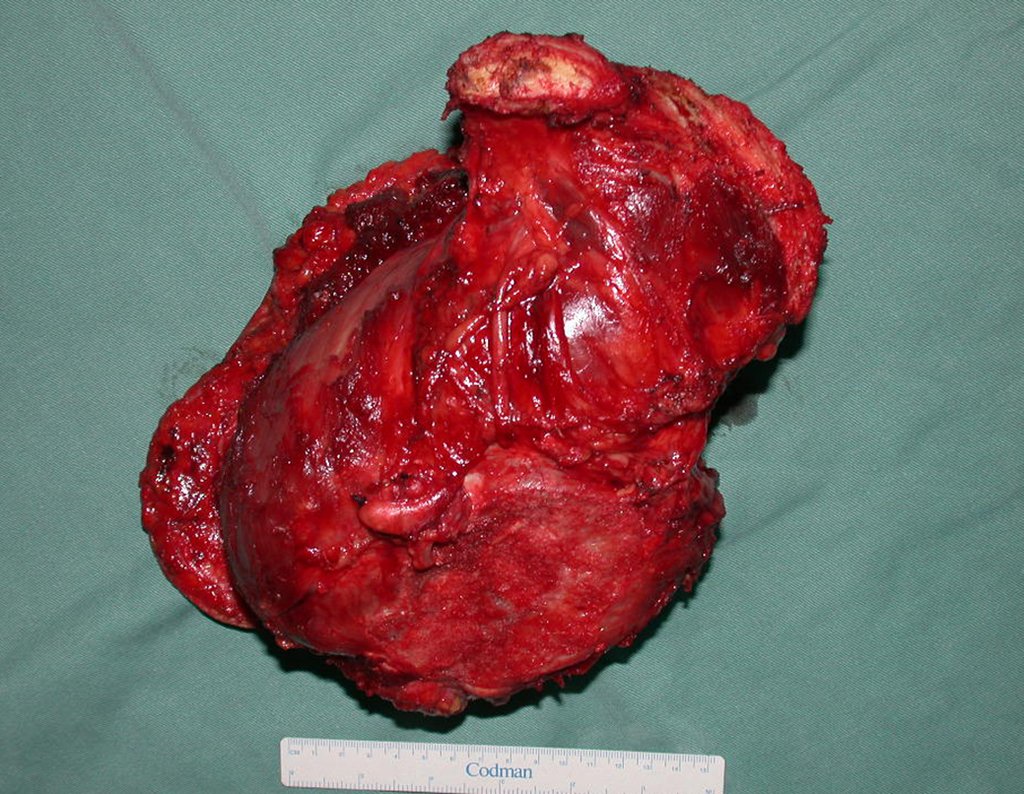
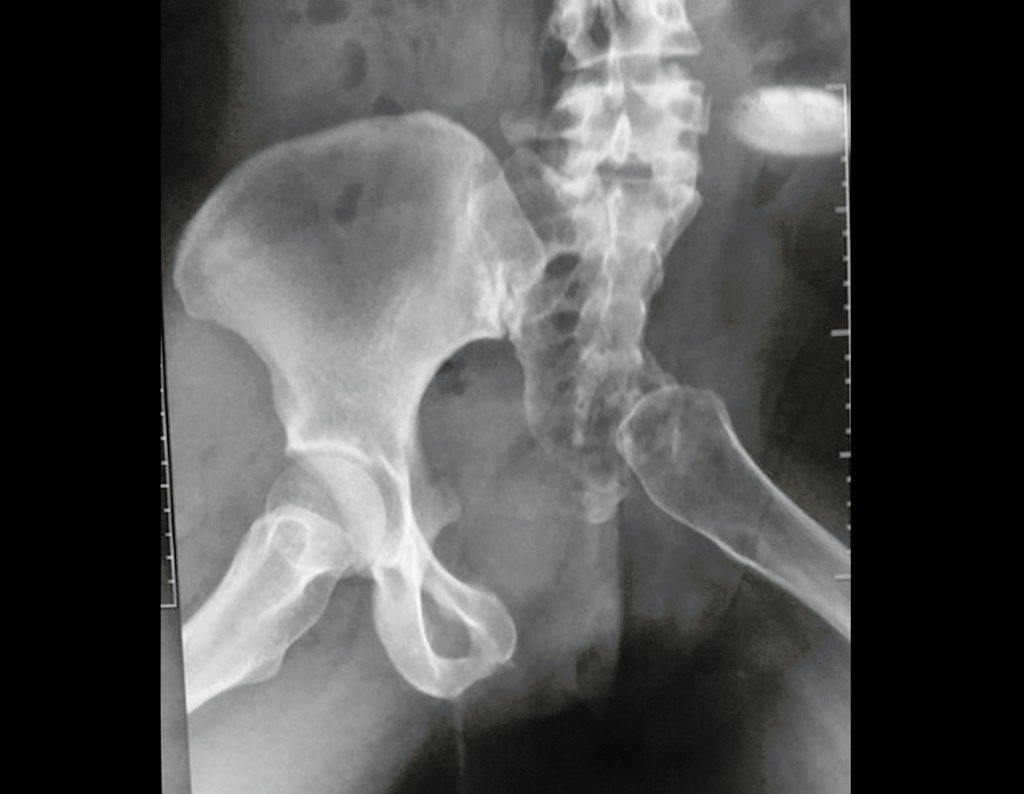
Surge normalmente nos ossos de origem endocondral e principalmente na raiz dos membros (ombro, pelve, costela e esqueleto axial (1)) sendo raros nos de origem membranosa (24,11,15,14). É de crescimento lento e o paciente muitas vezes busca tratamento quando a lesão apresenta grandes proporções. Este tumor pode acometer qualquer idade, com predomínio entre os 30 e 40 anos (7, 11, 22), com referência na literatura desde os três anos (15) até os 73 anos (1) de idade.
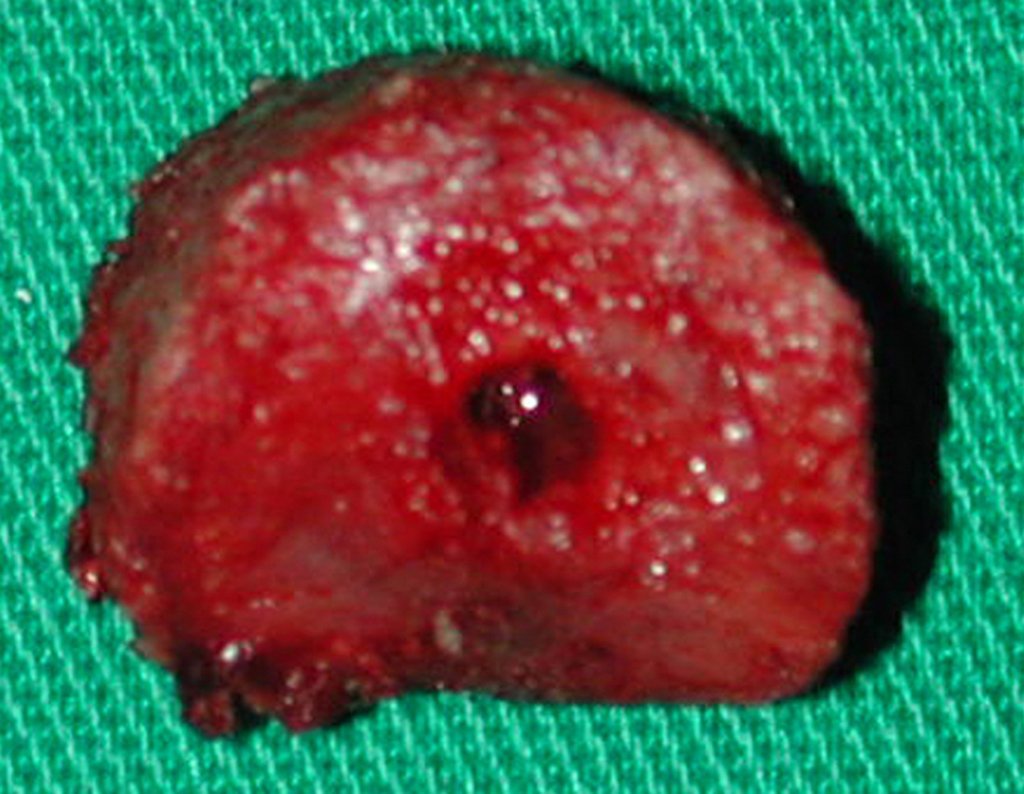
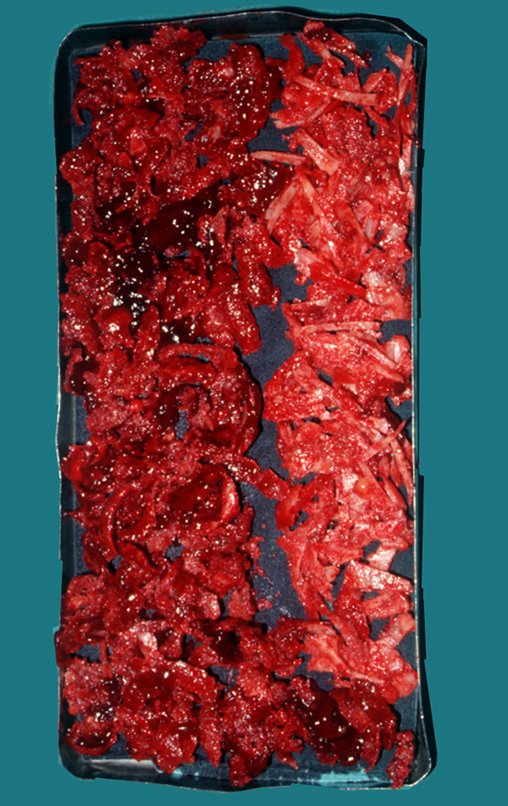
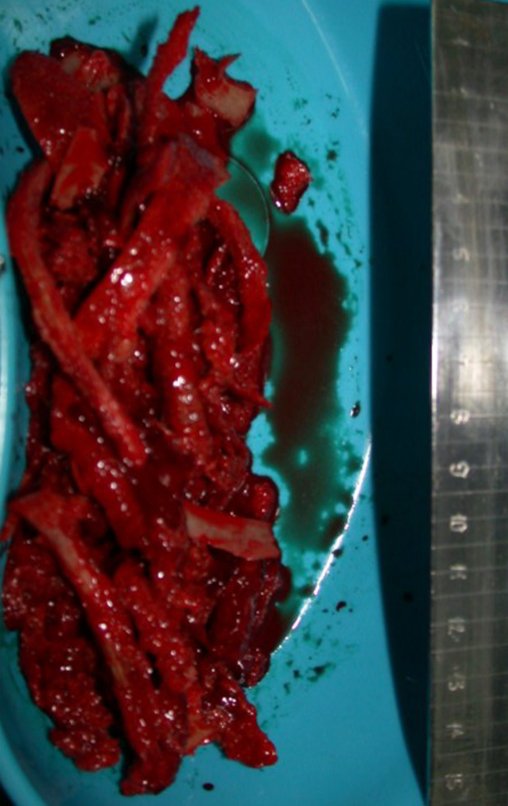
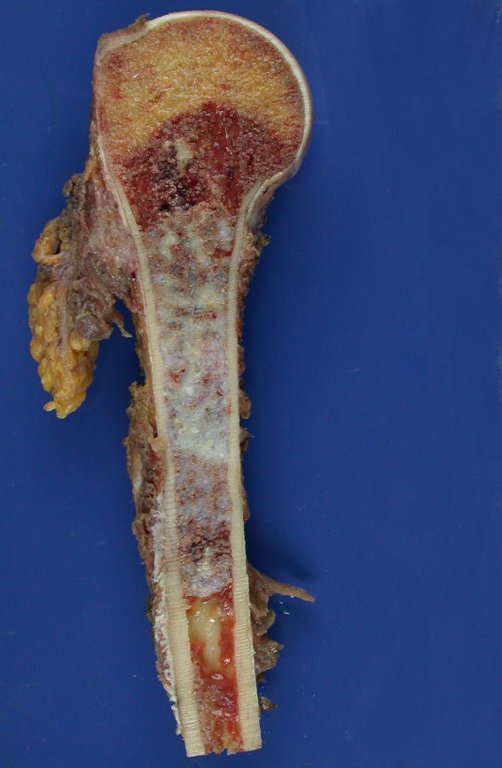
É uma neoplasia maligna de natureza mesenquimal, produtora de substância intersticial e células que assumem aspecto de cartilagem hialina, com graus variados de imaturidade e focos de calcificação freqüentes, podendo ocorrer em diferentes locais.
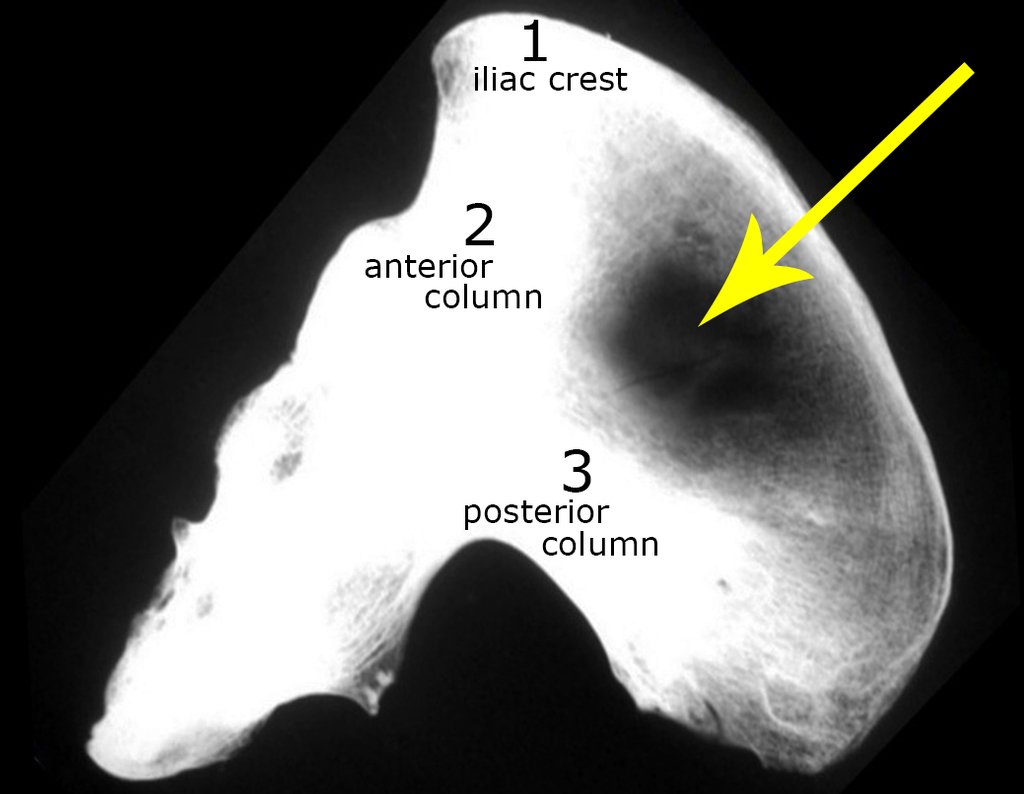
Podem ser classificados quanto a localização em: A- central, B- justa cortical (paraosteal, ou periosteal) (23,2,24,6,3), C- periférico (ou exofítico, que ocorre na capa cartilaginosa de um osteocondroma) (28) e D- de tecidos moles (13); quanto à histologia em: A- grau de anaplasia: classificam-se em graus I, II e III , B- desdiferenciado, C- mesenquimal e D- células claras; quanto à origem podem ainda ser: 1– primário e 2- secundário (que se origina no local de uma lesão benigna cartilaginosa preexistente, como na doença de Ollier (encondromatose) ou na Síndrome de Maffucci a transformação para condrossarcoma é freqüente (20 à 30 %) (2,28), podendo ocorrer também a partir de osteocondroma solitário (em menos de um %) ou múltiplo (10 %) (2) e mais raramente secundário à doença de Paget.
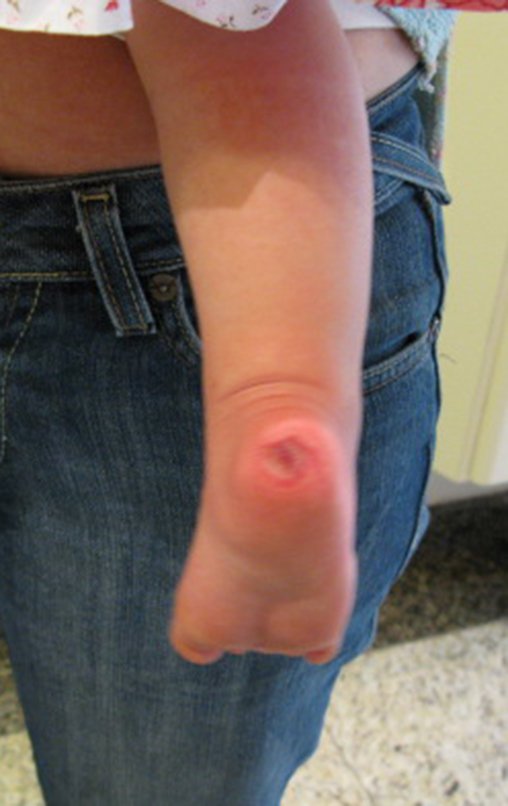
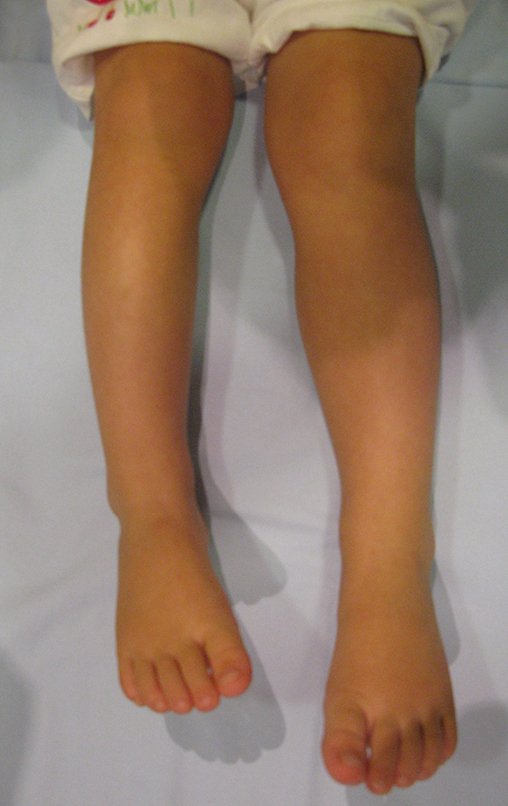
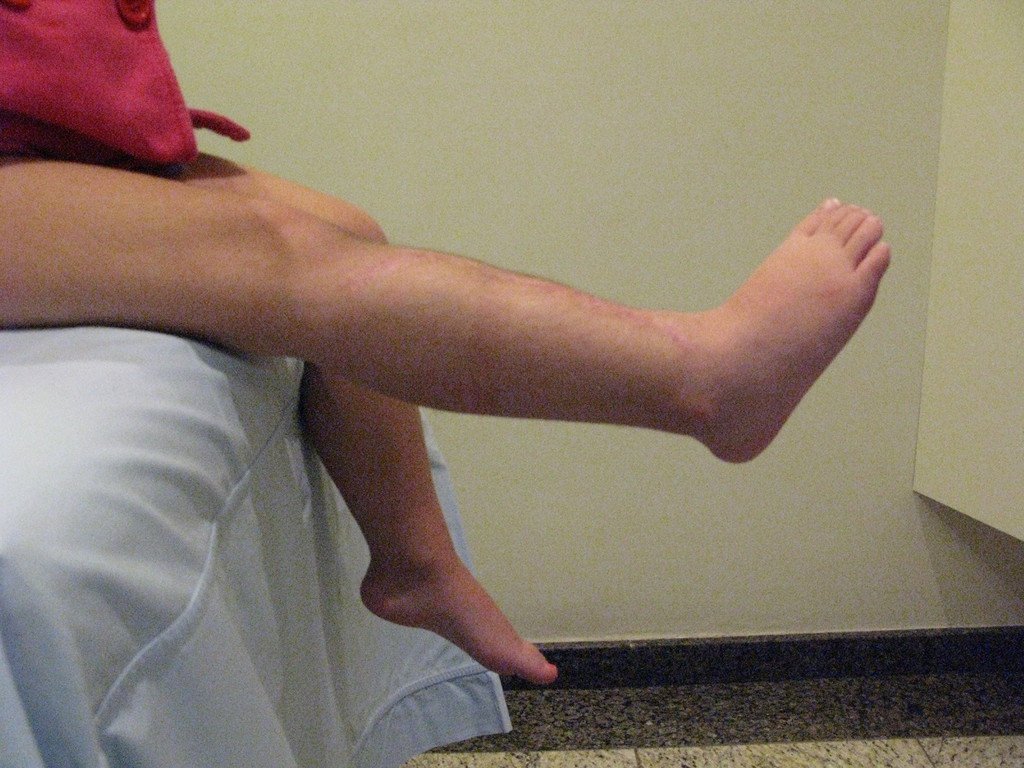
A dor pode ser sintoma insidioso por vários anos, evoluindo com crescimento lento, aumento de volume, restrição de mobilidade ficando a pele às vezes avermelhada e quente (23). O primeiro sintoma muitas vezes é a fratura em osso patológico (2,24).
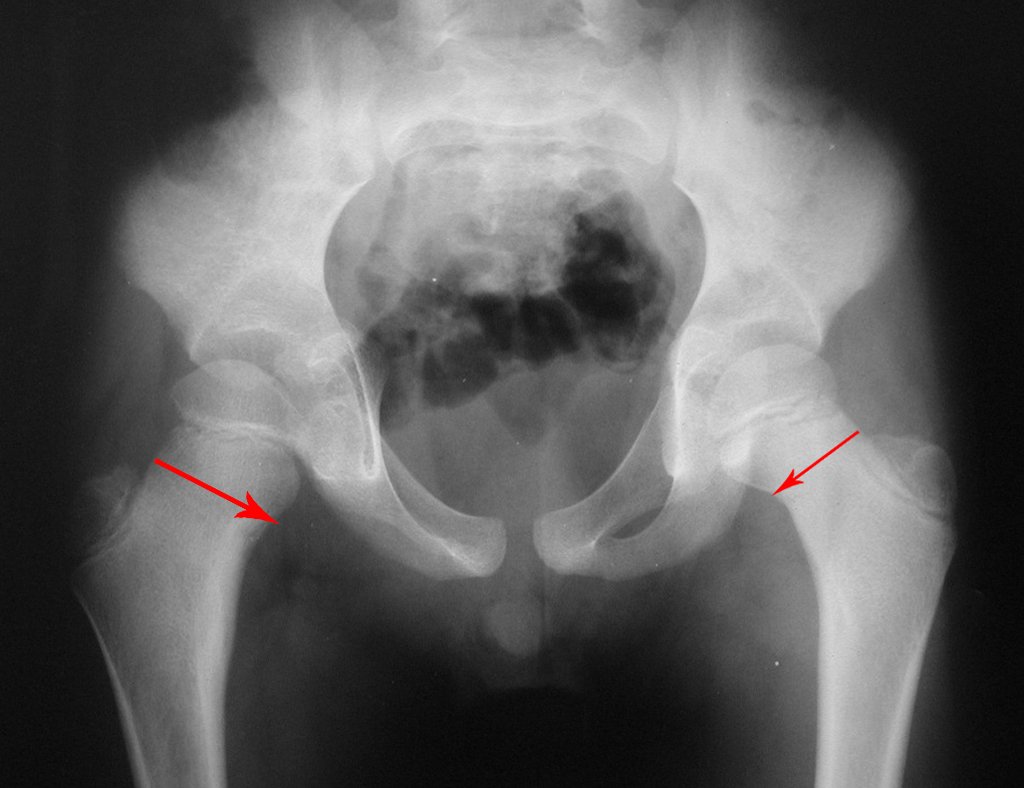
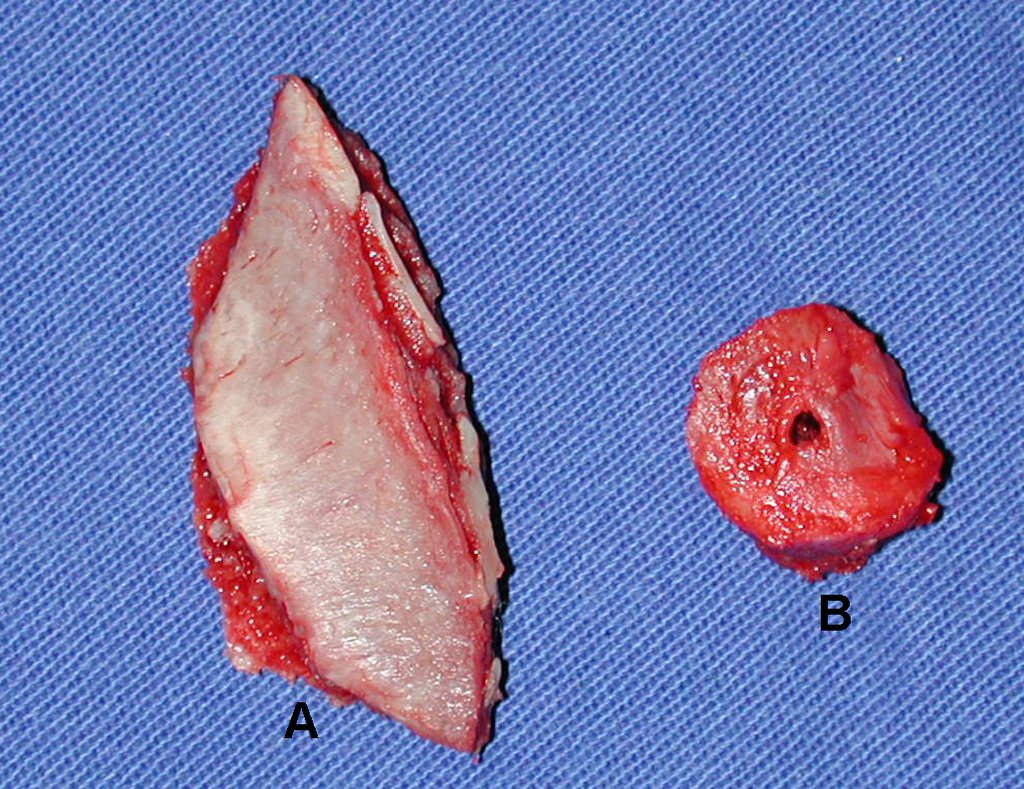
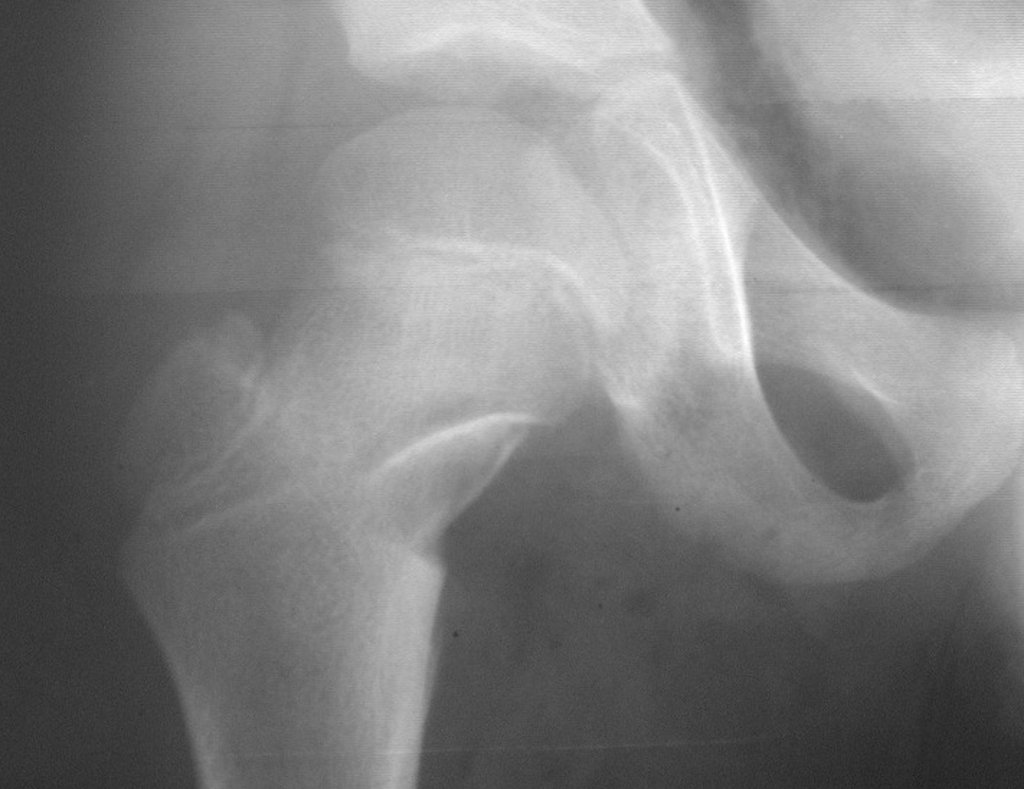
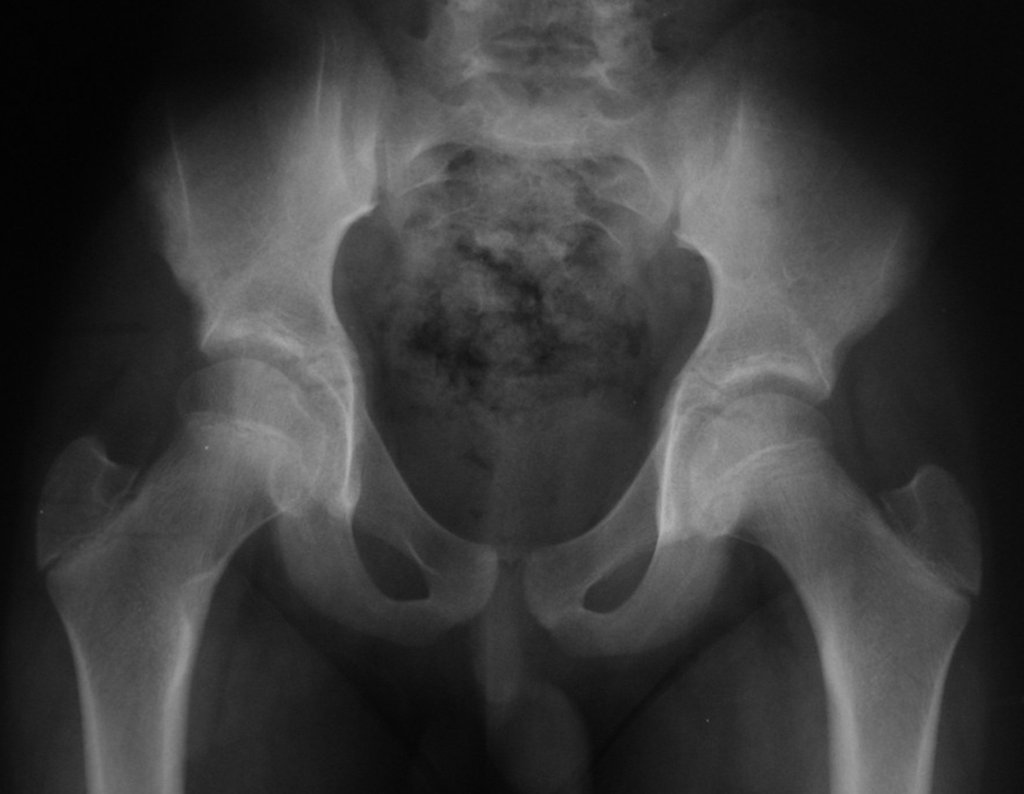
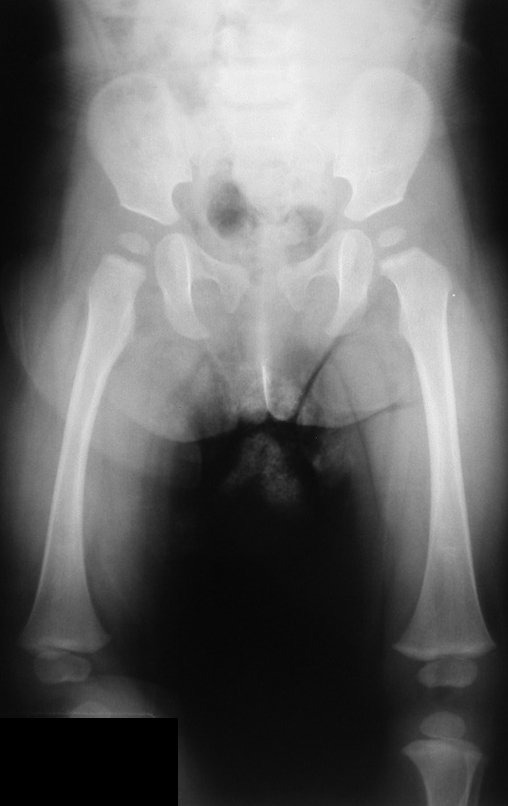
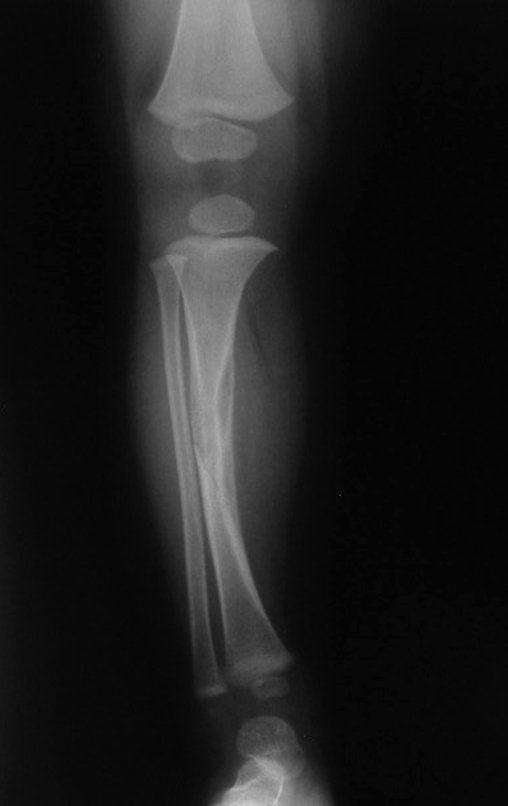
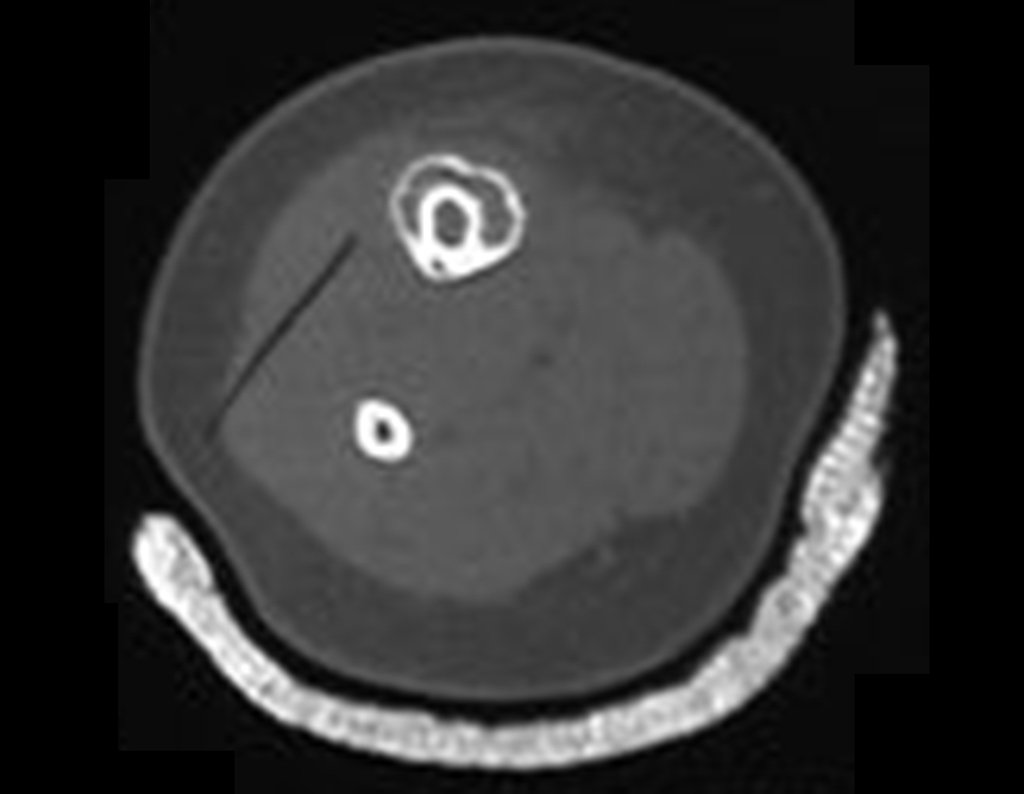
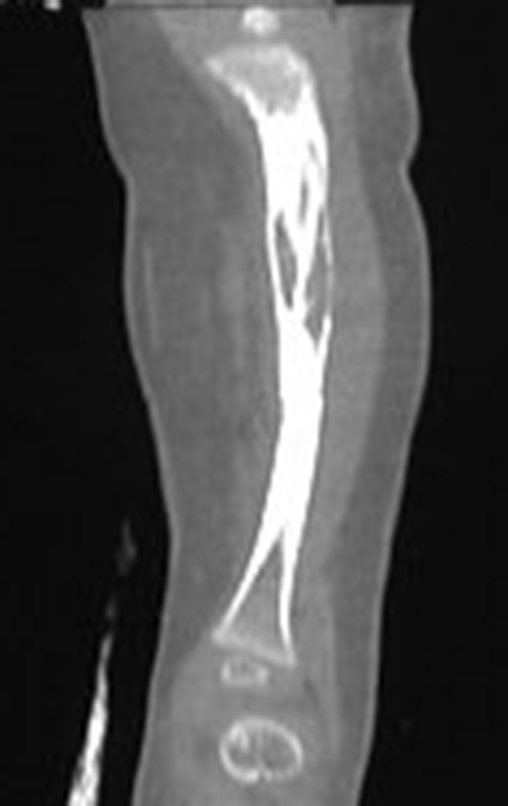
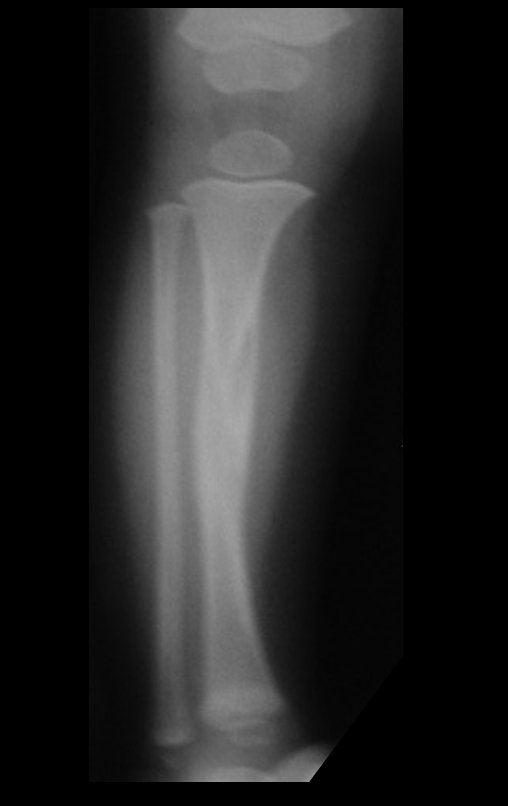
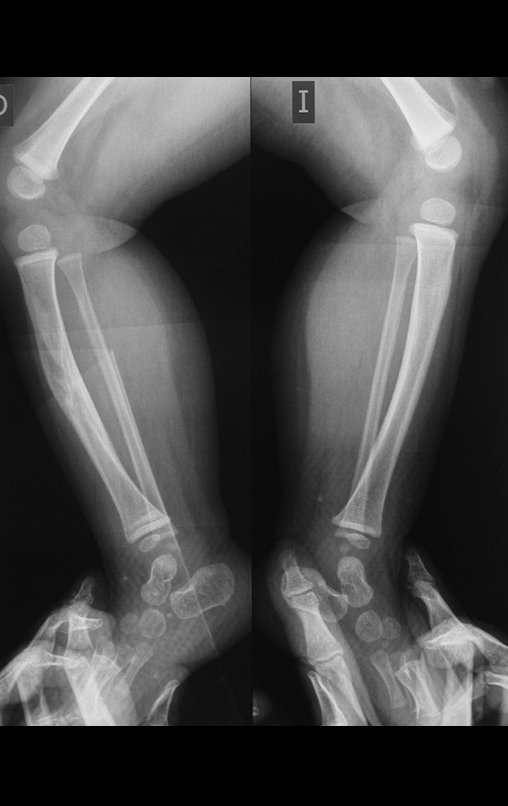
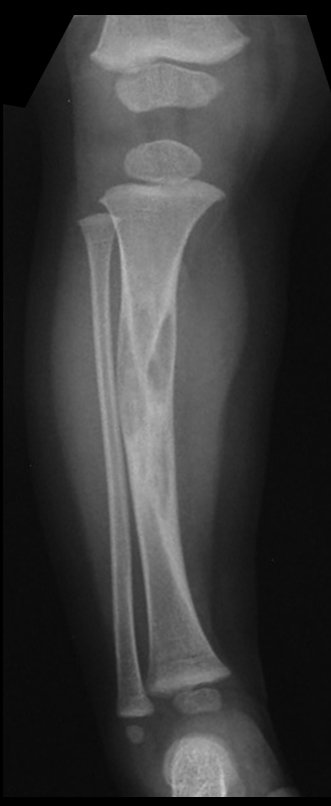
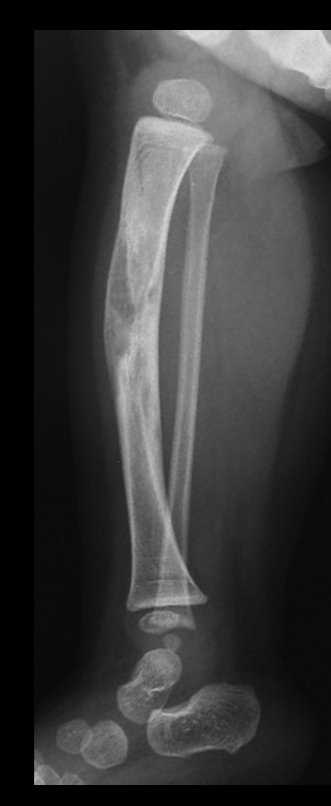
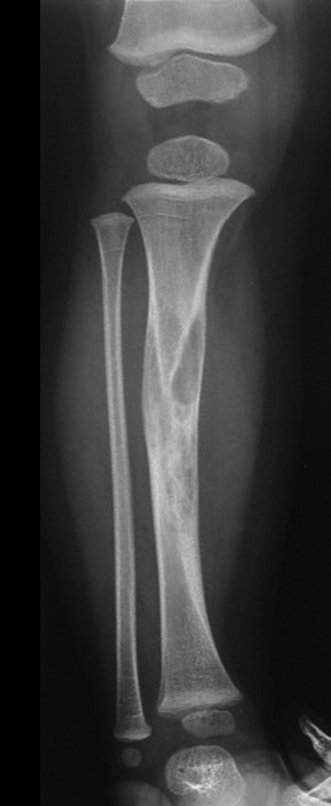
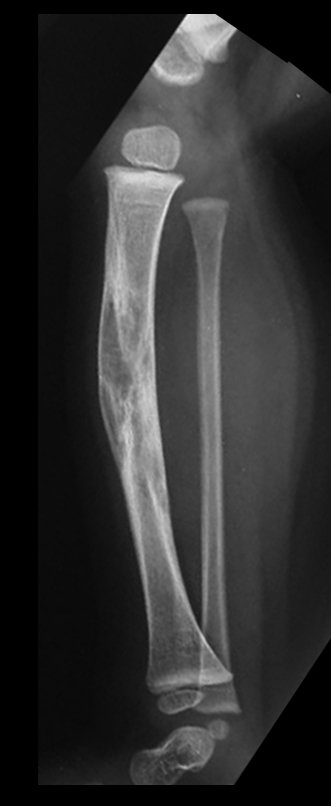
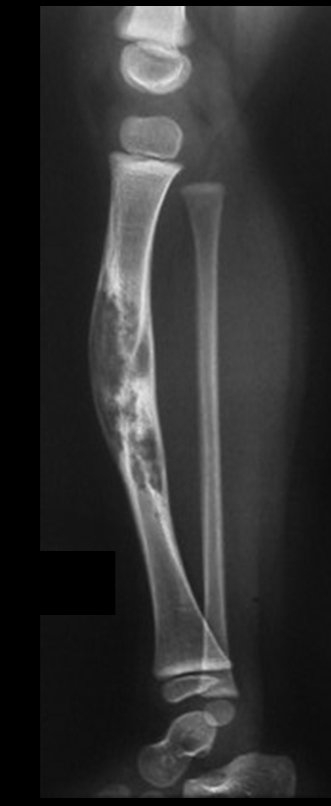
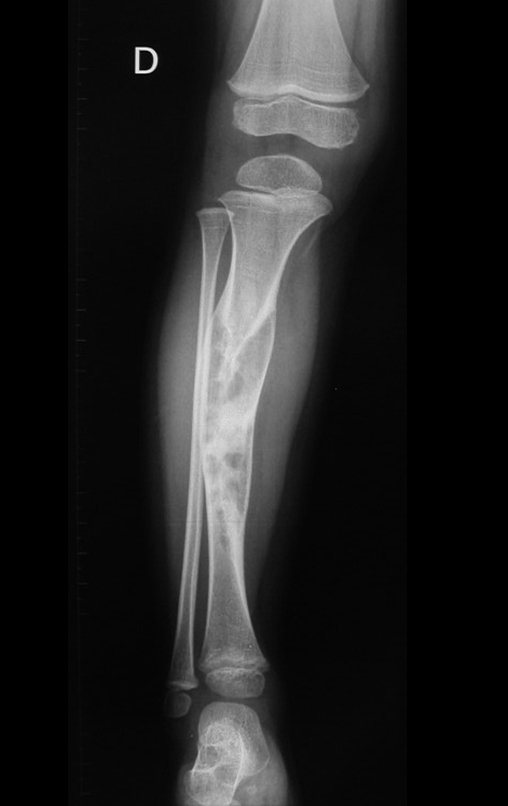
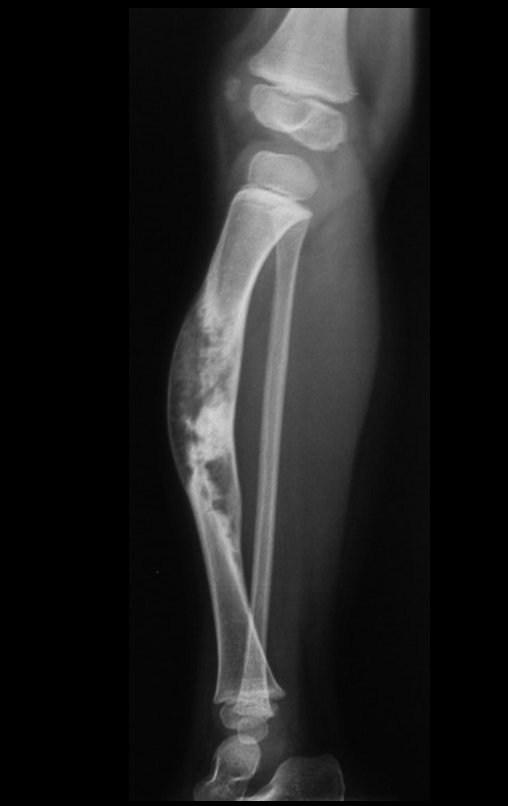
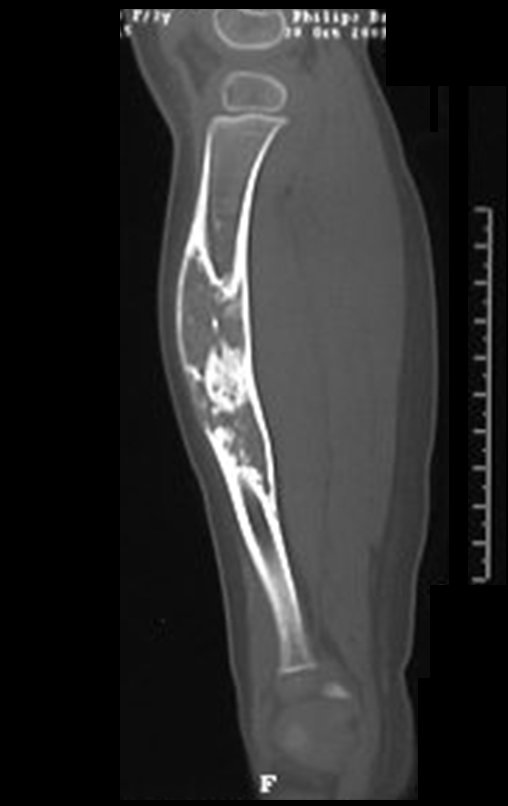
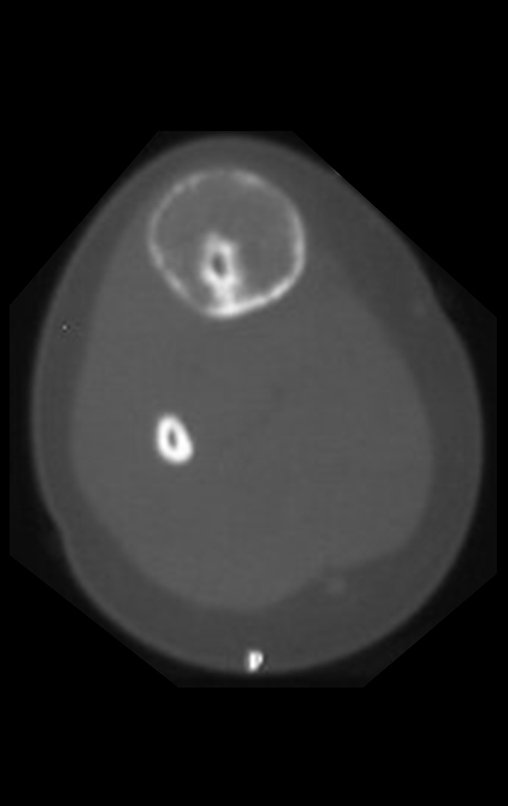
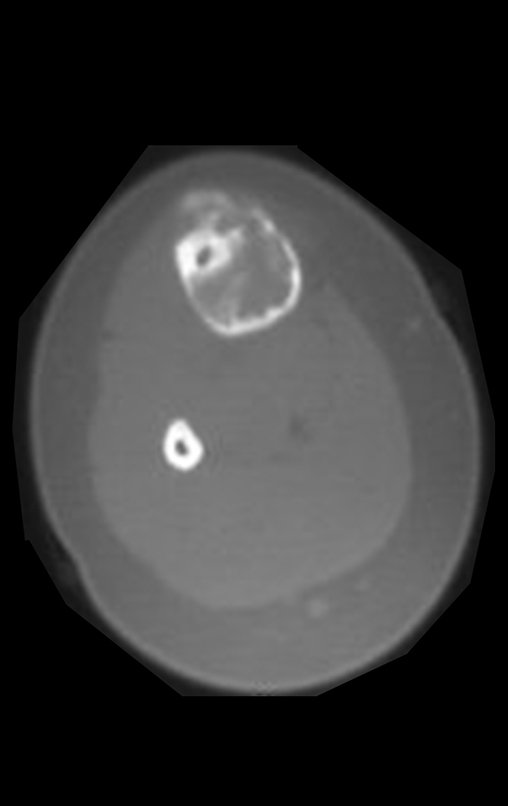
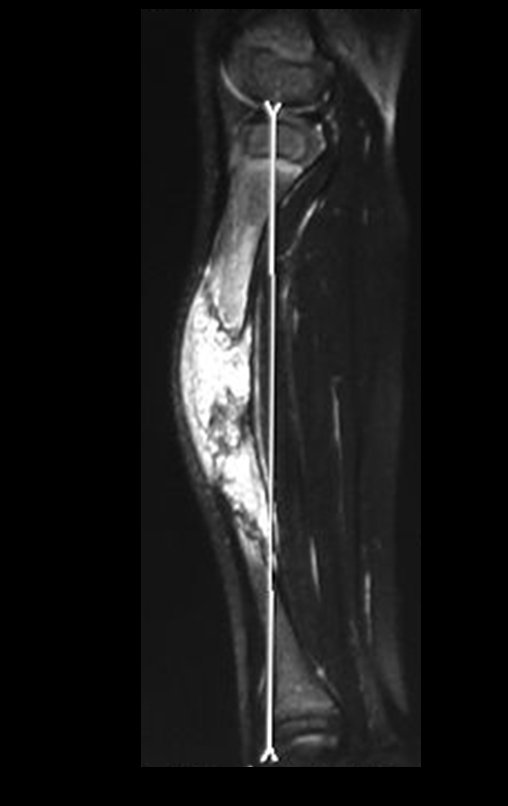
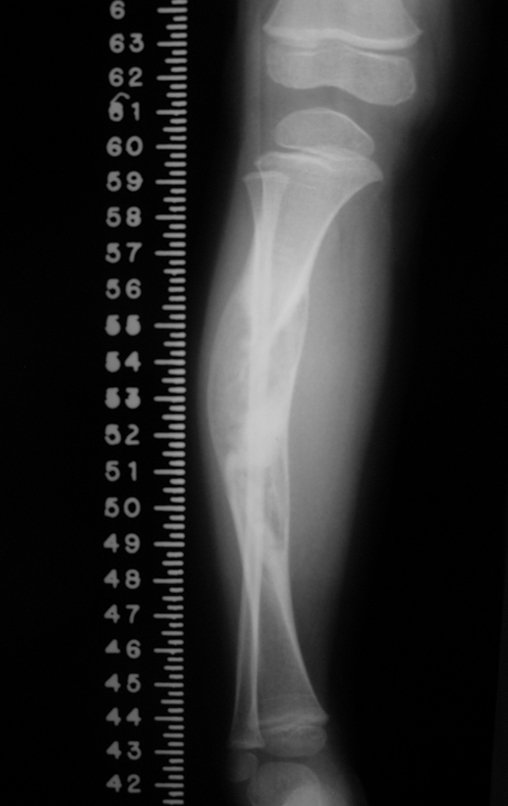
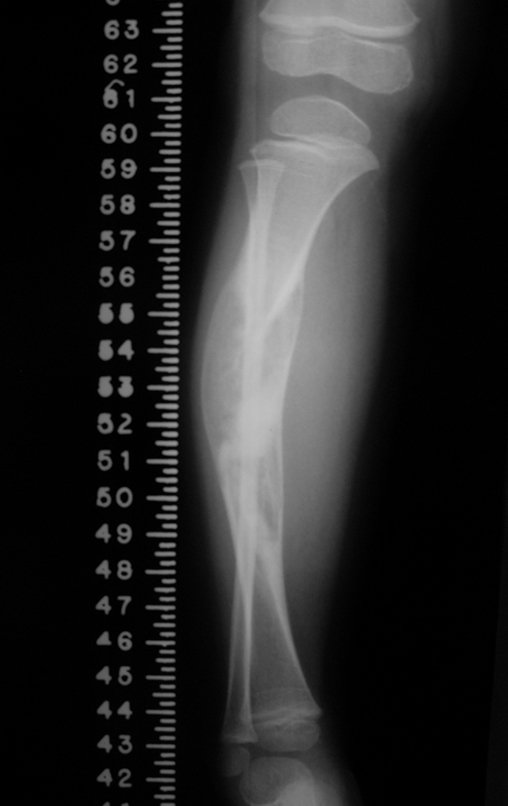
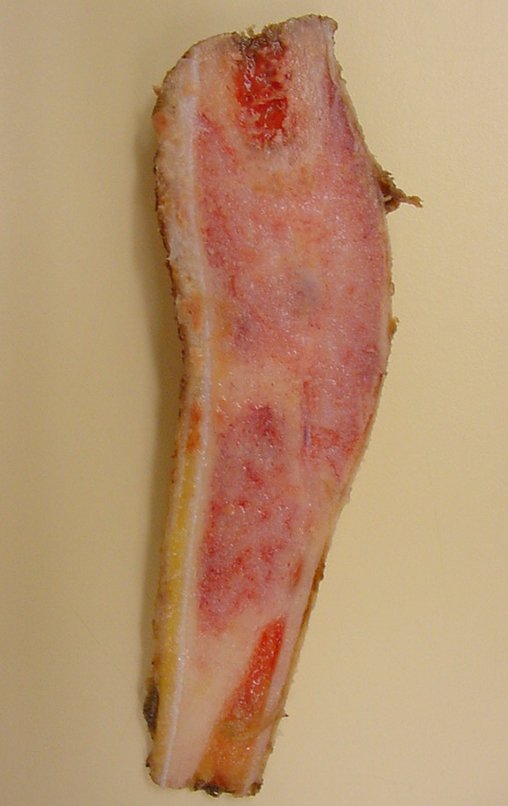
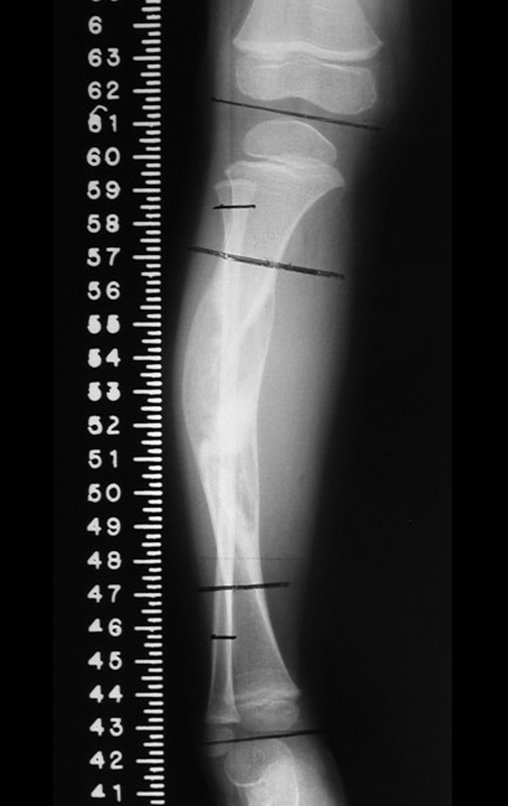
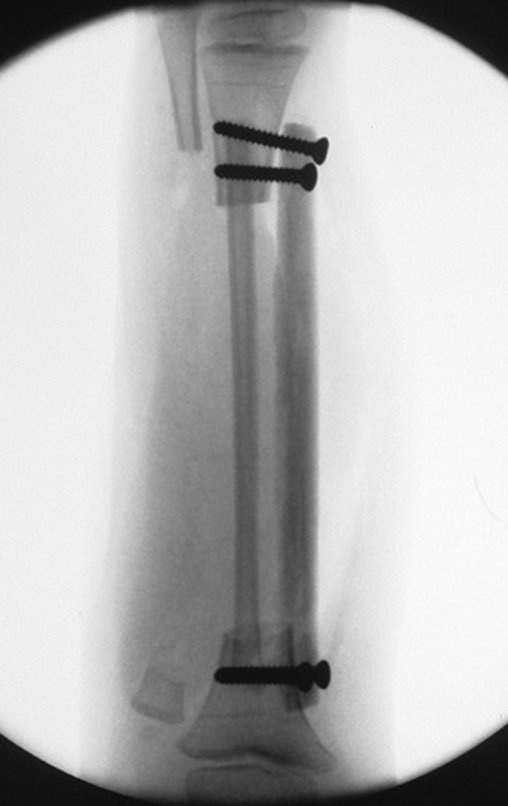
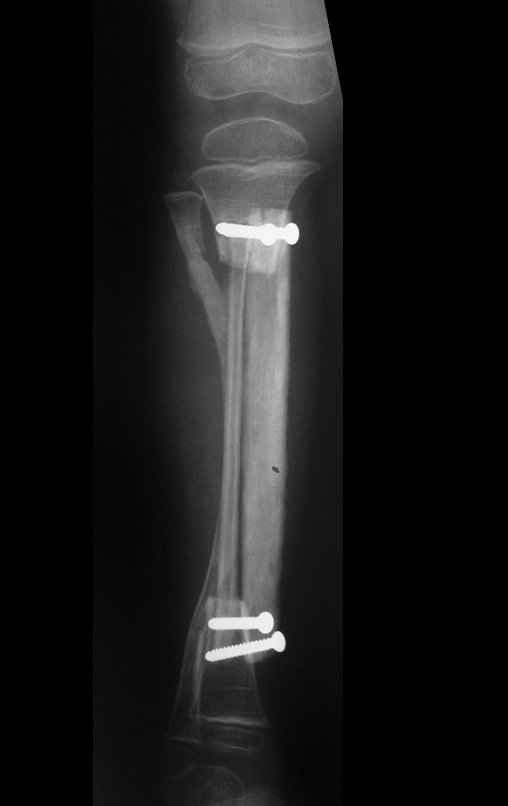
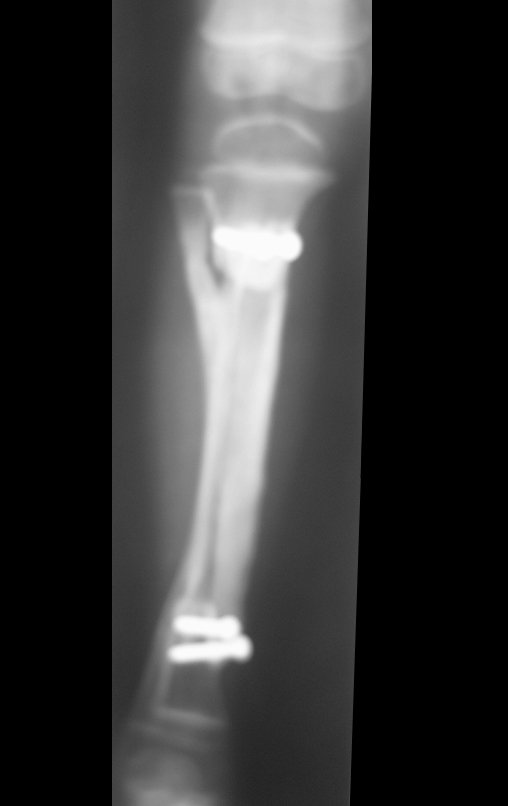
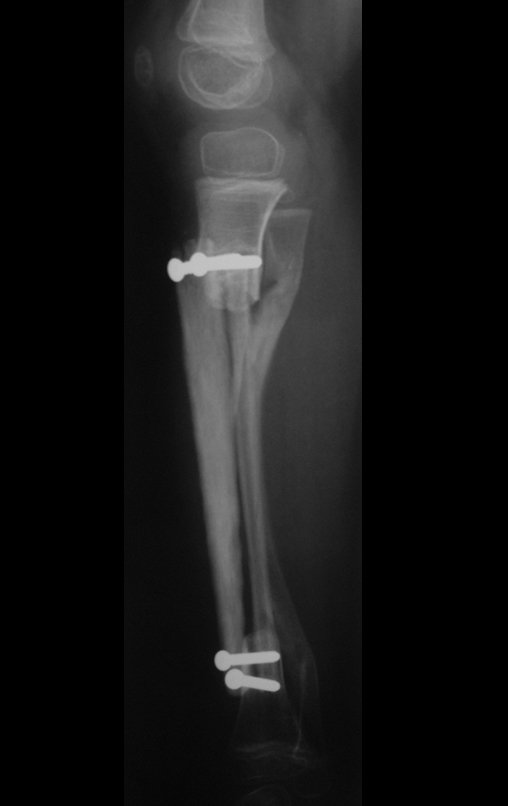
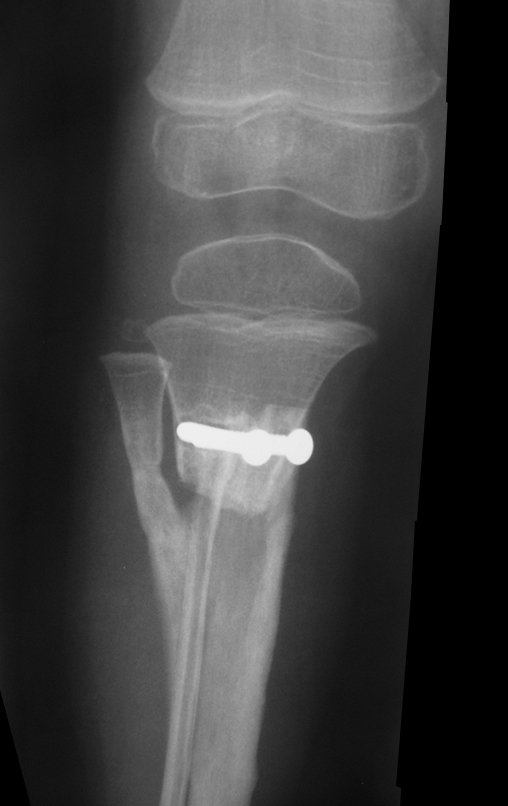
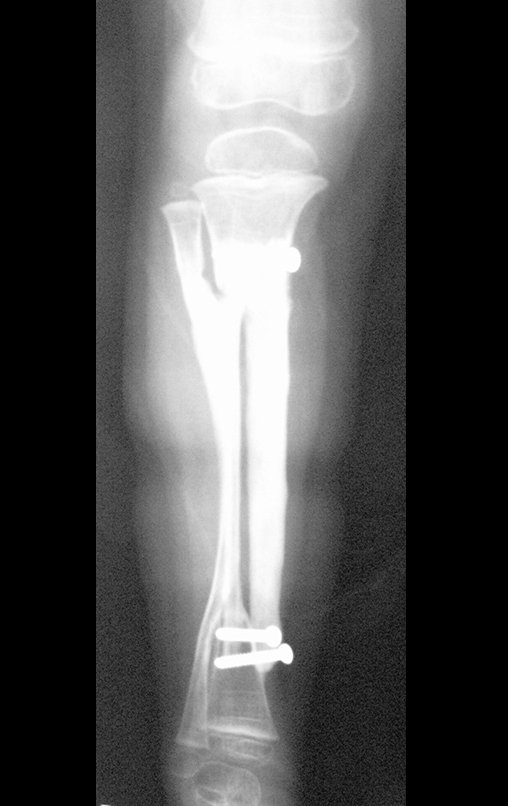
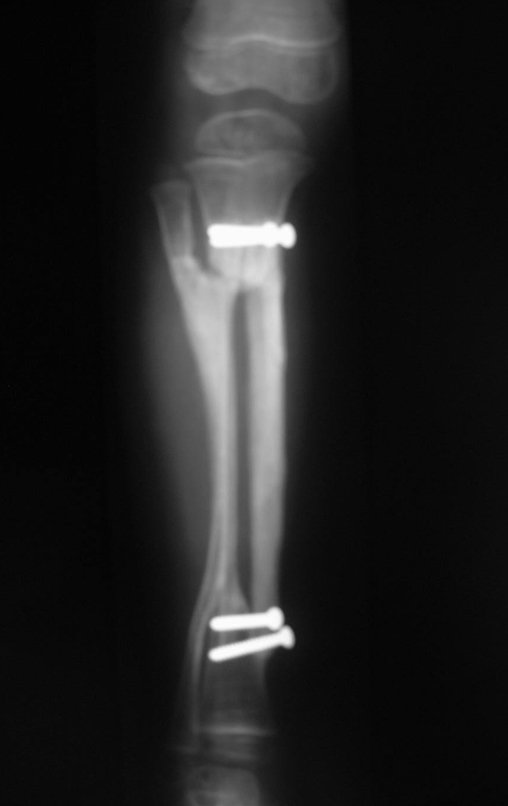
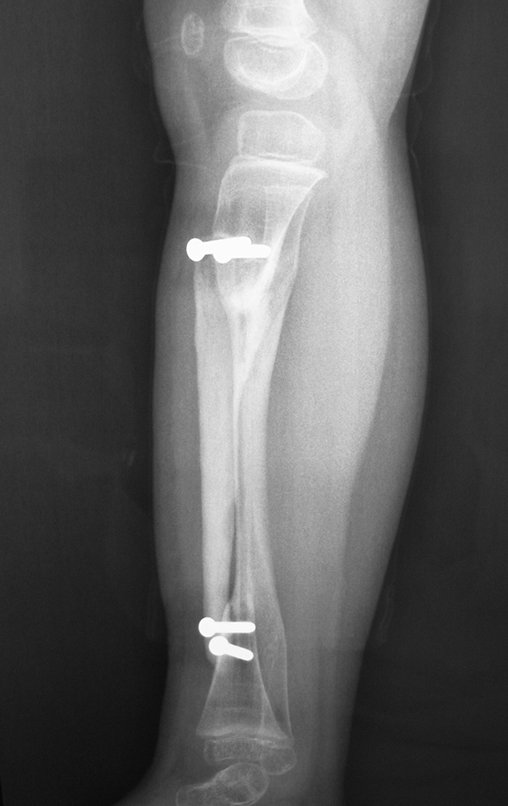
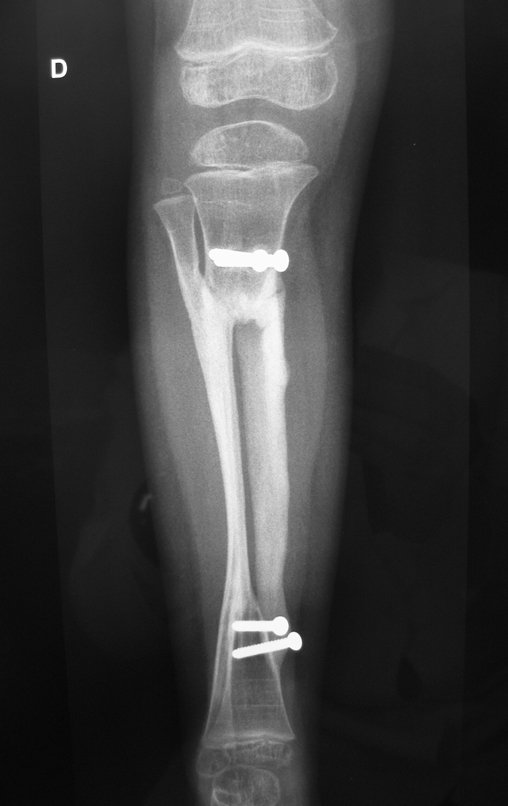
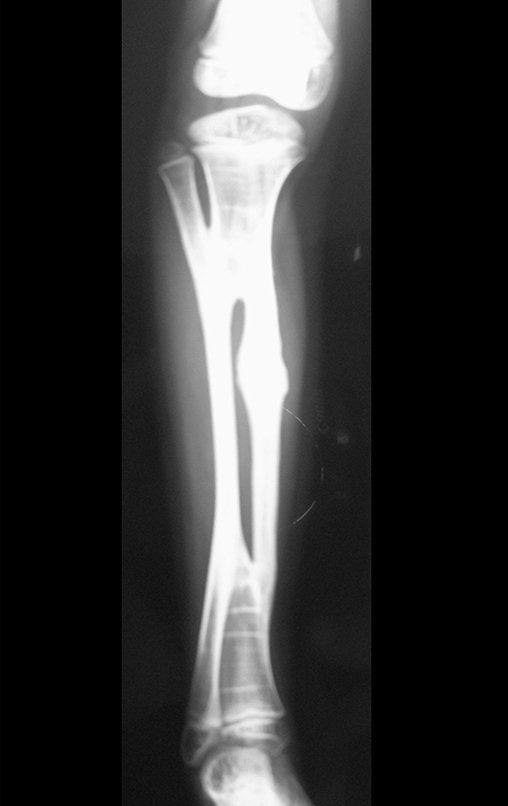
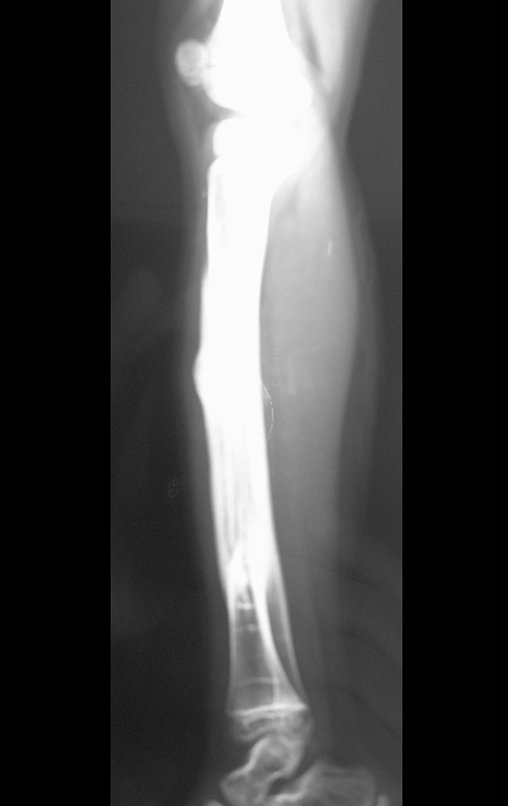
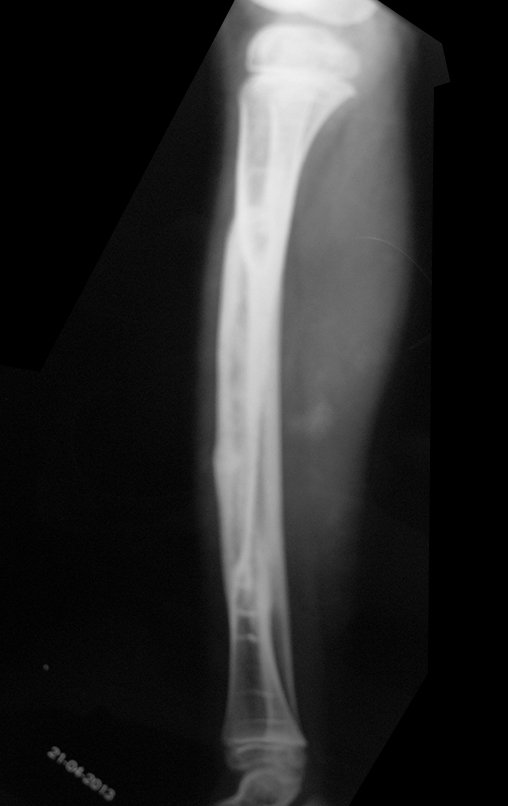
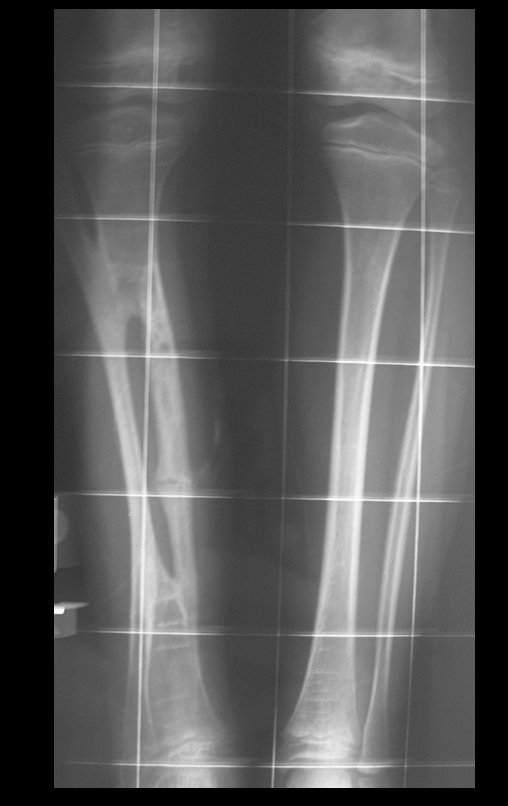
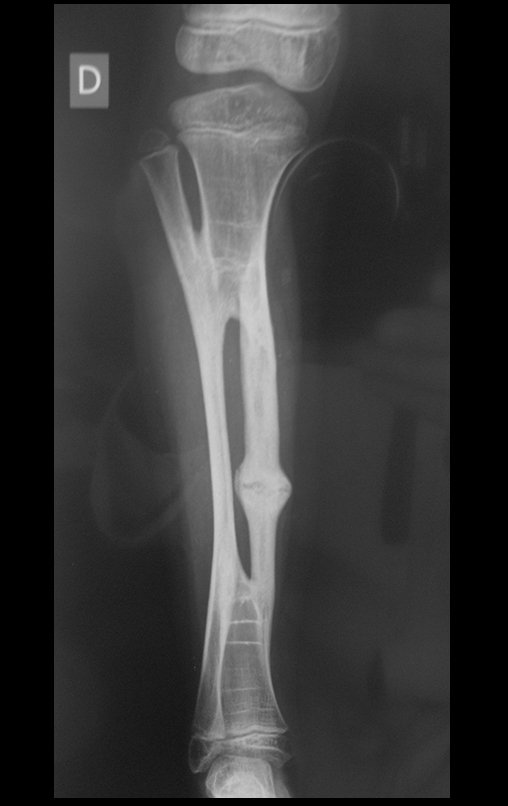
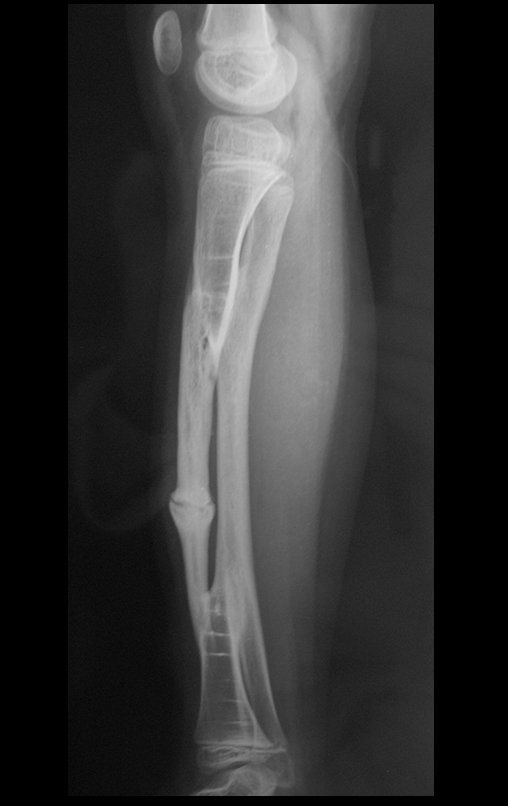
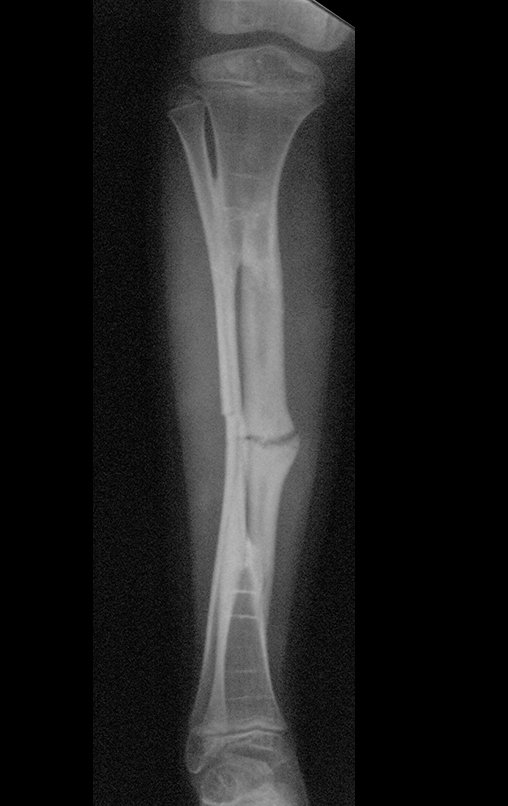
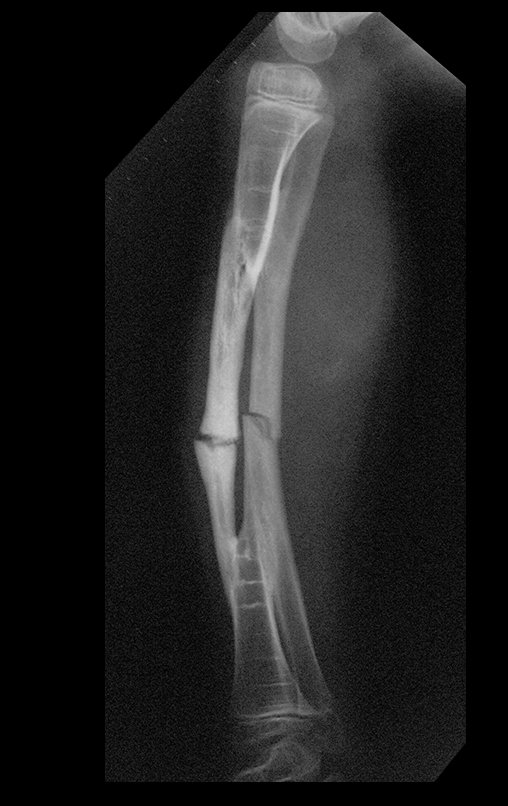
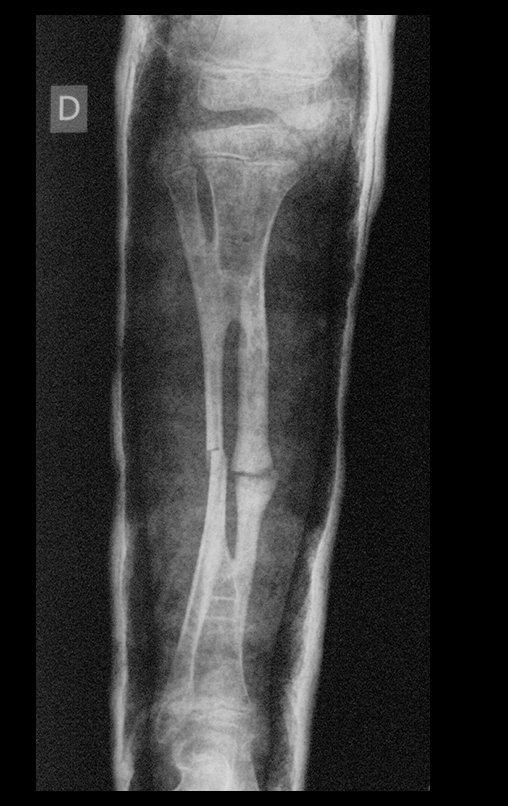
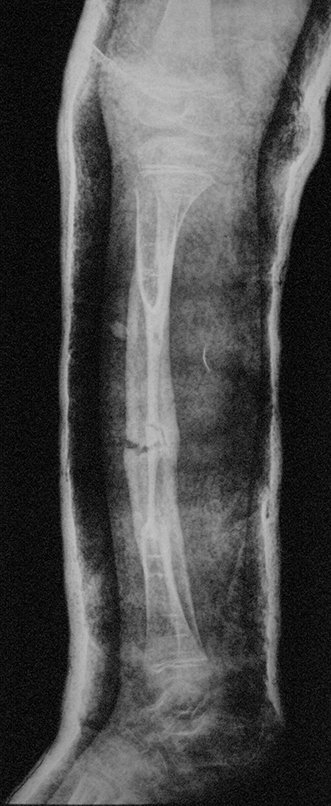
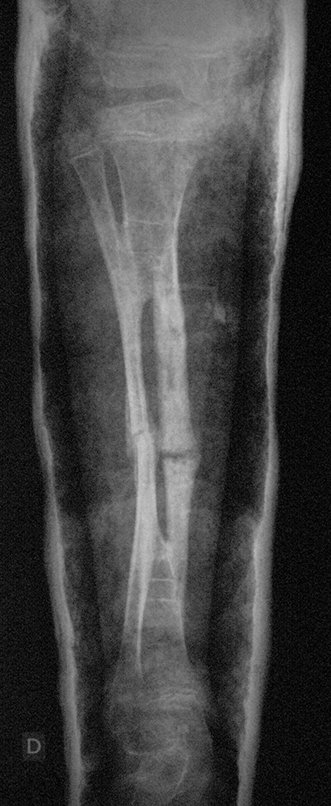
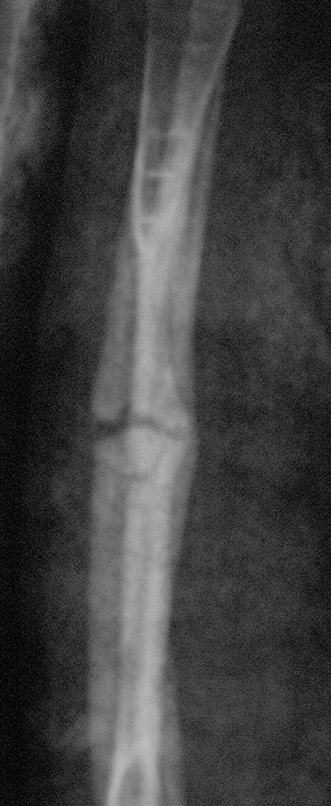
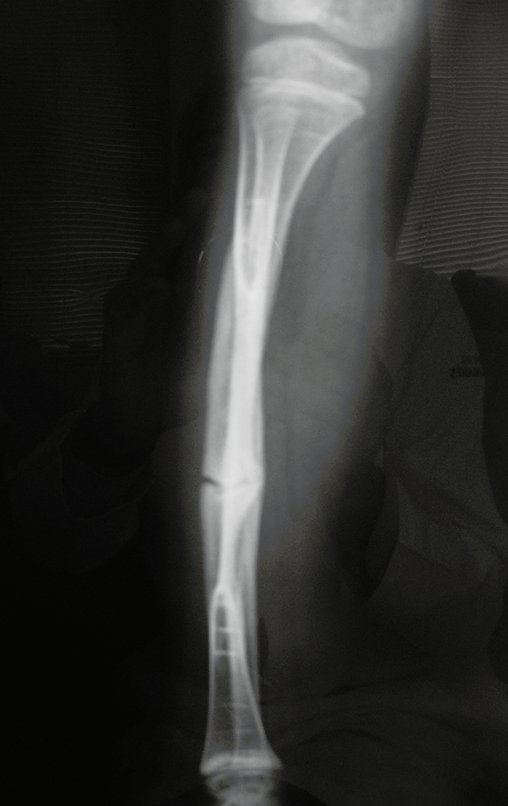
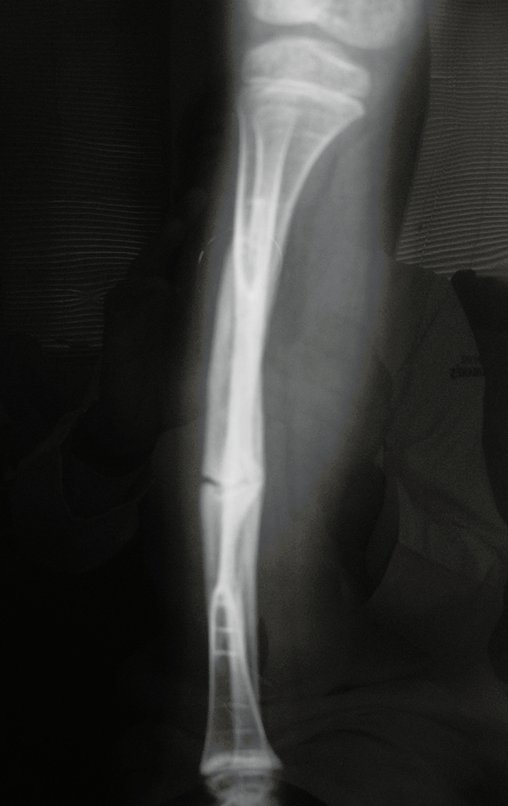
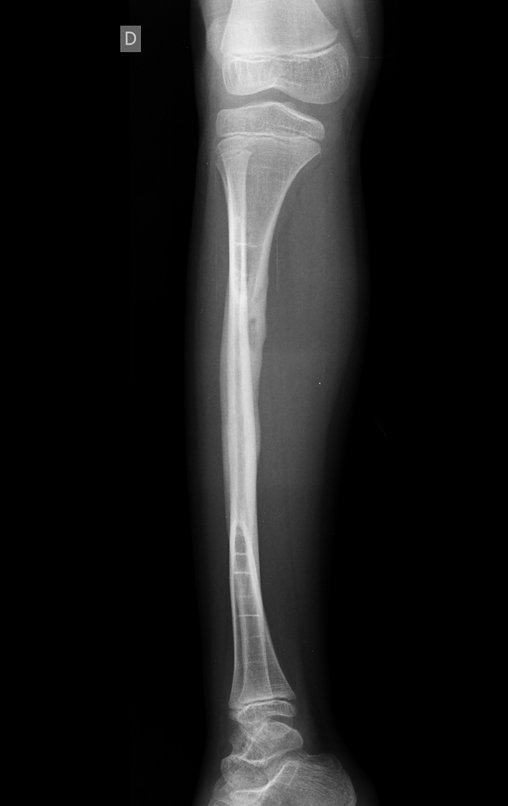
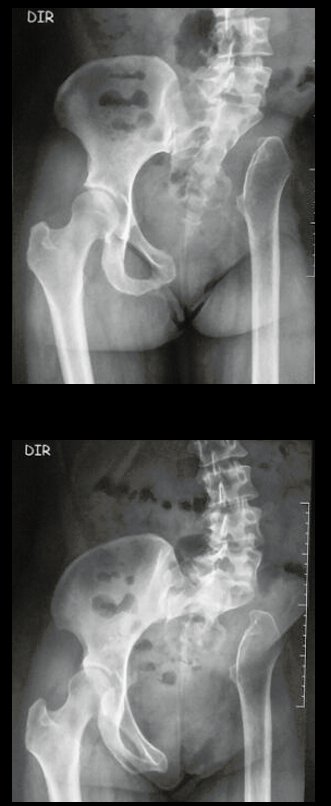
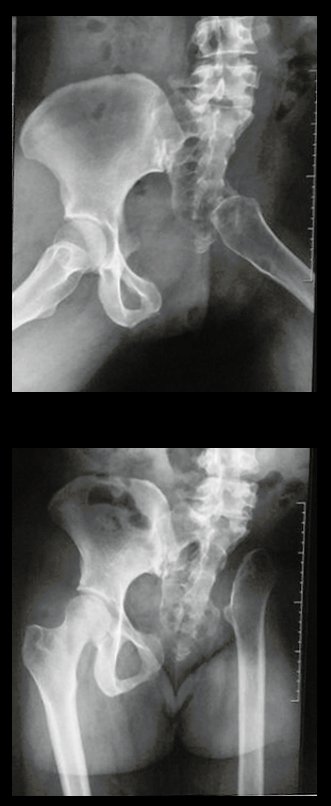
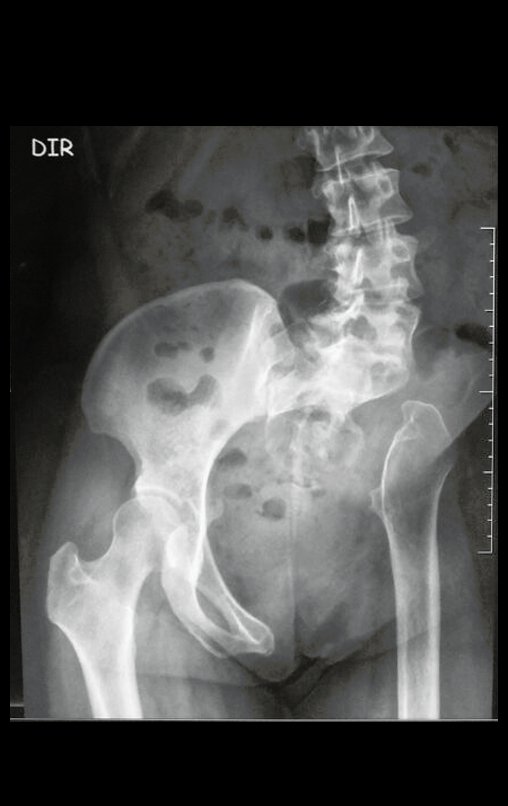
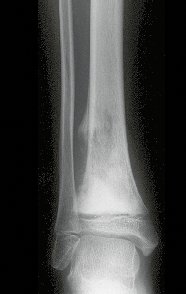
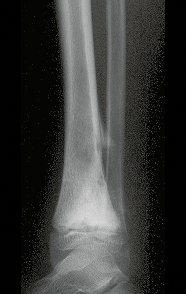
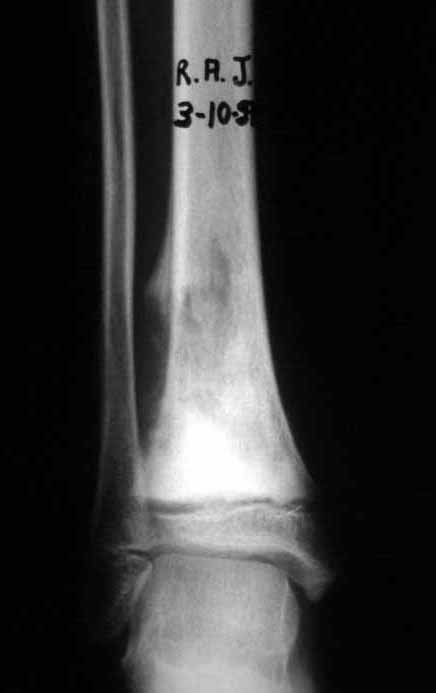
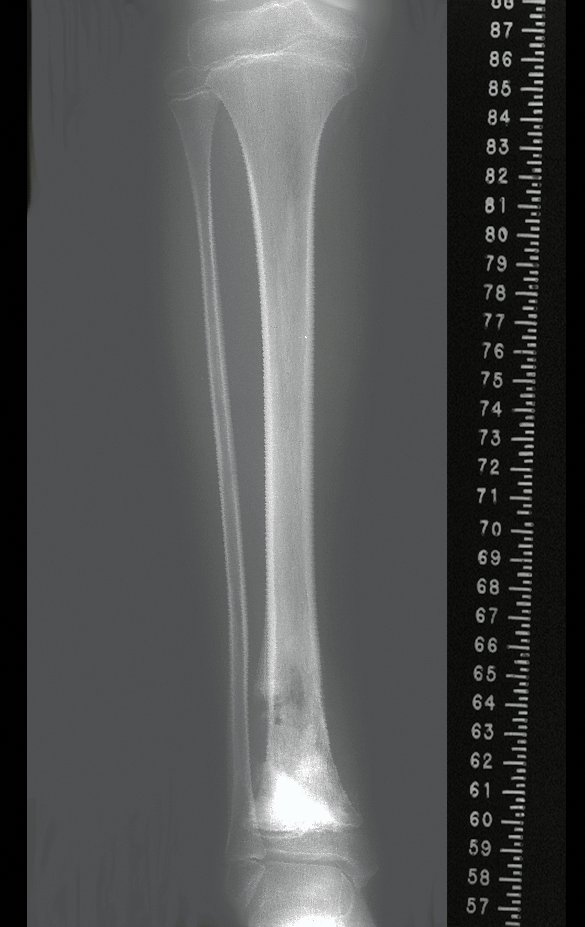
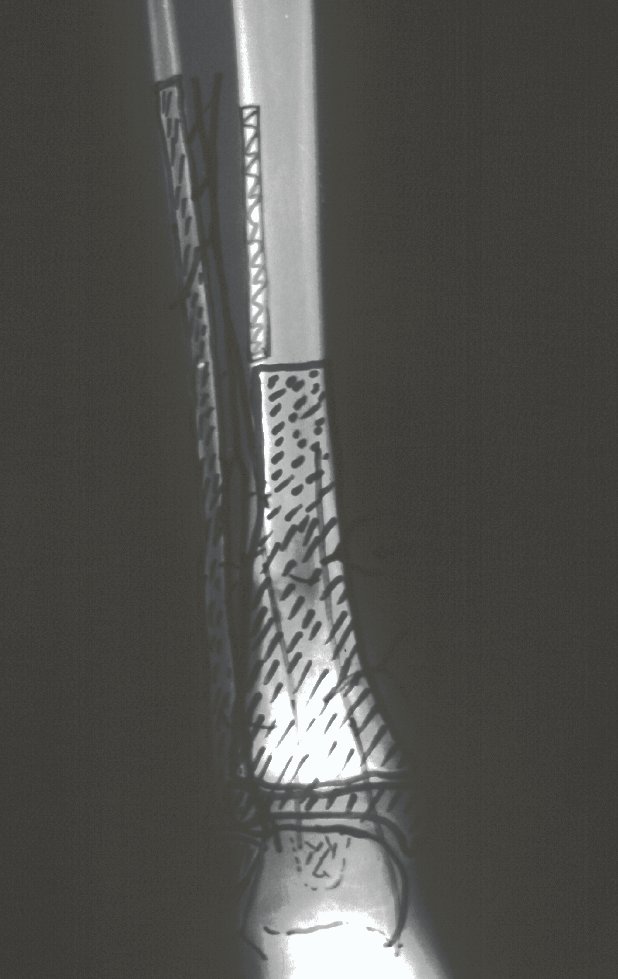
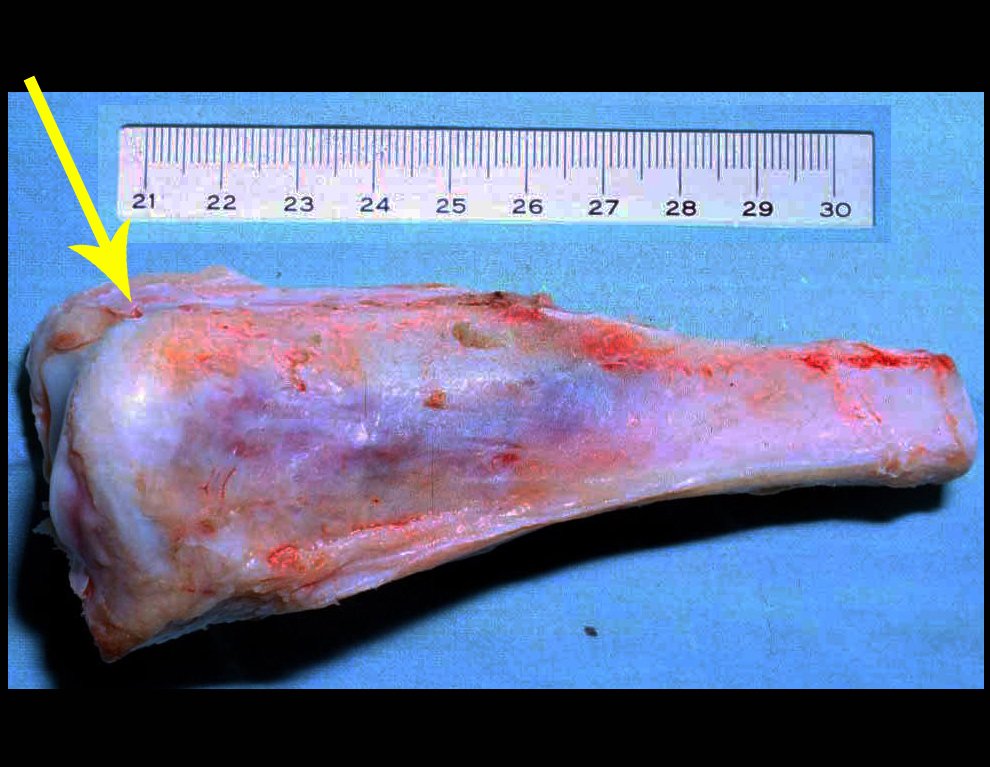
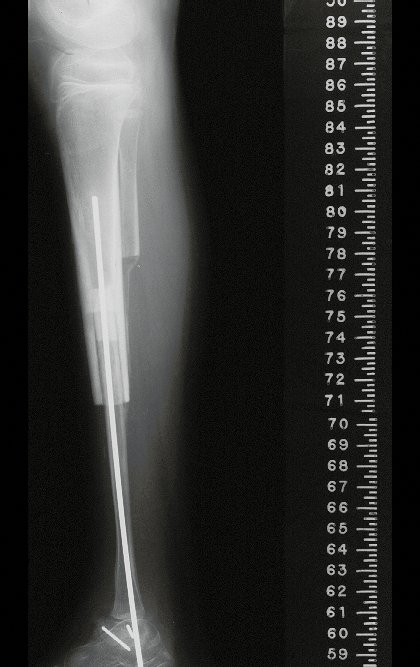
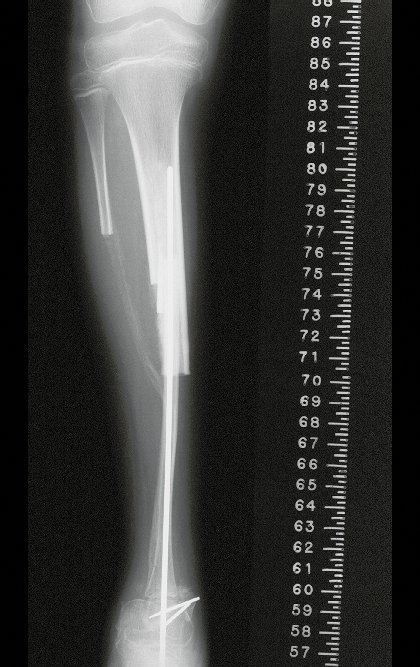
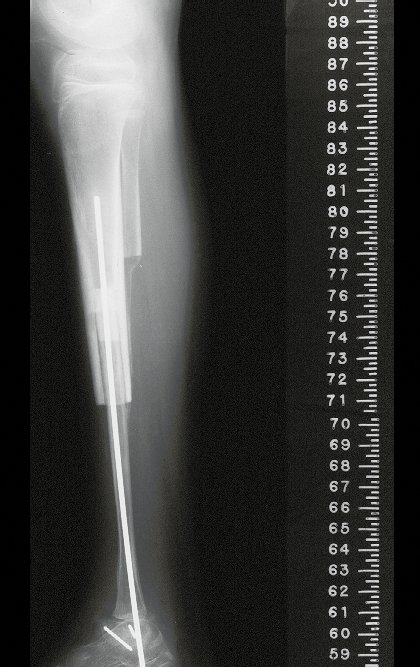
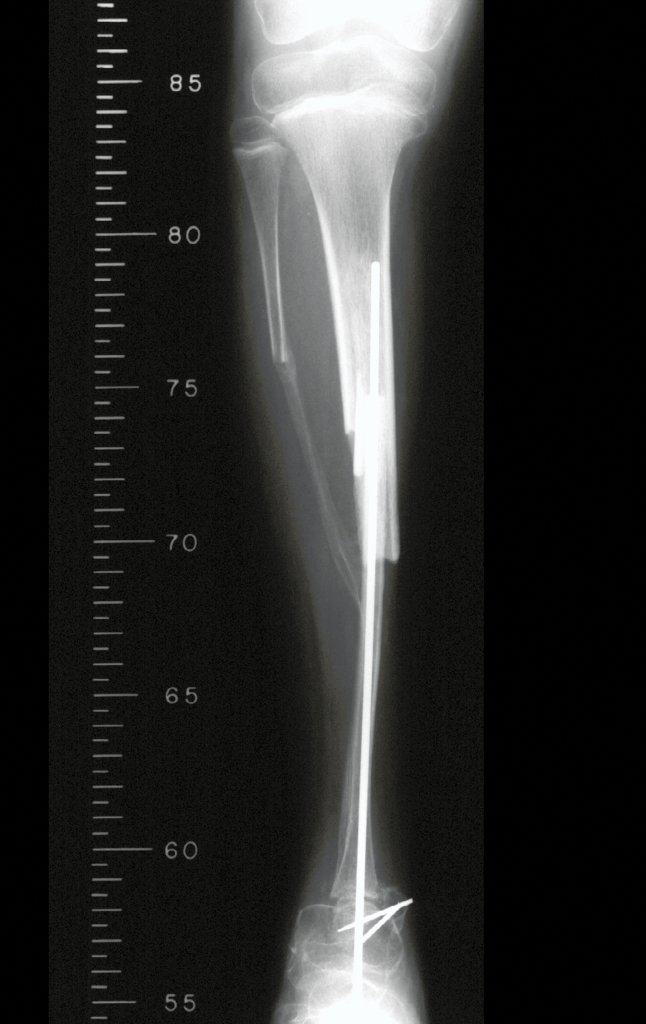
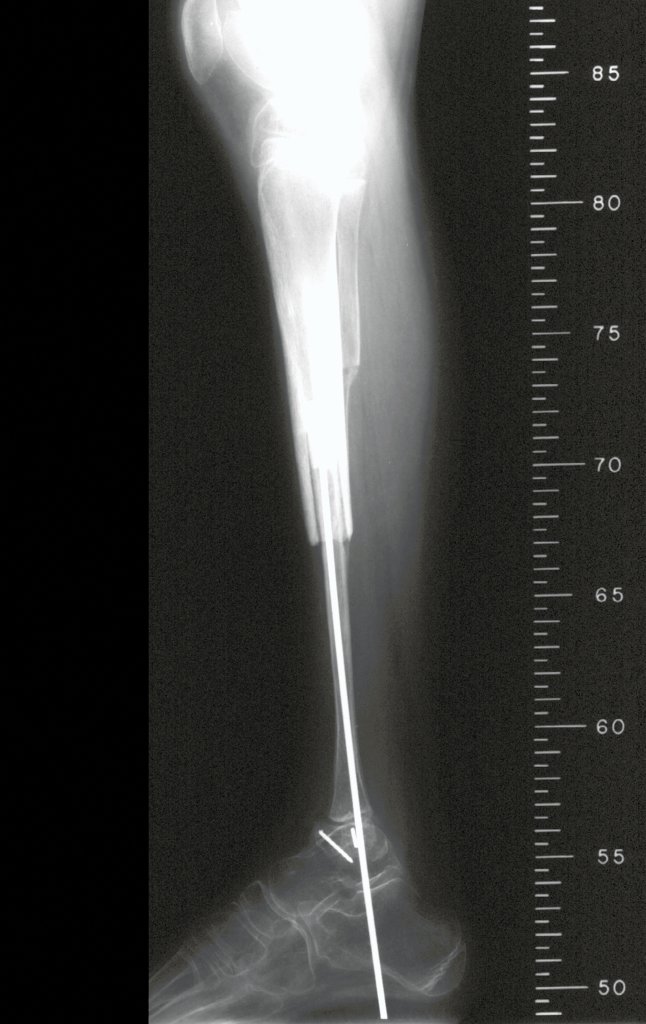
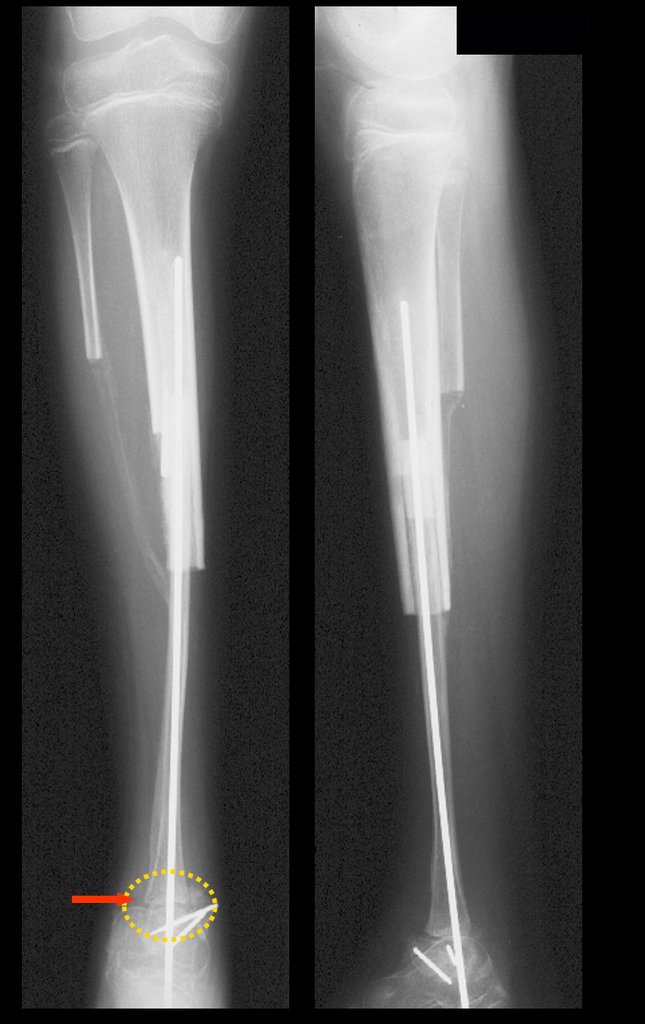
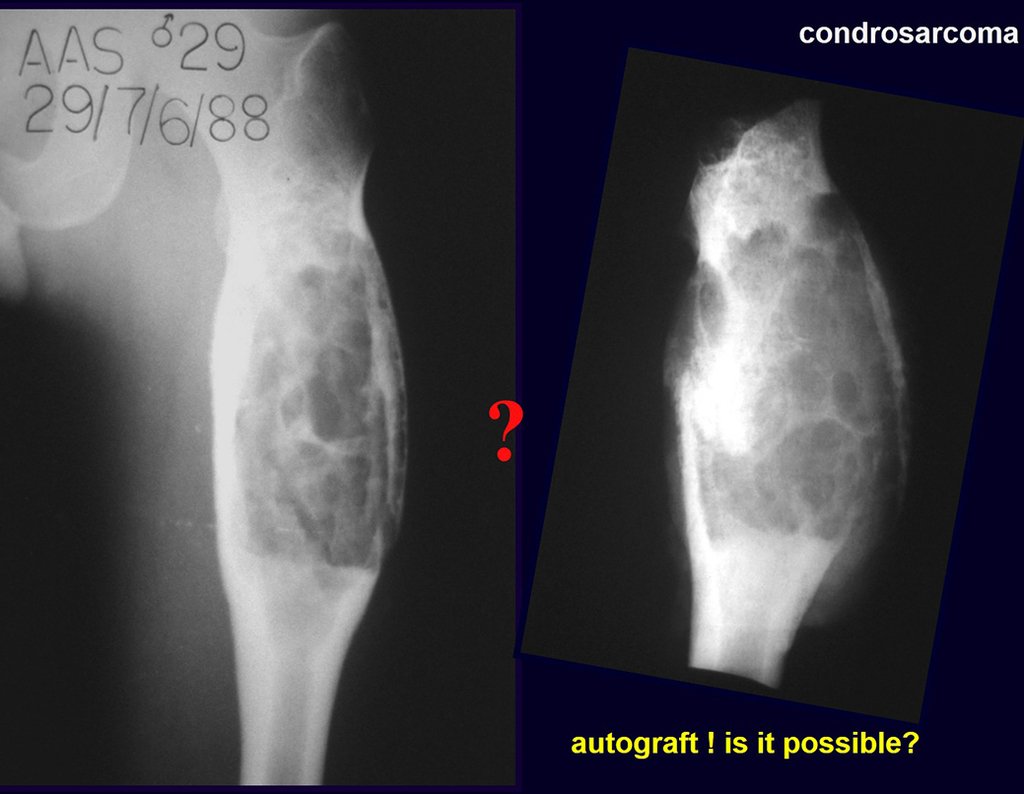
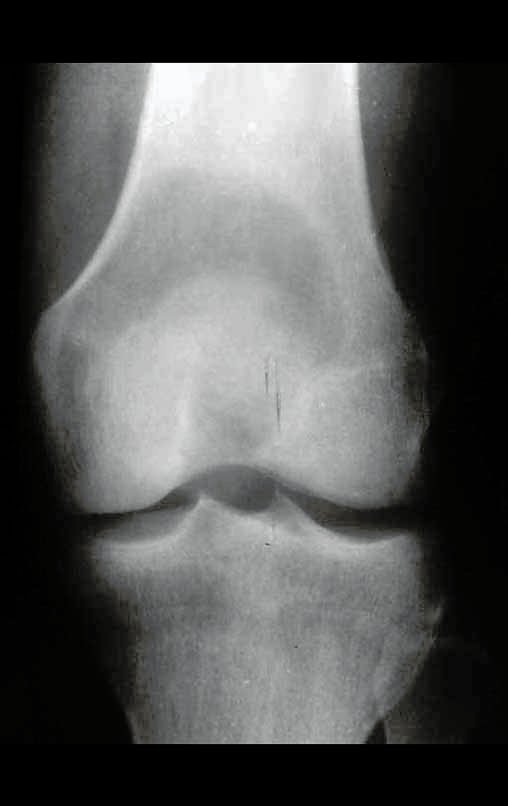
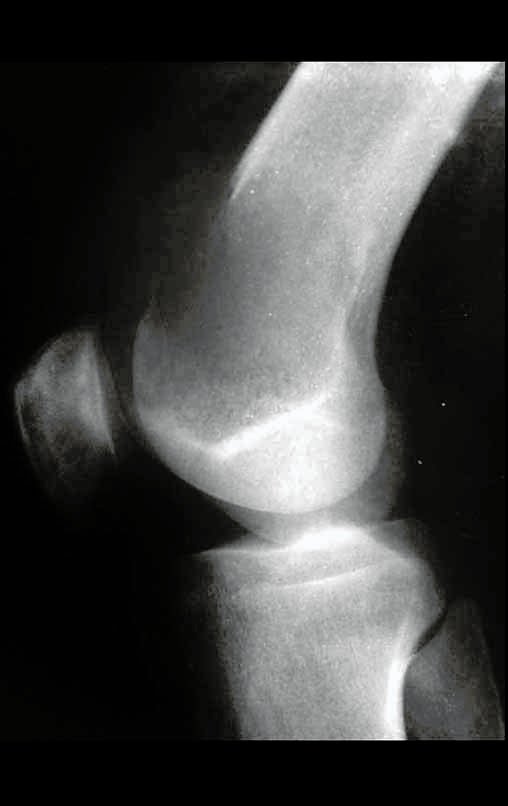
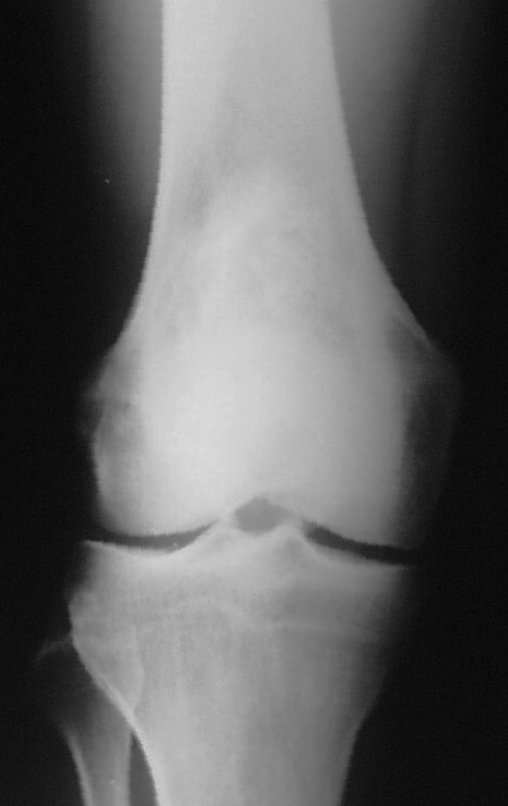
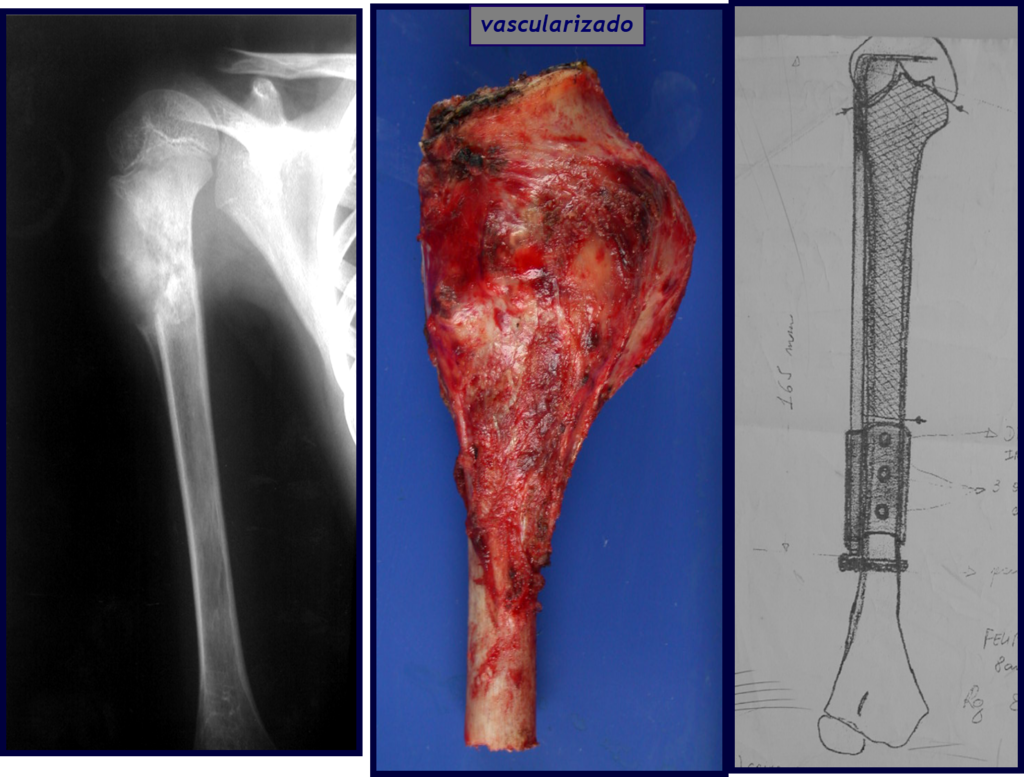
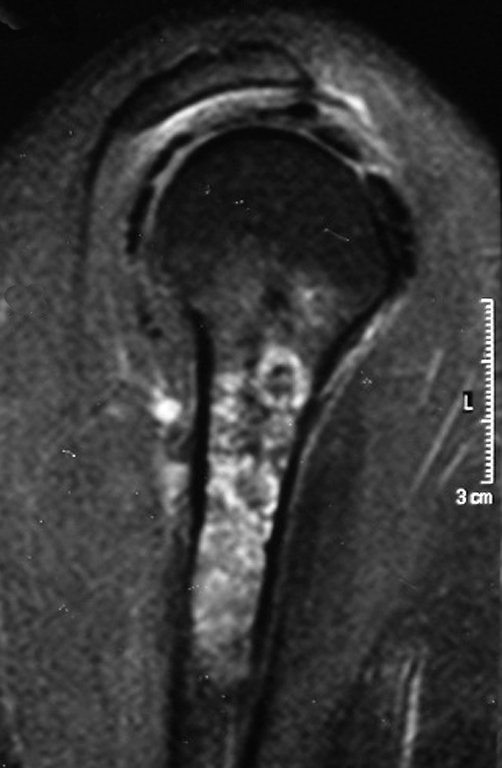
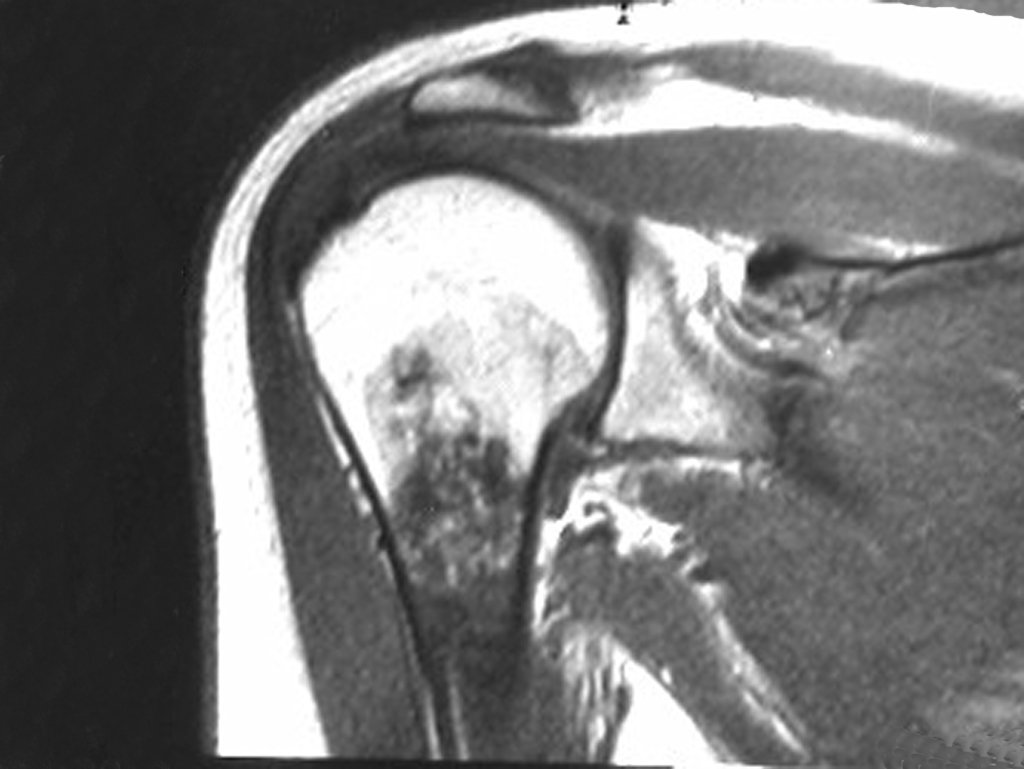
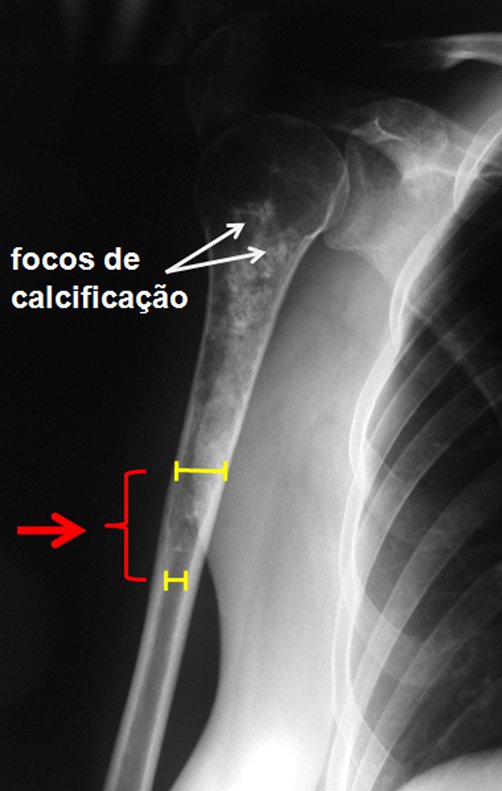
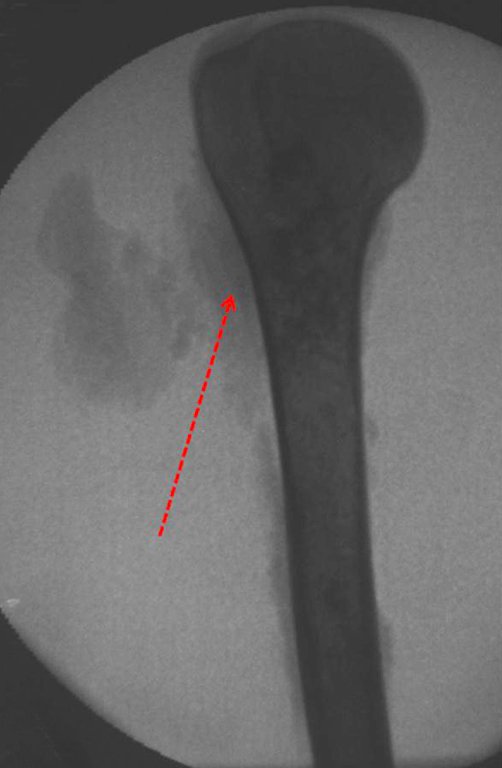
A radiografia mostra lesões metafisárias radio transparentes substituindo a medular óssea que se estendem para a epífise ou diáfise, erodindo a cortical interna (lesões em saca-bocado), insuflando ou expandindo a porção medular do osso, mas permanecendo delimitado pela cortical que se espessa.
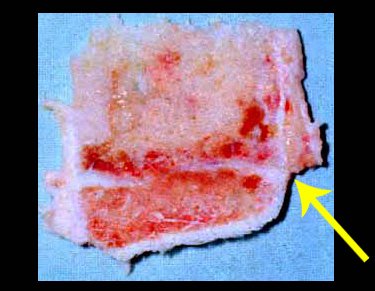
O aparecimento de calcificações (salpicadas, como flocos de algodão (5) ou anelares) é freqüente (23, 2, 24, 13, 6, 28). Estas são decorrentes da degeneração da cartilagem que recebe nova vascularização e se calcifica. Este processo é acelerado nos condrossarcomas e lento nas lesões cartilaginosas benignas e de baixo grau.
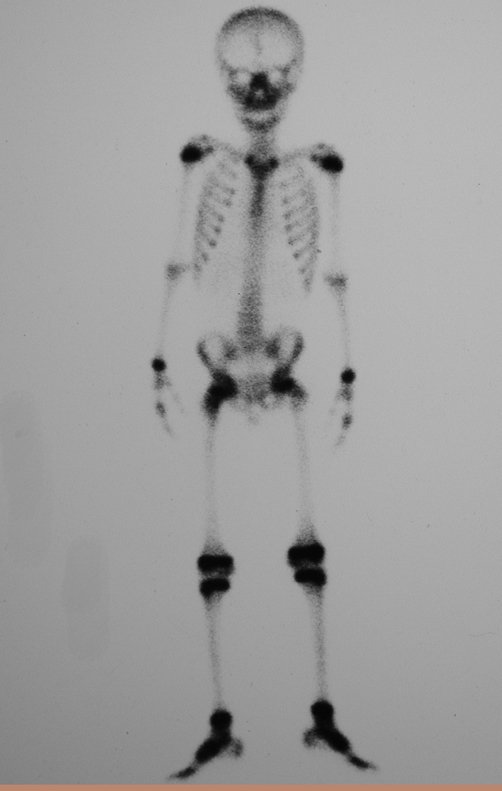
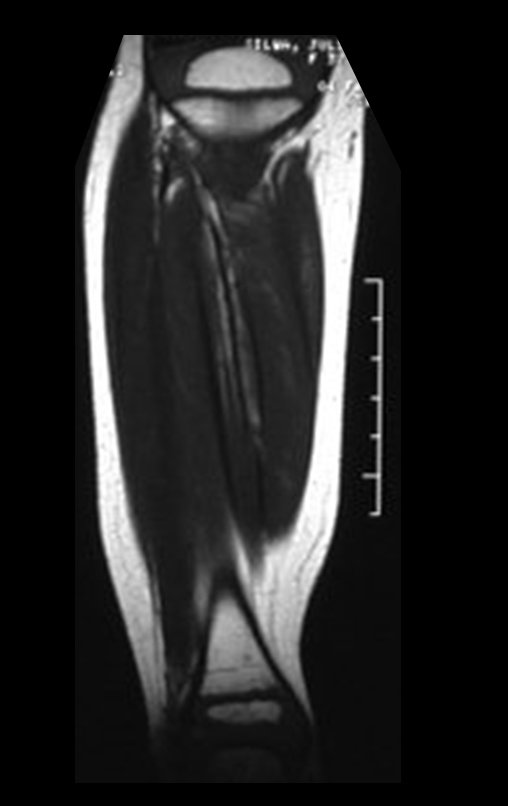
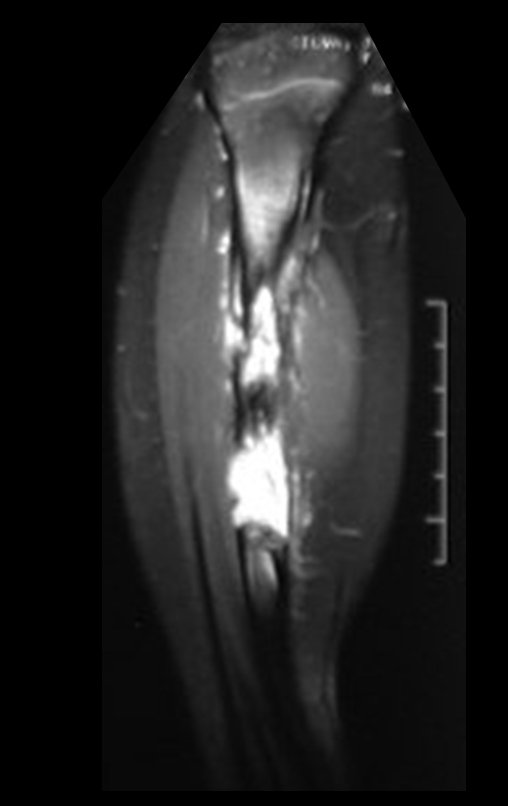
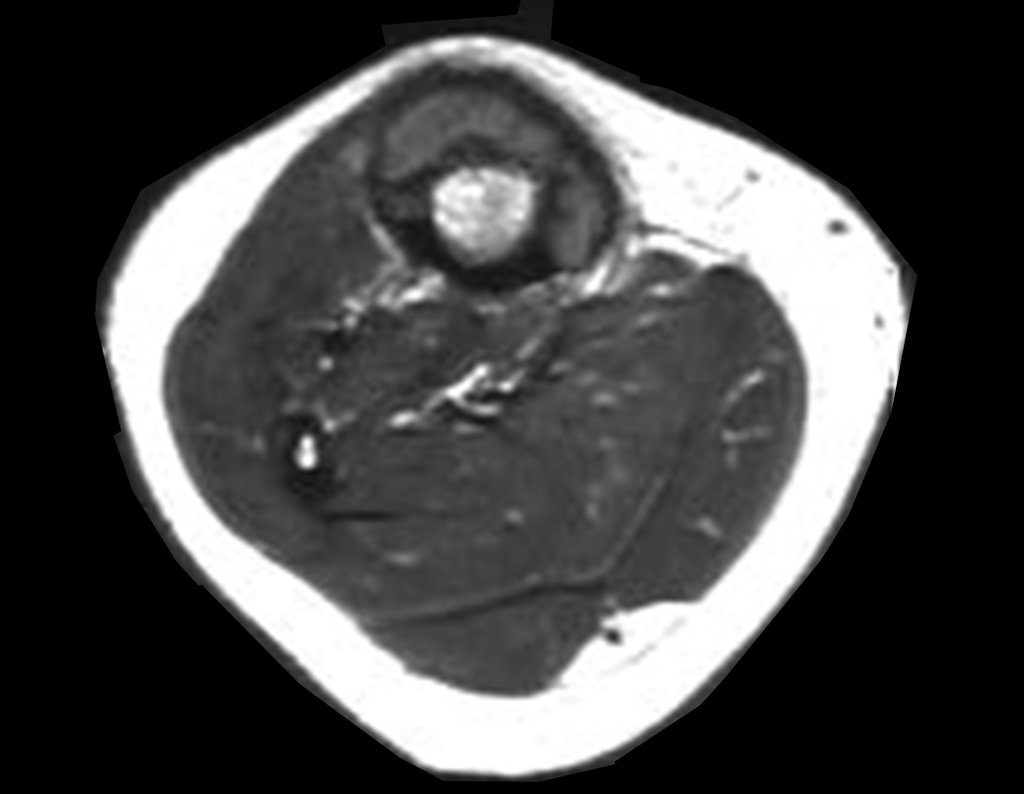
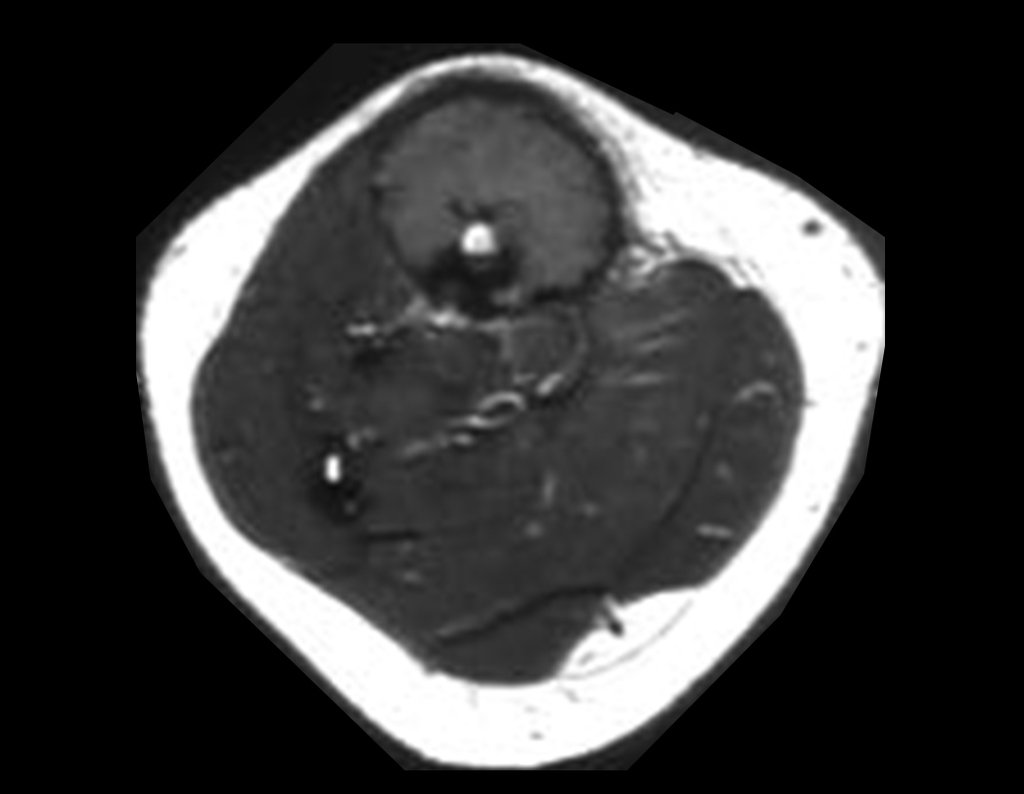
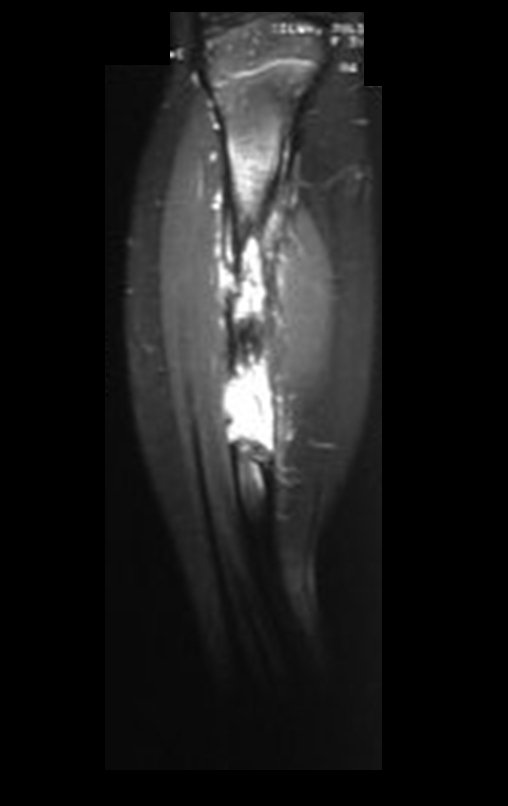
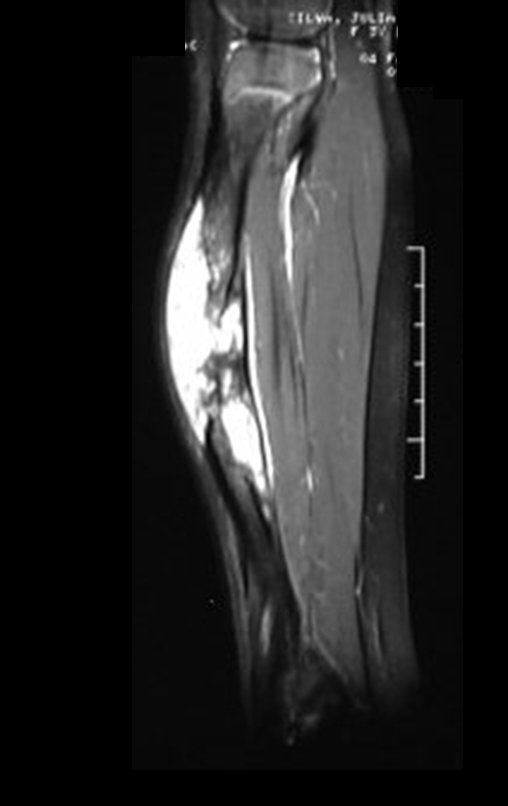
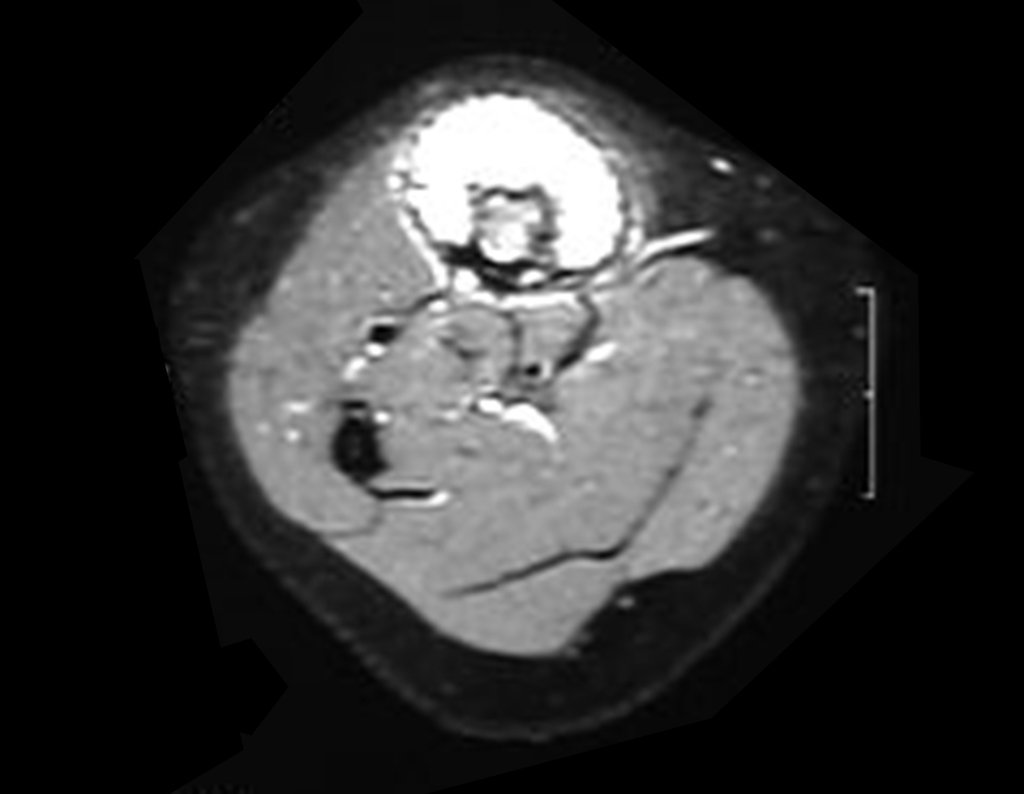
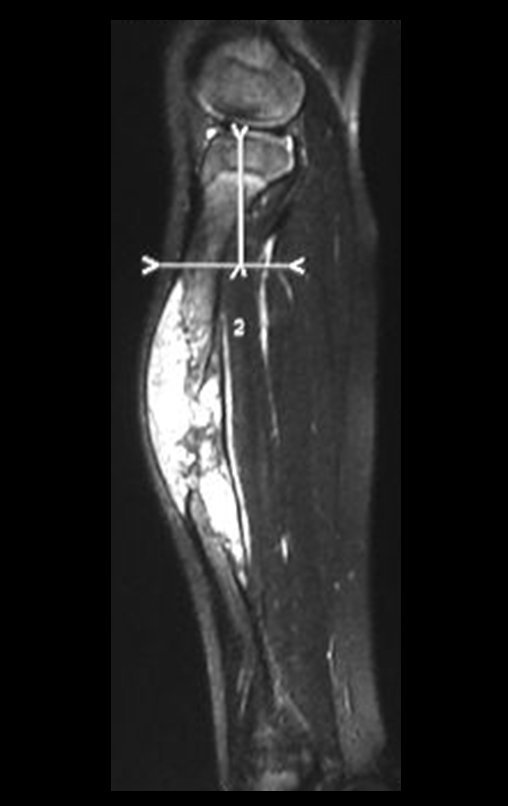
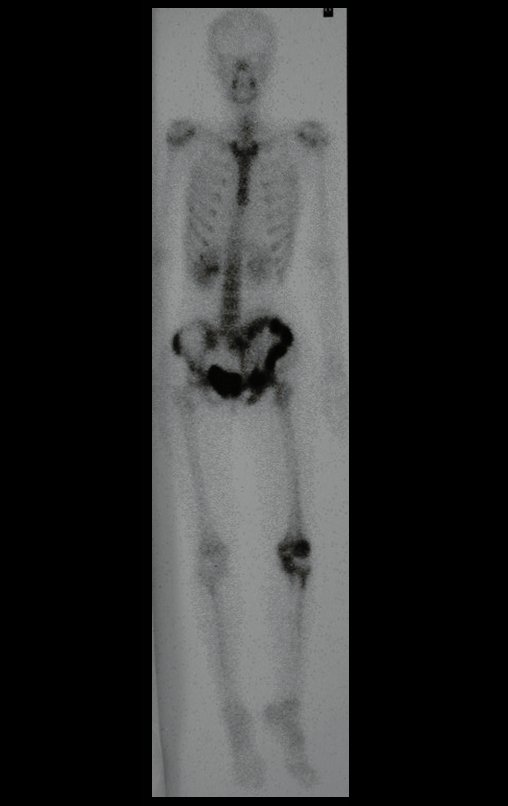
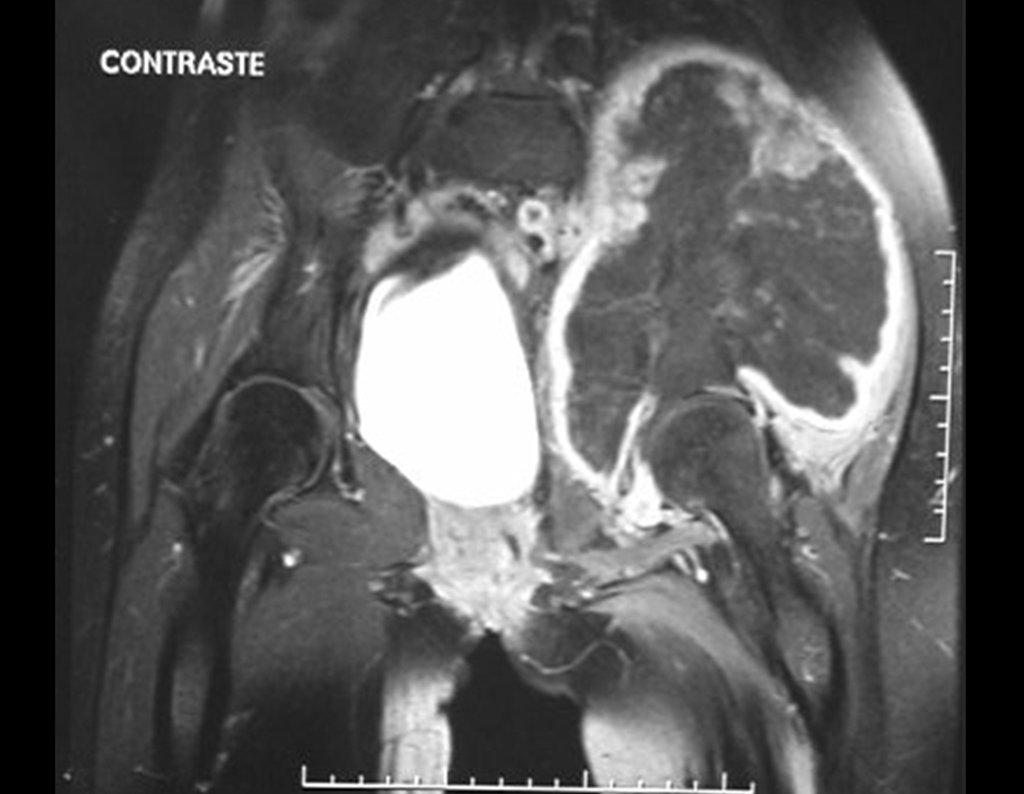
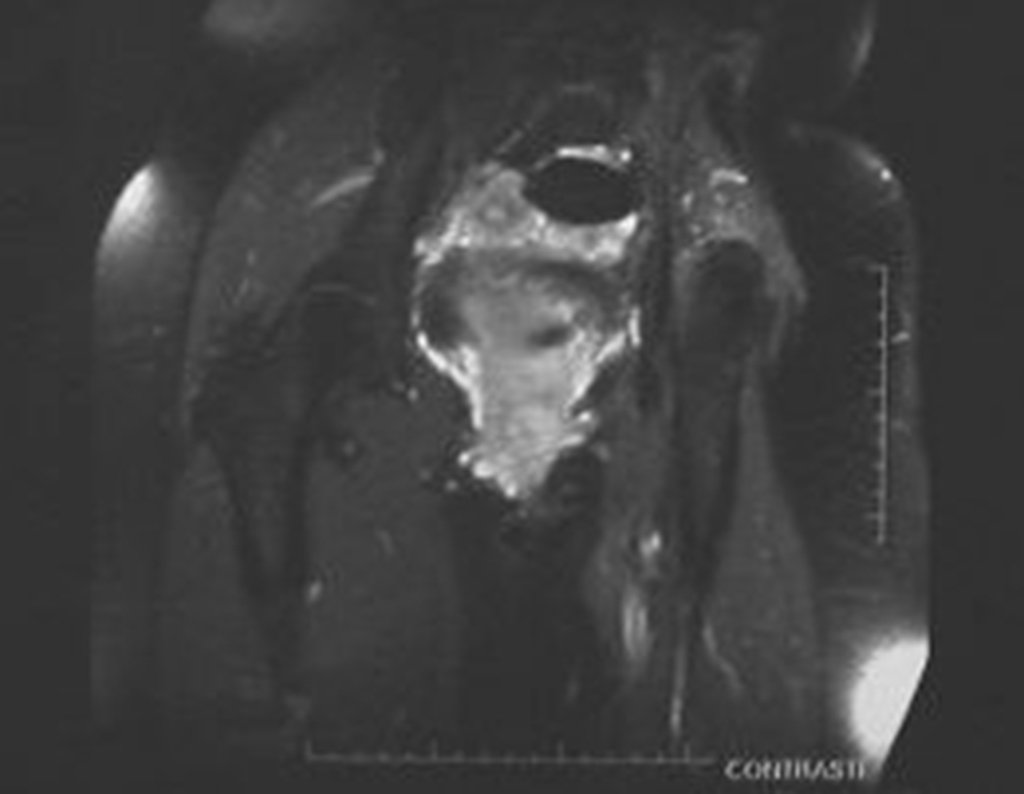
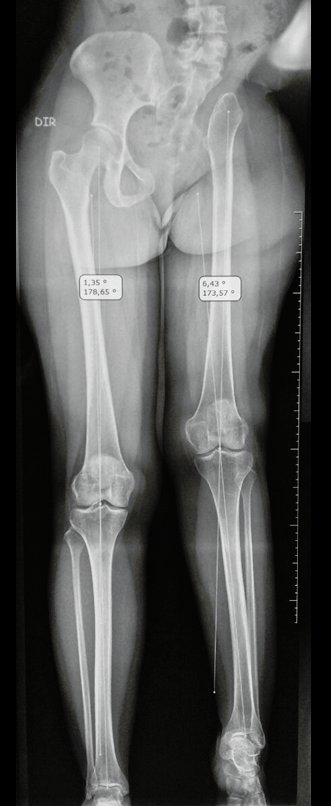
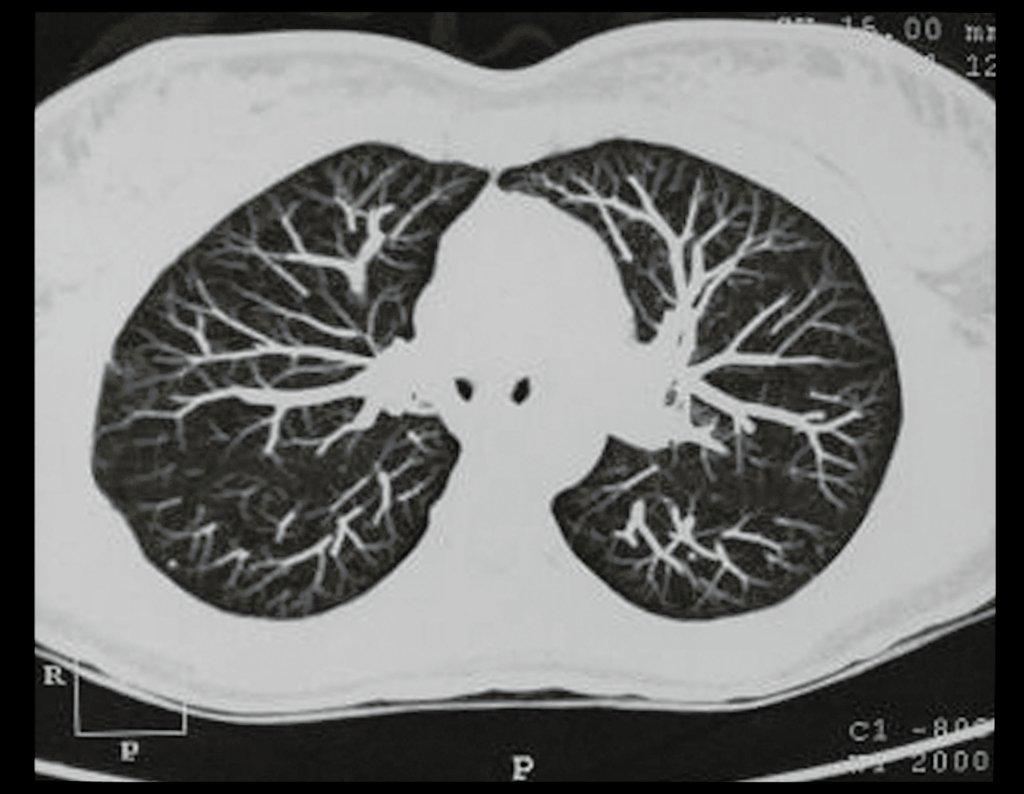
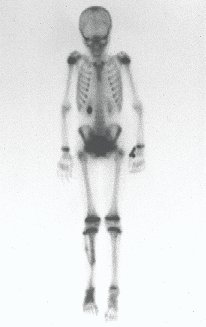
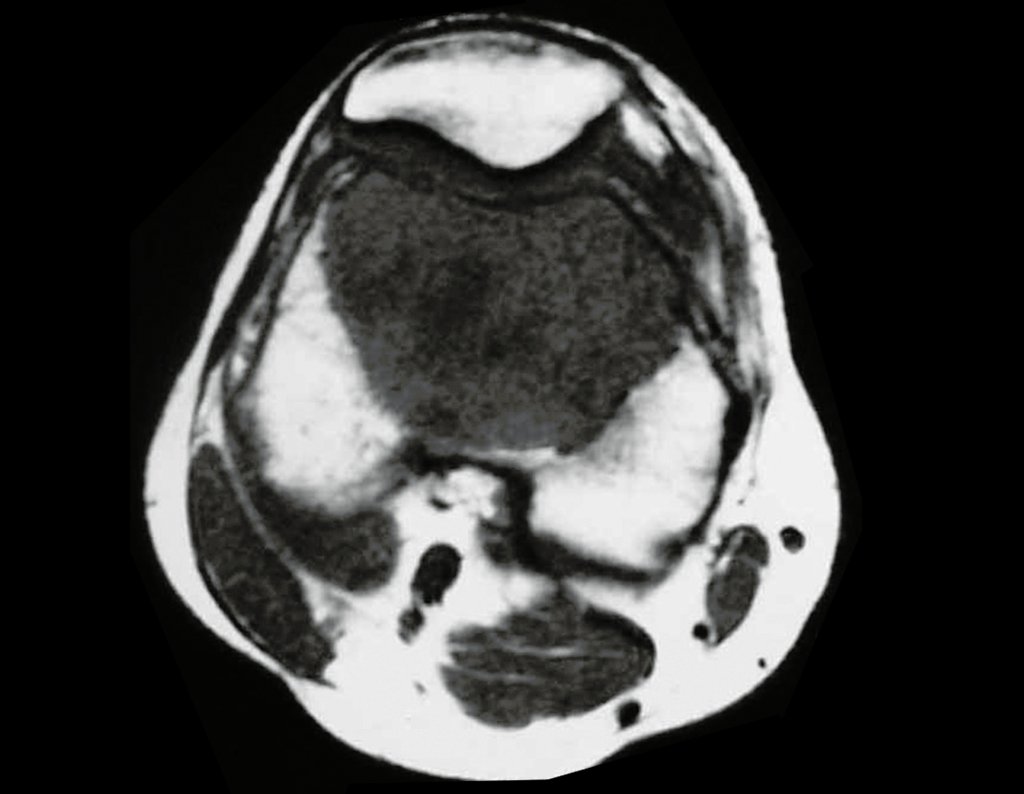
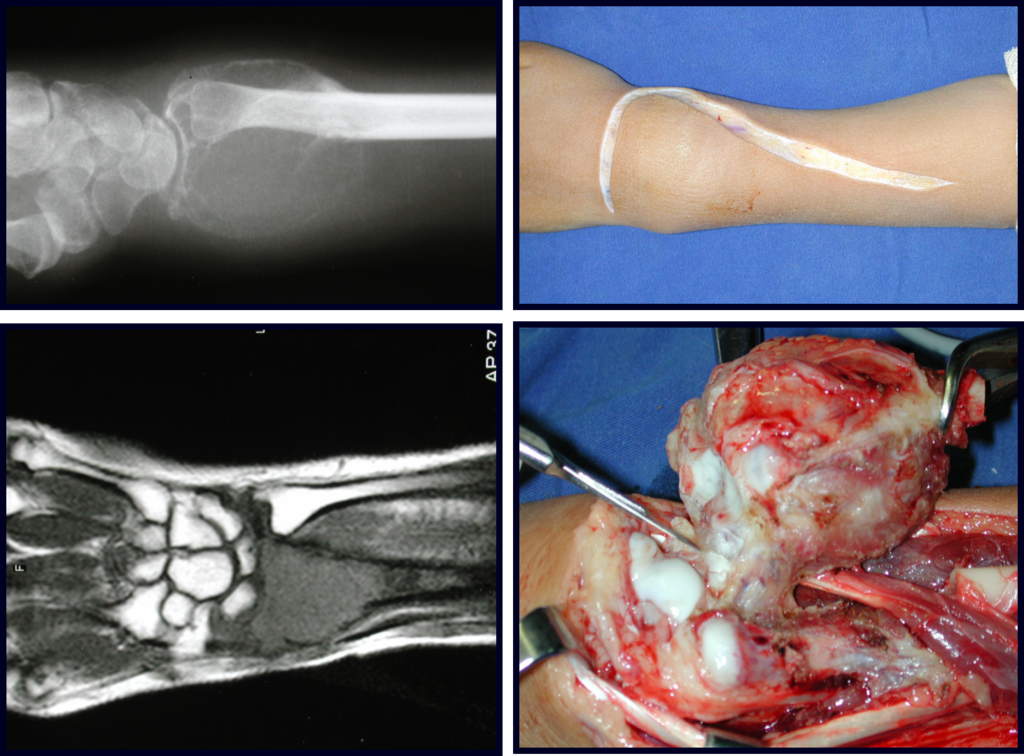
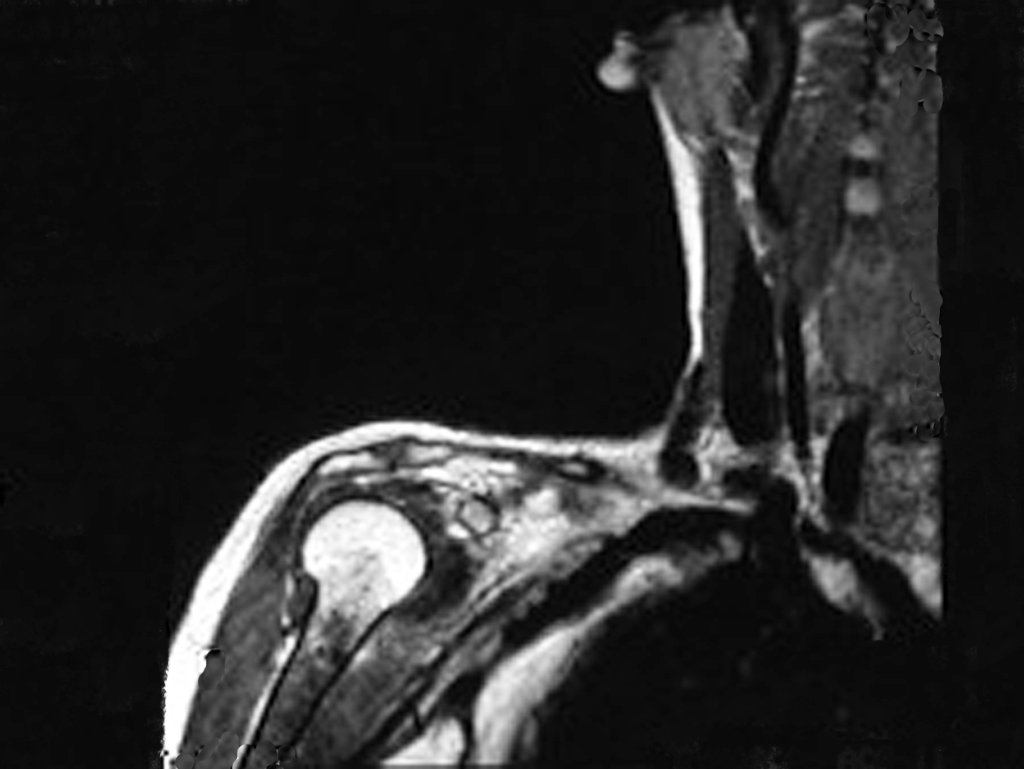
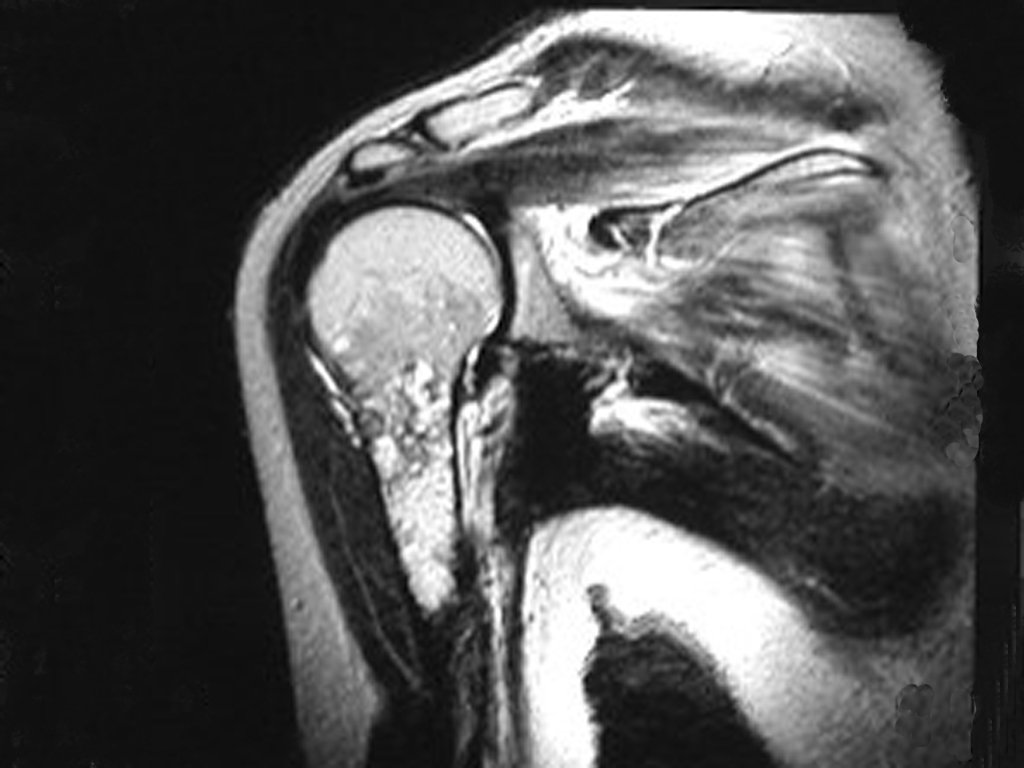
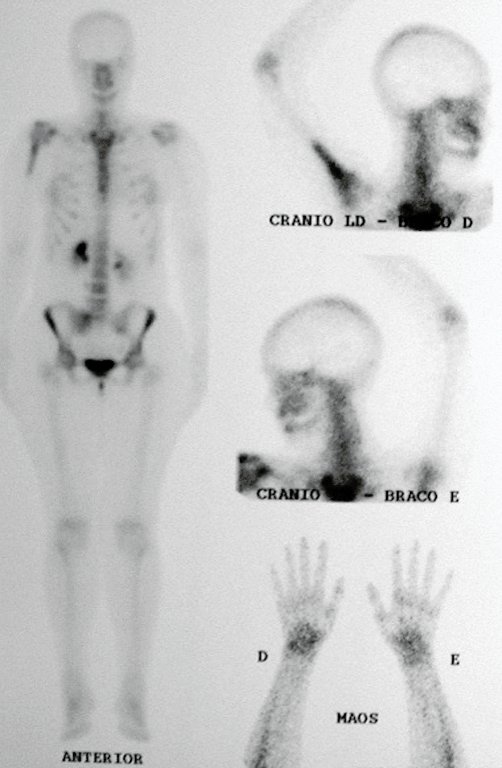
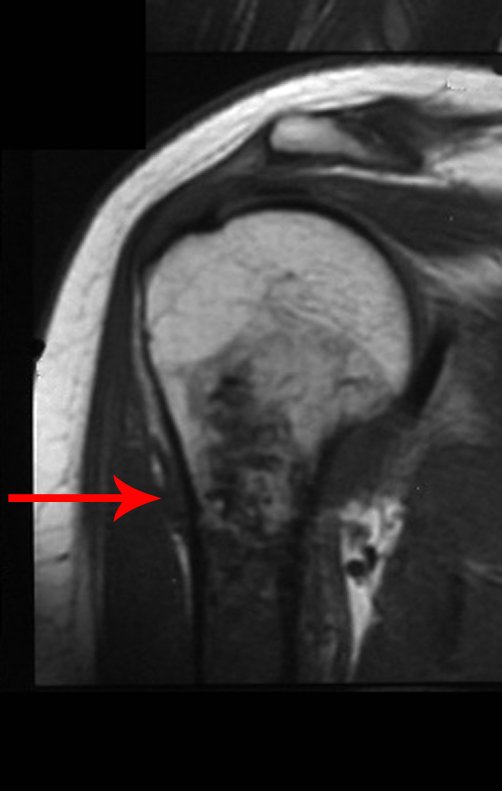
O mapeamento ósseo auxilia no estadiamento da lesão e a ressonância magnética e a tomografia são importantes para a avaliação da extensão intramedular e extra-óssea da lesão (2).
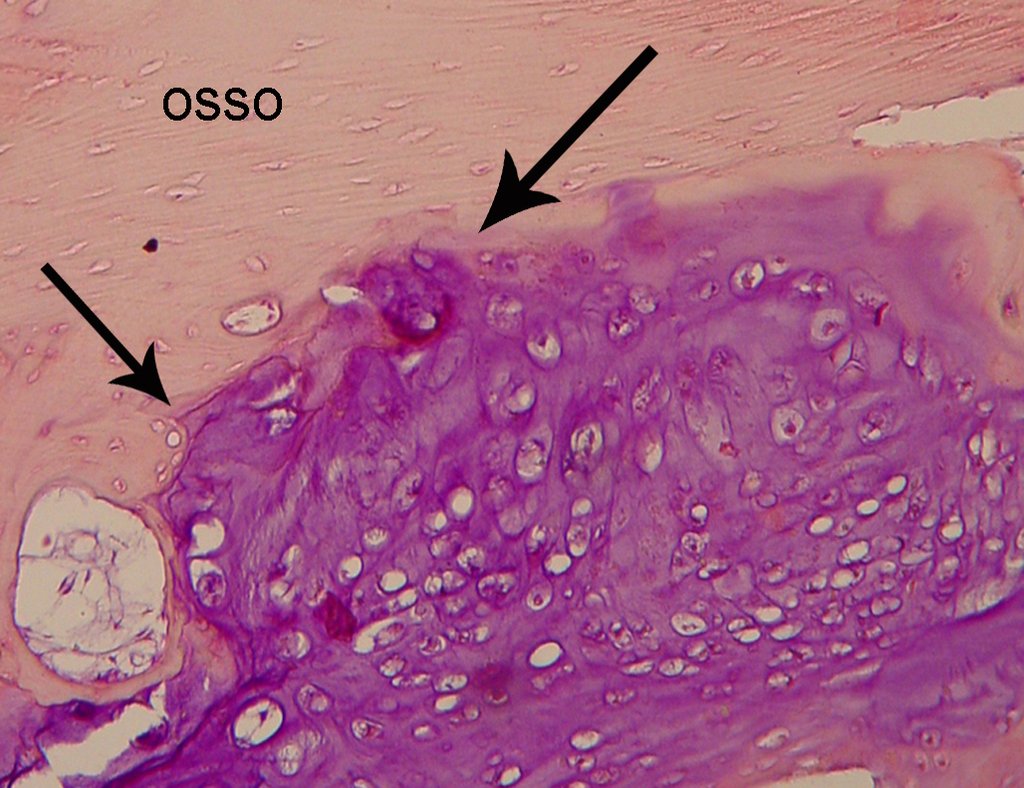
O diagnóstico de condrossarcoma bem diferenciado apresenta dificuldades histológicas e os dados de história clínica, localização, aspectos de imagem devem ser valorizados para a conclusão diagnóstica e definição de conduta adequada (23, 14, 12). As minúcias histológicas de irregularidade na disposição e no número das células dentro da matriz condróide, as alterações nucleares de hipercromasia, polimorfismo e mitoses atípicas, quando situados em raízes de membros, devem ser considerados condrossarcomas grau I, embora estes mesmos aspectos histológicos possam ser encontrados nos condromas benignos das mãos e pés. Na microscopia as descrições são semelhantes aos condrossarcomas centrais (23).
Para o diagnóstico é preciso, ainda, diferenciar as semelhanças anatomopatológicas, clínicas e radiológicas com outras lesões.
Faz diagnóstico com o cisto ósseo aneurismático, por seu caráter multiloculado; com o condroma, o osteocondroma, o condroblastoma, o osteossarcoma paraosteal e periosteal (com o condrossarcoma justa cortical) (16); miosite ossificante; fibroma condromixóide; T.G.C. e linfoma não Hodgkin (23, 6, 28). O condrossarcoma de células claras tem formação intra-lesional de osso reativo podendo causar confusão com osteossarcoma. O condrossarcoma mesenquimal é formado por lâminas de células pequenas arredondadas que lembram hemangiopericitoma e sarcoma de Ewing (14). O condroma central dos ossos longos, o condrossarcoma e o infarto ósseo são muitas vezes de difícil diagnóstico, necessitando periodicamente de avaliação clínica e radiográfica para o acompanhamento da evolução da lesão e definição da conduta.
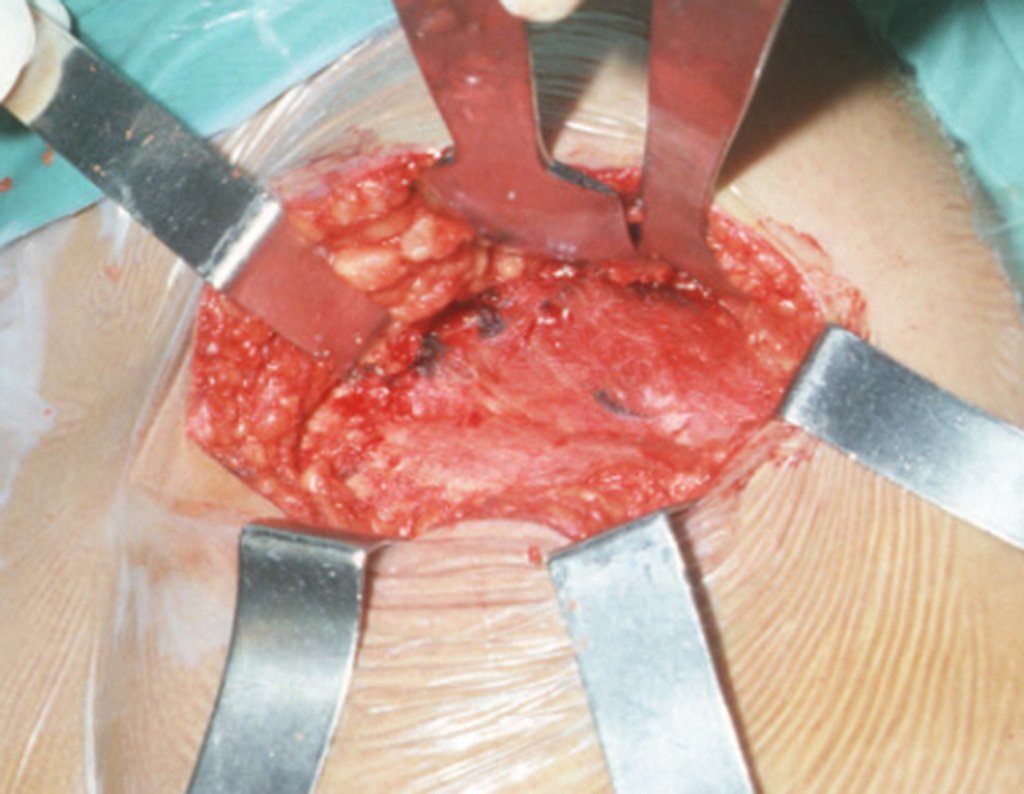
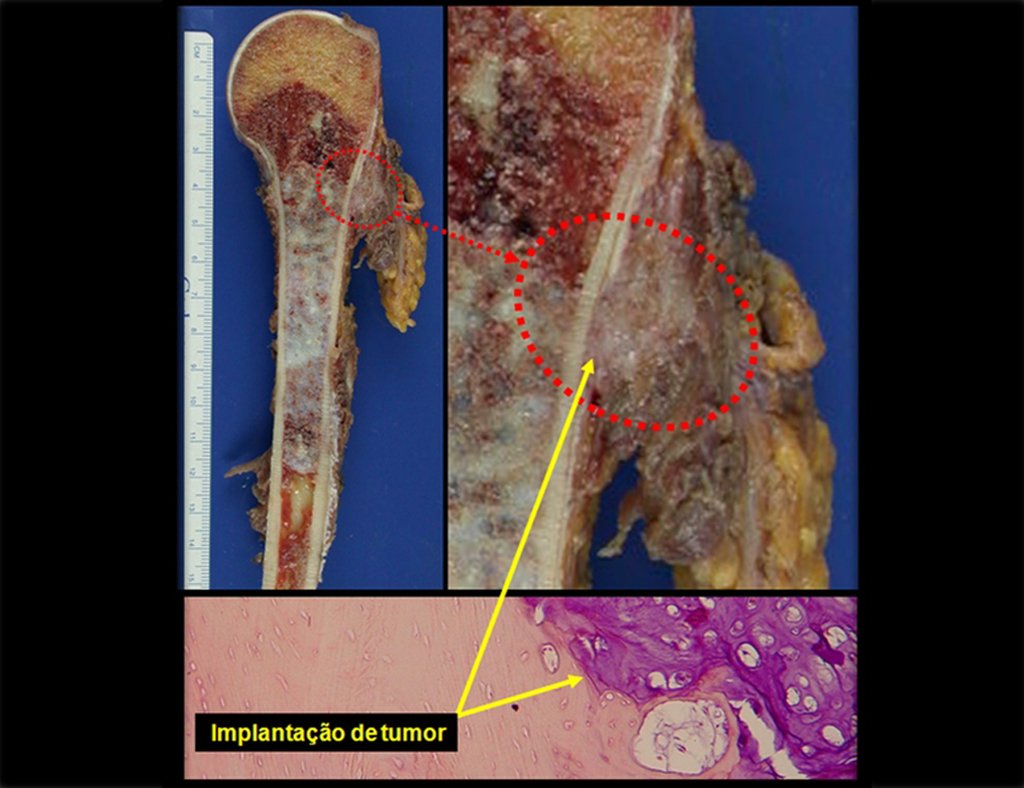
A biópsia muitas vezes pode não ser definitiva para o diagnóstico (23, 28, 12).
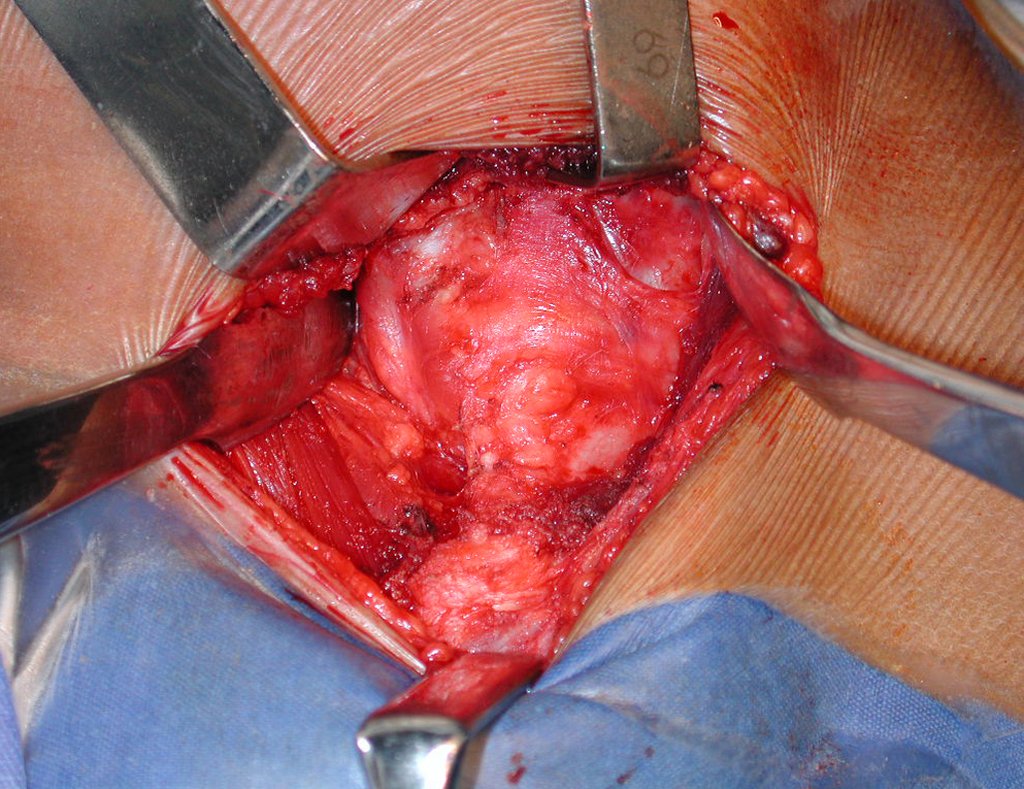
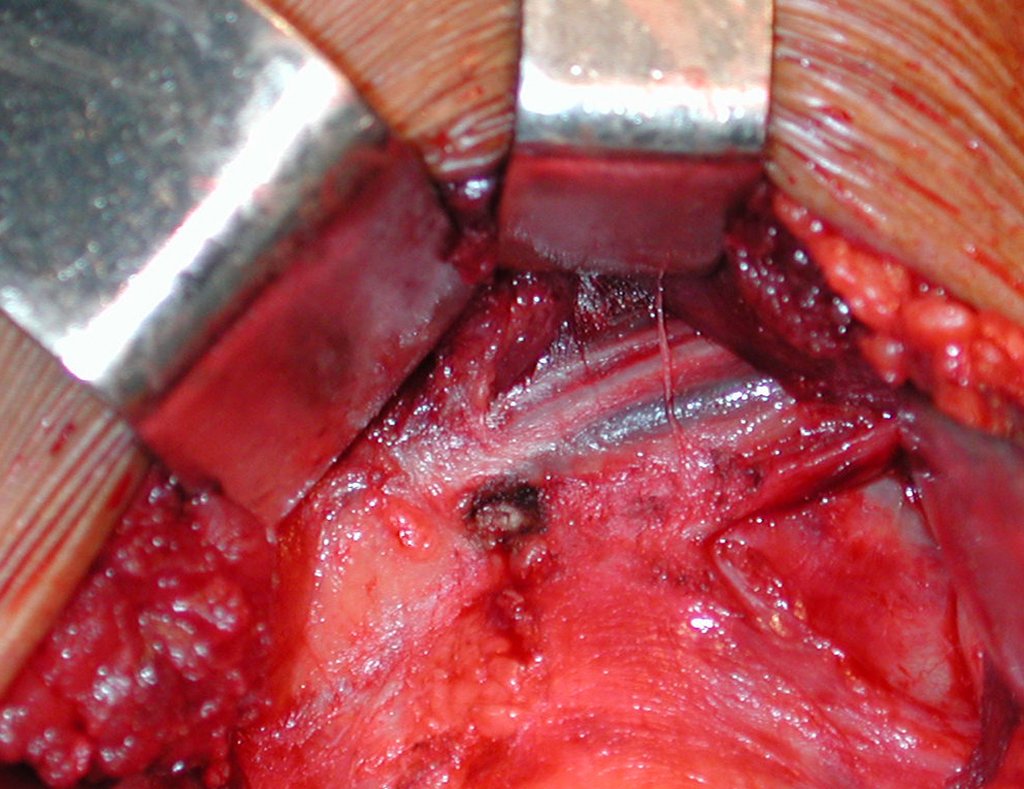
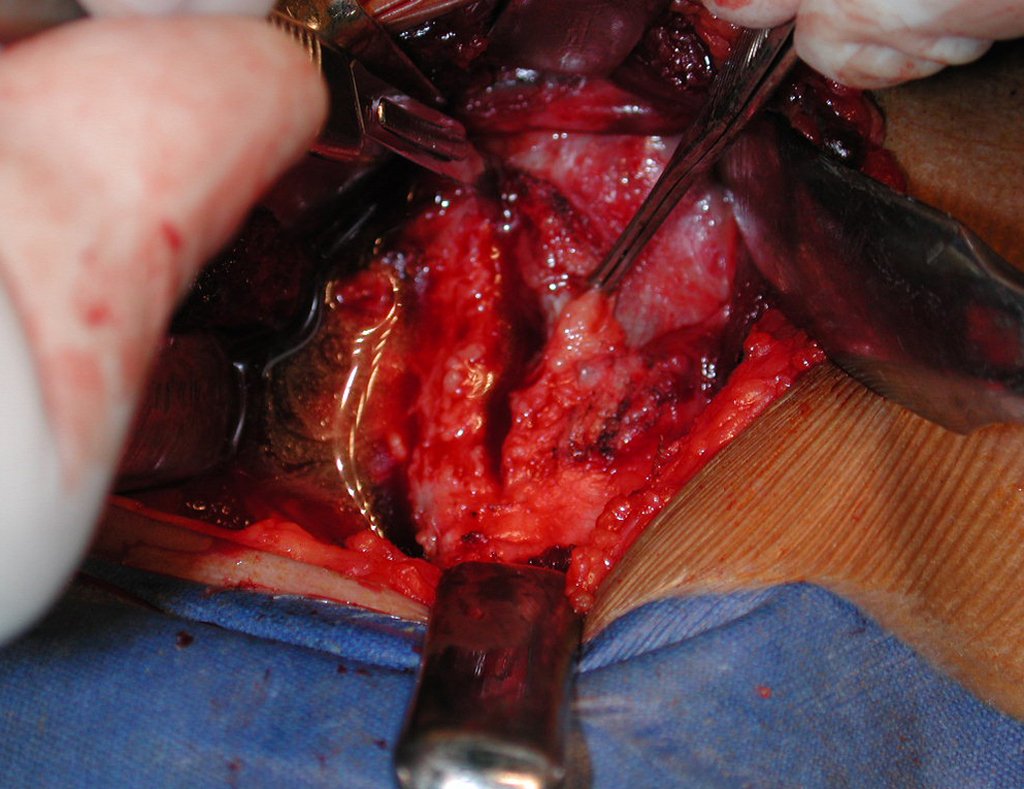
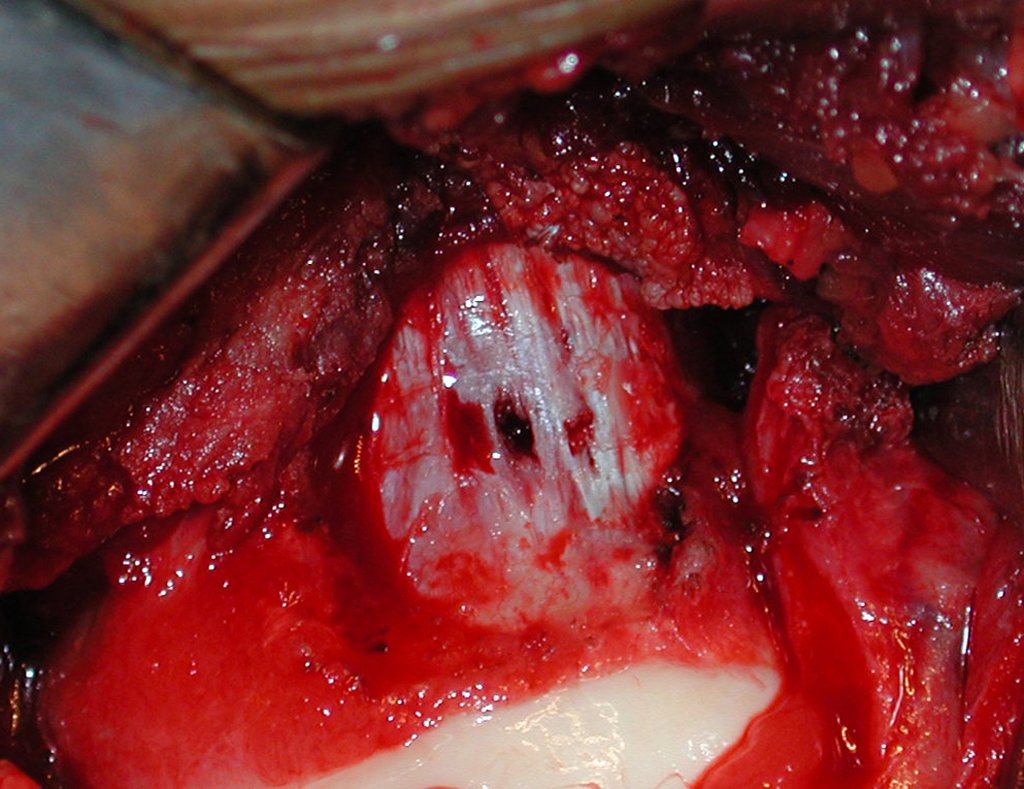
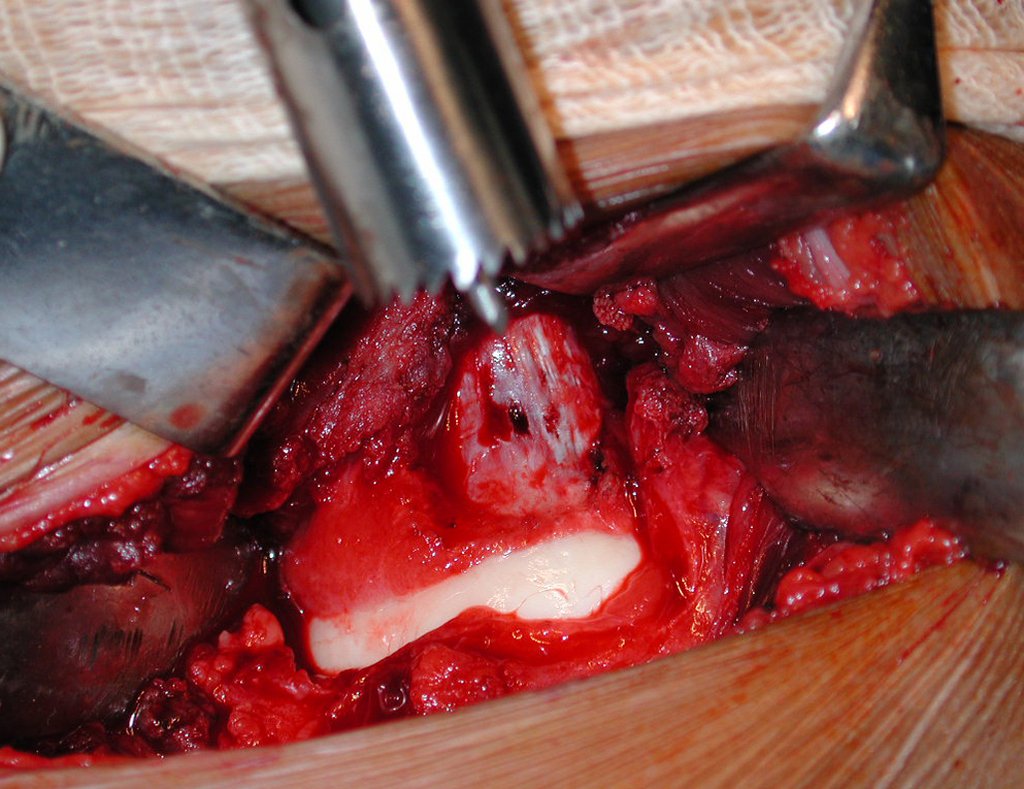
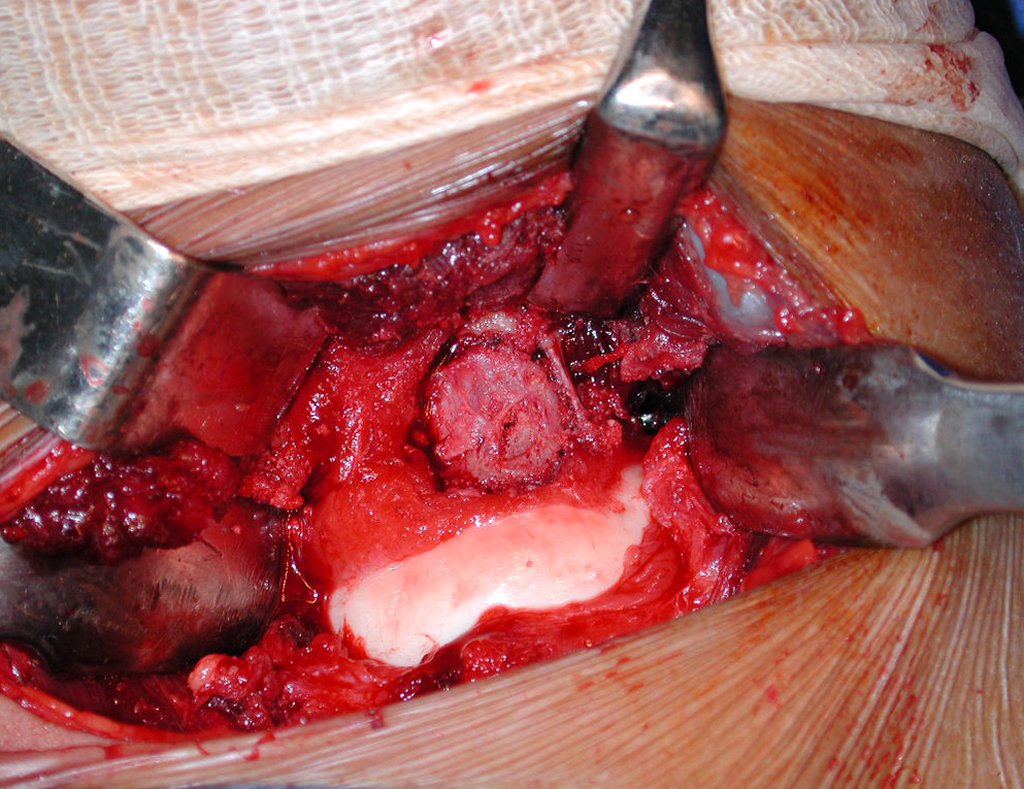
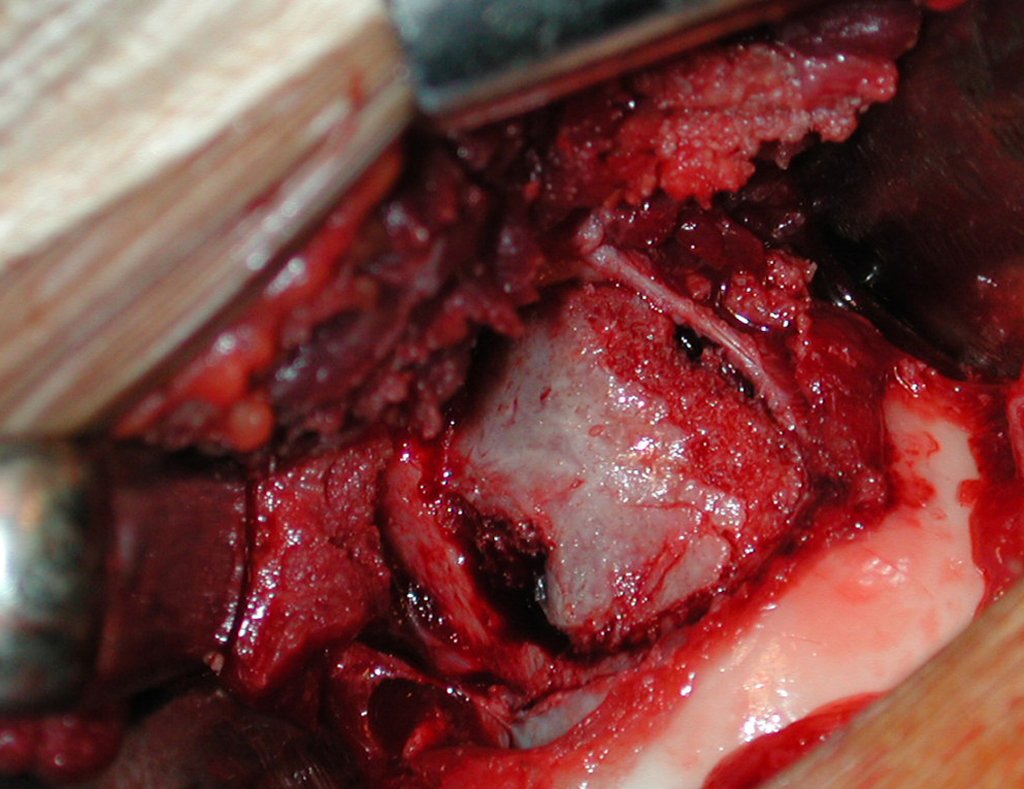
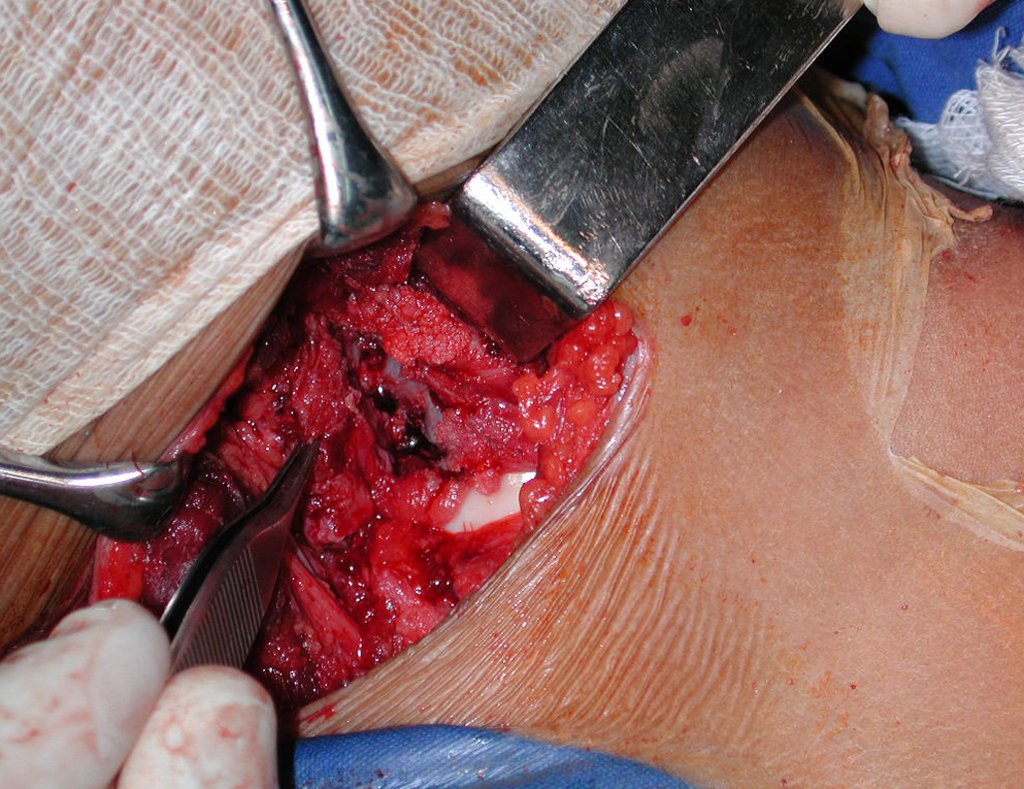
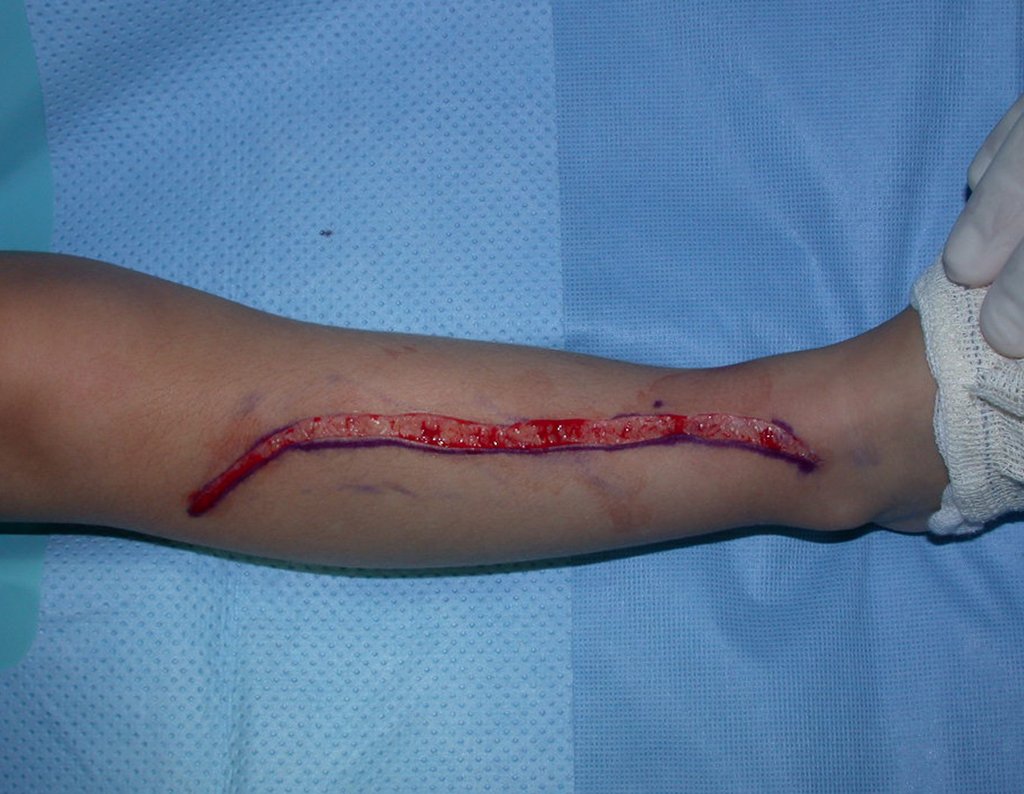
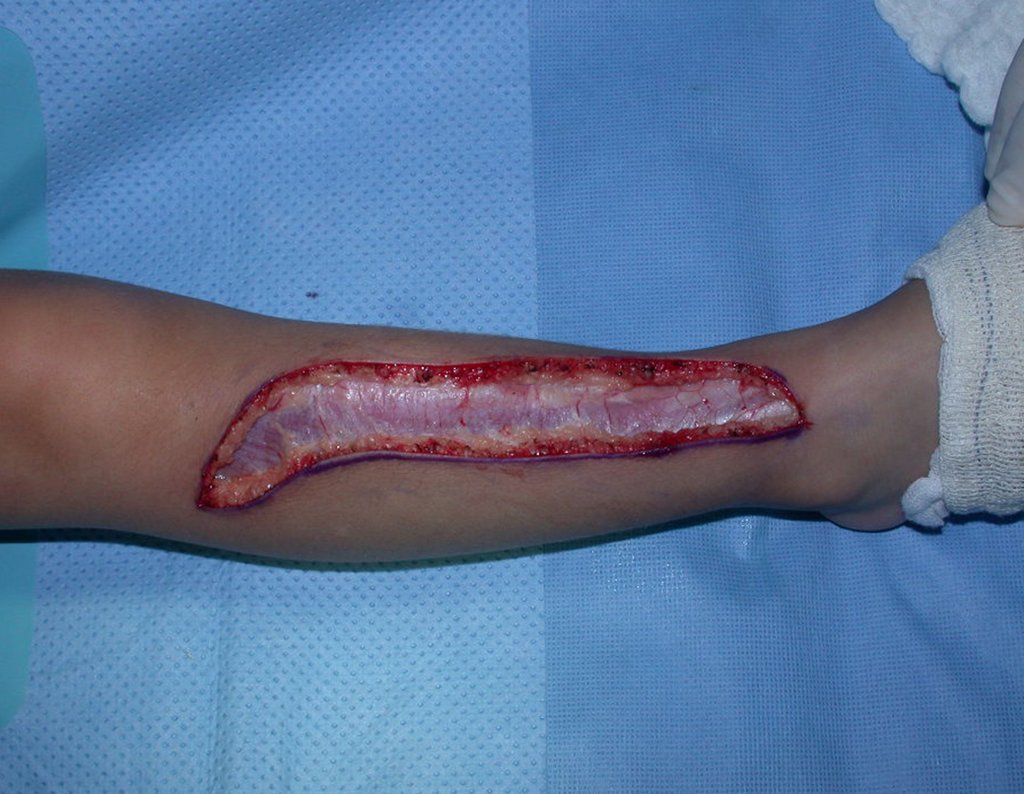
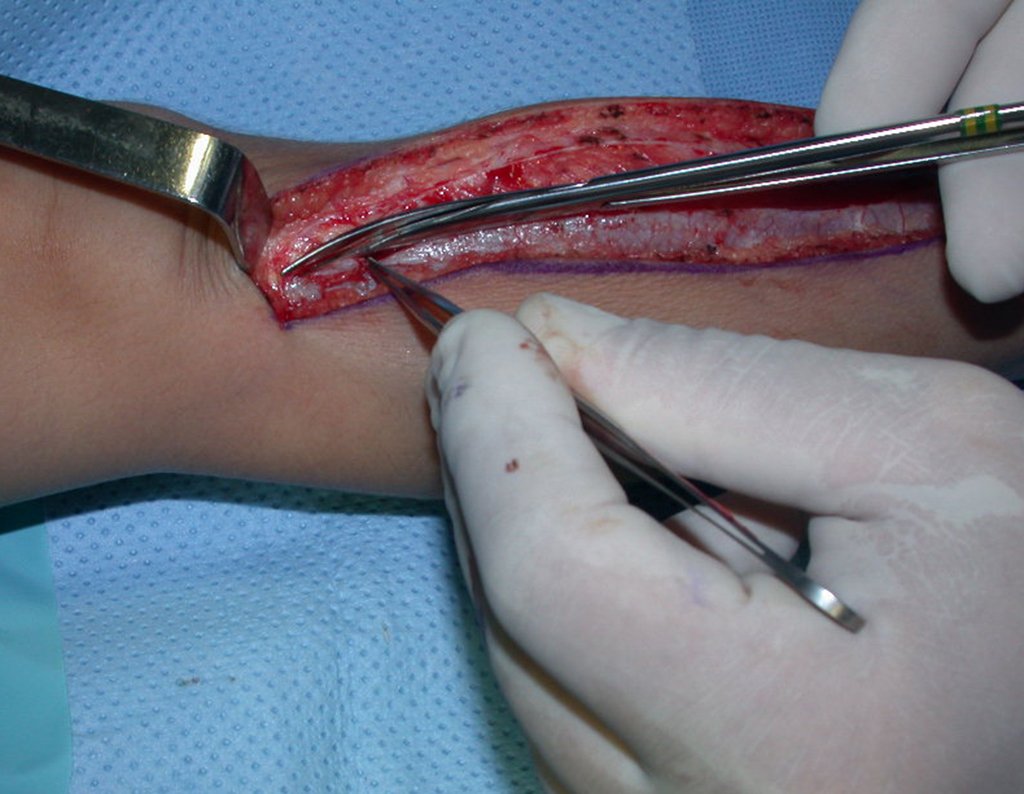
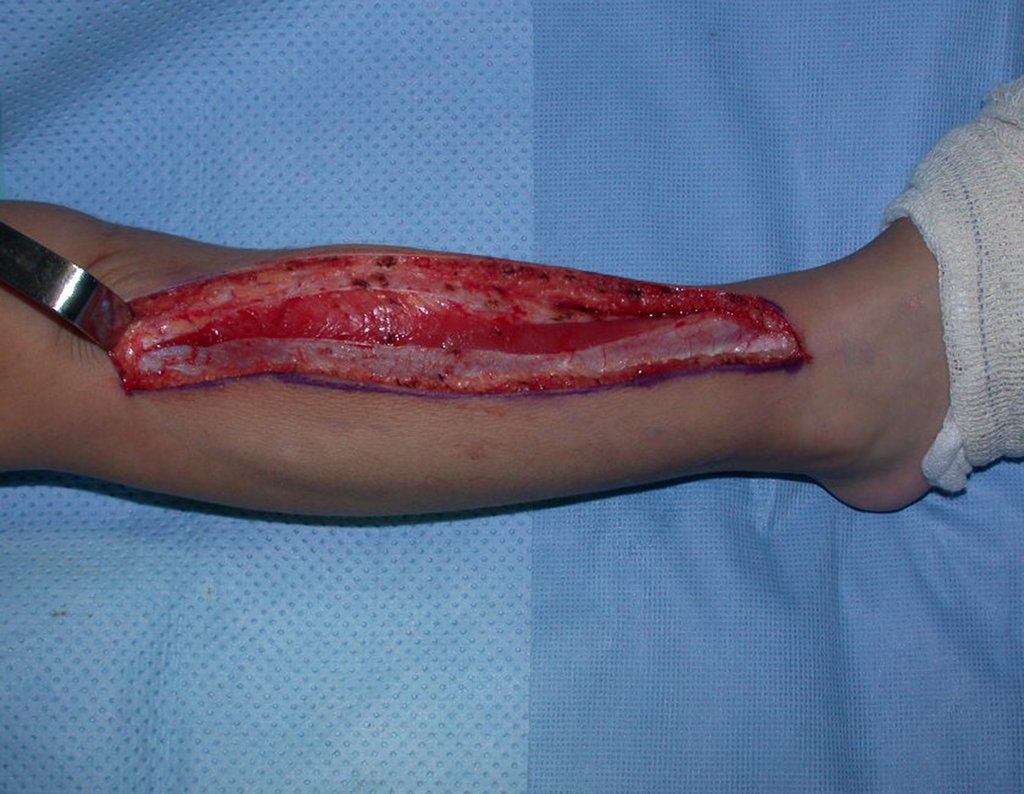
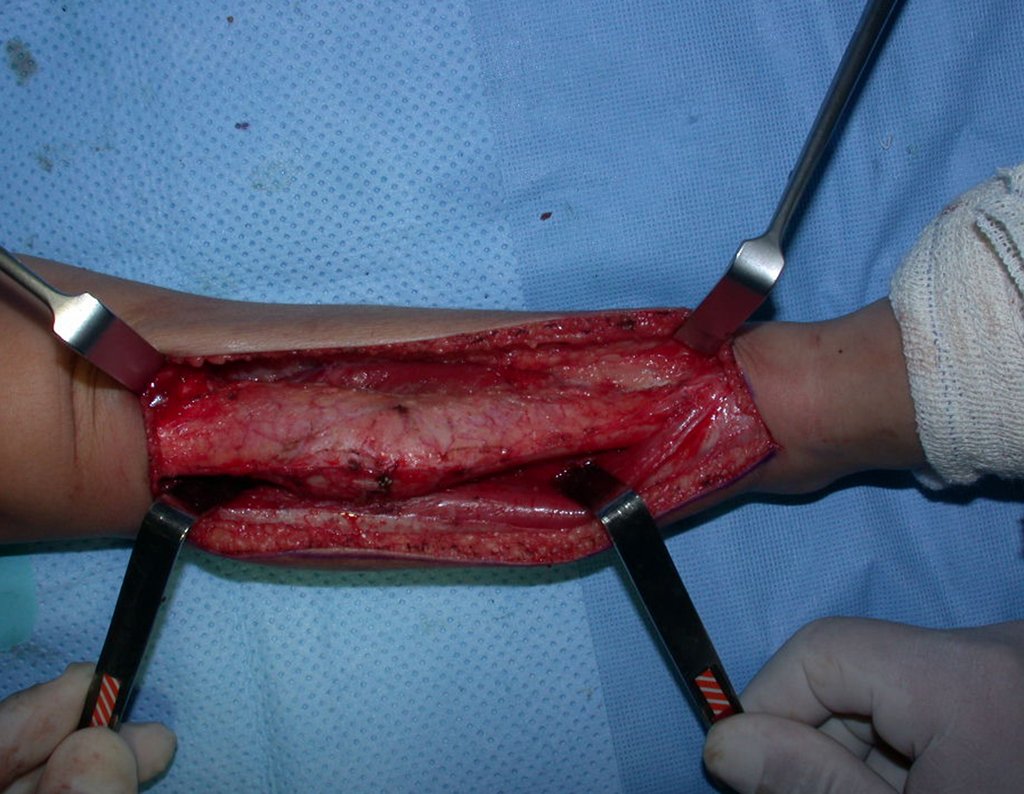
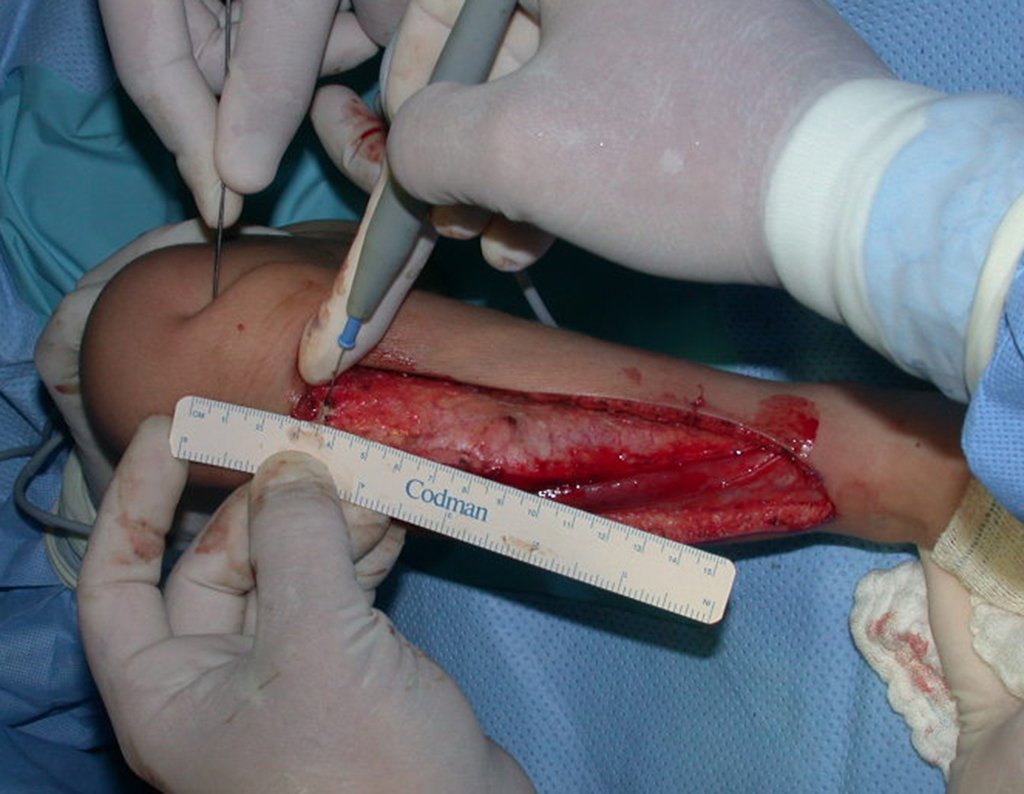
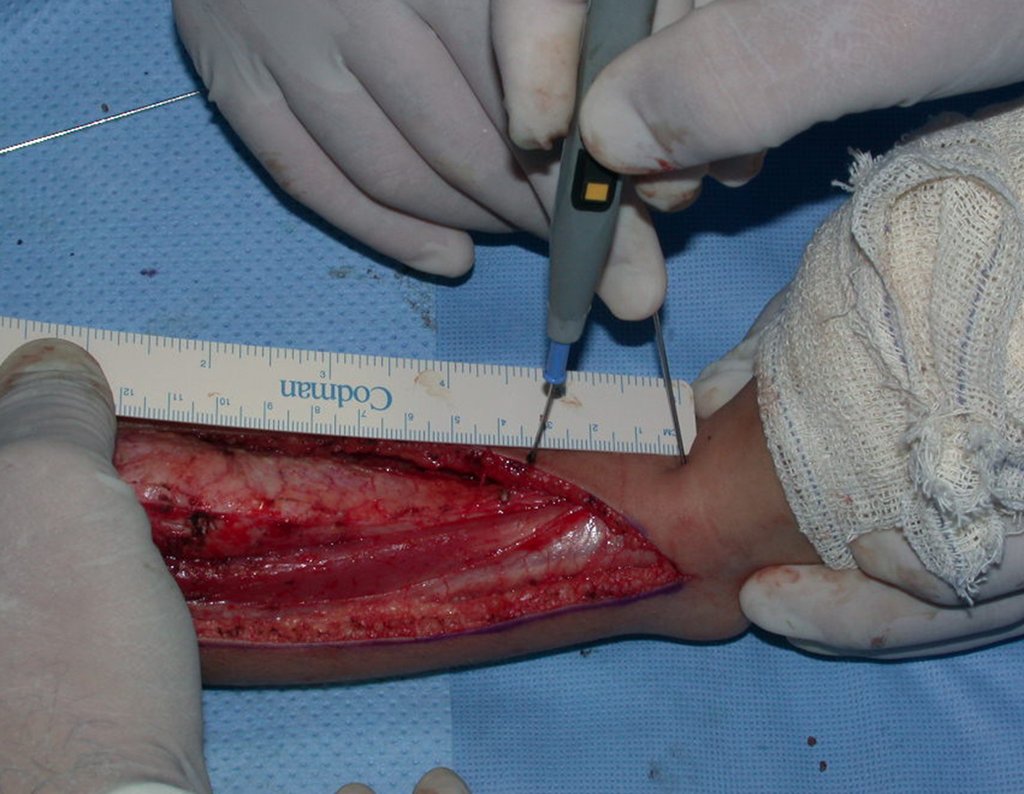
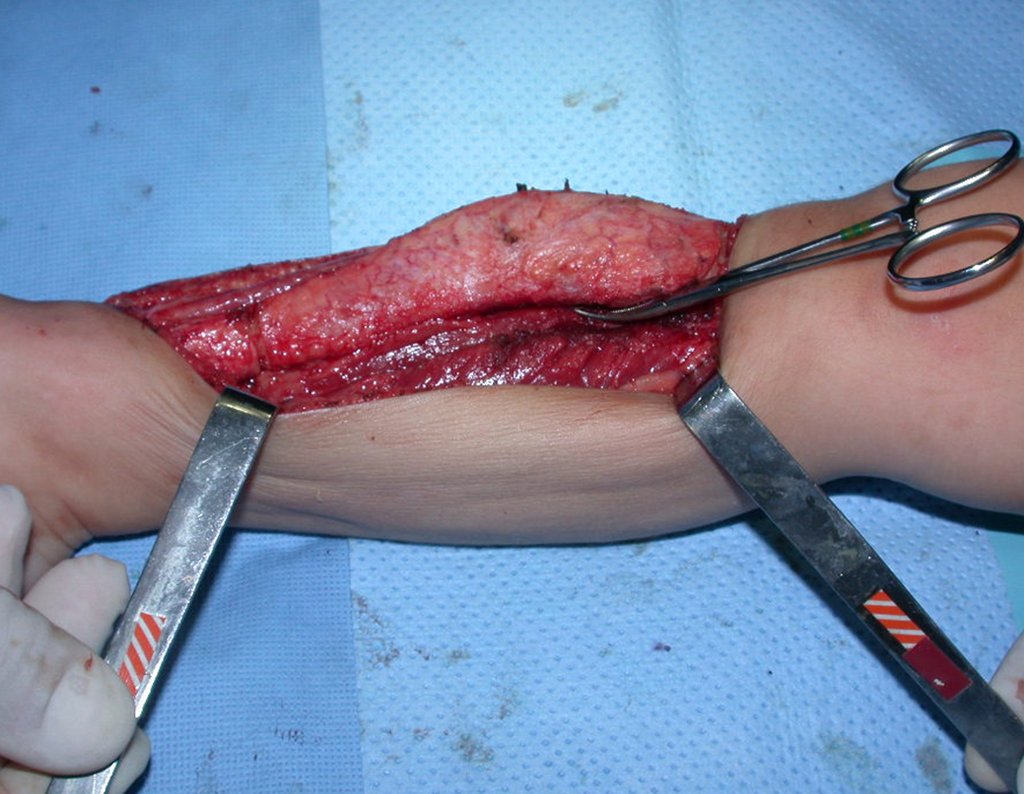
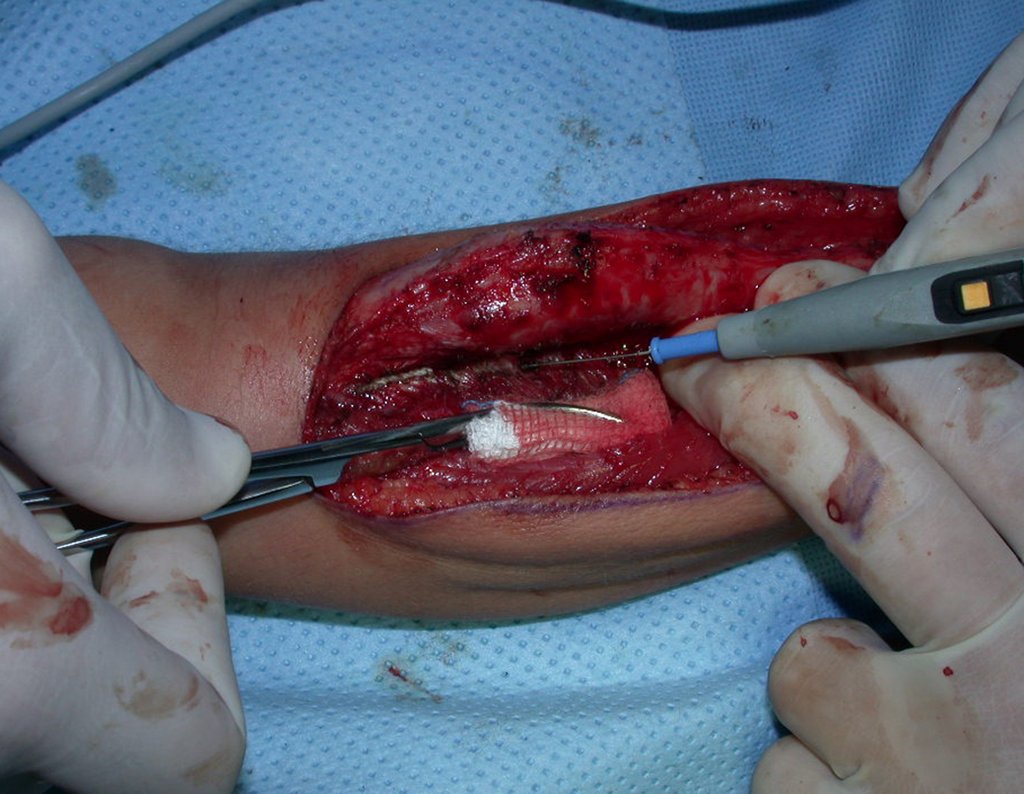
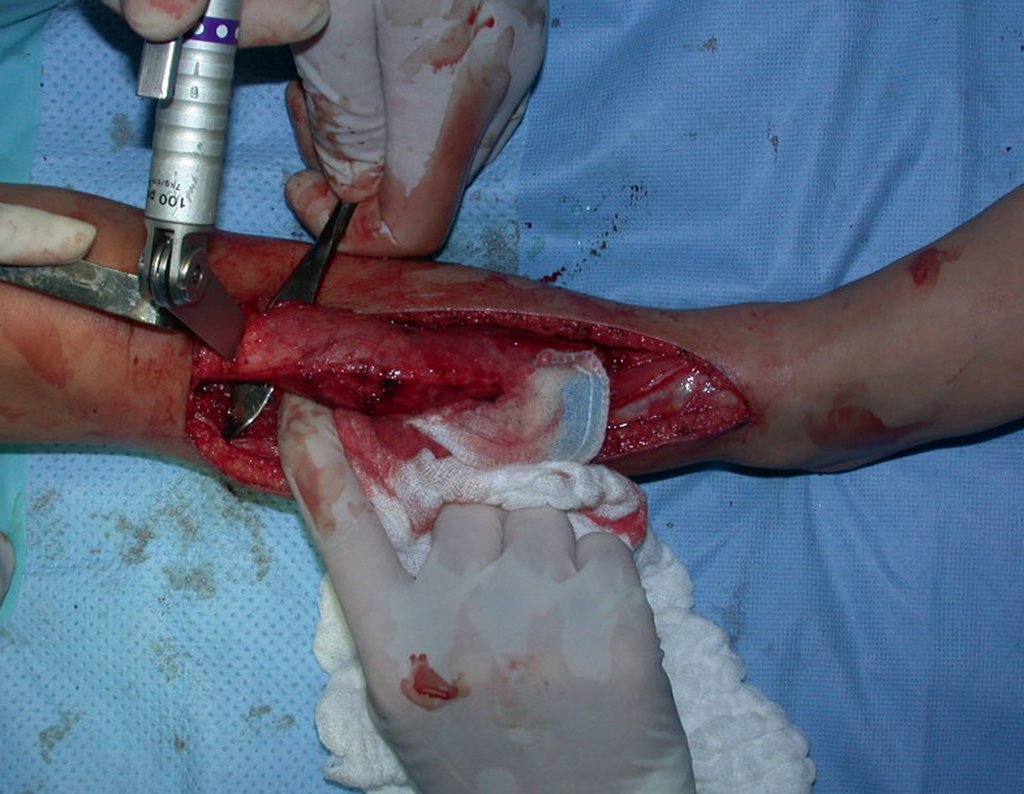
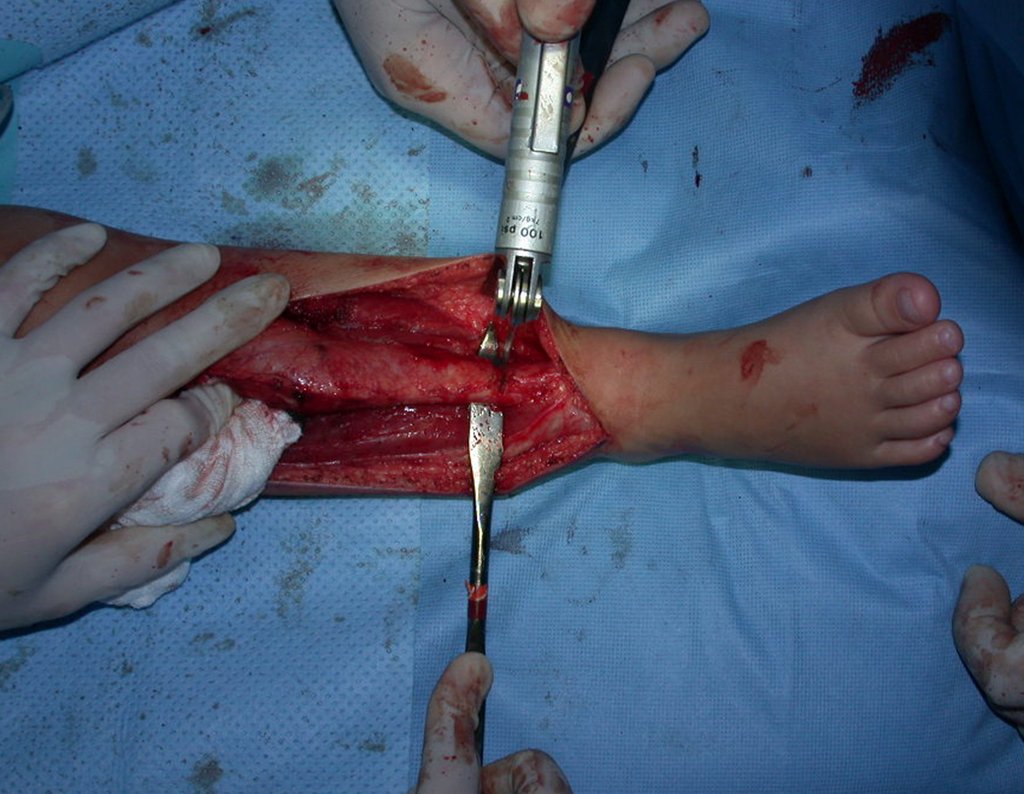
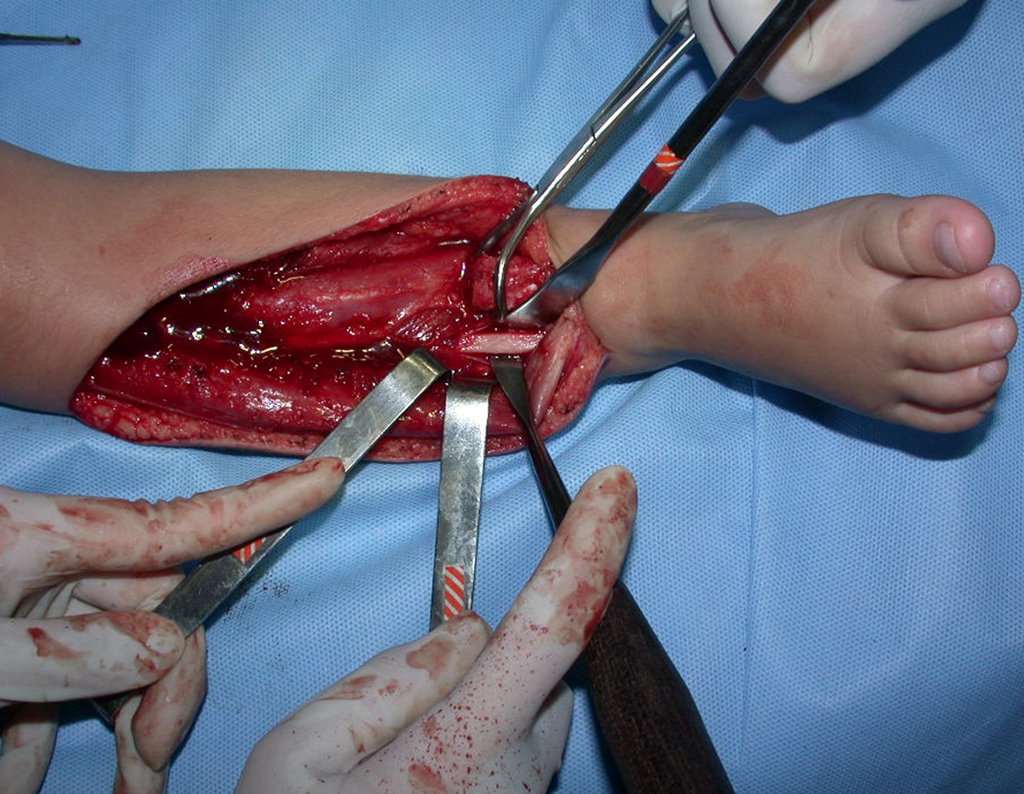
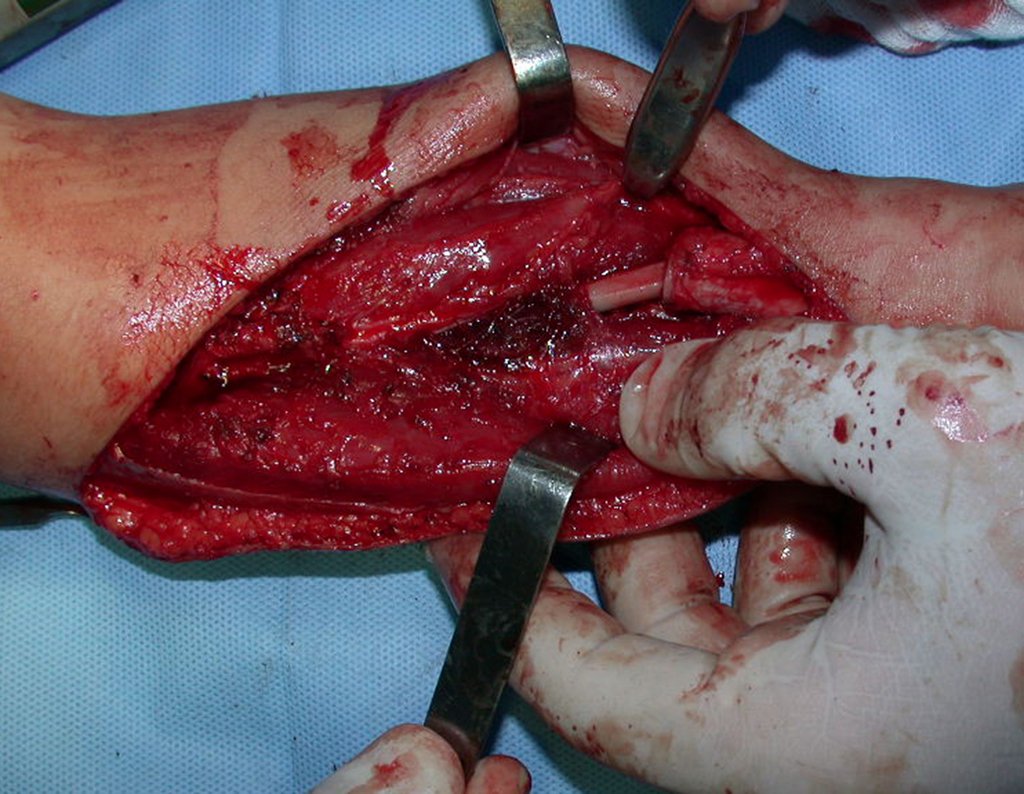
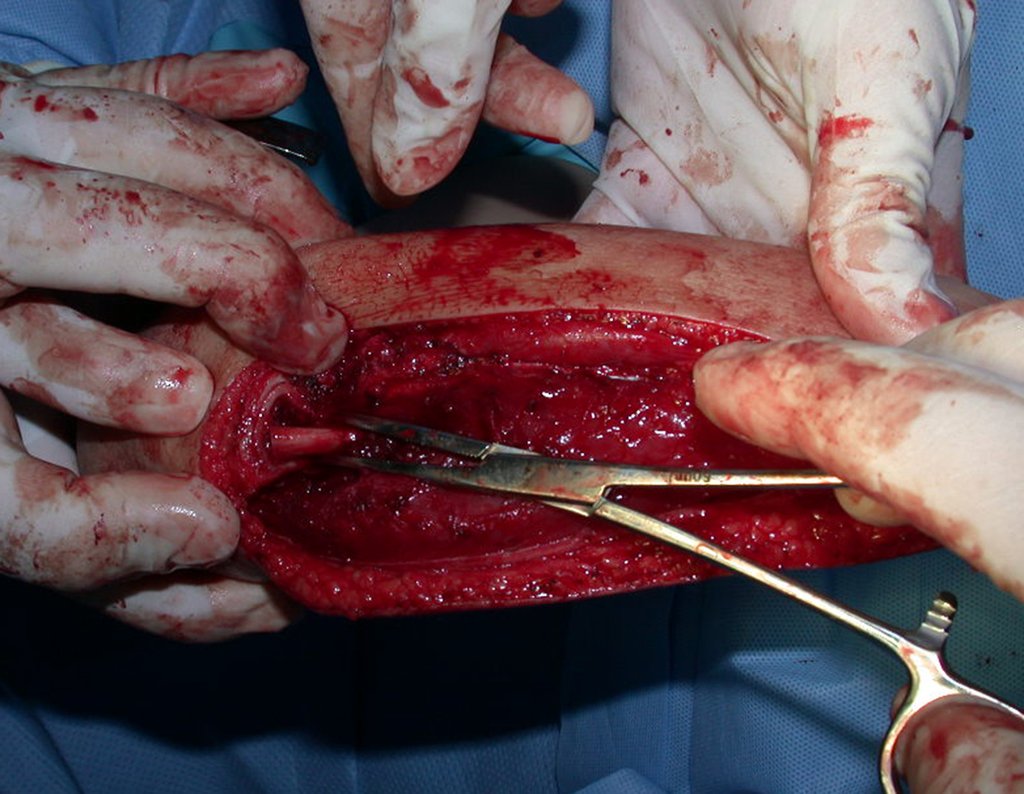
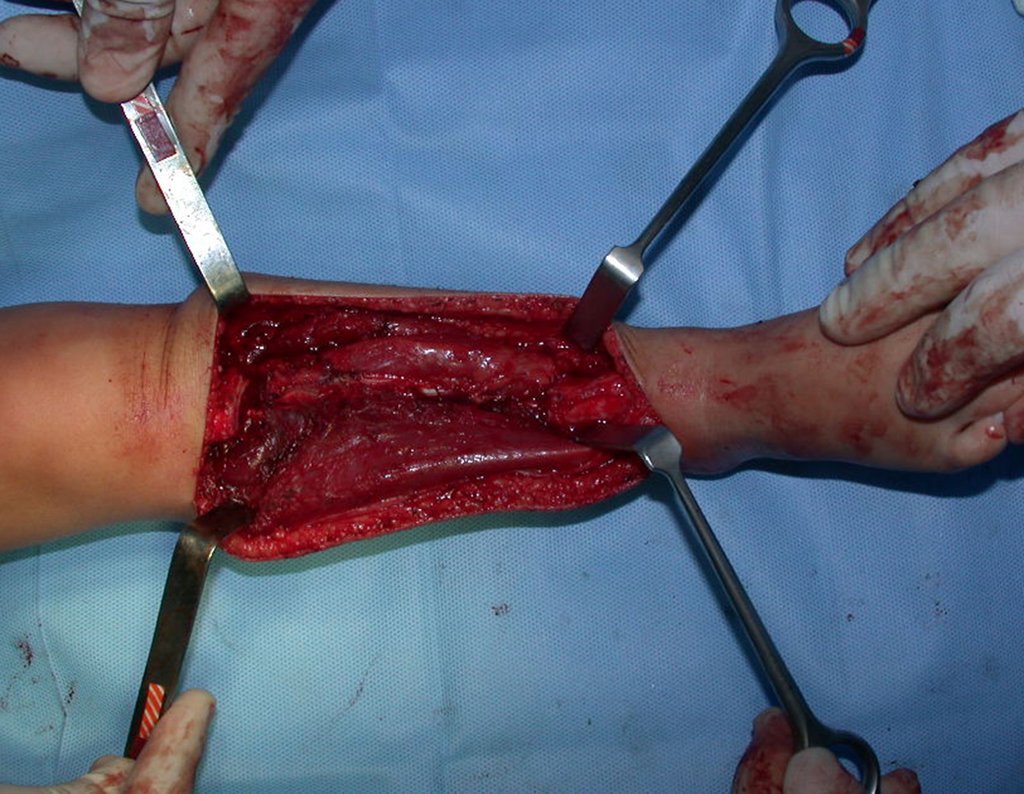
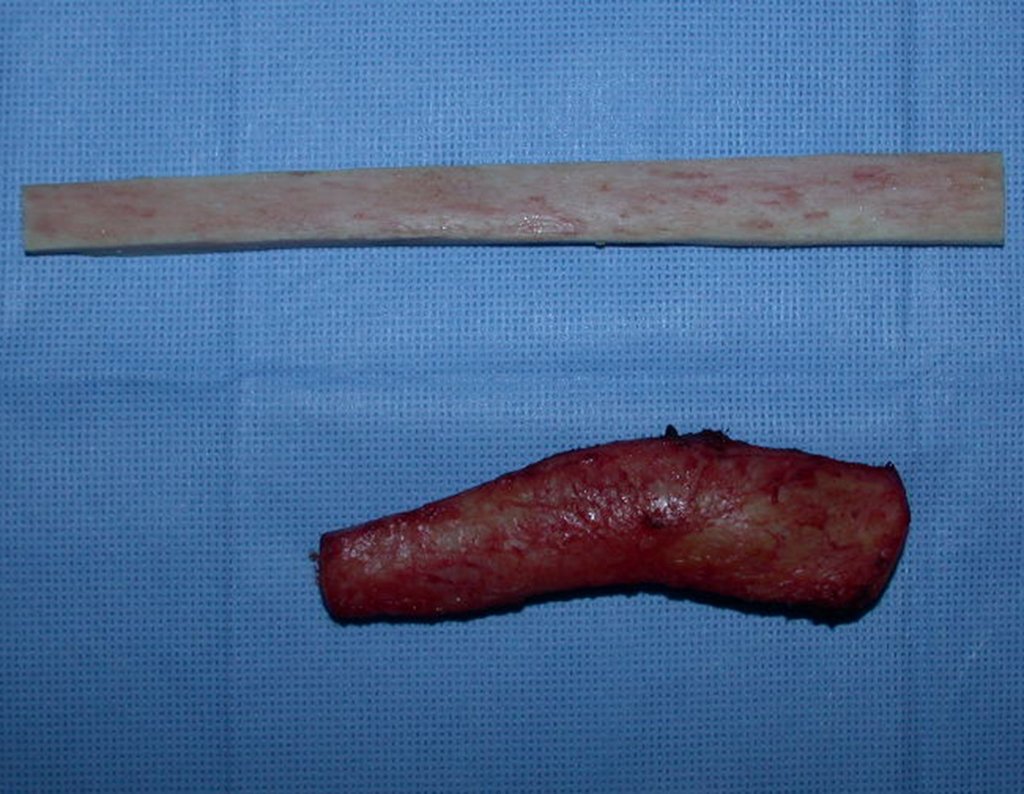
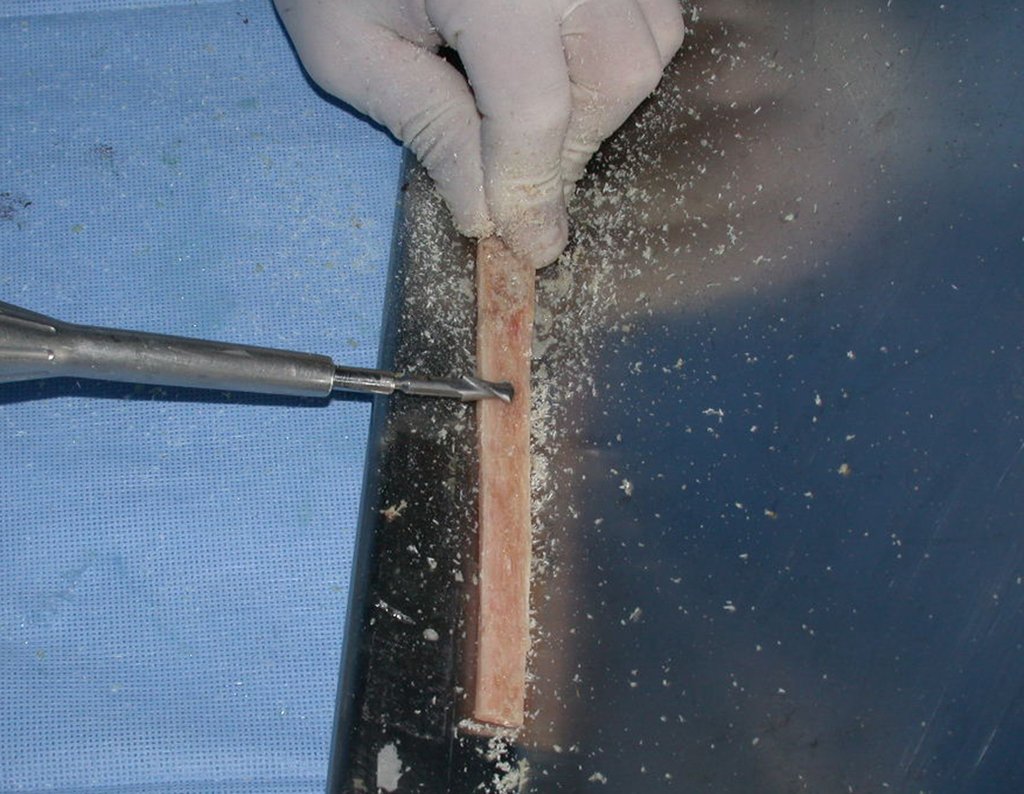
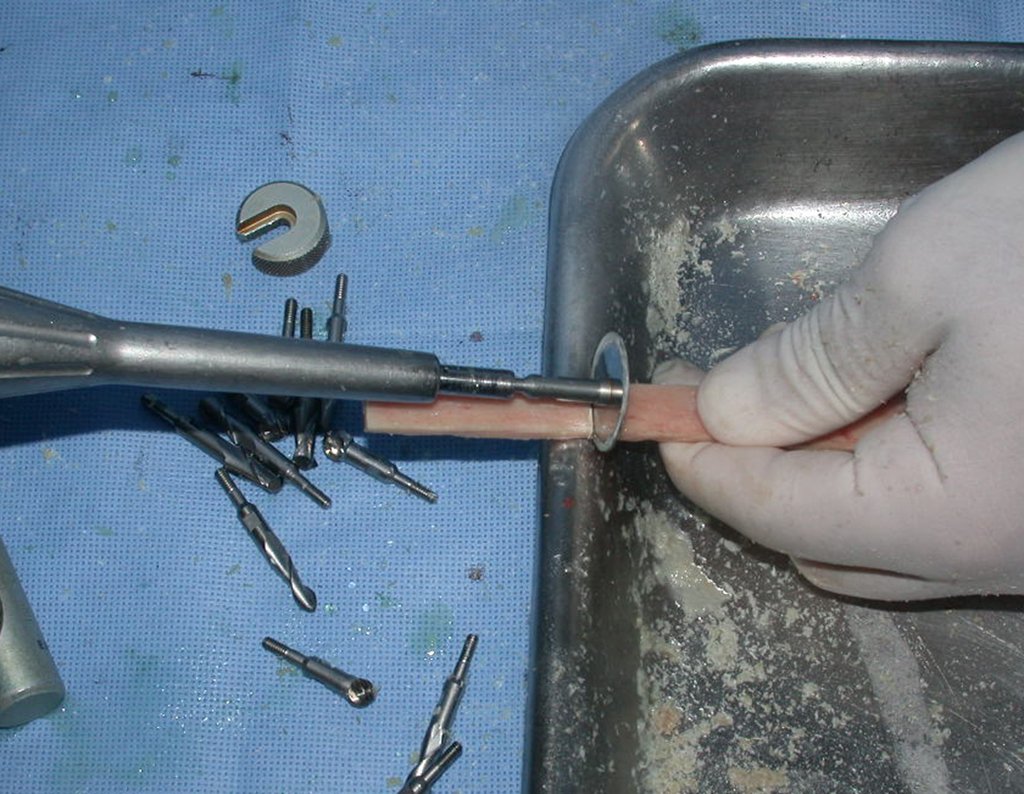
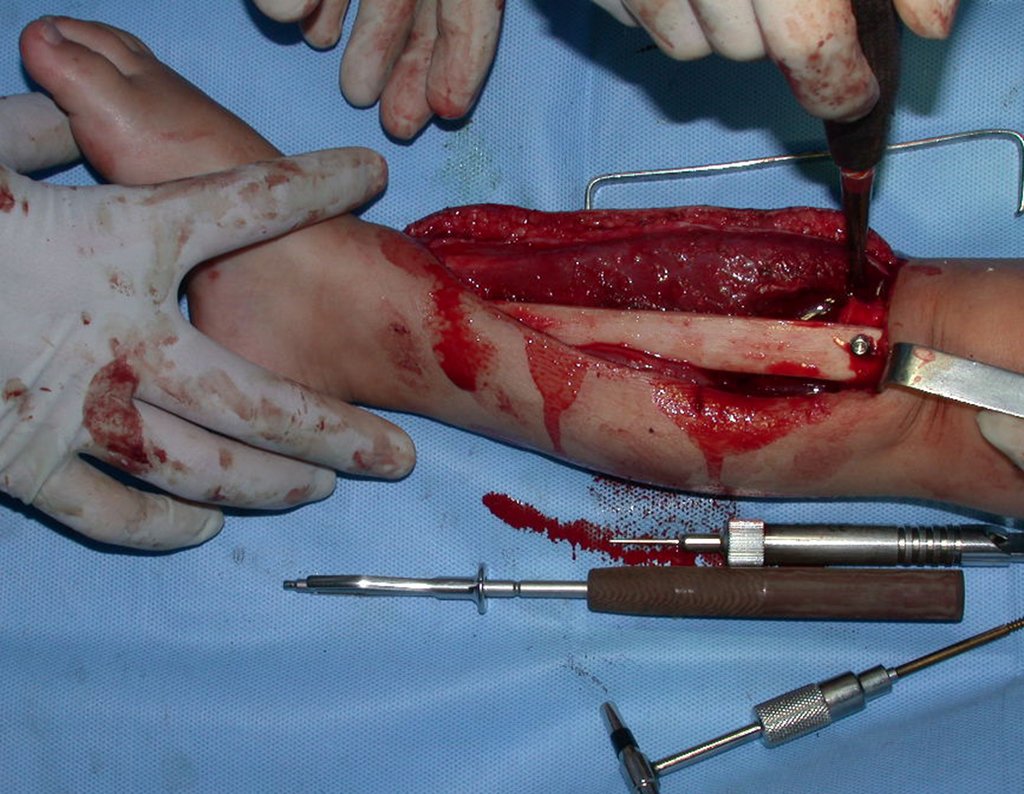
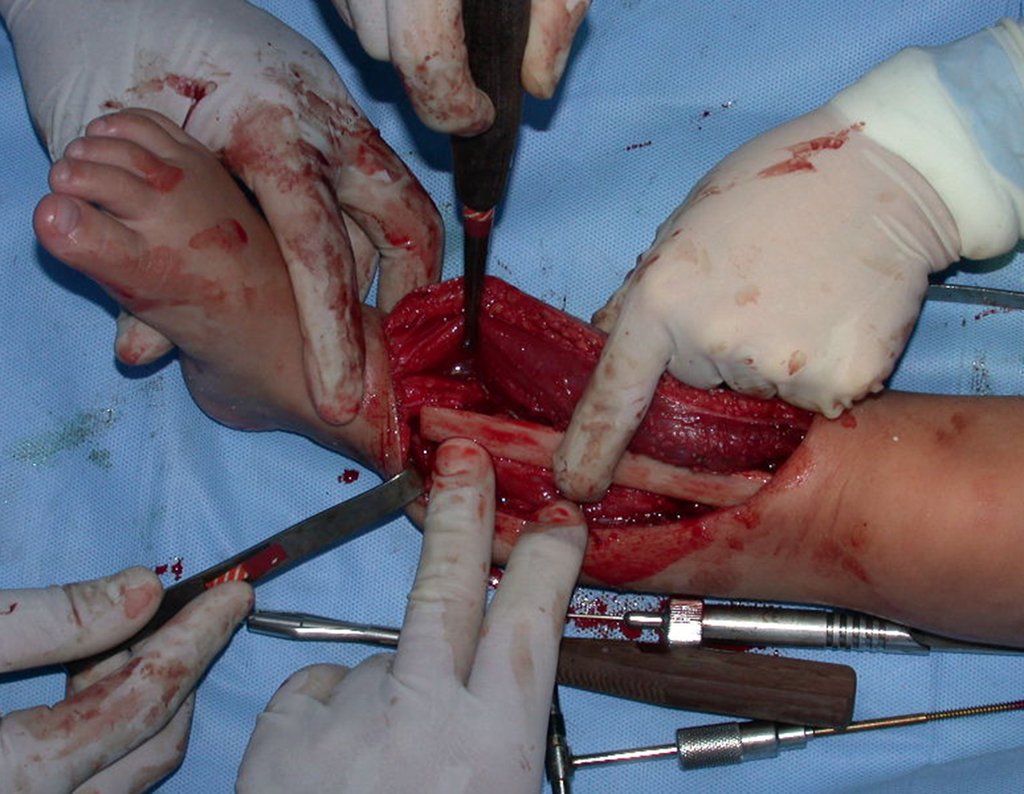
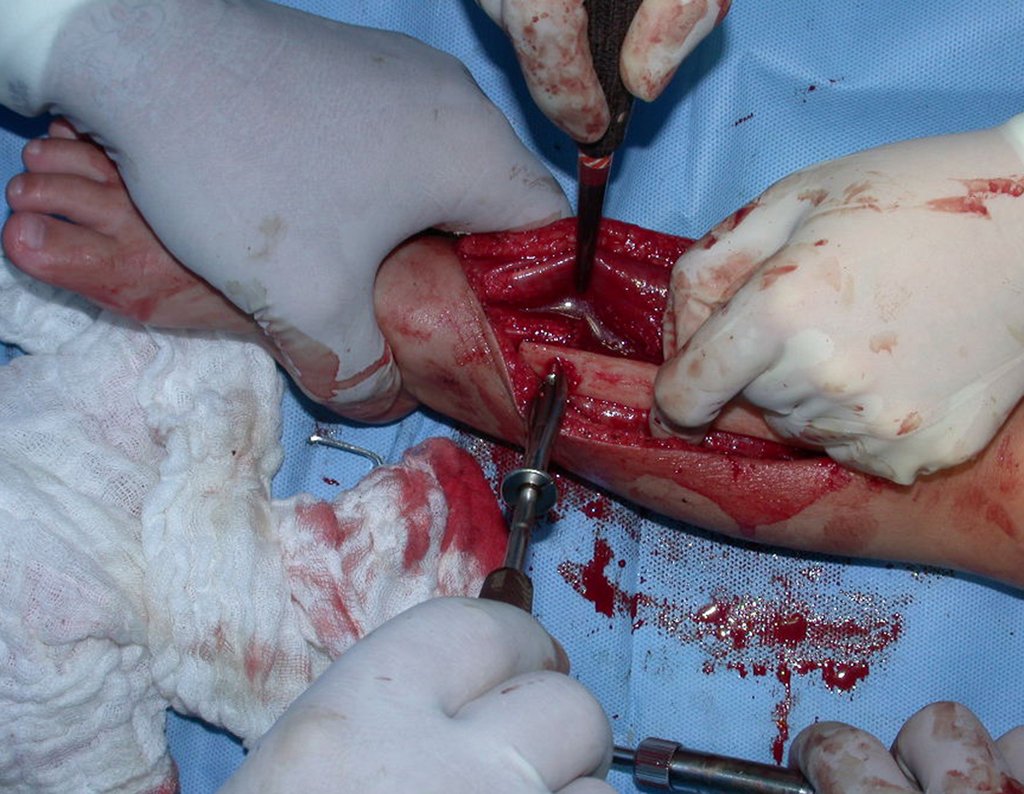
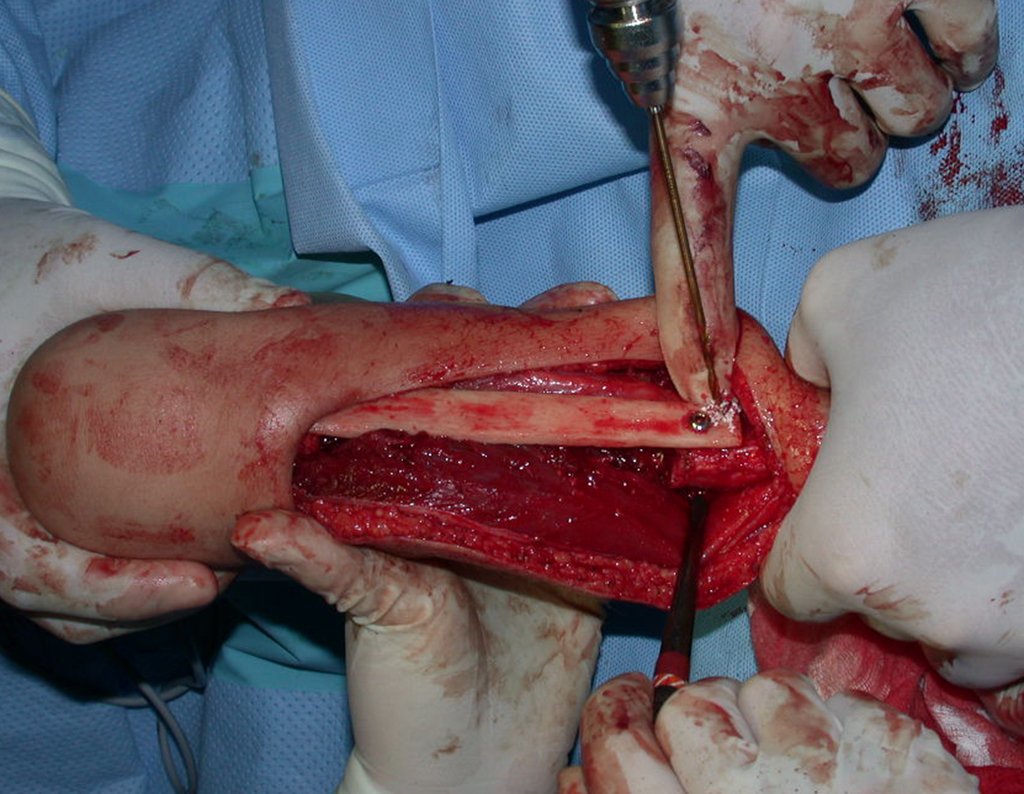
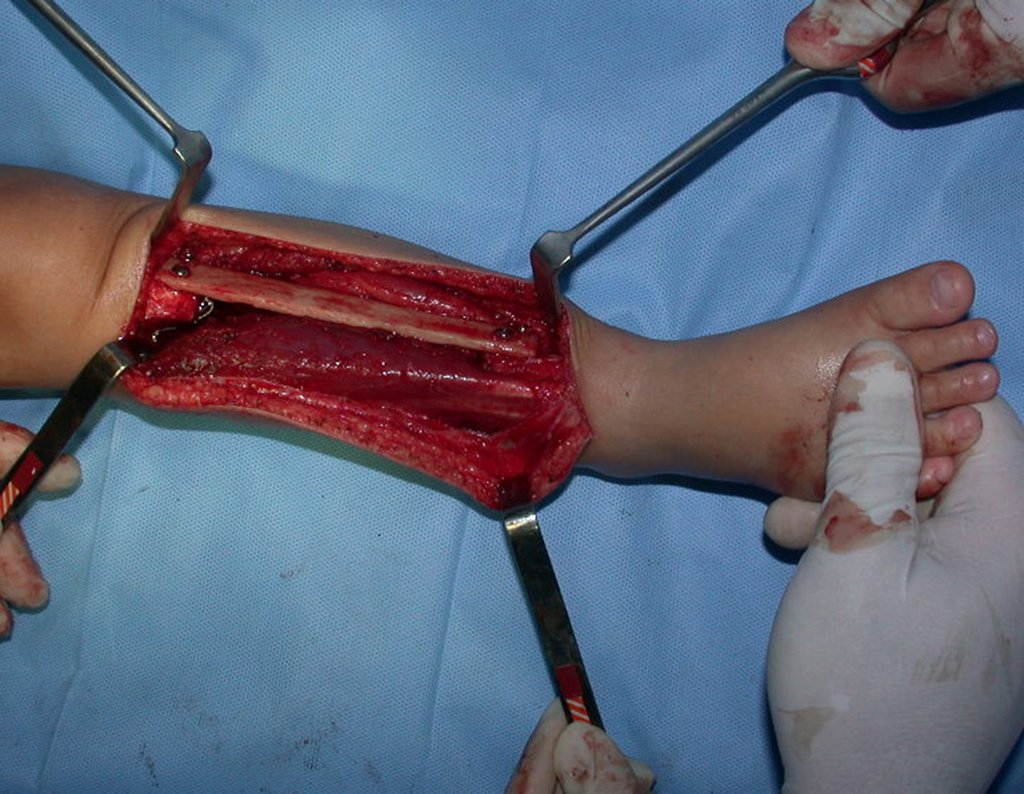
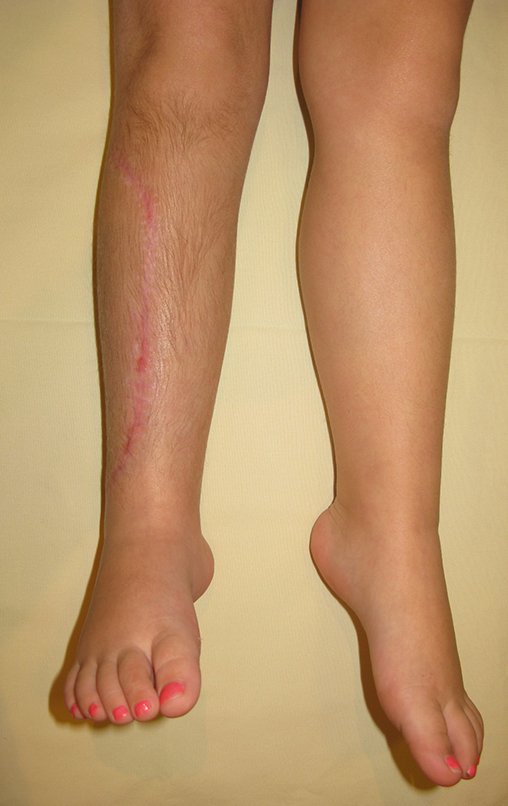
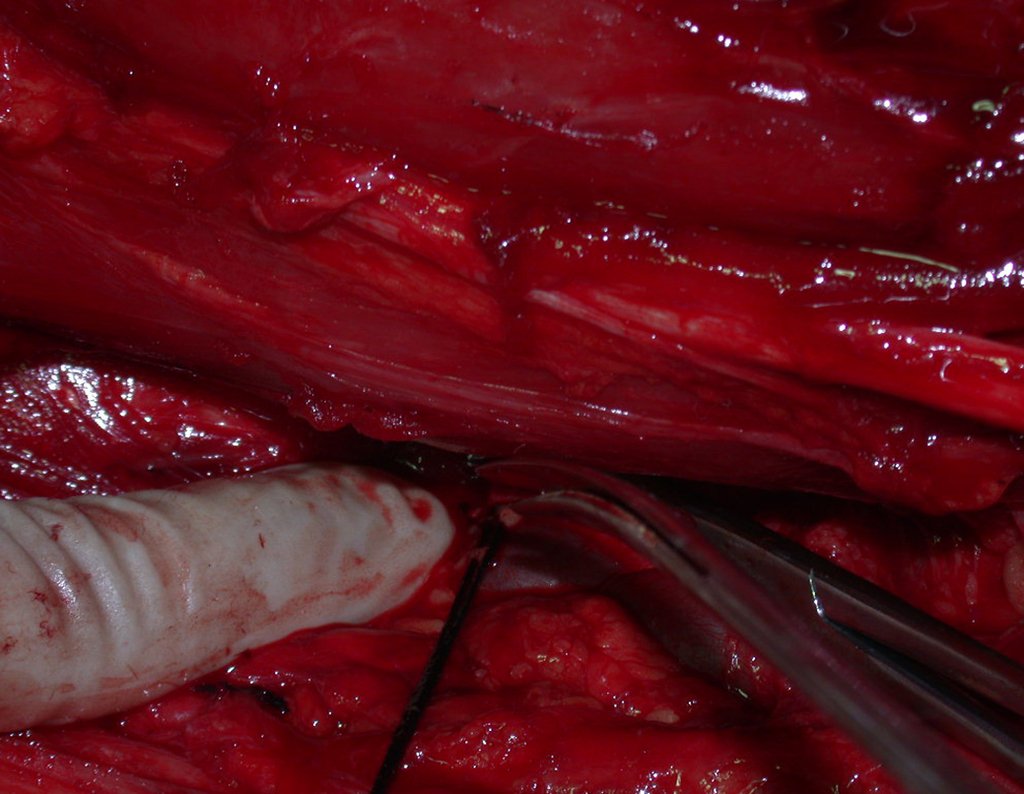
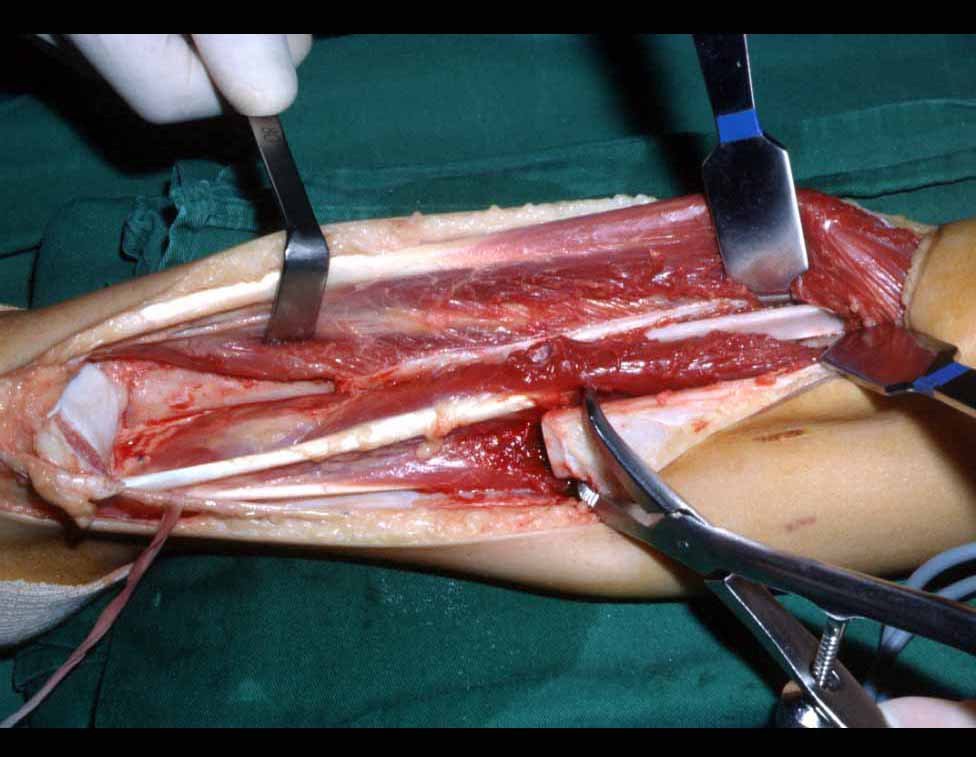
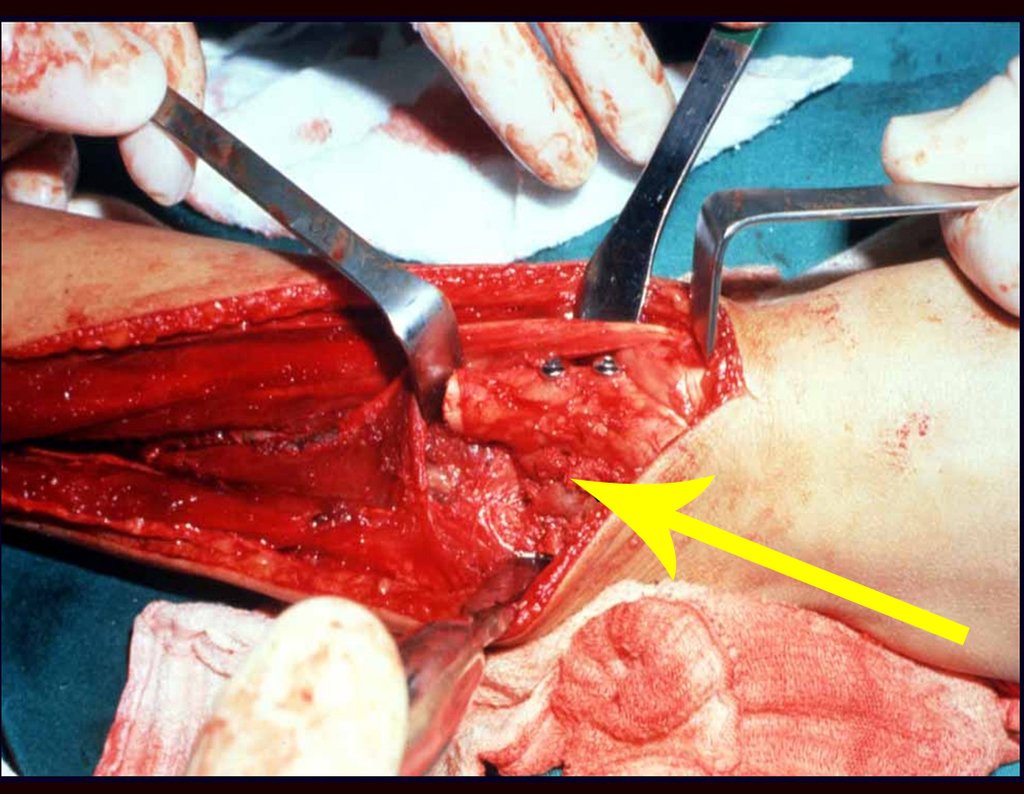
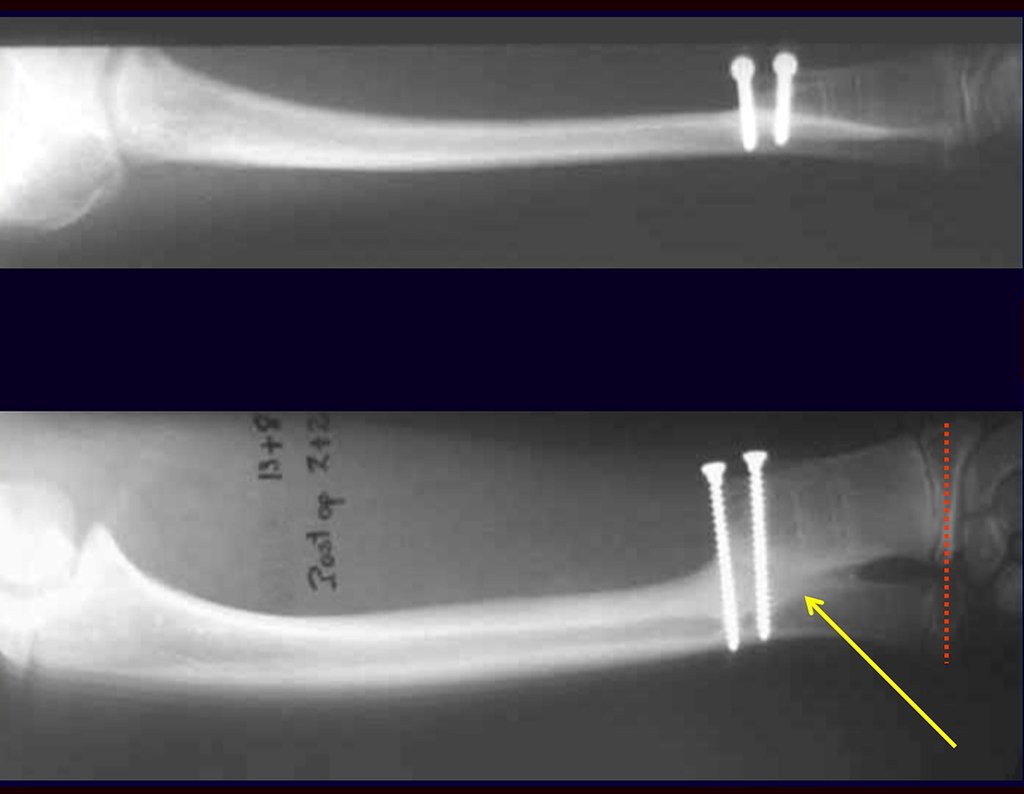
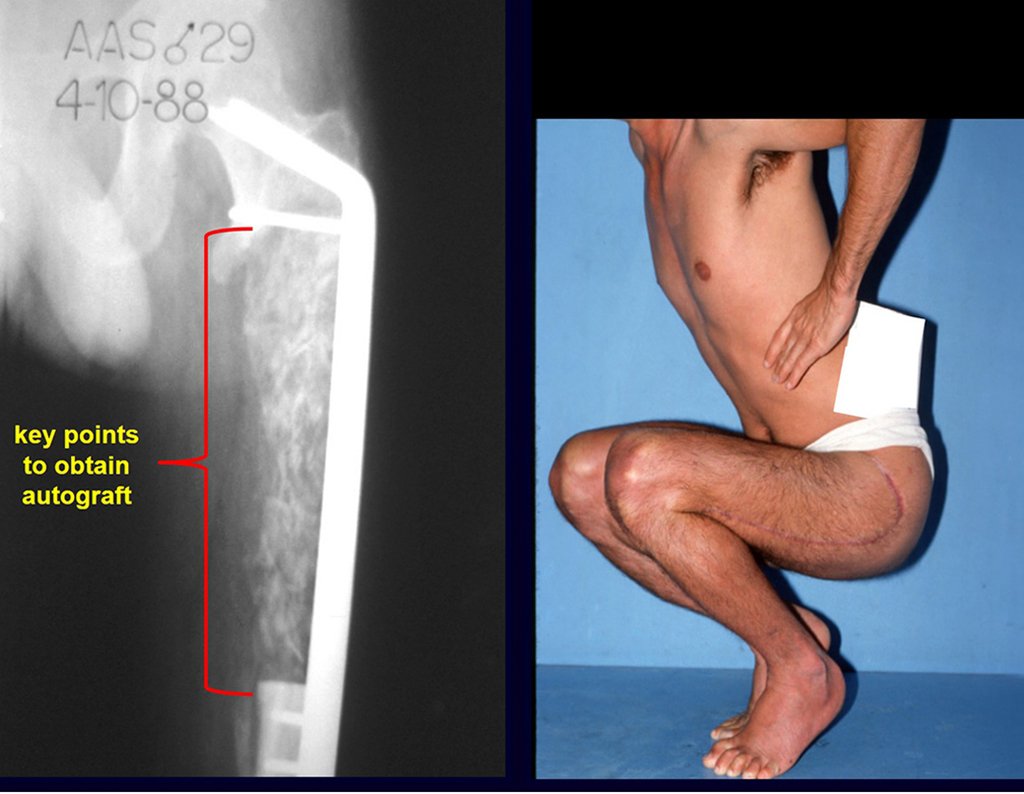
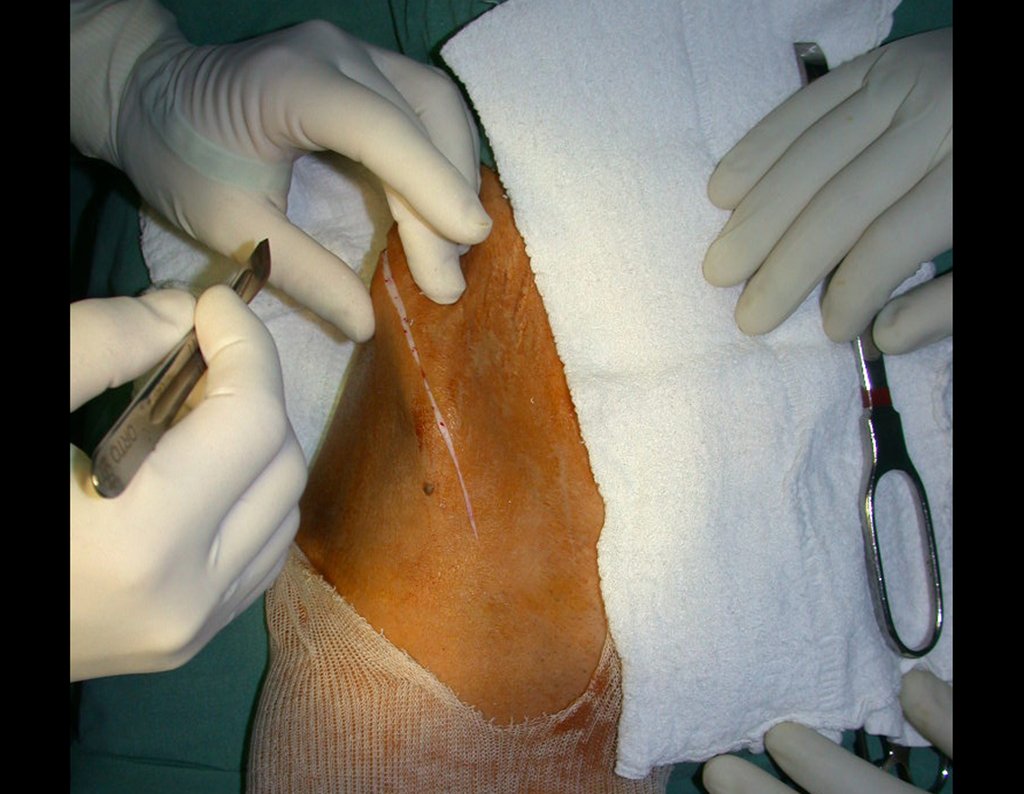
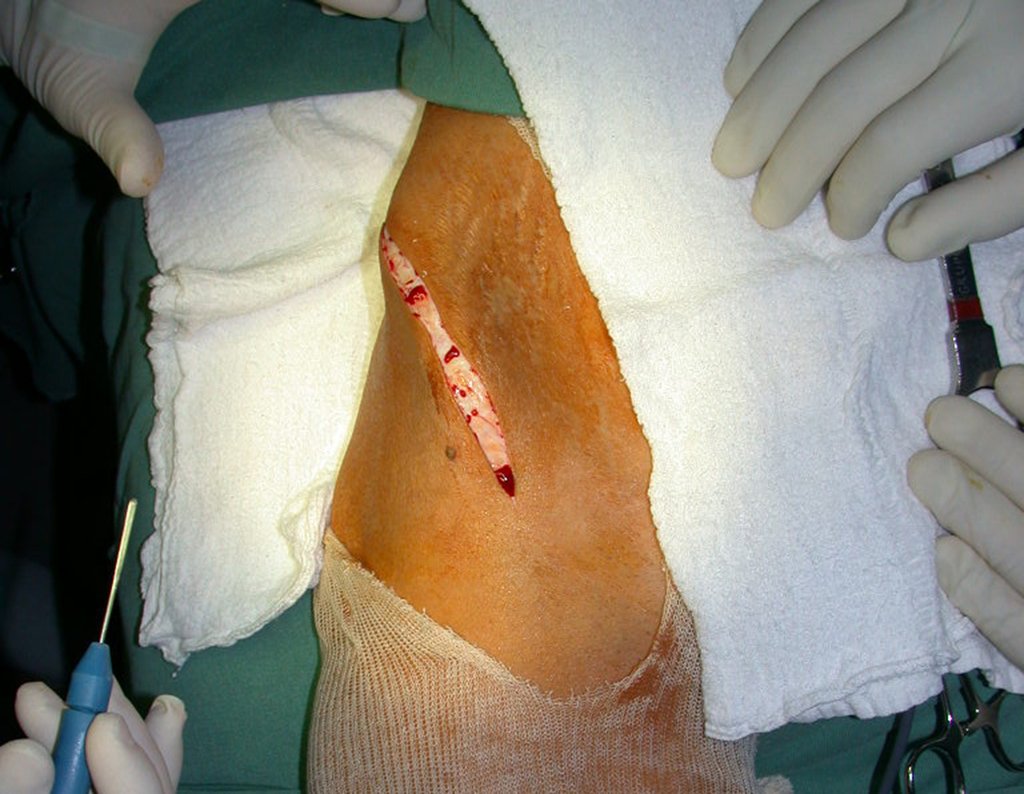
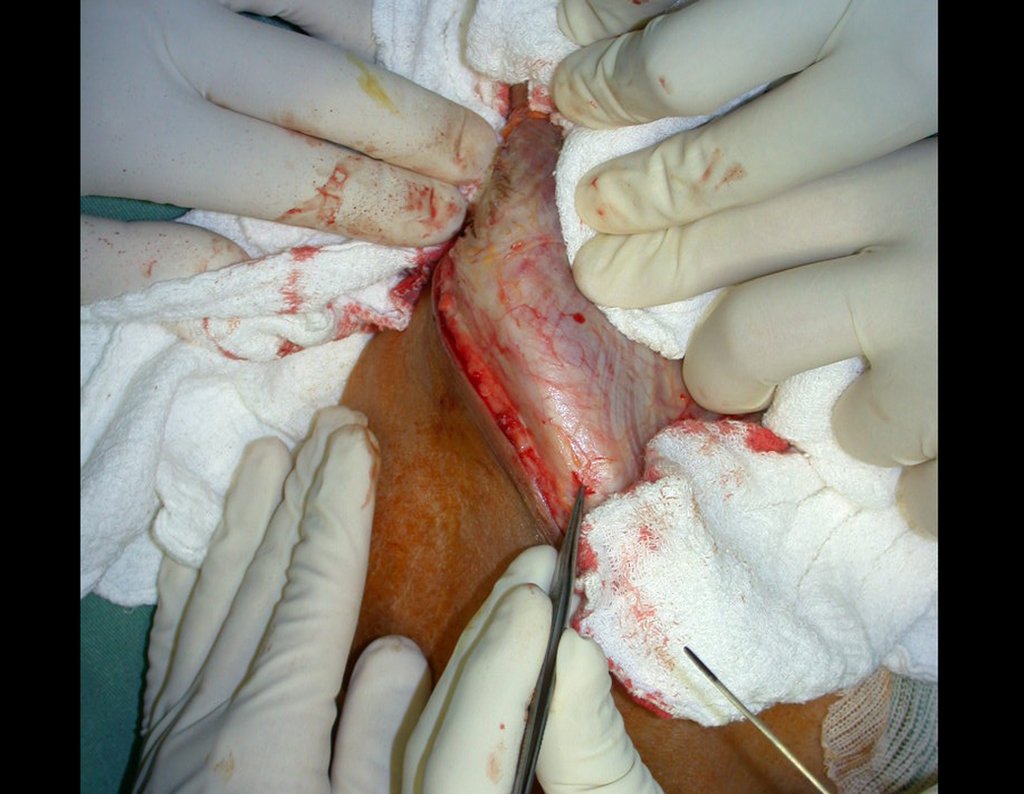
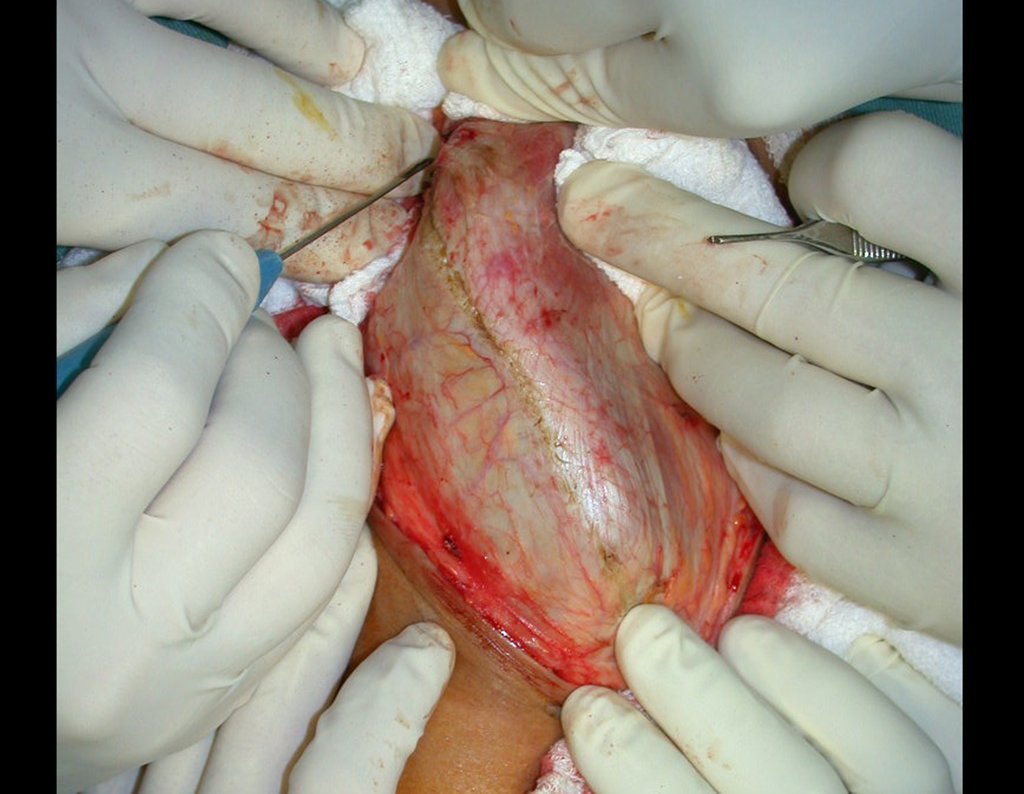
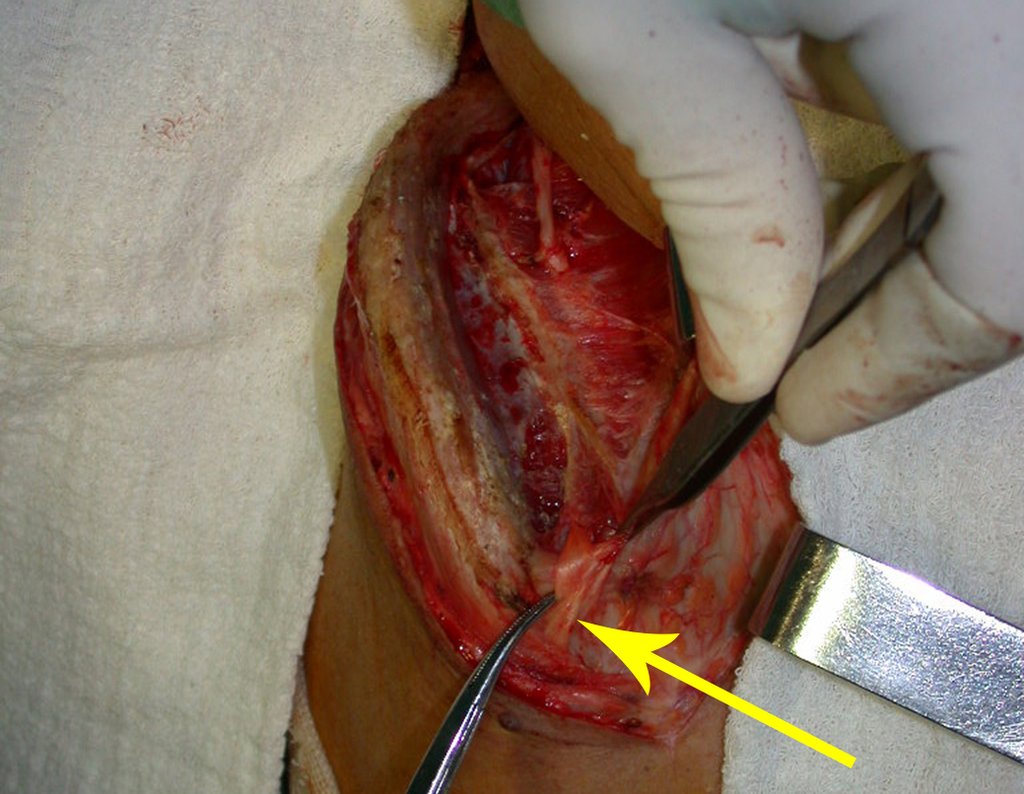
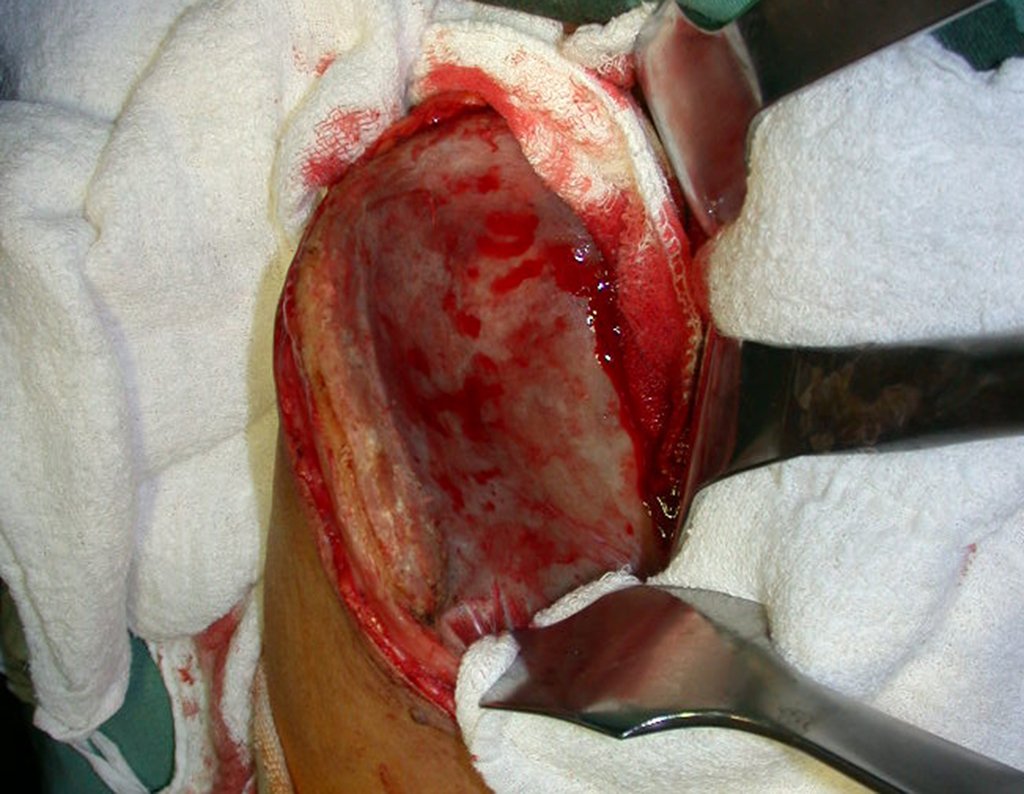
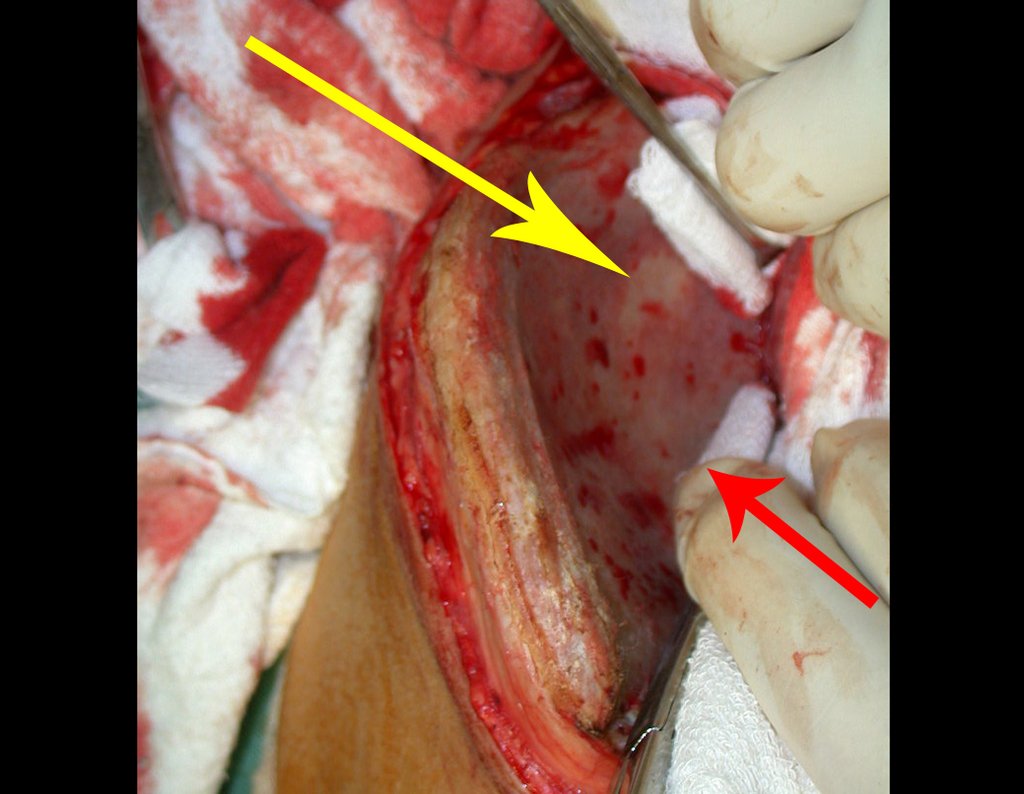
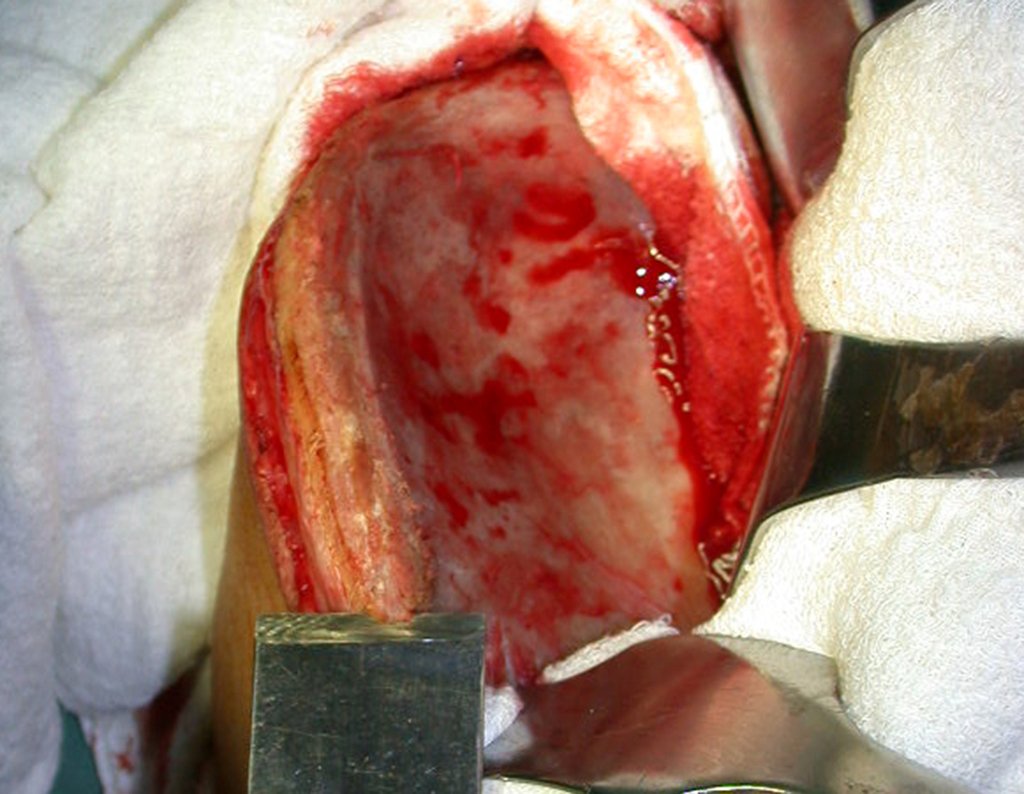
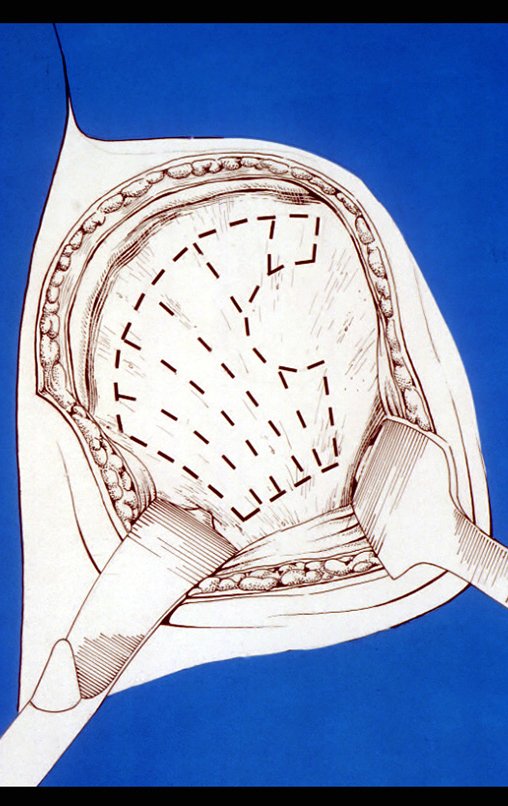
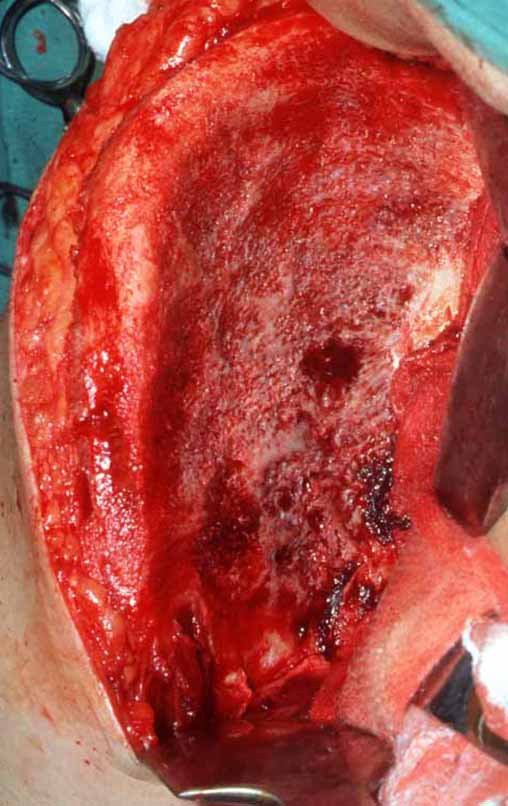
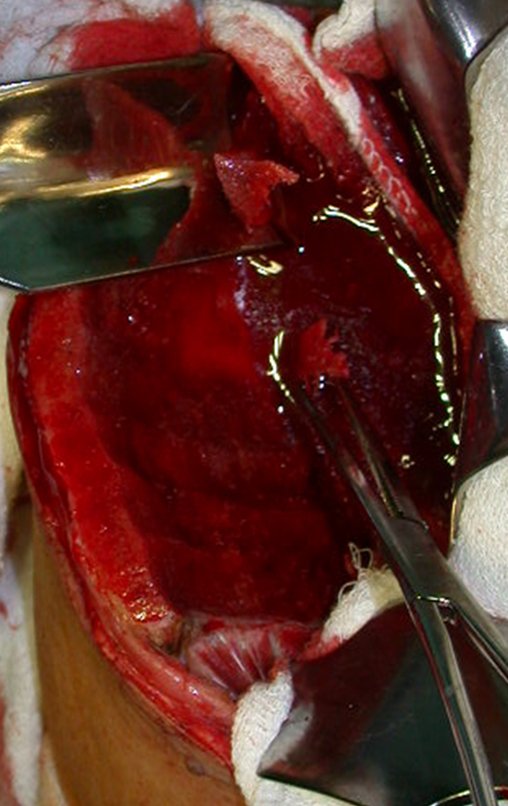
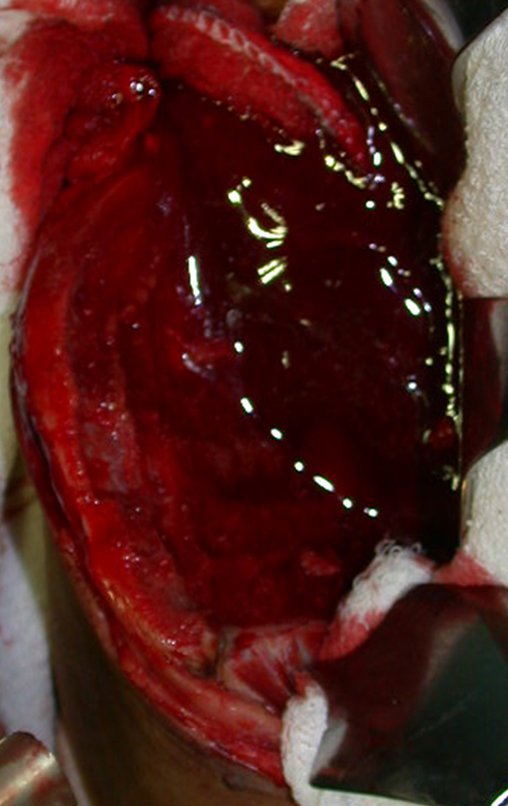
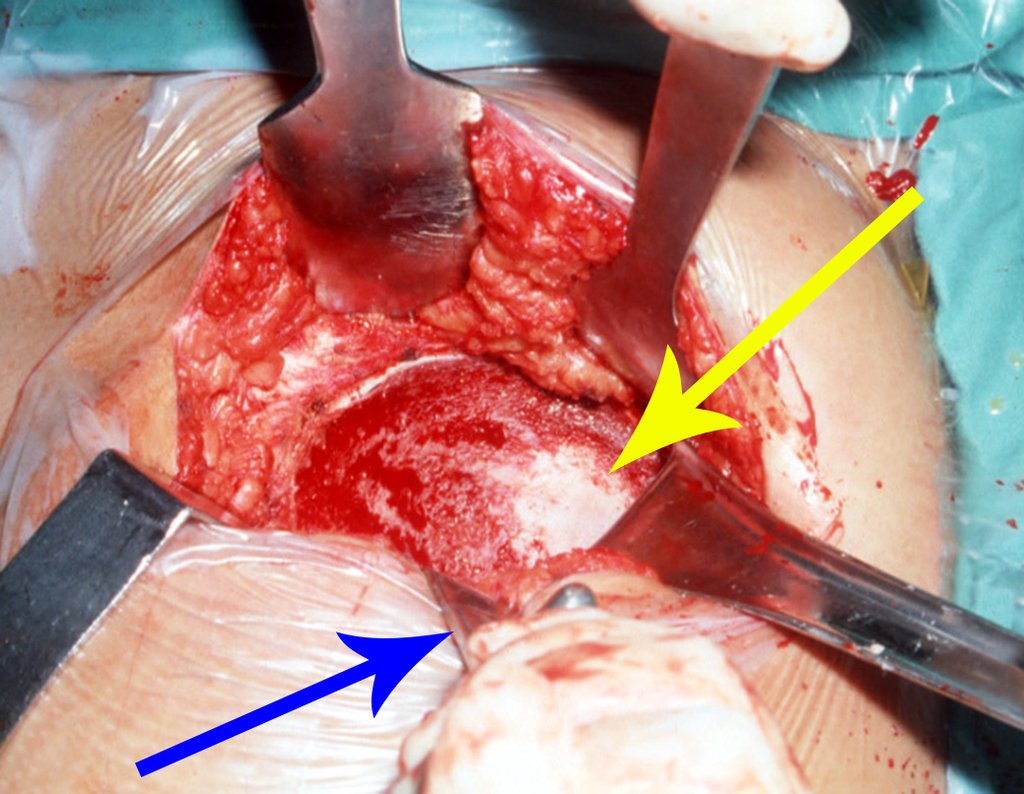
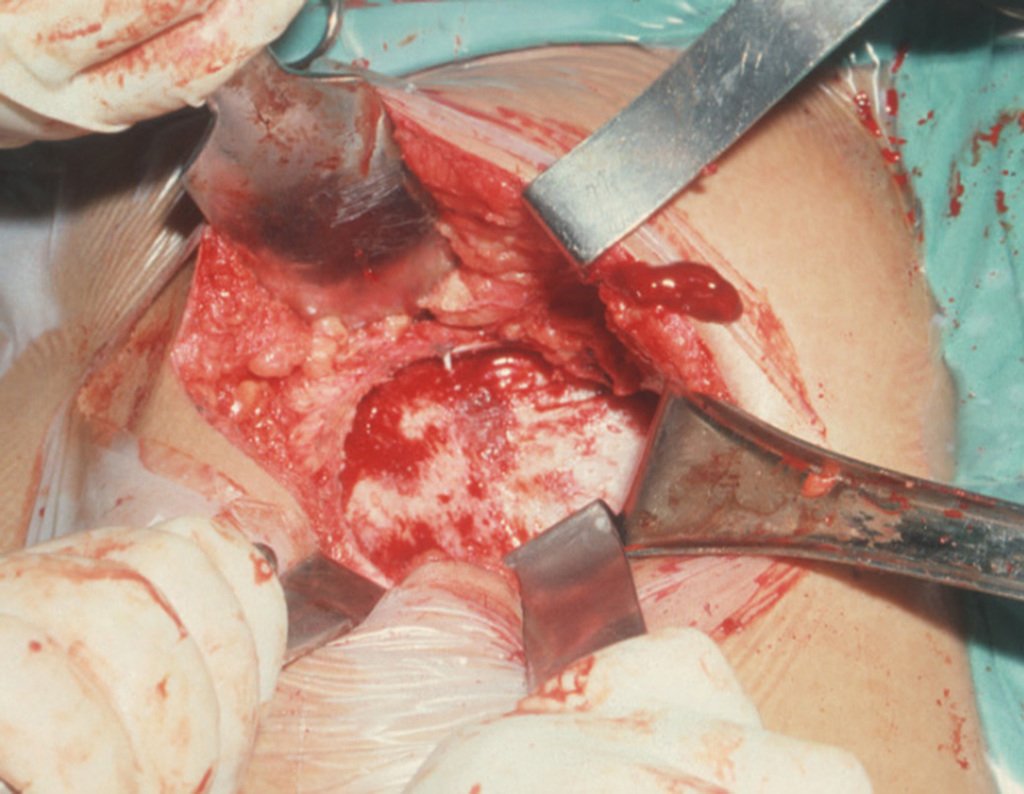
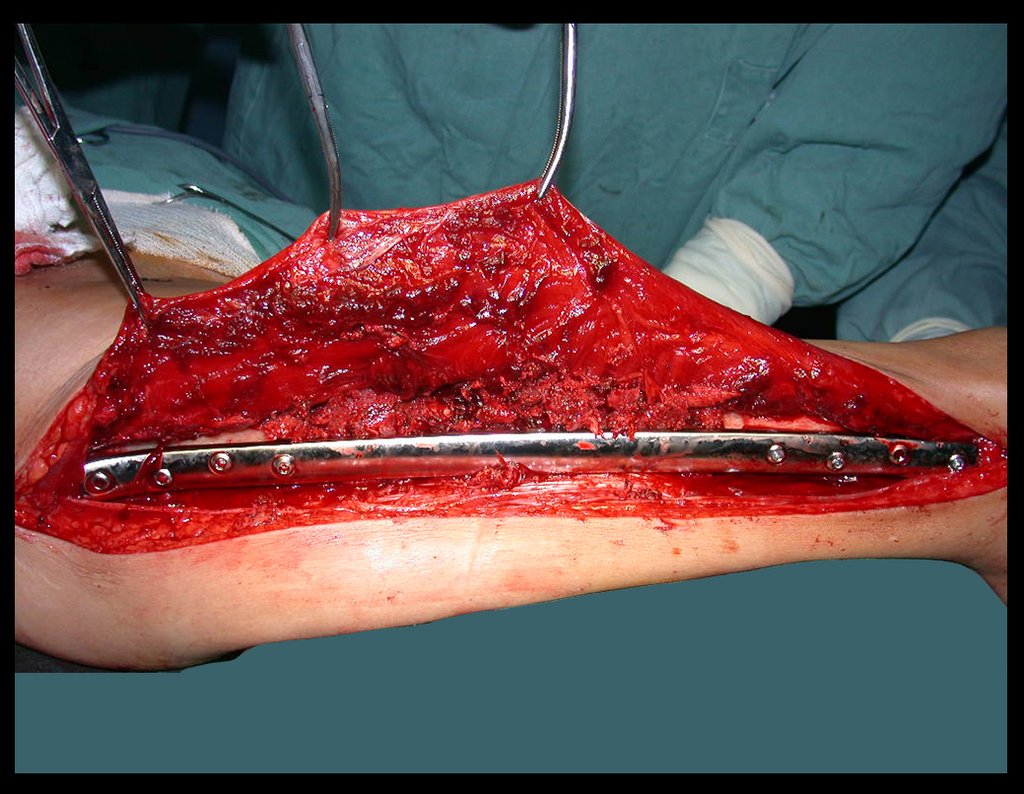
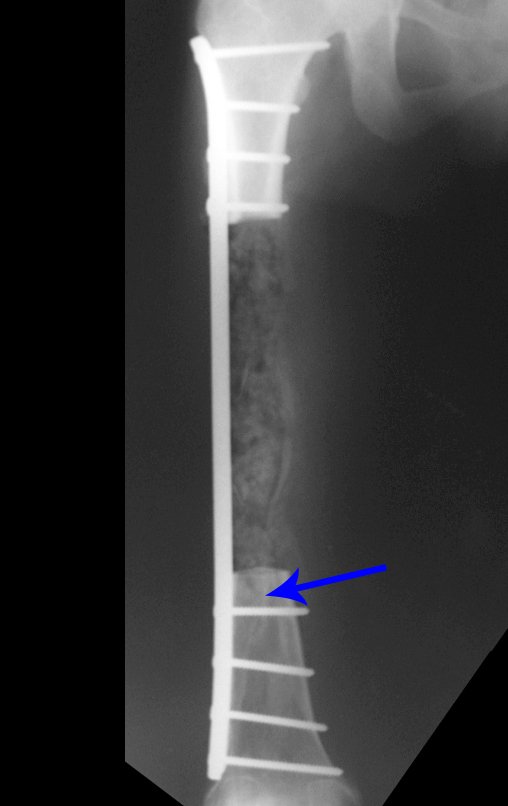
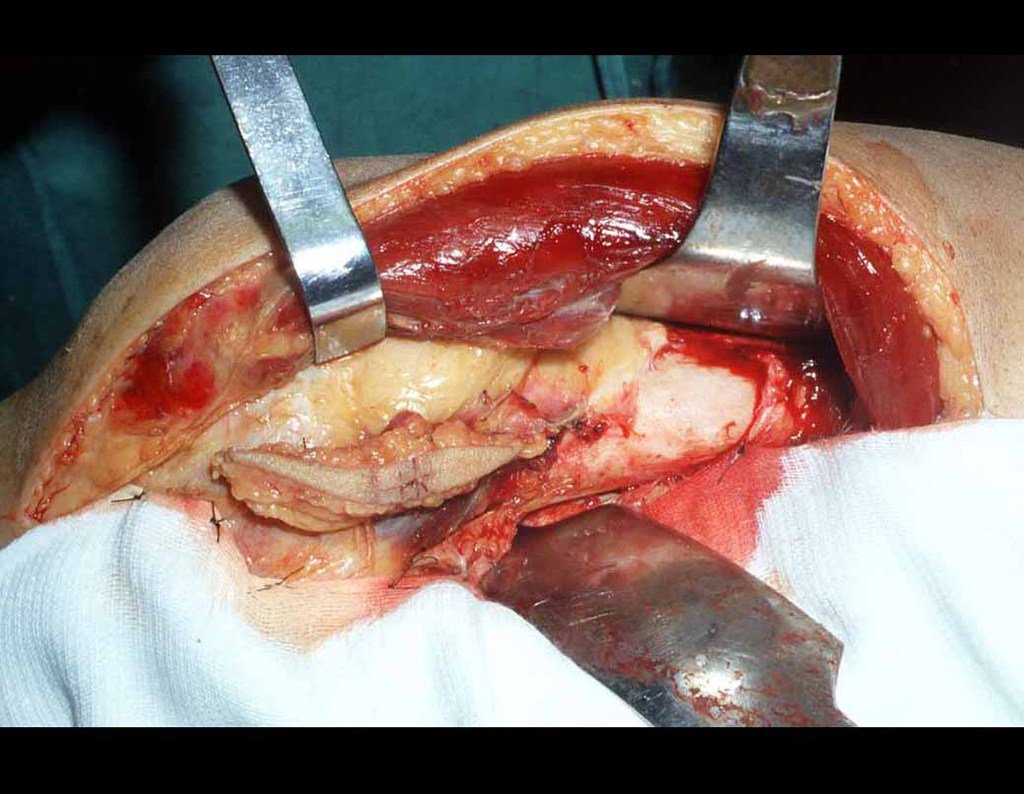
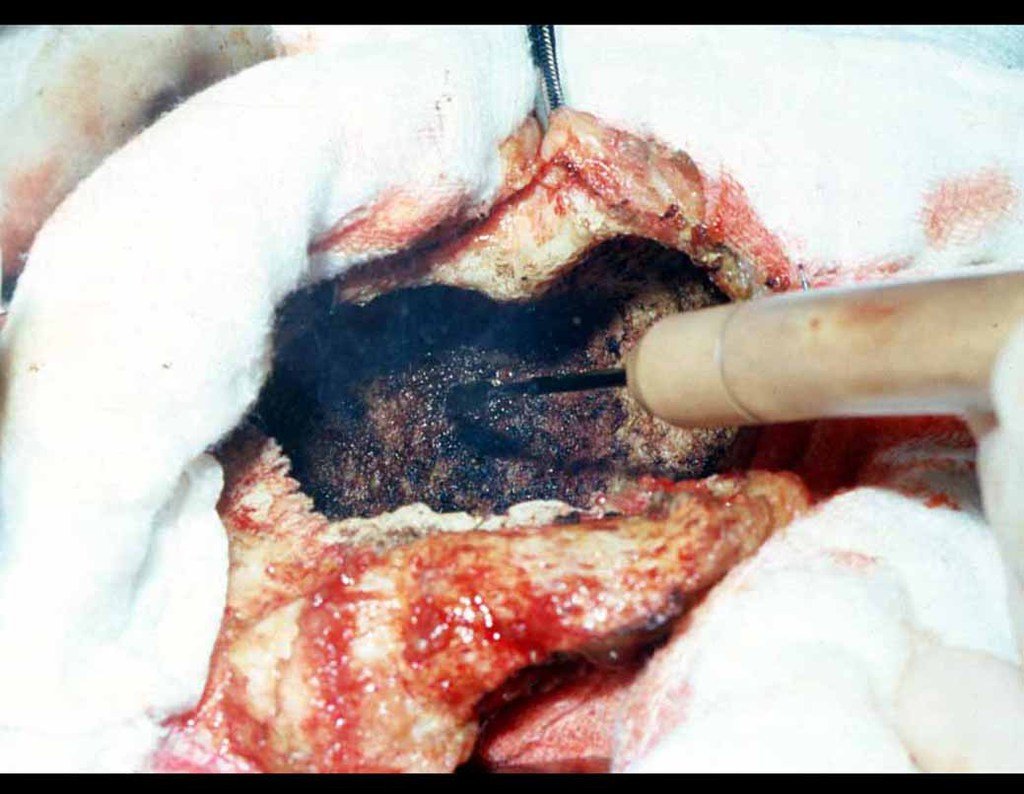
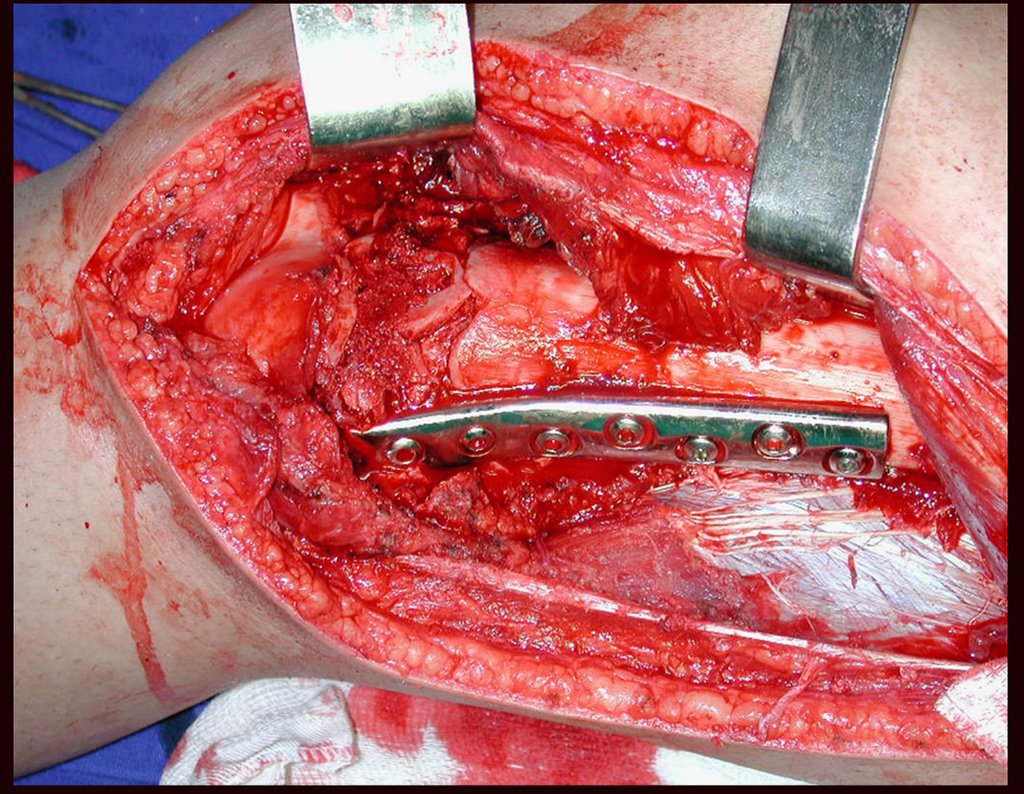
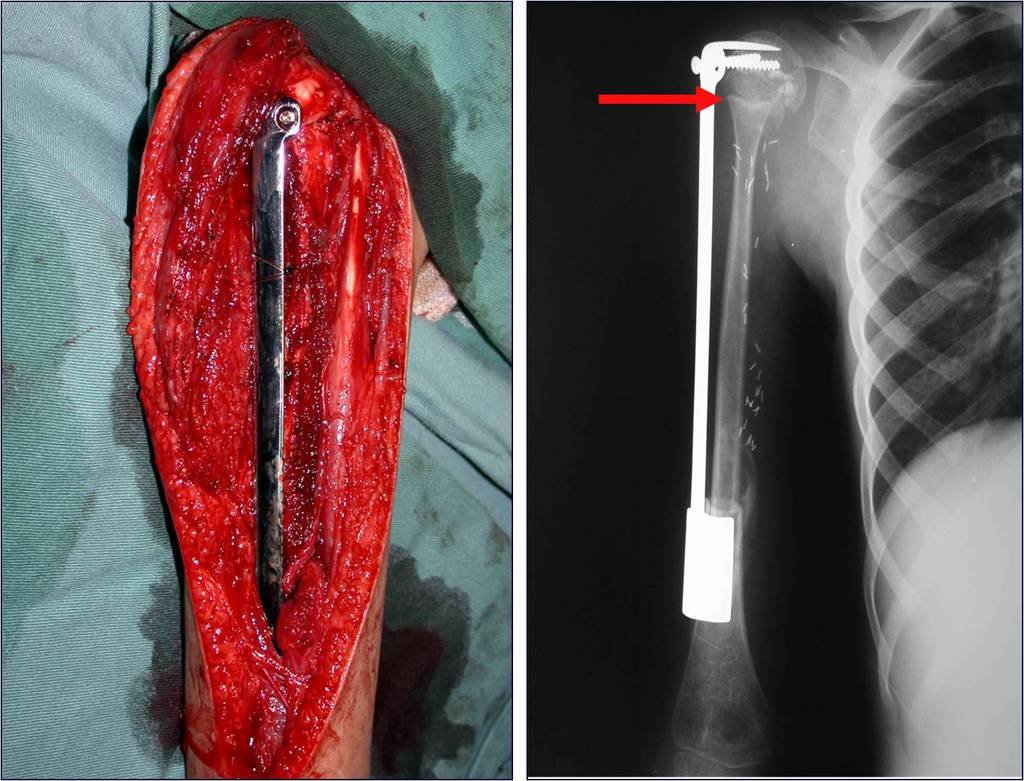
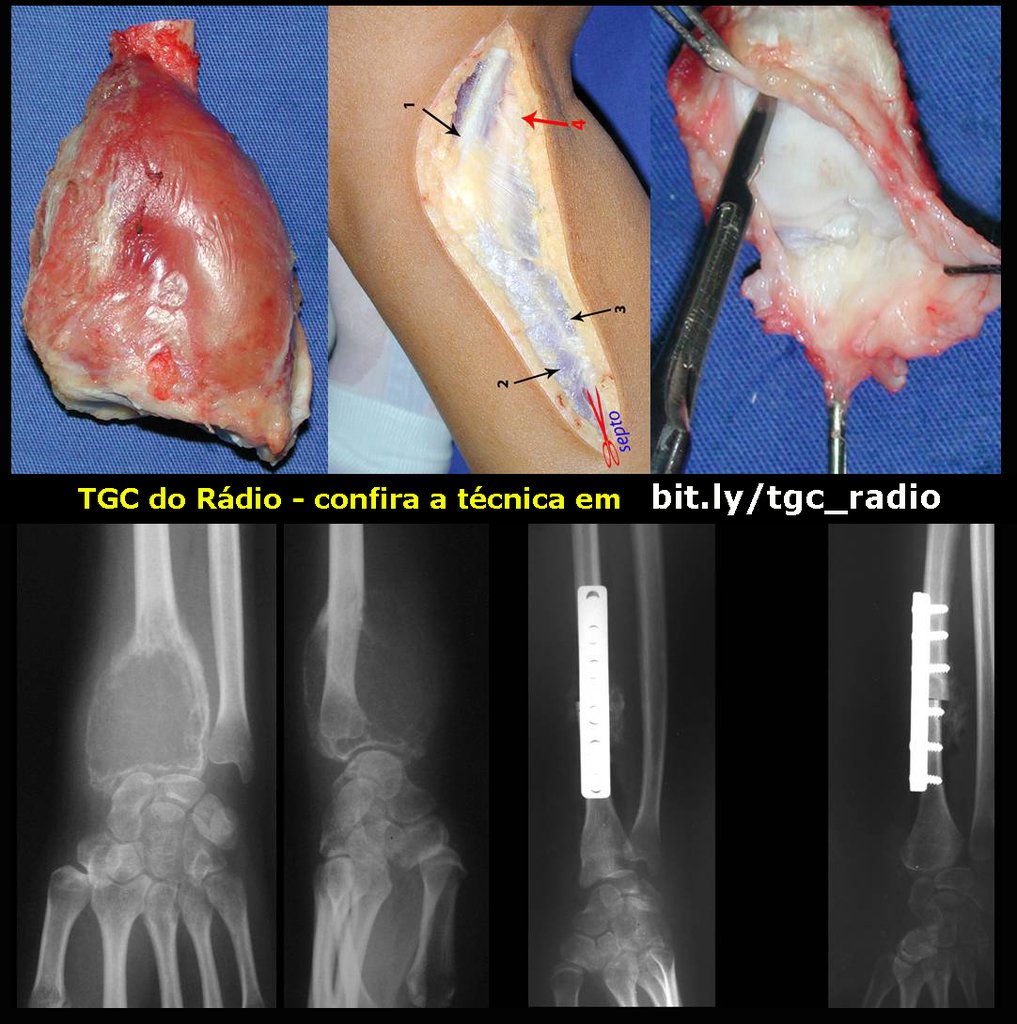
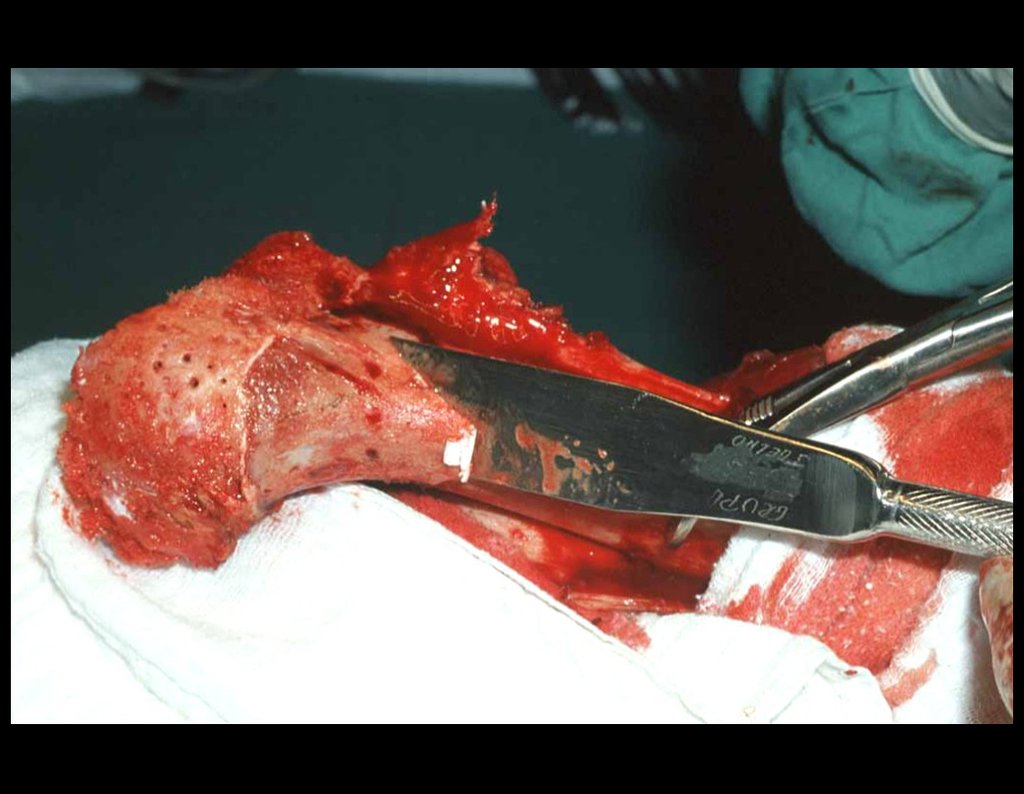
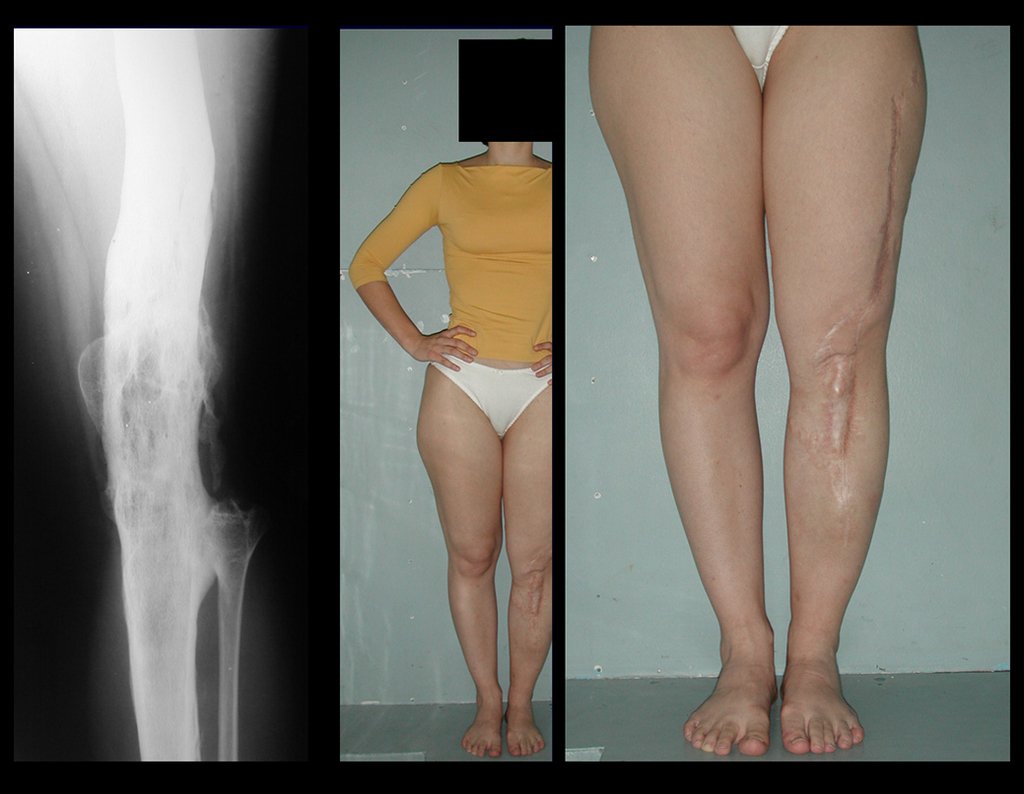
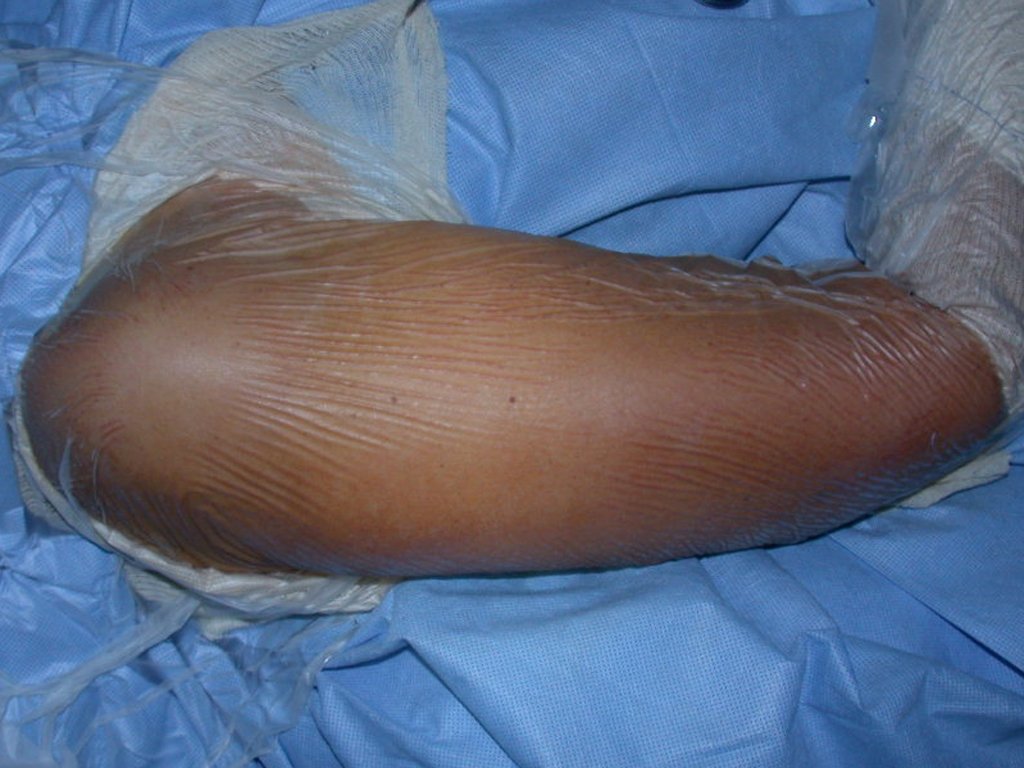
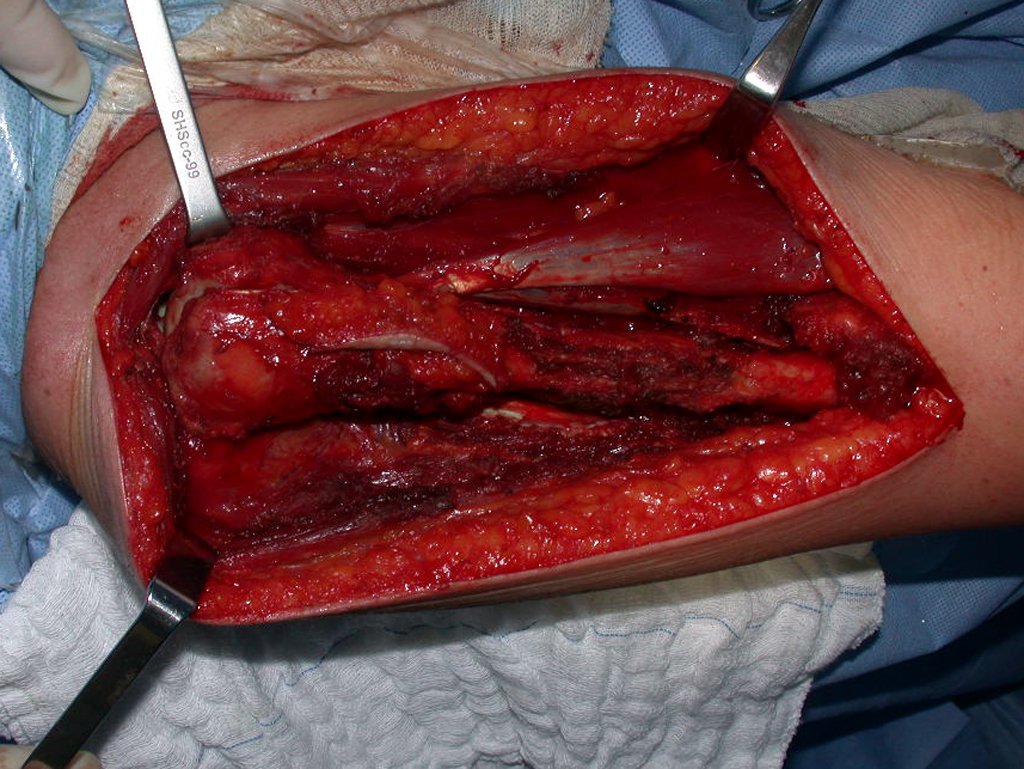
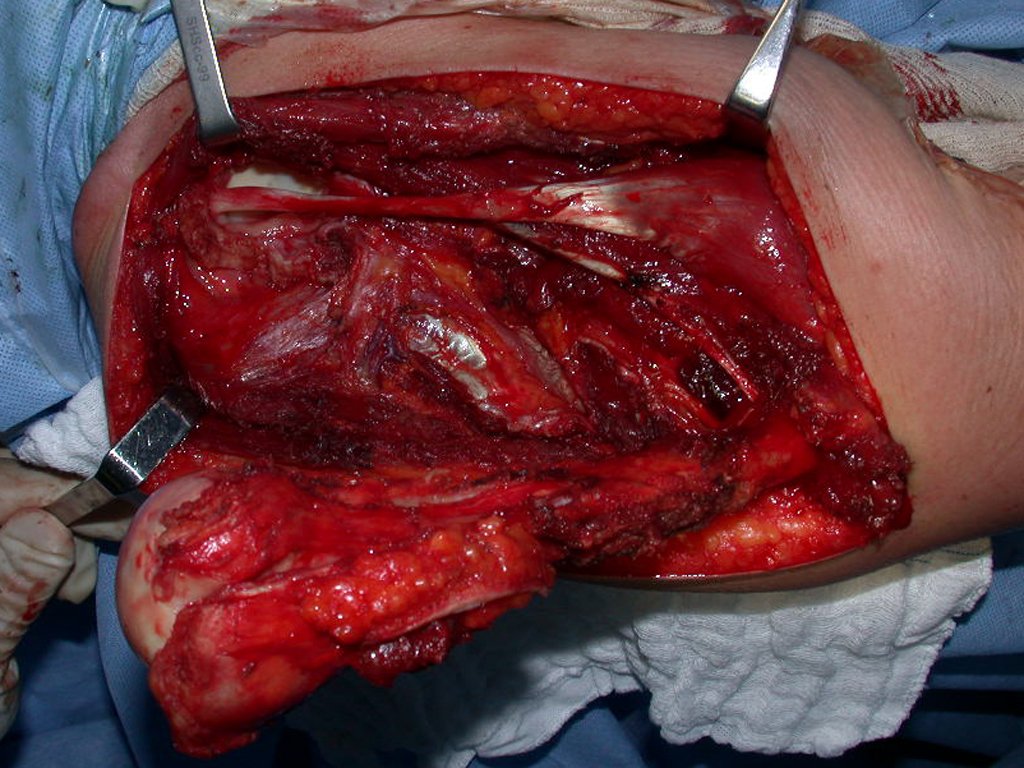
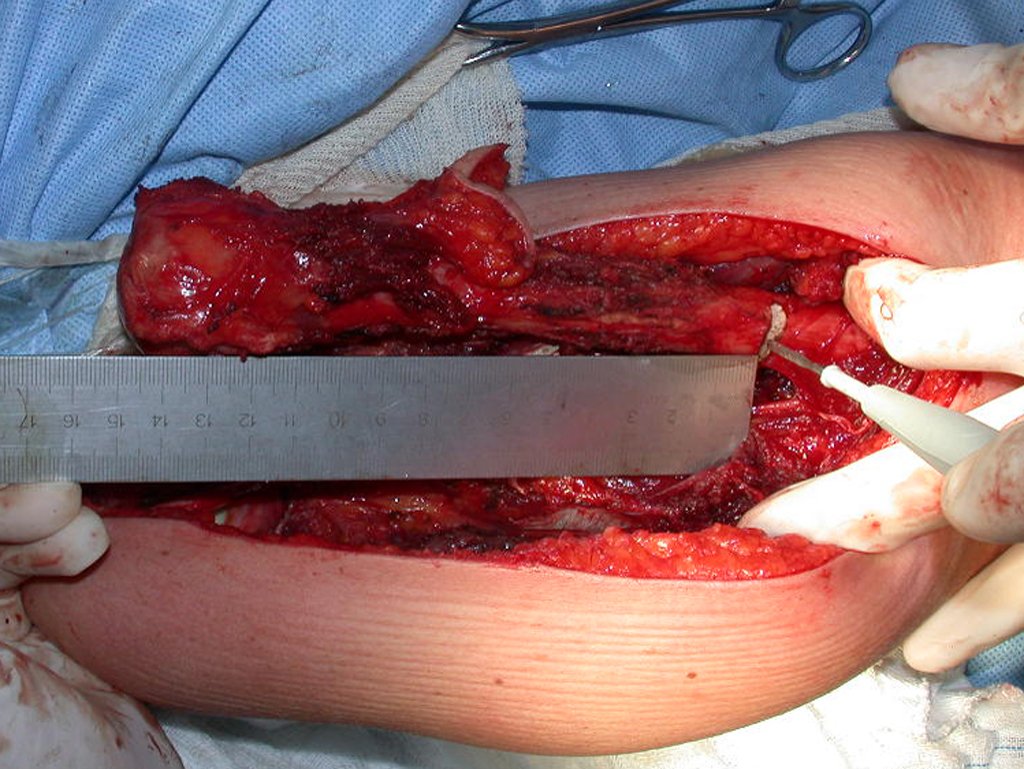
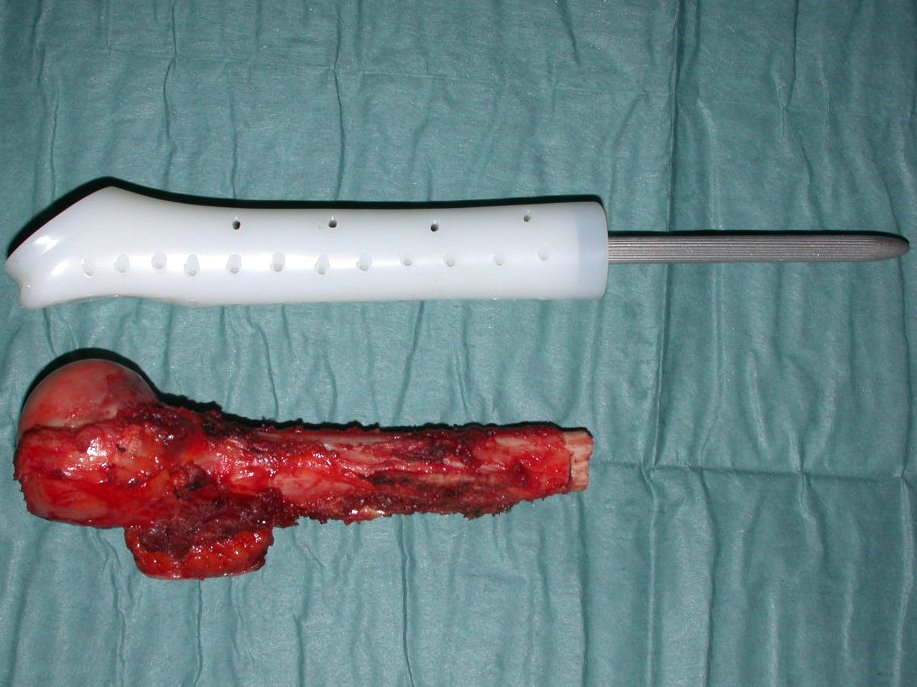
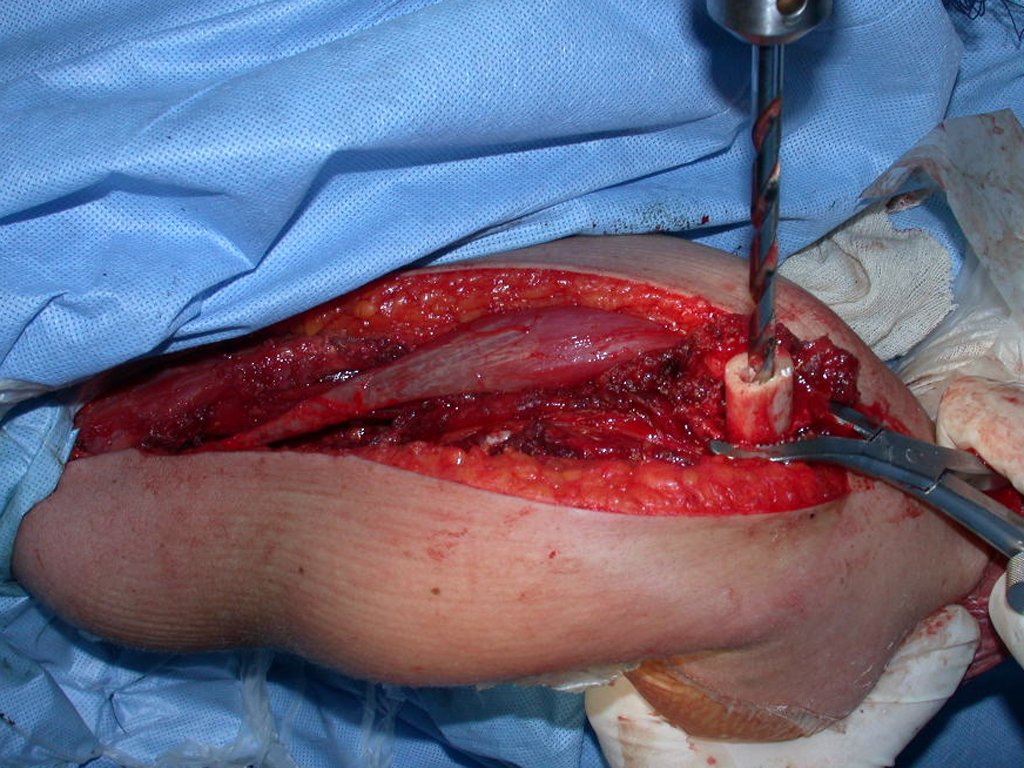
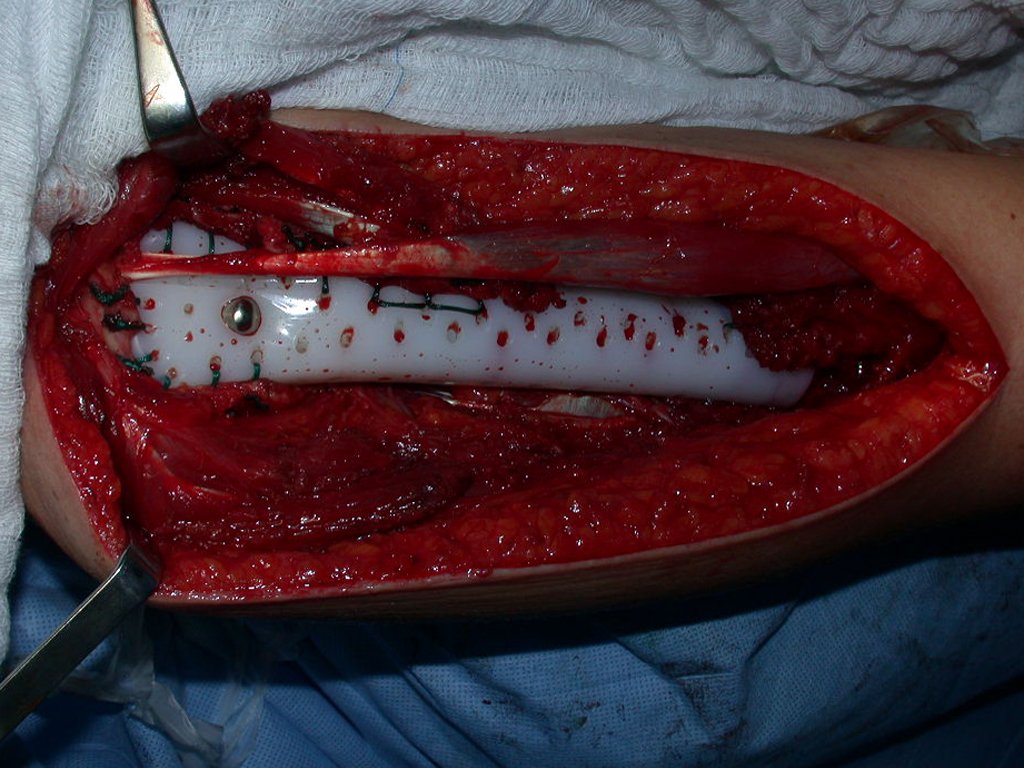
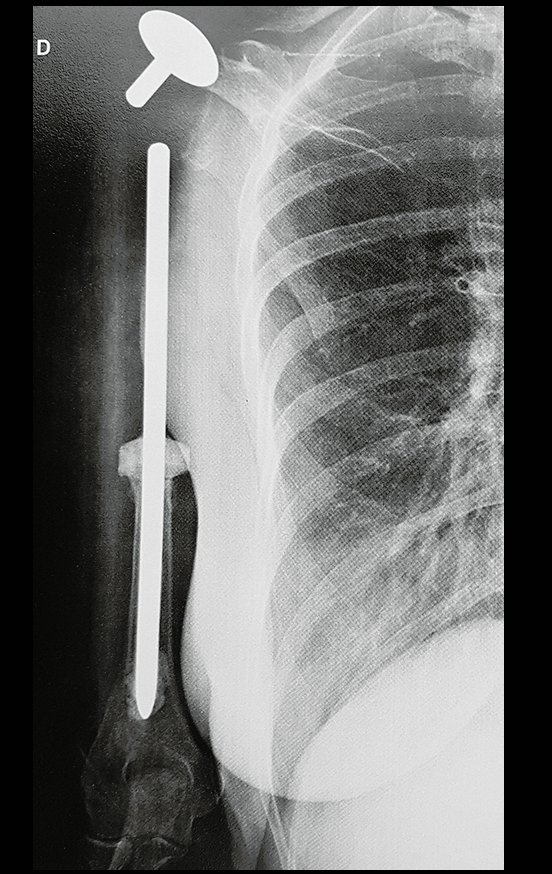
O tratamento do condrossarcoma é exclusivamente cirúrgico (25), devendo-se eleger uma ressecção ampla, incluindo o trajeto da biópsia (21, 13). A radioterapia é ineficaz (6) no controle desta neoplasia. Para os casos de grau III pode-se discutir a indicação de quimioterapia com o protocolo empregado para os sarcomas de grandes células de alto grau. No condrossarcoma mesenquimal, que apresentar predomínio de células pequenas indiferenciadas, a quimioterapia discutida recai sobre o protocolo de tratamento do sarcoma de Ewing. Em ambos os casos a resposta à quimioterapia costuma ser pobre (6). O tratamento desta neoplasia deve ser particularizado para cada subtipo clínico.
Como complicações ocorrem metástases hematogênicas para os pulmões(28), podem também apresentar disseminação linfática e recidiva local. Muitos condrossarcomas apresentam tendência de invasão local (14), atingindo tamanhos enormes, tornando-se inoperáveis e causando a morte por complicações desta propagação local.
A recidiva local aumenta a incidência de metástases pulmonares (21).
EXERCÍCIOS:
1. Quais são as características radiográficas do condrossarcoma central ?
- ossificação intra e extra medular.
- lesão diafisária com rarefação óssea e triangulo de Codman com reação lamelar grossa.
- áreas de rarefação óssea, erosão da cortical interna e focos de calcificação.
- áreas de condensação óssea com reação periosteal em casca de cebola.
Resposta: c) o tecido cartilaginoso é mais radiopaco que o osso e, portanto, apresenta-se como rarefação óssea que provoca alargamento da medular e lesões em saca bocado na cortical interna, provocando erosões. Este tecido cartilaginoso em reprodução recebe brotos vasculares e a cartilagem entra em regressão calcificando-se.
2. Quais são as características da ressonância do condrossarcoma?
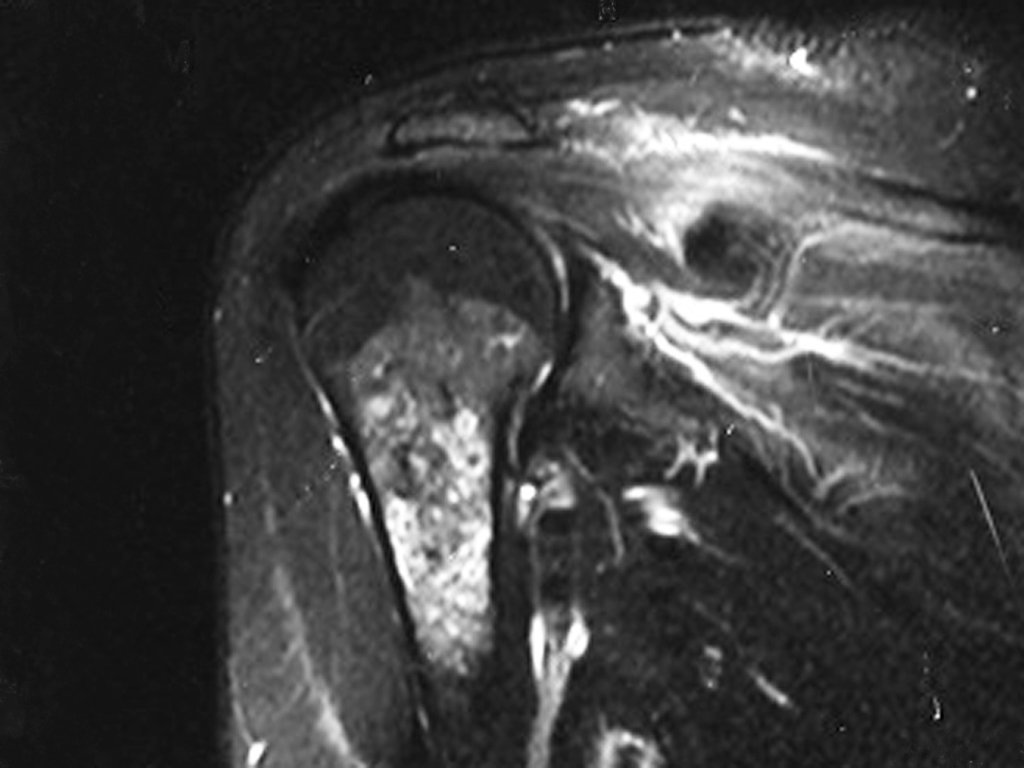
- hiper-sinal em T1, baixo sinal em T2 e com captação de contraste.
- hipo-sinal em T1, hipo-sinal em T2 e com captação ao contraste.
- hipo-sinal em T1, hiper-sinal em T2 e sem captação ao contraste.
- baixo sinal em T1, alto sinal em T2 e com captação ao contraste.
Resposta: d) o tecido cartilaginoso tem sinal baixo e intermediário em T1. Intermediário pela cartilagem e baixo pelos focos de calcificação. Apresenta captação ao contraste pelo aumento do metabolismo local, devido a neoplasia.
3. Quais são os principais diagnósticos diferenciais do condrossarcoma central ?
- Infarto ósseo e condroma.
- osteocondroma e sarcoma de Ewing
- osteomielite e T.G.C.
- osteossarcoma e condroblastoma.
Resposta: a) o infarto ósseo ocasiona lesão condensante na medular óssea, mas não causa erosão da cortical interna e não apresenta dor de caráter evolutivo. Geralmente é um achado diagnóstico numa radiografia ocasional. O mesmo ocorre com o condroma que não evolui e representa apenas restos cartilaginosos do desenvolvimento.
4. Qual é o tratamento indicado para o condrossarcoma central?
- curetagem intralesional e enxerto ósseo autólogo.
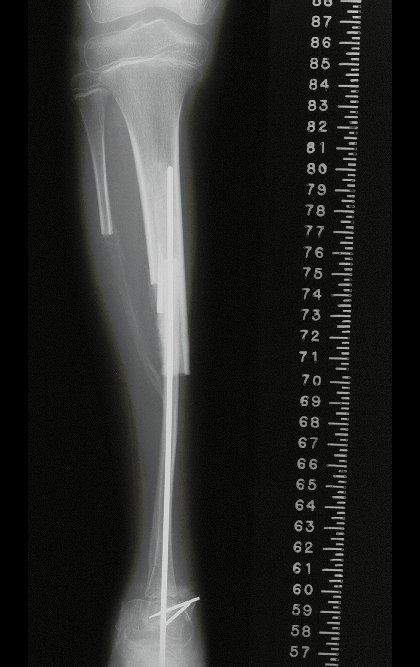
- Ressecção ampla e substituição com endoprótese não convencional.
- curetagem intralesional, adjuvante local com nitrogênio líquido e enxerto ósseo homólogo.
- curetagem intralesional, adjuvante local com eletrotermia e cimento ósseo.
Resposta: b) a cirurgia de ressecção ampla garante o tratamento oncológico e a reconstrução com endoprótese confere o melhor restabelecimento da função.
5. Histologicamente é difícil o diagnóstico diferencial entre:
- osteossarcoma e granuloma eosinófilo.
- condrossarcoma grau I e condroma.
- T.G.C e sarcoma de Ewing.
- osteoblastoma e encondroma.
Resposta: b) o condroma central dos ossos longos e o condrossarcoma grau I são muitas vezes de difícil diagnóstico histológico, necessitando-se da avaliação radiográfica para a definição e conduta.
Referências bibliográficas
- ACKERMAN, L.V.; SPJUT, H.J. Tumors of bone and cartilage. Atlas of tumor pathology. Washington, Air Force Inst. Pathology, 1962, fasc, 4.
- CANALE, S.T. Cirurgia ortopédica de Campbell. Barueri: Manole; 2006
- DAHLIN, D.C. Tumores óseos . Barcelona: Ediciones Toray S/A; 1982
- DORFMAN, H.D.; CZERNIAK, B. Bone tumors. St Louis, C.V. Mosby Co., 1997, cap. 7, p.410.
- EDEIKEN, J.; HODES, P.J. Diagnóstico radiológico de las enfermedades de los huesos. Buenos Aires, Panamericana, 1977, cap. 15.
- ETCHEBEHERE, M. Tumores cartilaginosos malignos: Condrossarcomas. In: Camargo O.P. Clínica Ortopédica. Rio de Janeiro: Med si; 2002. p. 753-759
- FELDMAN, F. Cartilaginous tumors and cartilage-forming tumor like conditions of the bonés and soft tissues. In: Diseases of the Skeleton System (Roentgen Diagnosis). Part. 6 – Bone Tumors, New York, Springer-Verlag, 1977,p.177.
- FLETCHER, C.D.M., Unni K.K., OMS – Merters F. (Eds.): World Health Organization. Classification of Tumors. Pathology and Genetics of Tumors of Soft Tissue and Bone. IARC Press: Lyon 2002.
- GREENSPAN, A. Radiologia ortopédica. Rio de Janeiro: Guanabara; 2001.
- HENDERSON, E.D.; Le PAGE, G. A. Apud FELDAMAN, F. Cartilaginius tumors and cartilage forming tumor like conditions of the bone and soft tissues. In: Disease of the Skeletal System (Roentgen Diagnosis). Part. 6 – Bone tumors, New York, Springer Verlag, 1977, p.182.
- HUVOS, A.G. Bone tumors Diagnosis, Treatment and Prognosis. Philadelphia, W. B. Saunders Co., 1979, p. 13.
- JAFFE, H.L. Tumores y estados tumorales oseos y articulares. México: La Prensa Medica Mexicana; 1966.
- JESUS-GARCIA, R. – Reynaldo Jesus-Garcia
- LICHTENSTEIN, L. Barcelona: Talleres Gráficos Ibero-Americanos; 1975.
- LICHTESTEIN, L. Bone Tumor. 4 Ed St. Louis, C.V. Mosby Co., 1972, cap. 15.
- LICHTESTEIN, L.; BERNSTEIN, D. Unusual benign and malignant chondroid tumors of bone. Cancer, 12:1142, 1959.
- MARCOVE, R.C. Condrosarcoma: Diagnóstico y tratamiento. In: Clínicas Ortopécias de Norteamérica. Tumores del aparato musculosquelético. Buenos Aires, Panamericana, 1977, cap. 7.
- MARCOVE, R.C. et al. Chondrosarcoma of the pélvis and upper end of the femur. Na analisys of factors influencing survival time in113 cases. J. Bone Joint Surg., 54A:61, 1972.
- MARCOVE, R.C.; SHOJI, H,; HARLEN, M. Altered carbohidrate metabolism in cartilaginous tumors. Contemp. Surg. 5:53, 1974.
- McFARLAND, G.B.Jr.; McKINLEY, L.M.; REED, R.J. Dedifferentiation of low grade chondrosarcomas. Clin. Orthop., 122:157, 1971.
- MENENDEZ, L.R. Orthopaedic knowledge update: Actualizaciones en cirugía ortopédica y traumatología. Barcelona: Ars Medica; 2003.
- O’NEAL, L.W.; ACKERMAN, L. V. Chondrossarcoma of boné. Cancer, 5:551, 1952.
- PRÓSPERO, J.D. Tumores Ósseos. São Paulo, Roca, 2001, cap. II.
- ROBBINS. Patologia estrutural e funcional. Rio de Janeiro: Guanabara; 1996.
- ROMSDAHL, M.; EVANS, H.L.; AYALA, A.G. Surgical treatment of chondrosarcoma. In: Managment of primary bone and soft tissue tumors. Chicago, Year book med. Publisher Inc., 1977, p. 125.
- SCHAJOWICZ, F. Tumores y Lesiones Seudotumorales de Huesos y Articulaciones. Buenos Aires: Editora Médica Panamericana; 1982.
- TORNBERG, D.N.; RICE, R.W.; JOHNSTON, A.D. The ultrastructure of chondromyxoid fibroma. Clin. Orthop. Rel. Research, 95:295, 1973