Quando mensuramos a distância entre a posição do pinode Schanz e a da osteossíntese, obtivemos uma média de2,2 cm, variação até 6 cm. Em sete casos (43,8%) dos 16 infecta-dos, a distância mensurada foi 0 cm, dois entre 1 e 2 cm, doisentre 3 e 4 cm, um entre 4 e 5 cm, três com 5 cm e um com6 cm (tabela 2). Quanto à avaliação da qualidade de fixação eredução, pudemos observar que dos 16 casos em quatro (25%)os seis avaliadores concordaram, em dois a fixação foi conside-rada adequada e nos outros dois inadequada; em cinco casos(31,3%) cinco avaliadores concordaram quanto à qualidade daavaliação, em dois foi considerada adequada e em três inade-quada; em quatro casos (25%) quatro avaliadores concordaramcom a avaliação, todas foram consideradas inadequadas; emtrês casos (18,7%) não houve concordância entre os avaliado-res, três consideraram a fixação e redução adequadas e outrostrês inadequada (tabela 3).
Nos 13 casos (81,2%) nos quais houve alguma concordância(adequada ou inadequada), ela foi considerada adequada emquatro (30,8%) e inadequada em nove (69,2%).
Ao analisar as avaliações, obtivemos 96 avaliações, em38 vezes (39,6%) foi considerada adequada e em 58 (60,4%)inadequada. Ao analisar as avaliações de cada avaliador, obti-vemos para o avaliador um: cinco casos (31,3%) avaliados comoadequada e 11 (68,7%) inadequada; avaliador dois: 10 casos
Quando avaliamos isoladamente os ortopedistas commais de cinco anos de experiência, obtivemos 32 avaliações,15 (46,9%) foram consideradas adequadas e 17 (53,1%) inade-quadas (tabela 4). Nesse grupo ocorreu concordância na qua-lidade da fixação e redução em nove casos (56,3%) e não con-cordância nos sete (43,7%) restantes, dos nove casos com con-cordância em quatro (44,4%) a qualidade da redução e fixaçãofoi considerada adequada e em cinco (55,6%) inadequada.
Quando avaliamos isoladamente os residentes do terceiroano, obtivemos 32 avaliações, 14 avaliações (43,7%) foramconsideradas adequadas e 18 (56,3%) inadequadas (tabela 4).Nesse grupo houve concordância na qualidade da redução efixação em nove casos (56,3%) e não concordância nos seterestantes (43,7%), dos nove casos com concordância em qua-tro (44,4%) a redução e fixação foi considerada adequada e emcinco (55,6%) inadequada.
Quando avaliamos isoladamente os residentes do segundoano, obtivemos 32 avaliações, nove (28,1%) foram consideradasadequadas e 23 (71,9%) inadequadas (tabela 4). Nesse grupohouve concordância na qualidade da redução e fixação em13 casos (81,3%) e não concordância nos três restantes (18,7%),dos 13 casos com concordância em três (23,1%) a redução efixação foi considerada adequada e em 10 (76,9%) inadequada.
Ao observarmos as avaliações consideradas adequadas,podemos perceber uma tendência à semelhança de avaliaçõesentre os assistentes e os residentes do terceiro ano, mas umaavaliação menor de casos considerados adequados para osresidentes do segundo ano (tabela 5).
Quando comparamos os casos nos quais houve concordân-cia dos assistentes com a avaliação dos residentes do terceiroano, observamos que houve concordância em cinco (31,3%)dos 16 casos, em três a redução e fixação foi consideradaadequada e em dois inadequada. Dos 11 casos restantes, emquatro, apesar da concordância de avaliação dos assistentes,não houve concordância com os residentes do terceiro ano, emum caso a redução e fixação foi considerada adequada pelosassistentes e em três inadequada.
Quando comparamos os casos nos quais houve concordân-cia dos assistentes com a avaliação dos residentes do segundoano, observamos que houve concordância em sete (77,8%) dosnove casos, em dois desses a redução e fixação foi conside-rada adequada e em cinco inadequada. Em um caso que houveconcordância dos assistentes (considerada adequada) os resi-dentes do segundo ano consideraram inadequada.
Ao avaliar os sete casos em que não houve concordânciaentre os assistentes com mais de cinco anos de experiência,observamos que em um caso os residentes, quer seja do ter-ceiro quer do segundo ano, também não concordaram. Emquatro casos, os dois avaliadores residentes do terceiro anotambém não concordaram e em três casos os dois avaliado-res residentes do terceiro ano concordaram e consideraram a redução e fixação inadequada. Dos sete casos que os assisten-tes não concordaram, os avaliadores residentes do segundoano consideraram a redução e fixação adequada em um casoe inadequada em quatro.
Discussão
Os fixadores externos, dispositivos de fixaça~o mais versáteisque permitem diversos tipos de montagens e configuraço~es,podem ser colocados de maneira rápida, são aplicados no tra-tamento das fraturas nas situações de urgência e emergência(controle de danos) e de forma percutânea, com um menordano aos tecidos moles.
Esse procedimento, tanto provisório quanto definitivo,ainda é rotina em muitos serviços e varia de 32 a 89% da esco-lha de um grupo de ortopedistas em um estudo prévio.9Noentanto esse procedimento não é isento de riscos.
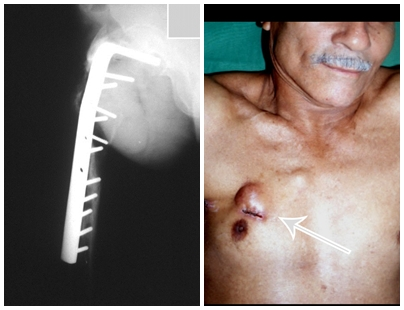
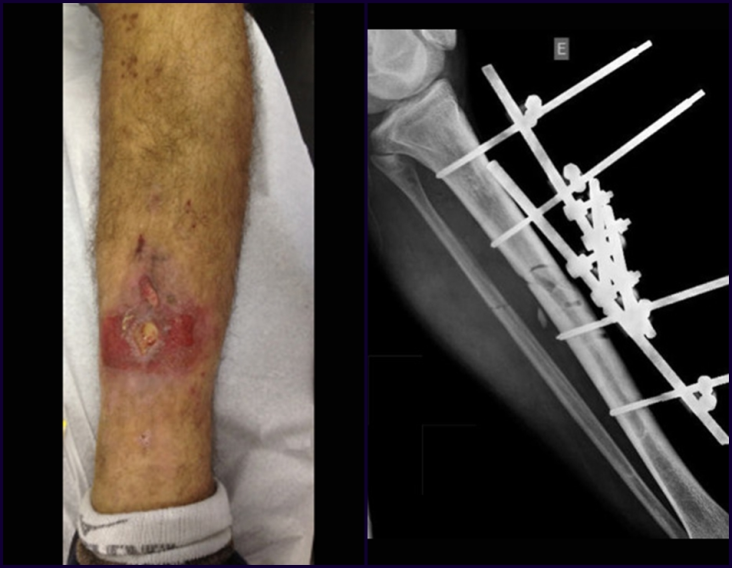
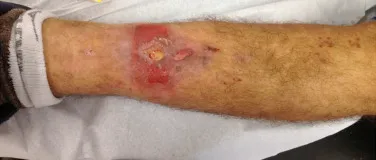
Na nossa amostra, verificamos a frequência de 13,3% deinfecção após o uso de fixador externo para controle de danos.Embora compatível com aos dados da literatura, que variamde 0,5 a 30%,2,3preocupamo-nos por julgar esse índice muitoelevado entre as complicações possíveis.
A primeira questão sempre lembrada na busca da etiolo-gia da infecção é o ambiente em que ocorre o tratamento, nonosso caso um hospital-escola. Parece uma correlação causa eefeito fraca, porque o procedimento é considerado de pequenacomplexidade e havia ao menos um médico com três anos detreinamento na equipe cirúrgica.
Outro fator que está envolvido com a complicação dainfecção após osteossíntese interna é a infecção do trajeto dospinos de Schanz. Nos nossos pacientes, a presença de suspeitaclínica de infecção foi indicação da troca do pino por instalaçãoem outra localização ou a continuidade do tratamento comosteossíntese pelo fixador externo.
A redução e fixação foram consideradas inadequadas em60% das avaliações, valor considerado muito alto, e em médiaos assistentes e residentes do terceiro ano acharam a reduçãoe fixação adequadas em apenas 50% das avaliações. Isso mos-tra que existe a necessidade de melhor ensino no tratamentodas situações de emergência com fixador externo.
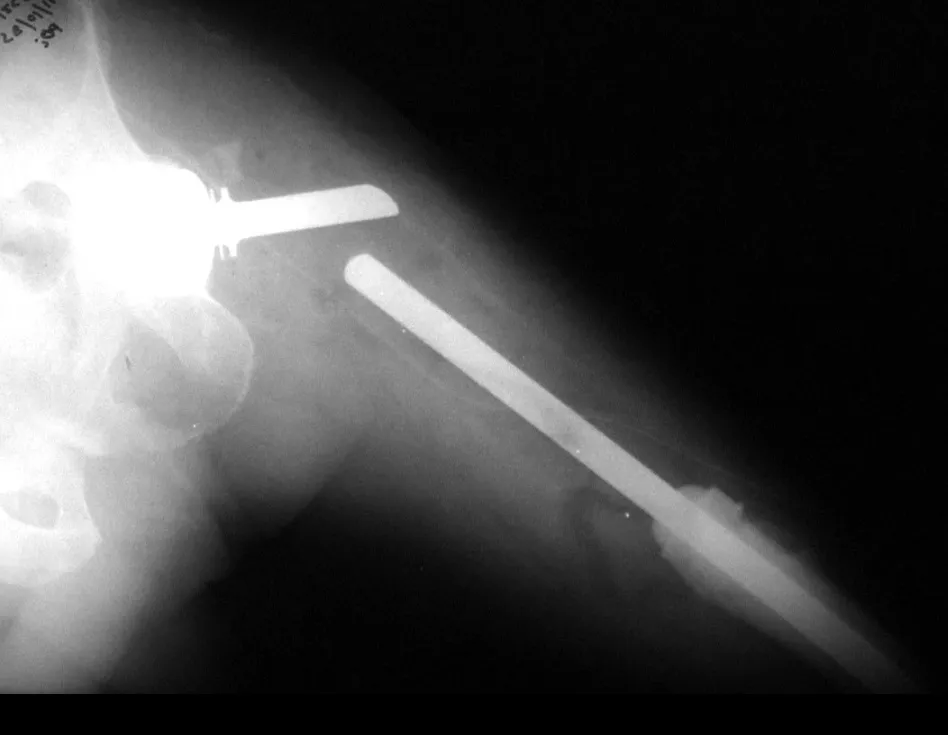
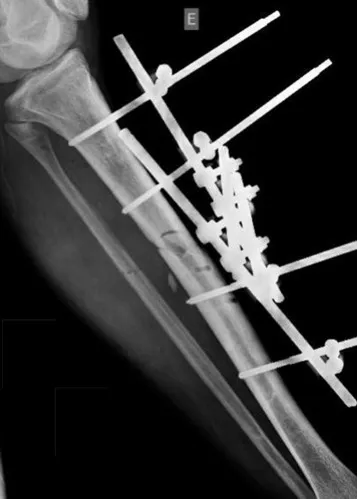
A fixação externa frequentemente é negligenciada emnosso meio tanto na sua programação pré-operatória quantono procedimento e em cuidados posteriores. Em qualquerprocedimento de fixação externa deve-se sempre conside-rar a futura síntese definitiva na montagem do fixador ecolocação dos pinos. Tal situação sempre deve ser discutidacom o médico assistente, que pode fazer uma programaçãopré-operatória tendo-se em vista a futura síntese, seja placaou haste. No nosso estudo, em 43,8% das vezes o local do pinode Schanz não tinha distância da osteossíntese definitiva.
A técnica correta de inserção do pino, os cuidados com ocurativo e com a ferida operatória são imprescindíveis para aprevenção dessas complicações.9,10Pré-perfuração, inserçãomanual dos pinos, uso do corredor de segurança são fato-res que não podem ser esquecidos durante a fixação. Asistematização desses cuidados intra e pós-operatórios é fatorque encontramos passível de controle pelo médico para influ-enciar a taxa de infecção do trajeto dos pinos de Schanz nocontrole de danos.
Rotineiramente a qualidade da redução da fratura não é tãoimportante para se considerar infecção pós-operatória, umavez que o uso do fixador externo é temporário.8No entanto,em algumas situações nas quais o fixador permanece porum tempo prolongado esse fator deve ser levado em conta.Na nossa casuística, o maior período para conversão foi de30 dias e a redução temporária é importante para estabilizaçãodo quadro, os cuidados locais e a condição geral.
Em nossos casos, observamos que todos apresentavam ocorredor de segurança respeitado na análise das radiografias(em nossa casuística não foram observadas lesões neurovas-culares).
Quando fomos identificar a importância da qualidade dainstalação e da montagem espacial dos fixadores externos,pedimos a médicos com diferentes tempos de treinamentoque julgassem a qualidade da montagem e buscassem indíciosde inadequação técnica nas radiografias dos arquivos, o queocorreu em 60% das vezes no nosso estudo, valor consideradomuito alto.
Quanto à frequência da infecção óssea pós-controle dedano, comprovamos que dos 13% infectados em 50% identi-ficamos a presença de erro ou inadequação técnica que podehaver contribuído para o desfecho indesejável./p>
Ao considerarmos as montagens de fixadores externos, nãopodemos correlacionar a frequência de infecção com determi-nado tipo de montagem. Existiu a prevalência de montagensdo tipo transarticular, empregadas nas fraturas metaepifisá-rias, nas fraturas de ossos ipsilateral e nas lesões extensasde partes moles para evitar as deformidades articulares pós–traumáticas (62,5% dos casos).
Embora não tenha sido possível correlacionar a infecçãopós-osteossíntese interna e o uso de fixadores no controle dedanos, a presença de inadequação nas montagens na urgênciasugere a possibilidade e necessidade de treinamento e regraspara seu uso e montagem.
Conclusão
Ocorreu infecção óssea em 13,3% dos casos tratados com con-trole de danos musculoesquelético após osteossíntese interna.Nesses casos, a redução e fixação foi considerada adequada em 39,6% das avaliações e inadequada em 60,4%. Salientamosque esse procedimento não é isento de riscos e treinamentopara médicos que o fazem deve ser obrigatório.
Conflitos de interesse
Os autores declaram não haver conflitos de interesse.
Conflitos de interesse
Os autores declaram não haver conflitos de interesse.
1. Scalea TM, Boswell SA, Scott JD, Mitchell KA, Kramer ME,Pollak AN. External fixation as a bridge to intramedullarynailing for patients with multiple injuries and with femurfractures: damage control orthopedics. J Trauma.2000;48(4):613-21.2. Parameswaran AD, Roberts CS, Seligson D, Voor M. Pin tractinfection with contemporary external fixation: how much of aproblem? J Orthop Trauma. 2003;17(7):503-7.3. Mahan J, Seligson D, Henry SL, Hynes P, Dobbins J. Factors inpin tract infections. Orthopedics. 1991;14(3):305-8.4. Harwood PJ, Giannoudis PV, Probst C, Krettek C, Pape HC. Therisk of local infective complications after damage controlprocedures for femoral shaft fracture. J Orthop Trauma.2006;20(3):181-9.5. Green SA, Ripley MJ. Chronic osteomyelitis in pin tracks. JBone Joint Surg Am. 1984;66(7):1092-8.6. Clasper JC, Cannon LB, Stapley SA, Taylor VM, Watkins PE.Fluid accumulation and the rapid spread of bacteria in thepathogenesis of external fixator pin track infection. Injury.2001;32(5):377-81.7. Moroni A, Vannini F, Mosca M, Giannini S. State of the artreview: techniques to avoid pin loosening and infection inexternal fixation. J Orthop Trauma. 2002;16(3):189-95.8. Cardozo RT, Silva LG, Bragante LA, Rocha MA. Tratamento dasfraturas diafisárias da tíbia com fixador externo comparadocom a haste intramedular bloqueada. Rev Bras Ortop.2013;48(2):137-44.9. Balbachevsky D, Belloti JC, Martins CVE, Fernandes HJA,Faloppa F, Reis FB. Como são tratadas as fraturas expostas datíbia no Brasil? Estudo transversal. Acta Ortop Bras.2005;13(5):229-32.10. Petinne KA, Chao EY, Kelly PJ. Analysis of the external fixatorpin-bone interface. Clin Orthop Relat Res. 1993;293:18-27.
Clique aqui para baixar o PDF