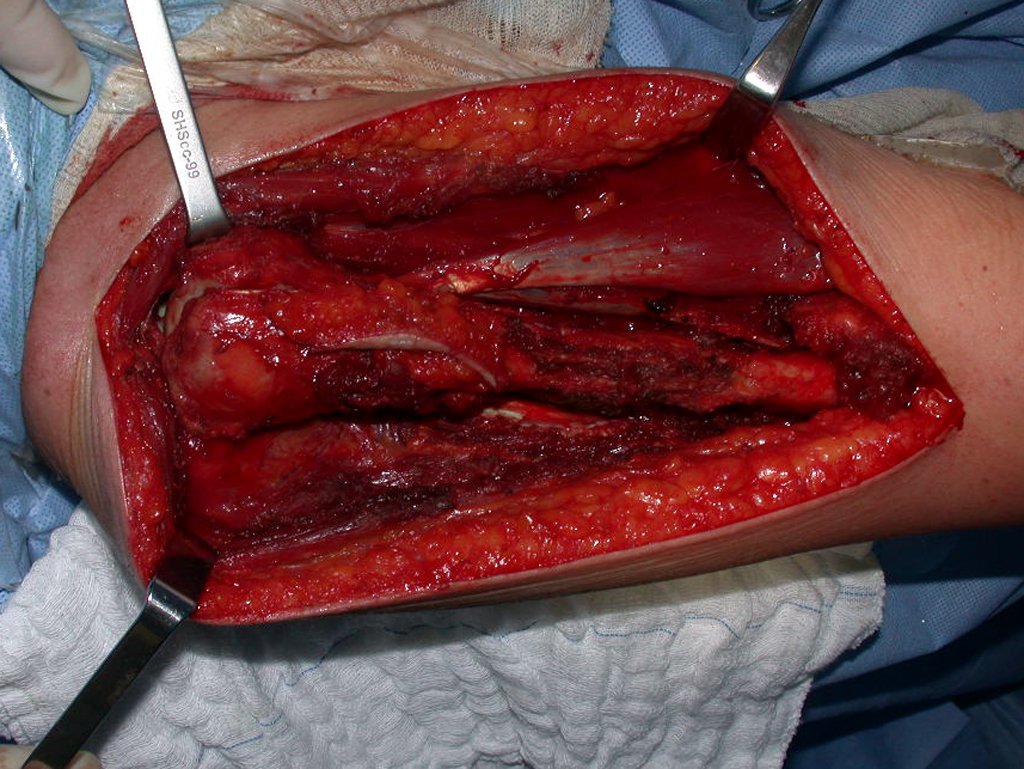
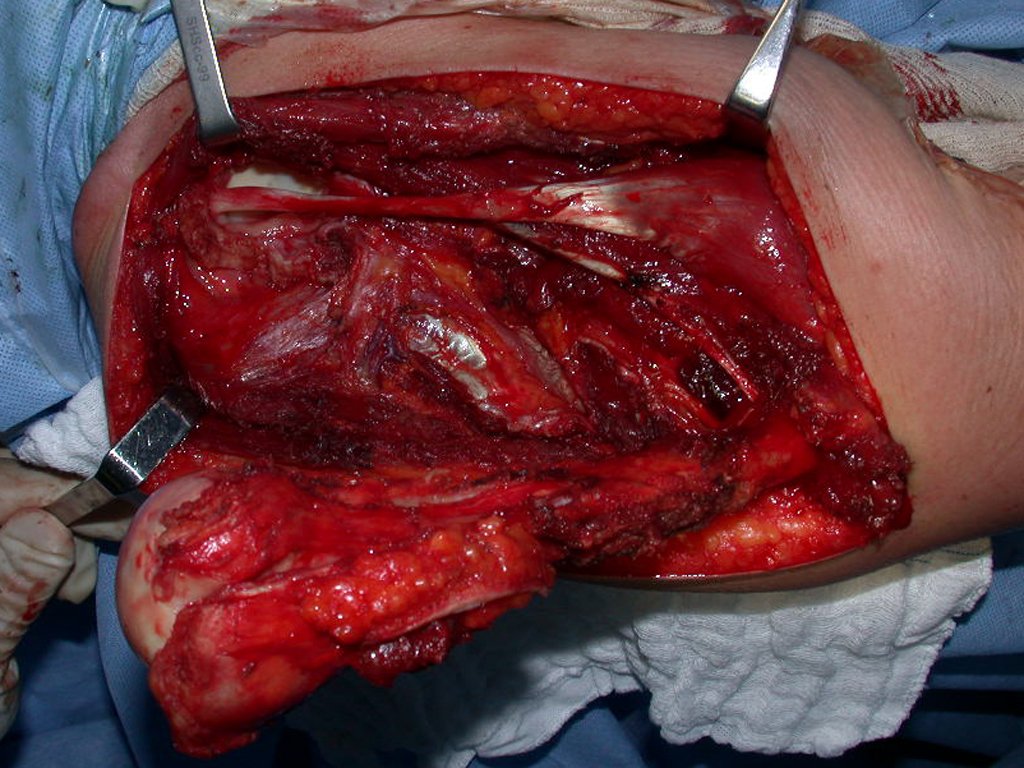
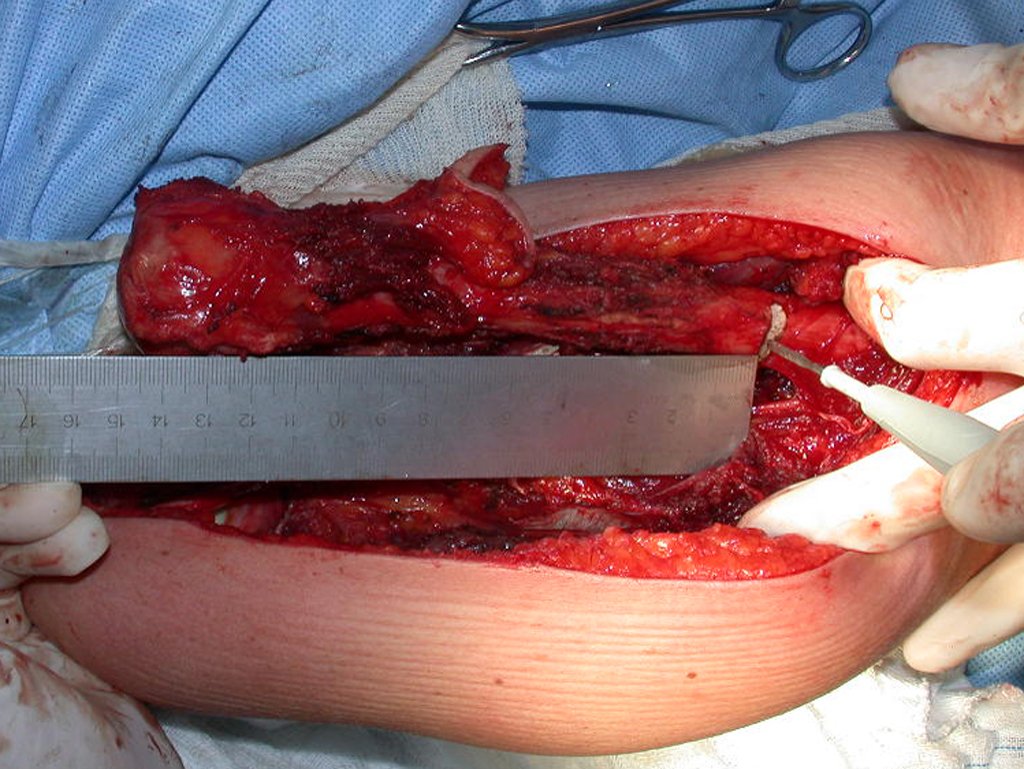
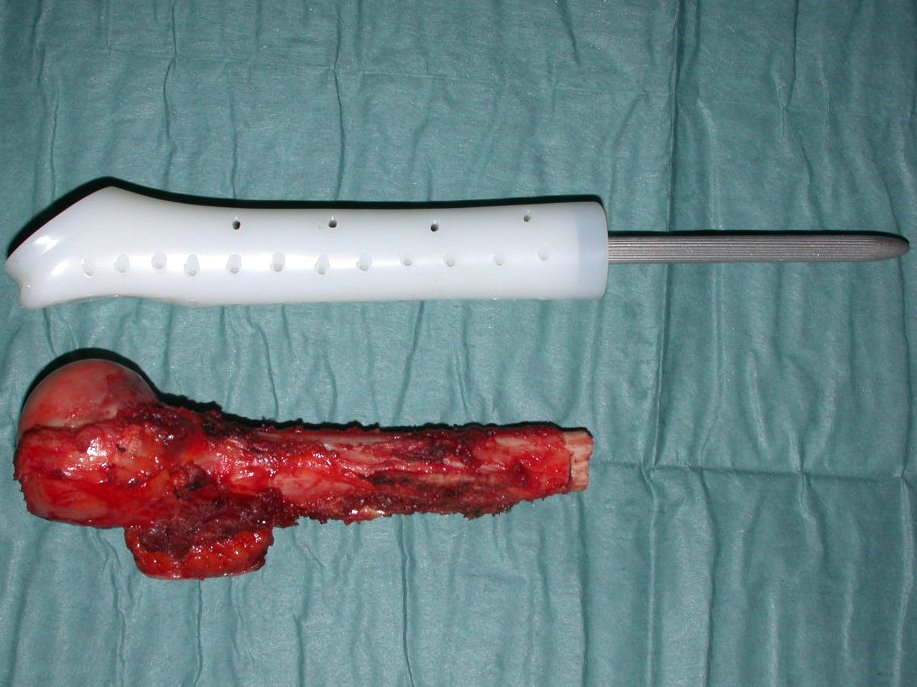
Granuloma Eosinófilo
Granuloma Eosinófilo: Histórico: Em 1938, Schairer diagnostica lesão no crânio de uma criança como mieloma eosionfílico ou osteomielite eosinofílica1. Esta afecção foi posteriormente descrita como uma nova entidade clínica por Otani e Ehrlich em 1940 sob o nome de Granuloma Solitário do Osso2.
Farber e Green, em 1942, demonstraram que a lesão poderia ocorrer de maneira localizada ou múltipla no esqueleto e possivelmente ter relação com a doença de Hand-Schuller-Christian e a doença de Letter-Siwe3.
Em 1944, Jaffe e Lichtenstein introduziram o termo granuloma eosinófilo do osso4. A relação desta lesão com as formas sistêmicas da doença foi confirmada por Lichtenstein em sua publicação de 1953, englobando-as sob o nome de Histiocitose X5.
Atualmente esta entidade é denominada Histiocitose de Células de Langerhans que apresenta quatro formas clínicas distintas: Granuloma Eosinófilo, forma restrita ao esqueleto, podendo ser localizada ou múltipla; Hand-Schuller-Christian, forma crônica e disseminada; Letter-Siwe, forma aguda ou subaguda disseminada e Hashimoto-Pritzker, forma pós natal de resolução espontânea6.
Introdução: O granuloma eosinófilo solitário do osso é a mais frequente das quatro formas de apresentação da Histiocitose de Células de Langerhans, chegando a representar entre 60% a 80% dos casos7.
Dentre as lesões ósseas benignas, é uma entidade rara, correspondendo a menos de 1%8. Acomete preferencialmente crianças e adolescentes com predominância do sexo masculino 2:19. Cerca de 80% dos pacientes estão abaixo dos 21 anos de idade e destes a maioria entre os cinco e 15 anos6,7,9.
Alguns pacientes podem iniciar o quadro com uma lesão óssea isolada e posteriormente surgirem lesões ósseas múltiplas. Estes casos podem eventualmente evoluir para as formas sistêmicas da doença. Quando isto ocorre, geralmente acontece dentro dos primeiros seis meses do diagnóstico e praticamente nunca após um ano de evolução, sendo este um critério de bom prognóstico, quando não surgem novas lesões depois desse período de acompanhamento clínico10.
A Síndrome de Hand-Schuller-Christian é a forma crônica da Histiocitose de células de Langerhans, caracterizada por acometimento sistêmico com lesões ósseas múltiplas, principalmente na calota craniana, exoftalmia e diabetes insípidos, acometendo crianças acima de 3 anos de idade10.
A Síndrome de Letter-Siwe afeta crianças abaixo de três anos de idade, é a forma aguda ou subaguda, também de acometimento sistêmico. Apresenta quadro de febre, otite média, infecções bacterianas de repetição, anemia, hemorragias, viceromegalias, adenopatia difusa e dolorosa com acometimento cutâneo semelhante a eczema seborreico e lesões ostelíticas generalizadas, com frequente evolução ao óbito10.
A Síndrome de Hashimoto-Pritzker é a forma da Histiocitose de células de Langerhans que apresenta comprometimento exclusivo da pele. Acomete crianças no primeiro mês de vida manifestando-se com erupções eczematosas de resolução espontânea6.
Etiologia: Desconhecida.
Genética: Nenhum relato significativo à respeito.
Definição: O Granuloma Eosinófilo é uma lesão pseudotumoral, de etiologia desconhecida, caracterizada por rarefação óssea que pode ser solitária ou múltipla. Microscopicamente apresenta profileração de células histiocitárias mononucleares, apresentadoras de antígenos de origem dendrítica, conhecidas como células de Langerhans, em meio à variável quantidade de leucócitos, eosinófilos, linfócitos e células gigantes.
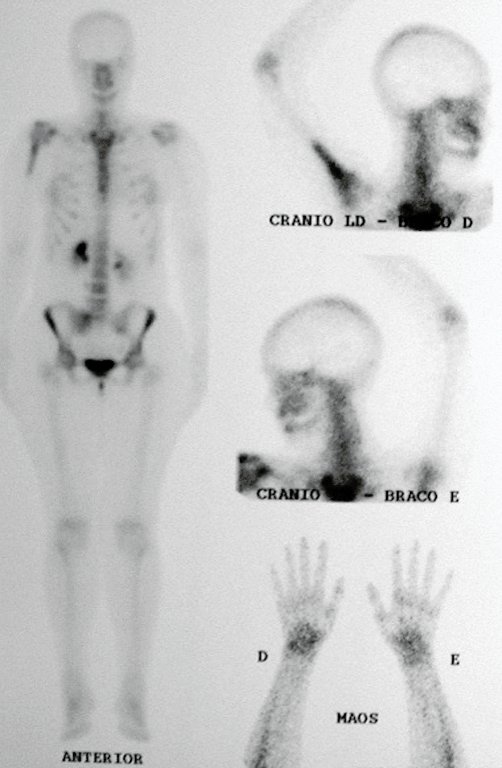
Epidemiologia: O Granuloma Eosinófilo acomete principalmente o esqueleto axial, nesta ordem: crânio, pelve, vertebras, costelas, mandíbula, clavícula e escápula.
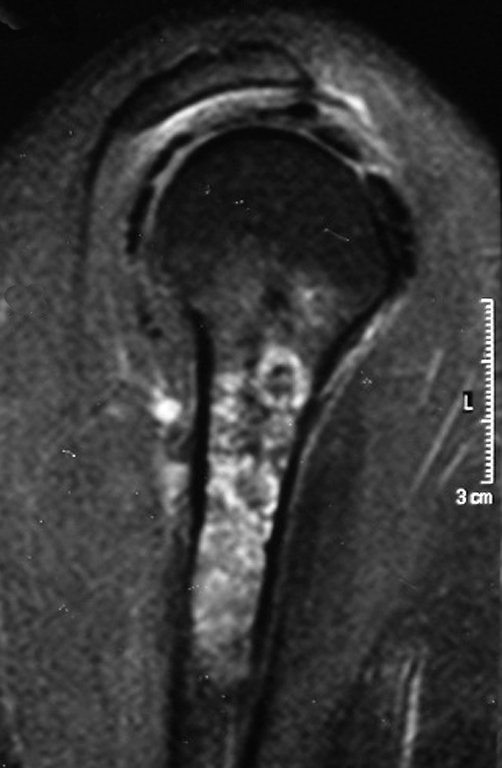
No esqueleto apendicular o fêmur, região proximal e diáfise, úmero e tíbia9. A maioria das vezes acomete a diáfise ou a região metadiafisária, sendo raro na epífise7.
A coluna representa 10% dos casos na população pediátrica, a maioria na região lombar.
Nos adultos ocorre em maior frequência nas costelas e menor na coluna, respectivamente 25% e 3%6.
Quadro clínico: O sintoma mais frequênte do Granuloma Eosinófilo é a dor localizada, latejante, de curta duração, com piora noturna associada a calor local e edema. Quando acomete o crânio, esta dor confunde-se com outras causas de cefaléia.
O comprometimento de corpos vertebrais pode produzir escoliose dolorosa. Os eventuais desvios angulares são pequenos, menores do que 100, pois o achatamento vertebral costuma ser uniforme e raramente produz sintomas neurológicos.
Nas outras formas da Histiocitose de Células de Langerhans, sintomas sistêmicos podem estar presentes como febre, rush cutâneo e diabetes insípidos. A hepatoesplenomegalia pode ocorrer na síndrome de Letter-Siwe que é a forma mais grave da doença6
Classificação: O Granuloma eosinófilo pode manifestar-se sob duas formas clínicas: Solitário ou Múltiplo.
Exames laboratoriais: As alterações laboratoriais que podem ser encontradas são aumento do VHS e PCR, podendo eventualmente ocorrer discreta eosinofilia no hemograma.
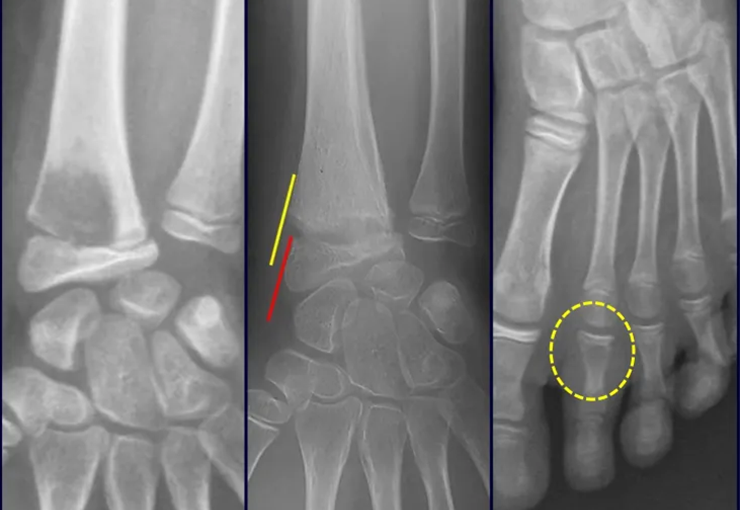
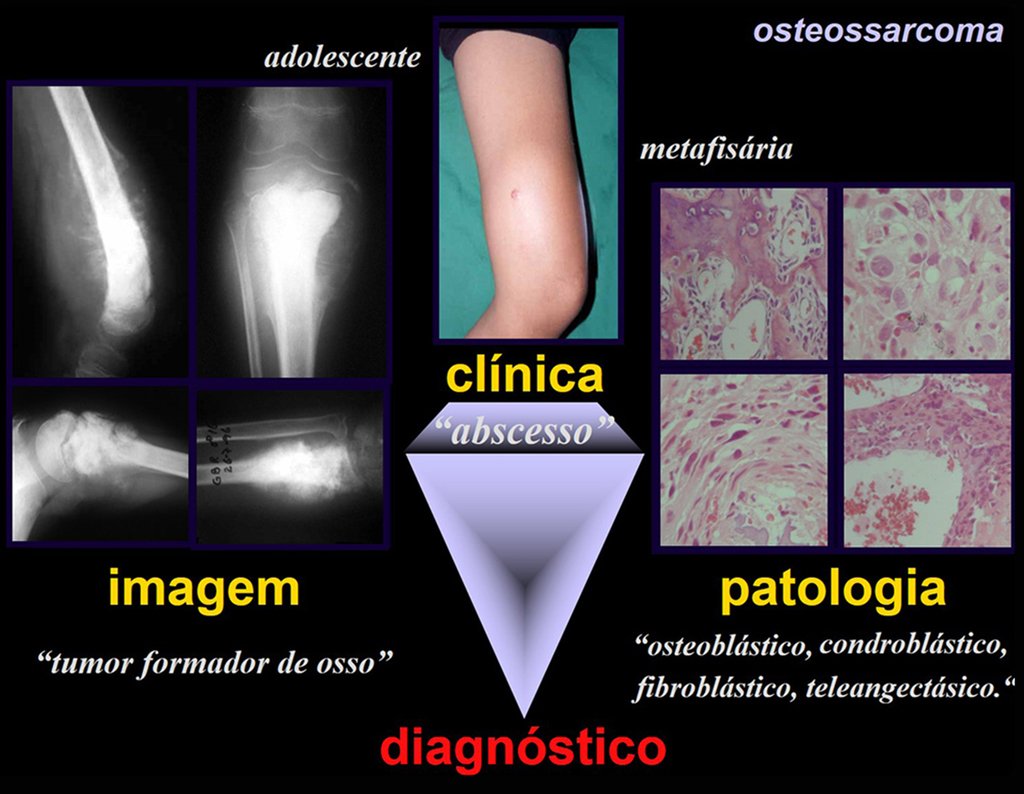
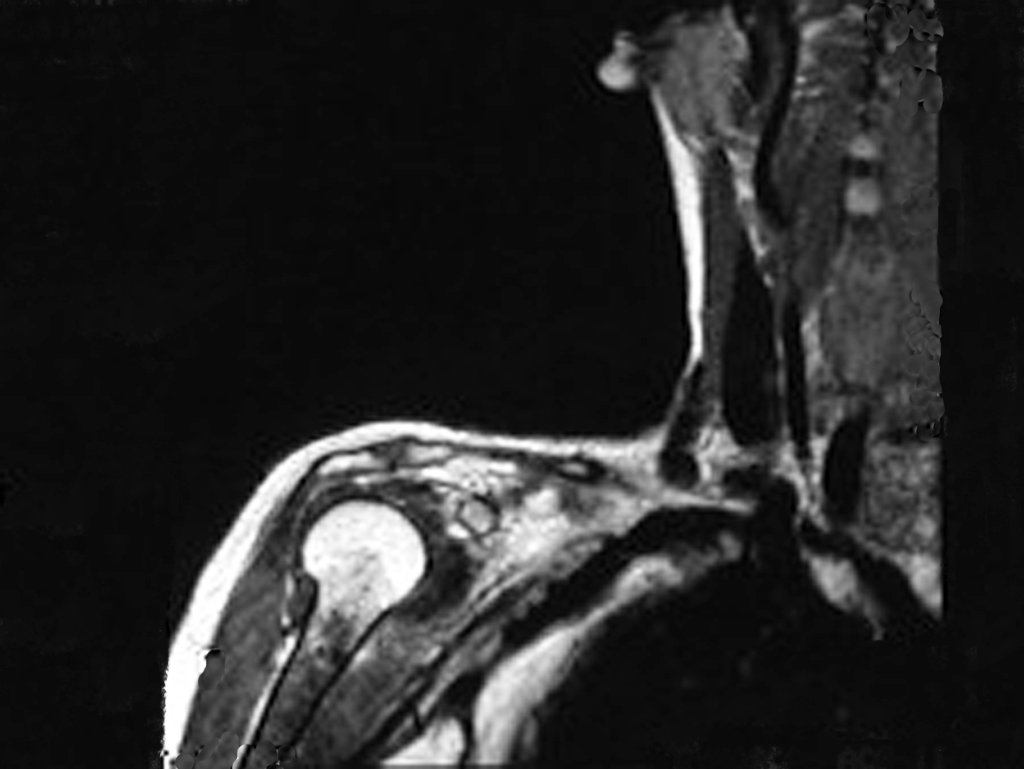
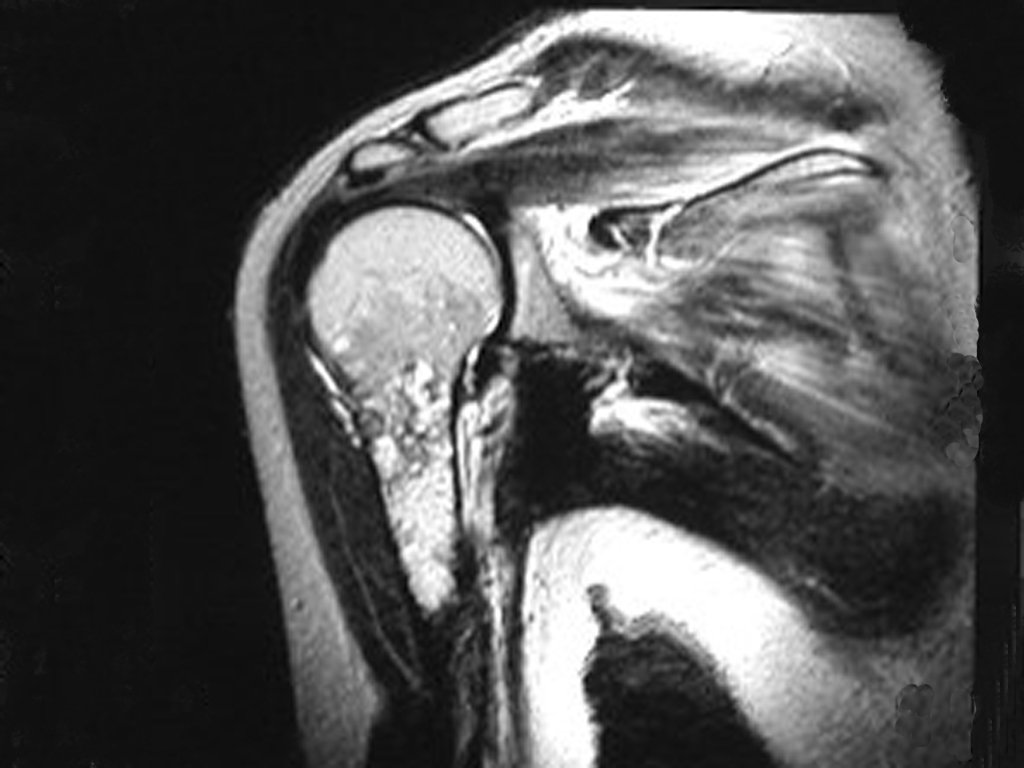
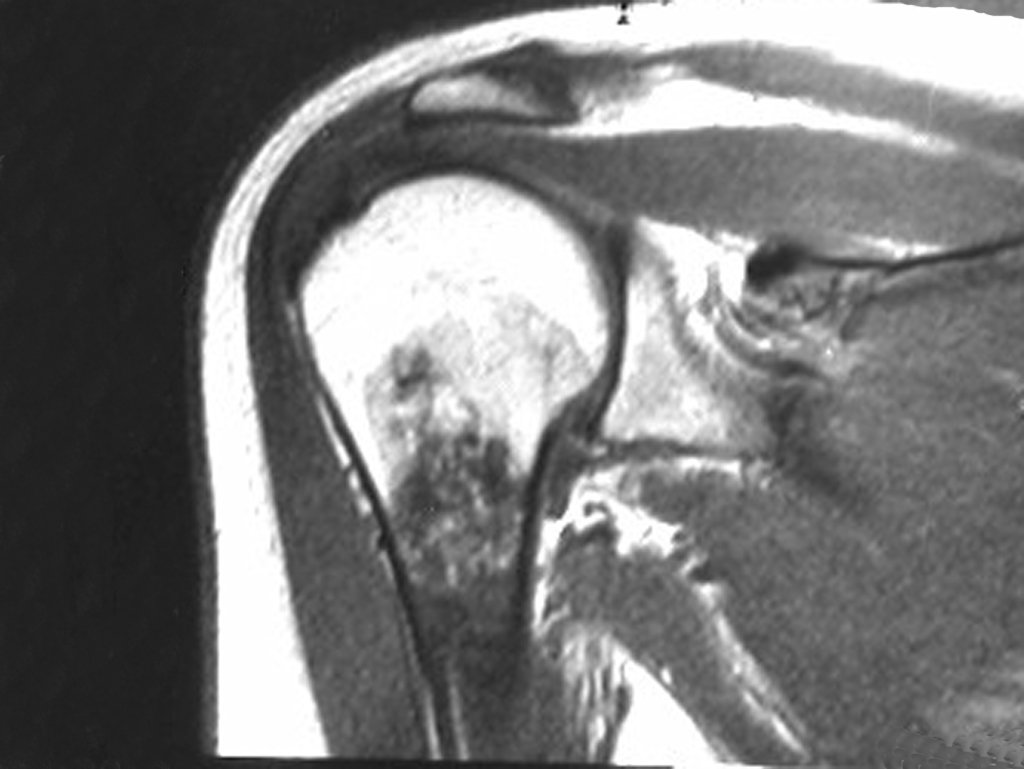
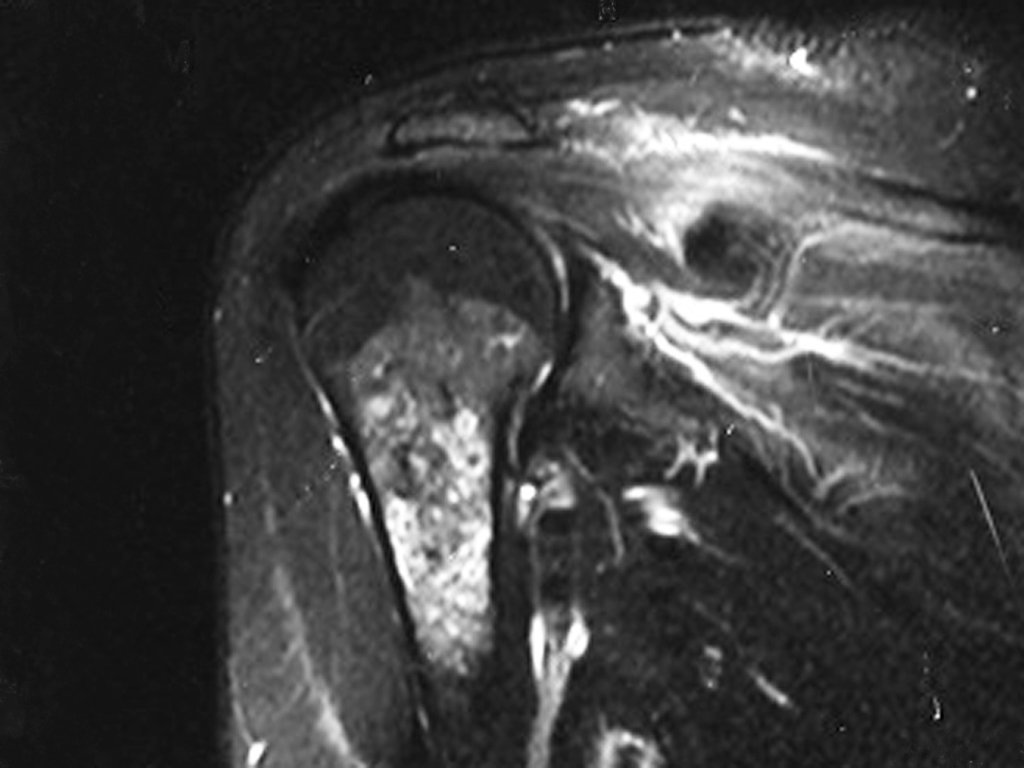
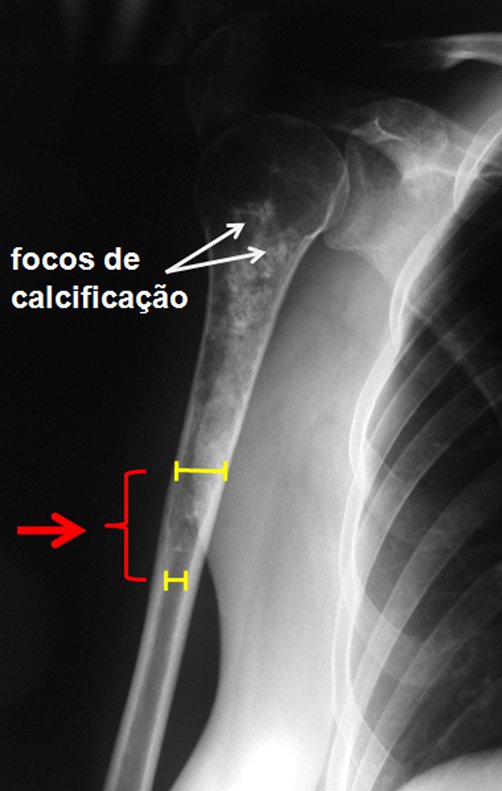
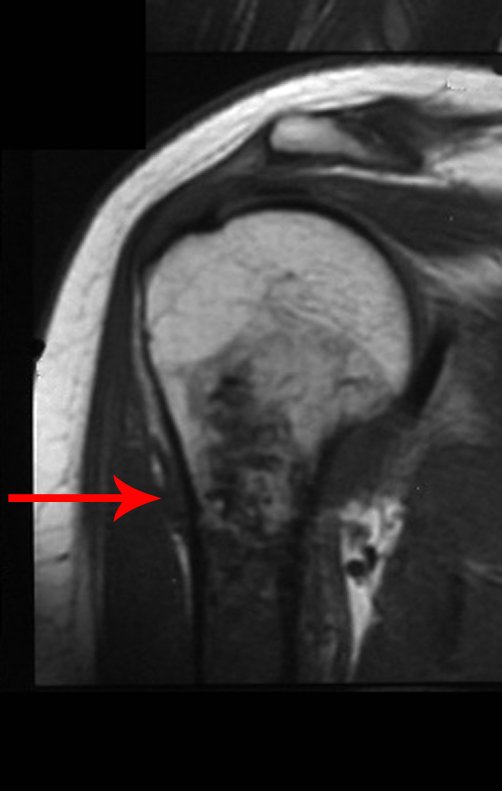
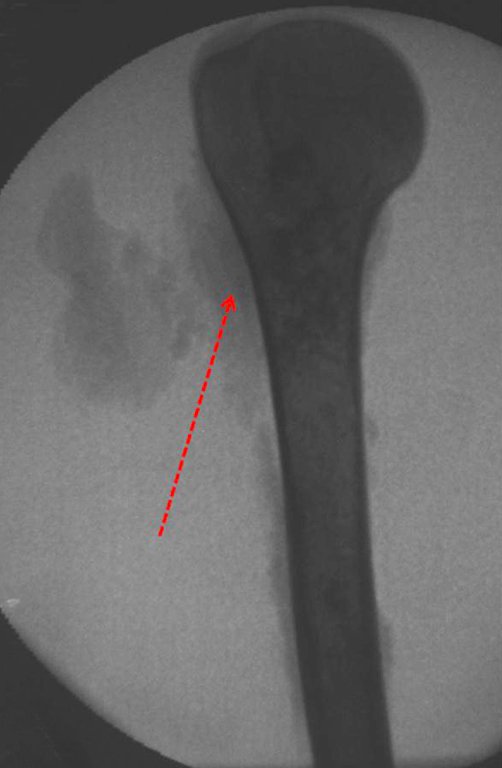
Exames de imagem: A imagem radiográfica é de rarefação óssea, arredondada ou ovalada, que se inicia na medular e progride com erosão da cortical óssea.
Na fase inicial as bordas são irregulares e mal delimitadas.
Na fase tardia pode ocorrer discreta esclerose ao redor da lesão. Nos ossos longos há reação periosteal evidente que se apresenta como múltiplas camadas lamelares grossas, que caracteriza as lesões benignas de evolução lenta ou a reação da osteomielite.
Este tipo de reação periosteal sólida diferencia o Granuloma Eosinófilo do Sarcoma de Ewing, onde a reação periosteal é lamelar fina, devido à rápida evolução do tumor maligno.
Outra diferença radiográfica entre essas duas lesões é que o tumor de Ewing precocemente apresenta tecido tumoral extra-cortical, de grande volume, o que não ocorre no Granuloma Eosinófilo.
Nos ossos chatos, como crânio ou pelve, a erosão acomete ambas as corticais de maneira irregular e assimétrica produzindo a impressão visual de um orifício dentro de outro orifício, denominada lesão em duplo contorno.
Na mandíbula, a destruição do osso alveolar produz a impressão radiográfica de dentes flutuantes.
Na coluna, a doença acomete o corpo vertebral, sendo que em 15% dos casos ocorre o seu achatamento, produzindo a chamada vértebra plana de Calvè6. Os elementos posteriores e os discos intervertebrais são preservados, mesmo quando a lesão ocorre em mais de uma vértebra.
Anatomia patológica:
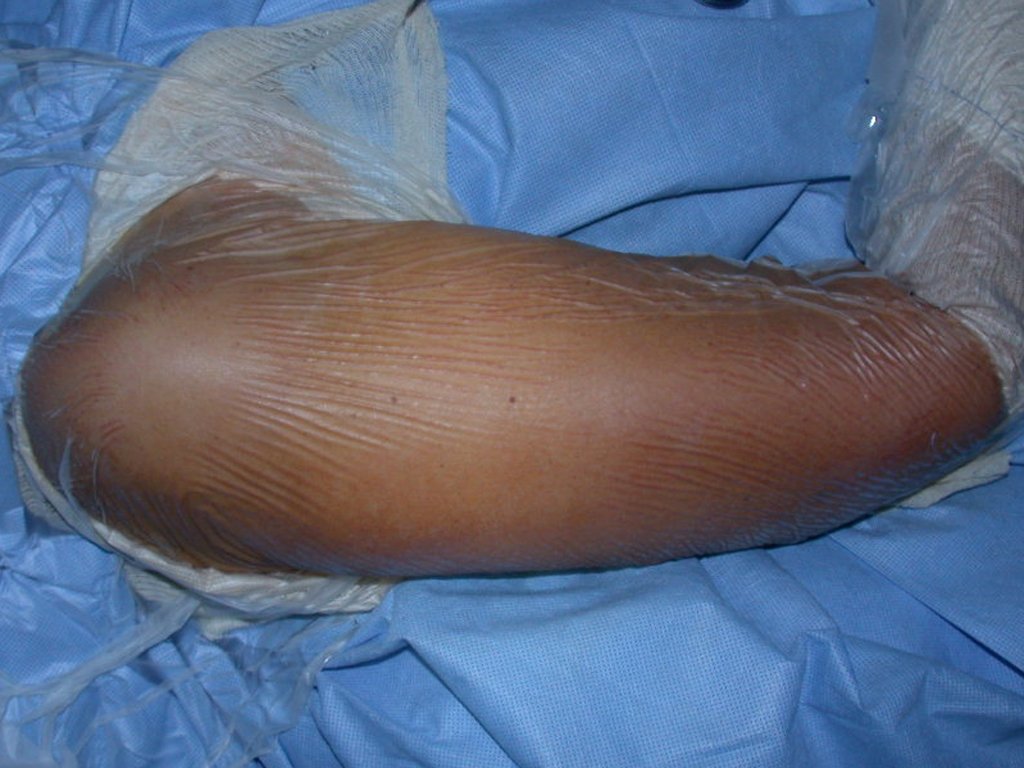
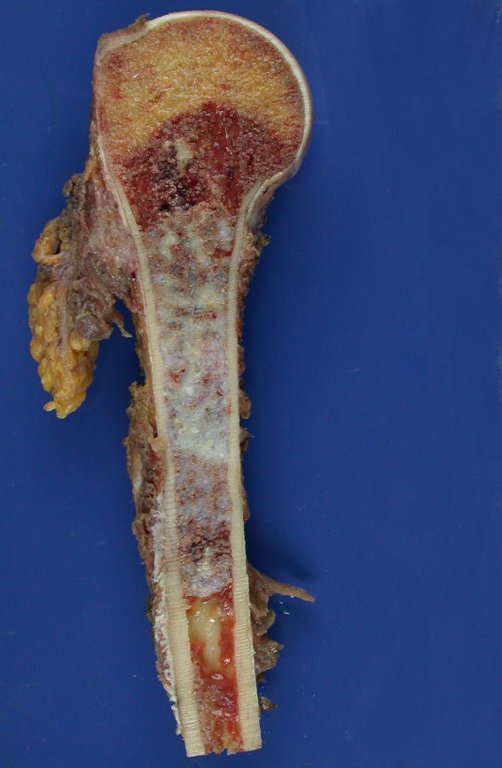
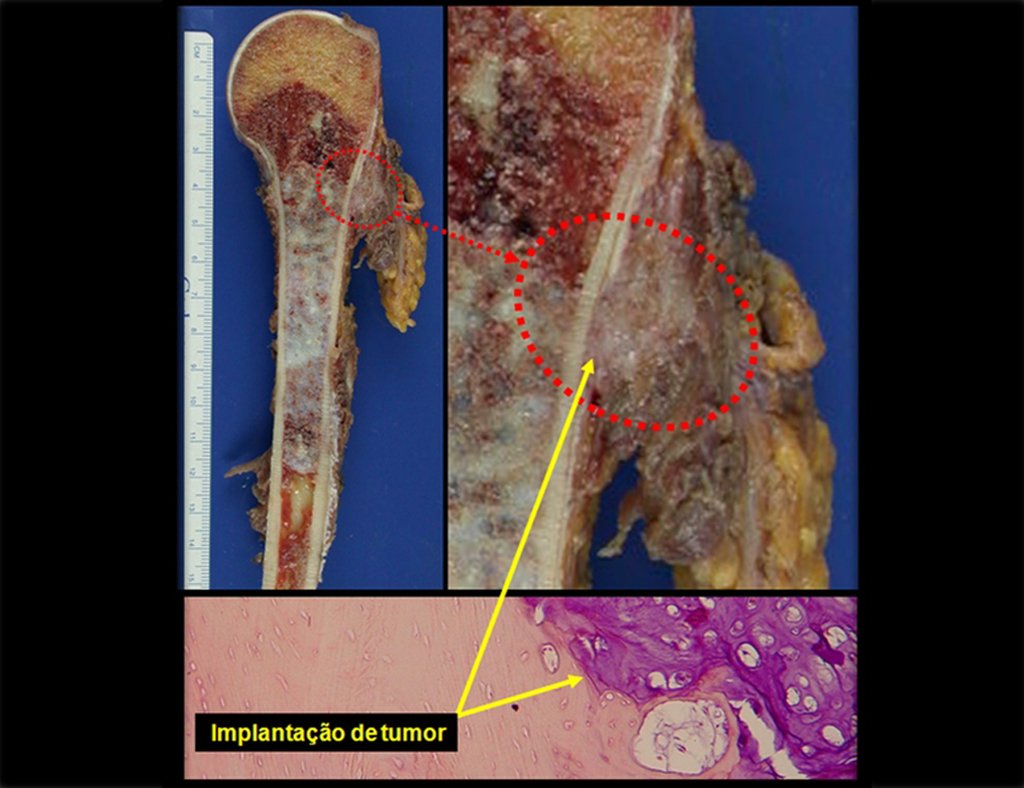
Aspecto Macroscópico: apresenta consistência mole, gelatinosa, de coloração amarelada, liquefação necrótica é frequente.
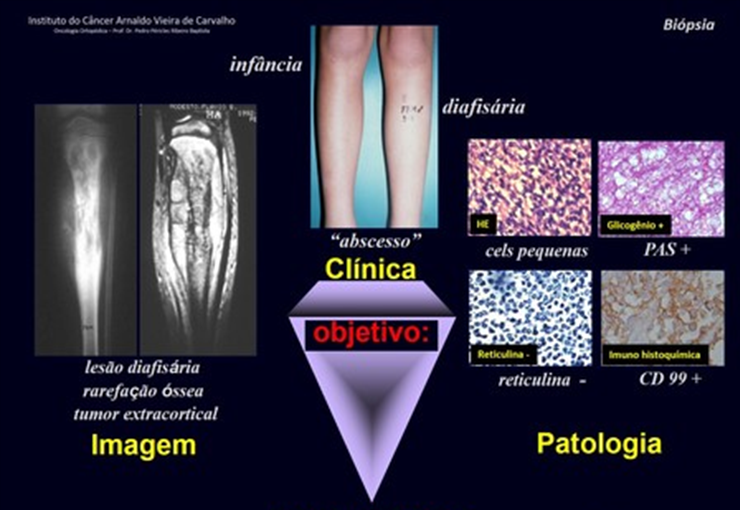
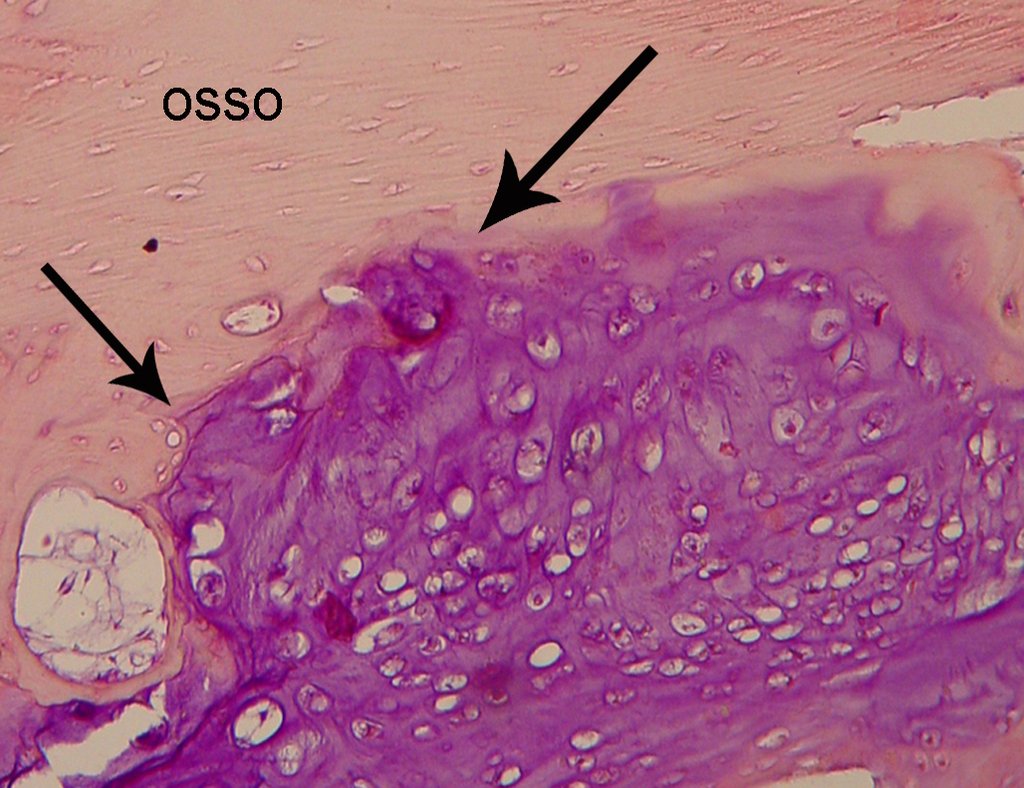
Aspecto microscópico: Apresentam-se como aglomerados de células histiocitárias grandes, com citoplasma levemente basófilo, nucléolos globosos, lobulados ou identados, nestes casos semelhantes a um grão de feijão, que correspondem às células de Langerhans.
Estes aglomerados estão entremeados por células gigantes, linfócitos, numerosos eosinófilos e áreas de necrose, simulando um abscesso. Na microscopia eletrônica apresenta grânulos citoplasmáticos típicos chamados Corpúsculos de Birbeck11,12.
Na imunohistoquímica apresenta positividade para proteína S-100, vimentina e CD1a11,13.
Diagnóstico:
Diagnóstico diferencial: Os principais diagnósticos diferenciais radiológicos do Granuloma Eosinófilo são a Osteomielite e o Tumor de Ewing.
Quando a lesão ocorre no crânio deve-se diferenciar de cisto epidermóide ou metástase. Os principais diagnósticos diferencias histológicos são a Osteomielite e o Linfoma.
Estadiamento:
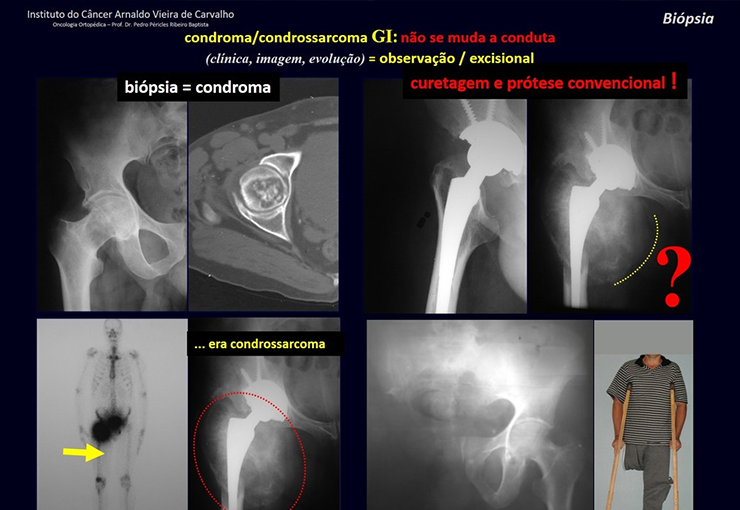
Tratamento: A literatura apresenta relatos que o tratamento expectante ou apenas a biópsia podem ser indicados como estratégia terapêutica eficaz nas lesões isoladas do esqueleto7,14.
O Granuloma Eosionófilo pode ter resolução espontânea, principalmente em crianças. A capacidade de o osso afetado refazer-se existe, pois a maioria dos pacientes é acometida antes da maturidade esquelética, portanto com grande potencial de remodelação pelas fises de crescimento, que normalmente não são acometidas15,16.
Em nossa experiência houve resolução em cinco casos, que regrediram apenas com a biópsia percutânea. O mesmo acontece após o colapso vertebral nas lesões da coluna, provavelmente pelo extravasamento do conteúdo da lesão, assemelhando-se a drenagem de um abscesso, sendo extremamente rara a indicação cirúrgica na coluna. São relatados casos onde ocorreu restituição completa da altura do corpo vertebral15. Em nossa casuística tivemos dois casos que apresentaram esta evolução.
Embora possa haver resolução espontânea, o tempo necessário é imprevisível, podendo haver morbidade significativa secundária a dor intensa e limitação funcional.
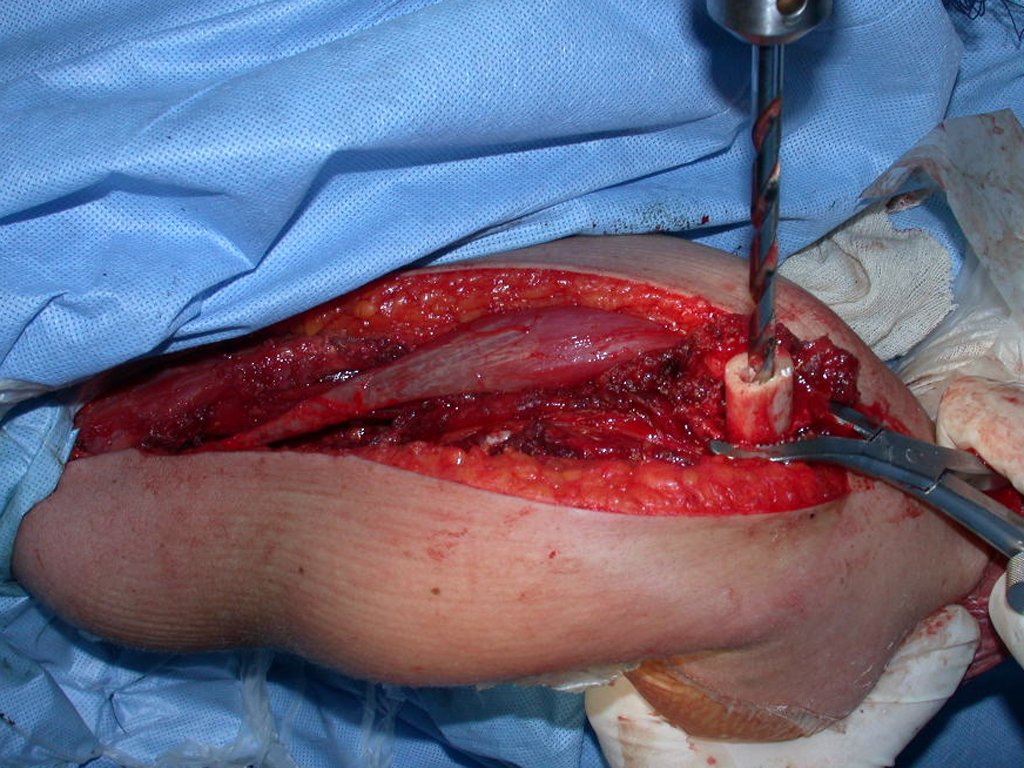
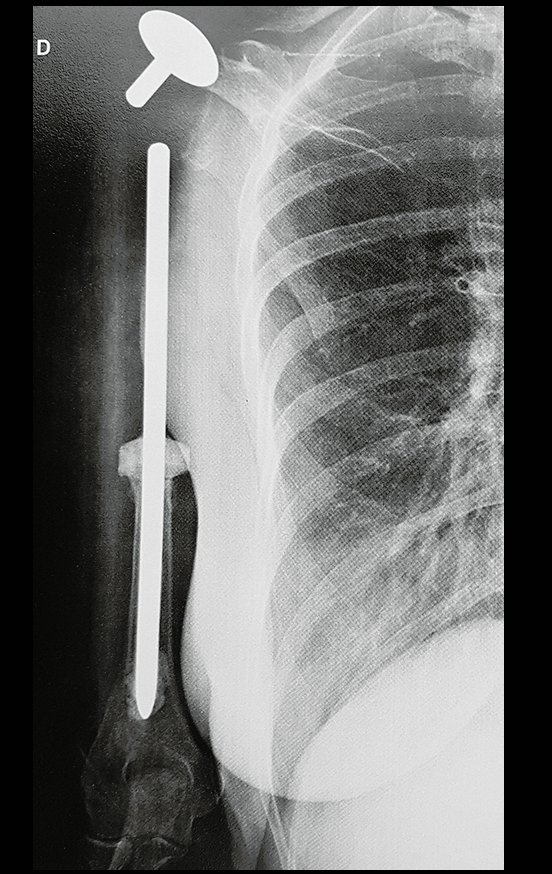
Atualmente, a melhor conduta terapêutica para o Granuloma Eosionófilo é realizar a biópsia percutânea, se possível com diagnóstico imediato por congelação, seguida de infusão intralesional de corticóide (metilpredinisolona – 40mg a 120mg dependendo do tamanho da lesão)7. O resultado anatomopatológico deve ser posteriormente confirmado pela histologia em blocos de parafina.
O Granuloma Eosionófilo pode levar até três meses para regredir, podendo ser necessário repetir a infusão6. Em nossa experiência, tivemos apenas um caso, de lesão isolada do úmero, que necessitou de complementação do tratamento inicial no qual realizamos corticoterapia via oral, prednisolona 5mg/24h, por quatro meses. No Granuloma Eosinófilo poliostótico a corticoterapia sistêmica é empregada.
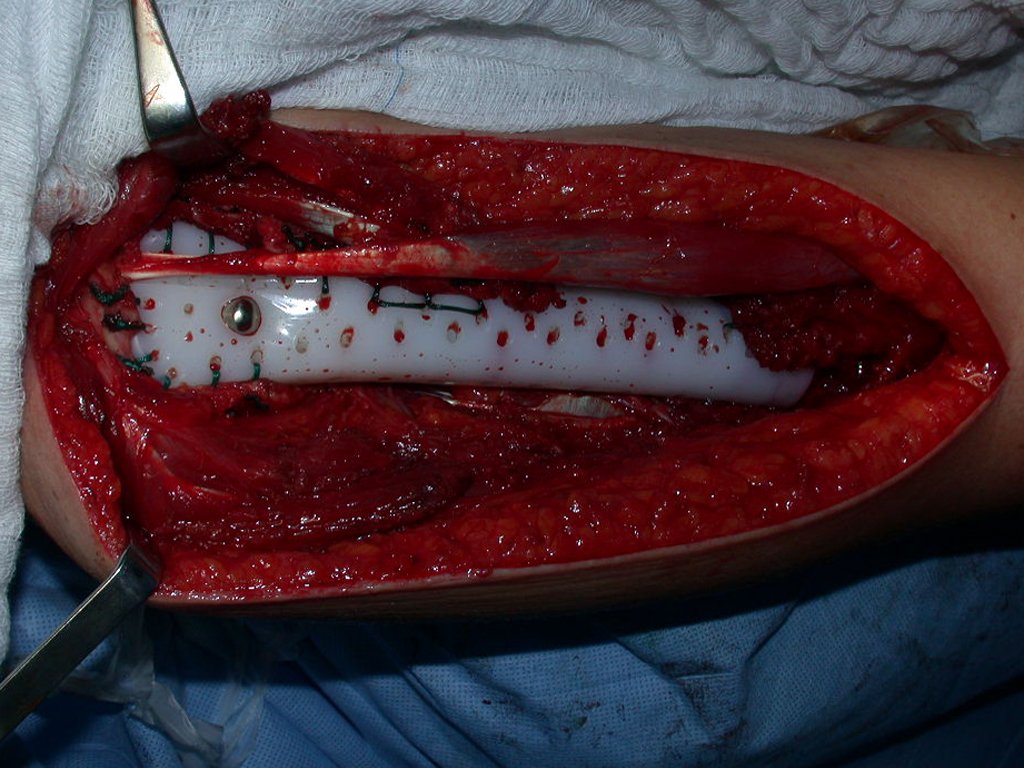
Quando houver necessidade de biópsia incisional, o corticóide pode ser aplicado localmente após a curetagem da lesão, que facilita a resolução do processo. Esta curetagem deve ser cuidadosa, realizada por abertura em formato de fenda estreita, longitudinal ao osso, procurando não acrescentar maior fragilidade local. Eventualmente pode-se preencher a cavidade com enxerto ósseo, porem este geralmente é dispensável pela grande potencialidade de regeneração que existe.
A radiofrequência foi proposta como tratamento percutâneo para o Granuloma Eosionófilo, sendo aplicada em segundo tempo, duas a quatro semanas após a biópsia17. O autor restringe a técnica para lesões pequenas e que estejam distantes no mínimo um centímetro das estruturas neurais ou viscerais, advertindo para o risco de fratura nos membros de carga. Essa conduta, além de aumentar o custo e causar morbidade local, não acrescenta vantagem ao tratamento. A própria biópsia pode ter sido curativa, e a infusão de corticóide tem maior fundamentação, já que este tem sua indicação tanto nos casos isolados como nas lesões múltiplas. Não existem até o momento trabalhos comparando as técnicas percutâneas com infusão de corticoide em relação ao uso da radiofrequência que justifiquem a sua utilização.
Historicamente, a radioterapia foi utilizada em doses baixas e fracionada para o tratamento da Histiocitose de Células de Langerhans. Atualmente a indicação de radioterapia para lesões benignas é controversa.
Nos casos de granuloma eosinófilo com mais de uma lesão no esqueleto, sem comprometimento visceral, o tratamento sistêmico pode estar indicado por um período aproximado de seis semanas com corticoterapia (2 mg/kg) e Vimblastina (6 mg/kg).
Prognóstico: As lesões solitárias do granuloma eosinófilo evoluem bem em 97% dos casos, com a biópsia isolada ou acrescida de infusão de corticóide ou com o tratamento cirúrgico6.
Bibliografia:
1 SCHAIRER, E. Ueber eine eigenartige Erkrankung dês kindlichen Schädels. Zentralbl Allg Patho Pathol. Anat., 71:113, 1938.
2 Otani S, Ehrlich JC; Solitary granuloma of bone simulating primary neoplasm. Am J Pathol 16:479-90. 1940
3 Green WT, Faber S; “eosinophilic or solitary granuloma” of bone. J Bone Joint Surg (Am) 24:499-526. 1942
4 Jaffe HL, Lichtenstein L; Eosinophilic granuloma of bone. ArchPathol 37: 99-118. 1944.
5 Lichtenstein L.: Histiocytosis X. Integretion of eosinofilic granuloma of bone, Letterer-Siwe disease and Schuller-Christian disease as related manifestations of a single nosologic entity, A.M.A. Arch. Pathol. 56:84, 1953
6 Schwartz HS. Orthopaedic Knowledge Update: Musculoskeletal Tumors 2.American Academy of orthopaedic Surgeons, Rosemont, Illinois. Cap 12 (128-32), 2007
7 Mavrogenis AF, Abati CN, Bosco G, Ruggieri P. Intralesional Methylprednisolone for Pain ful Solitary Eosinophilic Granuloma of the Appendicular Skeleton in Children. J PediatrOrthop 2012;32:416–422
8 Chadha M, Agarwal A, Agarwal N, et al. Solitary eosinophilic granuloma of the radius. An unusual differential diagnosis. Acta Orthop Belg. 2007; 73:413–417.
9 Campanacci, M. Bone and Soft Tissue Tumors; Springer-Verlag Wien New York. Second Edition, (54); 857-75. 1999.
10 SCHAJOWICZ, F. Buenos Aires: Tumores Oseos; Talleres de editorial Médica Panamericana S.A. (9); 464-80. 1981.
11 CHRISTIAN, H. A. Defects in membranous bones, exosphthalmos and diabetes insipidus: in un usual syndrome of dyspituitarism: a clinical study. Med. Clin. North. Am., 3:849, 1920.
12 ARCECI, R. J.; BRENNER, M. K.; PRITCHARD, J. Controversiesand new approaches to the treatment of Langerhans cell histiocytosis. Hemtol. Oncol. Clin. North. Am., 12:339, 1998
13 ALBRIGHT, F.; REIFNSTEIN, E. C. The parathyroide glands and metabolic disease. Baltmore, Williams & Wilkins, 1948.
14 Plasschaert F, Craig C, Bell R, et al. Eosinophilic granuloma. A different behaviour in children than in adults. J Bone Joint Surg Br. 2002;84:870–872.
15 Greenlee JD, Fenoy AJ, Donovan KA, et al. Eosinophilic granuloma in the pediatric spine. Pediatr Neurosurg. 2007; 43:285–292.
16 Sessa S, Sommelet D, Lascombes P, et al. Treatment of Langerhans cell histiocytosis in Children. Experience at the Children’s Hospital of Nancy. J Bone Joint Surg Am. 1994; 76:1513–1525.
17 Corby RR, Stacy GS, Peabody TD, et al. Radiofrequency ablation of solitary eosinophilic granuloma of bone. Am J Roentgenol.2008;190:1492–1494.
Diagnóstico dos tumores
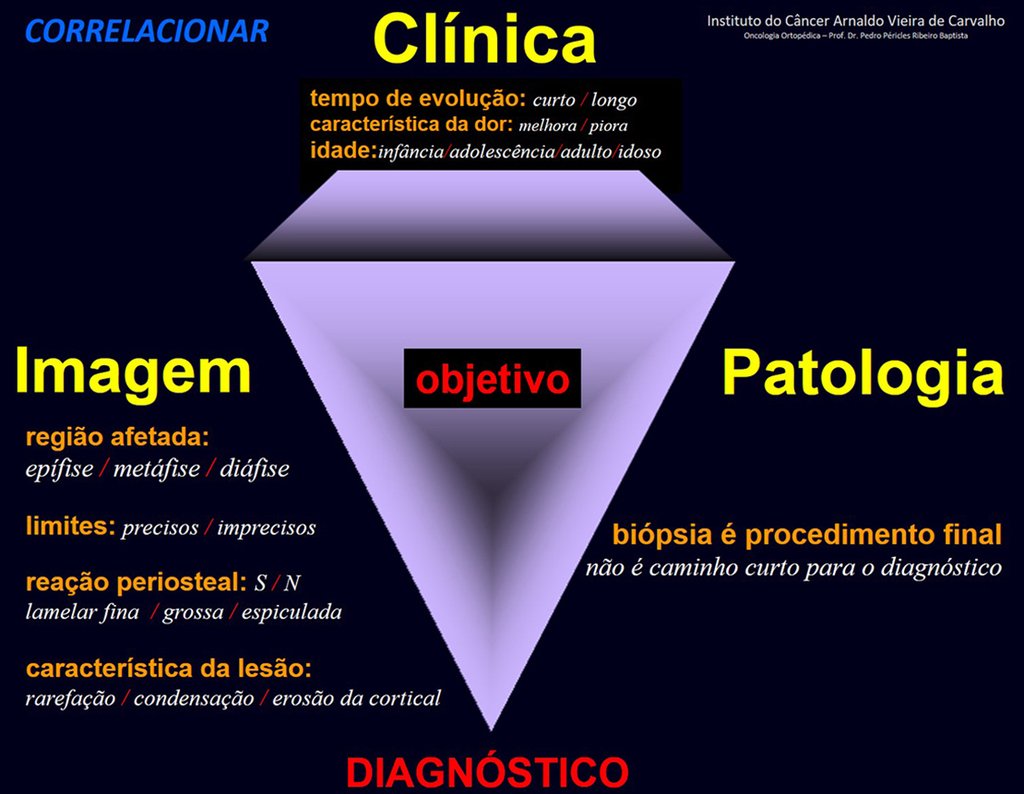
2. Parâmetros:
Devemos analisar os seguintes aspectos da lesão:
1) Identificar o osso ou ossos comprometidos;
2) Quanto ao número de lesões:
2.1) Localizada em um osso: monotópica;
2.2) Uma lesão em diversos ossos: monotópica e poliostótica;
2.3) Múltiplas lesões em um osso: politópica e monostótica;
2.4) Múltiplas lesões em diversos ossos: politópica e poliostótica.
3) Quanto à localização no osso:
3.1) Epífise, metáfise ou diáfisa;
3.2) Região cortical, esponjosa, subperiostal, paraosteal ou justa-cortical;
3.3) Central ou excêntrica.
4) Limites da lesão no osso:
4.1) Precisos, imprecisos, infiltrativo ou permeativo, circundado ou não por esclerose reacional;
4.2) Ultrapassa a cortical com lesão extra-óssea;
4.3) Atinge as partes moles (sim/não) (desloca/infiltra);
4,4) Ultrapassa a linha de crescimento.
5) Quanto ais aspectos da lesão:
5.1) Destrutiva (osteolítica)
5.2) Condensante ou osteogênica
5.3) Multiloculada, “em bolhas de sabão”
5.4) Calcificações: focais, difusas, estriadas
6) Tipo de reação periostal:
6.1) Em lâminas finas – “em casca de cebola”
6.2) Em lâminas grossas
6.3) Espiculadas – “em raios de sol” ou “em pente”
6.4) Levantamento periostal interrompido pelo tumor – Triângulo de Codman
3. Diagnóstico:
Métodos de estudo para exame anátomo patológico:
Citologia:
É o estudo de células descamadas obtidas em secreções, excreções ou obtidas com agulhas e realizando-se “imprints” (impressão de fragmentos de tecidos em lâminas). Raramente devera ser utilizado para diagnóstico de uma neoplasia óssea. Sua importância reside principalmente, na correlação cito-histológica.
Punção-biópsia:
Coleta de material com trefinas para inclusão em parafina e exame microscópico. Embora o material obtido por este método seja pequeno, quando é colhido em área significativa da neoplasia e por ortopedista com experiências no manuseio destas lesões, possibilita o diagnóstico definitivo. O local de obtenção deste material deve ser planejado pelo cirurgião, a fim de impedir ruptura do equilíbrio do tumor nos tecidos vizinhos, evitando sua disseminação.
Biópsia incisional:
É o método mais utilizado para diagnóstico de tumores ósseos. O local da biópsia deve ser planejado, não só quanto à área que possibilitará melhor diagnóstico histológico como para prever a futura ressecção do tumor, na qual deverá ser incluída a pele da região biopsiada. A biópsia não deverá ser realizada em locais inadequados do tumor como áreas de necrose, hemorragia, no triângulo de Codman ou em áreas que apresentam apenas esclerose óssea reacional peritumoral.
Biópsia de congelação
É realizada durante o ato cirúrgico. Este método não é indicado quando existir tecido ósseo. A possibilidade de erro diagnóstico é grande, nesta situação. Os erros de diagnóstico nas numerosas lesões ósseas com células gigantes multinucleadas, nos diversos tumores de células indiferenciadas, de células pequenas e redondas, a impossibilidade de diagnóstico diferencial histológico quando há tecido ósseo neoformado no calo de fratura, osteossarcoma e miosite ossificante, são alguns exemplos que contra-indicam o método. O exame em congelação poderá ser útil em casos de lesões metastáticas e mesmo assim, a rapidez do método não alterará a conduta operatória.
Estudo microscópico:
Os fragmentos obtidos por punção ou biópsia incisional devem ser incluídos em parafina e posteriormente faz-se a coloração com hematoxilina-eosina. Métodos especiais como PAS (Acido periódico de Schiff) e impregnação pela prata para estudo da reticulina são usualmente utilizados para diagnóstico diferencial, por exemplo, entre Sarcoma de Ewing, Linfomas e PNET (Tumor neuroectodérmico primitivo). O PAS, demostrando glicogênio e a escassa quantidade de reticulina, são usuais para diagnóstico de sarcoma de Ewing. Nos Linfomas a reticulina é abundante e o PAS é negativo. Técnicas de imuno-histoquímica com imunoperoxidase estão entrando na rotina dos exames anatomopatológicos. São principalmente indicadas na procura do diagnóstico do órgão de origem de neoplasias metastáticas nos ossos. O uso de marcadores que permitem identificar a origem da célula neoplásica é cada vez mais usado na prática diária. Exemplos são o PSA, para identificar neoplasia originária da próstata, CK7 para neoplasia primitiva do pulmão, CK20 para neoplasia primitiva do tudo digestivo e receptores de estrógeno e progesterona para neoplasia da mama.
Peças cirúrgicas:
Rotineiramente uma peça cirúrgica deve ser examinada externamente e aos cortes. Externamente para análise das margens cirúrgicas com a finalidade de se verificar se a neoplasia foi completamente extirpada. Aos cortes verificamos o comprometimento do osso, extensão e dimensões da neoplasia e seus caracteres macroscópicos principais para adequado estudo microscópico. (Figura 1)
Quando o estudo de uma ressecção cirúrgica for de paciente submetido a quimioterapia pré-operatória, particularmente no osteossarcoma e no sarcoma de Ewing, o estudo da peça deverá obedecer uma sistematização de exame, pois a finalidade é analisar a resposta da neoplasia à terapêutica. As etapas do estudo serão as seguintes:
A) Serão feitas fatias da peça cirúrgica em toda sua extensão com espessura máxima de 0,5 cm,
B) Uma ou mais fatias deverão ser reproduzidas em “scanner” de computador ou fotografadas e radiografadas,
C) Esta reprodução deverá ser quadriculada da extremidade proximal até a distal,
D) Os fragmentos de cada área quadriculada deverão ser minuciosamente examinados ao microscópico com a finalidade de quantificar a necrose da neoplasia e a persistência de células tumorais histológicamente viáveis,
E) O relatório final do estudo de toda a peça deverá ser graduado quanto à resposta de quimioterapia pré-operatória nos critérios de Huvos.
Critérios de Huvos:
Grau I: Até 50% de necrose tumoral;
Grau II: de 50 a 90/% de necrose tumoral;
Grau III: Acima de 90% de necrose;
Grau IV: 100% de necrose tumoral – Ausência de células neoplásicas histológicamente viáveis.
Com esta graduação o oncologista poderá orientar o tratamento pós-operatório tendo em vista o pior prognóstico estatístico nos casos de gruas I e II e melhor nos de III e IV.
Autor : Prof. Dr. Pedro Péricles Ribeiro Baptista
Oncocirurgia Ortopédica do Instituto do Câncer Dr. Arnaldo Vieira de Carvalho
Consultório: Rua General Jardim, 846 – Cj 41 – Cep: 01223-010 Higienópolis São Paulo – S.P.
Fone:+55 11 3231-4638 Cel:+55 11 99863-5577 Email: drpprb@gmail.com