Sarcoma de Tecidos Moles. A cirurgia oncológica ortopédica abrange o tratamento das lesões musculoesqueléticas compreendendo as neoplasia ósseas benignas, malignas, lesões pseudotumorais e neoplasias benignas e malignas de tecidos moles.
Sarcoma de Tecidos Moles
O sarcoma de tecidos moles é uma neoplasia maligna, derivada do mesênquima que ocorre nos tecidos moles, como músculos, fáscias, tendões, etc. Não é chamado de carcinoma porque esta denominação refere-se às neoplasias malignas que tem sua origem embrionária no ectoderma, como a pele, os nervos, as vísceras ou glândulas.
Esta neoplasia surge a partir de uma célula mesenquimal que sofre mutação e passa a ter uma reprodução celular anômala, produzindo células polimorfas, com tamanhos variados, hipercromáticas, resultando em um tecido atípico, portanto maligno.
Sua nomenclatura é dada pela semelhança ao tecido que tentam reproduzir. Assim, por exemplo, quando o tecido neoformado atípico apresenta aspecto semelhante ao tecido gorduroso recebe o nome de lipossarcoma.
Etiologia:
A maioria dos sarcomas de tecidos moles não possui etiologia definida, porém alguns fatores de risco estão bem descritos como radioterapia prévia, linfedema, síndrome de Li-Fraumeni, neurofibromatose tipo I, propensão genética individual e infecção pelo vírus HIV.
Incidência:
É um tumor raro, pois o grupo de todos estes sarcomas compreende cerca de 12 por cento das neoplasias pediátricas, predominando o padrão de “pequenas células redondas” como o rabdomiossarcoma embrionário e o tumor primitivo neuroectodérmico periférico, e apenas um por cento de todos os tumores malignos do adulto 1,2, Quadro 1.
Estima-se 12 mil casos novos de sarcomas de tecidos moles por ano nos EUA, ocasionando cerca de 4700 mortes 1.
Cerca de 60 por cento dos sarcomas de tecidos moles surgem nos membros, sendo a maioria deles na coxa. Ocorre igualmente na parede torácica e no retroperitônio. Por ordem de frequência, os sarcomas de tecidos moles surgem no membro inferior (46%), dorso (18%), membro superior (13%), retroperitônio (13%) e cabeça e pescoço (9%)1.
Classificação:
A Organização mundial da saúde (OMS) classifica o sarcoma de tecidos moles de acordo com o subtipo histológico que a neoplasia se assemelha, assim temos o lipossarcoma, o sarcoma sinovial, o rabdomiossarcoma, etc.1
Em alguns casos a histologia é incerta e o aspecto morfológico passa a ser empregado para classificá-los como o sarcoma alveolar ou sarcoma de células claras.
Os sarcomas de tecidos moles mais comuns no adulto são: o indiferenciado, o lipossarcoma, o sarcoma sinovial, o leiomiossarcoma e o tumor maligno de bainha de nervo periférico, que é incluído neste capítulo, apesar de ter origem no ectoderma, pois apresenta comportamento biológico, tratamento e prognóstico semelhantes aos sarcomas de tecidos moles 1,2.
O grau histológico também é usado para classificar os sarcomas de tecidos moles, sendo classicamente divididos em Grau 1, bem diferenciado apresentando baixo grau de malignidade histológica; Grau 2, moderadamente diferenciado e Grau 3, pouco diferenciado com alto grau de malignidade 1.
Quadro clínico:
O quadro clínico inicial é de abaulamento tumoral palpável, muitas vezes indolor, com crescimento progressivo podendo chegar a tamanho considerável, principalmente na coxa.
Alguns pacientes podem eventualmente apresentar dor e parestesia por efeito compressivo tumoral. Apresentam-se clinicamente eutróficos, na maioria dos casos, sendo a febre ou o emagrecimento sintomas de exceção.
Os sarcomas de tecidos moles tendem a crescer entre os músculos adjacentes, empurrando e comprimindo as estruturas ao redor, raramente ultrapassam os compartimentos anatômicos. A velocidade de crescimento é variável entre os subtipos histológicos.
Não existem critérios clínicos absolutos para diferenciar os tumores de tecidos moles benignos dos malignos. No entanto, todos os tumores profundos, ou seja, abaixo do plano da fáscia muscular, e os tumores superficiais com mais de 5 cm, têm alta probabilidade de serem malignos 2.
Estadiamento:
No momento do diagnóstico, o sarcoma de tecidos moles raramente apresenta metástase, não ultrapassando 10 por cento dos casos. Isso ocorre mais frequentemente em tumores de grande volume, profundos à fáscia muscular e de alto grau 2.
O padrão de disseminação, para a maioria dos sarcomas, é hematogênico e o principal sítio de metástase é o pulmão. Por esse motivo todos os pacientes com sarcoma de tecidos moles devem realizar o estadiamento do tórax. A tomografia do tórax para pesquisa de metástase pulmonar deve ser sempre indicada, principalmente para pacientes com alto risco, como nas lesões superficiais maiores do que 5 cm, tumores profundos e com alto grau de malignidade.
Os linfonodos regionais são sítio de metástases em 2,6 por cento dos casos, porém, em alguns subtipos histológicos estas podem ser mais frequentes e deve ser pesquisado, como no rabdomiossarcoma, sarcoma sinovial, sarcoma epitelioide, sarcoma de células claras e angiossarcoma 2.
A tomografia do abdome e pelve é recomendada, principalmente no estadiamento do sarcoma de tecidos moles de células redondas e lipossarcoma mixóide, pelo alto índice de metástase extrapulmonar para o abdômen e retroperitônio. No caso do angiossarcoma a avaliação do sistema nervoso central, através da tomografia de crânio, é necessária pela propensão de metástase para o encéfalo.
Exames de imagem:
a) Radiografia:
A radiografia é o exame de imagem mais barato e acessível. Pode ser empregada como primeira linha de avaliação dos tumores, para diferenciar um tumor de origem esquelética de um sarcoma de tecidos moles. Além disso, pode evidenciar calcificações no seu interior.
b) Ressonância magnética:
A ressonância magnética ainda é o exame de escolha para avaliar os sarcomas de tecidos moles, quando não há elementos metálicos, como uma prótese ortopédica. Pode detalhar os limites do tumor e a sua relação com as estruturas vizinhas. O uso de contraste pode ainda diferenciar lesões sólidas de lesões preenchidas por liquido, devendo-se solicitar o exame com o emprego de contraste.
c) Tomografia:
A tomografia é o exame de escolha nos tumores do retroperitônio e na pesquisa de metástase pulmonar, pois a ressonância não é adequada devido ao movimento respiratório e ao peristaltismo intestinal. No estudo dos STM de extremidades a ressonância é superior no delineamento da extensão neoplásica 2.
d) Pet-Cet:
A tomografia por emissão de pósitrons com flúor desoxiglicose (FDG-PET/CT) permite, com alta sensibilidade, diferenciar o sarcoma de tecidos moles de alto grau dos tumores benignos de tecidos moles .. Entretanto perde valor na diferenciação entre tumores baixo grau ou graus intermediários 2.
O FDG-PET/CET não deve ser usado de rotina na avaliação inicial de um paciente com tumor em tecidos, porém seu uso é indicado na determinação prognóstica e na resposta ao tratamento quimioterápico 2,3.
O standaruptakevalue (SUV) é uma quantificação da glicose marcada com flúor consumida pelo tumor e demonstra metabolismo tumoral. O sarcoma de tecidos moles com SUV igual ou maior que 6, que após a quimioterapia apresentam redução deste valor menor do que 40 por cento apresentam maior risco de recidiva sistêmica da doença 2.
e) Cintilografia:
A cintilografia óssea nem sempre é realizada no estadiamento inicial do sarcoma de tecidos moles, pois metástases ósseas, em adultos, são infrequentes no estágio inicial da doença. A exceção são os tumores de células redondas e o lipossarcoma mixóide, porém o mapeamento do esqueleto pode ser falso negativo e recomenda-se a avaliação através de ressonância magnética 2.
Biópsia:
A biópsia é indicada para o diagnóstico histológico do STM, uma vez que os exames de imagens não apresentam características sugestivas do subtipo histológico, como podemos inferir em algumas neoplasias ósseas, como o osteossarcoma.
A biópsia nem sempre é necessária para o tratamento, pois o tratamento dos STM ainda hoje é prioritariamente cirúrgico e, em alguns casos, a biópsia pode ser substituída pela ressecção excisional ou também chamada de biópsia excisional.
Tumores superficiais, acima da fáscia muscular, menores do que 5 cm, apresentam baixa probabilidade de serem malignos. Nestes casos podem ser ressecados sem diagnóstico histológico se forem passiveis da realização de cirurgia oncológica (ressecção ampla com margem oncológica, sem comprometer estruturas nobres ao redor), pois este seria o tratamento correto na eventualidade de estarmos tratando de um sarcoma de tecidos moles de alto grau.
A biópsia deve ser realizada pelo cirurgião que fará o tratamento definitivo ou ser orientada por ele. O trajeto da biopsia deve estar em linha com a incisão que será usada na ressecção e todo este trajeto de biópsia deve ser removido em bloco, juntamente com o tumor.
A biópsia incisional, realizada através de uma incisão cirúrgica, expondo parte do tumor foi a mais utilizada para o diagnóstico do sarcoma de tecidos moles. Atualmente as biópsias percutâneas ganharam espaço com o desenvolvimento de agulhas apropriadas, como a trucut®, e aos métodos de imagem como o ultrassom e a tomografia para guiá-las.
Patologia:
O patologista deve sempre estar presente, para realizar o exame de congelação, visando confirmar e garantir que o material coletado é representativo da lesão, evitando-se a necessidade de repetição do procedimento. O resultado histológico definitivo deverá aguardar a histologia em parafina e eventualmente a imuno-histoquímica.
A biópsia percutânea com agulha, feita com estes cuidados, geralmente permite diferenciar tumores malignos de benignos e os patologistas experientes conseguem determinar corretamente o grau histológico dos tumores em respectivamente 97,6 e 86,3 por cento, além desta técnica provocar menor disseminação local da lesão, durante o procedimento 3.
Sarcoma de tecidos moles – Tratamento:
O tratamento dos tumores de tecidos moles é geralmente cirúrgico, entretanto, como na maioria das neoplasias o acompanhamento do paciente oncológico deve ser sempre multidisciplinar.
Desde o diagnóstico ao estadiamento e tratamento uma equipe de vários profissionais interage na condução do caso, como o ortopedista que realizará a cirurgia oncológica, o patologista, o radiologista, o oncologista clínico, o radioterapeuta, o psicólogo, o assistente social, etc.
O objetivo do tratamento é preservar a vida do paciente, evitando-se a recidiva local, maximizando a função do membro afetado e minimizando a morbidade do tratamento.
Quimioterapia:
Os Sarcomas de tecidos moles, da população pediátrica, respondem a quimioterapia sistêmica por apresentar maior resposta às drogas, propiciando melhora na sobrevida, pois a criança consegue suportar as doses de quimioterápicos necessárias para o controle da enfermidade, diferentemente dos adultos.
Nas crianças, os sarcomas de tecidos moles mais comuns são o rabdomiossarcoma, a forma extra óssea do osteossarcoma e a forma extra óssea do sarcoma de Ewing. Todos estes com protocolos quimioterápicos neoadjuvante e adjuvante.
Nos raros casos de ocorrência dessas neoplasias em adultos opta-se pelo protocolo quimioterápico pediátrico, nas doses suportadas para o adulto e suas eventuais comorbidades.
Nos sarcomas de tecidos moles do adulto, existe uma grande polêmica quanto ao uso da quimioterapia. A meta-analise publicada em 1997 pelo Sarcoma Meta-analysiscollaboration evidenciou que o uso de doxorubicina nestes pacientes aumentou o tempo livre de recidiva local e metástase a distância, porém não houve benefício estatisticamente significativo na sobrevida global dos pacientes 3.
Uma nova meta-análise atualizada foi publicada em 2008 demonstrando que o uso da doxorubicina associada a ifosfamida promoveu melhoria na sobrevida dos pacientes 3. No entanto, a quimioterapia é extremamente tóxica, principalmente na população adulta em que a presença de comorbidades clínicas pode tornar o tratamento efetivo inviável. A recomendação atual é individualizar cada caso, lembrando que o tratamento sistêmico não corrige uma ressecção cirúrgica inadequada.
De forma geral, os STM do adulto, são maus respondedores a quimioterapia. O tratamento, portanto, recai sobre a ressecção cirúrgica.
Cirurgia oncológica:
A cirurgia de ressecção do sarcoma de tecidos moles deve ser realizada com margens amplas, de forma que todo o tumor seja retirado em bloco e revestido por tecido saudável, visando garantir que não existam células neoplásicas residuais após a ressecção.
Os sarcomas de tecidos moles apresentam uma pseudocapsula ao redor. Esta estrutura é representada por um processo inflamatório produzido pela agressão tumoral e nem sempre é barreira suficiente para as células neoplásicas, que permeiam os tecidos ao seu redor. Pode-se indicar radioterapia adjuvante visando atuar nas margens quando estas precisarem ser exíguas, devido a necessidade de preservação de estruturas nobres, como vasos e nervos.
A ressecção tumoral através da pseudocapsula pode deixar tecido neoplásico microscópico no paciente podendo ser fator de risco para recidiva local e pior prognóstico.
Os sarcomas de tecidos moles tendem a crescer expandindo-se e empurrando os tecidos ao redor, mas raramente infiltrando-o. Dessa forma, é incomum a invasão óssea ou dos tecidos musculares adjacentes.
Na maioria das vezes em que o tumor se aproxima do osso é possível dissecá-lo retirando-se o periósteo que envolve o osso em questão, juntamente com o tumor. Esta desperiostização associada a radioterapia, que geralmente é usada como adjuvância, aumentam o risco de fratura, especialmente no fêmur 4.
Recorrência:
A espessura das margens amplas ao redor do tumor é questionável, sendo recomendado 1 cm, mas isso dificilmente acontece de maneira homogênea em toda sua circunferência.
Para preservar tecidos nobres, como grandes nervos ou vasos, eventualmente o cirurgião reduz essa margem para evitar a ressecção de tal estrutura, que pode colocar em risco tanto o paciente quanto o próprio membro em que se busca preservar a melhor função.
Por outro lado, os planos dos tecidos anatômicos representam diferentes barreiras ao tumor, como a fáscia muscular em que 1 a 2 milímetros de margens pode ser adequado, para uma ressecção segura.
Outros tecidos como a gordura ou o ventre muscular necessitam de margens mais amplas.
Grandes nervos podem ser preservados dissecando-se e retirando-se a bainha nervosa externa como margem, uma vez que os sarcomas de tecidos moles não costumam infiltrar os nervos. Quando o tumor circunda o nervo, há maior dificuldade técnica e este nervo pode necessitar ser seccionado e reconstruído com sutura microcirúrgica.
Enxertos nervosos para reconstrução raramente são úteis nos membros inferiores de adultos, especialmente em sitio que precisará ser irradiado. As crianças, entretanto, podem apresentar resultados melhores.
A cirurgia ablativa é geralmente evitada, pois mesmo uma função limitada do membro inferior pode ser viável, mesmo nos casos que necessitem de ressecção completa do nervo ciático.
Radioterapia:
O uso da radioterapia adjuvante promove a destruição das células tumorais ao redor da lesão principal. Quando associada a ressecção cirúrgica preservadora do membro promove aumento do controle local minimizando a recidiva para 10 a 15% 4. No entanto a associação dessa modalidade terapêutica não aumenta a sobrevida global.
A radioterapia é indicada para quase todos os casos de sarcoma de tecidos moles.
A ressecção cirúrgica exclusiva pode ser suficiente para os casos de tumores superficiais de baixo grau ou em tumores de pequeno volume, totalmente intramusculares, desde que as margens amplas estejam garantidas na cirurgia oncológica realizada.
Com a melhora no controle local, a radioterapia como adjuvância nos sarcomas de tecidos moles reduziu o índice de amputação de extremidades de 50% na década de 1970 para 1% atualmente, sem prejuízo da sobrevida 5.
A indicação de amputação na presença de STM pode ser necessária em tumores excessivamente extensos, de forma que o membro residual não tenha função.
Um exemplo é a necessidade de ressecar-se um tronco nervoso principal, como o plexo braquial com impossibilidade de obter-se margens amplas. Neste caso, a perda da sensibilidade resulta em um membro remanescente inviável.
O comprometimento de grandes vasos pelo tumor, já foi uma indicação de amputação no passado, porém com a técnica de reconstrução vascular tornou-se possível ressecar o tumor em bloco com os vasos e reconstruí-los com enxerto vascular, permitindo um membro viável.
Margens cirúrgicas:
A principal variável no controle local da doença são as margens cirúrgicas da ressecção tumoral 5.
A presença de margens coincidentes com o tumor aumenta o risco de recidiva local e a recidiva aumenta o risco de metástase a distância o que pode levar a menor sobrevida.
A presença de margens comprometidas, no entanto, não representa certeza de recidiva local, uma vez que apenas 30 por cento dos casos submetidos a ressecção incompleta, submetidos a radioterapia adjuvante sofreram recidiva.
As margens amplas, por outro lado, também não são garantia de controle local, uma vez que, mesmo quando associada à radioterapia, a recidiva nessa situação gira em torno de 5 a 10 por cento.
A presença margens positivas na ressecção podem requerer nova abordagem do leito cirúrgico, buscando ampliação das margens previamente obtidas.
Esta nova abordagem dependerá da análise sobre qual estrutura anatômica necessitará ser ressecada para essa ampliação.
Em centros de referência em cirurgia oncológica, a presença de margens comprometidas normalmente está relacionada a eventual tumor residual em grandes feixes nervosos que necessitariam de amputação para sua ressecção. Se for este o caso, pode-se utilizar dose maior de radioterapia (66-68 Gy) ou optar-se pela amputação, como último caso.
Tumores de tecidos moles benignos:
Os tumores benignos de tecidos moles são cem vezes mais comuns do que os tumores malignos. Dentre eles o lipoma subcutâneo está entre os mais diagnosticados na prática clínica.
Estas lesões não causam dor e são diagnosticadas quando são superficiais e fazem saliência na pele ou quando são profundas e atingem grande volume. A exceção é o schwannoma que surge de um nervo periférico e pode apresentar dor, parestesia e menos frequentemente alteração motora.
Apesar de benignos, com o crescimento desses tumores pode ocorrer compressão de estruturas adjacentes e só então aparecerem os sintomas.
O tratamento da maioria dos tumores benignos de tecidos moles é dependente dos sintomas que eventualmente produzam. Como a maioria deles são assintomáticos, a ressecção cirúrgica é indicada quando estão aumentando de tamanho, causando desconforto ou alteração estética.
Em tumores superficiais, de pequeno tamanho, assintomáticos e sem sinais sugestivos de malignidades nos exames de imagem, pode-se optar por observar a evolução clínica.
O tumor desmoide, apesar de benigno, é uma neoplasia de tecidos moles localmente agressiva, que produz sintomas pela agressão aos tecidos vizinhos.
Ao contrário da maioria das neoplasias de tecidos moles benignas, a ressecção do desmoide deve ser indicada com margens amplas, cirurgia oncológica semelhante ao tratamento para os tumores malignos.
O tumor desmoide é altamente recidivante, mesmo após ressecção adequada. Em alguns casos o paciente pode necessitar de amputação do membro devido às inúmeras recidivas, ou quando apresentar dor ou disfunção intratável e uma nova ressecção tornar-se impossível.
Discussão:
- Uma consideração é a realização de biópsia prévia ou biópsia excisional (ressecção biópsia) nos casos de sarcomas de tecidos moles pequenos, superficiais, ou em locais em que é possível a cirurgia oncológica, com amplas margens em toda a circunferência do tumor?
- Outra consideração é quanto aos sarcomas de tecidos moles do adulto, em que a quimioterapia neoadjuvante não melhora localmente e nem interfere na sobrevida, há uma controvérsia quanto a realização de radioterapia neoadjuvante:
- A) Radioterapia + cirurgia + radioterapia ou
- B) Cirurgia + radioterapia?
O Quadro 2 abaixo sintetiza parâmetros que devemos considerar.
Para a definição da cirurgia oncológica, devemos analisar a relação do tumor com a pele, aponeuroses, vasos e nervos. Há ainda que se definir a necessidade ou não de biópsia prévia ou a possibilidade de realizar-se uma ressecção biópsia, realizando-se a exérese da lesão em um só tempo, desde que seja possível operá-la com margem oncológica sem prejuízo da função.
Para isso os estudos de imagem vão definir essa possibilidade nos tumores que estejam suficientemente distantes de estruturas nobres.
A possibilidade de ressecção sem biópsia é vantajosa por facilitar a cirurgia e evitar-se a necessidade de repetição de biópsias com amostras impróprias do tumor e de revisão de cirurgias realizadas com diagnósticos inadequados.
Muitos sarcomas de tecidos moles são operados inicialmente como tumores benignos (inclusive após estudo anatomopatológico da biópsia, que é apenas uma amostra da lesão), mas que na realidade eram neoplasia malignas, que posteriormente foram diagnosticadas com o estudo completo do material cirúrgico que foi ressecado.
Vamos discorrer sobre a definição do tratamento discutindo os casos a seguir:
Caso 1 – Tumor de tecidos moles do ombro, figura 1.
Qual será a abordagem cirúrgica indicada? Biópsia prévia? Ressecção cirúrgica apenas? Neste caso foi realizada a biópsia prévia a cirurgia.
O primeiro diagnóstico destra amostra de biópsia foi de sarcoma fuso celular indeterminado.
A revisão da patologia realizada por outros patologistas do Brasil e dos E.U.A. relatava: “… sarcoma de células fusiformes não classificadas, de grau intermediário, havendo alguma possibilidade de que possa tratar-se de lipossarcoma desdiferenciado …”
A cirurgia oncológica precisa ser realizada com margem de segurança. Este caso deve ser operado como neoplasia maligna, visto tratar-se de uma lesão heterogenia.
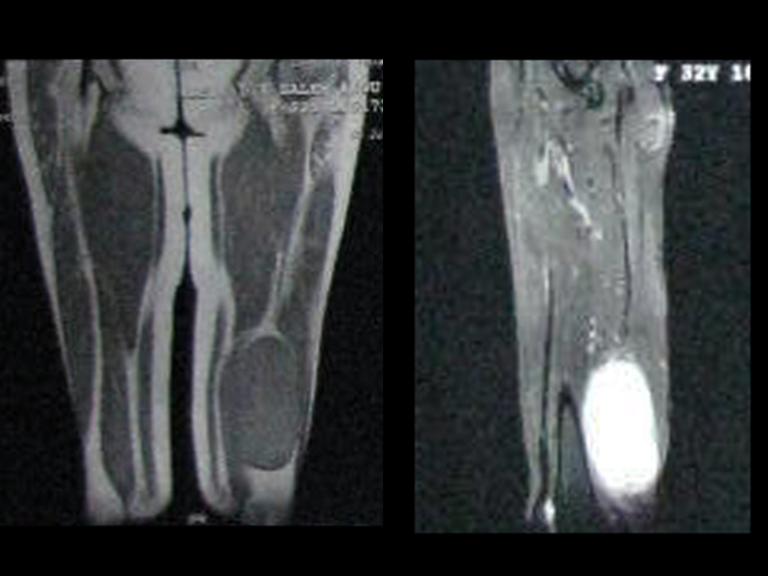
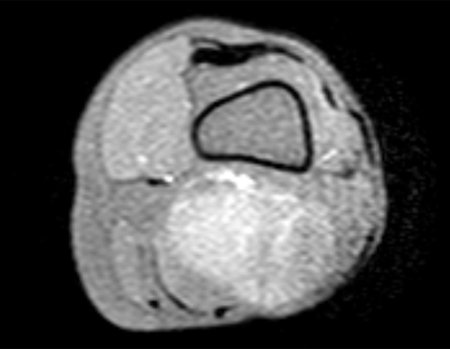
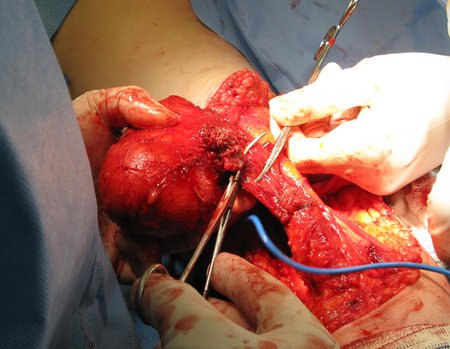
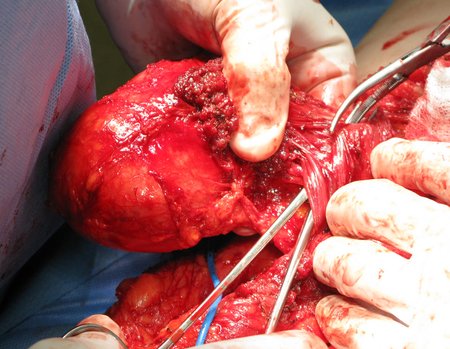
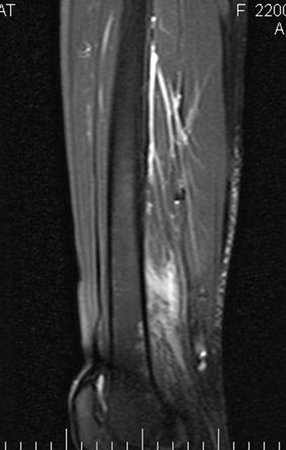
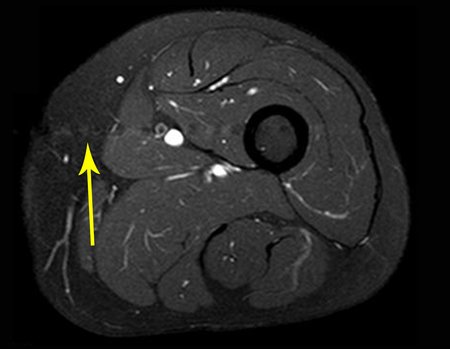
Caso 2 – Sarcoma de tecidos moles de alto grau do membro inferior, figuras 2 a 4.
Qual é o tratamento desta lesão na região anterior da coxa?
Esta lesão é certamente uma neoplasia maligna dos tecidos moles.
Mesmo que a biópsia inferisse tratar-se de lesão benigna a conduta cirúrgica deverá necessariamente ser executada com a técnica indicada para as neoplasias malignas, uma cirurgia oncológica, devido a heterogeneidade da lesão.
A biópsia é apenas uma amostra do tumor e pode obter material de área benigna e não ajudar em nada. O procedimento nestes casos deve ser executado por ortopedista especializado em oncocirurgia, para executar a biópsia no trajeto da futura cirurgia. Foi realizada a biópsia, figura 3.
Este tipo de lesão deve ser ressecado com a maior margem, na medida do possível. Neste caso sabemos que os limites serão exíguos.
Entretanto não há indicação de cirurgia ablativa, uma vez que a amputação não melhora a sobrevida.
- Quimioterapia neoadjuvante? Pouca probabilidade de resposta. Retarda a cirurgia e, com o aumento da lesão, diminui a possibilidade de preservação do membro.
- Radioterapia neoadjuvante? Fibrose intensa com maior dificuldade de liberação dos vasos e nervos e complicações com a ferida operatória.
Como ambas, quimioterapia e/ou radioterapia neoadjuvante não mudam o prognóstico de sobrevida, não indicamos neoadjuvancia nestes casos e realizamos a cirurgia em primeiro tempo, executada por dupla abordagem.
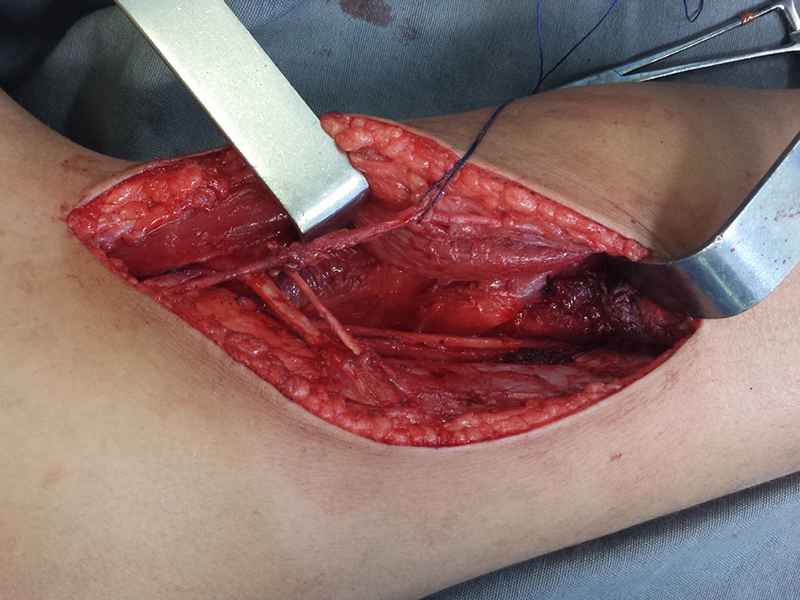
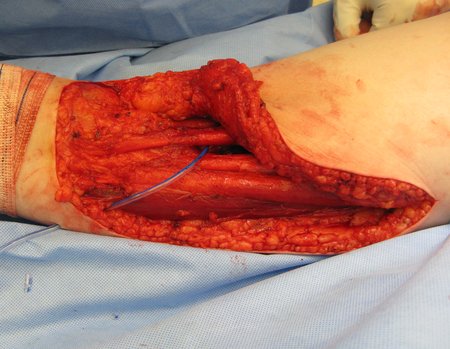
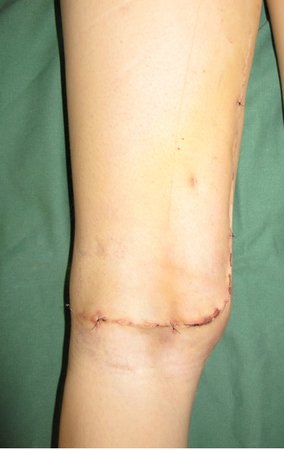
Primeiramente acesso medial, para isolamento seguro do feixe vascular e nervoso, liberação medial do periósteo e posteriormente acesso lateral, complementando o controle local com radioterapia adjuvante, figura 4.
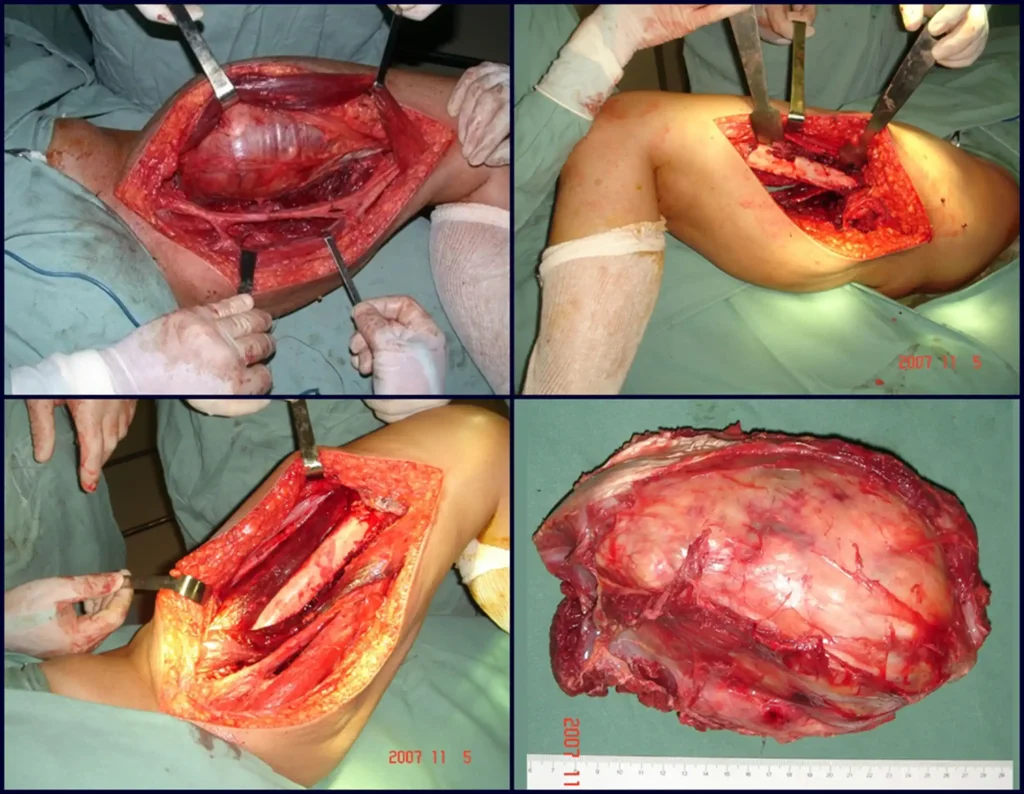
Caso 3 – STM de alto grau do cavo poplíteo, figuras 5 a 11 e vídeo 1.
Qual é a abordagem indicada para este caso?
A escolha do trajeto da biópsia deve ser determinada pela ortopedia oncológica. Deve-se escolher o ponto de maior heterogeneidade, fora de área de possível necrose e no trajeto da futura incisão cirúrgica.
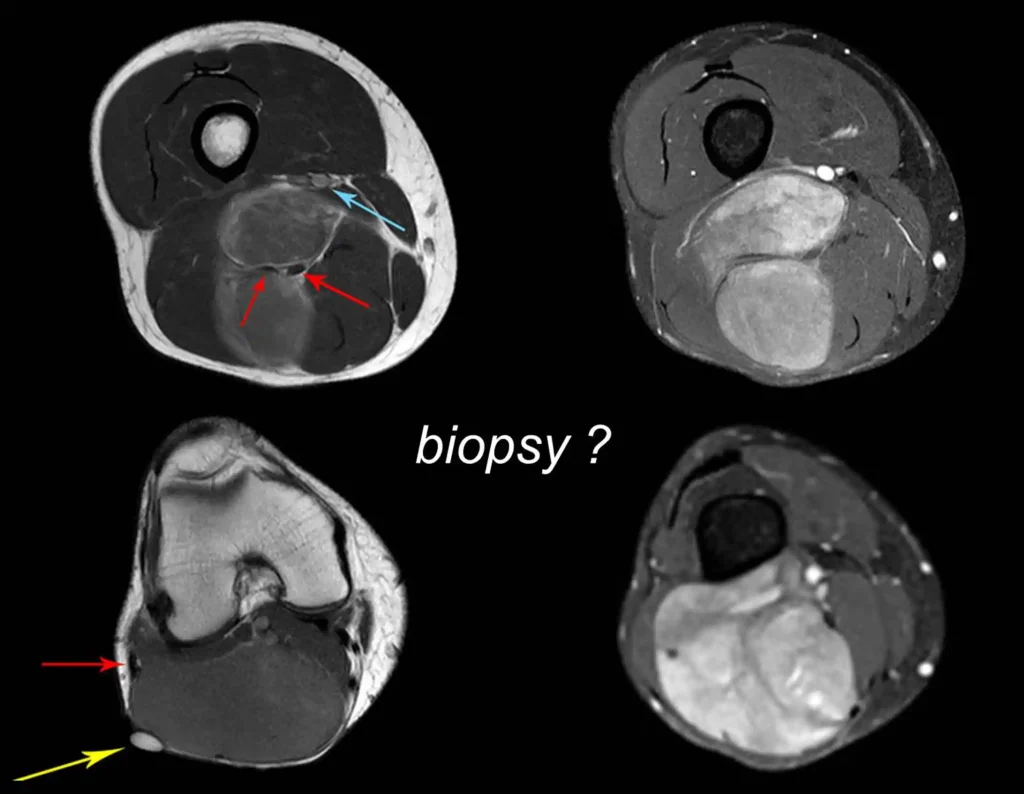

Nestes três casos apresentados verificamos que foi realizada a biópsia. A conduta cirúrgica, em todos eles, foi executada sem terapia neoadjuvante.
Assim, na maioria dos casos de neoplasias em que a clínica e os exames de imagem sugerirem malignidade e que forem passíveis de ressecção com margem oncológica, preservando-se tanto a estética quanto a função, preferimos optar pela biópsia de congelação, feita no ato cirúrgico, tendo a presença do patologista, o qual confirma tratar-se de neoplasia maligna e realizamos a ressecção biópsia (biópsia excisional), em primeiro tempo, como foi executado no caso 4, descrito a seguir.
Caso 4 – STM da coxa com metástase no osso esterno, figuras 12 a 20.
Paciente atendida em 1997, com dor e tumor de crescimento rápido na face medial da coxa direita, acometendo os tecidos moles.
O melhor exame de imagem para avaliar lesões nos tecidos moles é a ressonância magnética (Rm). Este exame revelou a presença de lesão sólida de aproximadamente 5,5 cm por 7,0 cm, dentro da musculatura adutora da coxa, figura 12.

Com este quadro clínico e de imagem temos que responder ao seguinte questionamento:
1- Realizar a biópsia, ou a ressecção biópsia, já que neste caso é possível a exérese da lesão com margem oncológica, sem alteração da função?
2- Caso o resultado da biópsia informe lesão sem atipias, fibroxantoma por exemplo, mudariam a resseção cirúrgica? Seria uma ressecção mais econômica? Mesmo com as características destas imagens, já que a biópsia é apenas uma pequena amostra da lesão?
Em nossa orientação a conduta cirúrgica não pode mudar. A ressecção deve ser feita com margem oncológica neste caso. A biópsia deve ser realizada com o propósito de orientar a indicação ou não de terapia neoadjuvante, caso se confirme tratar-se de neoplasia maligna que responda, como o rabdomiossarcoma embrionário, na criança.
3- Que tipo de biópsia realizar? Com agulha tru-cut? Incisional? Com diagnóstico por congelação e conduta de cirurgia oncológica no mesmo tempo?
Orientação:
O melhor é sempre fazer a biópsia das lesões dos tecidos moles com agulha tru-cut, guiadas por ultrassonografia e anatomia patológica de congelação, para validar o material colhido.
A conduta de ressecção dependerá de cada caso, podendo ser realizada nos casos em que a margem oncológica é possível, sem perda funcional.
Caso contrário deve-se aguardar o resultado do exame anatomopatológico em parafina e inclusive da imuno-histoquímica, quando for necessária.
Neste caso o diagnóstico foi de sarcoma de alto grau, na congelação e como a ressecção com margem era possível, a cirurgia foi realizada neste mesmo procedimento anestésico, figura 14, onde podemos observar o aspecto histológico anaplásico deste tumor.
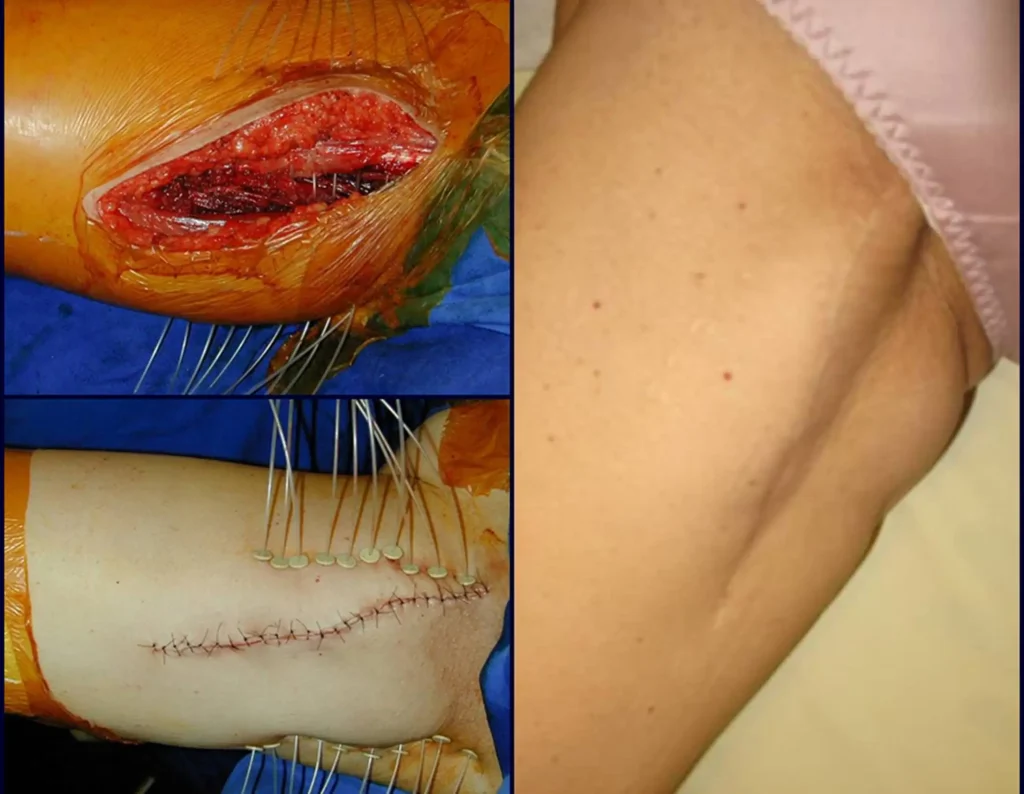
A radioterapia adjuvante foi iniciada nesta cirurgia, com a colocação dos cateteres para a braquiterapia, que era conduta ainda muito indicada naquela época.
Estes cateteres são passados através de uma agulha com diâmetro tubular suficiente, para a posterior colocação dos fios de irídio. Os cateteres são passados e fixados com uma presilha de plástico, figuras 14 a e b.
Posteriormente retiram-se os cateteres e complementa-se com radioterapia externa. A figura 14 c mostra o aspecto local após o tratamento radioterápico adjuvante.
O caso foi discutido em equipe multidisciplinar que optou por não se realizar quimioterapia adjuvante, já que a relação de possíveis benefícios com os efeitos colaterais não era favorável, pesando ainda o fato que esta quimioterapia não aumenta a sobrevivência global, Lancet 199720.
Evolução:
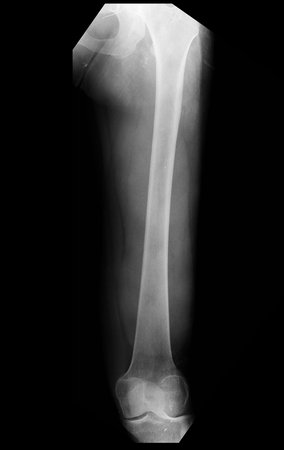
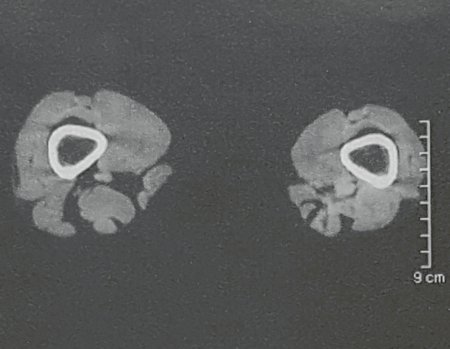
Na avaliação de controle, passados quatro anos e três meses, a paciente referiu abaulamento e dor no esterno. A radiografia, destaca a presença de lesão na porção distal do esterno. Figuras 15 a e b. A cintilografia óssea realizada para o estadiamento esquelético revelou lesão única, com intensa captação nesta região.
Figura 15: a– Radiografia de tórax, em perfil, evidencia lesão expansiva no esterno. b- A cintilografia apresenta intensa captação na metade inferior do esterno.
O estudo da ressonância mostrou a presença de uma lesão sólida, heterogênea, com erosão das corticais e destruição do tecido ósseo do esterno, com intensa captação de contraste, caracterizando um tumor agressivo, em uma paciente com antecedente de sarcoma pleomorfo de alto grau, figuras 16 a e b.
Com a história clínica pregressa desta paciente e estas imagens fizemos o seguinte questionamento:
1- Realizar a biópsia desta lesão?
2- O que fazer se recebêssemos um diagnóstico tumor benigno, como fibrohistiocitoma por exemplo? Ou de Cisto ósseo aneurismático? Qual a seria a conduta cirúrgica com o antecedente desta paciente já operada de sarcoma de alto grau? Curetagem? Repetições da biópsia?
Devemos relembrar que a biópsia é apenas uma amostra, portanto é questionável repetir-se biópsias até obtermos um diagnóstico de lesão maligna para essa doente.
Devemos assumir a necessidade de ressecção com margem desta lesão, já que está indicada a conduta de cirurgia oncológica e a ressecção do esterno não causa prejuízo nem estético e nem funcional.
Ainda temos que considerar que a Quimioterapia neoadjuvante não acrescentaria vantagem para o caso e nem a radioterapia prévia mudaria a necessidade de ressecção da área comprometida.
Conduta:
Se vamos ressecar o esterno, por que via de acesso? Qual é a incisão que permite a ressecção ampla e mais estética?
Escolhemos a via de acesso infra mamária, horizontal, figura 18.
Figura 17: a– Radiografia evidenciando a lesão. b– Incisão realizada na região infra mamária. c– Ressecção do esterno. d– Imagem do local onde foi ressecado o esterno.
Podemos observar a boa hemostasia realizada, que deve ser cuidadosa para dispensar a colocação de dreno e permitir a melhor estética.
4- Como reconstruir essa ressecção? Neste caso não há necessidade de prótese do esterno ou da colocação de placa de cimento rígida, que com a mobilidade respiratória pode ocorrer deformidade e dor. Não há necessidade de estrutura rígida, não ocorre tórax flácido
Este caso foi novamente discutido em reunião multidisciplinar.
A radioterapia pós-operatória não tinha indicação após o tipo de ressecção em bloco deste caso, nesta localização.
A revisão da literatura à época não apontava benefício da quimioterapia x toxicidade e a evidência de sobrevivência global era igual, Câncer 200810. A paciente não recebeu tratamento adjuvante.
Após sete anos e oito meses do tratamento do tumor da coxa e passados mais quatro anos e dois meses da ressecção do esterno, a paciente apresentou metástase na vértebra torácica, T11, figura 19.
A paciente foi submetida a quimioterapia paliativa adjuvante e após dois anos apresentou disseminação da lesão, falecendo devido às metástases pulmonares, figura 20.
Comentários:
Estudo randomizado, no ano de 2012, de quimioterapia adjuvante com doxorubicina e ifosfamida, não mostravam nenhum benefício na sobrevida livre de recidiva e nem na sobrevida global, Lancet28.
Na literatura em 2013 ainda relatava como incerto os benefícios da quimioterapia neoadjuvante e adjuvante, UpToDate 29.
A quimioterapia para sarcoma de tecidos moles ainda precisa evoluir muito. É preciso individualizar a terapia medicamentosa para cada histologia em particular.
Não se pode colocar todos os diagnósticos histológicos de “Sarcoma de Tecidos Moles” na mesma embalagem e tratar com o mesmo protocolo e ainda por cima realizarmos “trabalhos científicos” com conclusões prognósticas, sem particularizar cada diagnóstico.
Os tratamentos dos STM, em sua grande maioria, não são individualizados. Sabemos que a quimioterapia para o sarcoma de Ewing é diferente da quimioterapia para o osteossarcoma, por isso temos resultados favoráveis no tratamento destas afecções.
Portanto não se pode colocar o grande pool dos sarcomas no mesmo protocolo de tratamento, assim como os trabalhos sobre o resultado do tratamento deste pool de tumores não permitem conclusões.
Misturam-se casos que respondem com a maioria que não responde e o oncologista fica sem parâmetros.
No adulto a toxicidade ainda é agravada pelas comorbidades e a relação custo/benefício até esta data tem-se revelado desfavorável.
A cirurgia ainda é o tratamento primordial para os sarcomas de tecidos moles.
A radioterapia tem o seu papel no controle dos sarcomas de alto grau, mas não resgata uma ressecção inadequada. A radioterapia neoadjuvante tem menor complicação para a ferida operatória do que a braquiterapia. A radioterapia adjuvante é recomendada em praticamente todos os casos, fazendo-se eventualmente exceções para as lesões superficiais, para tumores ressecáveis menores do que cinco centímetros e lesões de baixo grau histológico.
______________________________
Bibliografia
- Miller RW, Young JL Jr, Novakovic B. Childhood cancer. Cancer 1995; 75:395.
- Fletcher CDM, Bridge JA, Hogendoorn PCW, Mertens F. World Health Organization Classification of tumours of soft tissue and bone, 4th, IARC Press, Lyon 2013.
- Siegel R, Ma J, Zou Z, Jemal A. Cancer statistics, 2014. CA Cancer J Clin 2014; 64:9.
- Fletcher CDM, Bridge JA, Hogendoorn PCW, Mertens F. World Health Organization Classification of tumours of soft tissue and bone, 4th, IARC Press, Lyon 2013. (2)
- Zagars GK, Ballo MT, Pisters PW, et al. Prognostic factors for patients with localized soft-tissue sarcoma treated with conservation surgery and radiation therapy: an analysis of 1225 patients. Cancer 2003; 97:2530.
- Coindre JM, Terrier P, Guillou L, et al. Predictive value of grade for metastasis development in the main histologic types of adult soft tissue sarcomas: a study of 1240 patients from the French Federation of Cancer Centers Sarcoma Group. Cancer 2001; 91:1914.
- Deyrup AT, Weiss SW. Grading of soft tissue sarcomas: the challenge of providing precise information in an imprecise world. Histopathology 2006; 48:42.
- Lawrence W Jr, Donegan WL, Natarajan N, et al. Adult soft tissue sarcomas. A pattern of care survey of the American College of Surgeons. Ann Surg 1987; 205:349.
- NCCN (2011). NCCN clinical practice guidelines in oncology: soft tissue sarcoma, version 2.2011. National Comprehensive cancer network Fort Washington, PA:National comprehensive Cancer Network Inc. (http://www.nccn.org/professionals/physician_gls/pdf/sarcoma.pdf)
- Christie-Large M, James SL, Tiessen L, et al. Imaging strategy for detecting lung metastases at presentation in patients with soft tissue sarcomas. Eur J Cancer 2008; 44:1841.
- Fong Y, Coit DG, Woodruff JM, Brennan MF. Lymph node metastasis from soft tissue sarcoma in adults.Analysis of data from a prospective database of 1772 sarcoma patients. Ann Surg 1993; 217:72.
- Demas BE, Heelan RT, Lane J, et al. Soft-tissue sarcomas of the extremities: comparison of MR and CT in determining the extent of disease. AJR Am J Roentgenol 1988; 15:615.
- Bastiaannet E, Groen H, Jager PL, et al. The value of FDG-PET in the detection, grading and response to therapy of soft tissue and bone sarcomas; a systematic review and meta-analysis. Cancer Treat Rev 2004; 30:83.
- Dimitrakopoulou-Strauss A, Strauss LG, Schwarzbach M, et al. Dynamic PET 18F-FDG studies in patients with primary and recurrent soft-tissue sarcomas: impact on diagnosis and correlation with grading. J Nucl Med 2001; 42:713.
- Folpe AL, Lyles RH, Sprouse JT, et al. (F-18) fluorodeoxyglucose positron emission tomography as a predictor of pathologic grade and other prognostic variables in bone and soft tissue sarcoma. Clin Cancer Res 2000; 6:1279.
- National Comprehensive Cancer Network (NCCN) guidelines www.nccn.org (Accessed on May 18, 2011).
- Schuetze SM, Rubin BP, Vernon C, et al. Use of positron emission tomography in localized extremity soft tissue sarcoma treated with neoadjuvant chemotherapy. Cancer 2005; 103:339.
- Noble JL, Moskovic E, Fisher C, Judson I. Imaging of skeletal metastases in myxoidliposarcoma. Sarcoma 2010; 2010:262361.
- Strauss DC, Qureshi YA, Hayes AJ, et al. The role of core needle biopsy in the diagnosis of suspected soft tissue tumours. J SurgOncol 2010; 102:523.
- Adjuvant chemotherapy for localisedresectable soft-tissue sarcoma of adults: meta-analysis of individual data. Sarcoma Meta-analysis Collaboration.Lancet. 1997 Dec 6;350(9092):1647-54.
- A systematic meta-analysis of randomized controlled trials of adjuvant chemotherapy for localized resectable soft-tissue sarcoma. 2008 Aug 1;113(3):573-81
- Gortzak Y, Lockwood GA, Mahendra A, et al. Prediction of pathologic fracture risk of the femur after combined modality treatment of soft tissue sarcoma of the thigh. Cancer 2010; 116:1553.
- Rosenberg SA, Tepper J, Glatstein E, et al. The treatment of soft-tissue sarcomas of the extremities: prospective randomized evaluations of (1) limb-sparing surgery plus radiation therapy compared with amputation and (2) the role of adjuvant chemotherapy. Ann Surg 1982; 196:305.
- Canter RJ, Beal S, Borys D, et al. Interaction of histologic subtype and histologic grade in predicting survival for soft-tissue sarcomas. J Am CollSurg 2010; 210:191.
- Zagars GK, Ballo MT, Pisters PW, et al. Prognostic factors for patients with localized soft-tissue sarcoma treated with conservation surgery and radiation therapy: an analysis of 1225 patient. Cancer 2003; 97:2530.
Consultório: Rua General Jardim, 846 – Cj 41 – Cep: 01223-010 Higienópolis São Paulo – S.P.
Fone:+55 11 3231-4638 Cel:+55 11 99863-5577 Email: drpprb@gmail.com
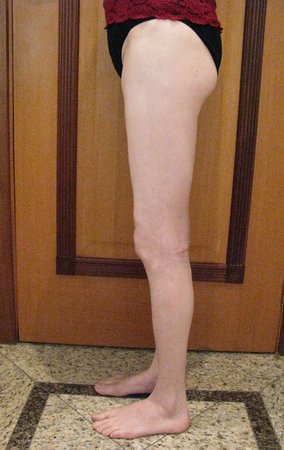
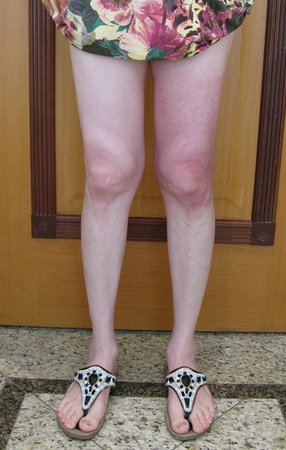
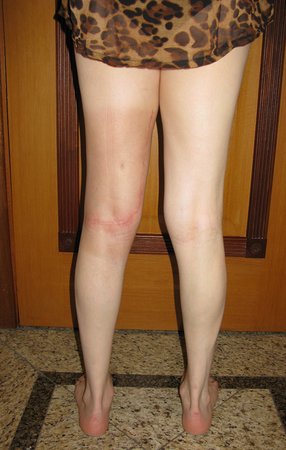
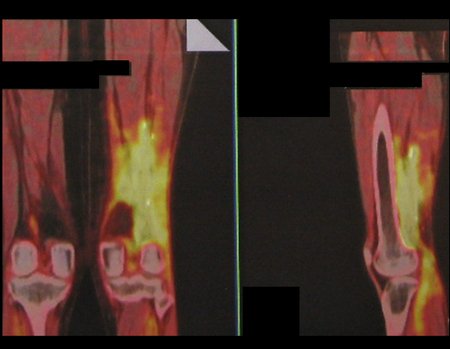
Técnica de Ressecção de Sarcoma de Tecidos Moles da Coxa. Paciente feminina, 33 anos de idade, refere tumor na face posterior e distal da coxa esquerda há um ano, com maior crescimento nos últimos três meses, durante o final da gravidez. Após atendimento com outro profissional, em que realizou exames de ultrassom, cintilografia óssea, ressonância magnética e biópsia, Figuras 1-20, foi-nos encaminhada para avaliação e tratamento.
17. Técnica de ressecção de sarcoma de tecidos moles da coxa

A análise da história, quadro clínico e imagens de uma lesão homogênea, compacta, com limites precisos, produtora de osso maduro permitiu o diagnóstico de osteoma, realizando-se a ressecção desta lesão por indicação estética. A cirurgia foi realizada sob anestesia geral e infiltração local, para diminuir o sangramento (figuras 10 à 20).
Autor : Prof. Dr. Pedro Péricles Ribeiro Baptista
Oncocirurgia Ortopédica do Instituto do Câncer Dr. Arnaldo Vieira de Carvalho
Consultório: Rua General Jardim, 846 – Cj 41 – Cep: 01223-010 Higienópolis São Paulo – S.P.
Fone:+55 11 3231-4638 Cel:+55 11 99863-5577 Email: drpprb@gmail.com