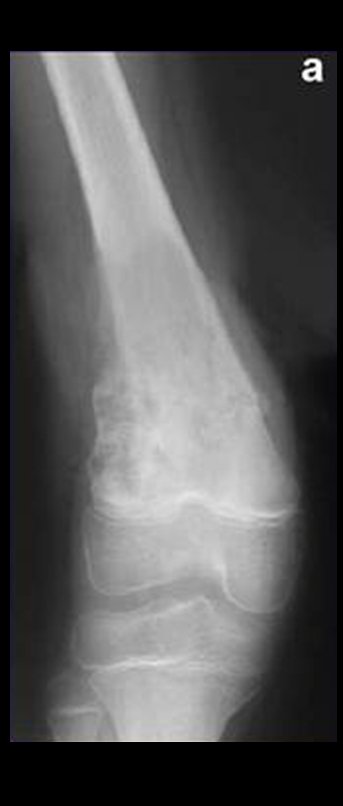
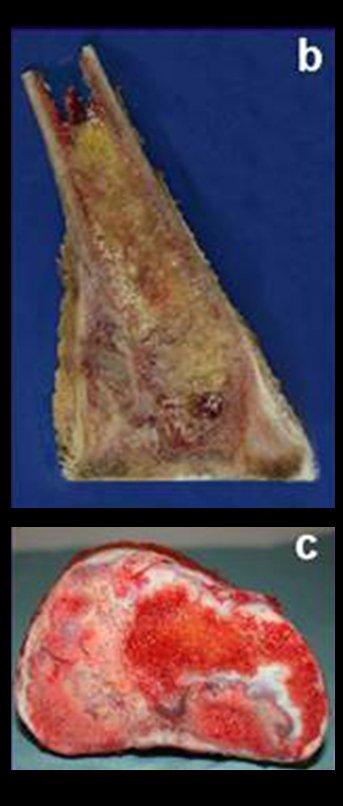
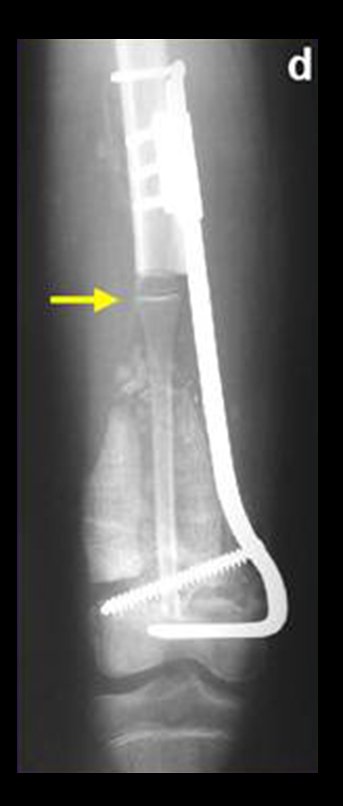
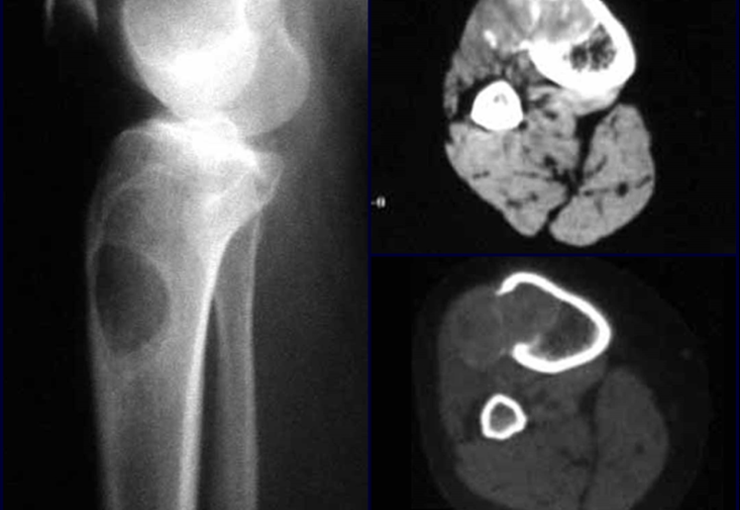
Via de acesso medial ao quadril para ressecção das lesões tumorais
Via de acesso medial ao quadril. As vias de acesso para abordagem medial do quadril descritas na literatura têm-se mostrado insuficientes para o tratamento dos tumores que afetam, simultaneamente, as regiões anterior, medial e posterior. Os autores descrevem uma via de abordagem medial, por uma inguinotomia, que facilita a ressecção dos tumores dessa área. A desinserção da musculatura adutora constitui etapa importante desta técnica que possibilita exposição ampla e melhor manipulação dos tecidos. Não houve complicações pós-operatórias decorrentes do emprego dessa via nos nove casos em que foi empregada. As vantagens incluem: facilidade, rapidez, pequeno sangramento intra-operatório, segurança quanto às estruturas neurovasculares e a ampla exposição que proporciona.
A abordagem medial à articulação coxofemoral é utilizada com freqüência para o tratamento da luxação congênita do quadril e das afecções neuromusculares. Fora desse âmbito, seu uso é limitado e as técnicas encontradas na literatura mundial são poucas quando comparadas às outras vias de acesso ao quadril, empregadas para as abordagens anterior, lateral e posterior.
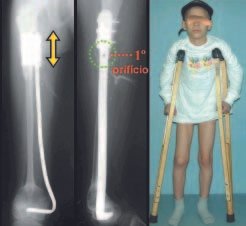
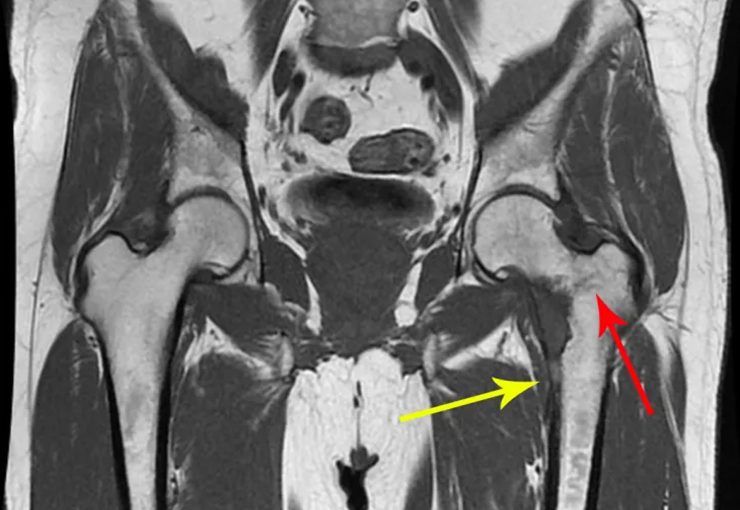
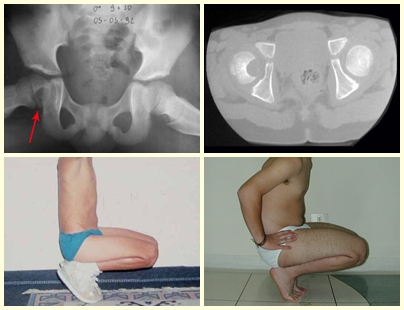
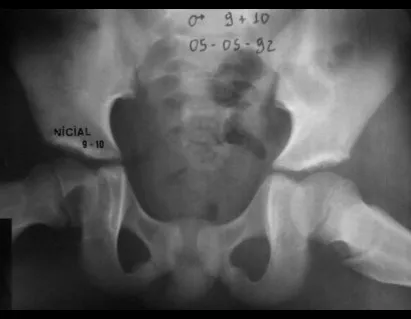
A partir de um caso de condromatose sinovial, que atingia as regiões anterior, medial e posterior do quadril (fig. 4, AL), o autor sênior passou a utilizar abordagem cirúrgica por inguinotomia medial, com desinserção da musculatura adutora, diferente das vias mediais descritas na literatura, pois estas não permitem, isoladamente, a exposição adequada da região.
O objetivo deste trabalho é descrever uma via de acesso medial ao quadril, por uma inguinotomia, com desinserção da musculatura adutora, que proporciona, simultaneamente, acesso amplo às regiões anterior, medial e posterior e facilita a ressecção dos tumores nesta localização.
MÉTODO
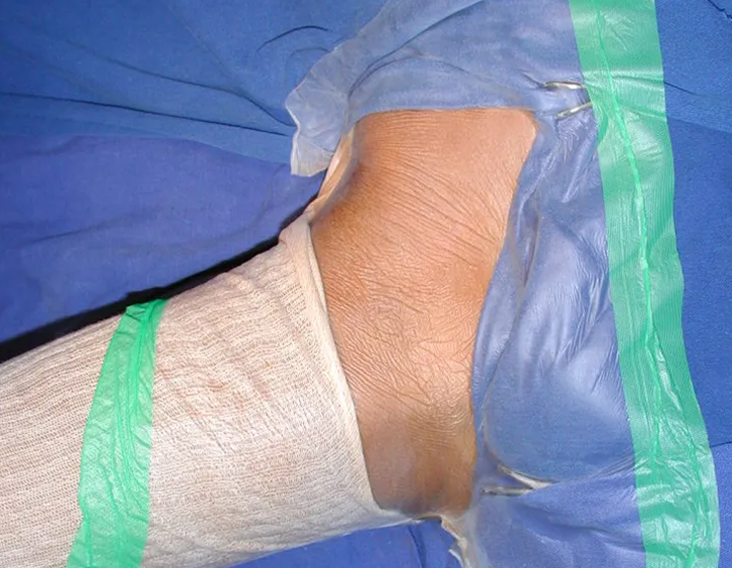
O paciente é colocado em decúbito dorsal horizontal. Ini-cia-se por assepsia de toda a região, incluindo o abdome, o dorso e o períneo, além de todo o membro inferior, que é preparado para permitir livre movimentação durante o ato operatório, de forma a facilitar o acesso às regiões anterior e posterior através dos movimentos de rotação externa e inter-na (fig. 4D). Posiciona-se o membro inferior do lado afetado em flexão, abdução e discreta rotação externa, posição semiginecológica (fig. 1). A incisão na pele inicia-se medialmente à palpação do pulso da artéria femoral, vai em direção ao tubérculo púbico, ponto de inserção do ligamento inguinal no púbis e centro da incisão, e prolonga-se posteriormente em direção à tuberosidade isquiática (fig. 2). A seguir, pro-cede-se à dissecção através do tecido celular subcutâneo, cauterizando os pequenos vasos (fig. 3, A e B). A incisão da fáscia tem o mesmo sentido que a da pele. Continua-se com a desinserção do músculo pectíneo do ramo iliopúbico, dos músculos adutor longo, adutor curto e grácil do púbis e parte do músculo adutor magno do ramo isquiopúbico (fig. 3, C e D). O nervo obturatório, que passa entre o músculo pectíneo e o adutor longo, fica protegido quando essa musculatura é rebatida (fig. 3D). O músculo psoas ilíaco é descolado da cápsula articular e isolado até a confluência dos vasos circunflexos, permitindo a maior exposição possível (fig. 3, E e F). A essa altura, um afastador do tipo Langembeck ou Hom-man é posicionado sob o psoas ilíaco de forma a afastar e proteger o nervo e os vasos femorais. Realiza-se uma incisão na porção medial da cápsula articular (fig. 3G) e pode-se dar continuidade com a ressecção tumoral ou com o procedimento em questão (fig. 3H). A cápsula é fechada com fio absorvível. Coloca-se dreno aspirativo e reinsere-se a musculatura adutora, ancorando-a no periósteo. O tecido celular subcutâneo e a pele são fechados com pontos simples (fig. 4G). Não é necessária a realização de nenhum tipo de imobilização pós-operatória.
DISCUSSÃO
As técnicas de Ludloff(9), Zazepen & Gamidov(13) e Fer-gusson(3) têm sido tradicionalmente empregadas para a abordagem cirúrgica medial do quadril. Estas vias de acesso, en-
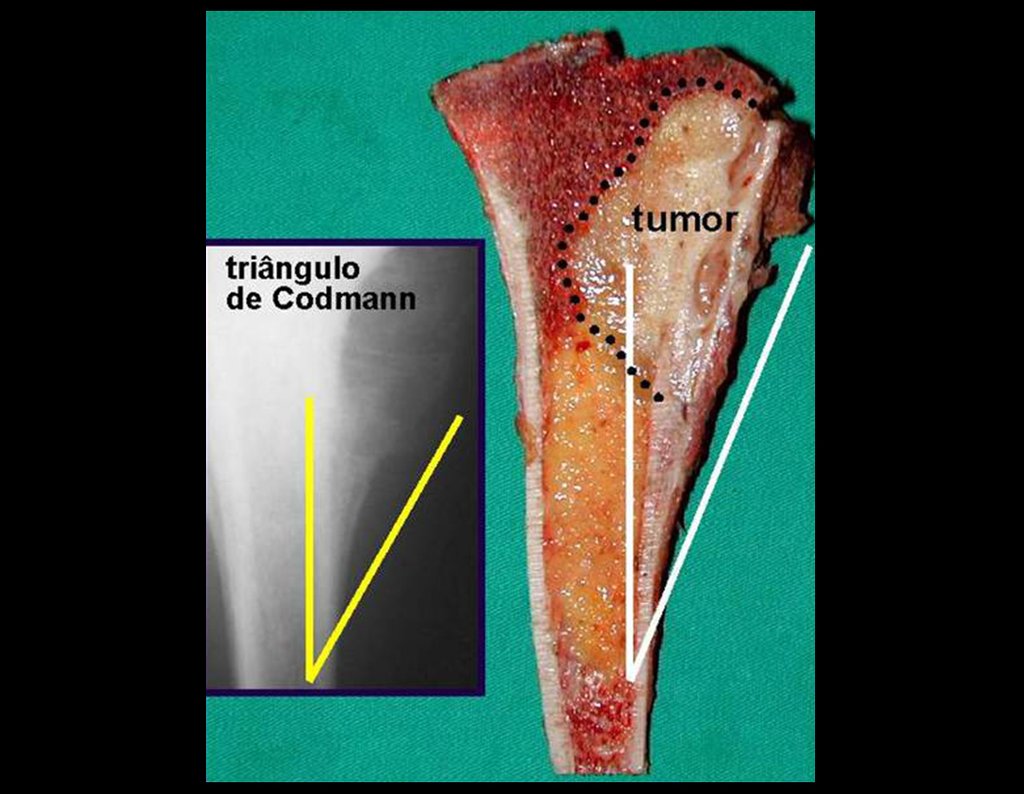
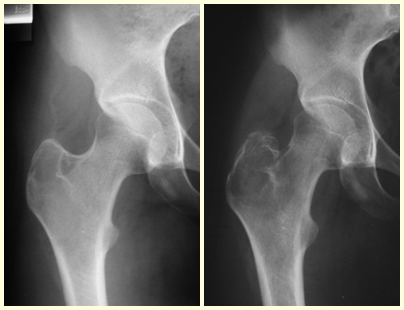
tretanto, nem sempre atendem às necessidades de exposição ampla para ressecção com margem adequada de tumores nessa localização (figs. 2, A e B; 3, A e C), pois os músculos adutores, quando afastados, não possibilitam um campo visual satisfatório, principalmente no adulto.
A via de Smith-Petersen(12) permite acesso à região ânte-ro-medial do quadril quando a articulação é colocada em flexão e rotação externa máxima, mas não expõe a região pós-tero-medial. Nas vias posteriores(2,4,7), a parede posterior do acetábulo pode dificultar a exposição adequada da cabeça femoral. Em casos extremos, a alternativa que resta ao cirurgião é a luxação do quadril, procedimento perigoso quanto à preservação da circulação da cabeça femoral. Em crianças, há ainda a preocupação com a fise de crescimento. Esses fatores levaram-nos a buscar uma técnica que permitisse, com maior facilidade, a exposição da região, visando manipulação menos traumática para os tecidos. A via lateral com osteotomia do trocanter maior(6), embora permita acesso anterior e posterior, não expõe a região medial.
A abordagem medial ao quadril que estamos descrevendo pode parecer arriscada em uma primeira impressão. Isto talvez devido a pensamento fundamentado em dois aspectos: primeiro, a proximidade dos vasos femorais e segundo, o emprego pouco freqüente, pelos ortopedistas, dos acessos mediais de modo geral. A experiência adquirida com as ressecções dos tumores do anel obturatório pela técnica de Radley et al.(11) e com a realização de hemipelvectomias(8) possibilitou a visibilização desse acesso e permitiu a extrapolação das técnicas empregadas nesses casos para o tratamento dos tumores da região medial do quadril.
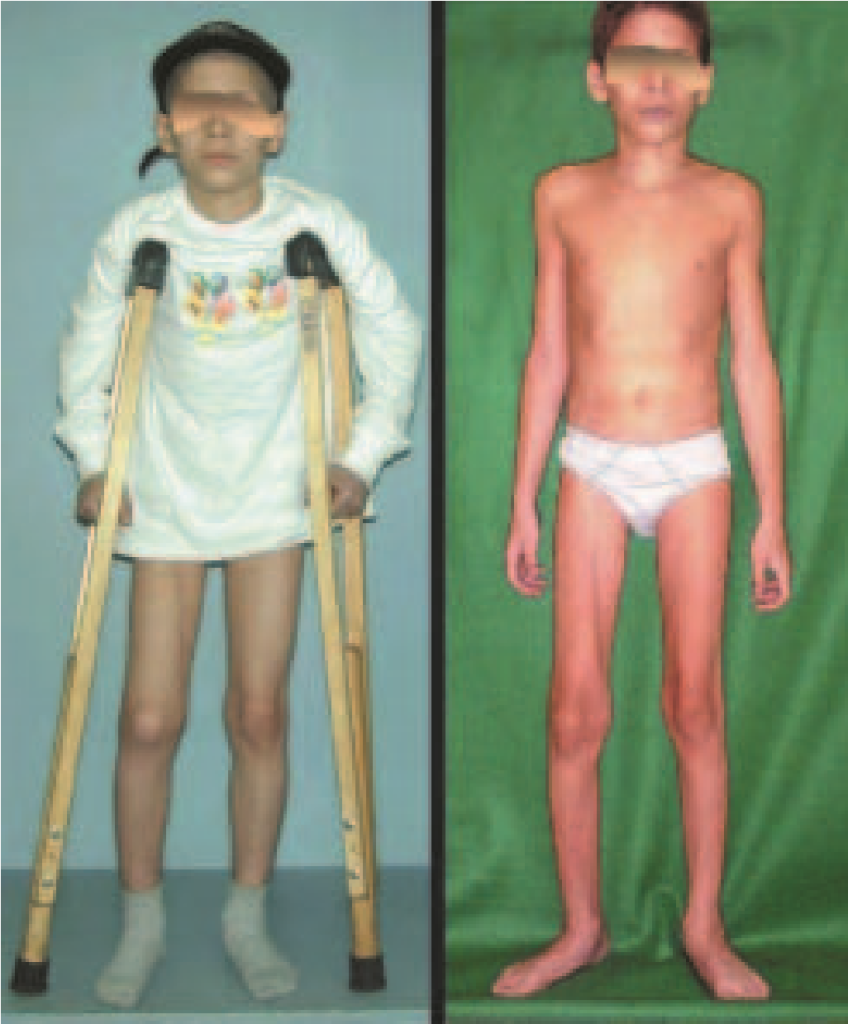
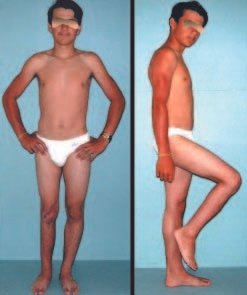
As vantagens da inguinotomia são várias. A via não necessita de grandes descolamentos nem de osteotomias, fatores que aumentam a morbidade pós-operatória. A preocupação intra-operatória com os grandes vasos femorais torna-se minimizada, pois eles, quando afastados, estão protegidos e, com a flexão do quadril, anteriorizam-se, distanciando-se da região. O sangramento intra-operatório é pequeno. O senti-do da incisão corre paralelamente às linhas de Langerhans, propiciando, portanto, boa cicatriz. A tensão da pele no pósoperatório é mínima na posição de repouso do paciente, em que os membros estão normalmente em adução. O local da incisão é facilmente coberto pelas roupas (inclusive as de banho) e pelos pêlos pubianos. O aspecto cosmético é o melhor possível (figs. 5 e 6).
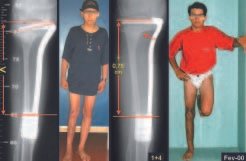
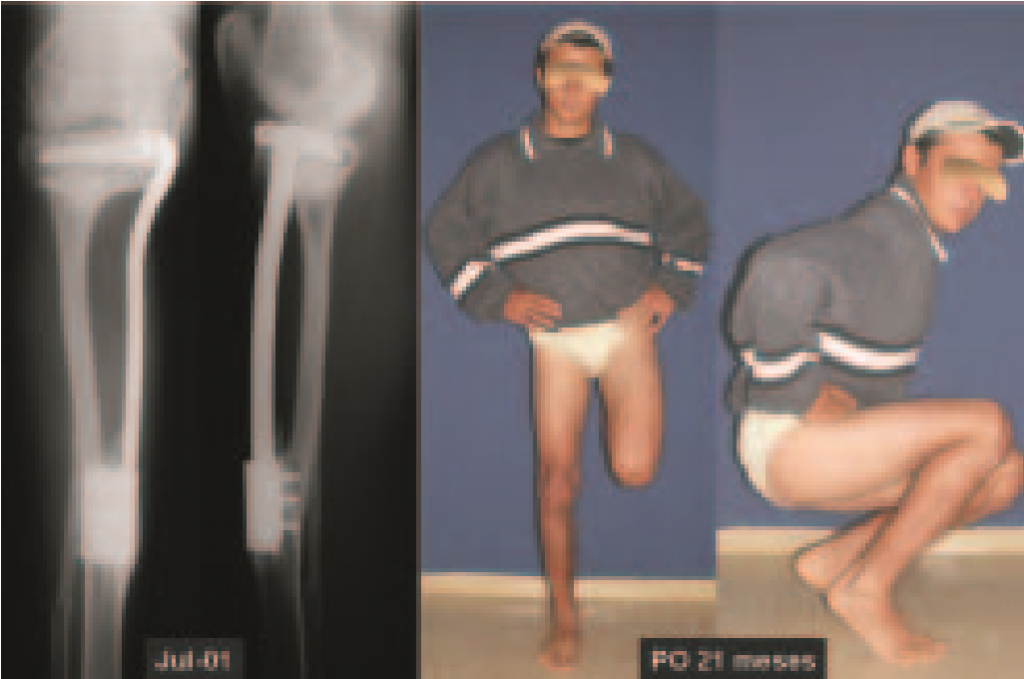
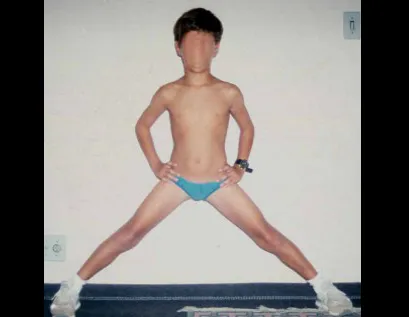
Foram tratados nove pacientes (tabela 1) portadores de tumor no quadril, operados através da via descrita. Todos os pacientes apresentavam algum grau de limitação articular, havendo melhora em todos os casos após a cirurgia. Não fo-ram encontradas complicações decorrentes da utilização dessa via de acesso. A desinserção da musculatura adutora não determinou nenhum déficit de força de adução ou limitação da abdução (fig. 4, H-L). Não houve alterações da sensibilidade no pós-operatório. A musculatura adutora é reinserida no periósteo de forma semelhante à reinserção da musculatura abdominal na crista ilíaca realizada nos procedimentos para retirada de enxerto.
A desinserção da musculatura adutora é um ponto fundamental para permitir exposição ampla, haja vista que, à medida que ela é rebatida distalmente, permite a colocação dos afastadores de forma estável, facilitando a atuação dos auxiliares. Essas condições são importantes no que se refere a critérios oncológicos para ressecção tumoral, tendo em vista que a manipulação excessiva dos afastadores tem o potencial de espalhar células neoplásicas, aumentando o risco de recidiva.
Os critérios oncológicos para a margem de ressecção das lesões tumorais muitas vezes impõem ao cirurgião o sacrifício de estruturas neurovasculares. No que se refere à abordagem que estamos descrevendo, a ligadura dos vasos circunflexos é ocasionalmente necessária. Este procedimento, quando realizado em situações em que já há comprometimento da irrigação endostal, como nos casos de epifisiolise e fraturas de colo do fêmur, aumenta o risco de necrose da cabeça femoral. Entretanto, no caso de ressecções tumorais, quando é possível preservar os vasos endostais, o risco é menor.
A finalidade deste trabalho é apresentar uma via de acesso à articulação coxofemoral, ressaltando que ela é fácil, rápida e segura. Sua utilização não está restrita ao tratamento de tumores da região medial do quadril. Seu emprego pode es-tender-se a outras indicações, como a cirurgia da luxação congênita do quadril, ressecção-biópsias, sinovectomias e retirada de corpos estranhos (como projéteis de arma de fogo). A nosso ver, esta é a melhor via para expor simultaneamente as regiões anterior, medial e posterior do quadril.
1. Capener, N.: The approach to the hip joint (editorial). J Bone Joint Surg [Br] 32: 147, 1950.
2. Crenshaw, A.H.: Campbell’s Operative Orthopaedics, 8th ed., Vol. 1,
3. J.B. Mosby Year Book, 1992.
4. Ferguson Jr., A.B.: Primary open reduction of congenital dislocation of the hip using a median adductor approach. J Bone Joint Surg [Am] 55: 671, 1973.
5. Gibson, A.: Posterior exposure of the hip joint. J Bone Joint Surg [Br] 32: 183, 1950.Hardinge, K.: The direct lateral approach to the hip joint. J Bone Joint Surg [Br] 64: 17, 1982.
6. Harris, W.H.: A new lateral approach to the hip. J Bone Joint Surg [Am] 49: 891, 1967.
7. Iyer, K.M.: A new posterior approach to the hip joint. Injury 13: 76, 1981.
8. King, D. & Steelquist, J.: Transiliac amputation. J Bone Joint Surg 25: 351, 1943.
9. Ludloff, K.: Zur blutigen Eihrenkung der Angeborenen Huftluxation. Z Orthop Chir 22: 272, 1908.
10. Osbourne, R.P.: The approach to the hip joint: a critical review and a suggested new route. Br J Surg 18: 49, 1930-1931.
11. Radley, T.J., Liebig, C.A. & Brown, J.R.: Resection of the body of the pubic bone, the superior and inferior pubic rami, the inferior ischial ramus, and the ischial tuberosity: a surgical approach. J Bone Joint Surg [Am] 36: 855, 1954.
12. Smith-Petersen, M.N.: A new supra-articular subperiostal approach to the hip joint. Am J Orthop Surg 15: 592, 1917.
13. Zazepen, S. & Gamidov, E.: Tumors of the lesser trochanter and their operative management. Am Dig Foreign Orthop Lit Fourth quarter: 191, 1972.
Autor : Prof. Dr. Pedro Péricles Ribeiro Baptista
Oncocirurgia Ortopédica do Instituto do Câncer Dr. Arnaldo Vieira de Carvalho
Consultório: Rua General Jardim, 846 – Cj 41 – Cep: 01223-010 Higienópolis São Paulo – S.P.
Fone:+55 11 3231-4638 Cel:+55 11 99863-5577 Email: drpprb@gmail.com