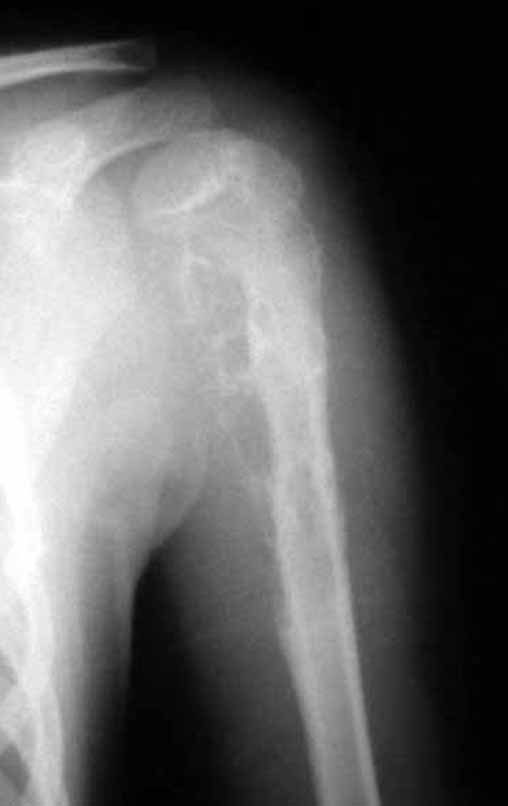
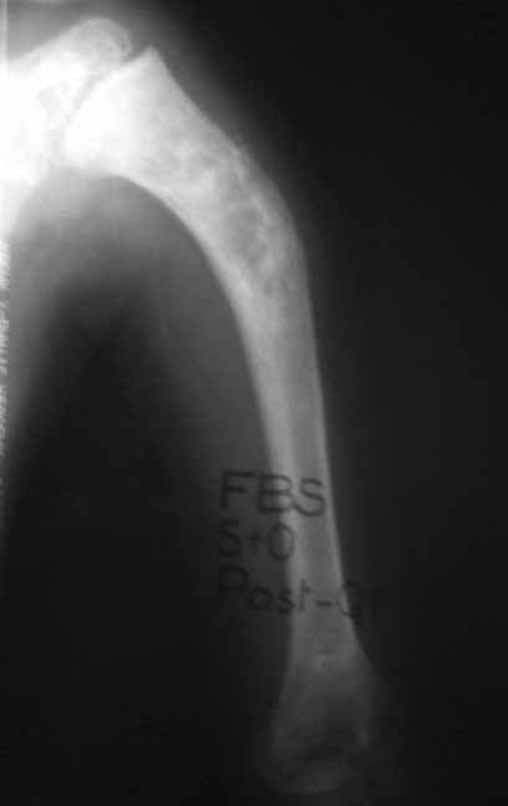
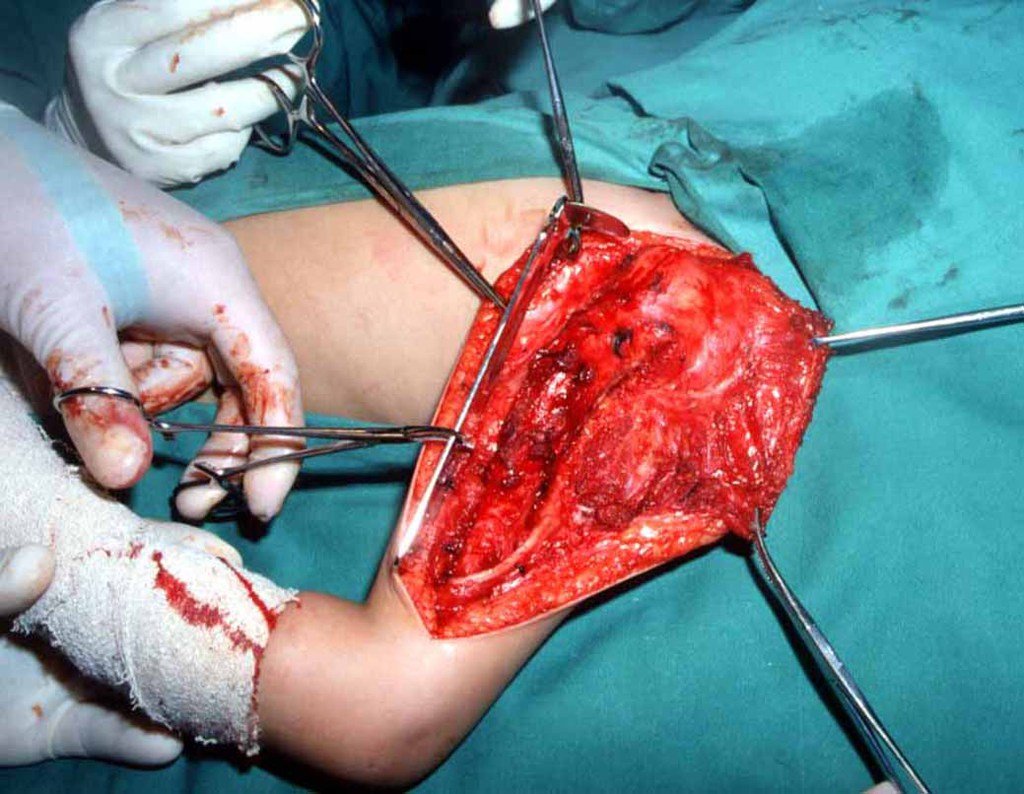
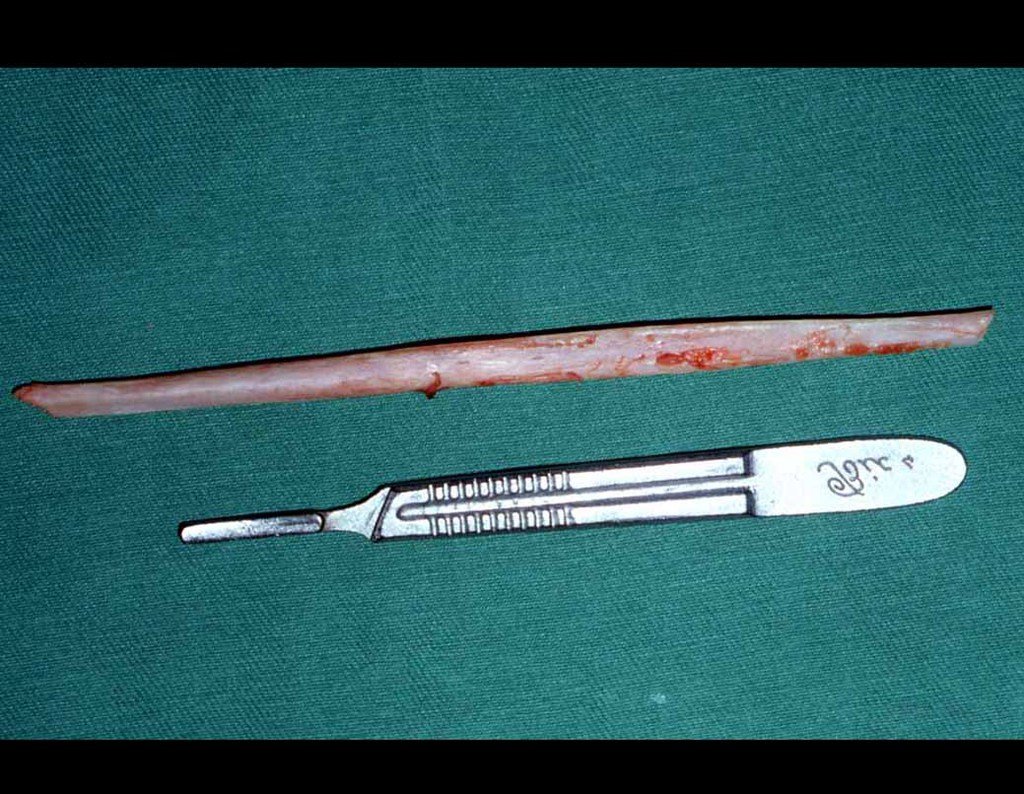
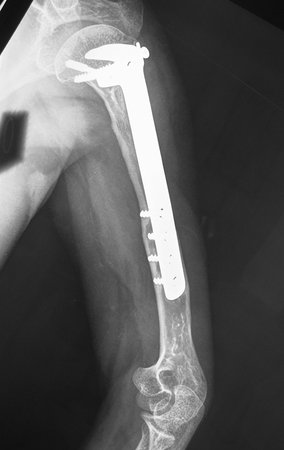
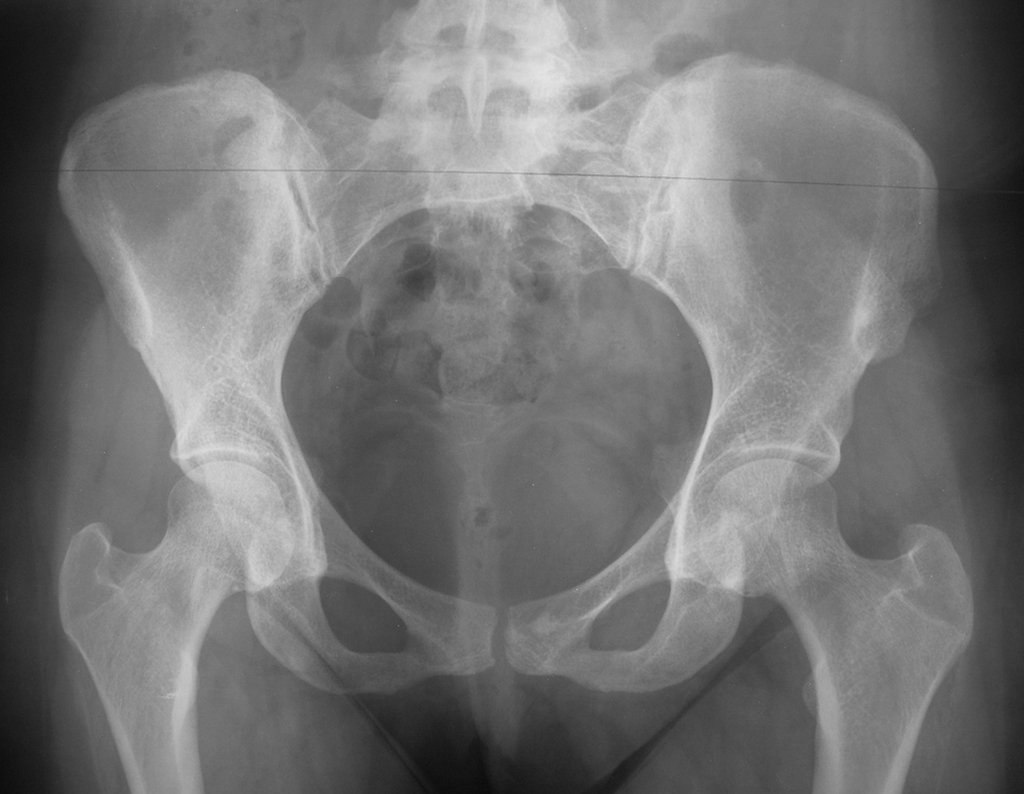
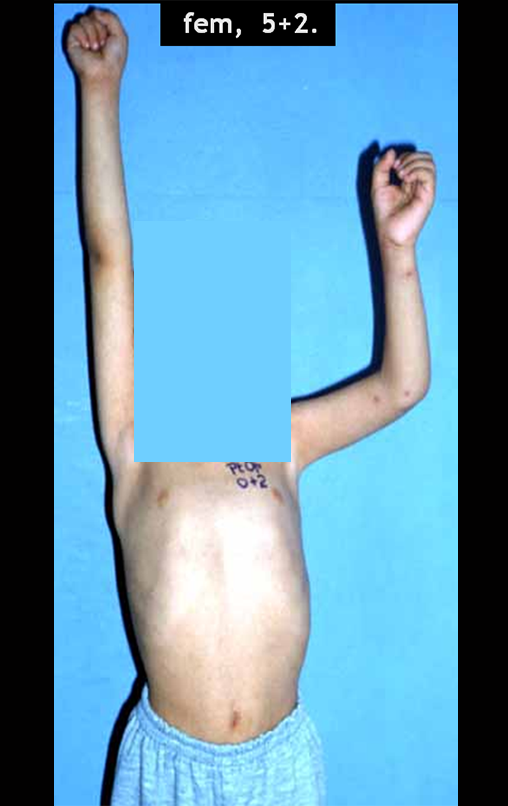
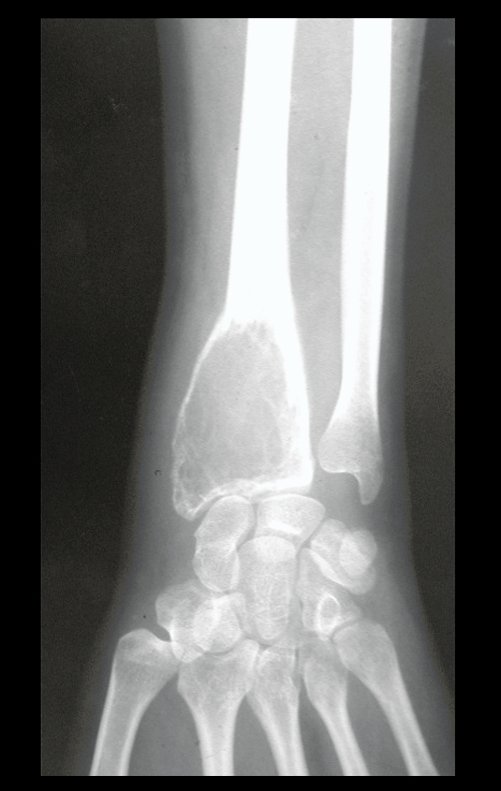
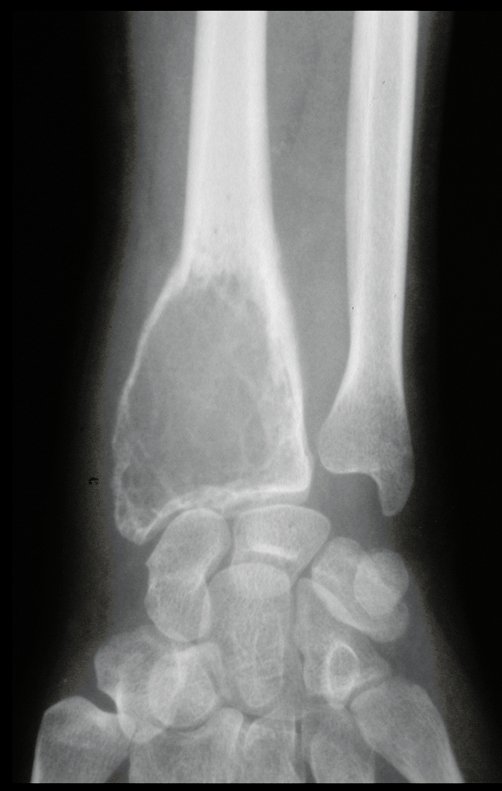
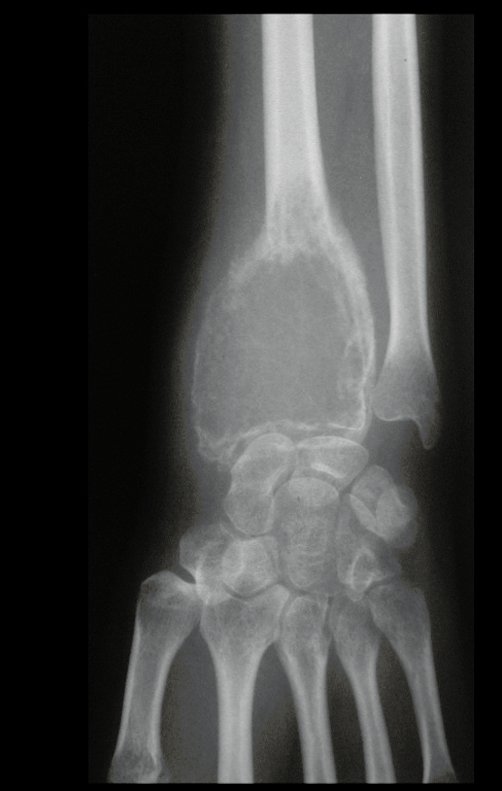
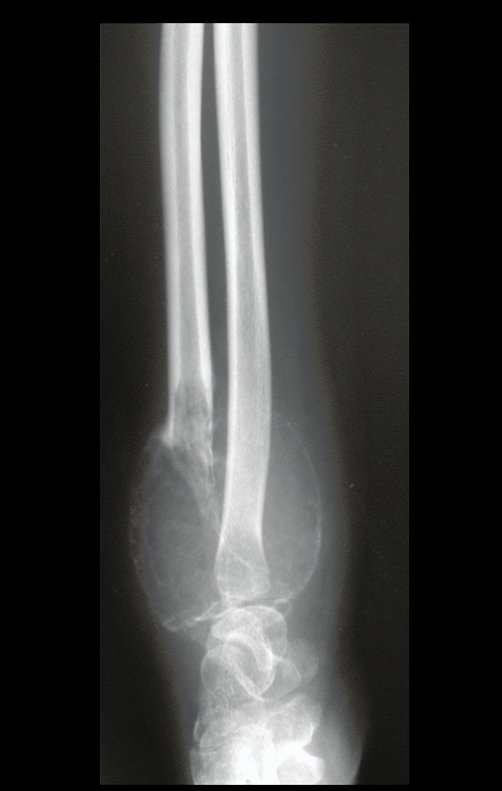
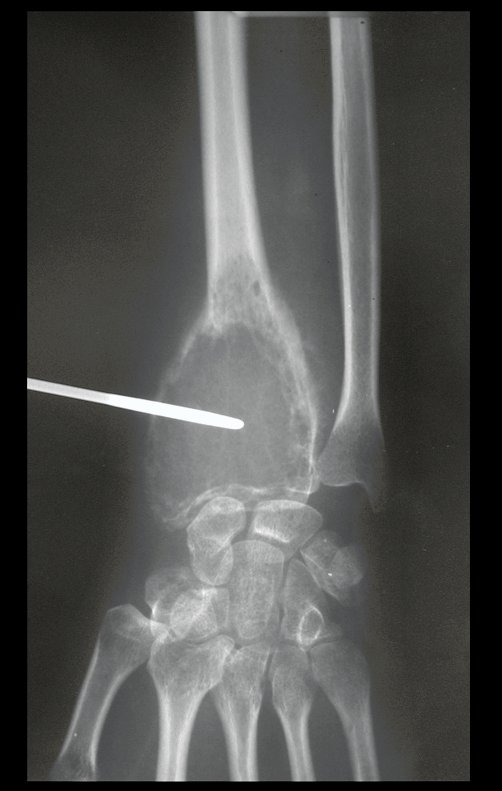
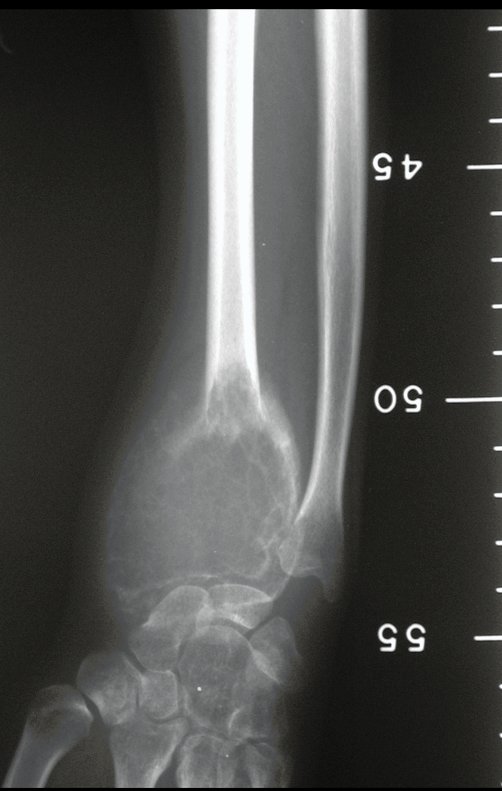
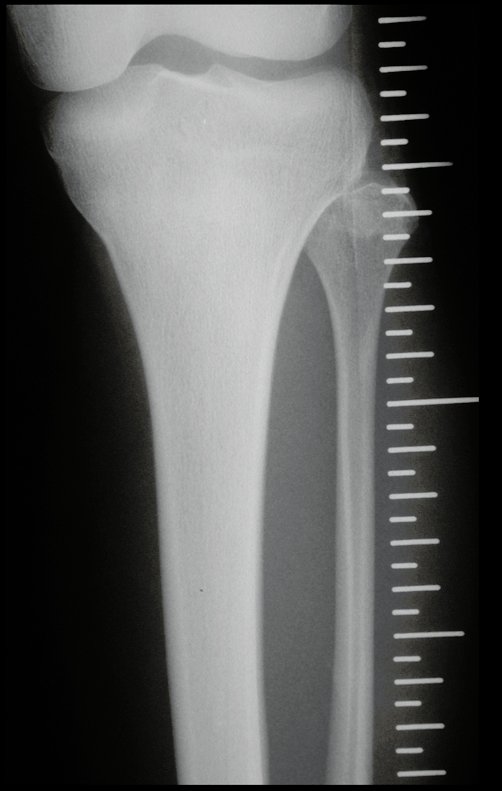
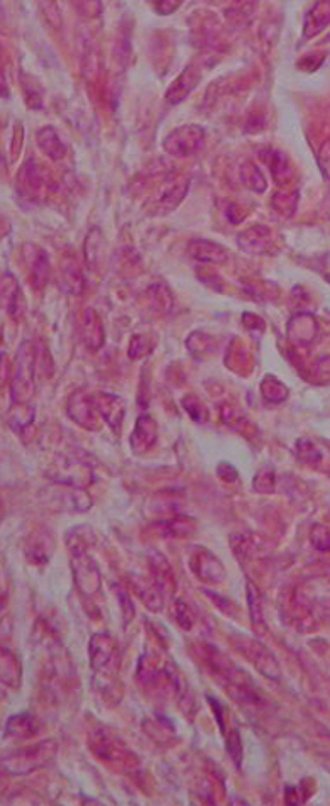
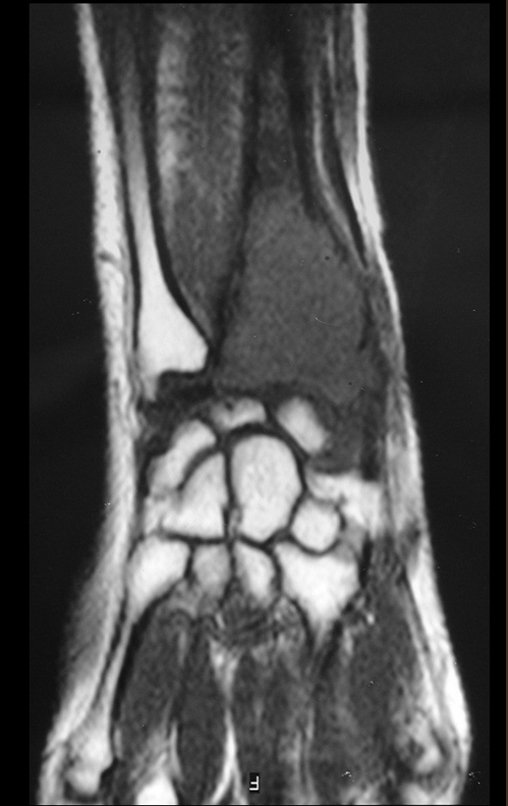
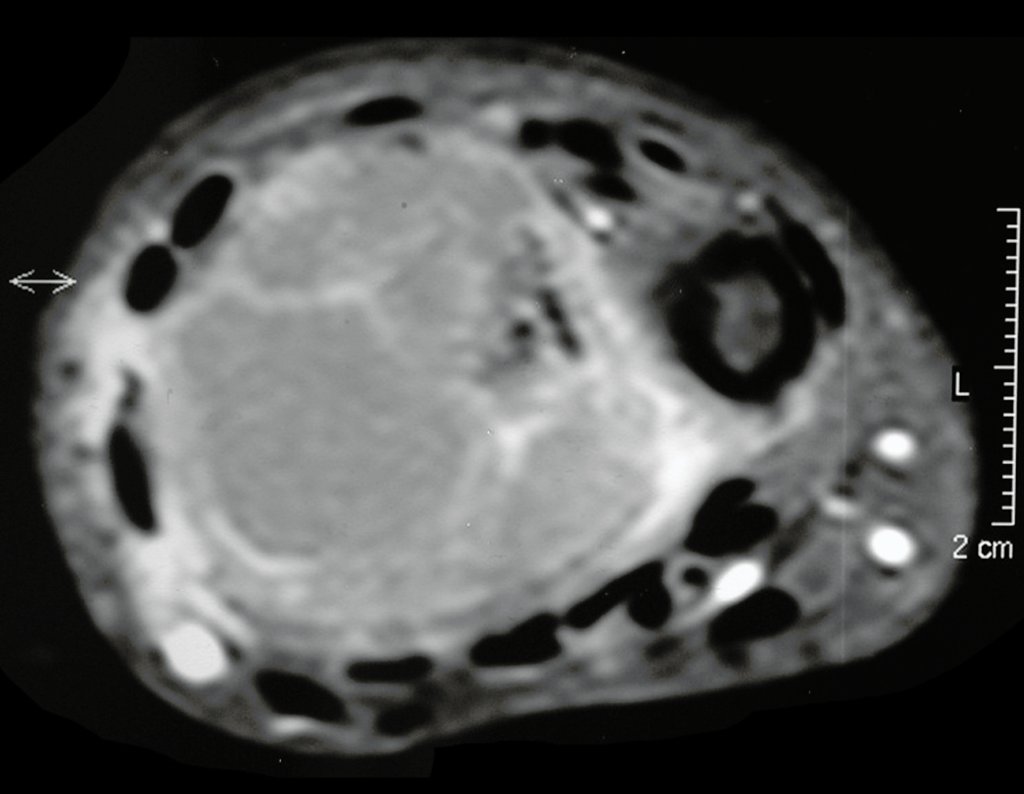
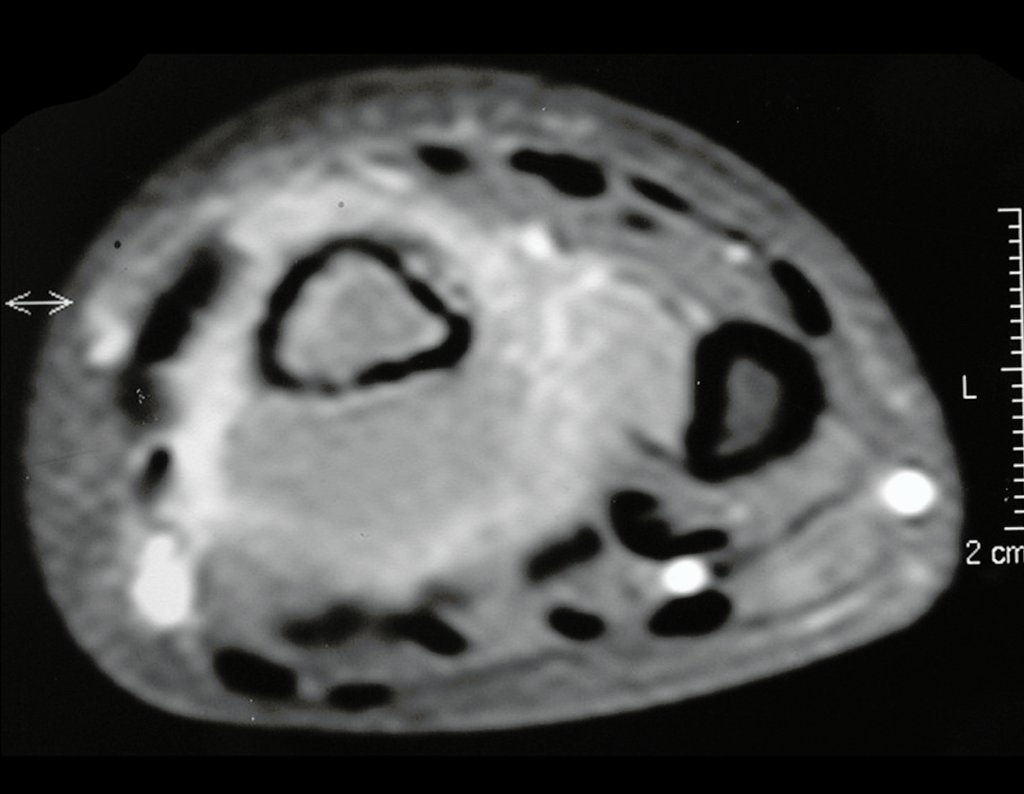
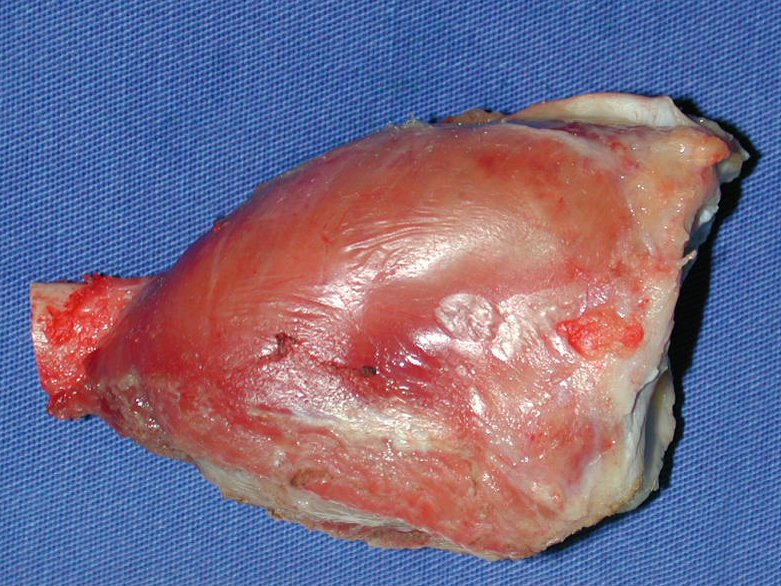
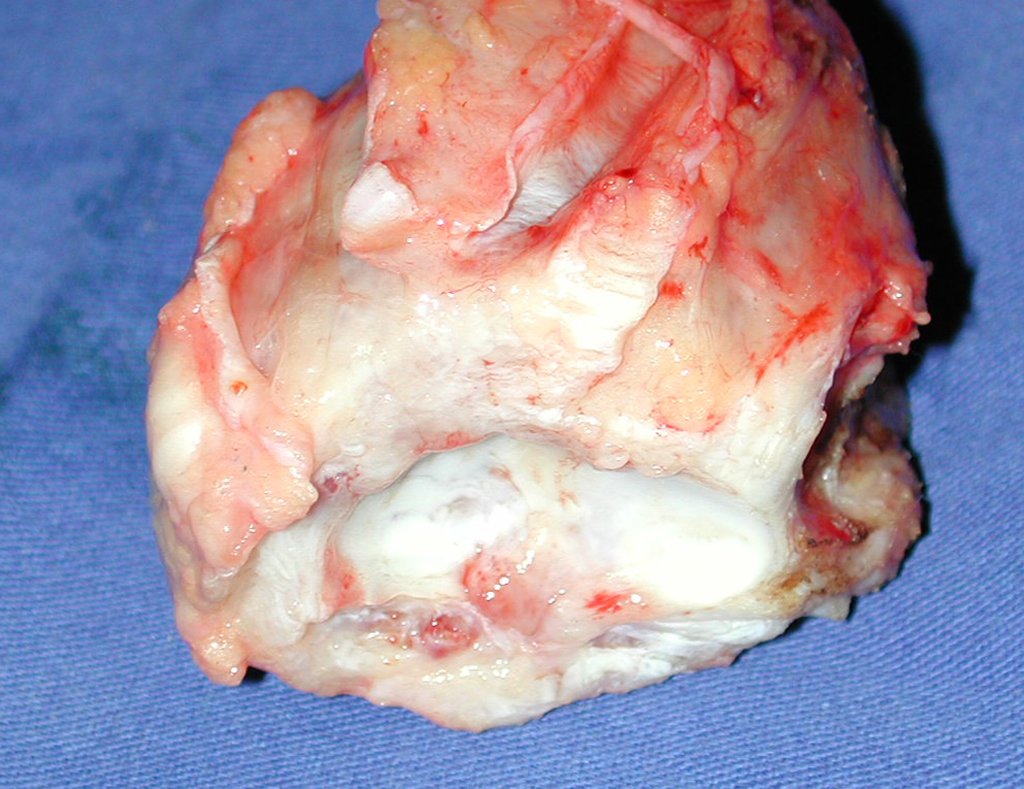
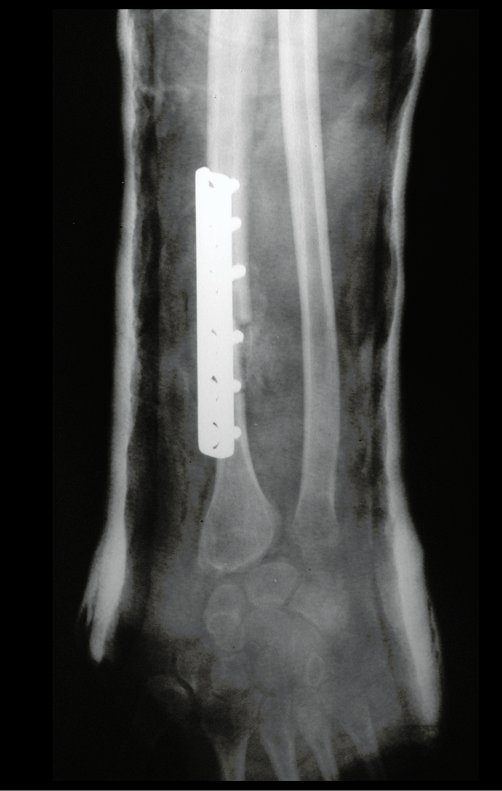
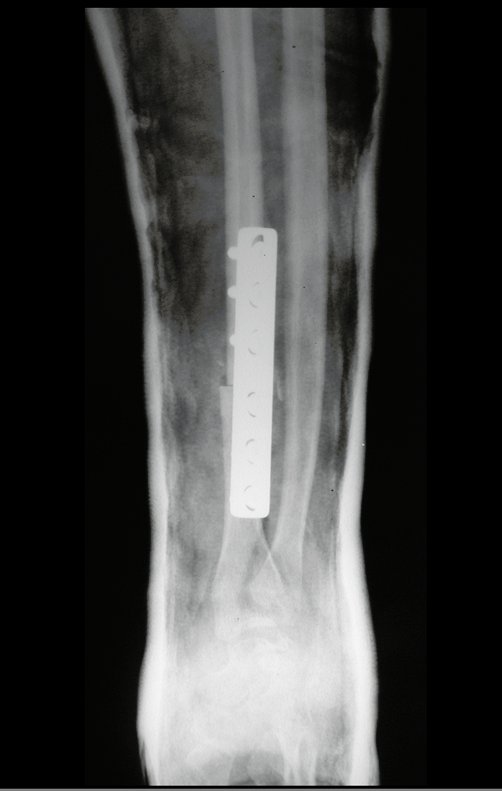
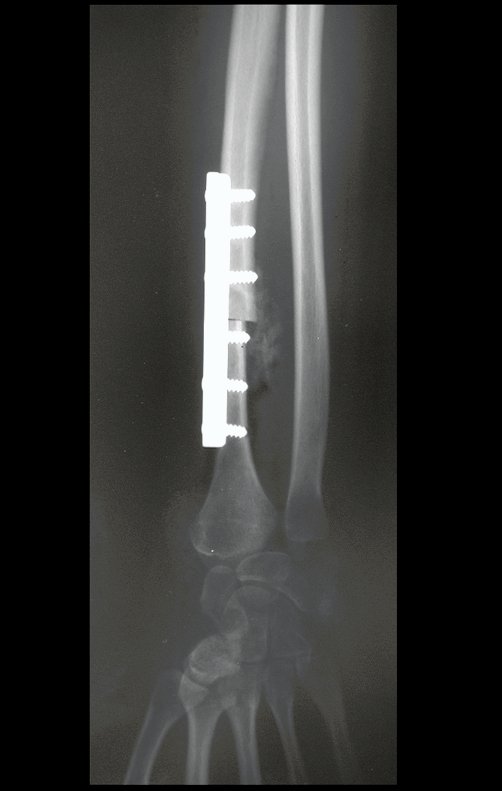
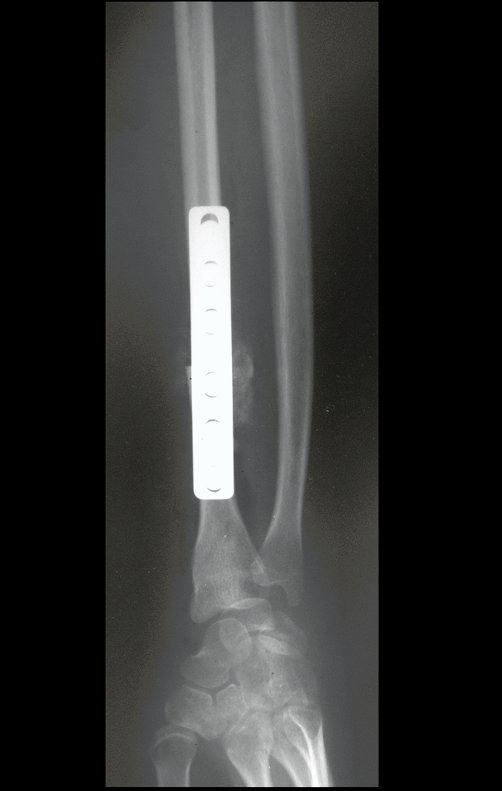
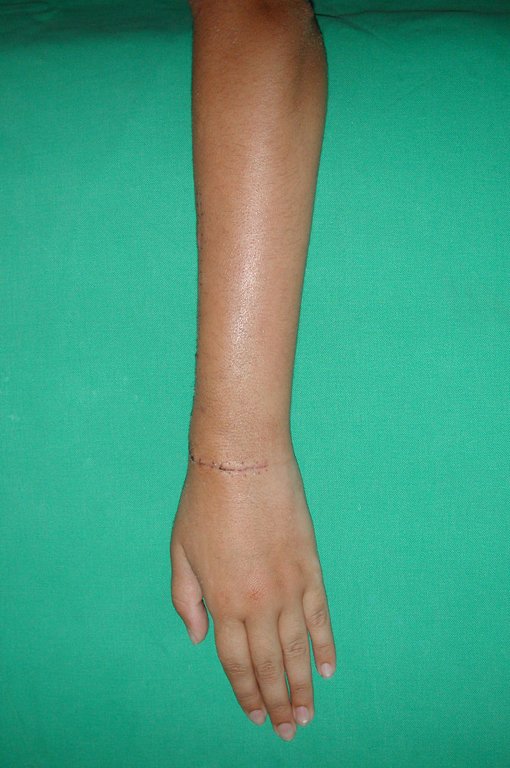
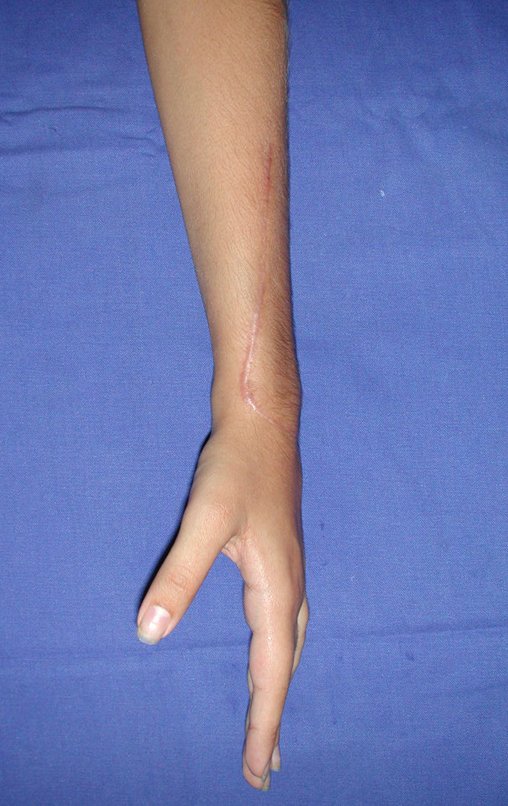
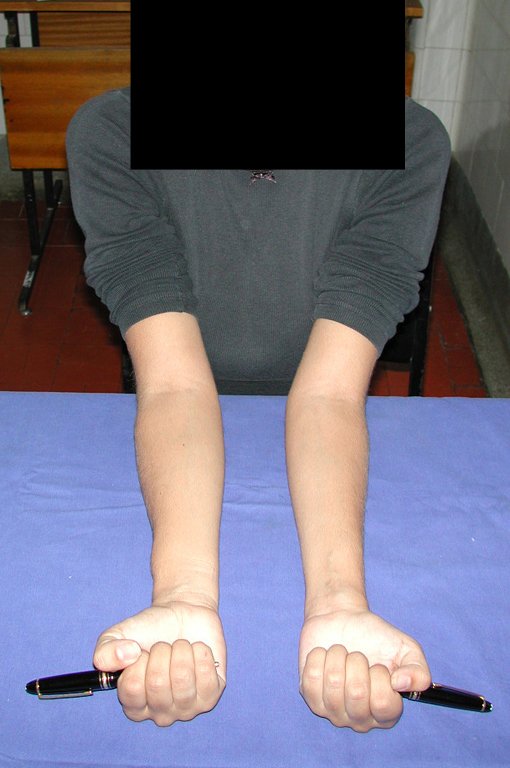
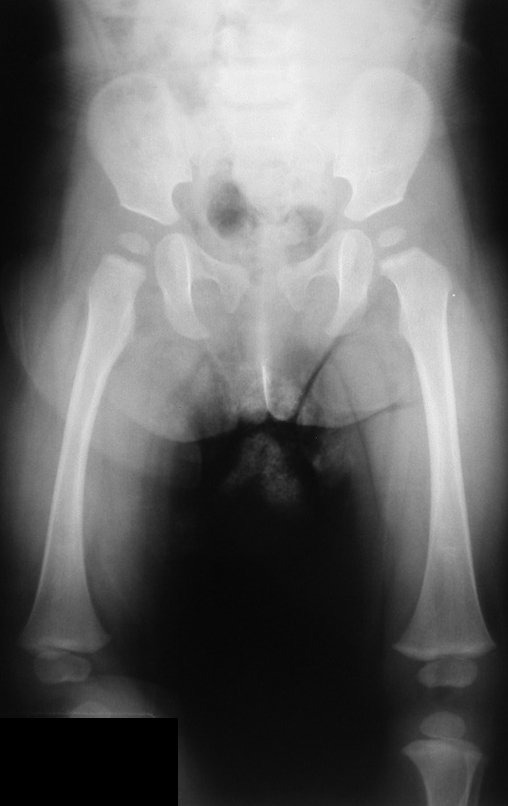
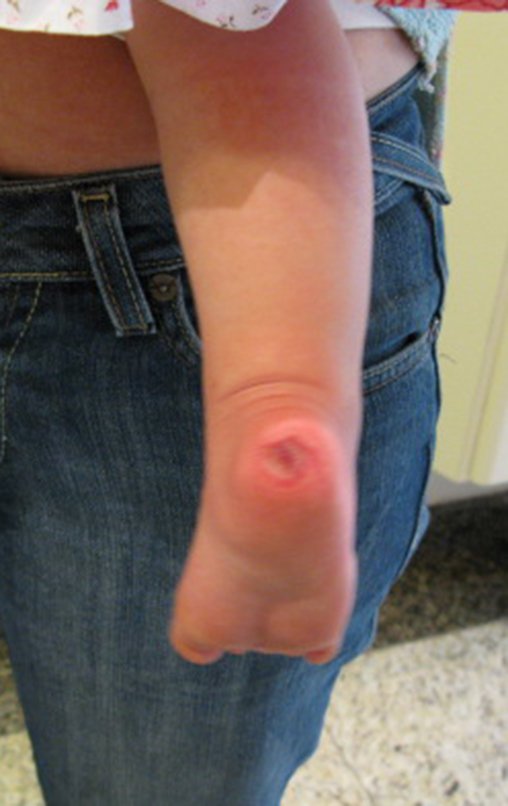
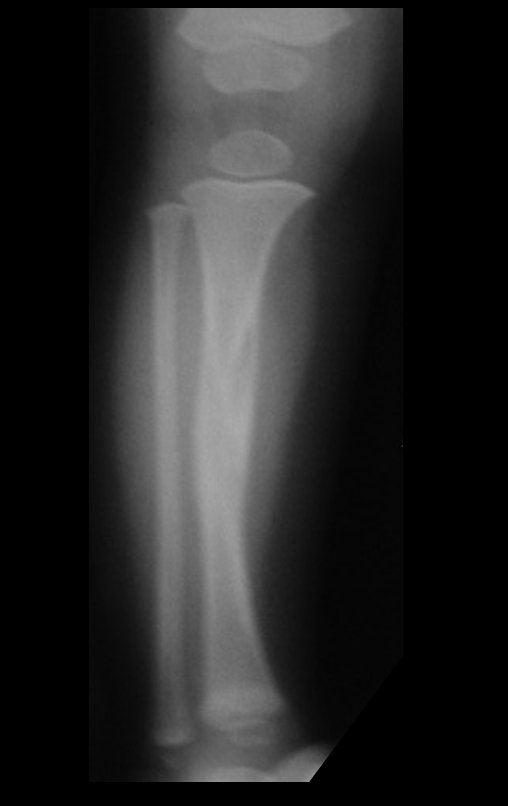
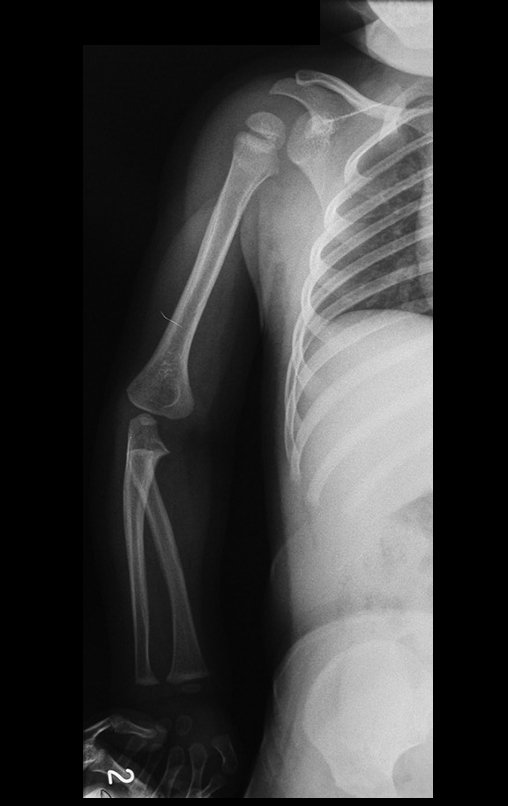
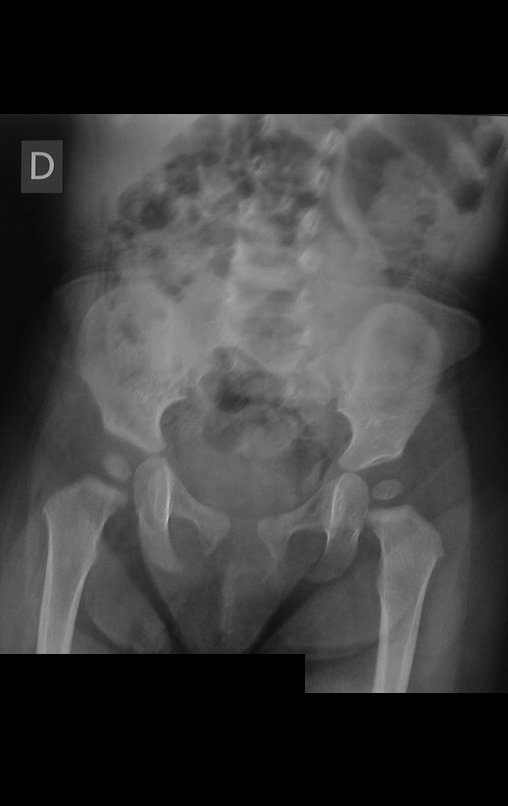
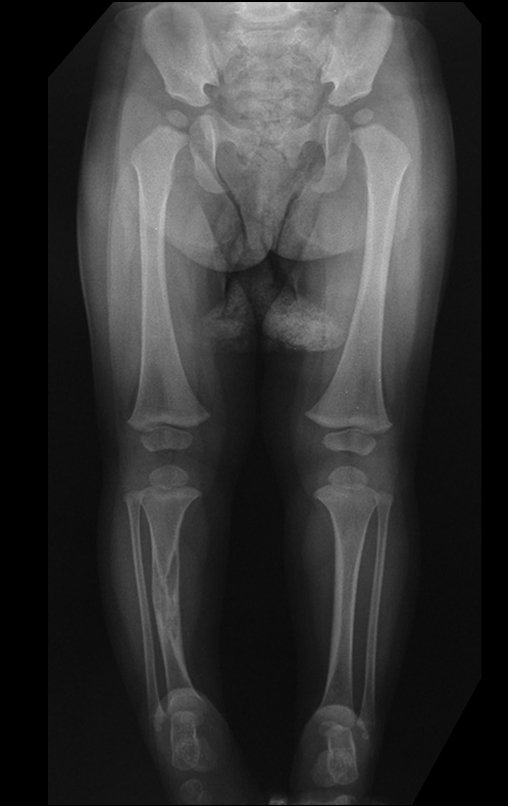
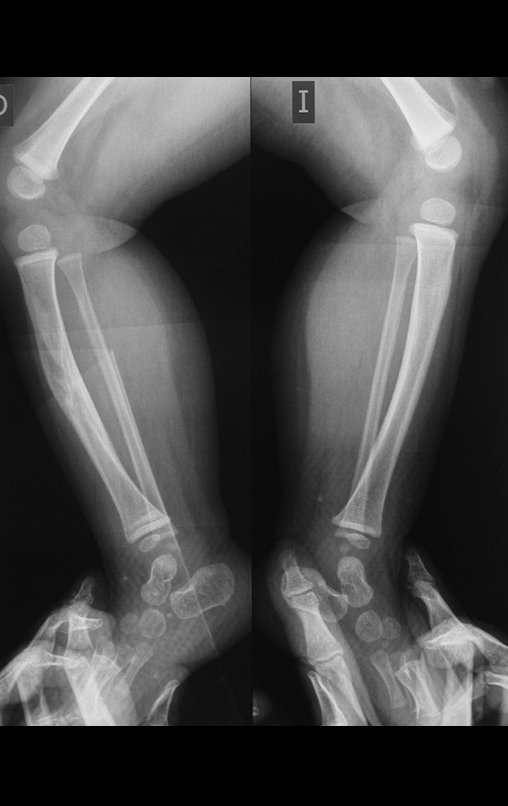
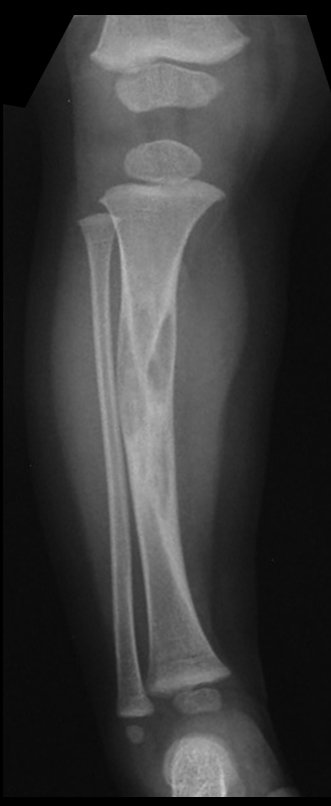
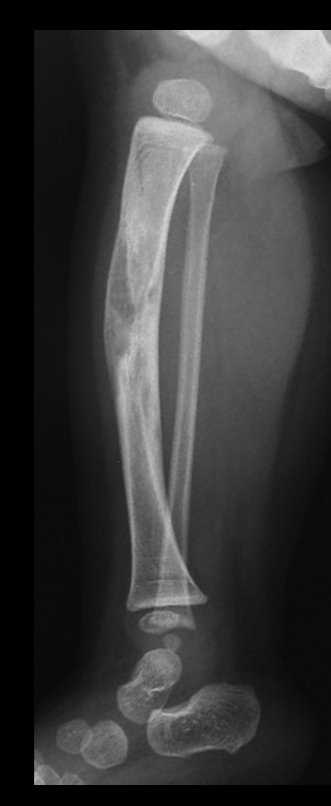
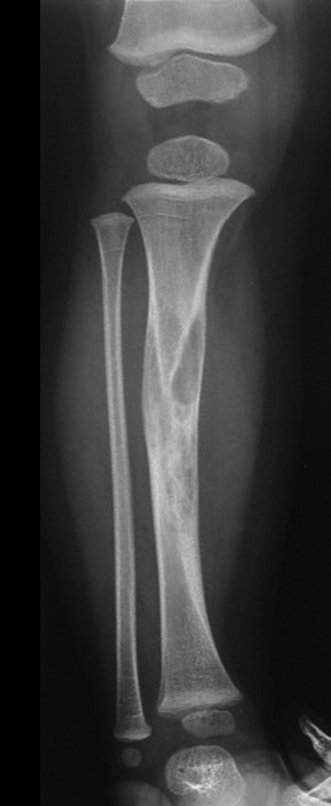
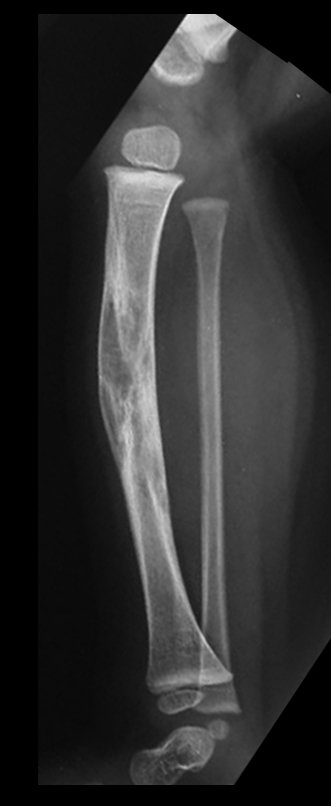
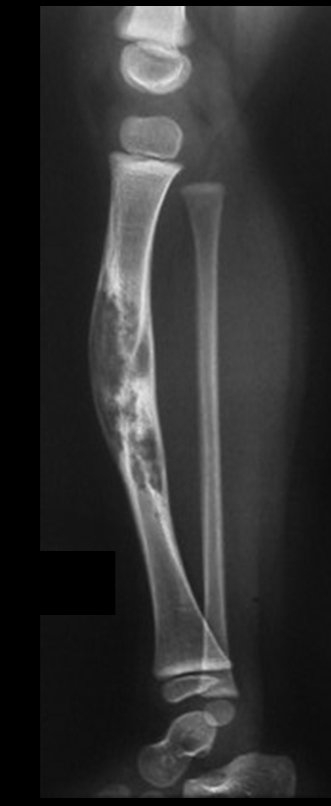
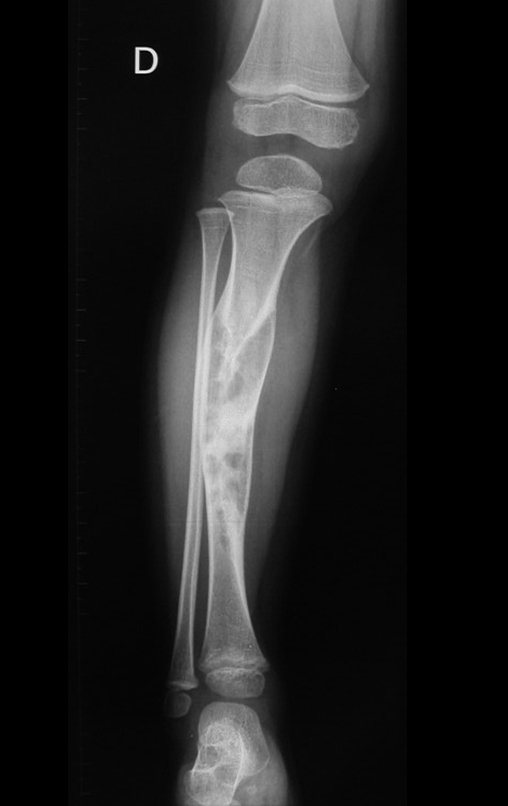
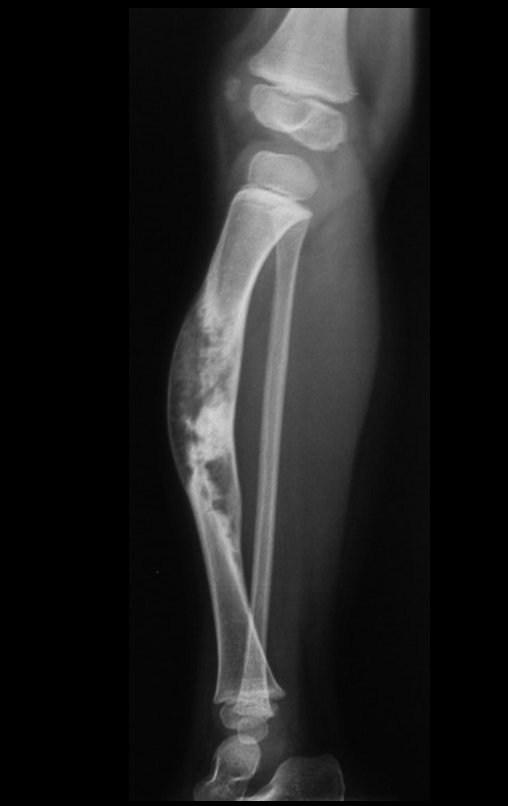
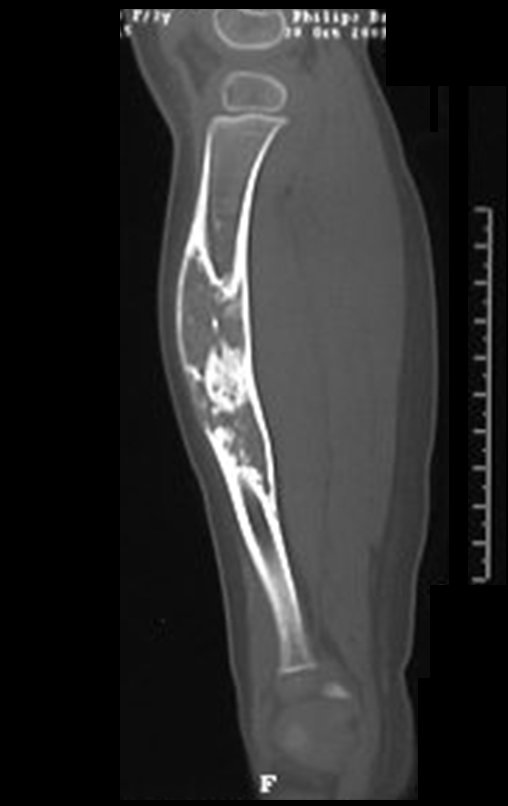
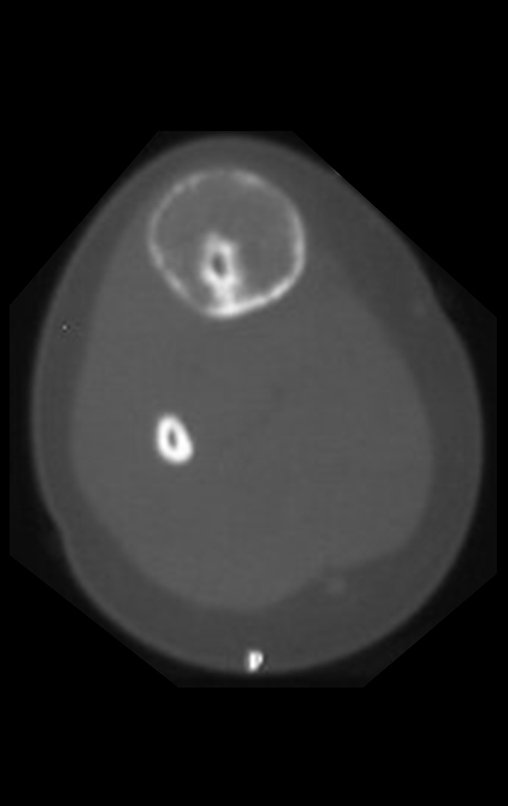
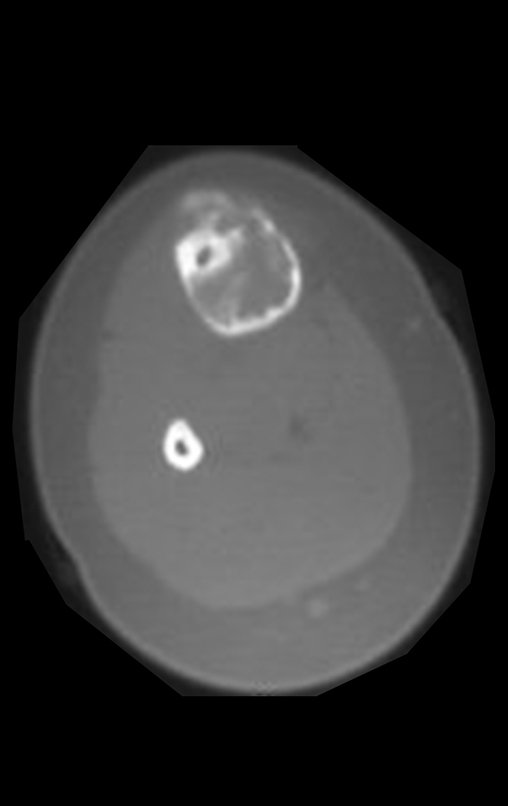
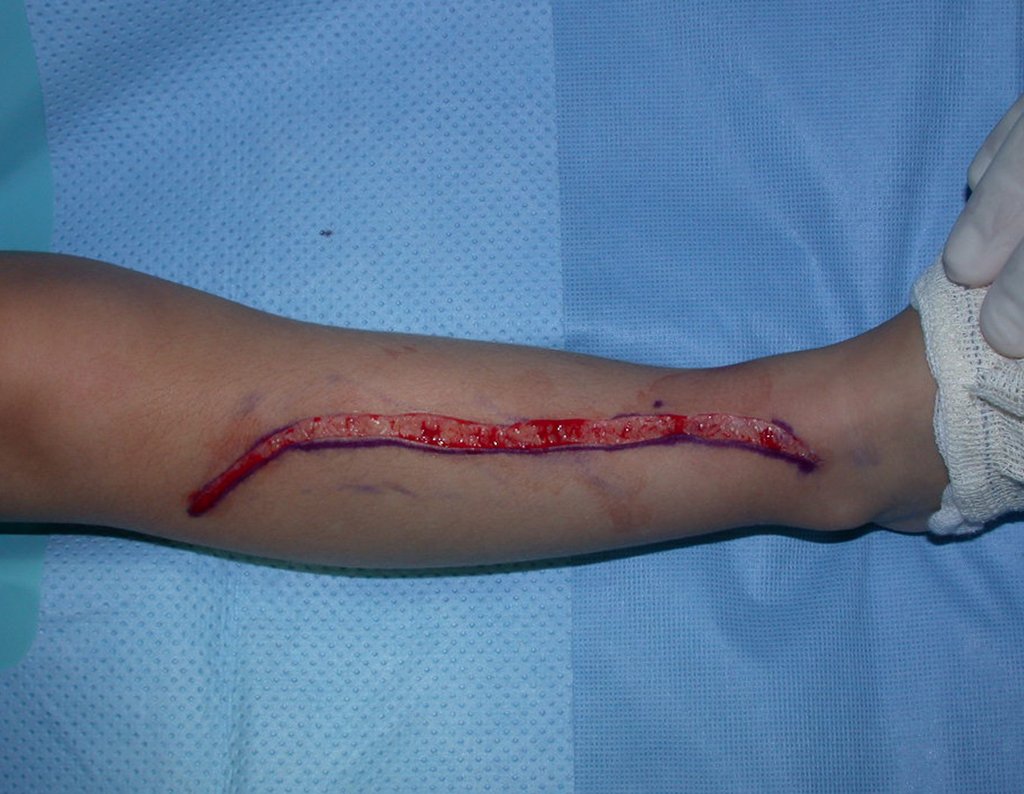
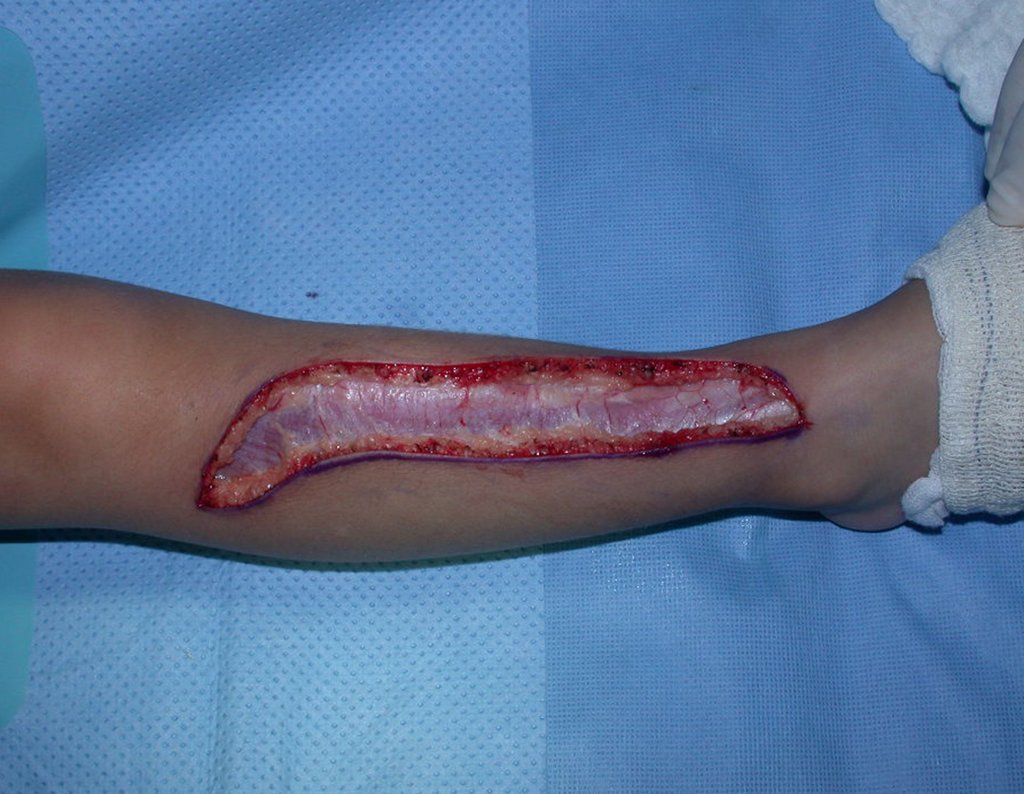
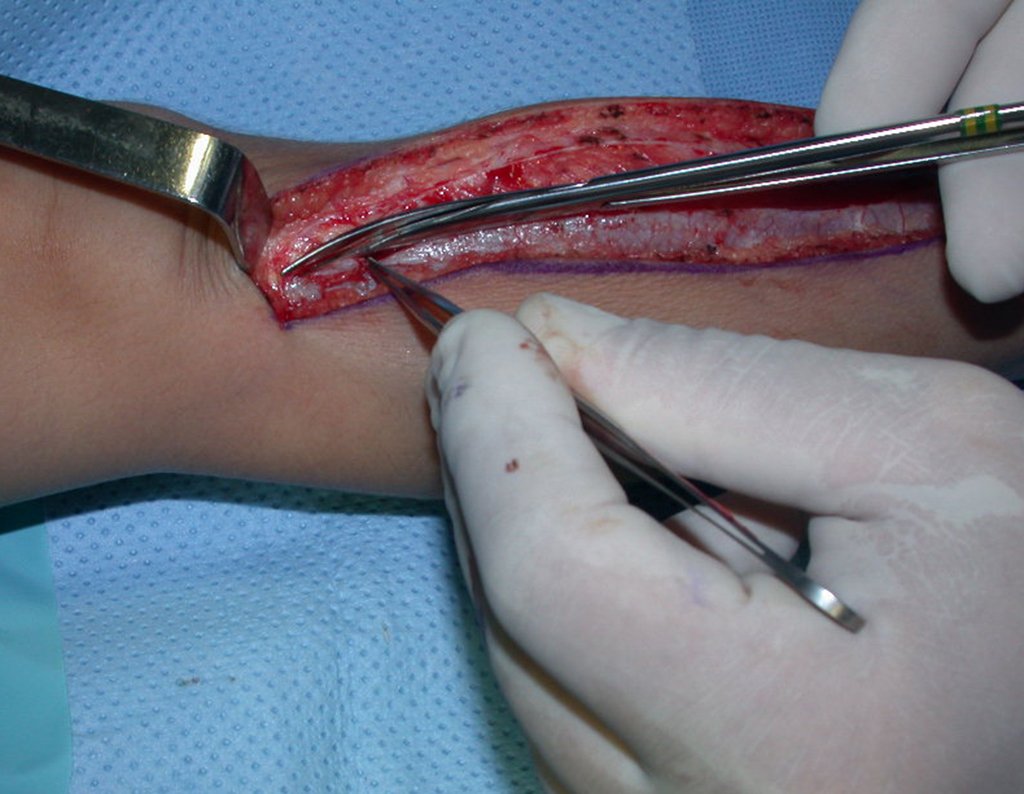
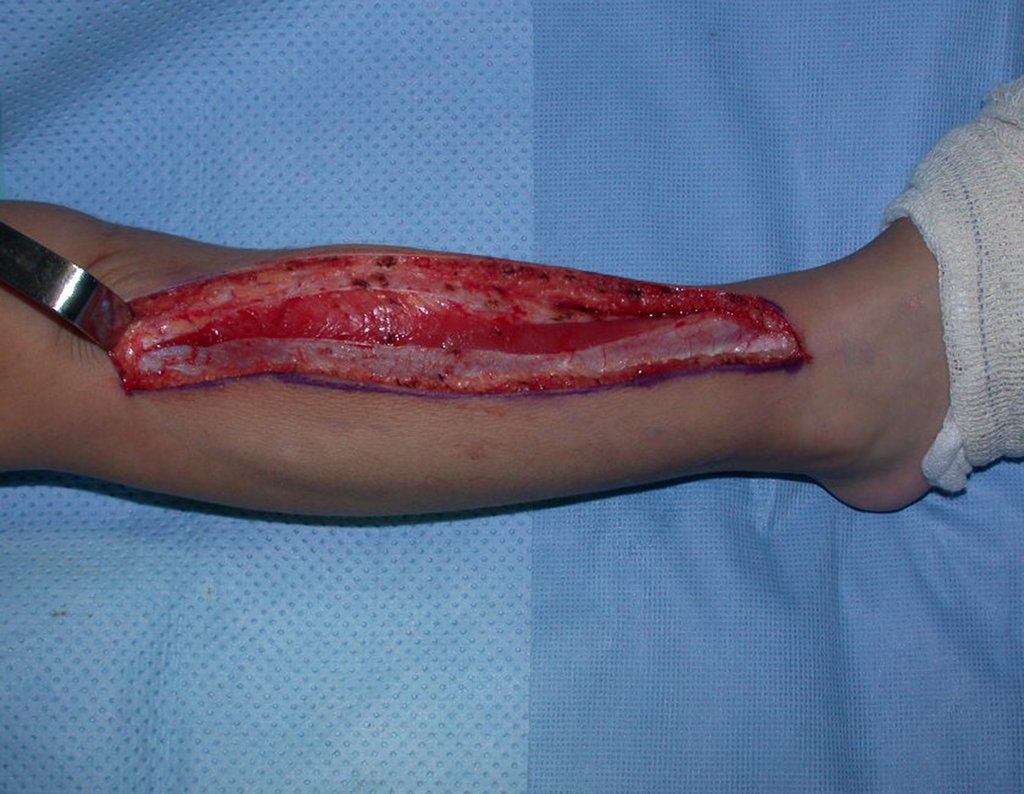
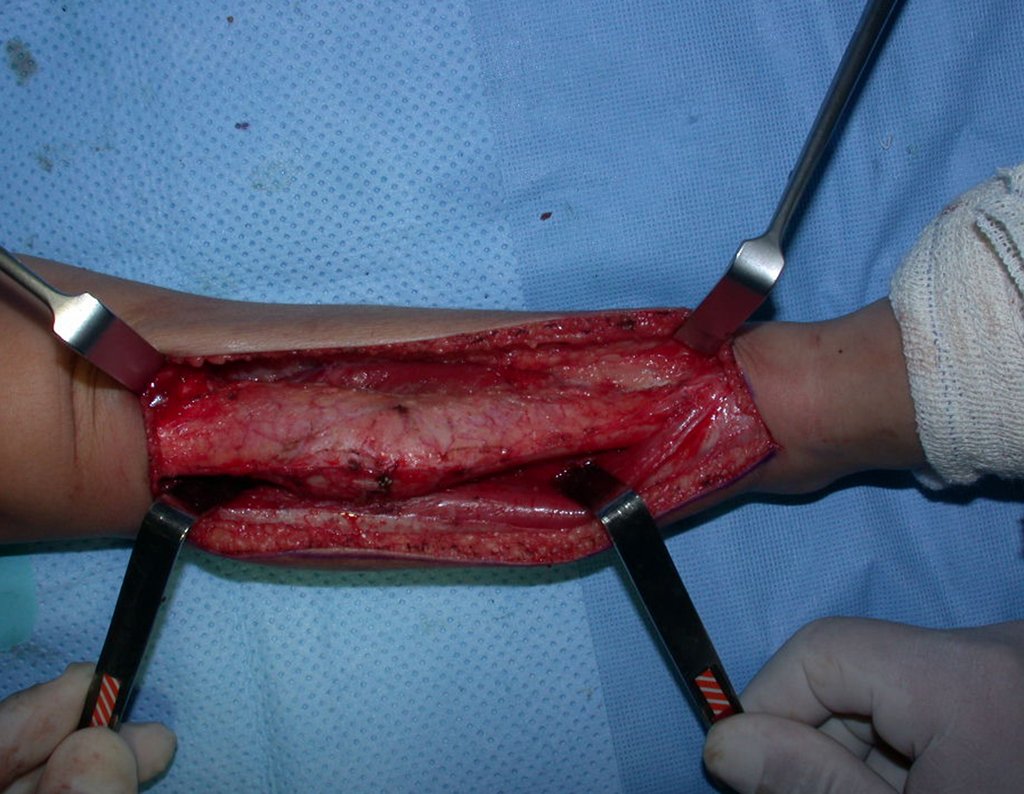
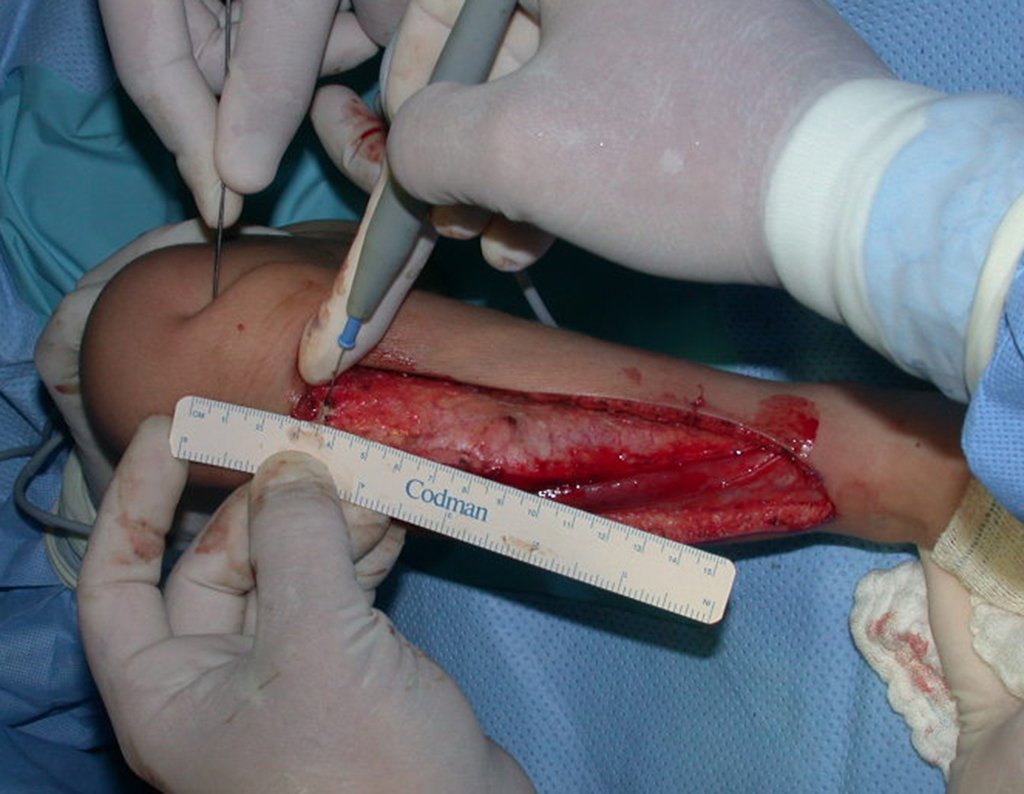
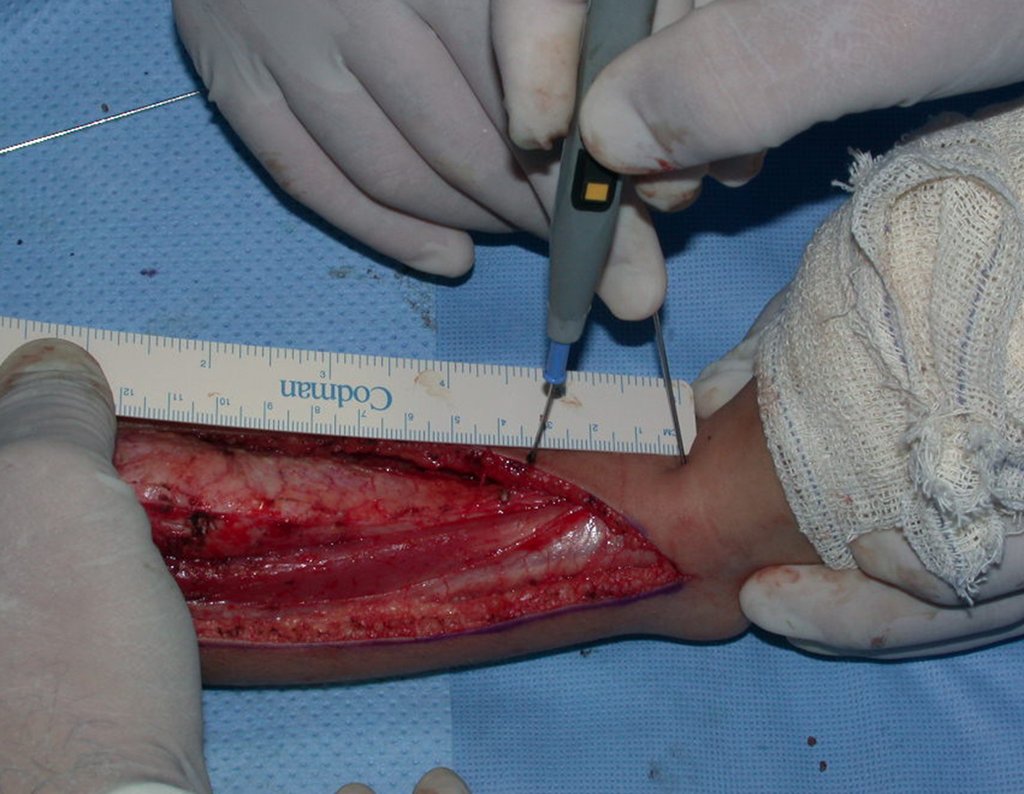
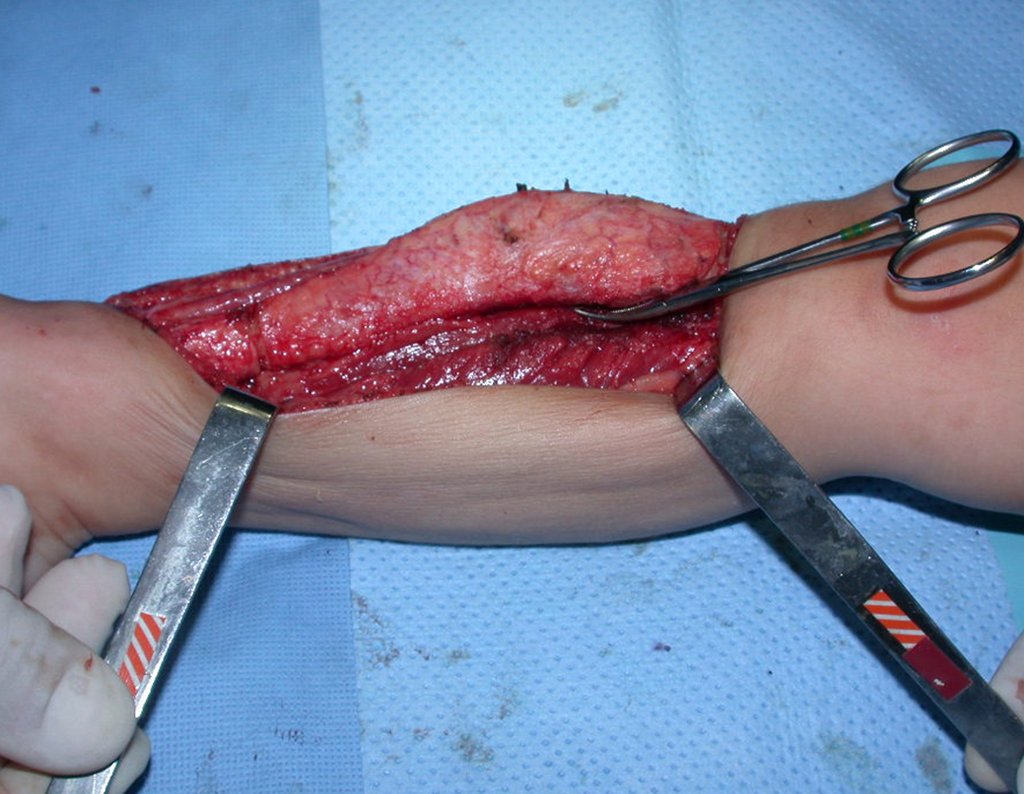
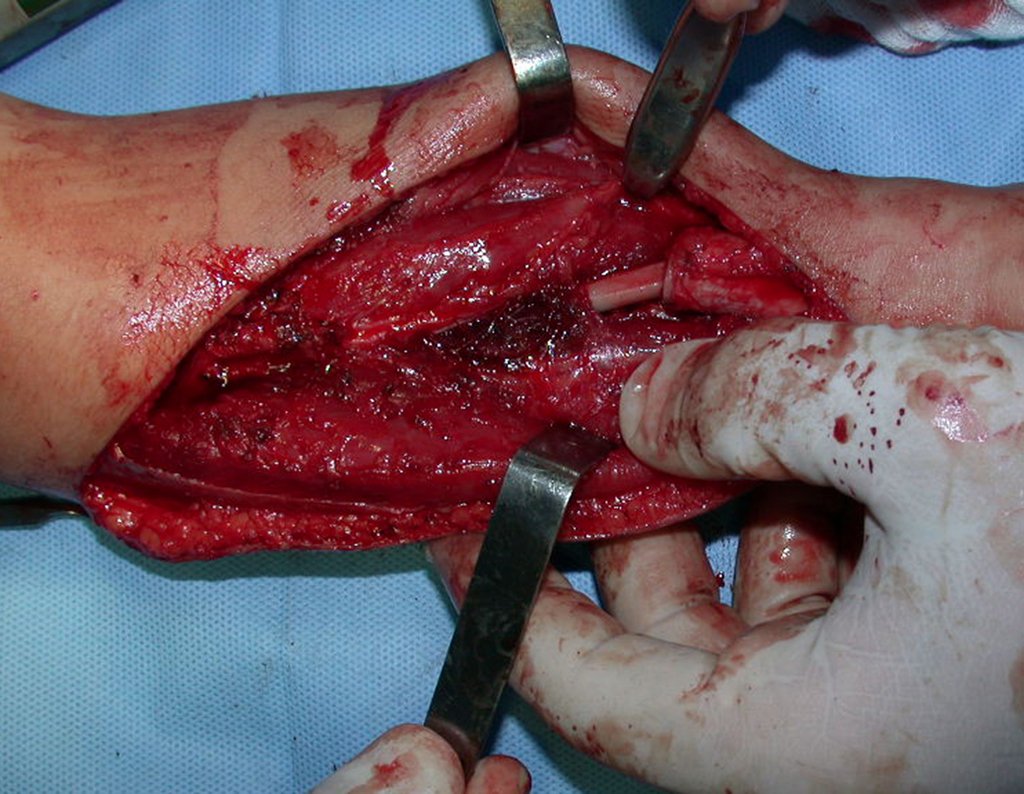
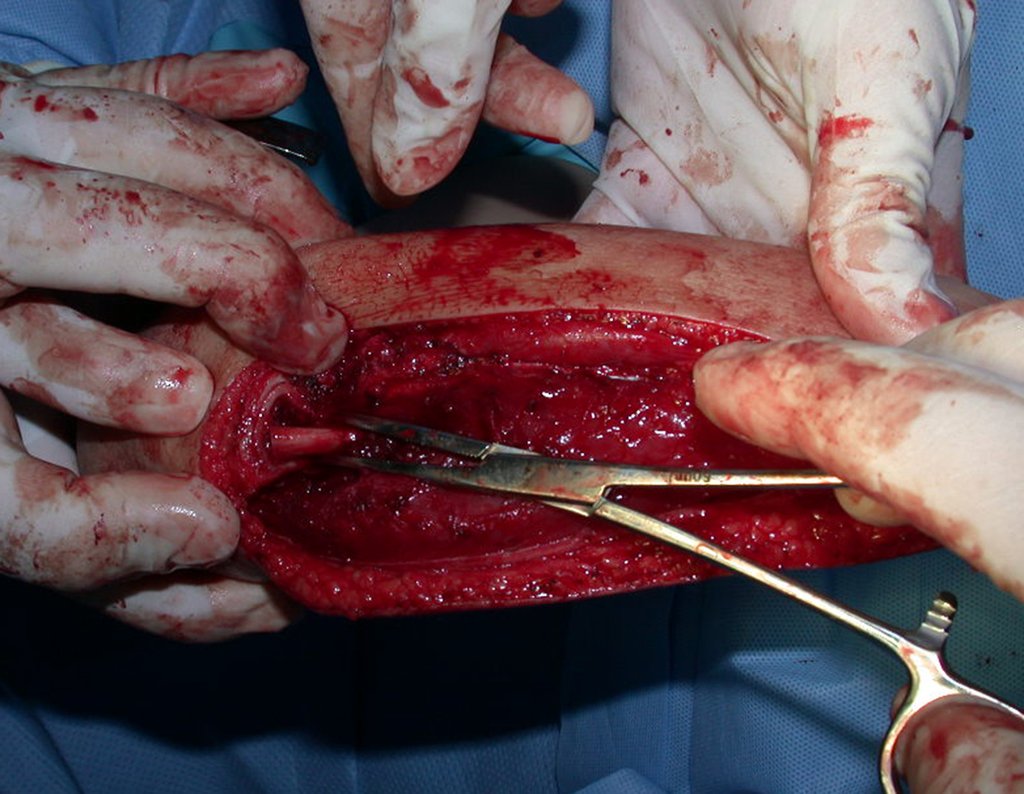
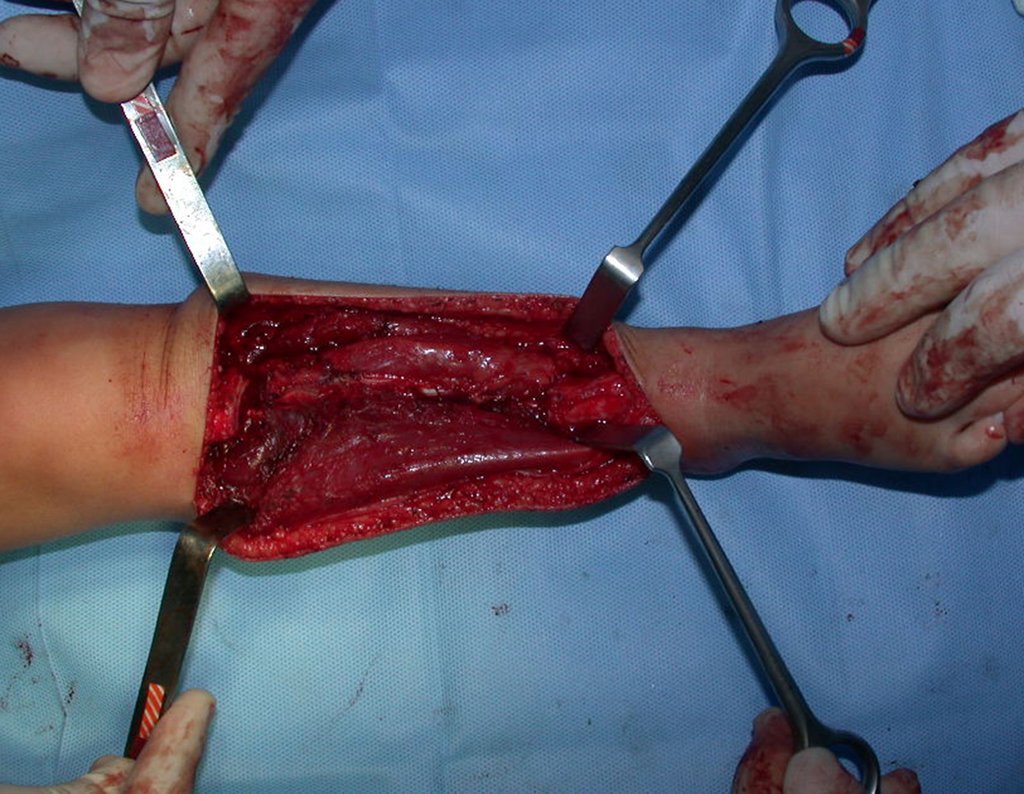
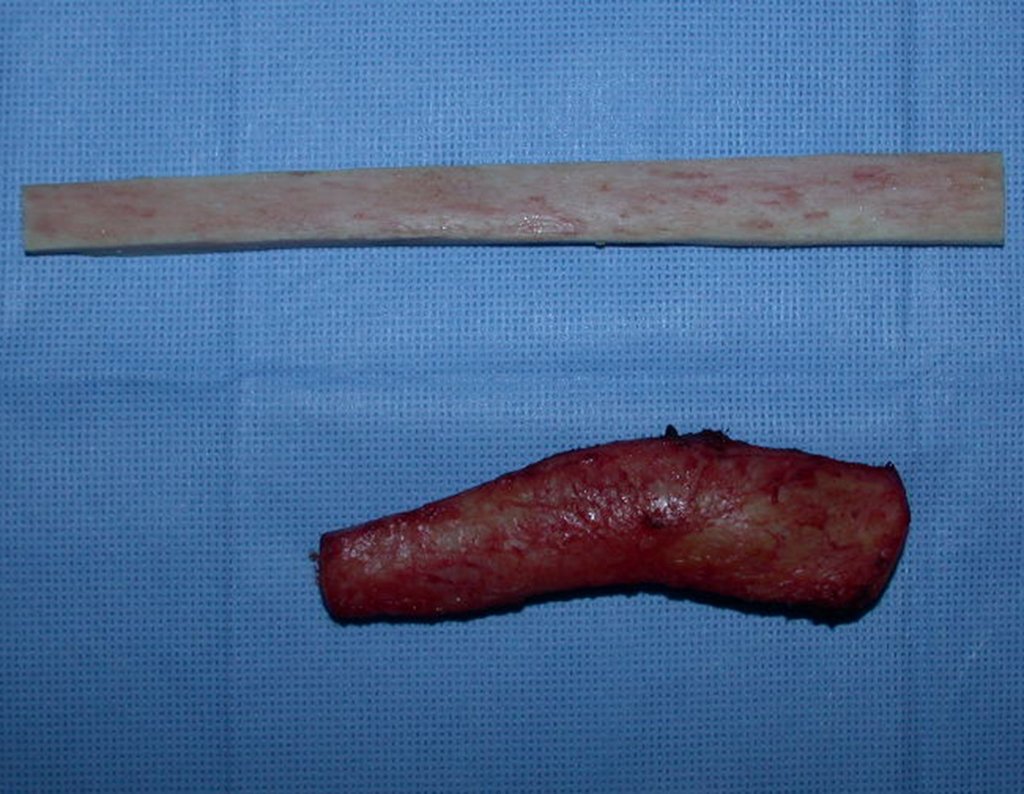
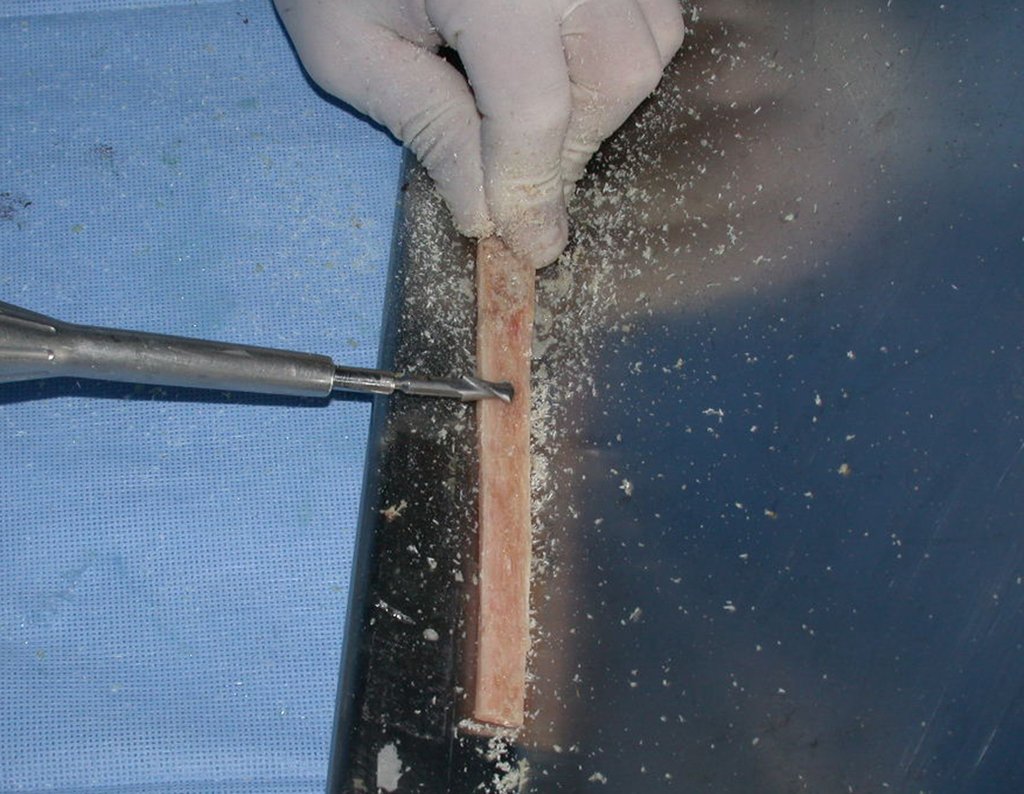
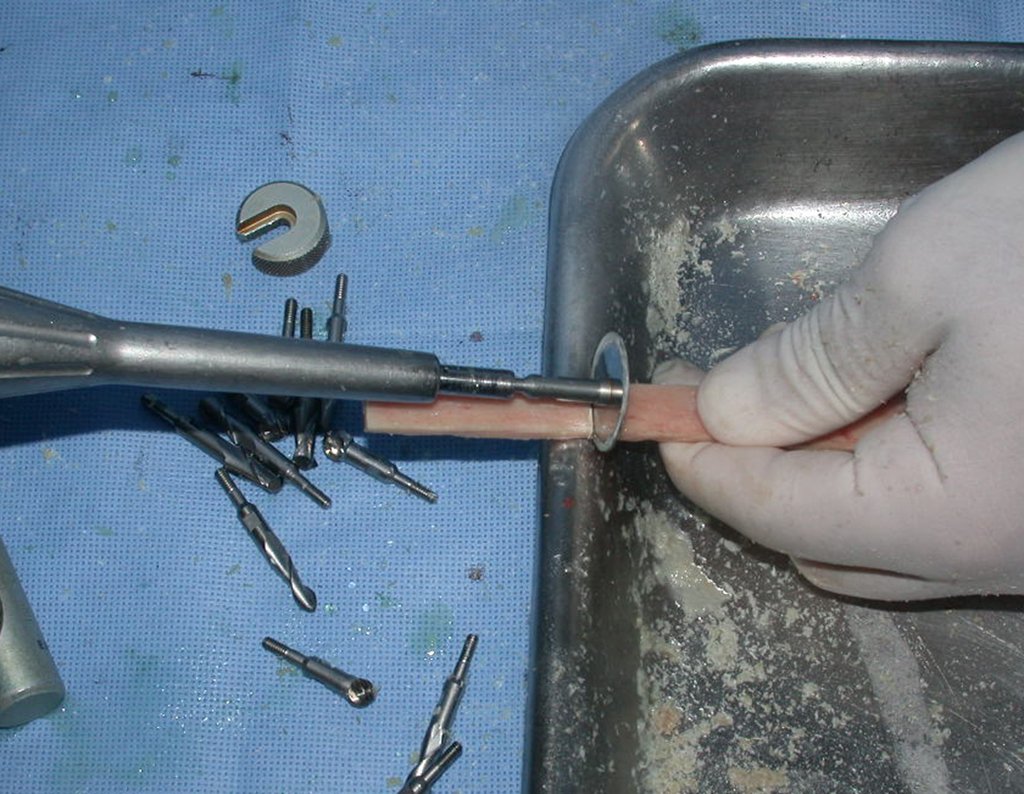
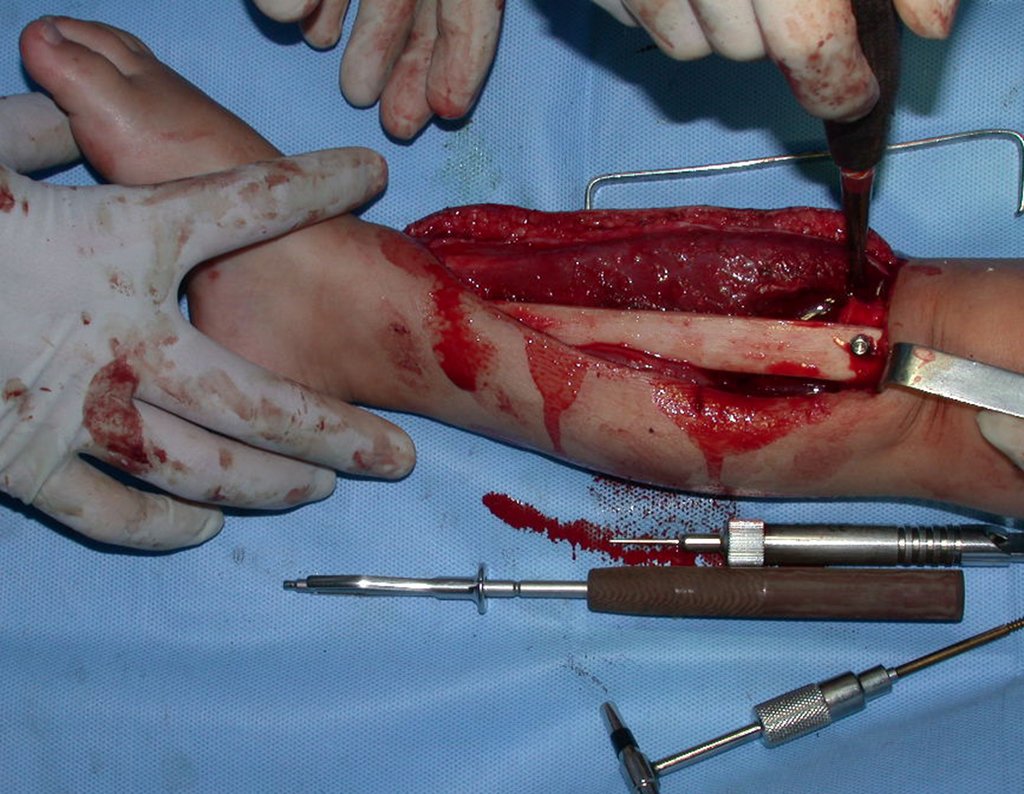
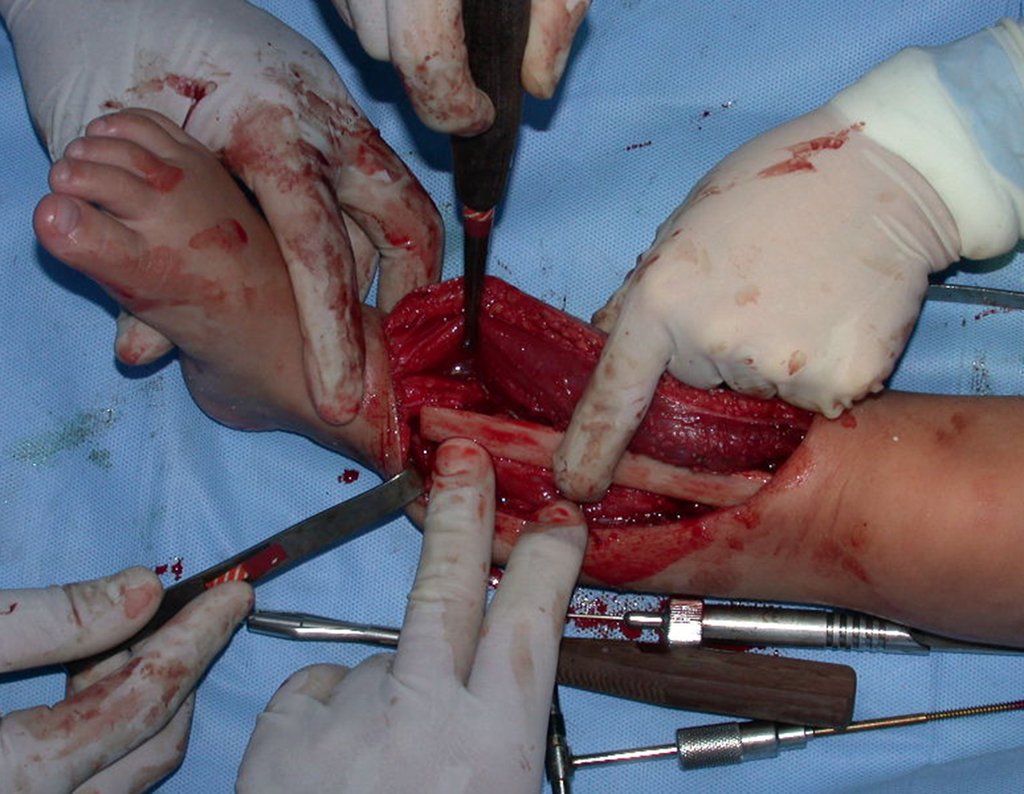
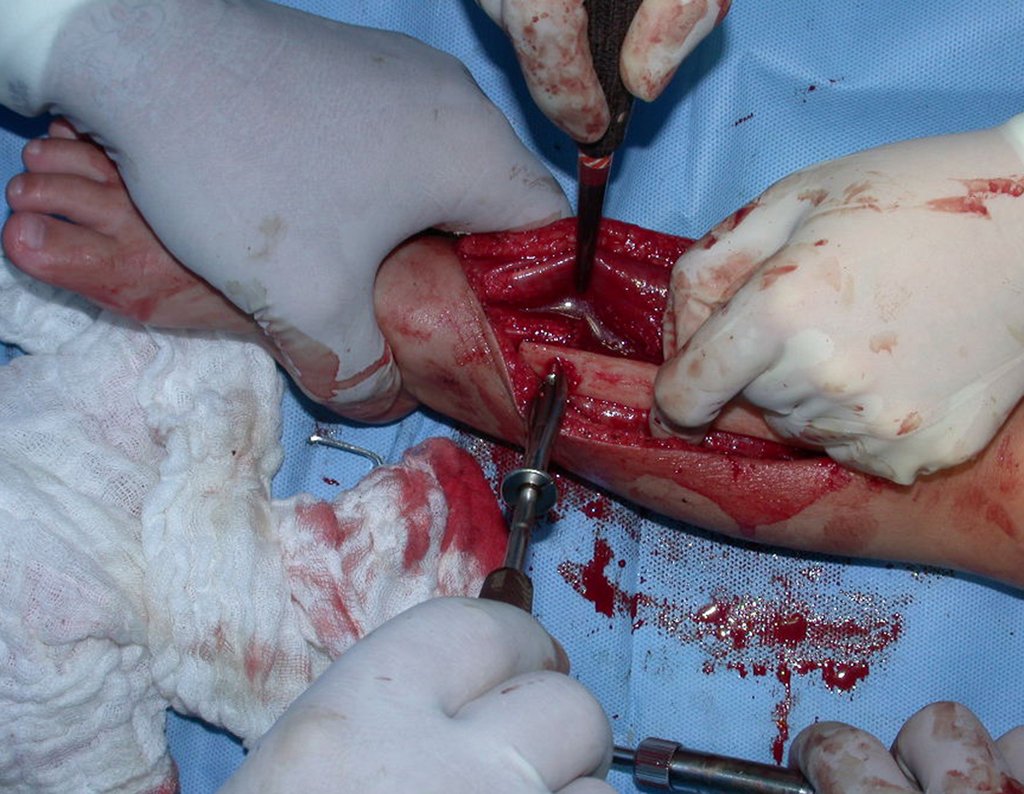
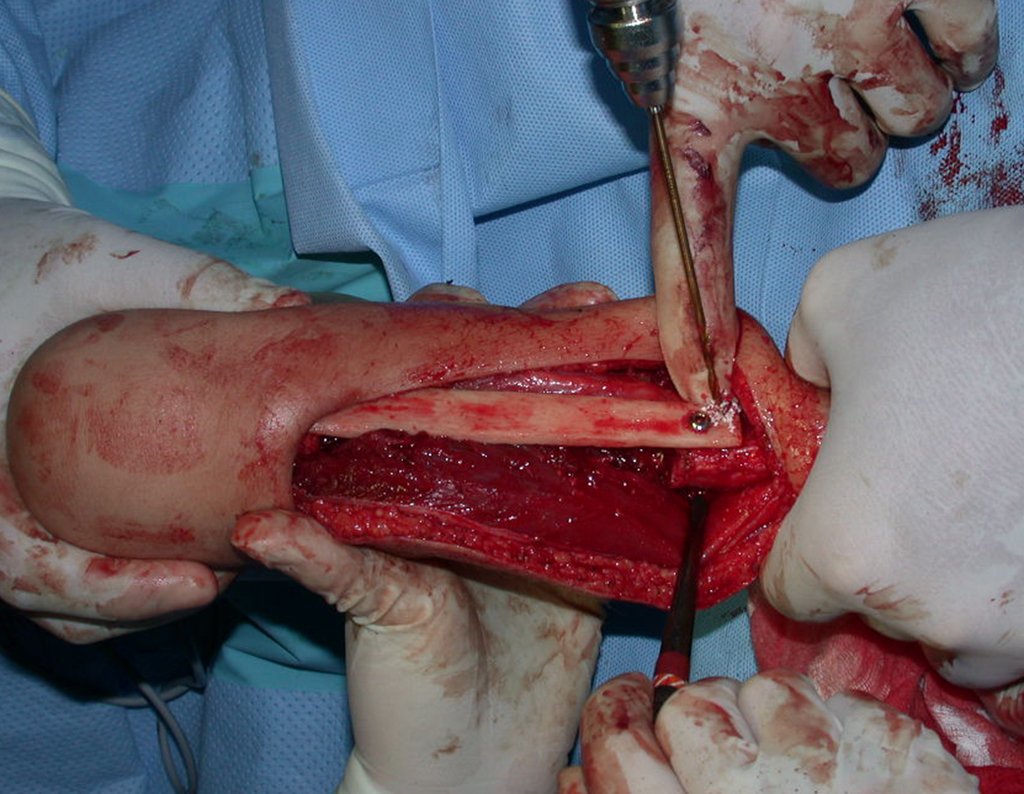
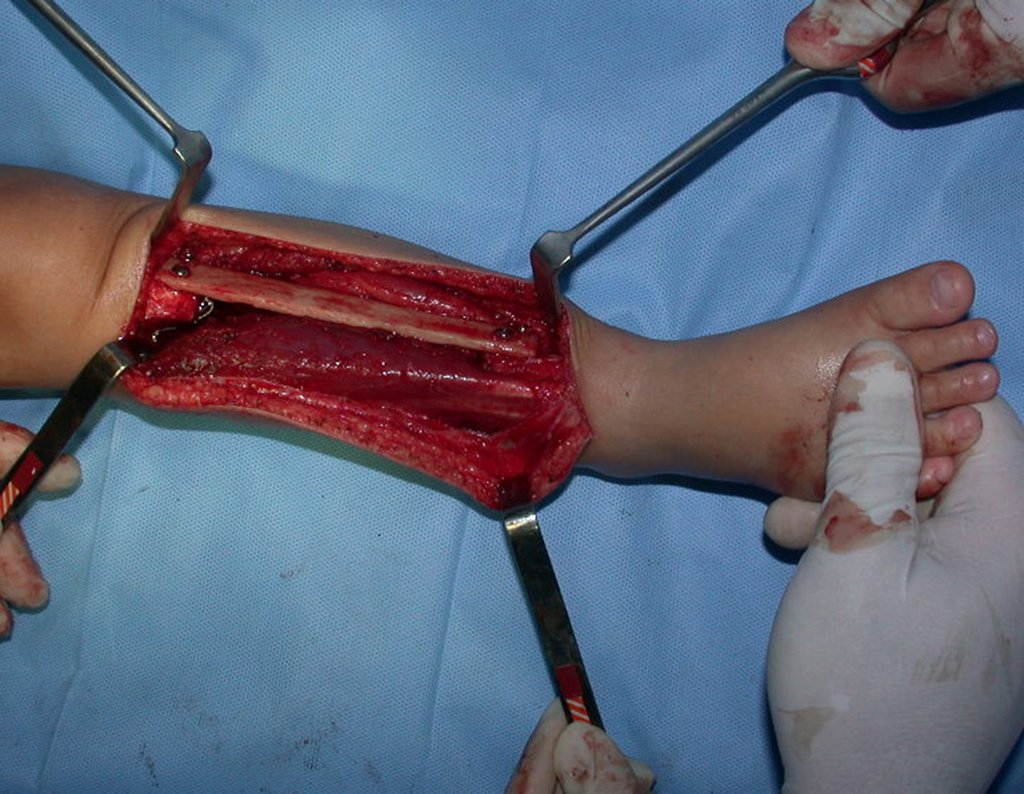
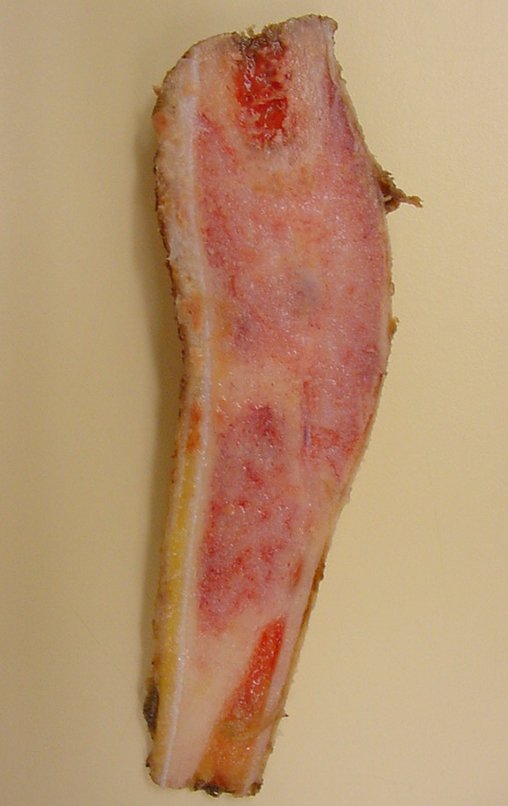
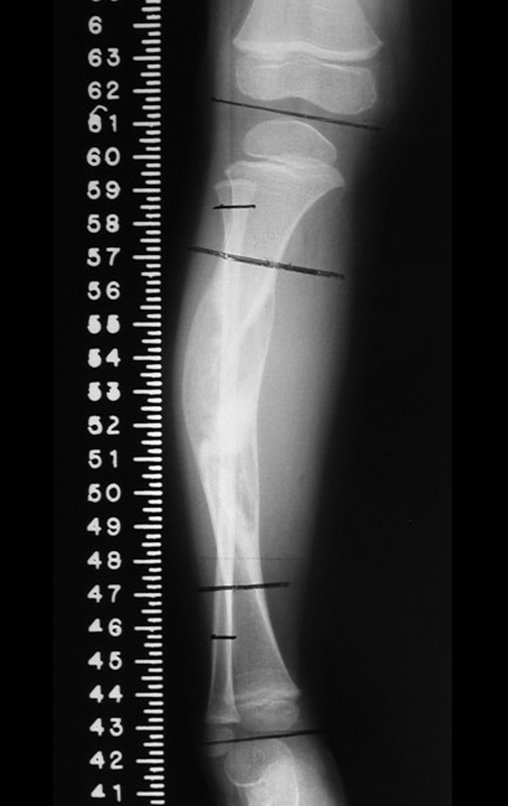
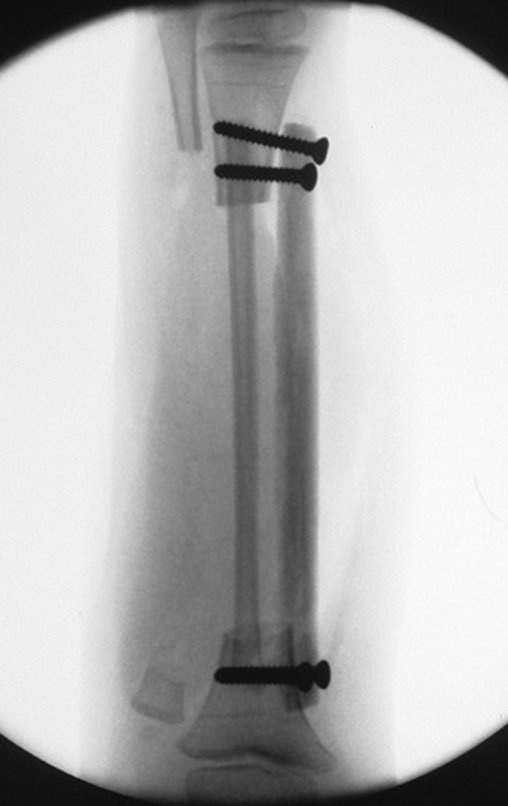
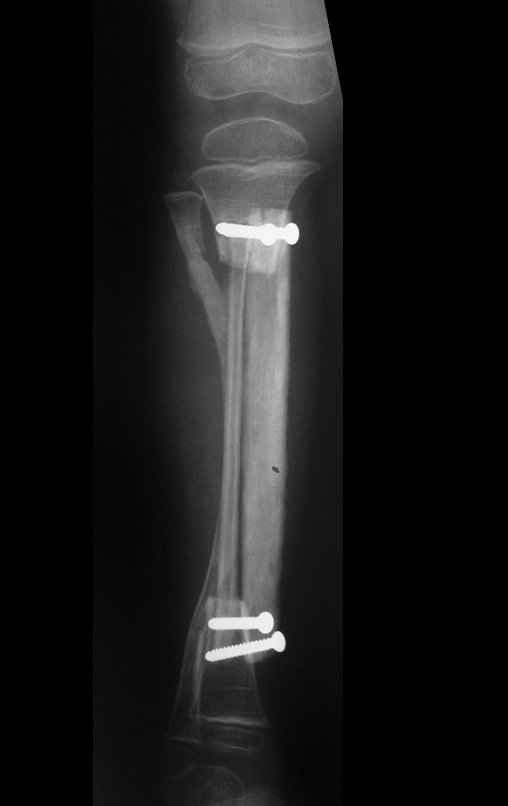
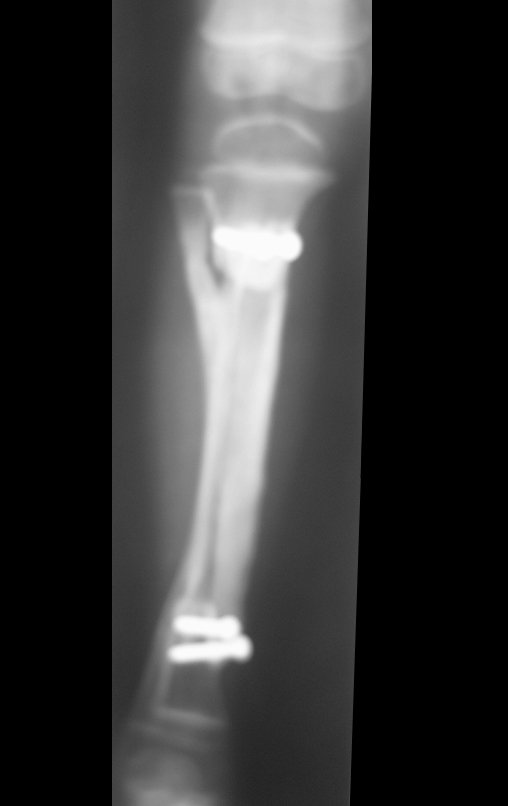
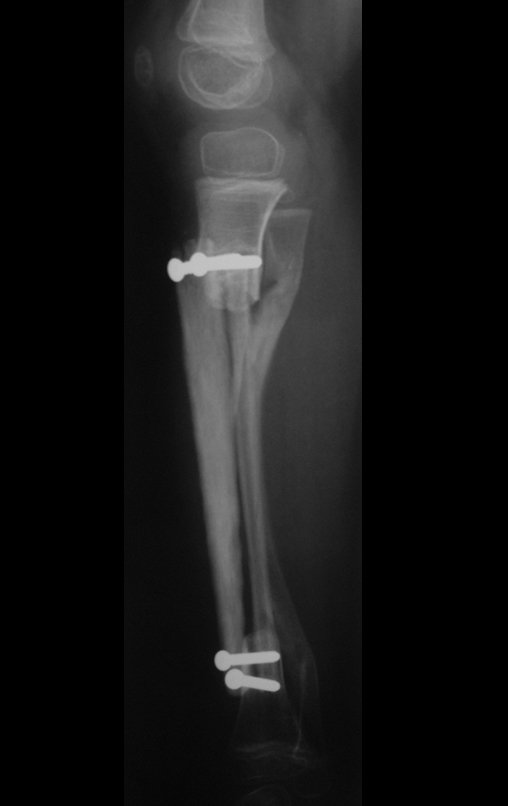
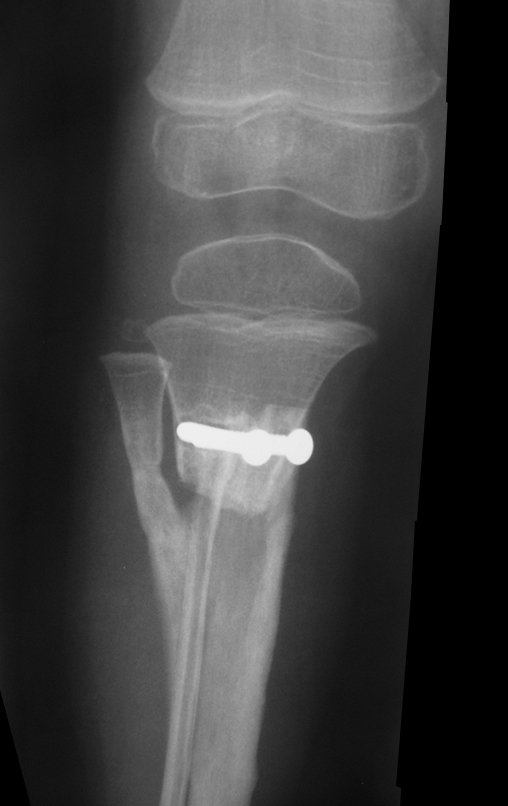
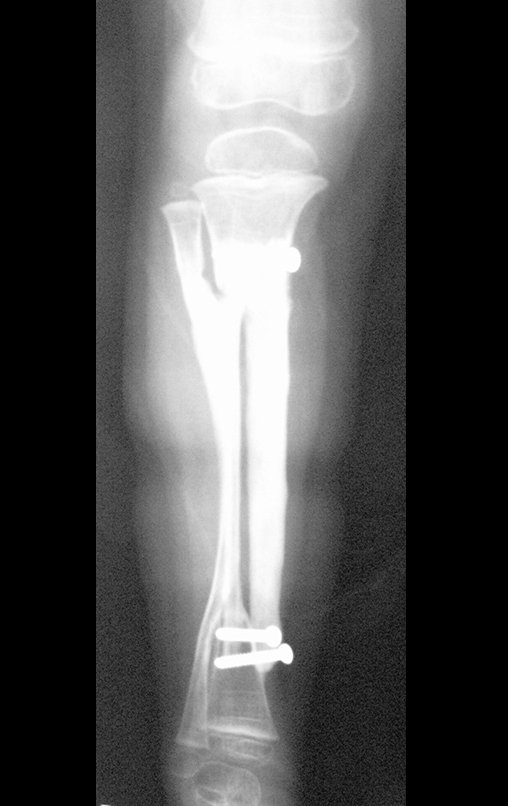
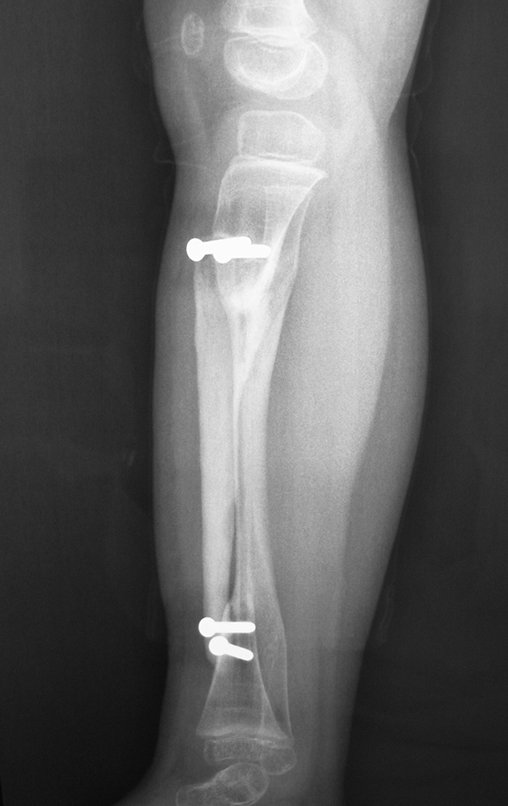
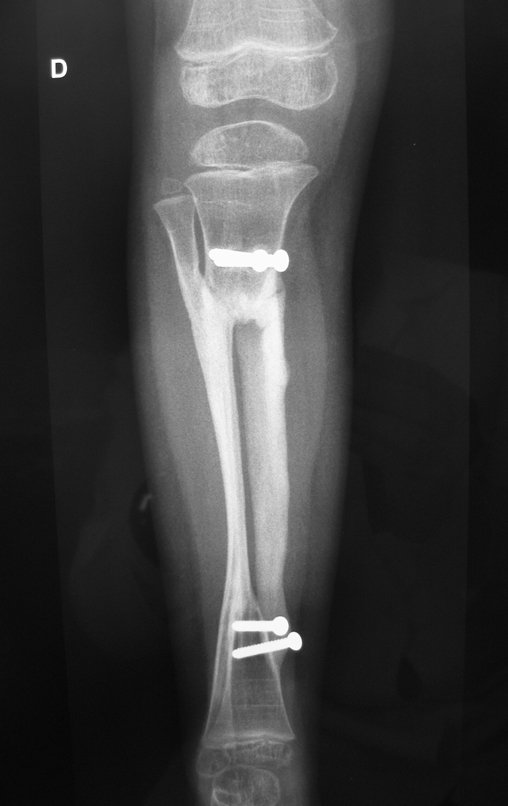
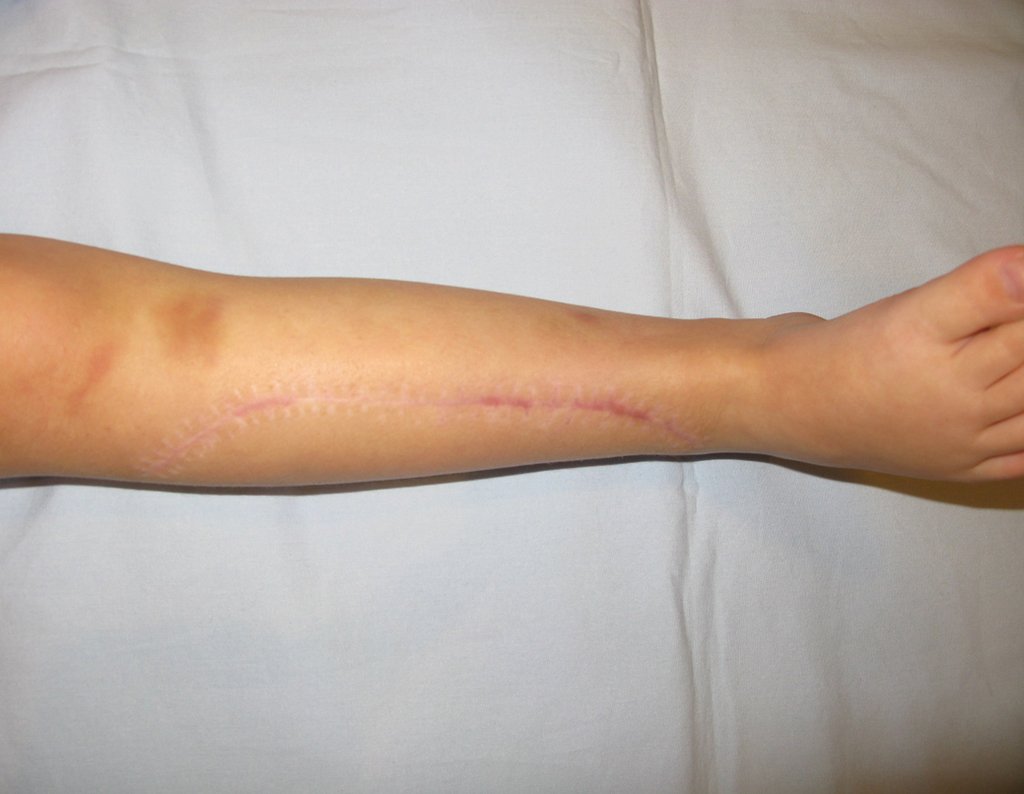
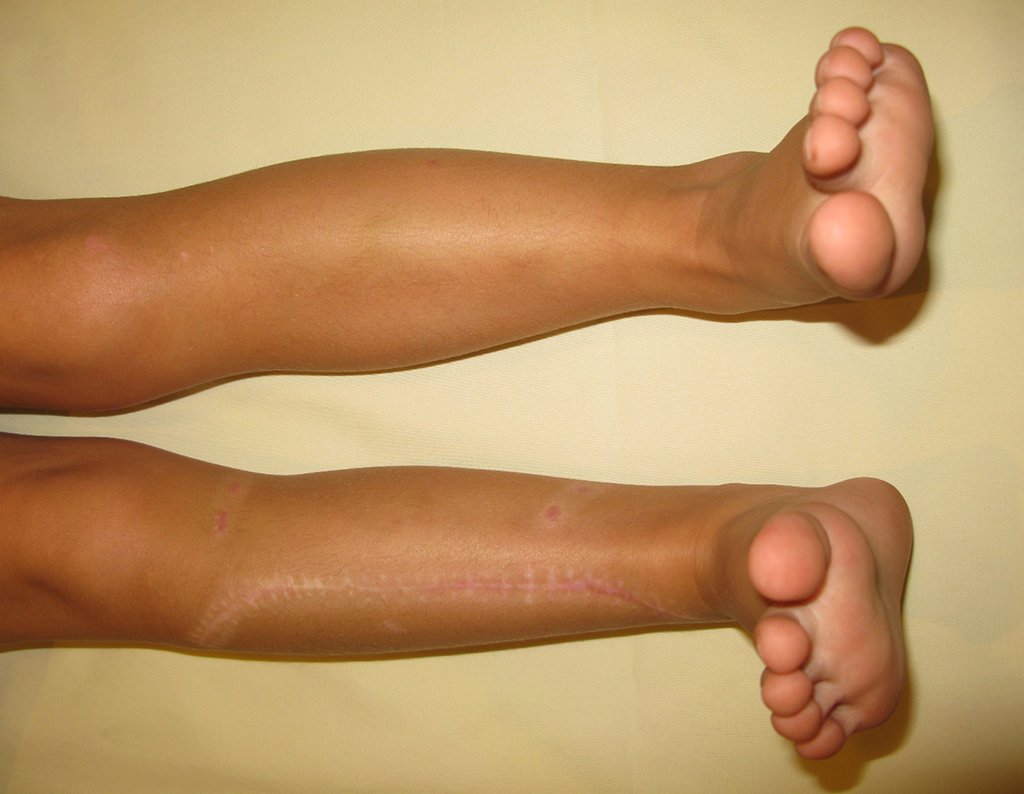
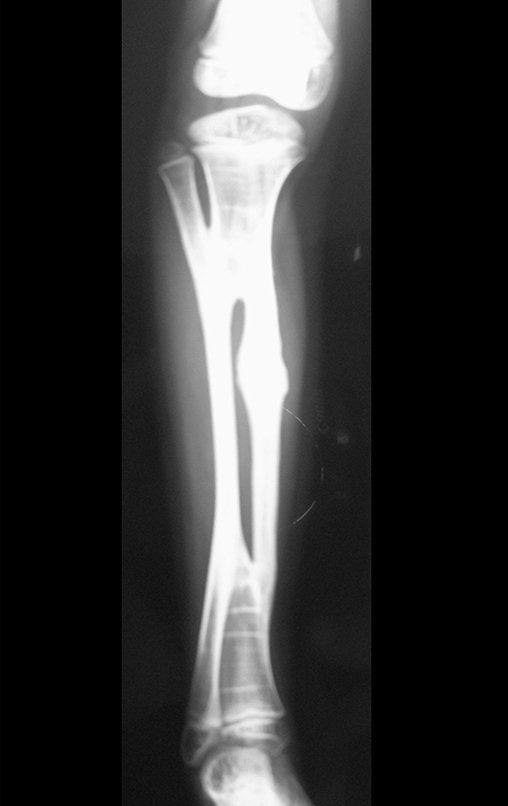
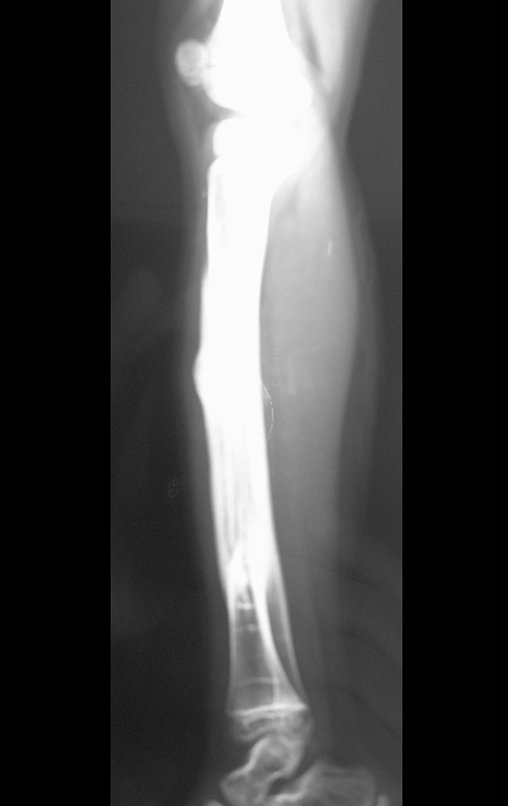
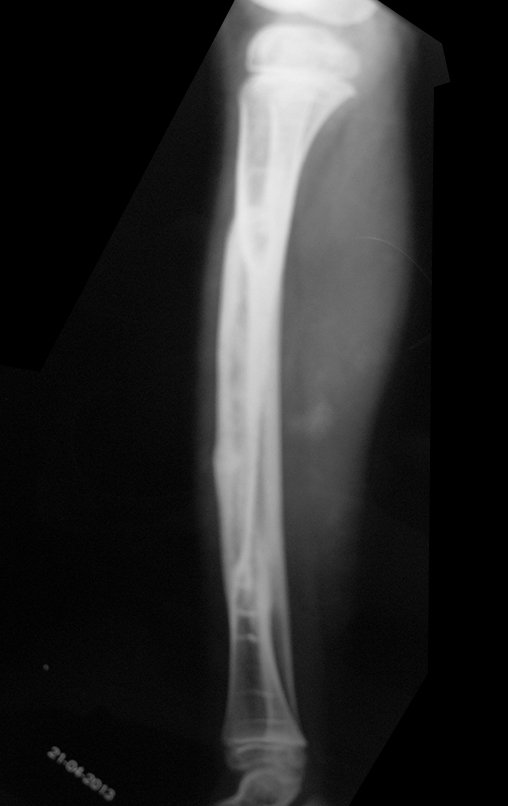
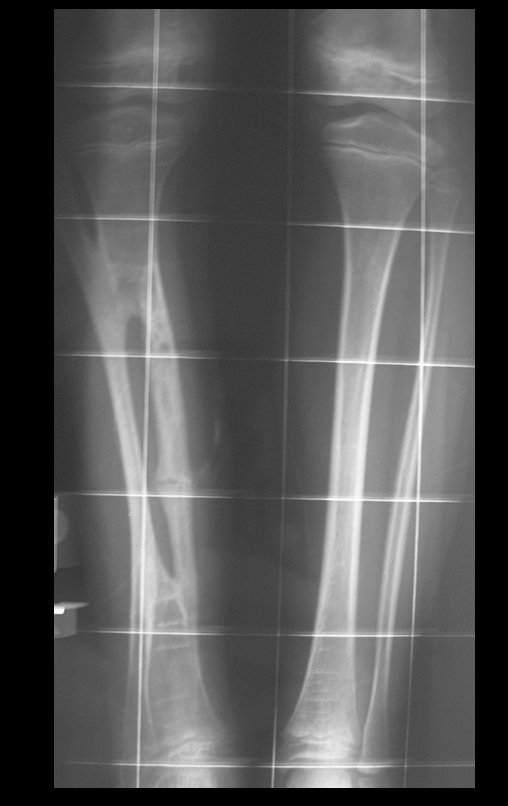
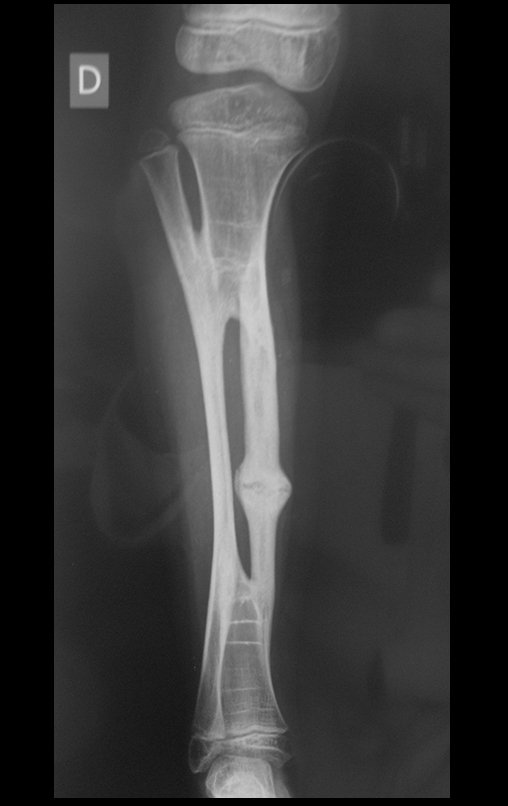
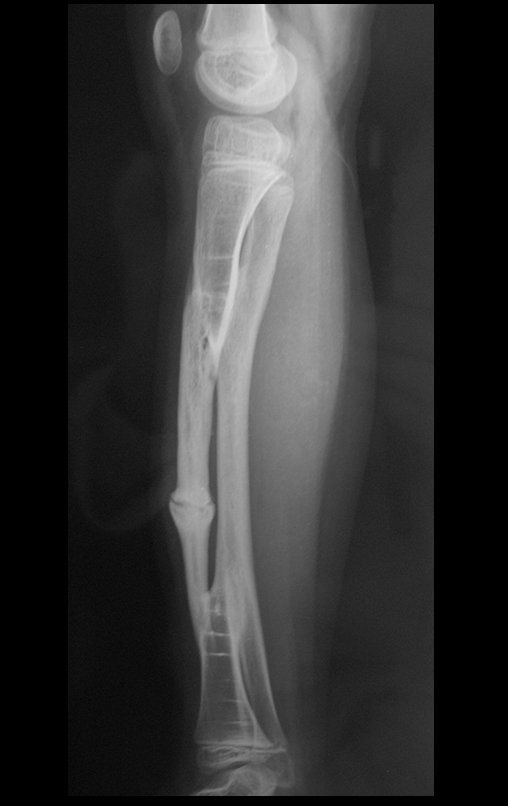
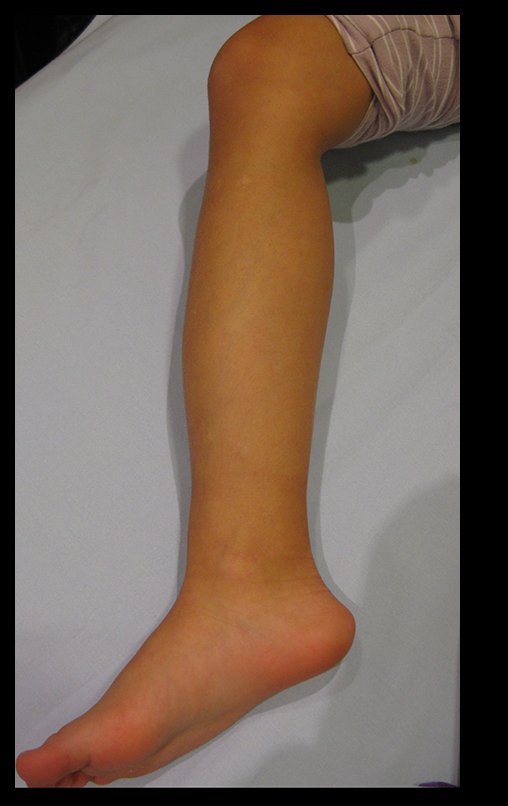
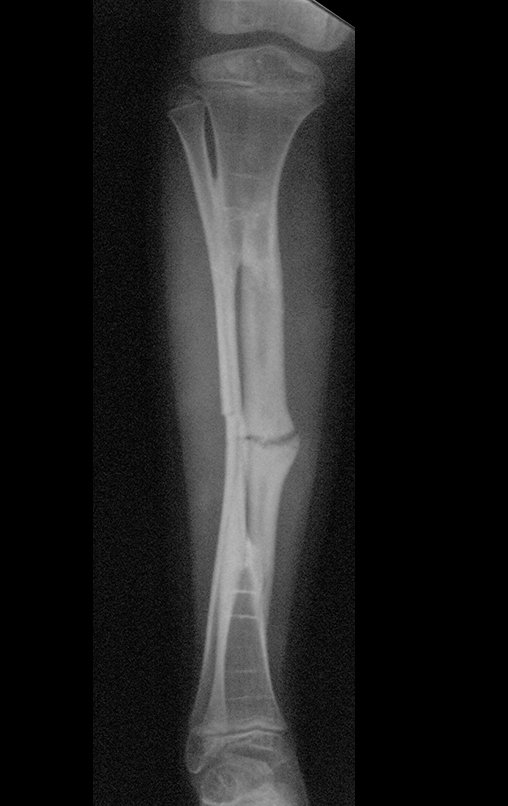
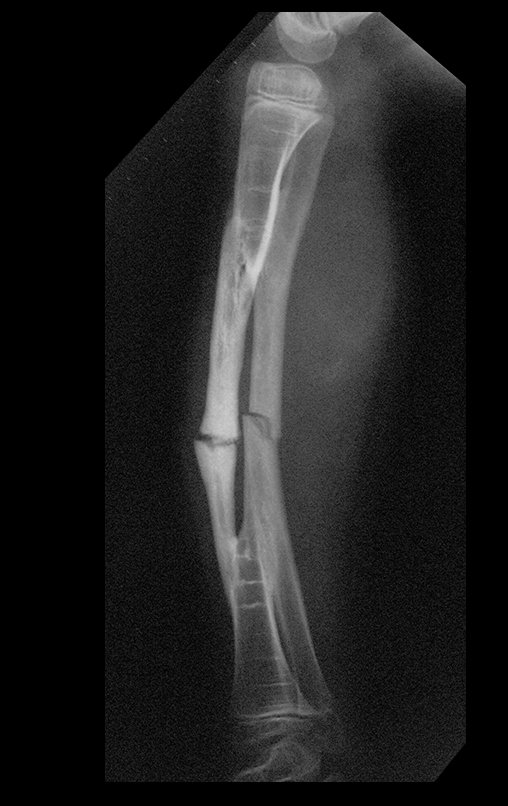
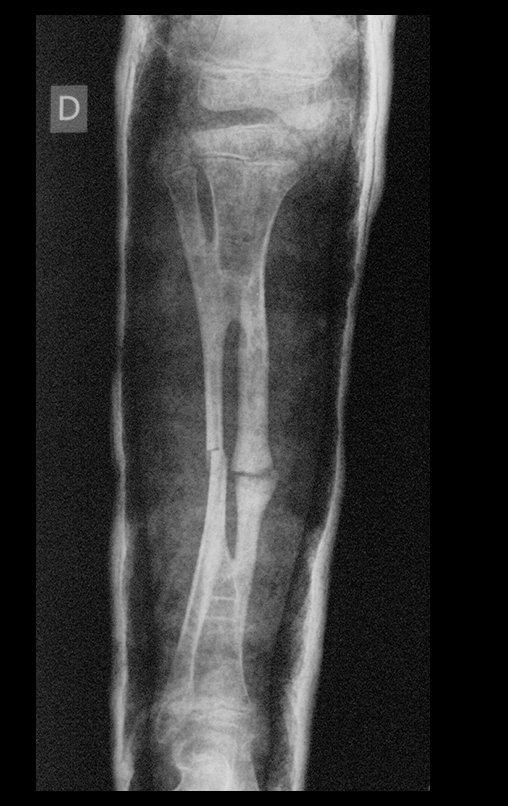
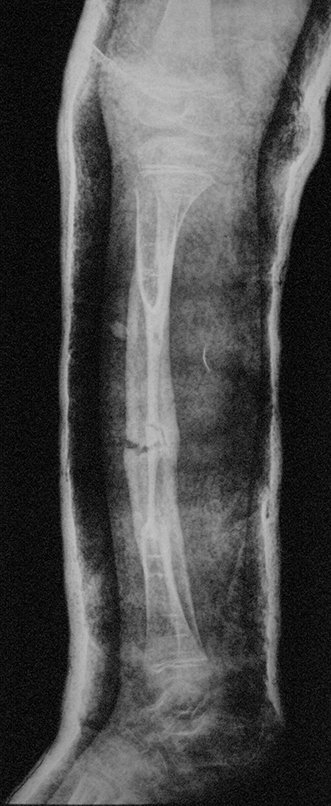
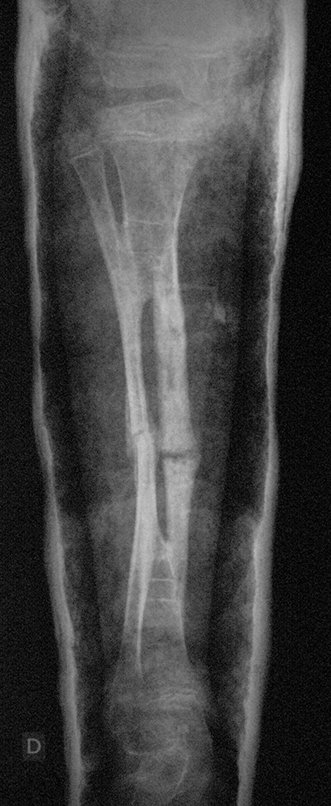
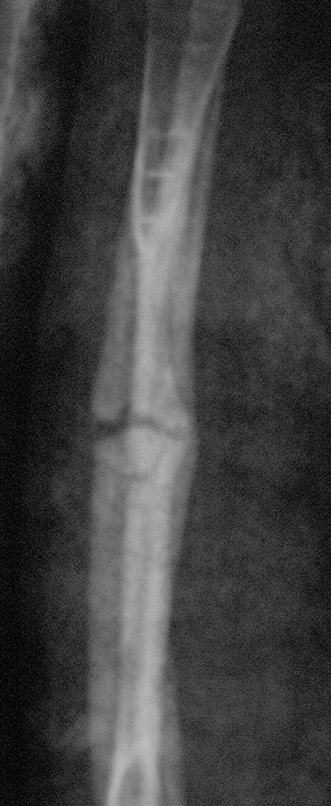
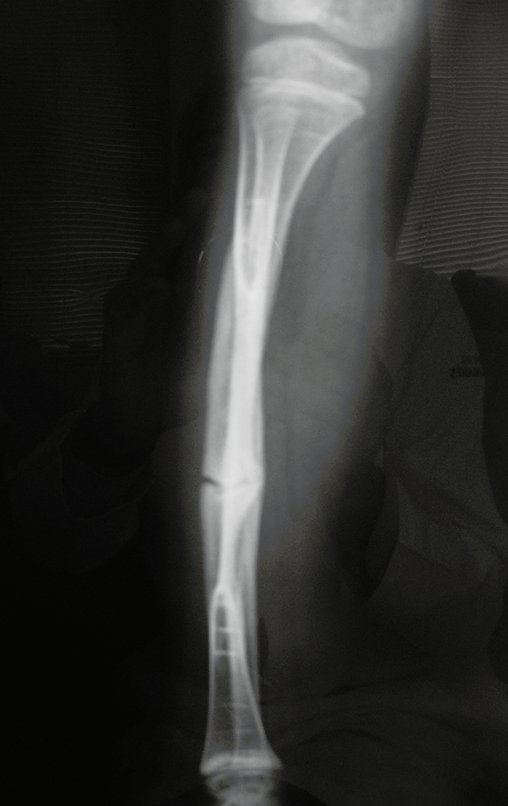
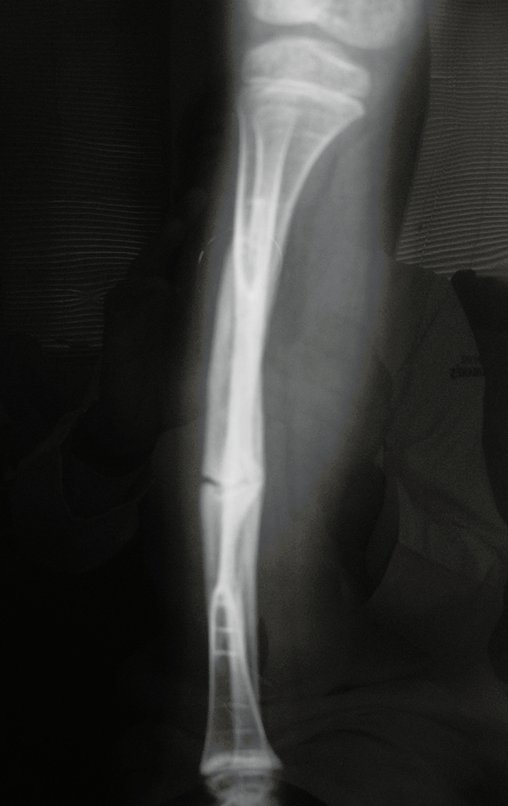
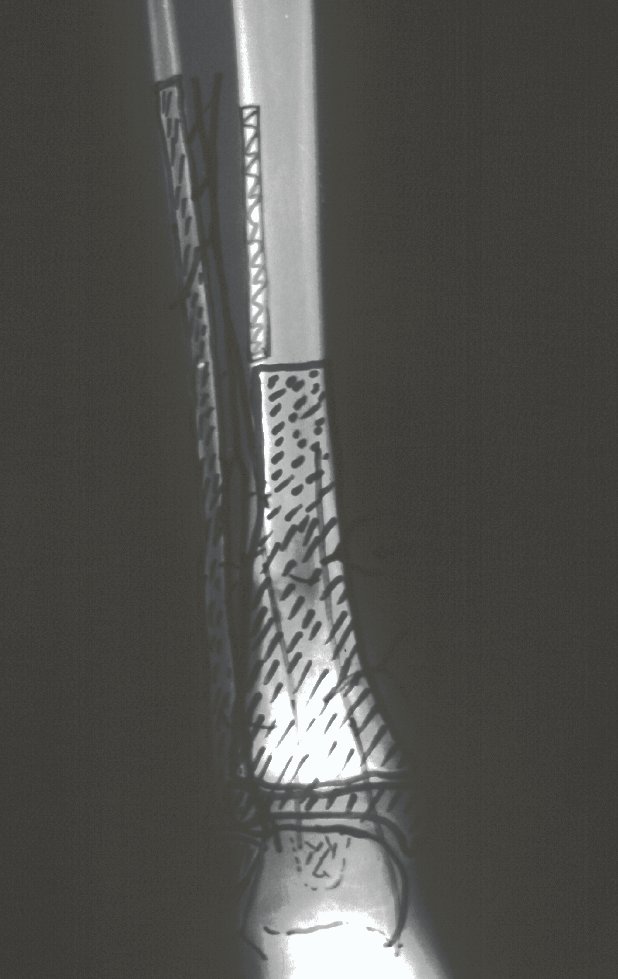
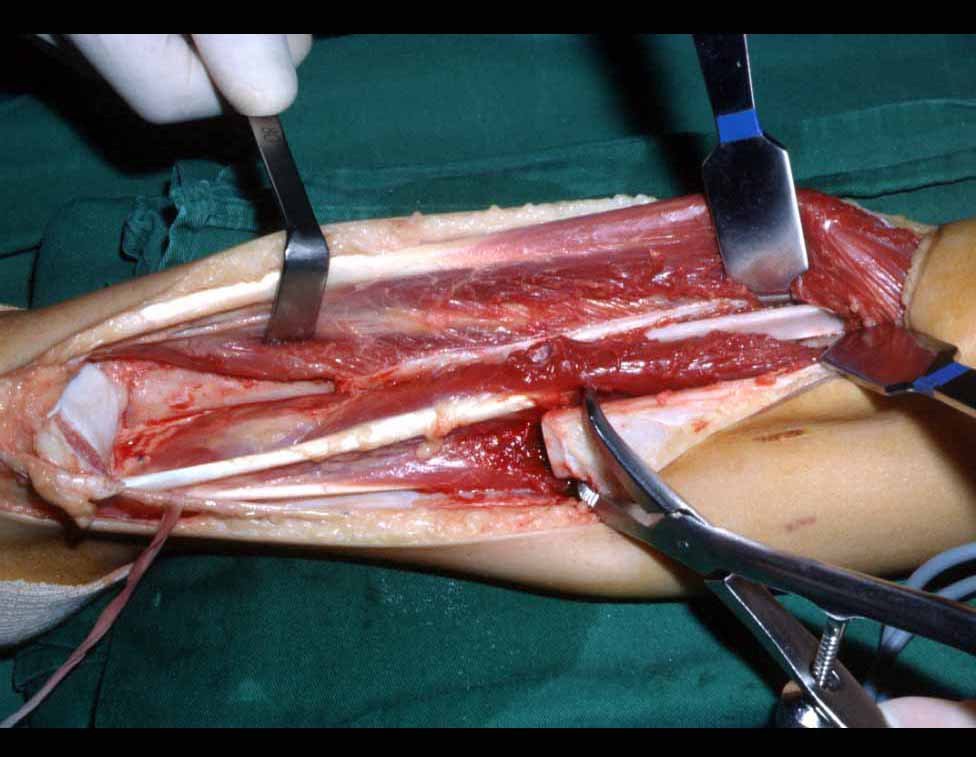
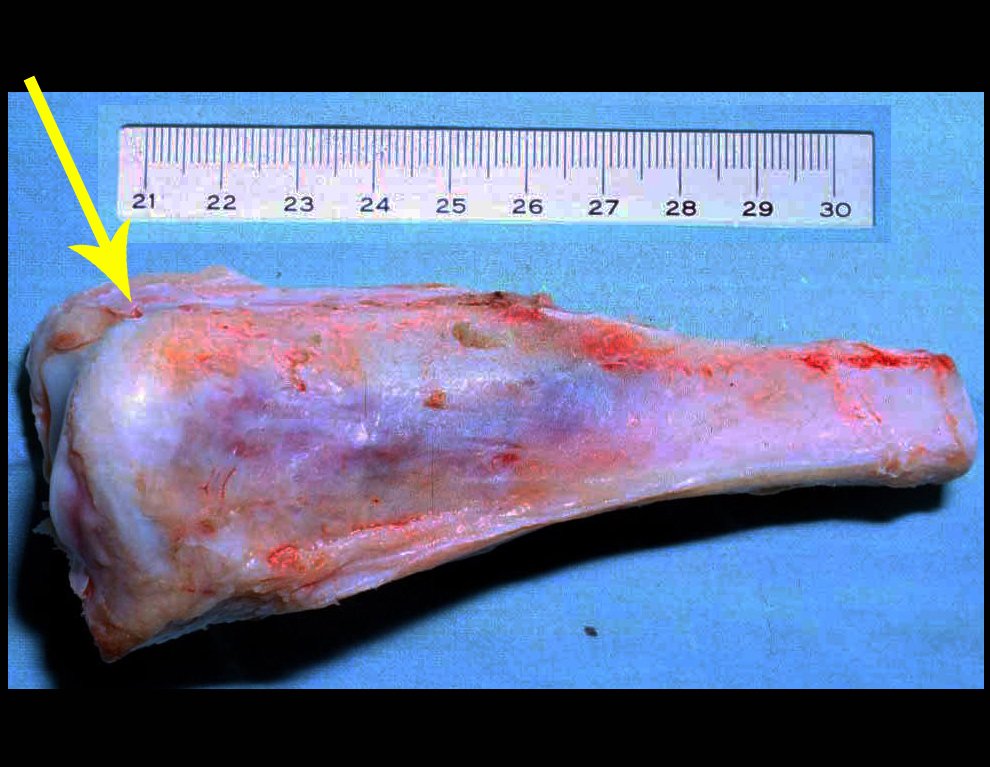
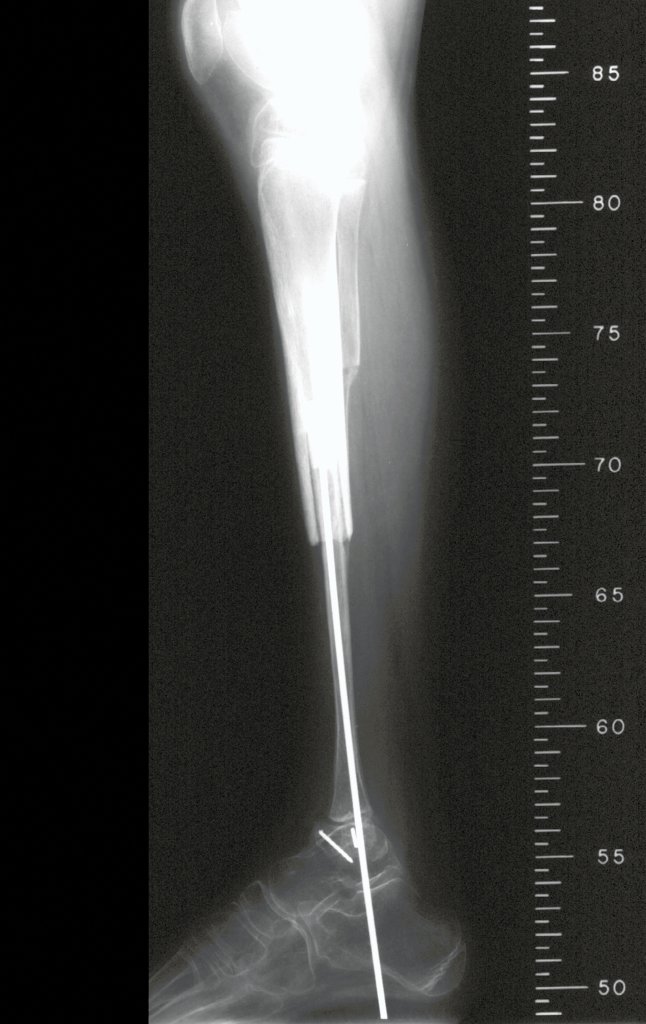
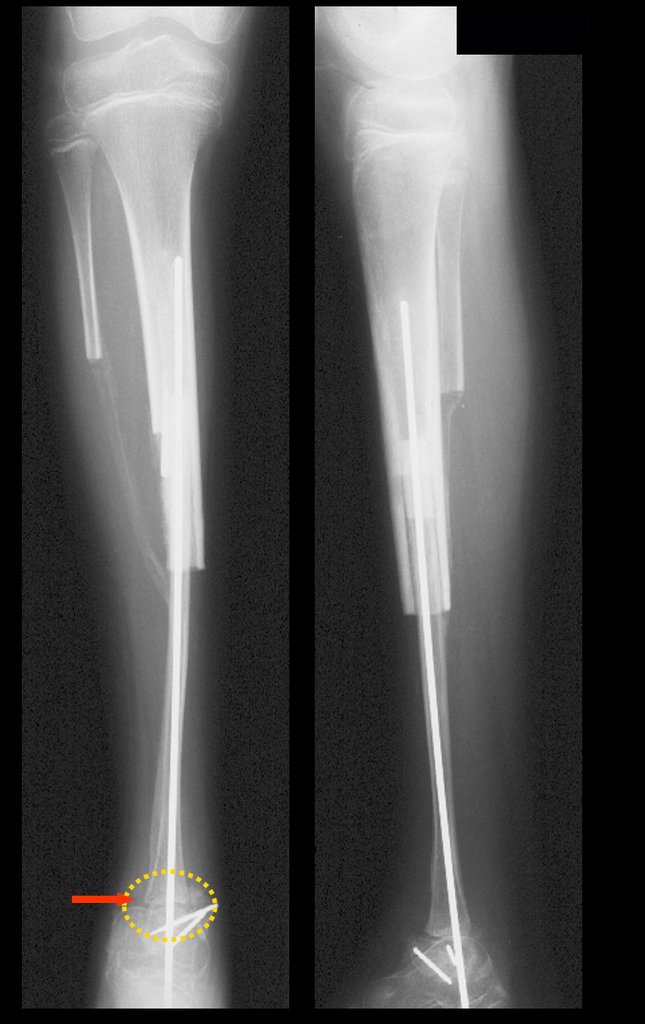
Cisto Ganglionar Intra Neural – Ganglion
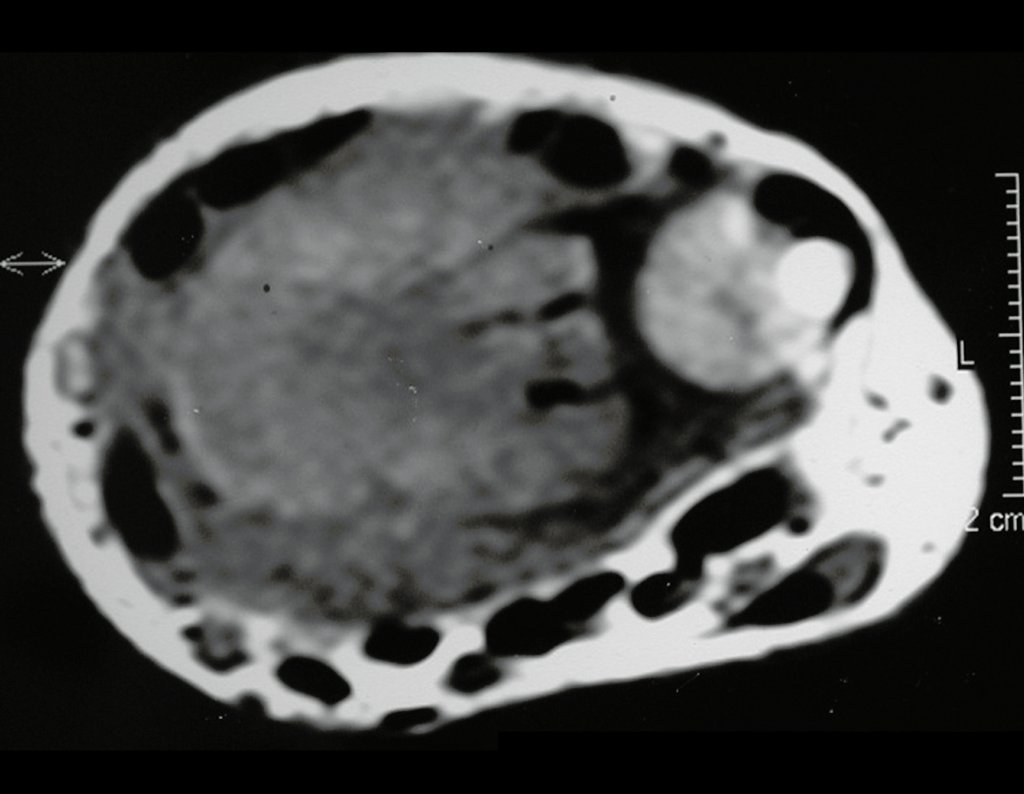
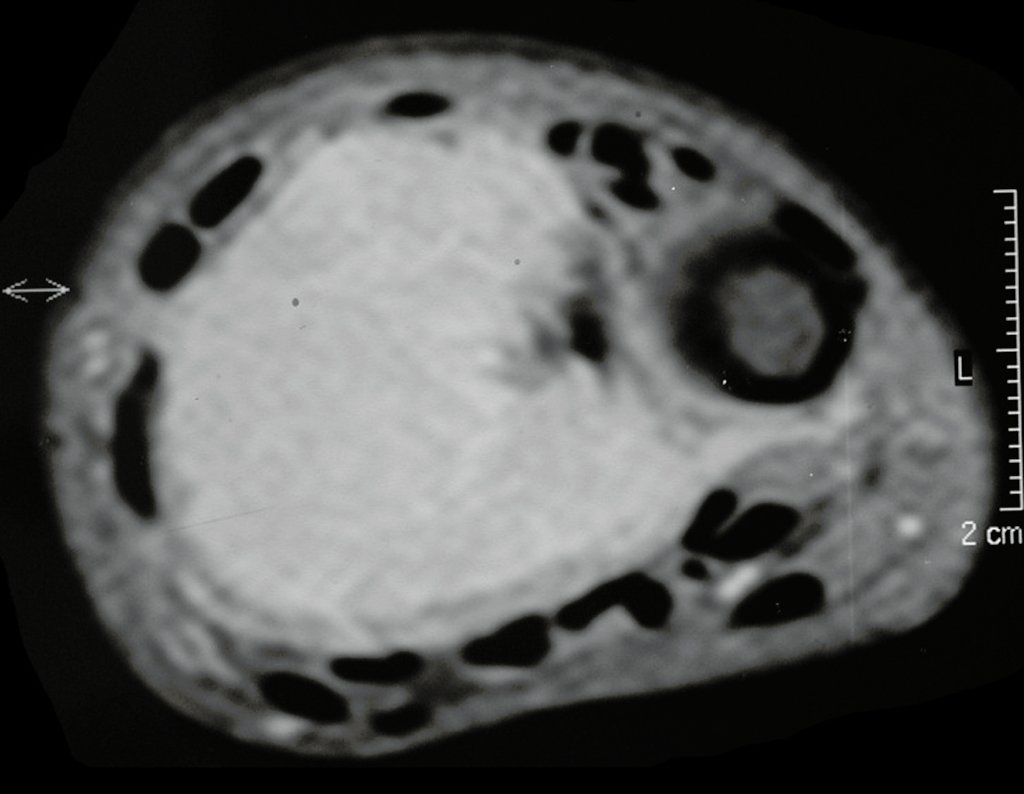
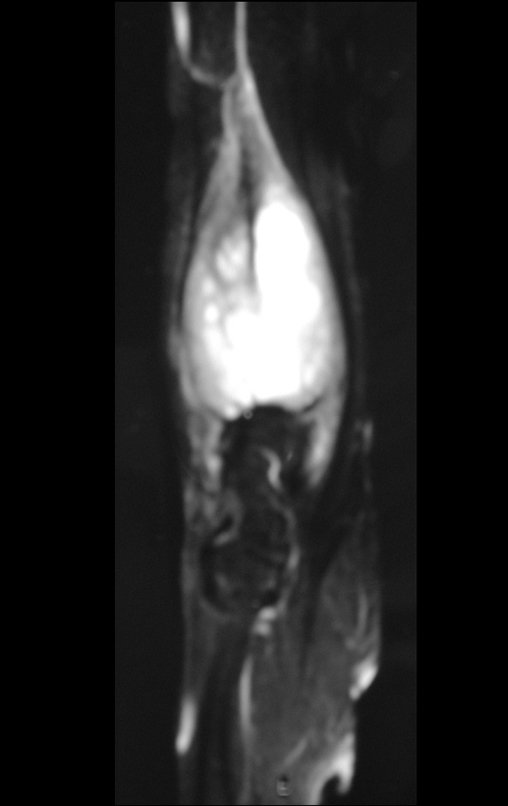
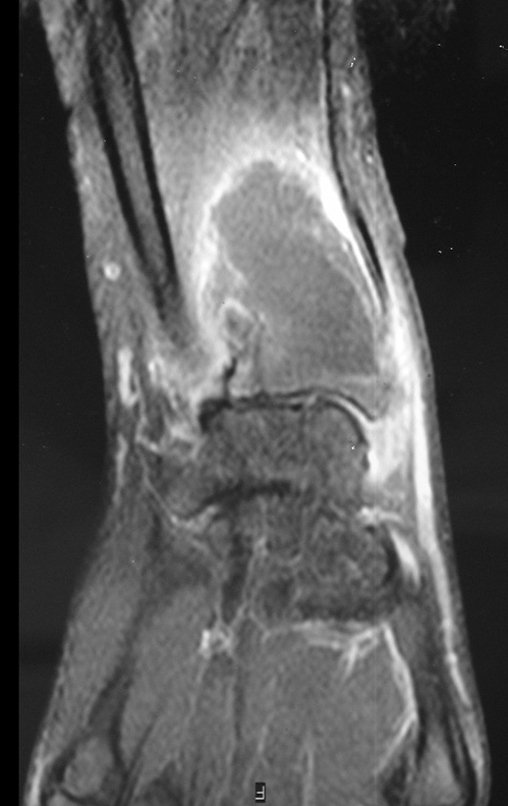
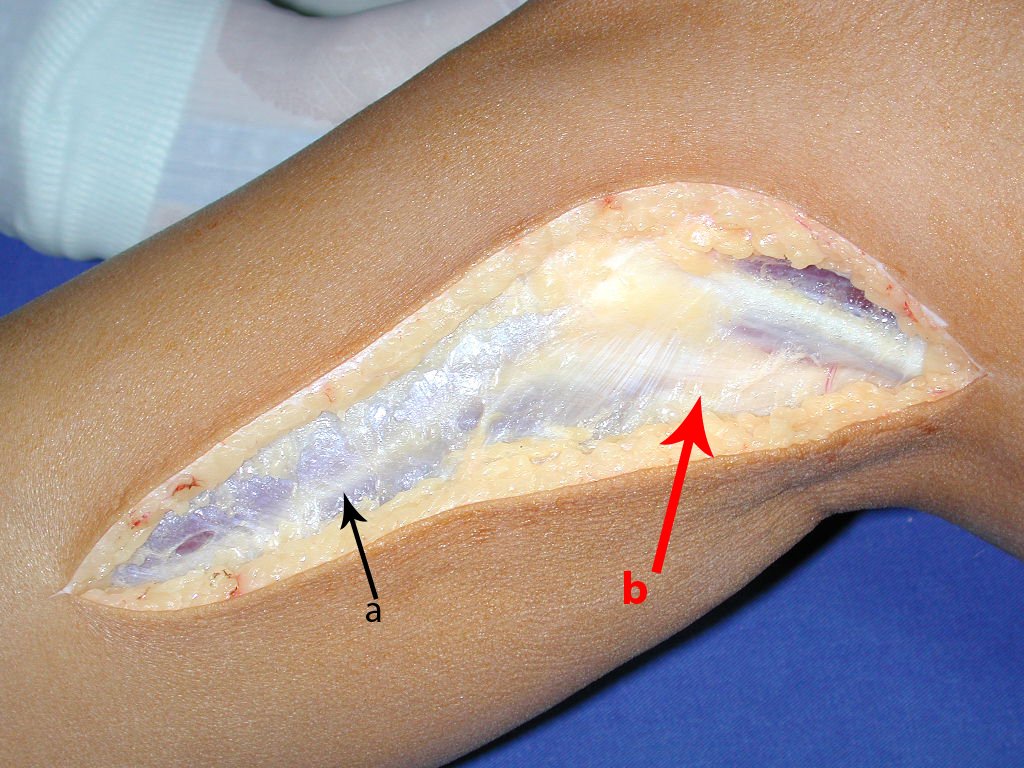
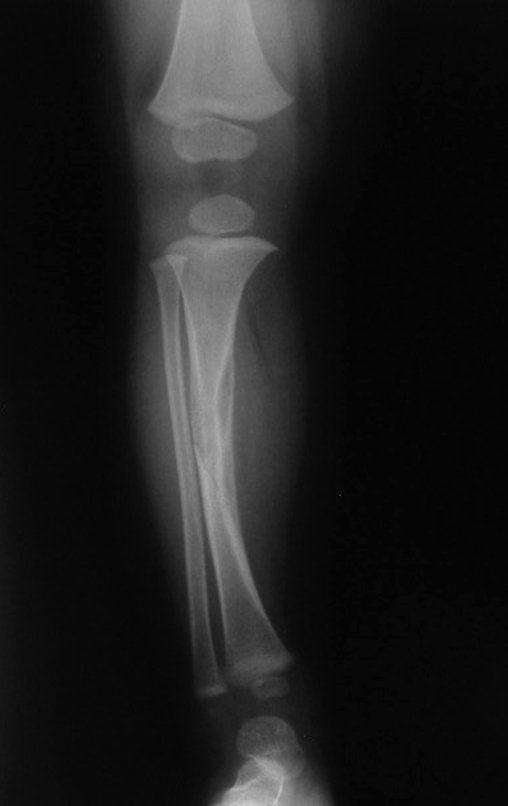
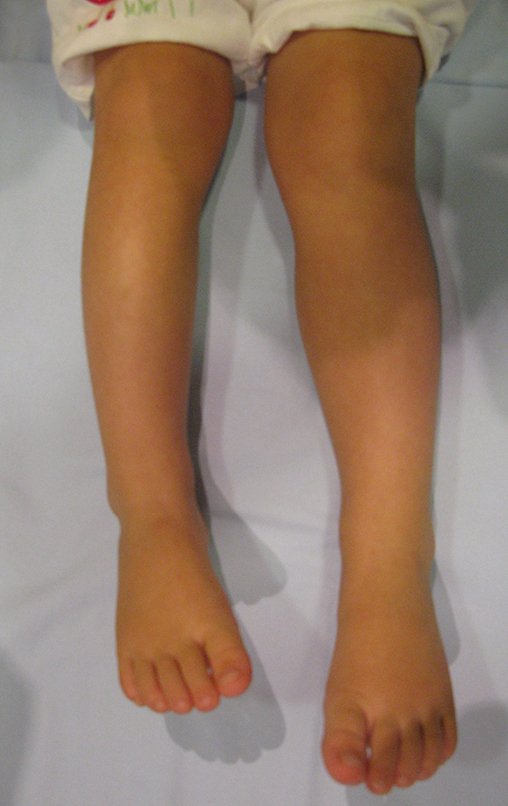
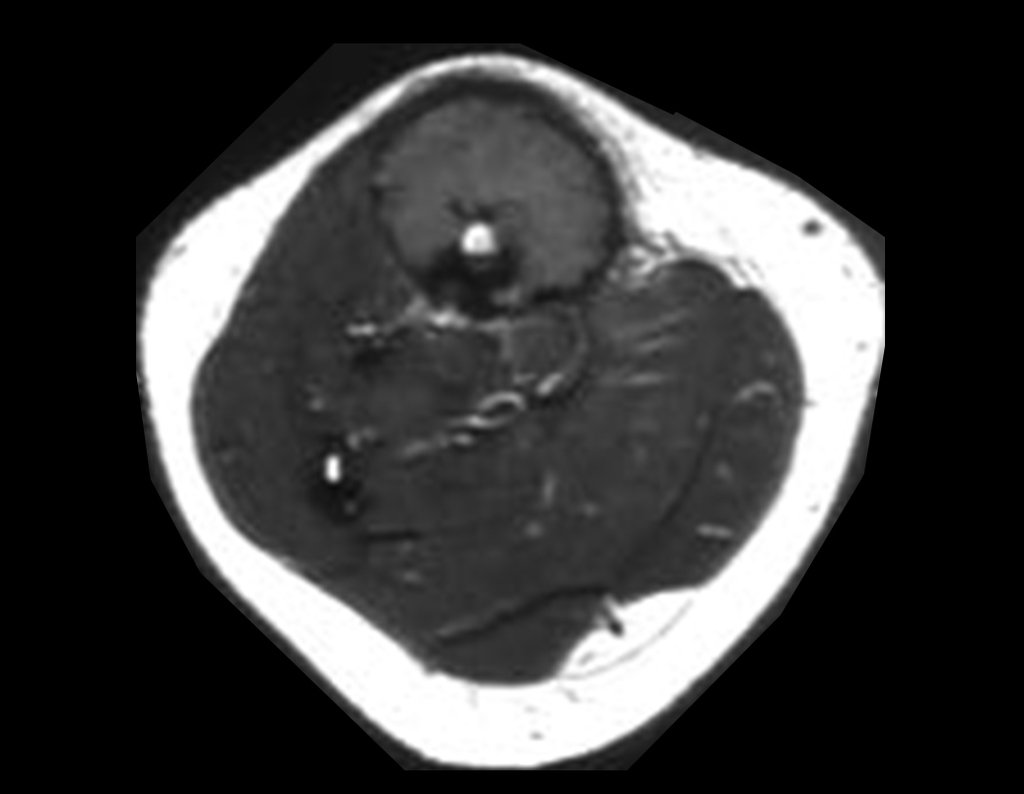
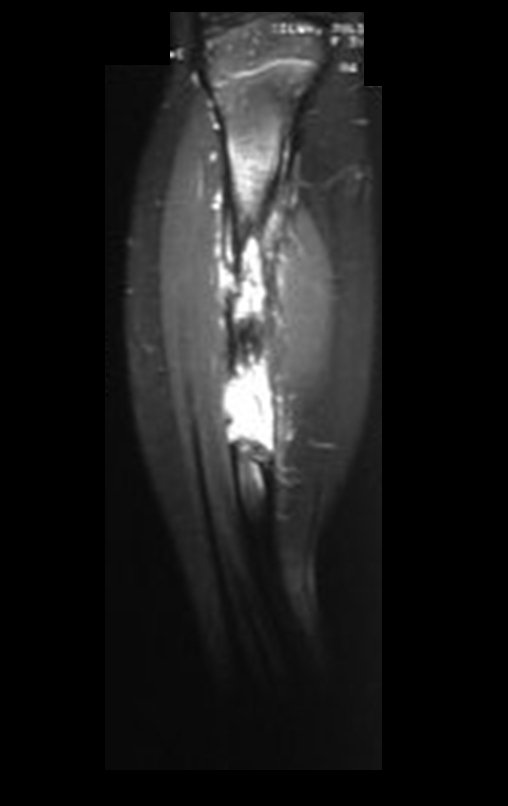
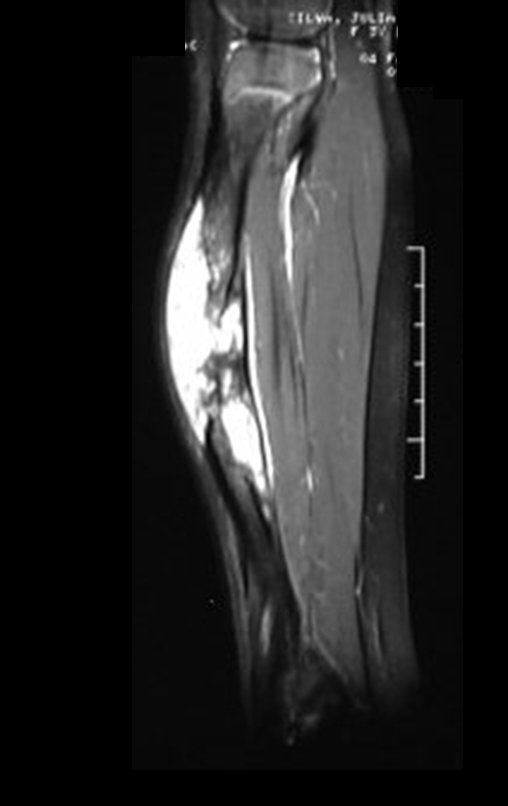
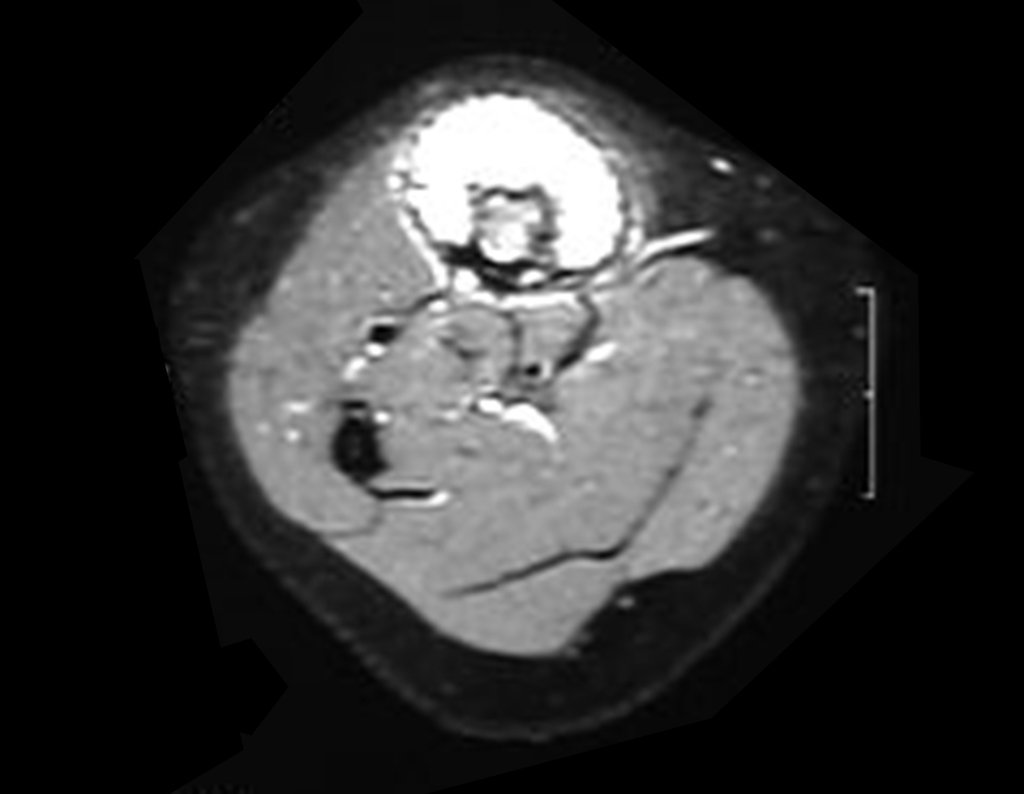
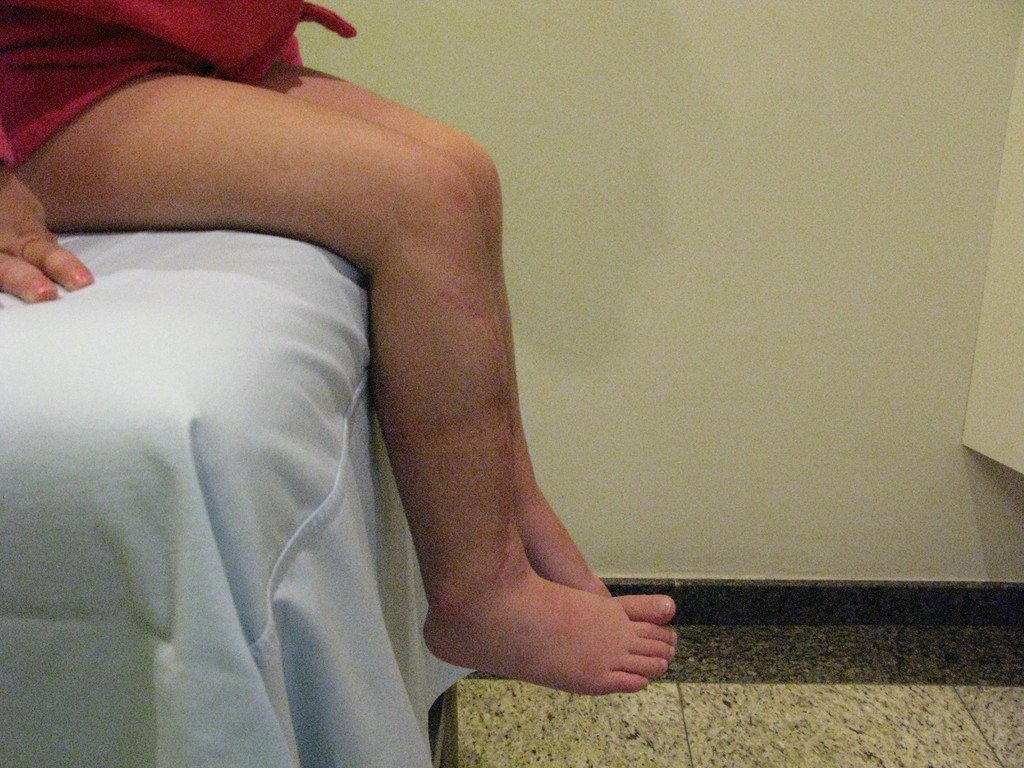
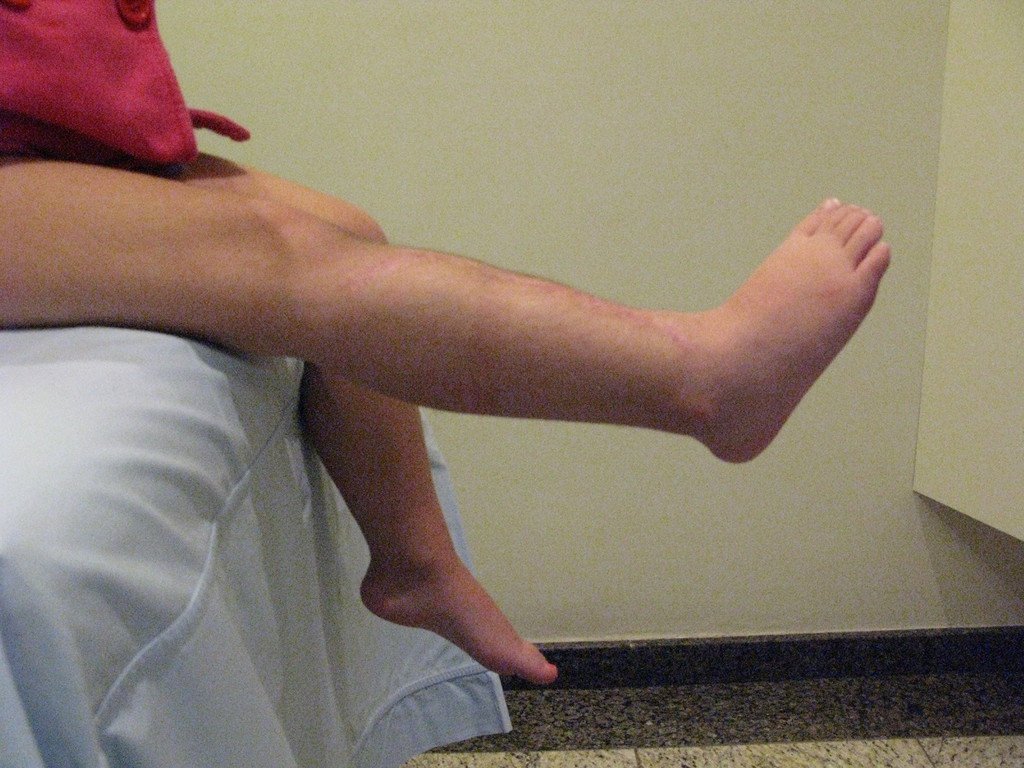
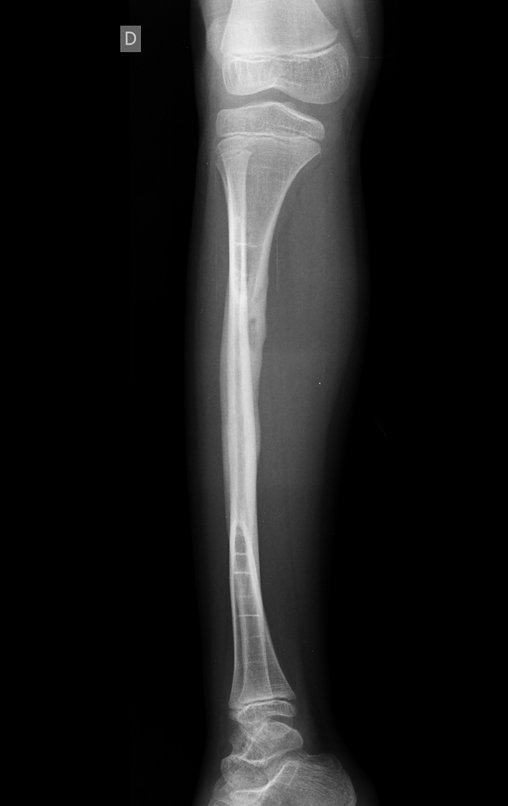
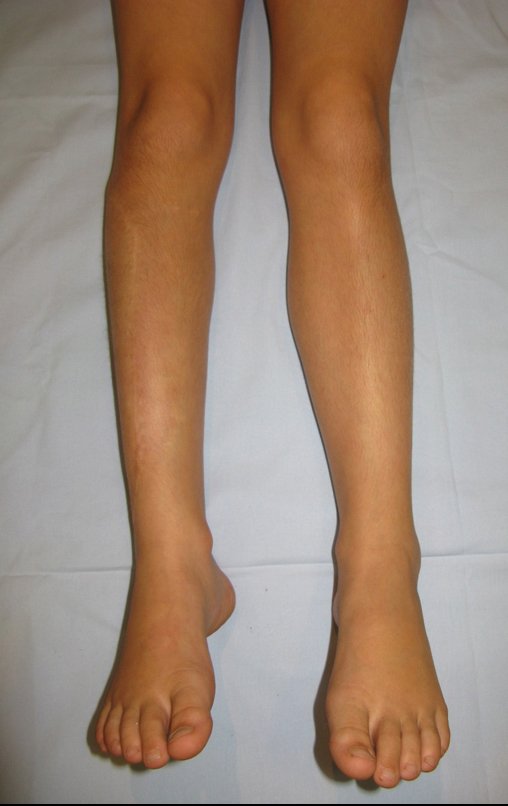
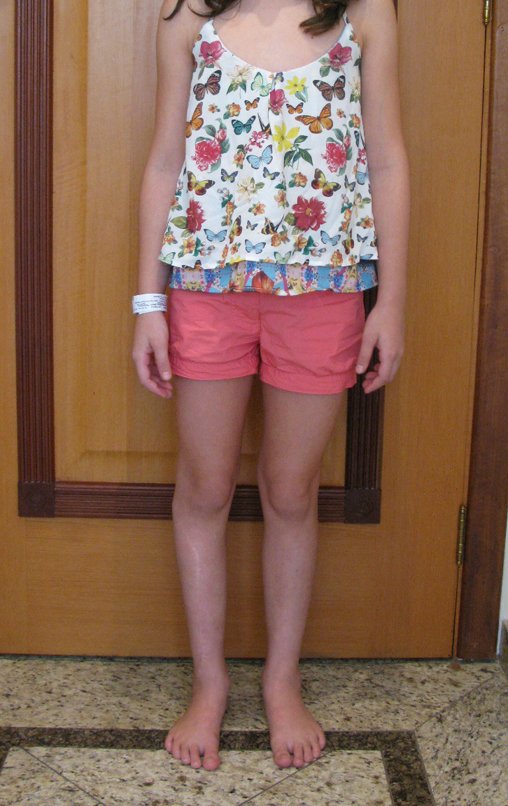
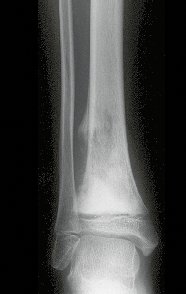
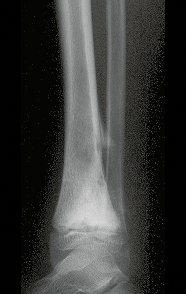
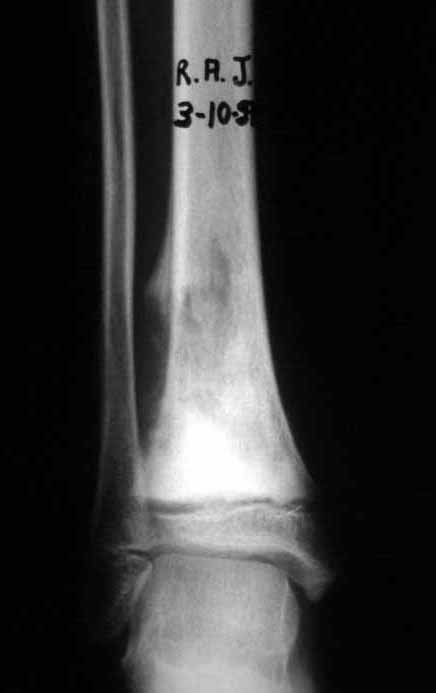
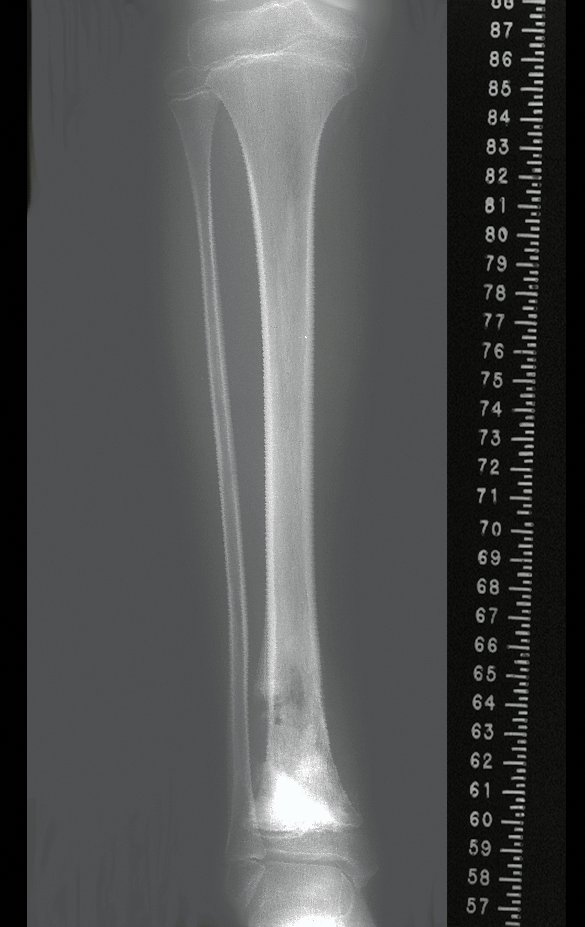
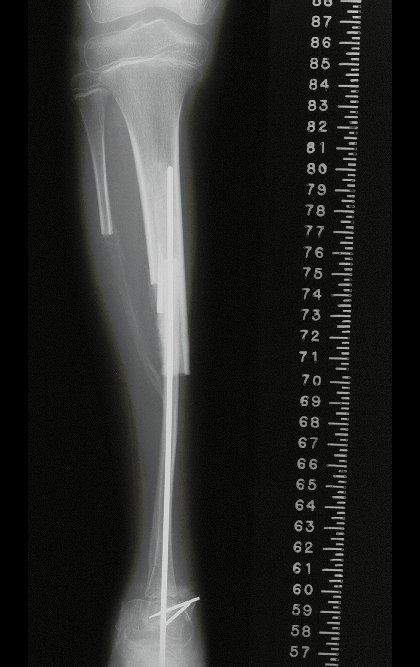
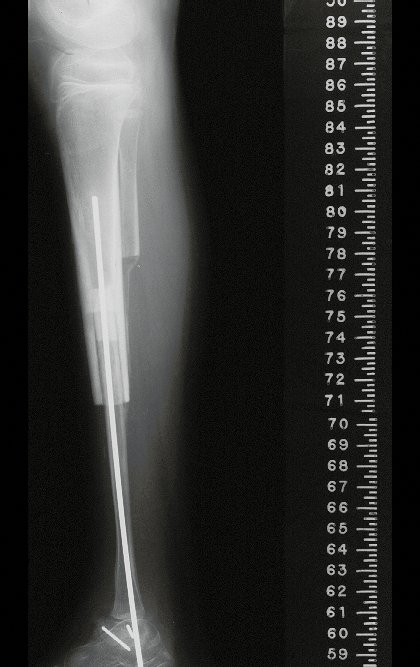
O cisto ganglionar intra neural é uma lesão rara, caracterizada pela sua presença dentro de um nervo periférico. Trata-se de uma formação benigna que contém um líquido gelatinoso similar ao encontrado nos cistos ganglionares comuns, os quais geralmente ocorrem perto de articulações ou tendões.
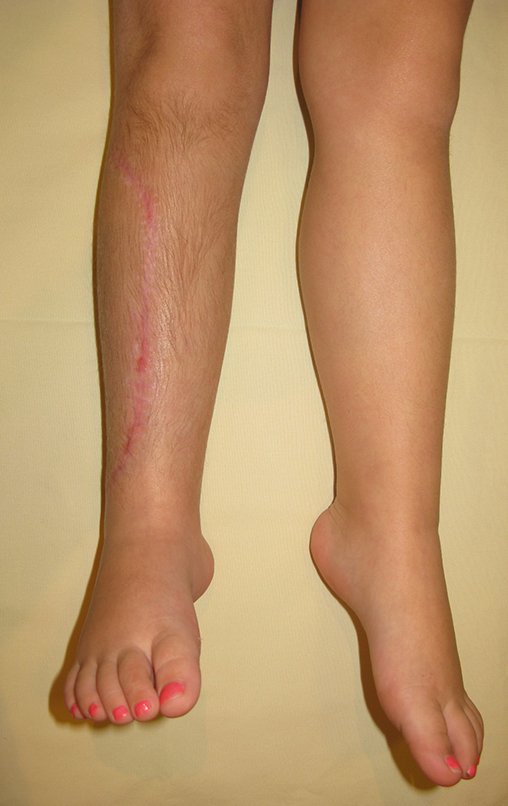
A localização intra neural, no entanto, diferencia esse cisto por causar sintomas específicos relacionados à compressão do nervo afetado, ocasionando sintomas de neuropraxia, que podem evoluir para paralisia motora. Por isso, deve ser tratado assim que diagnosticado, evitando-se a consequente degeneração gordurosa da musculatura envolvida, o que inviabilizaria a recuperação funcional.
A patogênese dos cistos intra neurais tem duas teorias: uma que sugere a formação cística isolada dentro do nervo devido a um processo degenerativo, enquanto a outra sugere que os cistos se originam de uma articulação vizinha, estendendo-se das articulações ao longo da adventícia de um ramo articular, assim como fazem ao longo do perineuro dentro dos feixes neuro vasculares, dada a forte associação de cistos intra neurais com articulações próximas.
Uma teoria unificada, baseada no nervo fibular, que é o mais comumente afetado, sugere que cistos para-articulares surgem de articulações com pressão intra-articular elevada. Essa pressão faria com que o material cístico se estendesse por rupturas ou regiões enfraquecidas da cápsula articular, seguindo caminhos de menor resistência, resultando em cistos tanto extra neurais quanto intra neurais. Essa teoria também foi estendida para explicar cistos em outros nervos, como o tibial, ulnar, mediano e supra escapular, em diversas articulações.
Os cistos podem se propagar por várias rotas, incluindo artérias, veias e nervos, levando a diferentes combinações de cistos. A presença simultânea de cistos intra neurais em nervos distintos, como o fibular e o tibial, associados a cistos vasculares e intramusculares no mesmo local, sugere uma relação causal comum, reforçando a ideia de um mecanismo compartilhado na formação desses cistos.
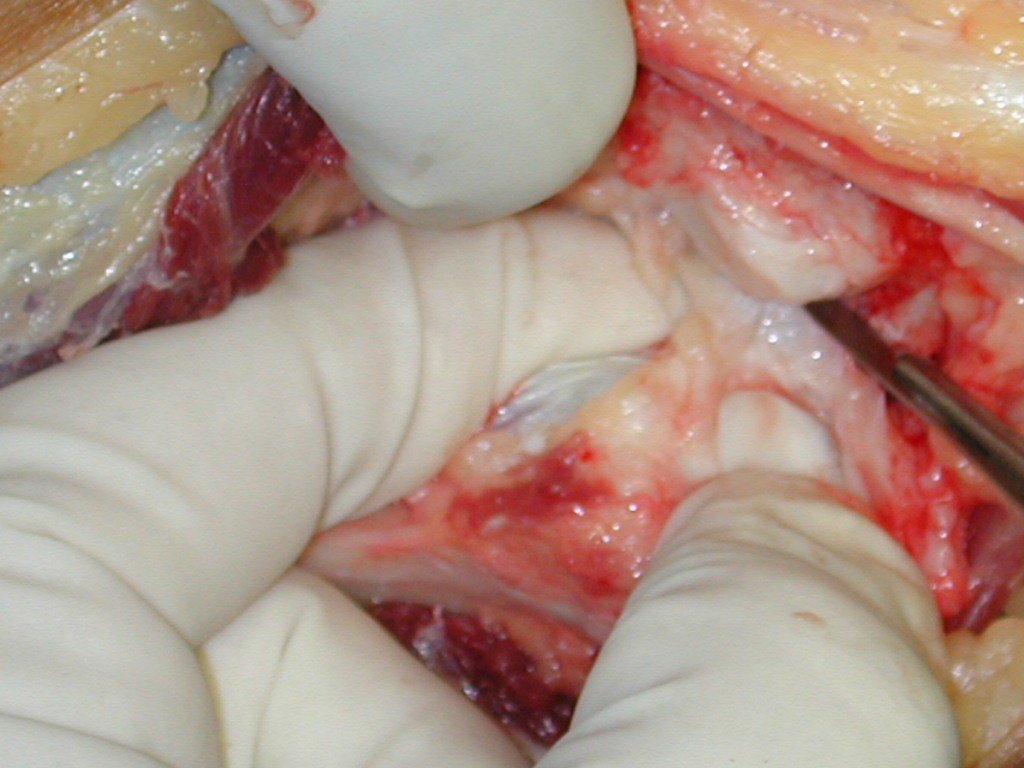
O tratamento cirúrgico, executado com a descompressão articular e a neurolise, deve ser o mais precoce possível. Estes cistos ganglionares intra neurais podem causar uma variedade de sintomas, dependendo do nervo envolvido e da extensão da compressão. Os sintomas comuns incluem dor, fraqueza muscular, dormência e parestesias (sensações anormais, como formigamento). Esses sintomas podem ser progressivos, à medida que o cisto aumenta de tamanho, exercendo maior pressão sobre as fibras nervosas.
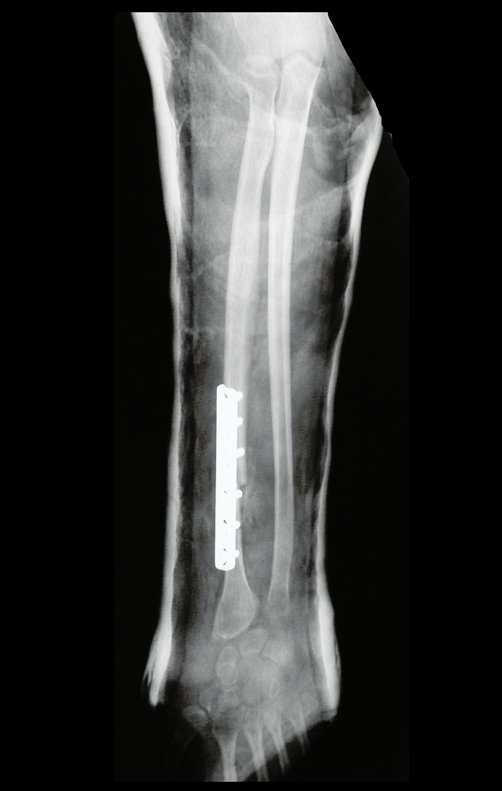
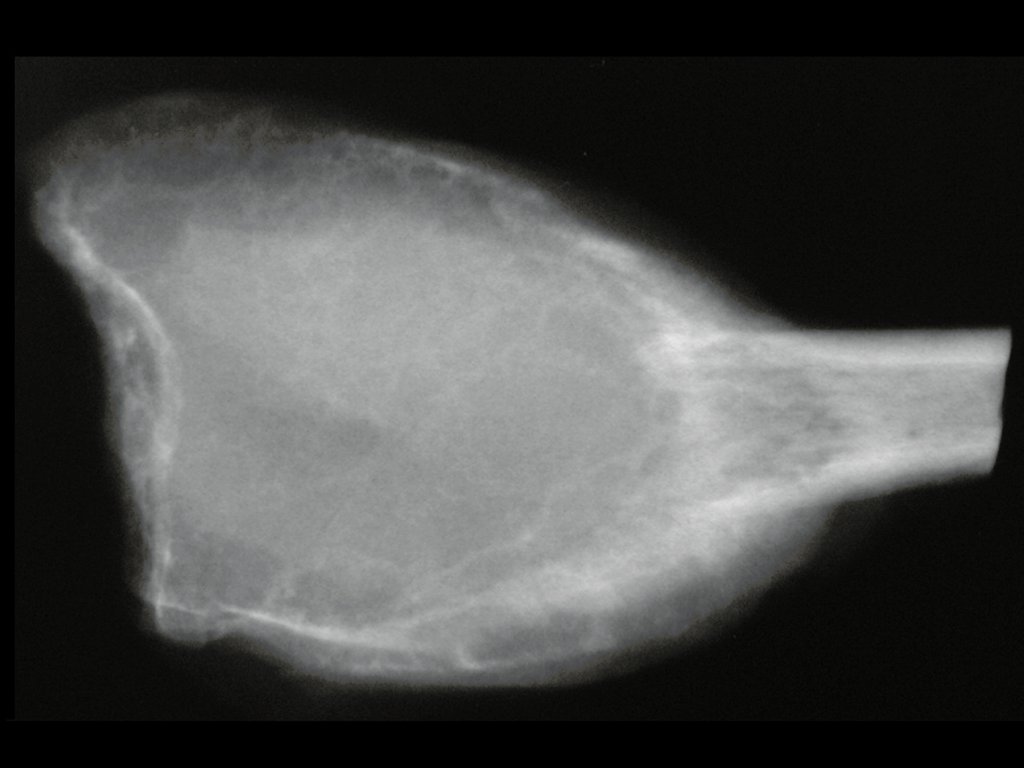
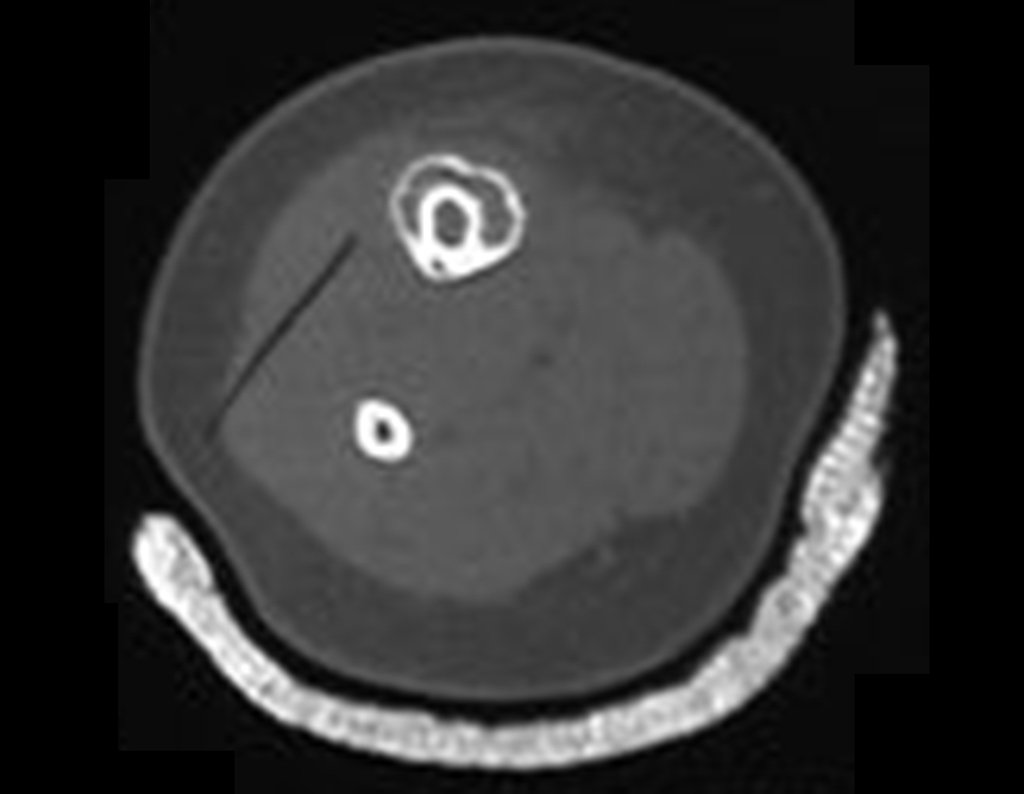
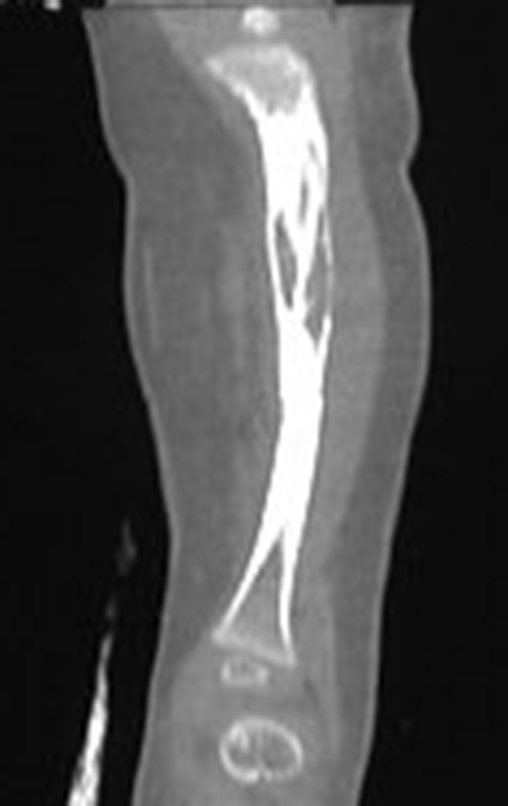
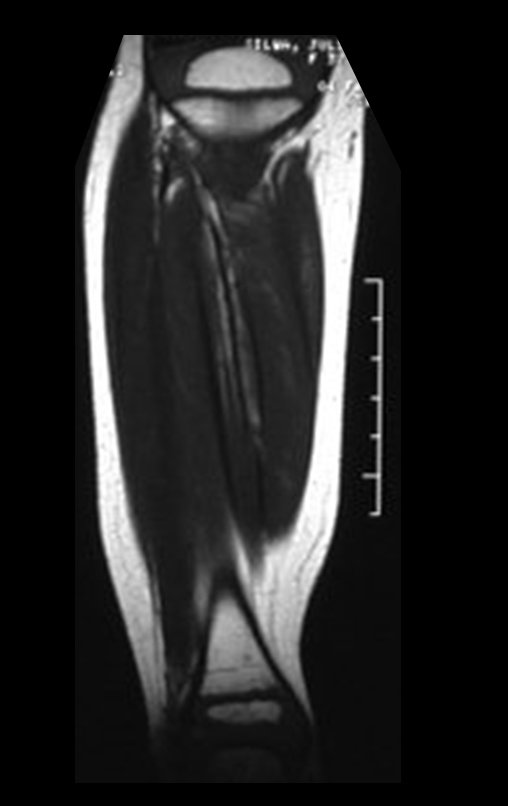
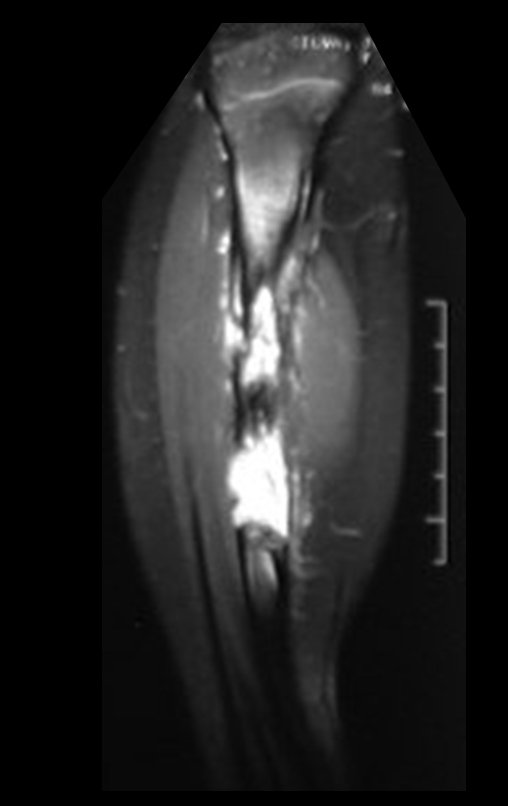
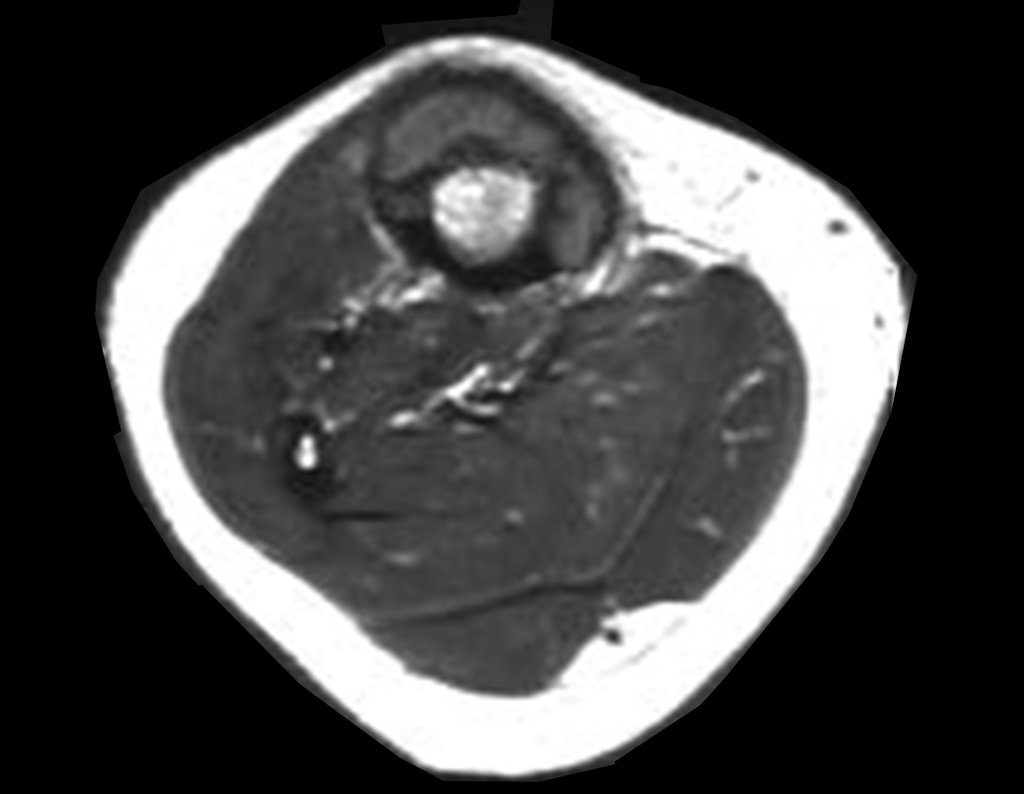
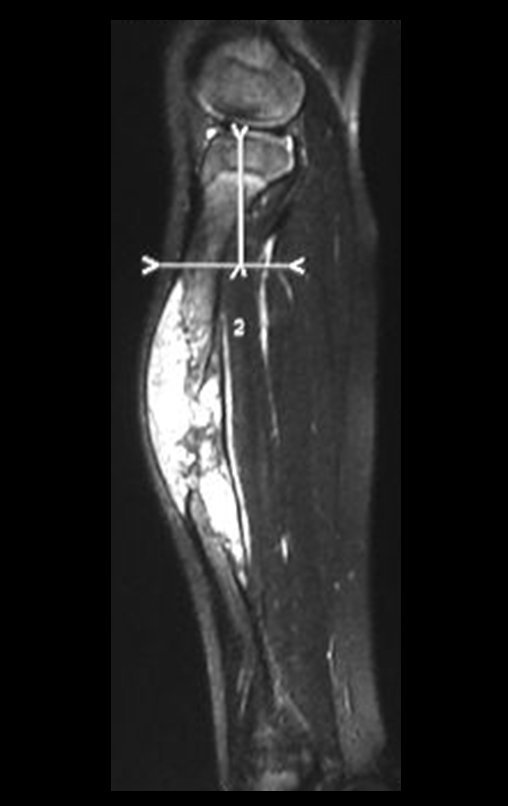
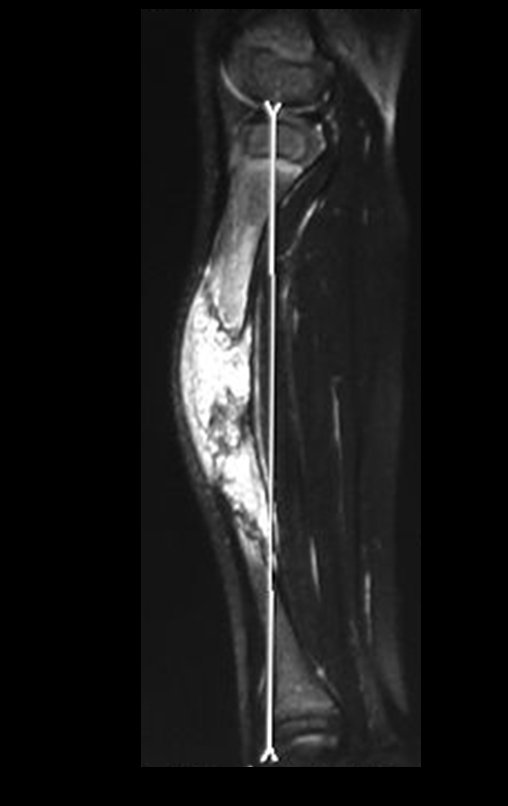
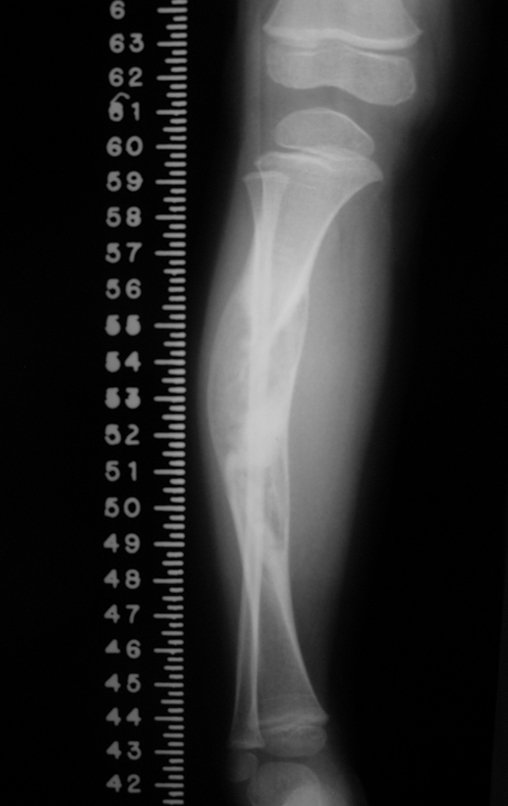
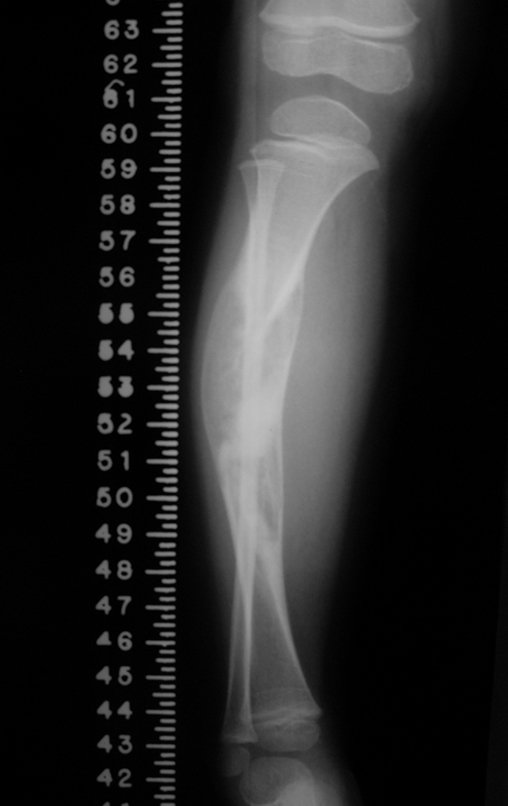
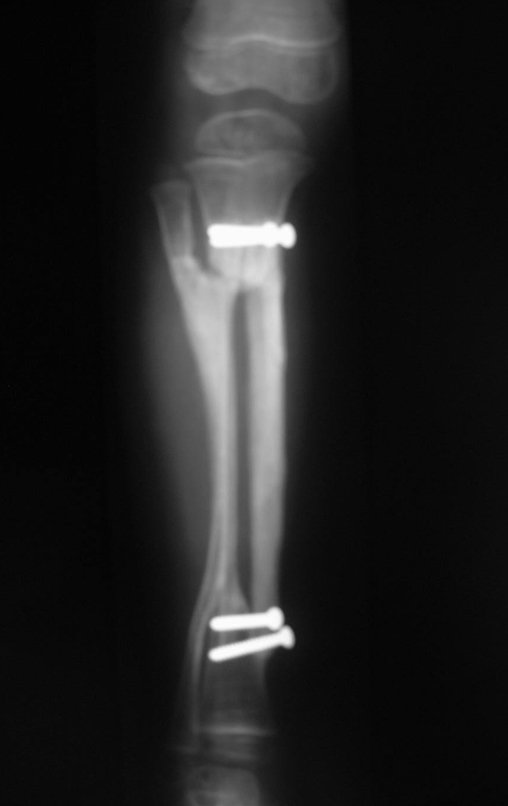
O diagnóstico de um cisto ganglionar intra neural geralmente envolve a realização de exames de imagem, sendo a ressonância magnética (RM) o melhor método para o diagnóstico. Esses exames permitem a visualização do cisto e ajudam a determinar sua localização, tamanho e eventual compressão articular existente. A ressonância magnética pode ser complementada pela tomografia neste estudo articular, que, associada à RM, torna-se mais eficaz para avaliar a relação do cisto com as estruturas nervosas e osteoarticulares adjacentes.
O tratamento de cistos ganglionares intra neurais pode variar dependendo da gravidade dos sintomas e do impacto na função nervosa. A aspiração com agulha guiada por ultrassonografia pode ser realizada para drenar o conteúdo do cisto. No entanto, há o risco de recorrência, pois a aspiração não remove a parede do cisto e não trata a compressão articular, quando existente.
Em casos de sintomas graves ou progressivos, a remoção cirúrgica do cisto pode ser necessária. A cirurgia visa remover o cisto completamente, incluindo sua parede, para minimizar o risco de recorrência, além de realizar a descompressão articular. O procedimento cirúrgico deve ser cuidadoso, visando preservar a integridade do nervo afetado.
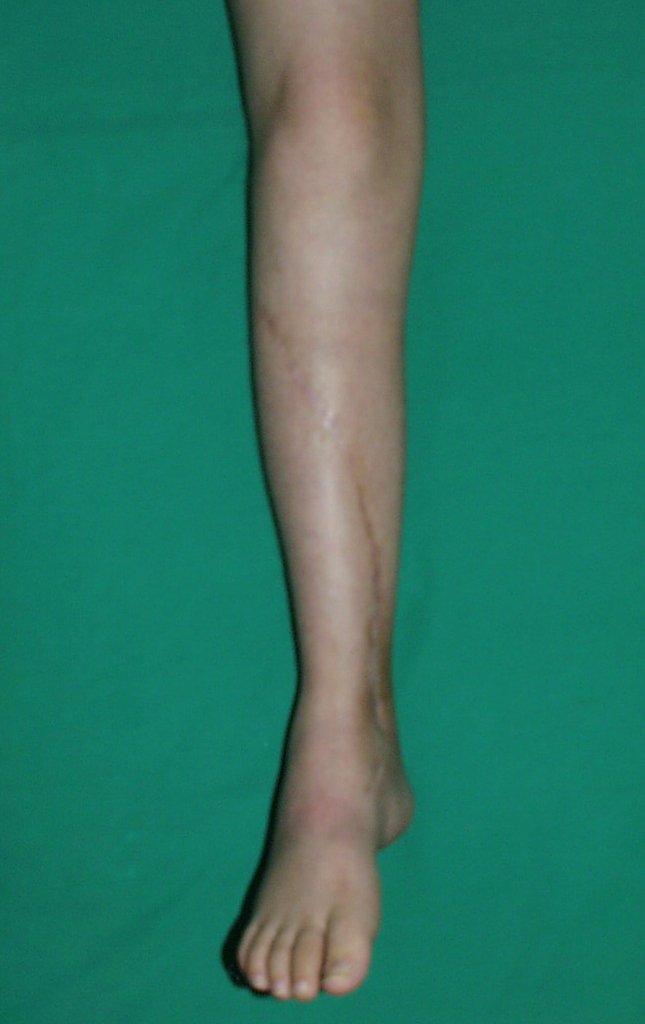
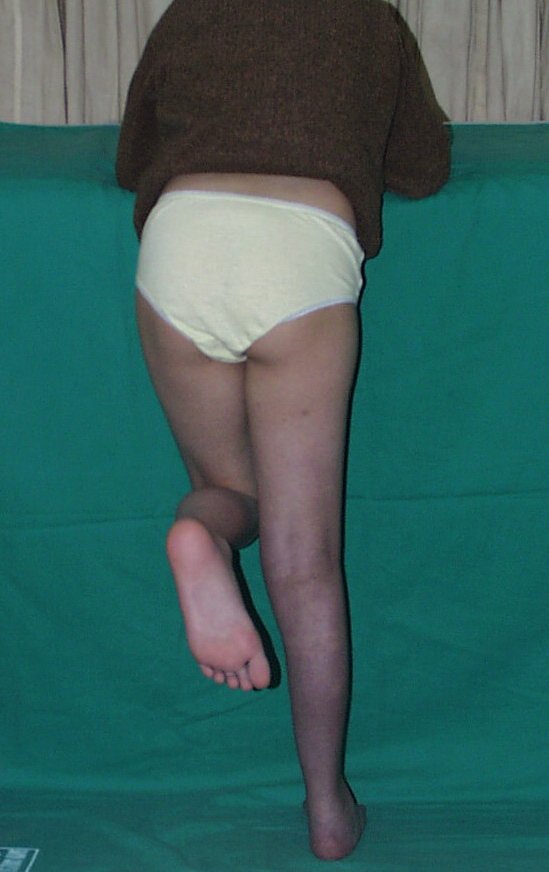
O prognóstico para pacientes com cisto ganglionar intra neural é geralmente bom, especialmente quando o diagnóstico é precoce e o cisto é tratado adequadamente. A remoção cirúrgica completa tende a oferecer os melhores resultados, com alívio significativo dos sintomas e baixo risco de recorrência. No entanto, a recuperação pode depender da extensão da lesão nervosa pré-existente e da eficácia da intervenção cirúrgica.
Em resumo, o cisto ganglionar intra neural é uma condição rara que pode causar sintomas neurológicos significativos devido à compressão nervosa. O diagnóstico precoce e o tratamento adequado são essenciais para prevenir danos nervosos permanentes e proporcionar alívio sintomático aos pacientes afetados.
Confira abaixo o vídeo da Aula.
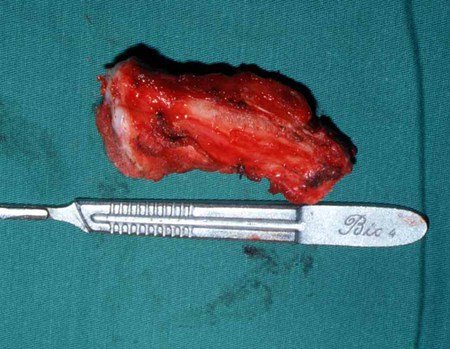
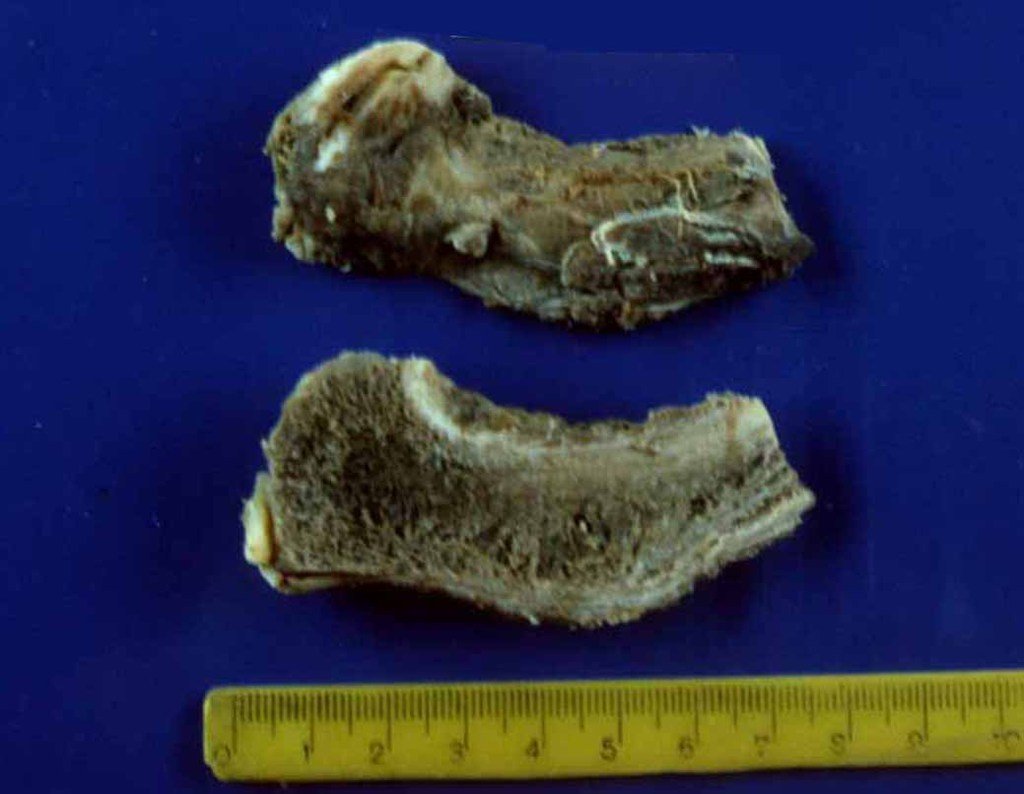
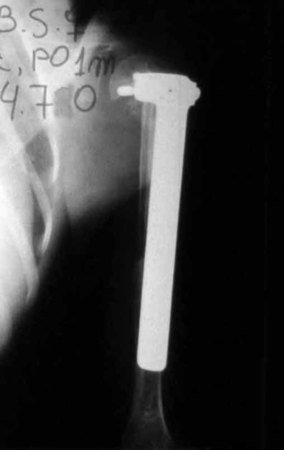
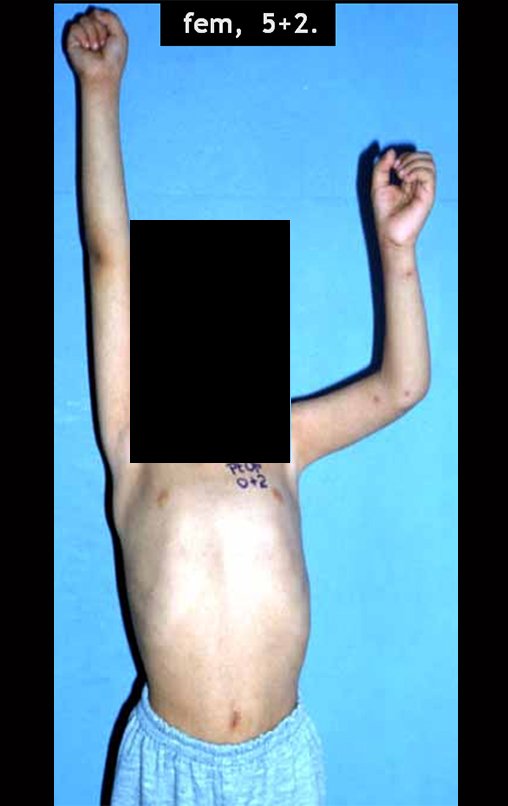
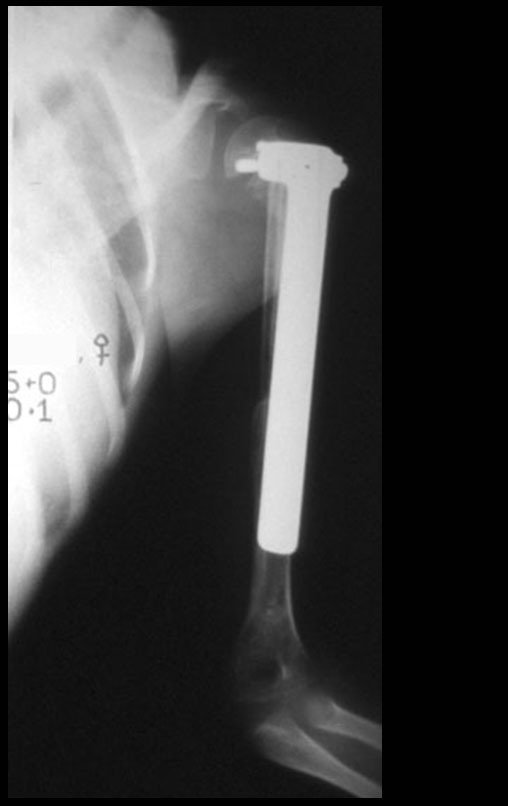
Sarcoma de Ewing do Úmero em Criança. Paciente com quatro anos e cinco meses de idade, apresentou dor e tumor no úmero esquerdo, em janeiro de 1991. A biópsia revelou tratar-se de Sarcoma de Ewing. O estadiamento não revelou outro foco. Submeteu-se a tratamento com quimioterapia neoadjuvante, apresentando boa resposta radiográfica ao tratamento, ocorrendo mineralização da lesão e deformidade angular pela plasticidade neoplásica, figuras 1 a 4.
10. Sarcoma de Ewing do úmero em criança – Conduta – Técnicas de ressecção e de reconstrução com placa especial – Enxerto autólogo combinado de fíbula e ilíaco
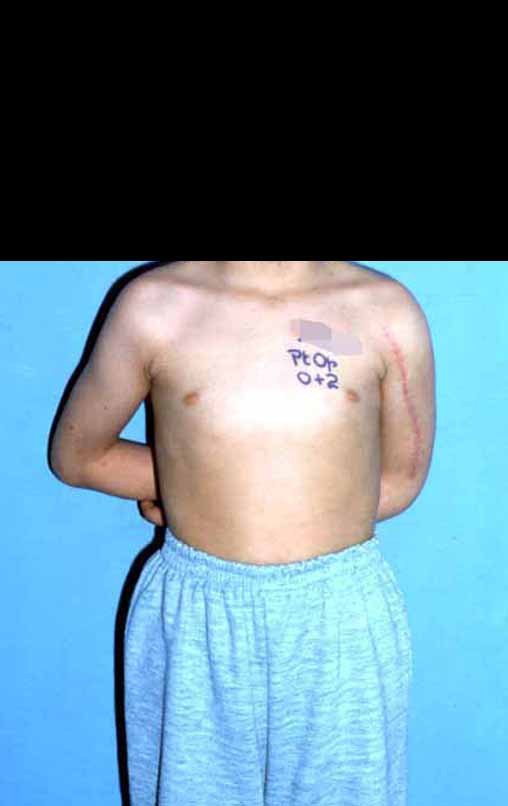
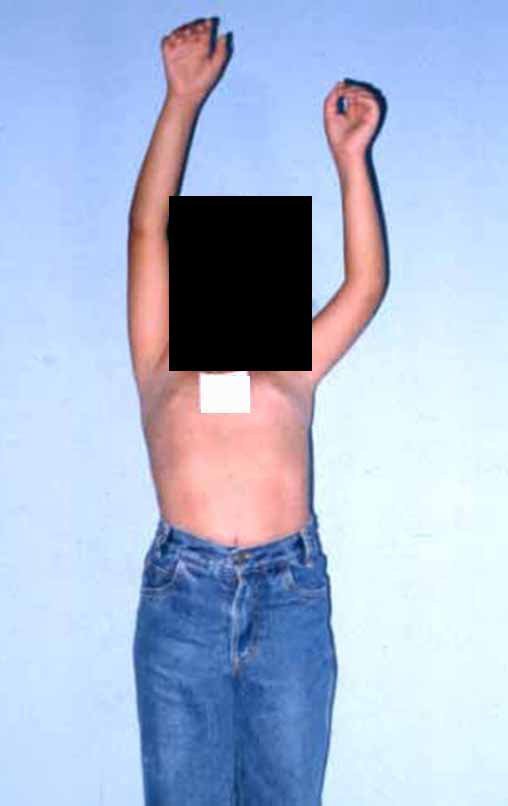
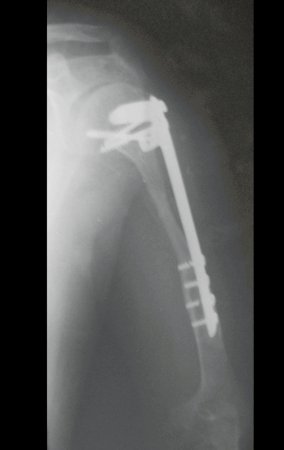
A radiografia de controle com um mês de pós-operatório e a função do membro operado são mostradas nas figuras 11 a 14.
Vídeo 1: Boa estética, apesar do encurtamento, boa função, após 22 anos da cirurgia, em 11/01/2012.
As figuras 37 a 42, ilustram etapas da evolução deste caso de Sarcoma de Ewing, tratado cirurgicamente com uma solução biológica.
Em maio de 2015, a paciente teve o seu primeiro filho, dando luz à um menino. Em 1991 ainda não realizavamos o autotransplante de cartilagem de crescimento, reconstruindo este segmento com fíbula vascularizada com a placa de crescimento, para substituir a placa do úmero que quando esta é ressecada. Entretanto, o membro superior aceita melhor a discrepância de comprimento, coroando a alternativa que empregamos na época.
Autor: Prof. Dr. Pedro Péricles Ribeiro Baptista
Oncocirurgia Ortopédica do Instituto do Câncer Dr. Arnaldo Vieira de Carvalho
Consultório: Rua General Jardim, 846 – Cj 41 – Cep: 01223-010 Higienópolis São Paulo – S.P.
Fone:+55 11 3231-4638 Cel.:+55 11 99863-5577 Email: drpprb@gmail.com
Tumor de células gigantes do rádio: Paciente feminina, 26 anos de idade, com dor no punho esquerdo havia dois meses. Procurou atendimento inicial em janeiro do ano 2000, quando foram feitas radiografias e tomografia, apresentando as seguintes imagens (Figuras 1 a 6).
08. Tumor de Células Gigantes do Rádio – Técnica de ressecção do tumor – Técnica de obtenção do enxerto autólogo da fíbula – Técnica de reconstrução do punho
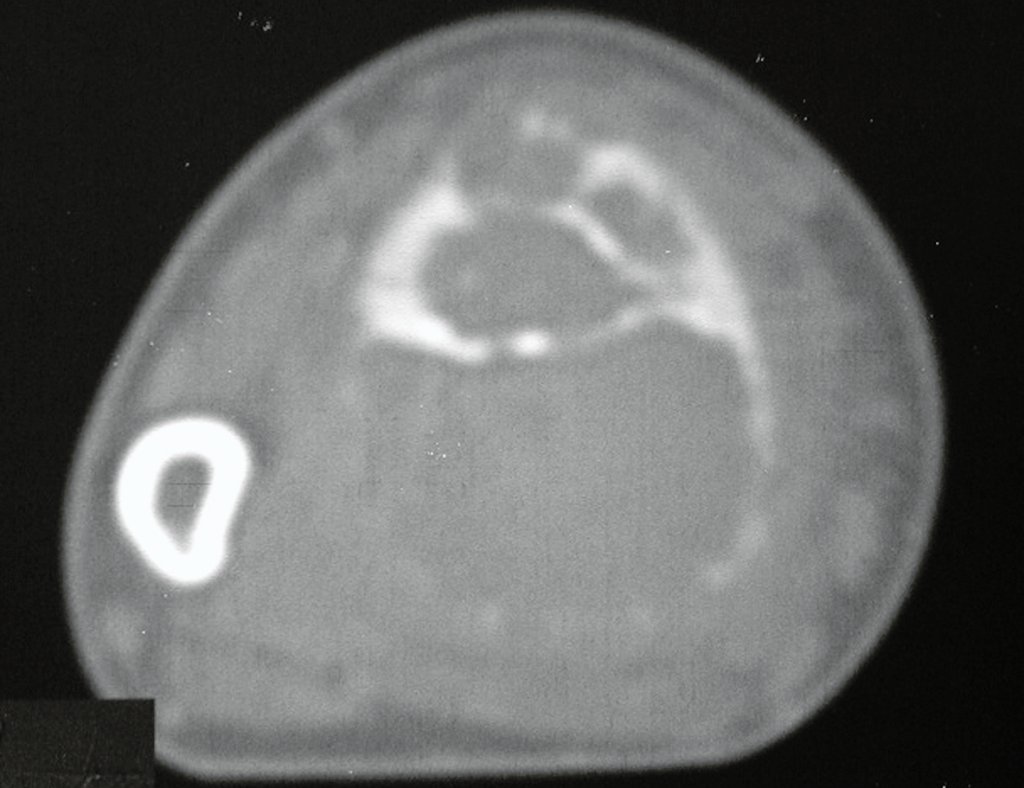
Em maio de 2005, com a suspeita de tumor de células gigantes, foi encaminhada para um segundo hospital, cinco meses do primeiro atendimento. Novo encaminhamento foi feito, agora para nosso atendimento, em outubro daquele ano (Figuras 7 à 10).
O diagnóstico histológico da biópsia confirmou a suspeita clínica de tumor de células gigantes (Figuras 19 a 24).
O estudo de ressonância magnética mostra lesão de rarefação óssea, com áreas de necrose, erosão, insuflação e fratura infracção da cortical, com deformidade e afundamento da superfície articular (figuras 25 a 36).
Com este estudo, confirmamos a agressividade local do tumor, e a grande destruição da extremidade distal do rádio esquerdo, com fratura por infracção, deformidade articular e encurtamento do rádio. Nesta situação o tratamento intralesional deve ser contraindicado, devido à alta possibilidade de recidiva local, além da perda da função. Oncologicamente está indicada a ressecção segmentar do rádio, e reconstrução do punho. A artrodese pode ser uma alternativa, mas preferimos preservar a função e a anatomia do punho, sempre que possível. Neste caso, optamos por reconstruir com enxerto autólogo não vascularizado, obtido do segmento proximal da fíbula ipsilateral, que mimetiza melhor o rádio.
A cirurgia é realizada em decúbito dorsal horizontal, preferentemente sem uso de garroteamento do membro. Os detalhes da ressecção são mostrados nas figuras 38 a 57.
Após a ressecção do segmento distal do rádio e a revisão cuidadosa da hemostasia, colocamos compressa umedecida com soro fisiológico no leito cirúrgico, e enfaixamos temporariamente com faixa crepe.
Passamos para a segunda etapa: A obtenção do enxerto autólogo, não vascularizado, obtido do segmento proximal da fíbula ipsilateral. É preferível utilizar o enxerto obtido do mesmo lado, pois a face lateral da fíbula e a tuberosidade de inserção do ligamento colateral lateral, mimetizam melhor a face dorsal do rádio do mesmo lado. Desta forma o ápice da fíbula substituirá a estiloide radial.
É importante obter este enxerto com cápsula articular, da articulação tíbio-fibular proximal, em toda a circunferência da epífise fibular.
Desta maneira teremos tecidos moles para a reconstrução circunferencial da neo articulação fibulo-carpal. A seguir, detalhamos a obtenção do enxerto da fíbula (Figuras 58 a 75).
Vídeo 1: Supinação e pronação ativa e simétrica dos punhos, seis meses após a cirurgia. Boa função.
Vídeo 2: Flexão e extensão ativa e simétrica dos dedos, após seis meses. Boa função.
Vídeo 3: Pronação e supinação simétrica, após quinze anos da cirurgia.
Vídeo 4: Flexão e extensão em 29 de setembro de 2015, após quinze anos de pós-operatório.
Vídeo 5: Atitude indiferente e espontânea dos punhos. Boa simetria e função em 29/15/2015. Pós-operatório de quinze anos.
Vídeo 6: Boa força muscular e estabilidade do punho esquerdo, levantando significativo peso após 19 anos de cirurgia, em 22 de agosto de 2019.
Autor: Prof. Dr. Pedro Péricles Ribeiro Baptista
Oncocirurgia Ortopédica do Instituto do Câncer Dr. Arnaldo Vieira de Carvalho
Consultório: Rua General Jardim, 846 – Cj 41 – Cep: 01223-010 Higienópolis São Paulo – S.P.
Fone:+55 11 3231-4638 Cel.:+55 11 99863-5577 Email: drpprb@gmail.com
Osteofibrodisplasia – Técnica De Tibialização Da Fíbula. Paciente com um ano de idade, apresentando deformidade angular da perna direita, com caráter progressivo. Atendida por ortopedista que realizou radiografias, tomografia e orientou bota gessada, para corrigir a deformidade, Figuras 1 a 9.
04. Osteofibrodisplasia – Técnica de tibialização da fíbula – Técnica de reconstrução combinada de enxerto autólogo e homólogo
Após este estadiamento, explicamos sobre o prognóstico desta afecção aos pais e indicamos a necessidade de intervenção cirúrgica. A Família foi para o exterior onde consultou e acompanhou com outros profissionais da especialidade, retornando a nos procurar em dezembro de 2009, trazendo as imagens daquele período de acompanhamento, Figuras 18 a 31.
Em virtude da proximidade com as festas de Natal, propusemos reavaliação no começo do ano e planejamento de cirurgia de ressecção da lesão e tibialização da fíbula, para a reconstrução.
A paciente é reavaliada no princípio de fevereiro de 2010, com o exame de ressonância magnética, Figuras 32 a 43.
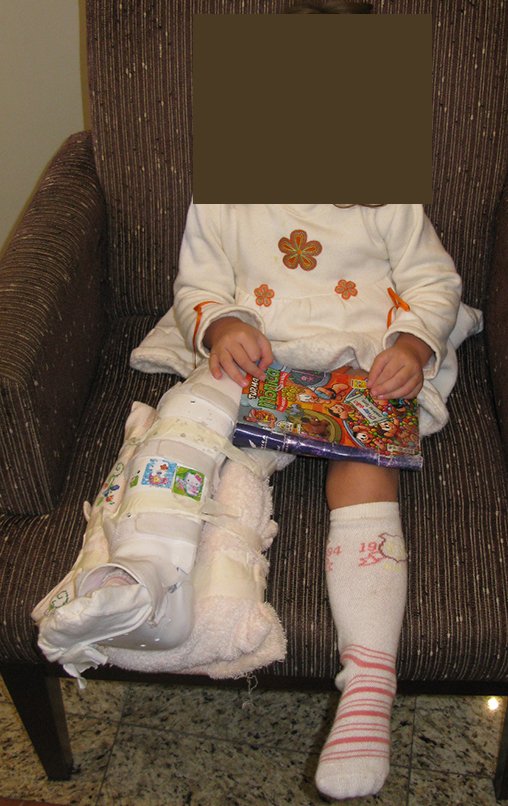
Nesta ocasião realizamos a confecção de um molde com gesso cruro-podálico, para a confecção de ortese, que será utilizada para imobilização no pós operatório, figuras 48 e 49.
No planejamento pré-operatório solicitamos a preparação de “réguas” de tíbia de osso de banco, para utilizar como suporte.
Geralmente encavilhamos a fíbula com fio de Kirchner, mas nesta paciente isto não era possível pois o canal medular da fíbula era muito estreito.
O enxerto homólogo de tíbia é escolhido e preparado para auxiliar na reconstrução. Para regularizar a espessura utilizamos uma fresa, até atingir o tamanho adequado, figuras 74 a 77.
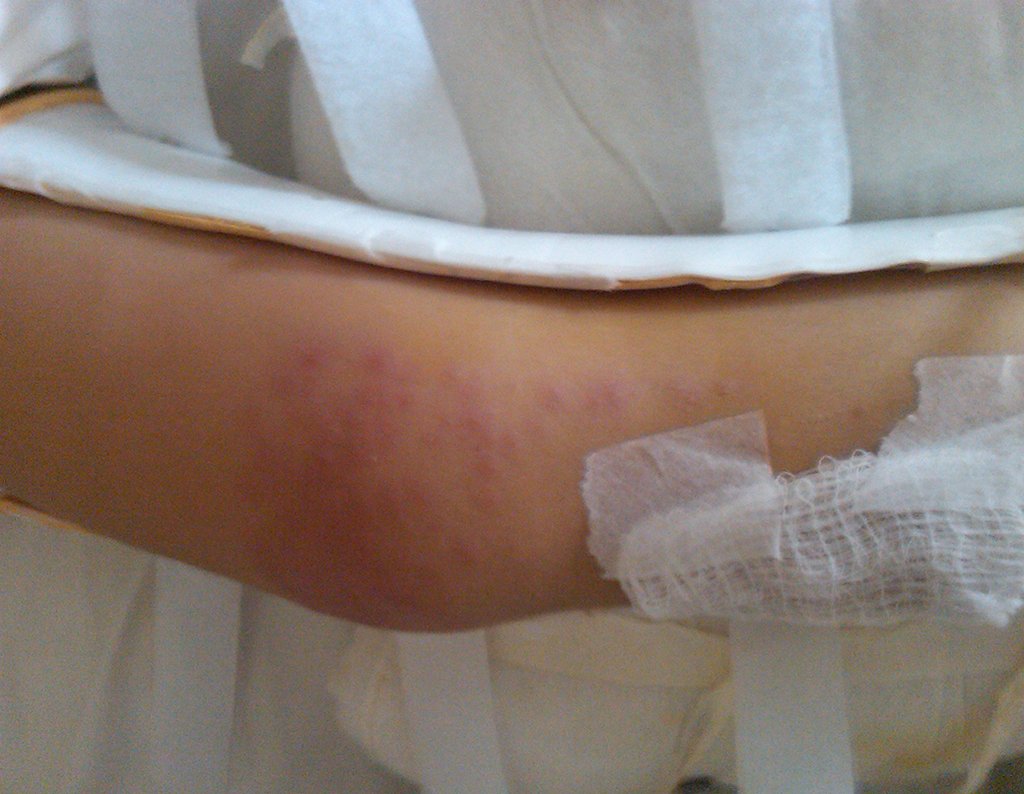
É preciso cuidado redobrado com crianças. No terceiro dia pós operatório, ao realizar o curativo para a alta hospitalar, observamos o início de uma escara por compressão, figura 94e 95. Os pais foram orientados quantos aos cuidados com o curativo, não deixar aumento de volume no local, evitando a compressão e contatar-me em qualquer eventualidade.
Visitamos a paciente no sexto dia de pós operatório, 25/02/2010, em sua casa. Paciente com a órtese, , bom aspecto clínico. O sorriso dela confirma a nossa tranquilidade de que está tudo bem, figura 96.
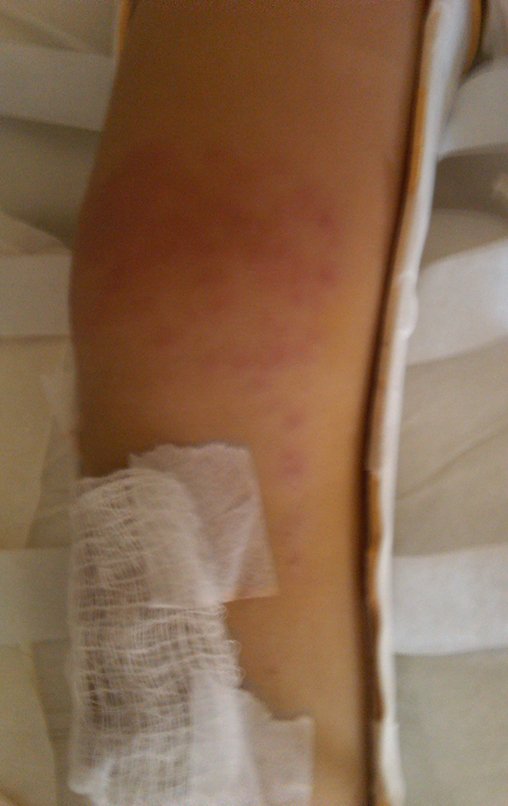
Surpreendentemente, às 23h00 do dia seguinte a mãe telefona informando que a criança estava inquieta e febril. Orientei para administrar antitérmico e manter-me informado. Na manhã do dia seguinte, sábado, 27/02/2010 ligo e recebo a informação de que a febre não cede e a criança está prostrada. Vou visitá-la preocupadíssimo. Infecção? Ao retirar a órtese encontro este aspecto clínico!!!, figuras 97 a 99.
O processo eritematoso está ocorrendo apenas onde há contato com o revestimento da órtese. Alergia?
Alergia!!! A paciente era alérgica ao revestimento da órtese. Alergia ao E.V.A. (Etileno Acetato de Vinila).
Conversando com a mãe, ela lembrou-se que a criança ficava com as nádegas cheias de pontos avermelhados quando brincava sobre o tapete emborrachado. Juntamente com o pai, retiramos todo o forro de E.V.A. da órtese, forramos com fralda de pano e administrei anti-histamínico, o que resolveu a intercorrência.
A paz voltou a reinar naquele sábado de 27/02/2010. Observem que a reação alérgica em faixa ocorre apenas sob o contato do E.V.A.
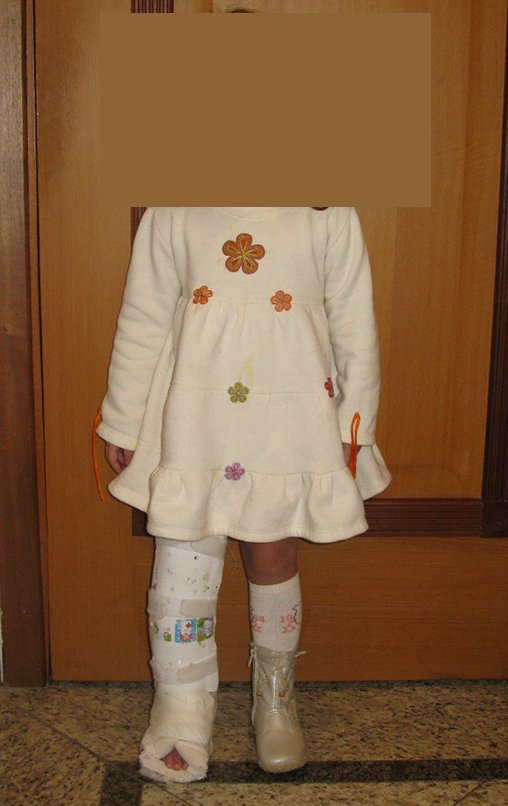
A paciente retorna ao consultório após seis semanas da cirurgia, figuras 100 a 102 e vídeo 1.
Vídeo 1: Início de carga, após seis semanas da cirurgia.
Na semana seguinte já consegue caminhar sem ajuda, video 2.
Vídeo 2: Carga total com sete semanas de pós-operatório, em 09/04/2012.
Reavaliação clínica e de imagem na décima semana de pós-operatório. sete semanas de pós-operatório, em 09/04/2012.
Vídeo 3: Função de flexo-extensão do joelho, após 14 semanas da cirurgia.
Vídeo 4: Marcha após 14 semanas da cirurgia, ainda usando a órtese para proteção da reconstrução.
Após o terceiro mês, liberamos o uso da órtese e a paciente inicia a marcha sem o tutor de proteção.
Vídeo 5: Marcha com 16 semanas de pós-operatório, sem a órtese.
Vídeo 6: Deambulação após cinco meses.
Vídeo 7: Paciente após seis meses da cirurgia.
Vídeo 8: Após sete meses da reconstrução, 27/09/2010.
Vídeo 9: Função normal, marcha sem claudicação, após um ano e um mês da cirurgia, 28/03/2011.
Vídeo 10: A paciente apresenta desenvoltura normal, após 13 meses de pós-operatório.
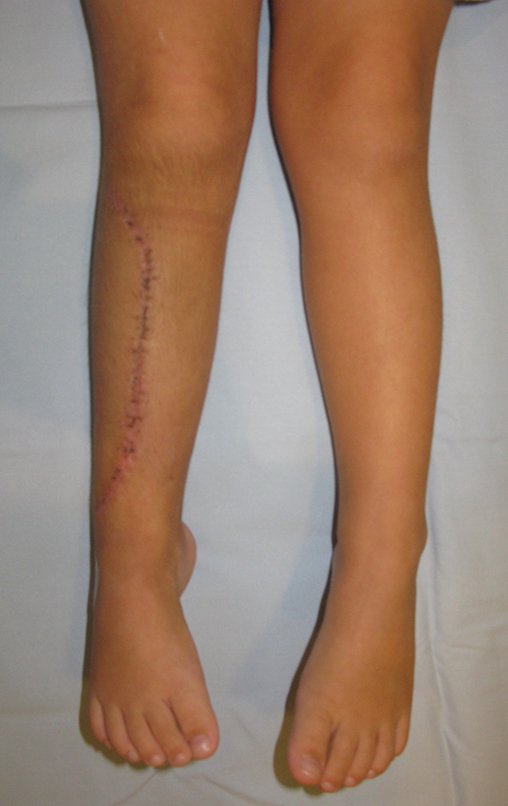
Como comentamos nas figuras 112 e 114, que o enxerto homólogo tem suas limitações. Quando começa a ser integrado, isto é, começa a ser reabsorvido para ser re-ossificado, ocorre a fragilização do osso estrutural. Neste caso, aparece uma fratura pós stress no osso homólogo “transplantado”. Analisemos as Figuras 121-125, a seguir.
A paciente apresentou claudicação por dor. O enxerto homólogo recebe parte da carga o que dificulta o espessamento da fíbula, retardando o fenômeno da tibialização. Em casos anteriores não utilizamos enxerto de banco de osso e não tivemos nenhuma dificuldade com a integração da fíbula, que tibializou-se sem dificuldade.
Apesar desta intercorrência, formou-se o calo hipertrófico e a claudicação desapareceu.
Vídeo 11: Paciente em 04/10/2012, após a consolidação do enxerto.
A fase proximal da tíbia, no joelho, cresce mais do que fase distal, no tornozelo, o que leva à migração distal da cicatriz do calo ósseo.
Vídeo 12: A paciente caminha com discreta claudicação, semelhante à marcha de pseudoartrose, em 20/04/2013.
Vídeo 13: Função em 28/05/2013.
Vídeo 14: Paciente em 22/07/2013.
Vídeo 15: Boa função em 20/12/2013.
Vídeo 16: Autorizada carga total, discreta claudicação.
Vídeo 17: Função em 15/01/2014, ainda discreta claudicação.
Vídeo 18: Melhora significativa da marcha, sem claudicação, com boa função, após quatro meses da fratura, em 12/02/2014, após quatro anos da transferência da fíbula para a tíbia.
Vídeo 19: Paciente após 5 anos e 9 meses de pós-operatório, flexão e extensão normal do joelho, sem carga.
Vídeo 20: Paciente em 10/11/2015, após cinco anos e nove meses da cirurgia, membros simétricos, andando sem claudicação, flexão e extensão dos membros inferiores normal, com carga total.
Vídeo 21: Equilíbrio e carga total no membro operado, retirando a sandália, após cinco anos e nove meses da cirurgia, em 10/11/2015.
Vídeo 22: Equilíbrio e carga total no membro operado, calçando a sandália, após cinco anos e nove meses da cirurgia, em 10/11/2015.
Autor: Prof. Dr. Pedro Péricles Ribeiro Baptista
Oncocirurgia Ortopédica do Instituto do Câncer Dr. Arnaldo Vieira de Carvalho
Consultório: Rua General Jardim, 846 – Cj 41 – Cep: 01223-010 Higienópolis São Paulo – S.P.
Fone:+55 11 3231-4638 Cel.:+55 11 99863-5577 Email: drpprb@gmail.com
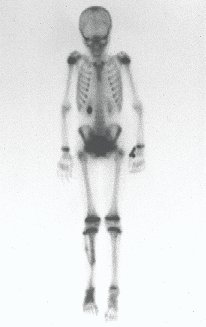
Auto transplante Da Placa De Crescimento Distal Da Fíbula. Paciente em dezembro de 1996, com oito anos de idade, com osteosarcoma da região meta-epifisária distal da tíbia, tratada com quimioterapia neo-adjuvante (Figuras 1 à 4).
02. Auto transplante da placa de crescimento distal da fíbula. Osteossarcoma da região distal da tíbia. Tibialização da fíbula distal com preservação da placa epifisária.
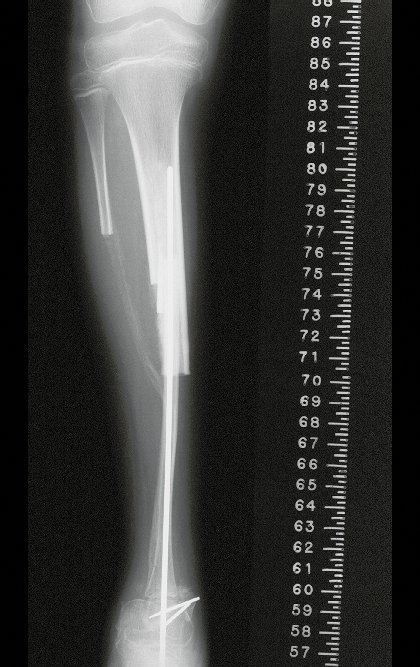
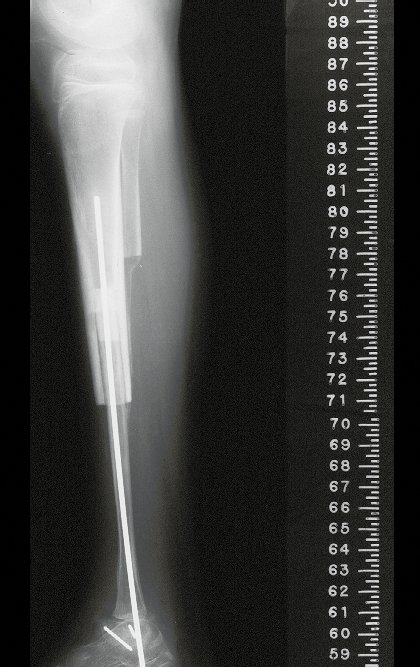
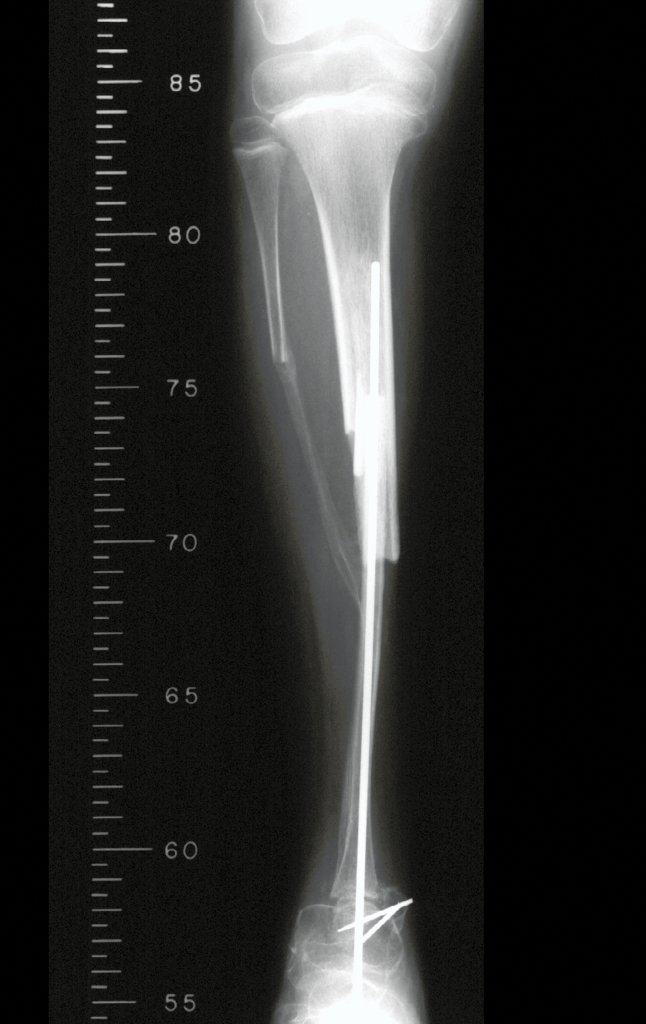
A tomografia evidencia tumor próximo à placa de crescimento, requerendo a ressecção da mesma, como margem oncológica (figura5). Como reconstruir este segmento em uma criança com sete anos de idade e evitar a discrepância dos membros inferiores? Nossa proposta foi realizar a ressecção do 1/3 distal da tíbia e reconstruir com a fíbula do mesmo lado, transferido a fíbula para a substituir a falha tibial. Nesta transferência levaríamos a fíbula vascularizada, com a placa fisária, artrodesando a sua epífise com o tálus e encavilhando o 1/3 proximal da fíbula no seguimento proximal da tíbia. Realizamos radiografias, arteriografia e planejamento para a execução (figuras 6.7 e 8).
O planejamento deste procedimento deve incluir a confecção de uma órtese que servirá para imobilizar o membro operado. Fazemos um gesso cruro podálico que servirá de molde para a modelagem da órtese, feita em polipropileno (figura 9).
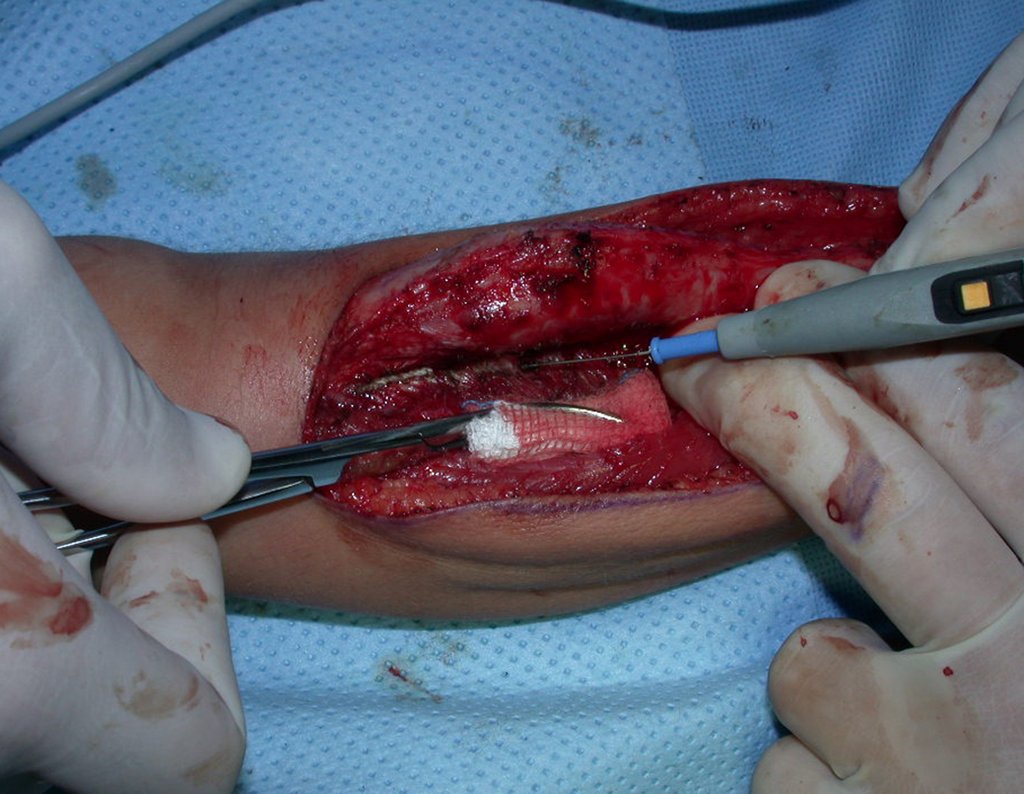
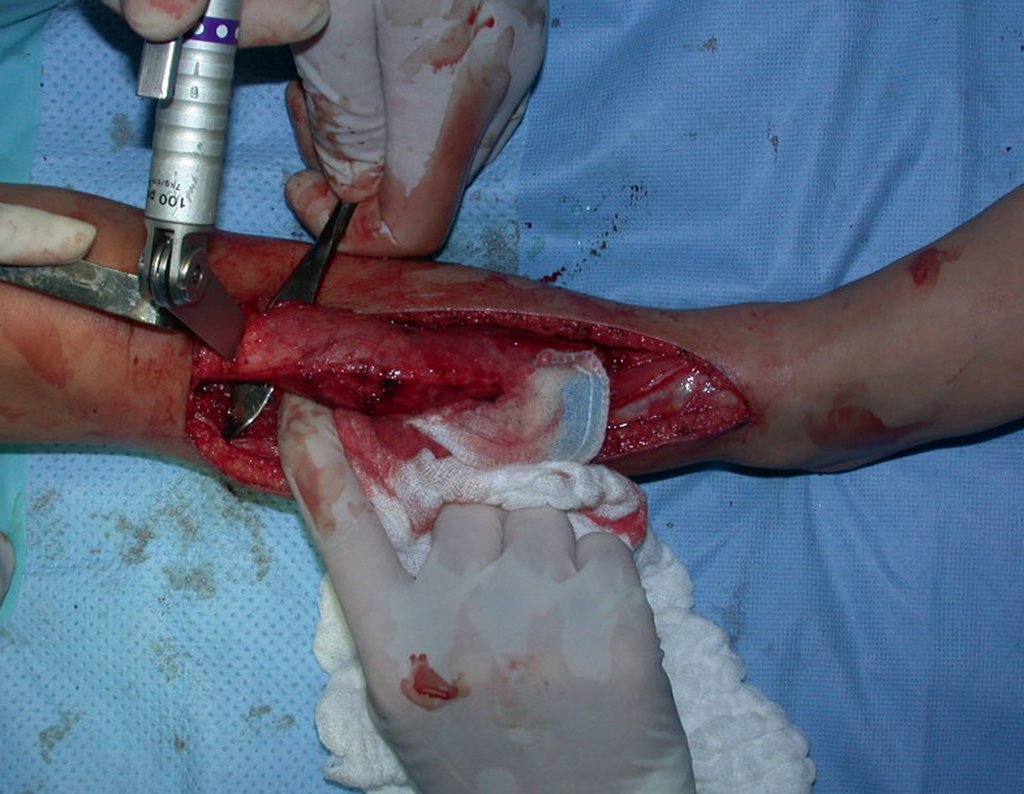
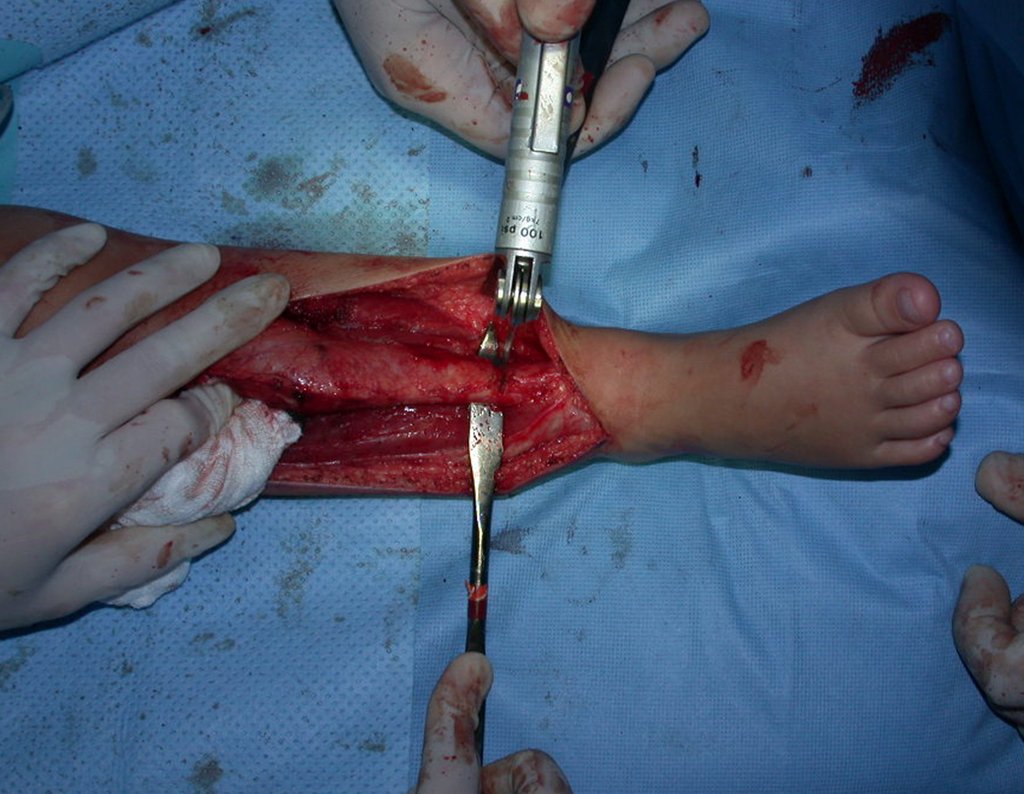
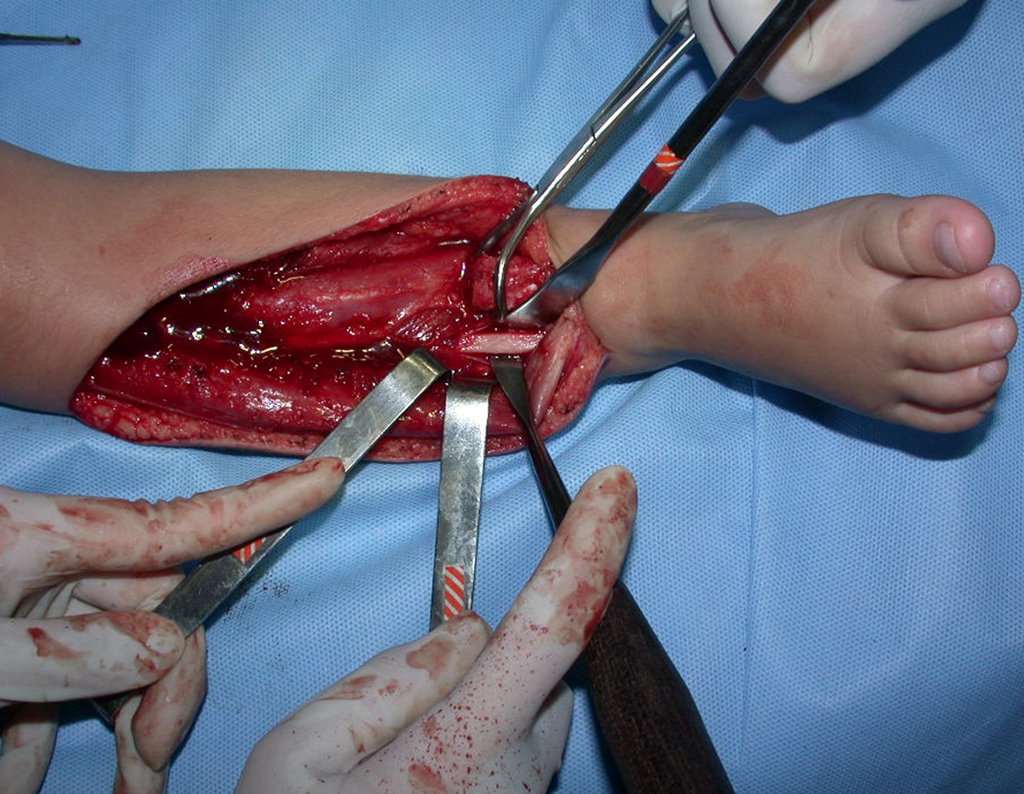
A cirurgia de ressecção do tumor, englobando todo o terço distal da tíbia e a reconstrução deste segmento com o autotransplante da cartilagem de crescimento da fíbula para a tíbia são detalhados nas figuras 10 a 20.

A documentação radiográfica e acompanhamento da reabilitação da paciente, após a reconstrução, são ilustrados nas figuras 21 a 46.
Esta técnica de autotransplante da fíbula, com a sua placa de crescimento, para substituir o seguimento distal da tíbia, em crianças de baixa idade, é uma excelente alternativa de reconstrução biológica autóloga que preserva o crescimento do membro, evitando discrepâncias.
Foi publicada na Revista Brasileira de Ortopedia e Traumatologia em novembro de 1998, vol. 33 – número 11.
Autor: Prof. Dr. Pedro Péricles Ribeiro Baptista
Oncocirurgia Ortopédica do Instituto do Câncer Dr. Arnaldo Vieira de Carvalho
Consultório: Rua General Jardim, 846 – Cj 41 – Cep: 01223-010 Higienópolis São Paulo – S.P.
Fone:+55 11 3231-4638 Cel.:+55 11 99863-5577 Email: drpprb@gmail.com