Tumor de Células Gigantes
‘Tumor de Células Gigantes.
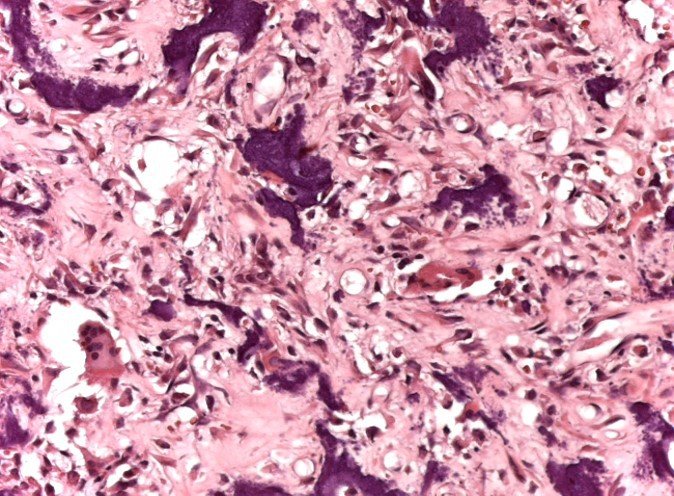
O Tumor giganto-celular é neoplasia de natureza mesenquimal, caracterizada por proliferação de células gigantes multinucleadas – gigantócitos – que se assemelham aos osteoclastos, em meio a estroma de células mononucleadas.
Devido a esse aspecto histológico presente em diversos outros processos, o tumor giganto-celular poderia confundir-se necessitando muitas vezes da análise do aspecto clínico e radiográfico, para a confirmação do seu diagnóstico.
O tumor giganto-celular é também conhecido pela sigla TGC, pelos nomes de tumor de células gigantes e osteoclastoma.
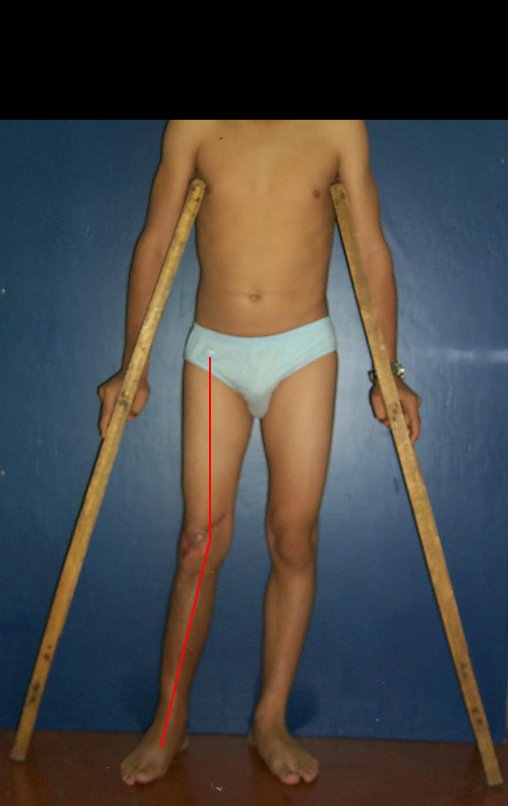
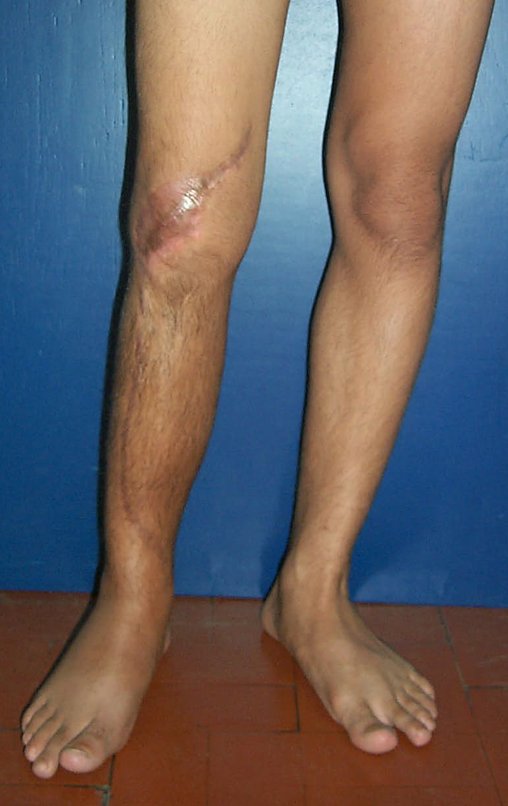
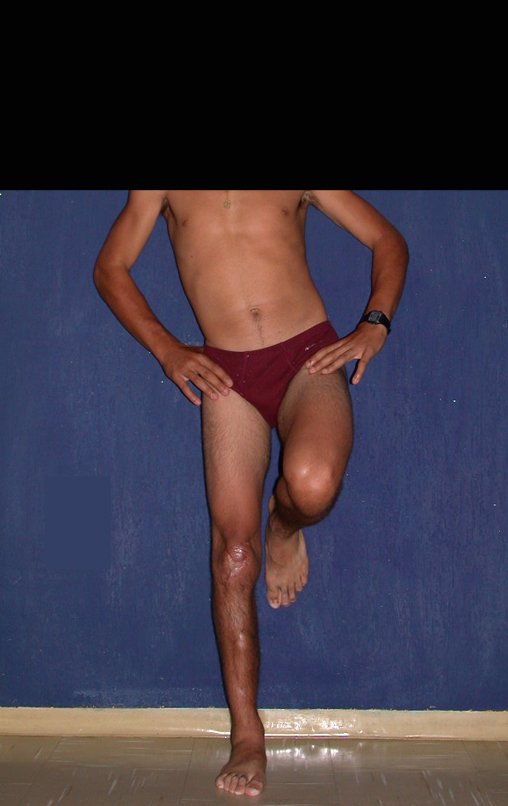
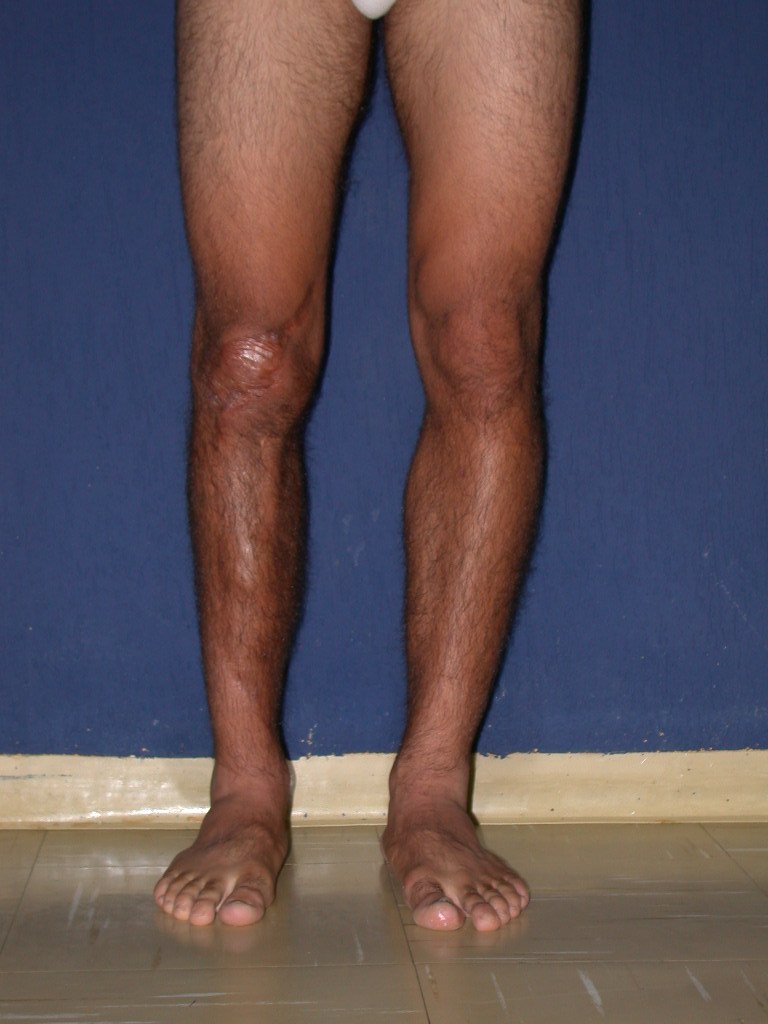
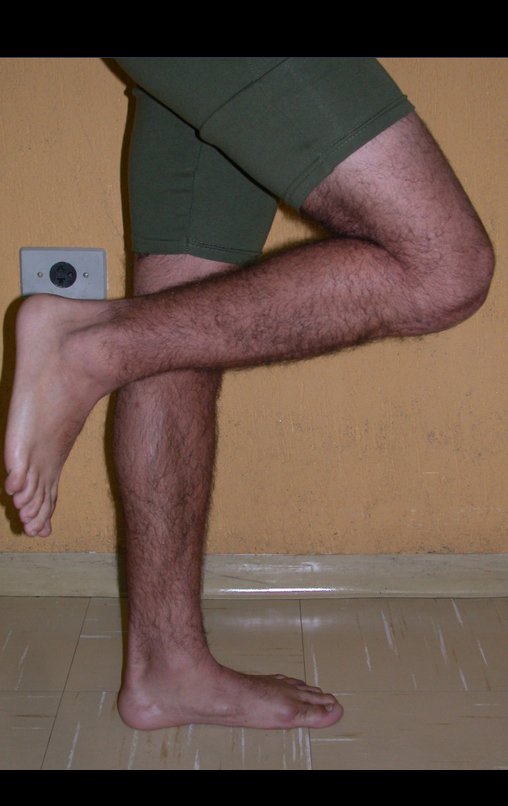
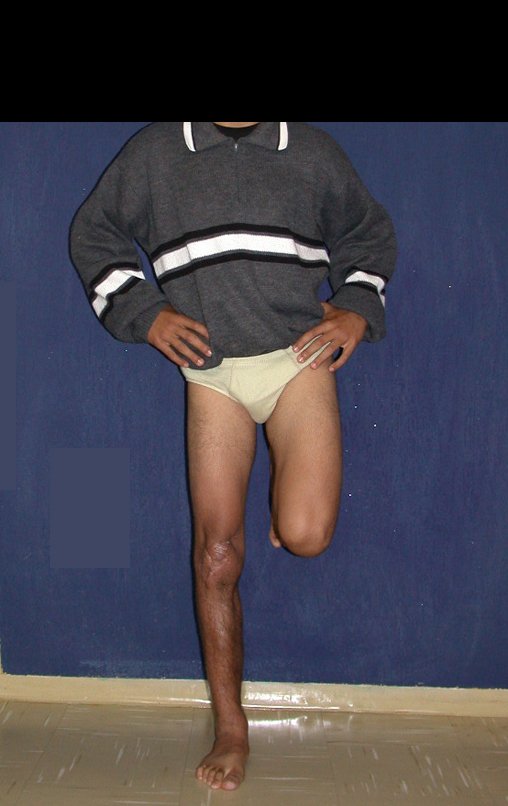
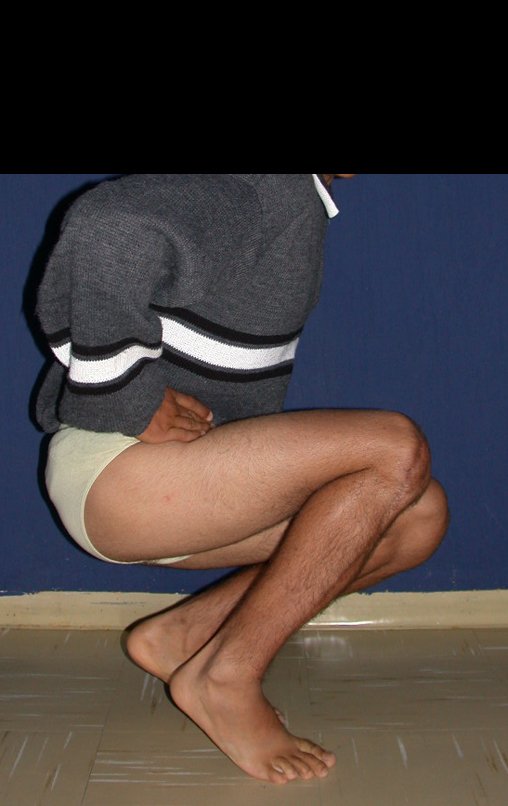
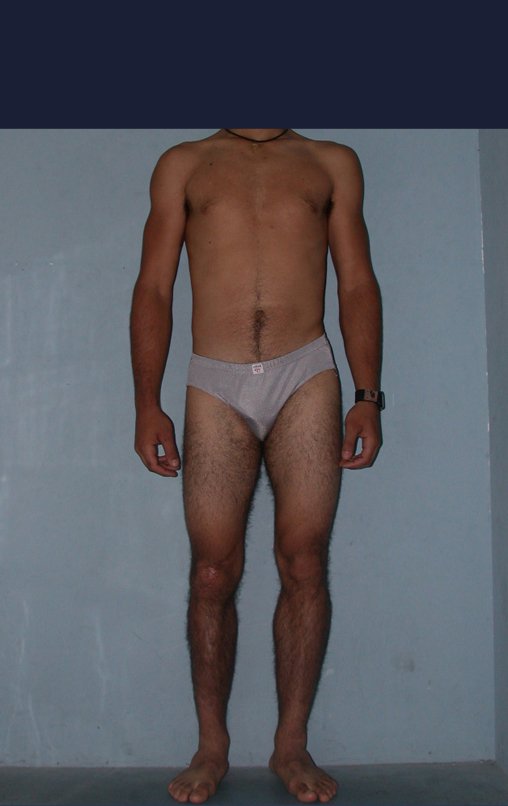
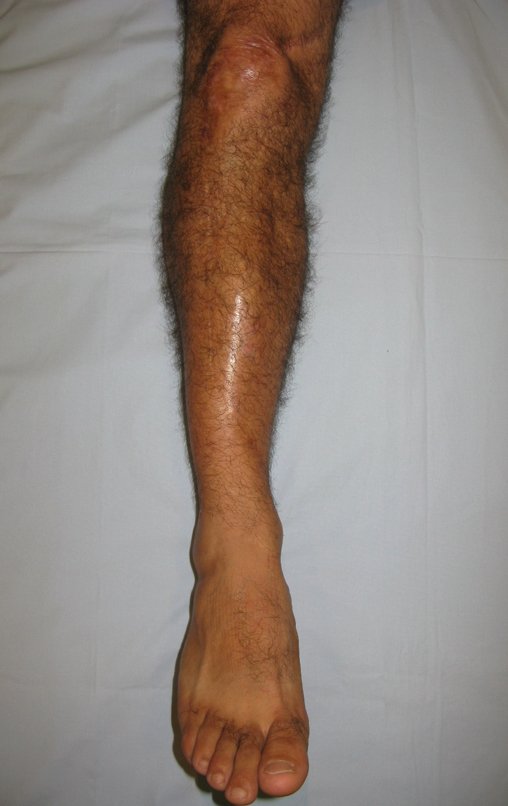
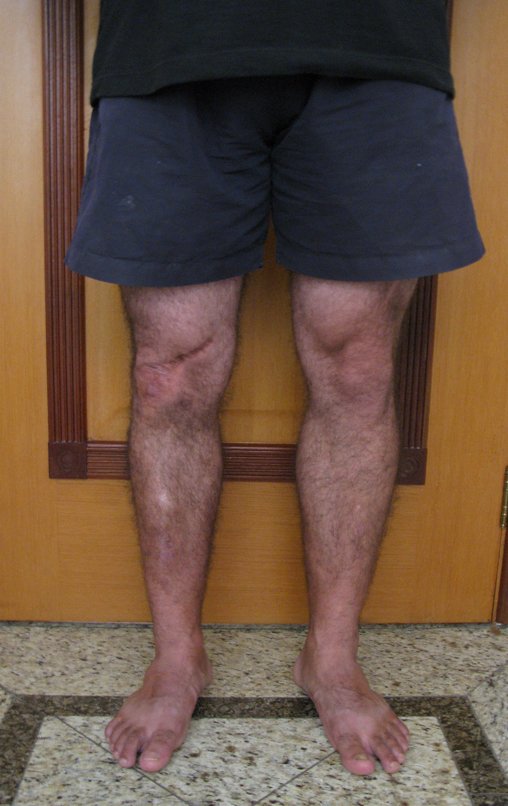
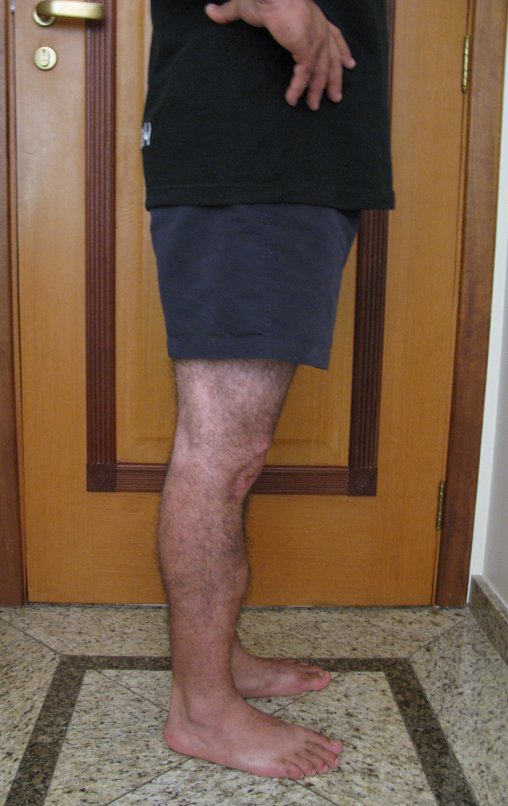
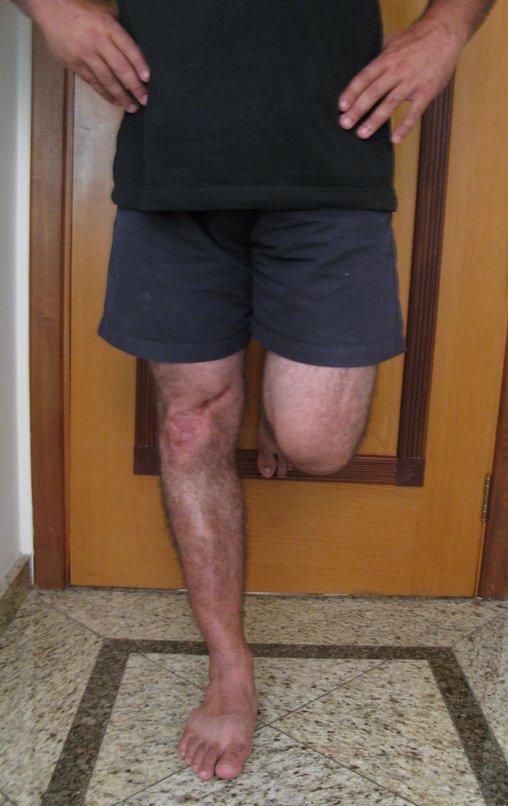
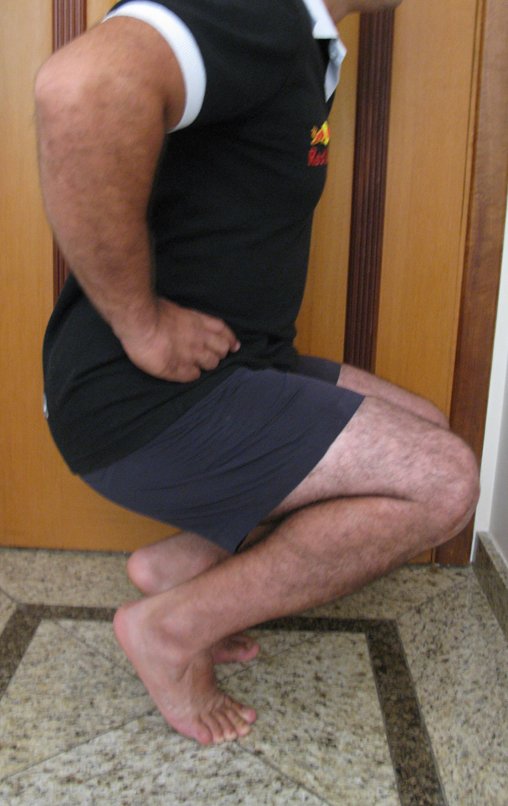
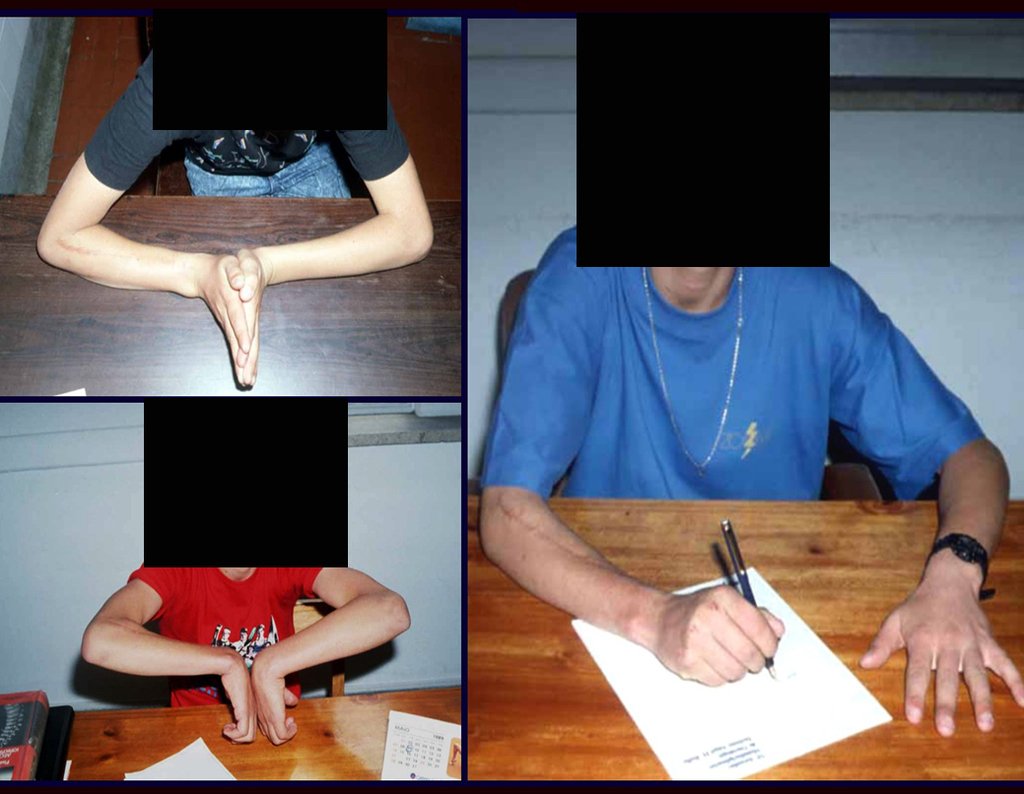
A manifestação principal é a dor local intermitente, acompanhada ou não de aumento de volume da região afetada e limitação dos movimentos da articulação vizinha. O tempo de história, em média de 6 a 12 meses, é variável de caso a caso e depende do osso afetado.
Alguns doentes procuram tratamento em virtude da dor, outros pela percepção do tumor ou por fratura patológica. Não é rara a referência a trauma mais ou menos intenso como início da história clínica.
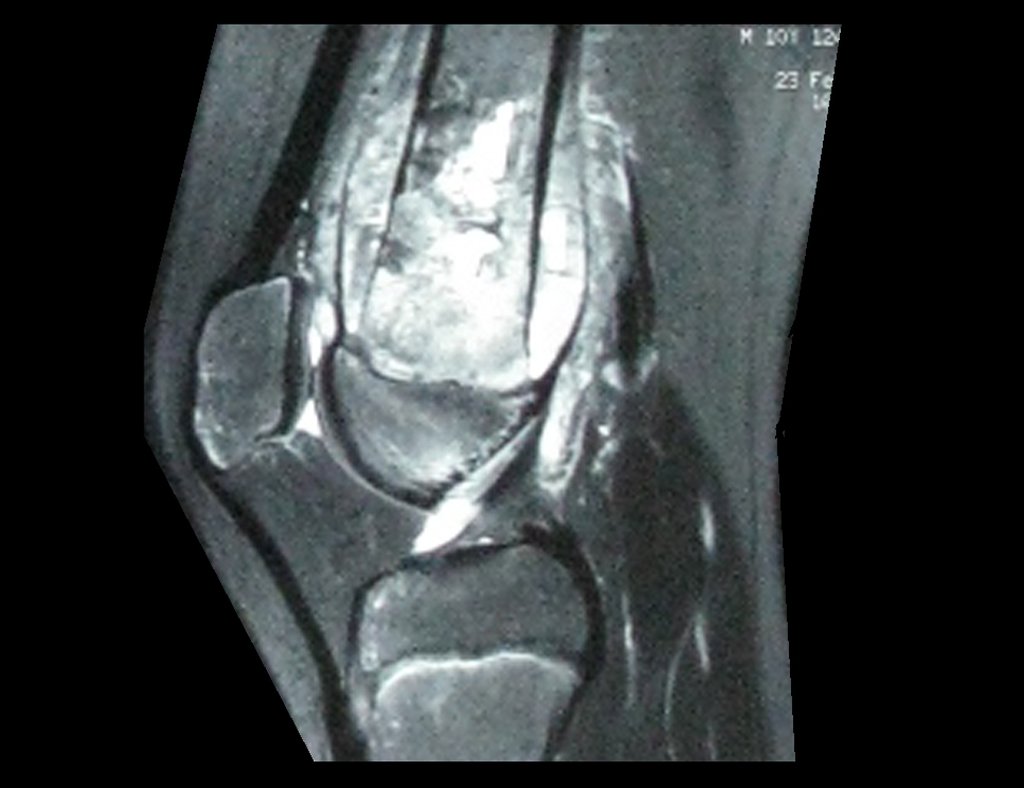
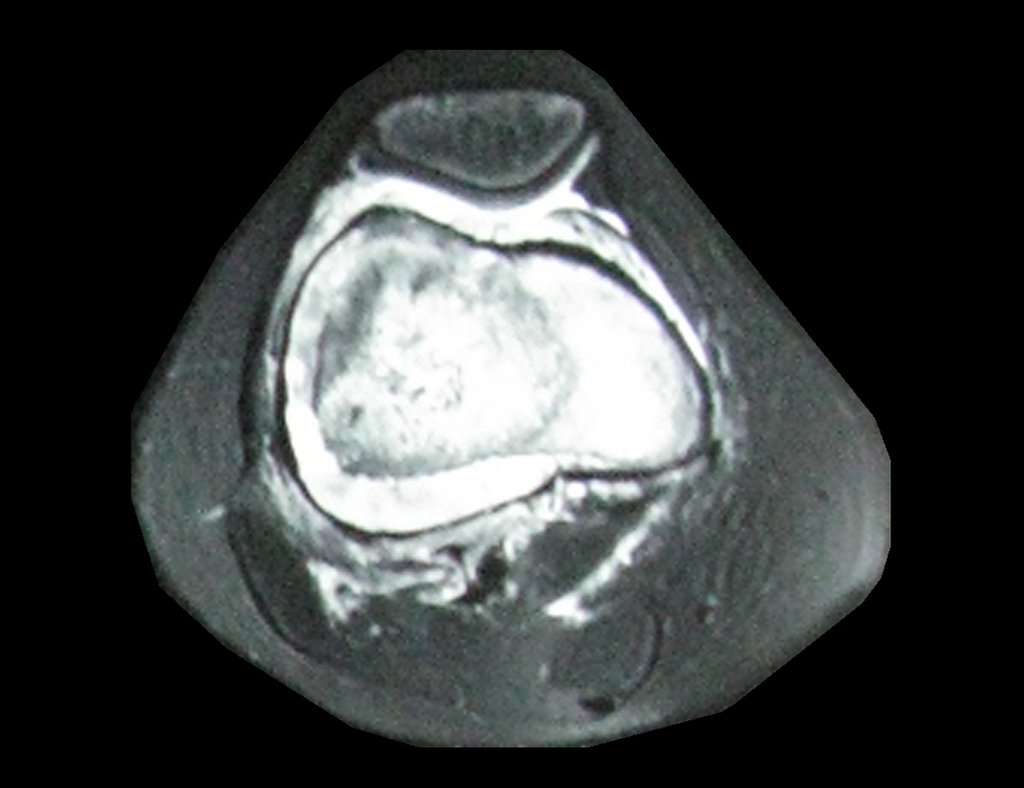
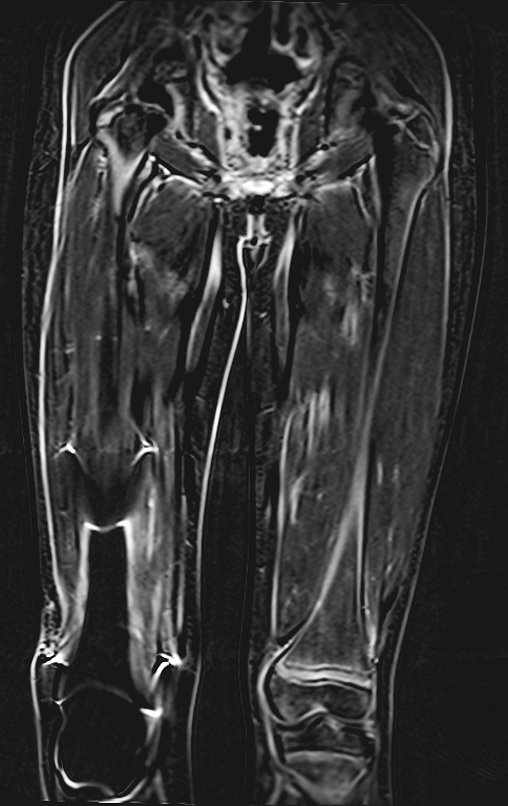
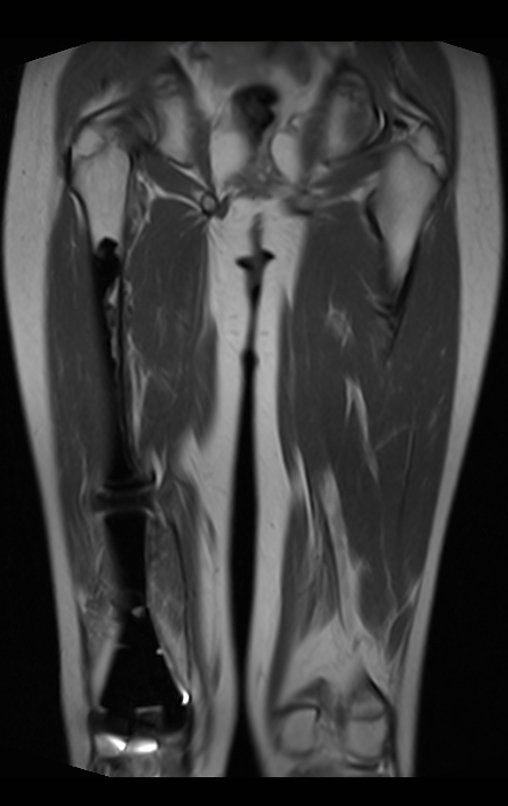
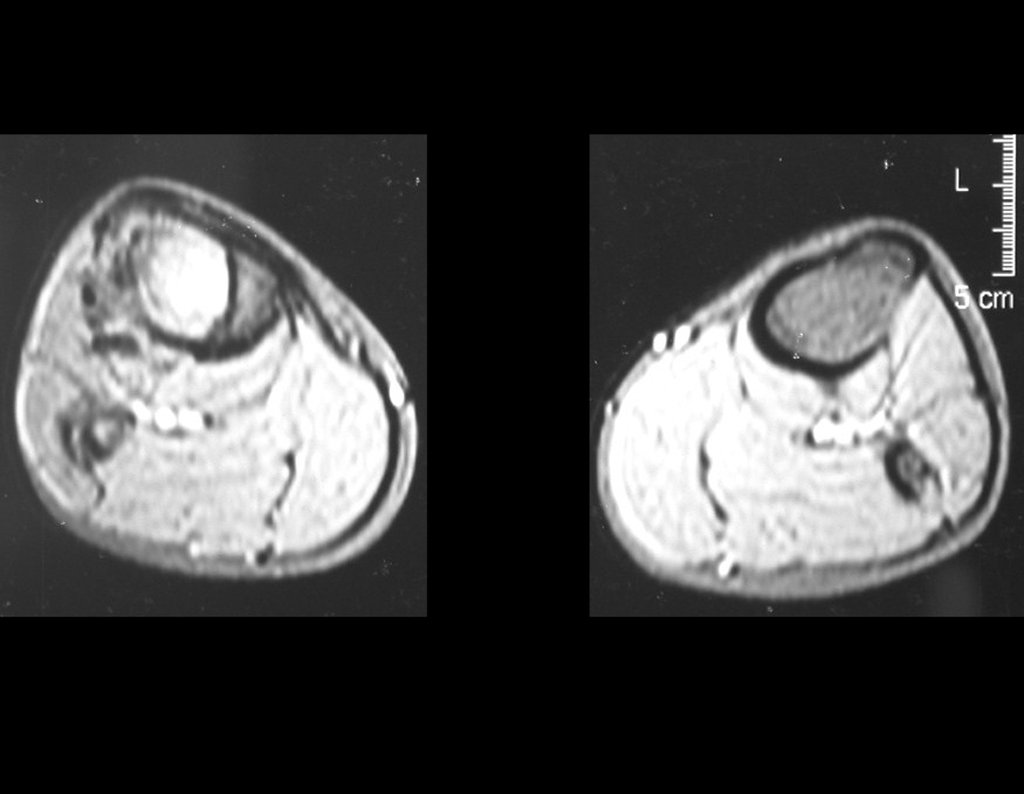
Como na maioria das vezes o tumor é epifisário, é freqüente o comprometimento clínico da articulação vizinha, com progressiva impotência funcional.
Pode ocorrer derrame articular e quadro clínico simulando processos meniscais ou de artrite.
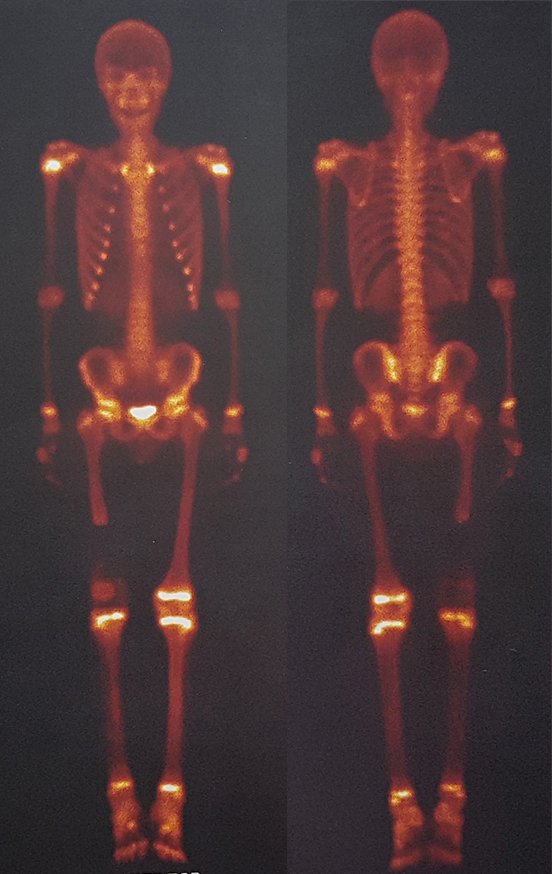
Nos tumores localizados na coluna vertebral e no sacro além da dor e aumento de volume pode ocorrer manifestações neurológicas. O volume às vezes é enorme predominando sobre os demais sintomas.
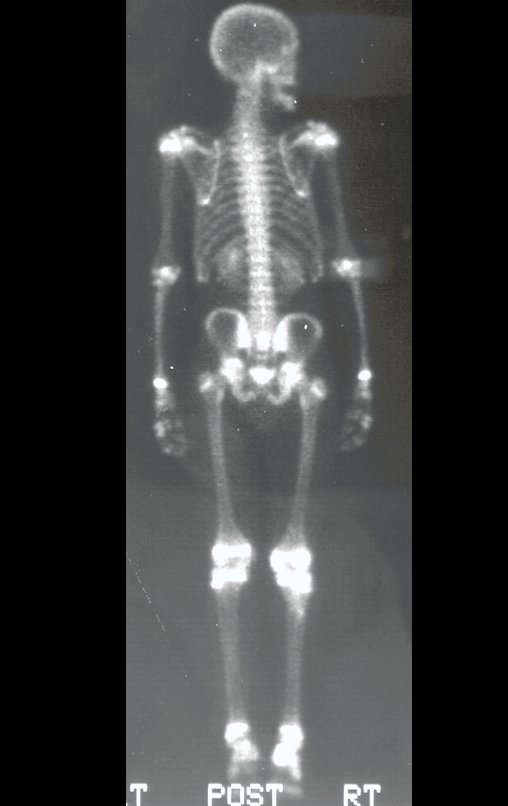
O tumor giganto-celular em geral acomete um só osso. Quando há lesões em vários ossos deve-se verificar a possibilidade de tratar-se de “tumor marrom do hiperparatireoidismo”, cujas lesões apresentam aspectos radiográficos semelhantes, mas são múltiplas e o paciente apresenta alteração do cálcio e fósforo.
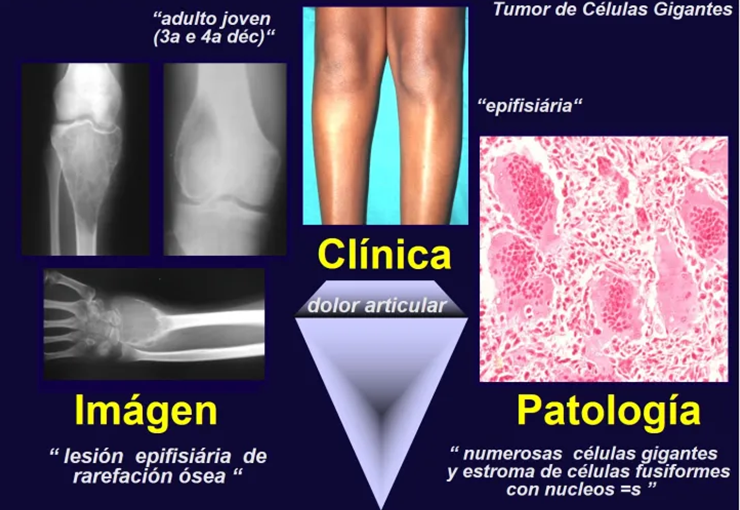
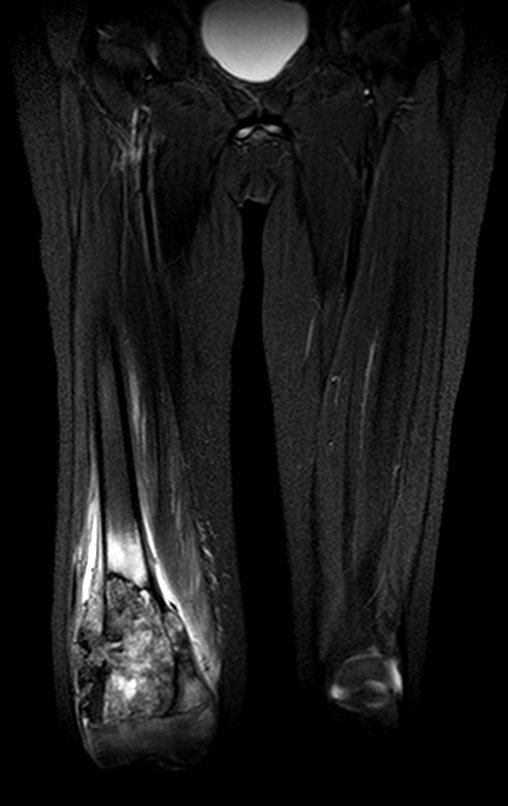
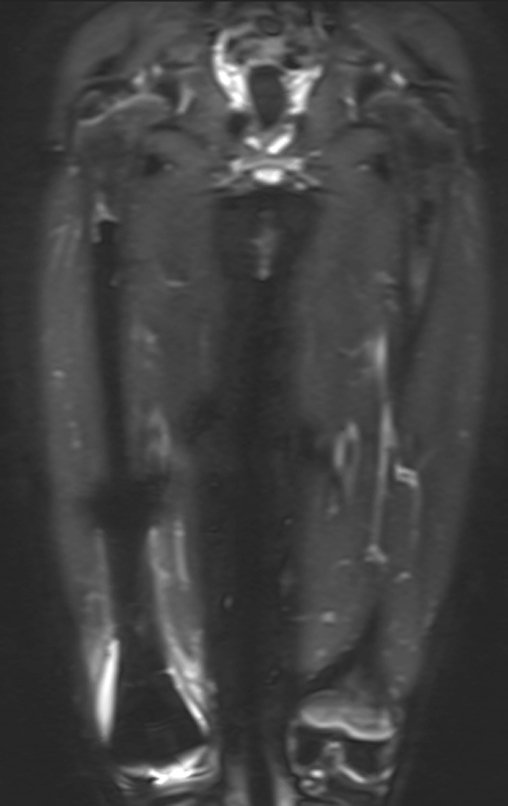
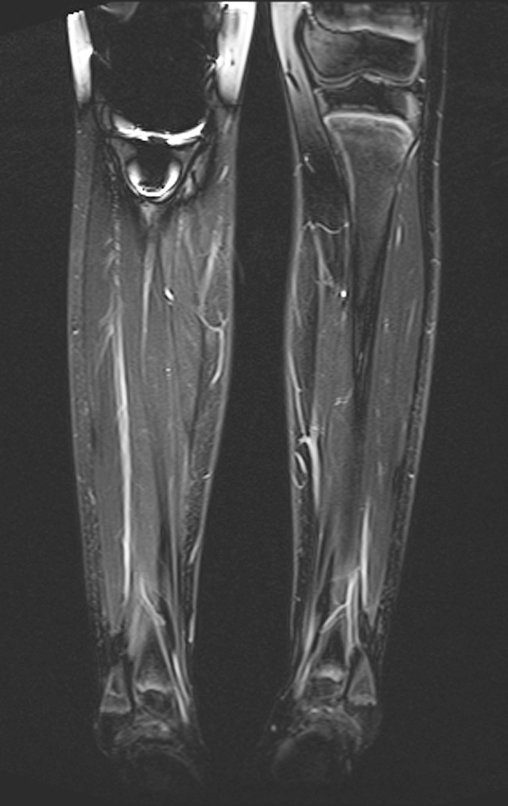
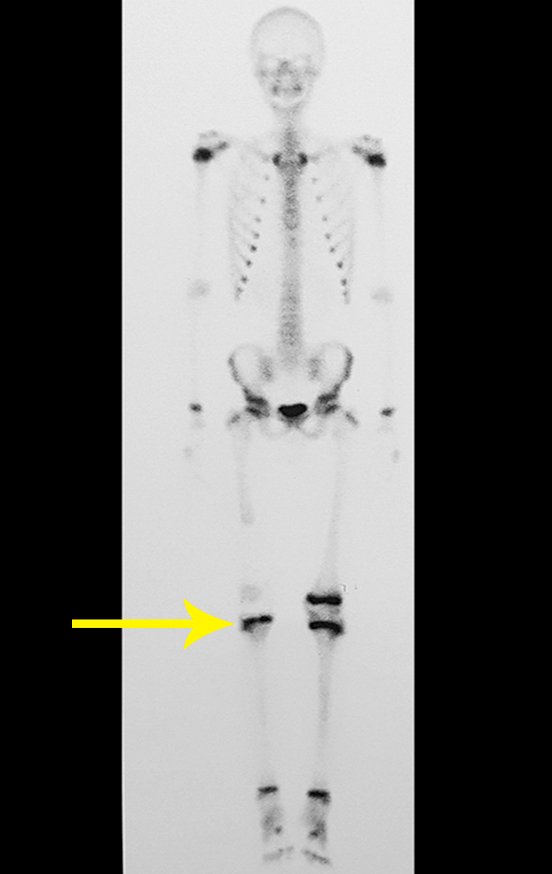
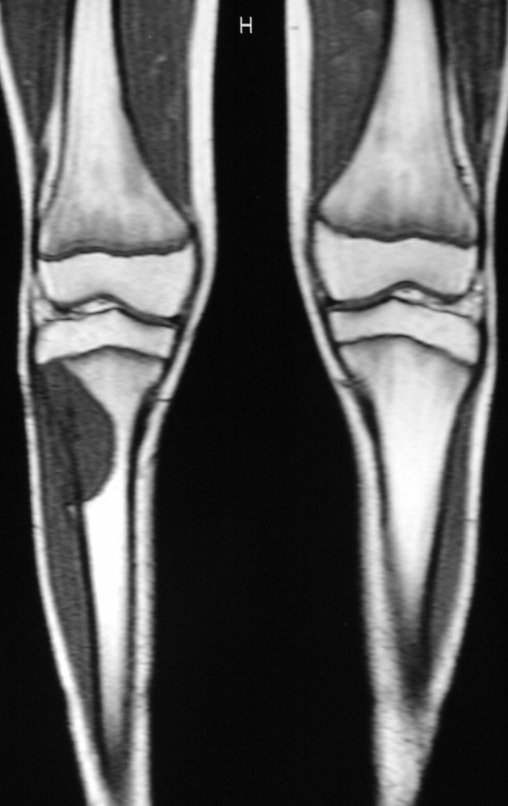
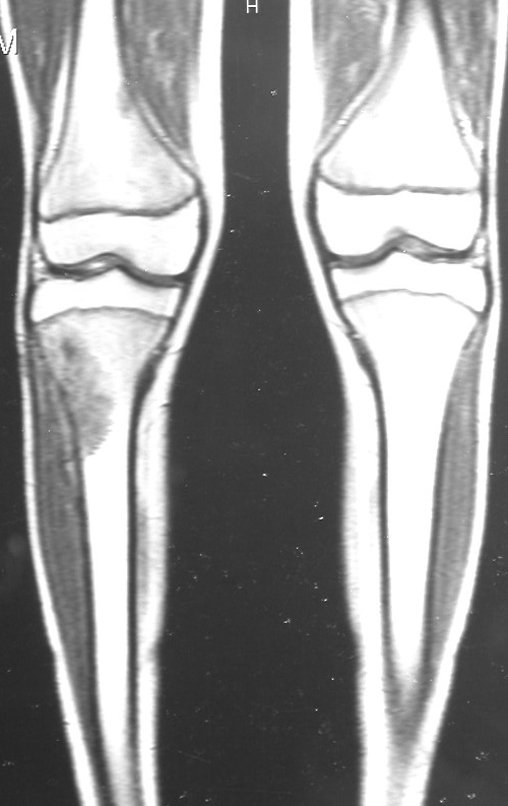
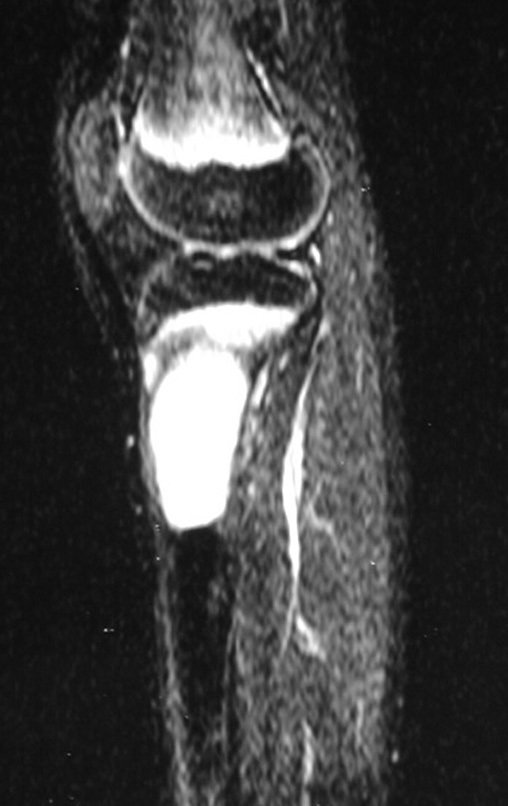
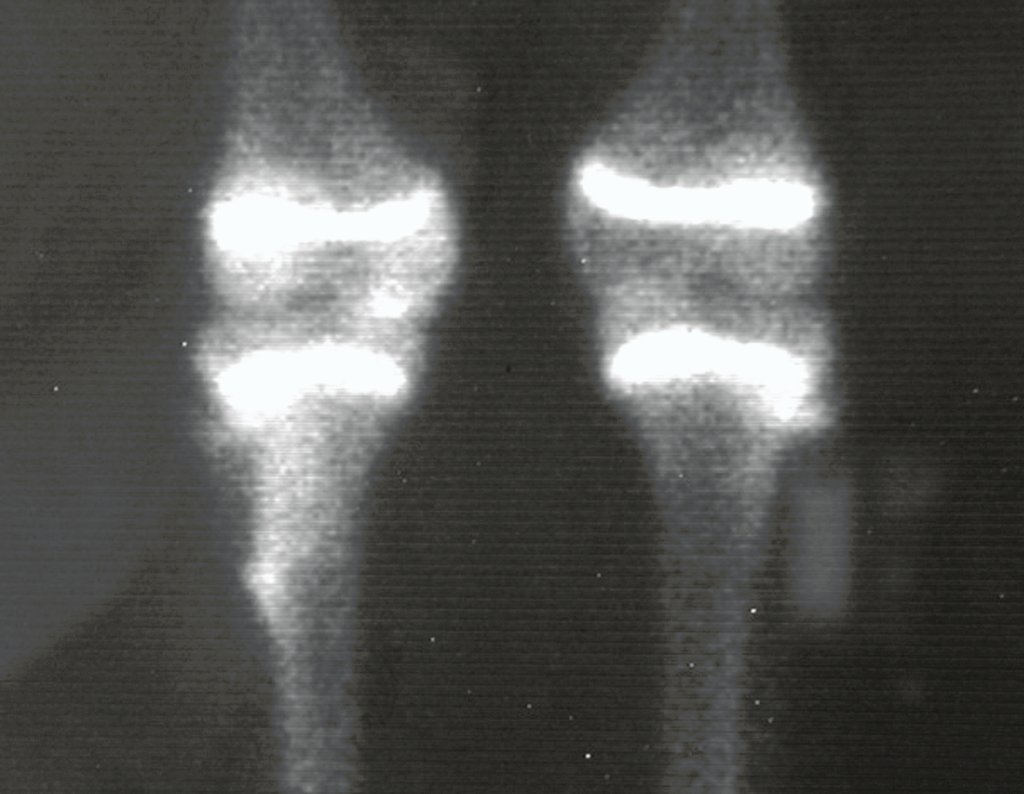
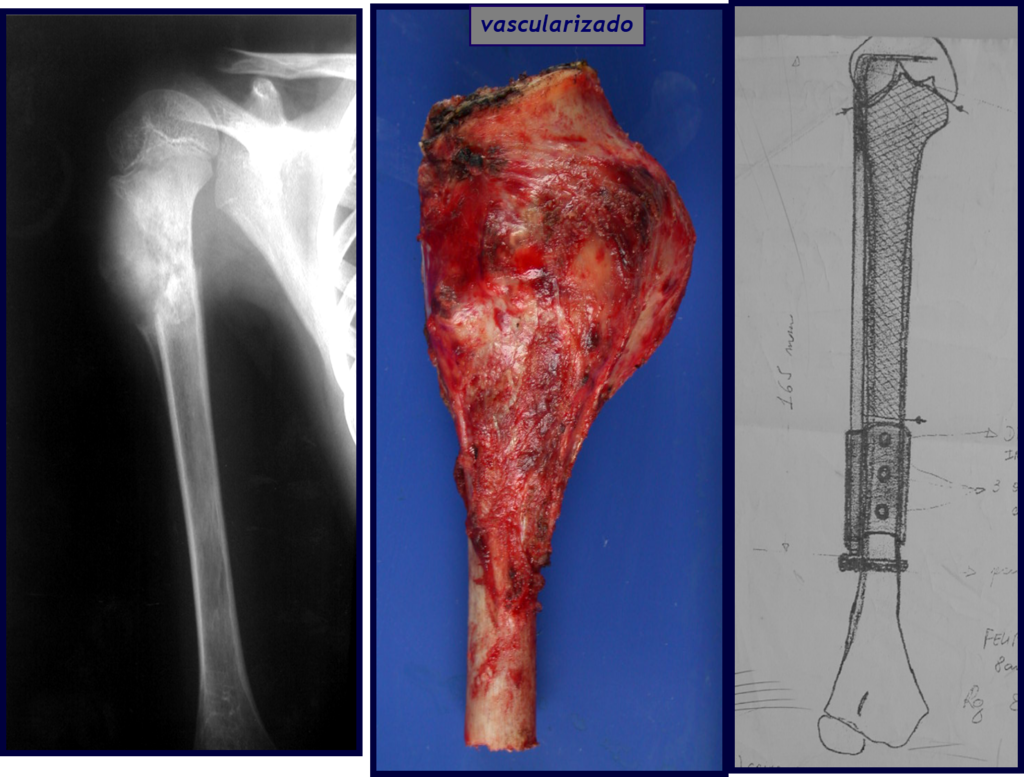
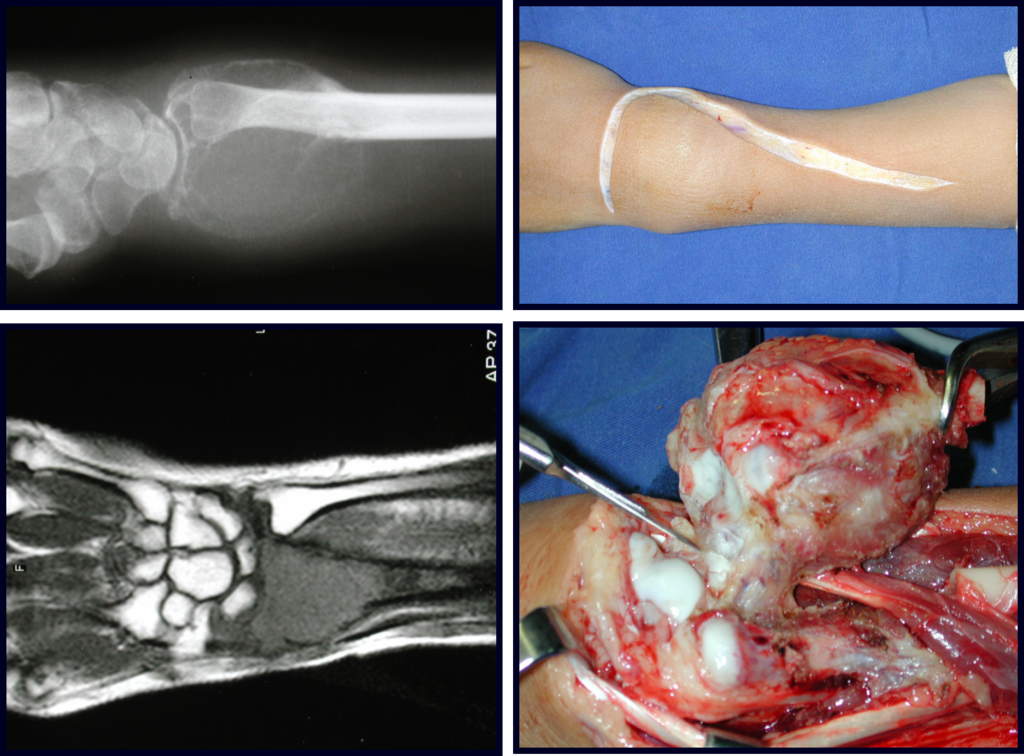
O TGC é classicamente conhecido como tumor da epífise de ossos longos, mais freqüentes na região do joelho, isto é, na epífise distal do fêmur e proximal da tíbia e, em seguida por ordem de freqüência, na região proximal do úmero e distal do rádio. No esqueleto axial é raro e quando ocorre tem predominância no sacro.
Ocorre na terceira e quarta década, comprometendo igualmente ambos os sexos.
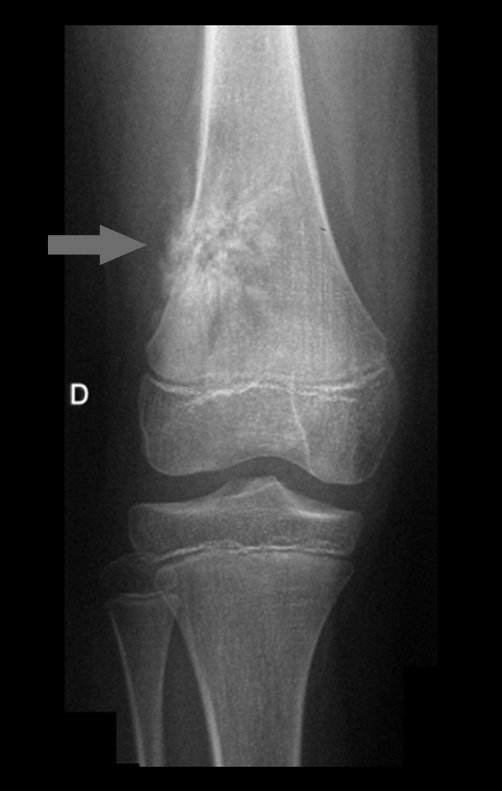
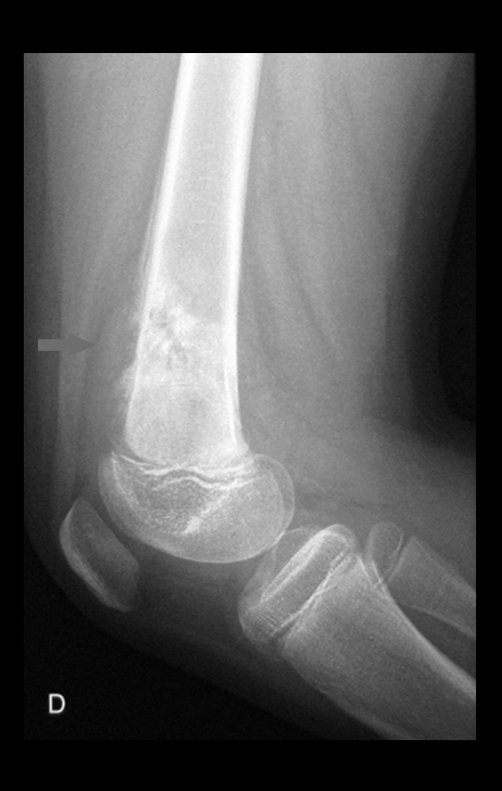
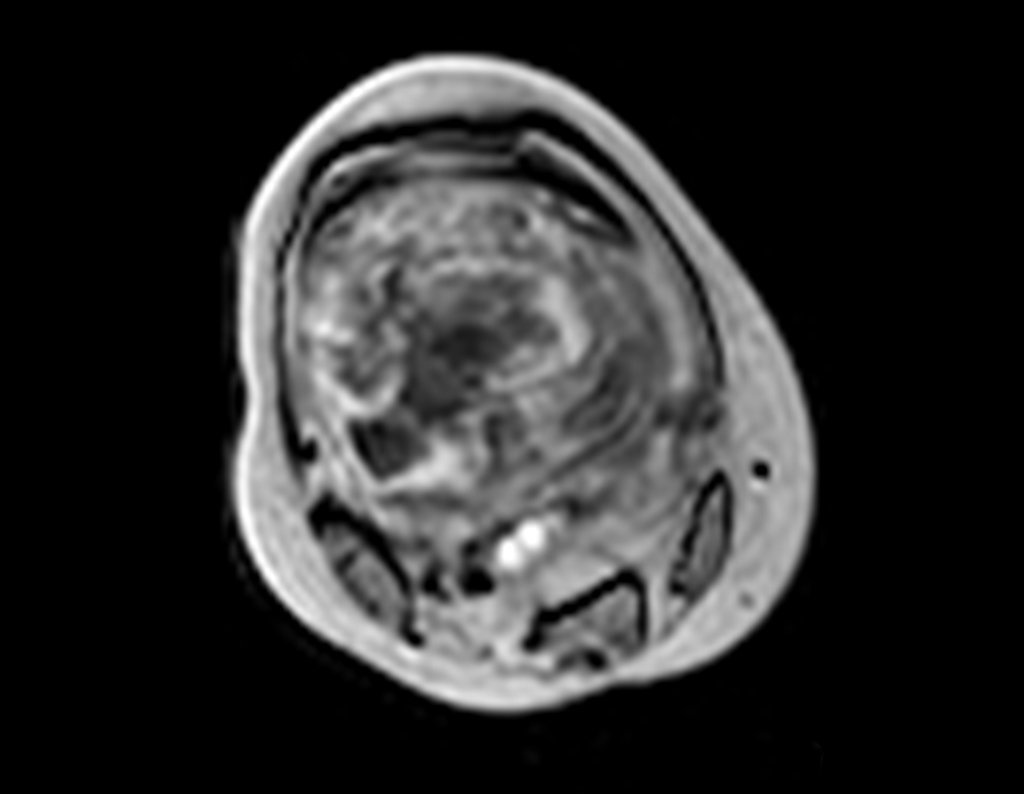
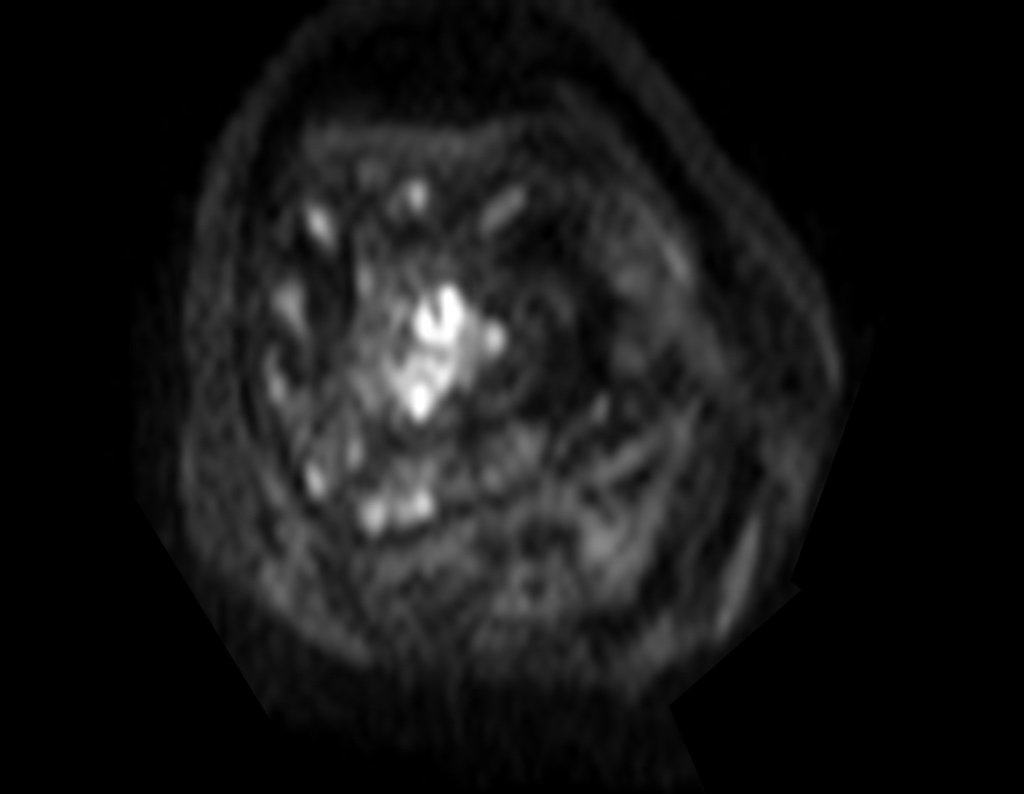
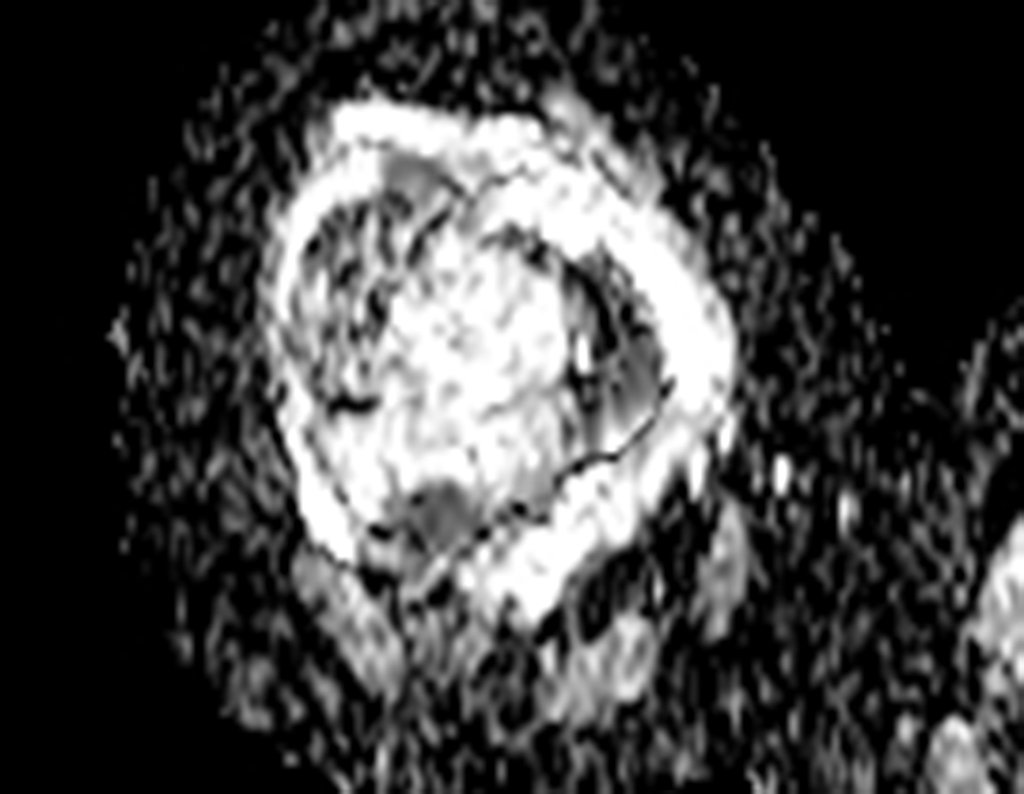
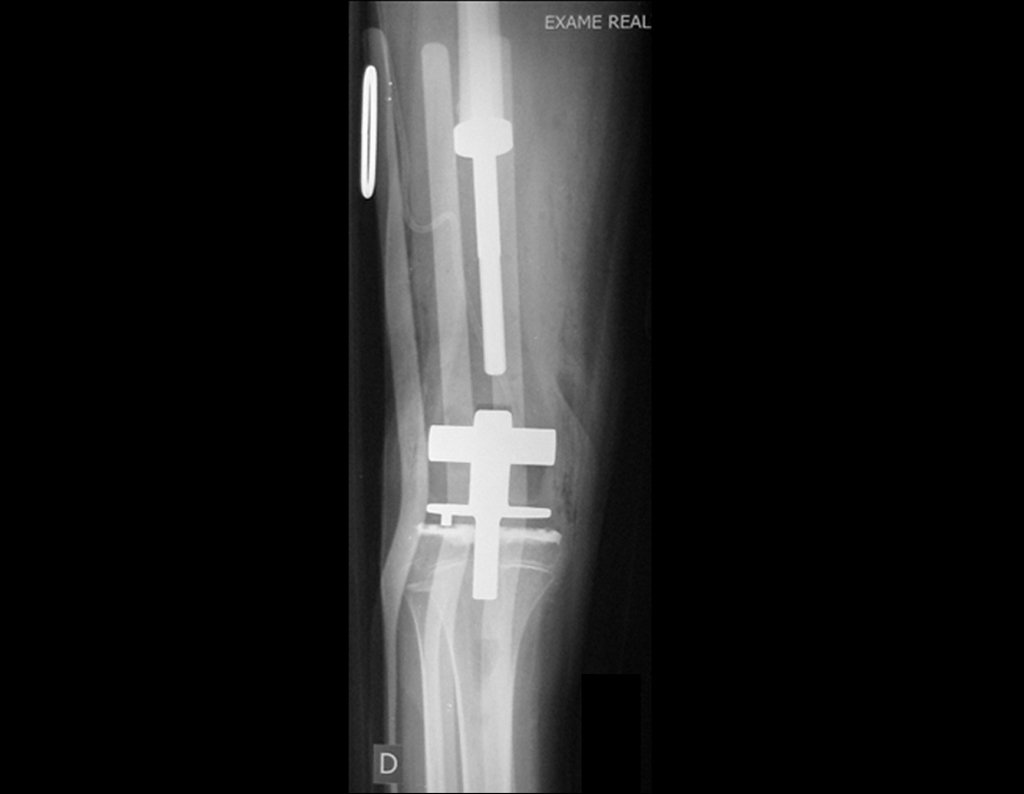
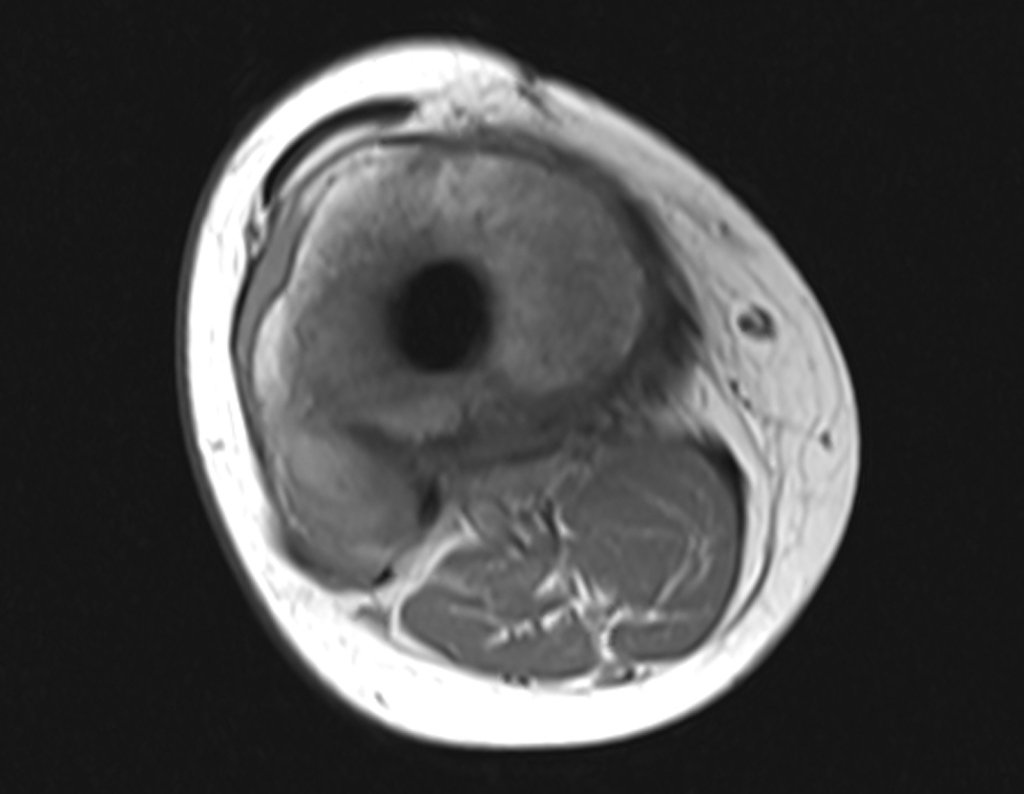
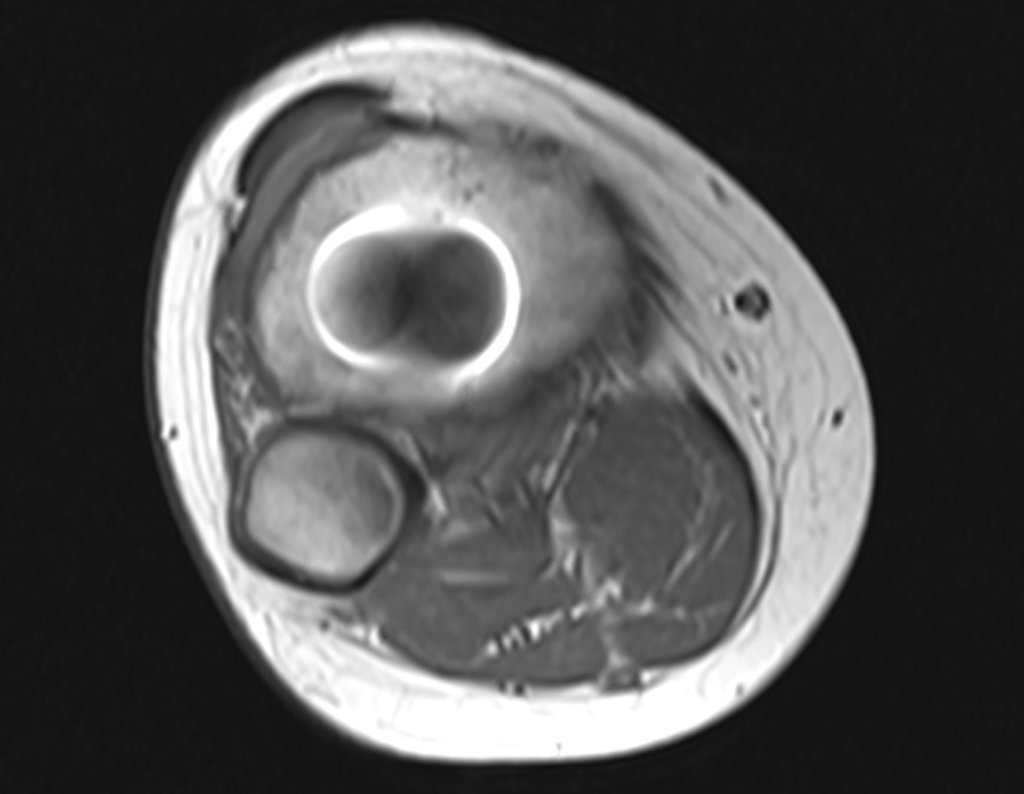
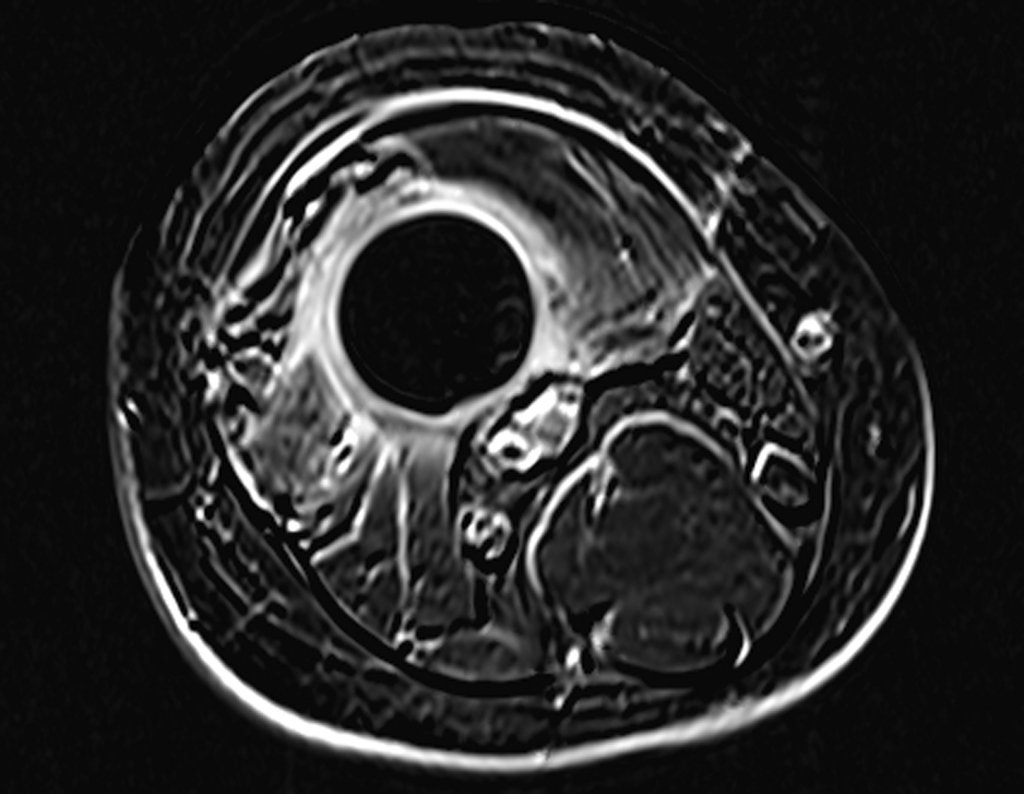
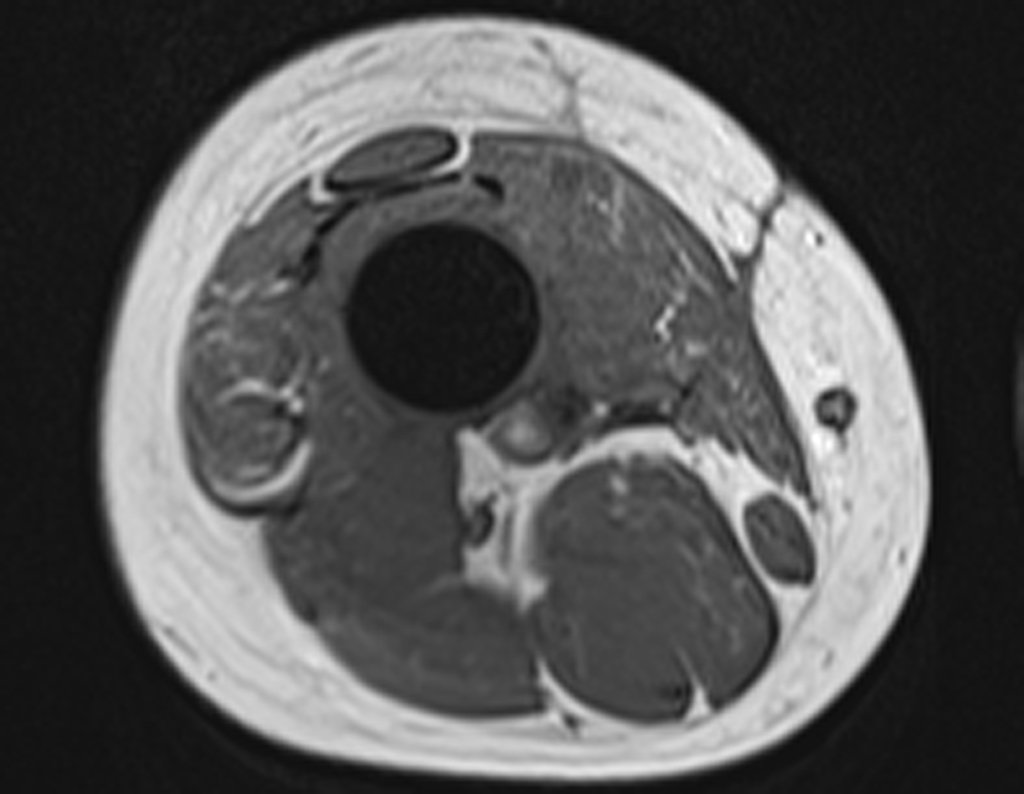
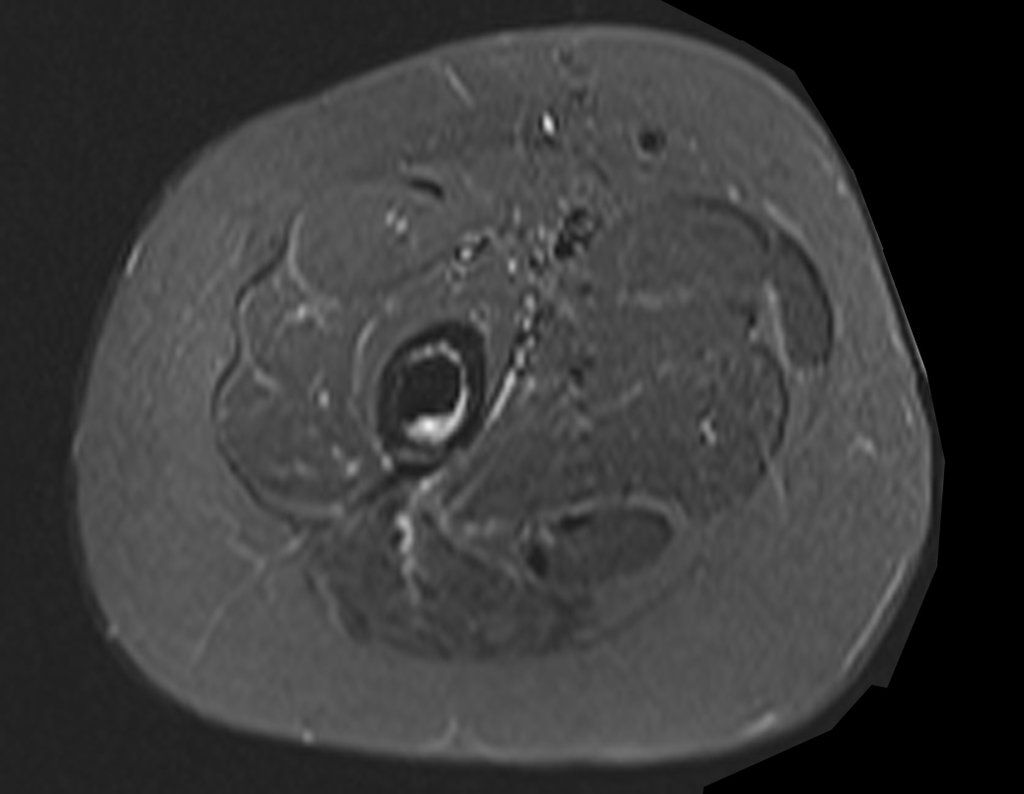
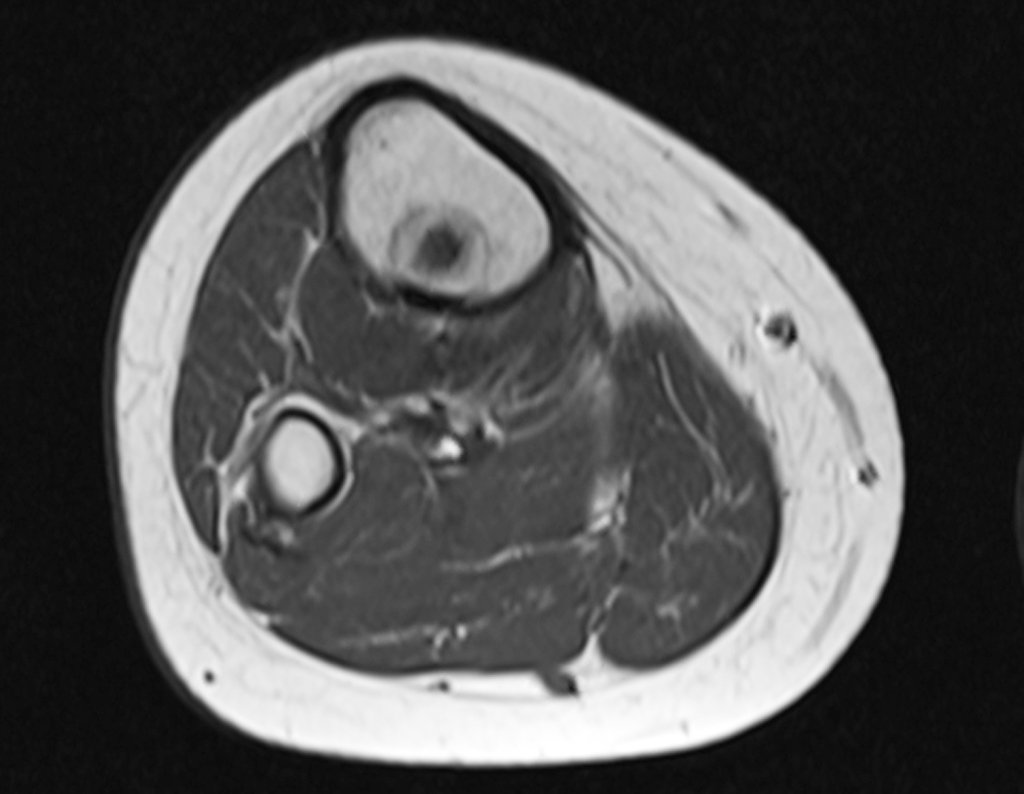
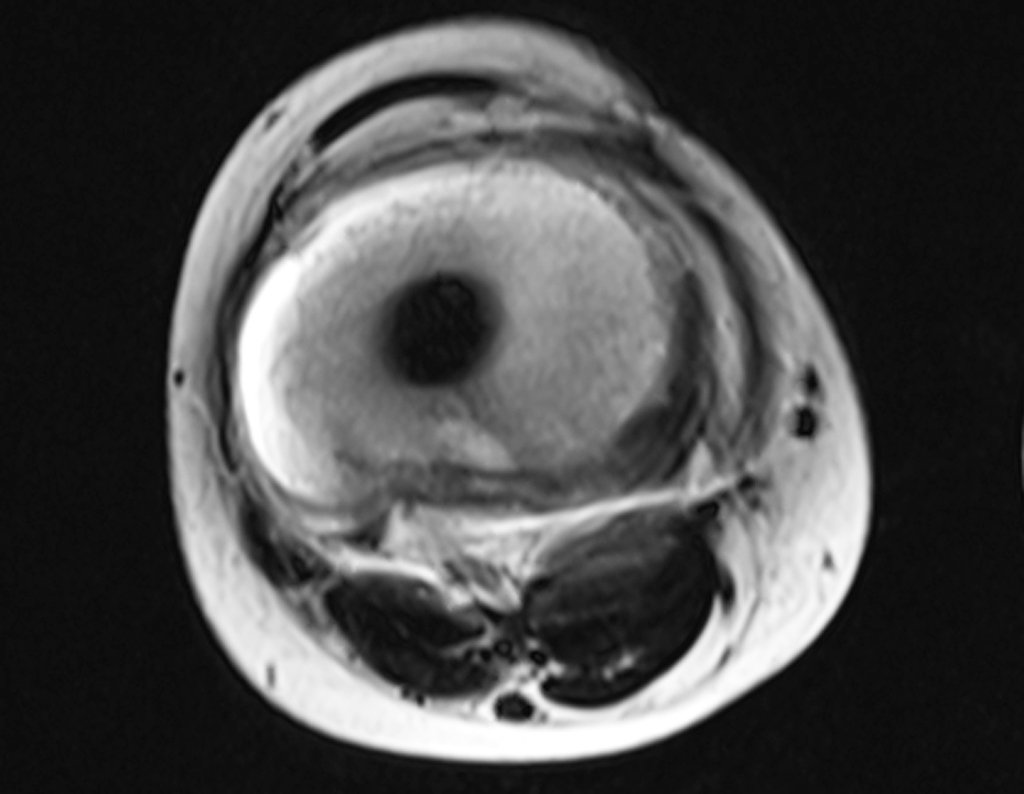
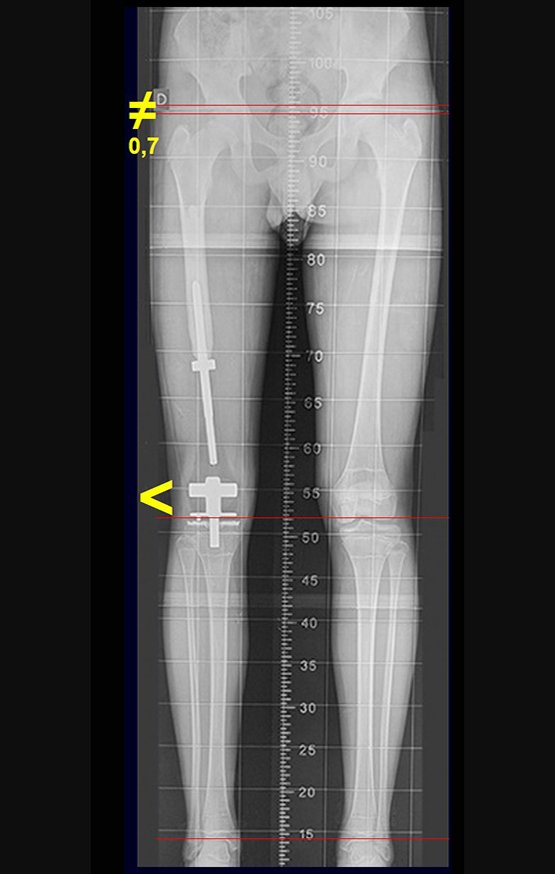
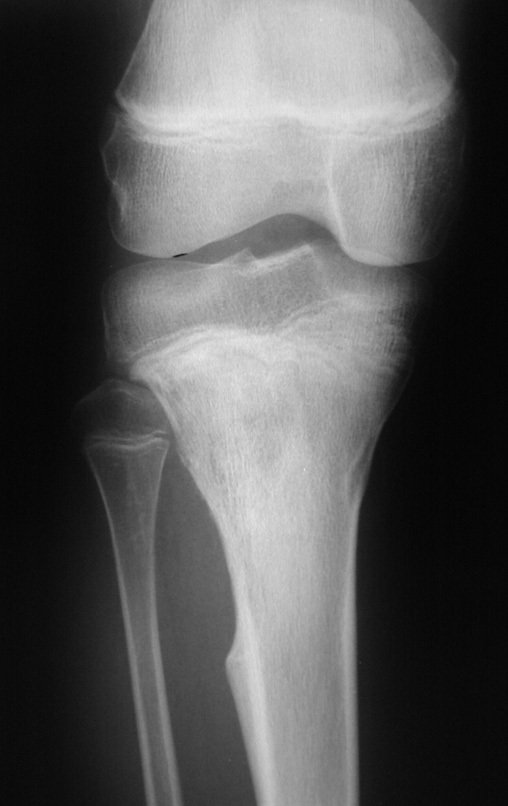
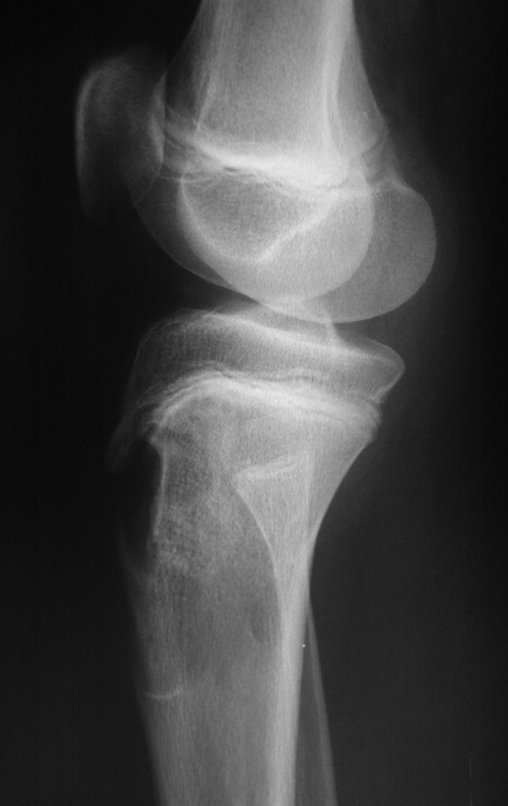
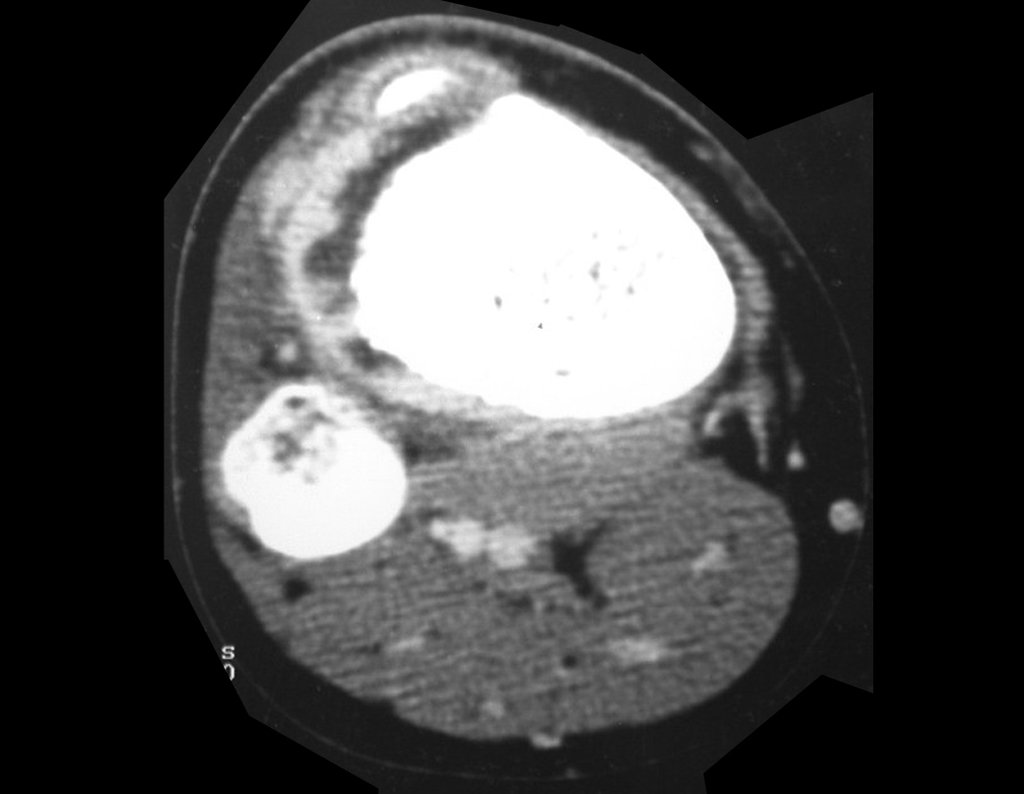
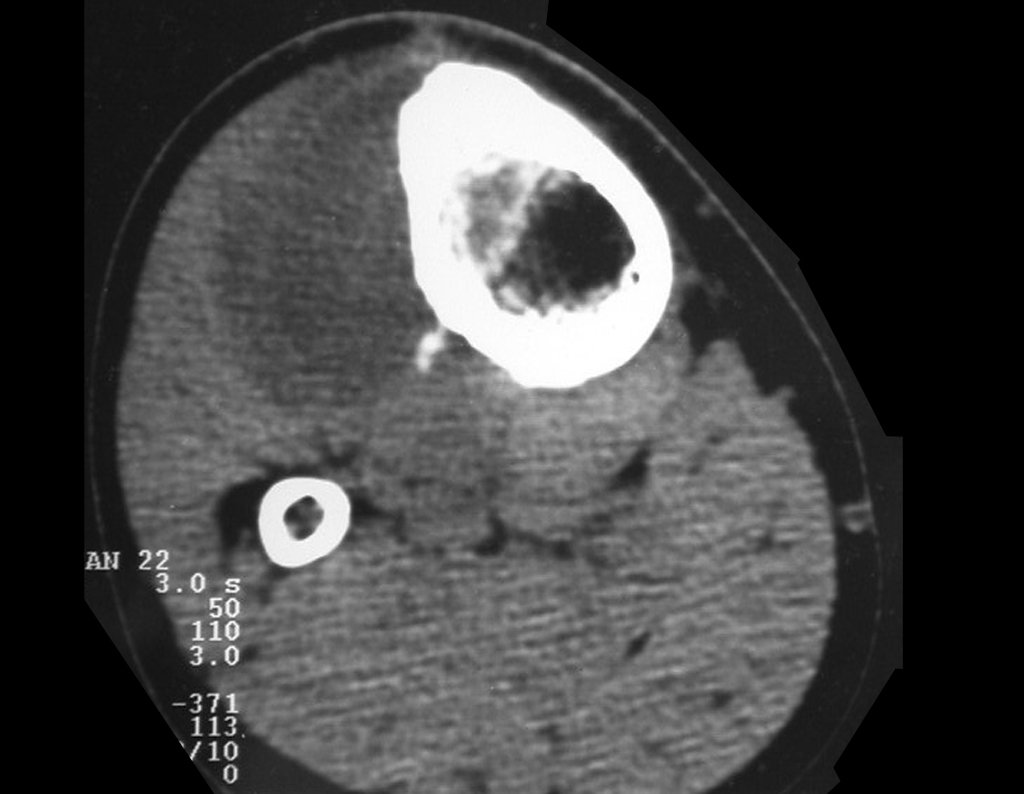
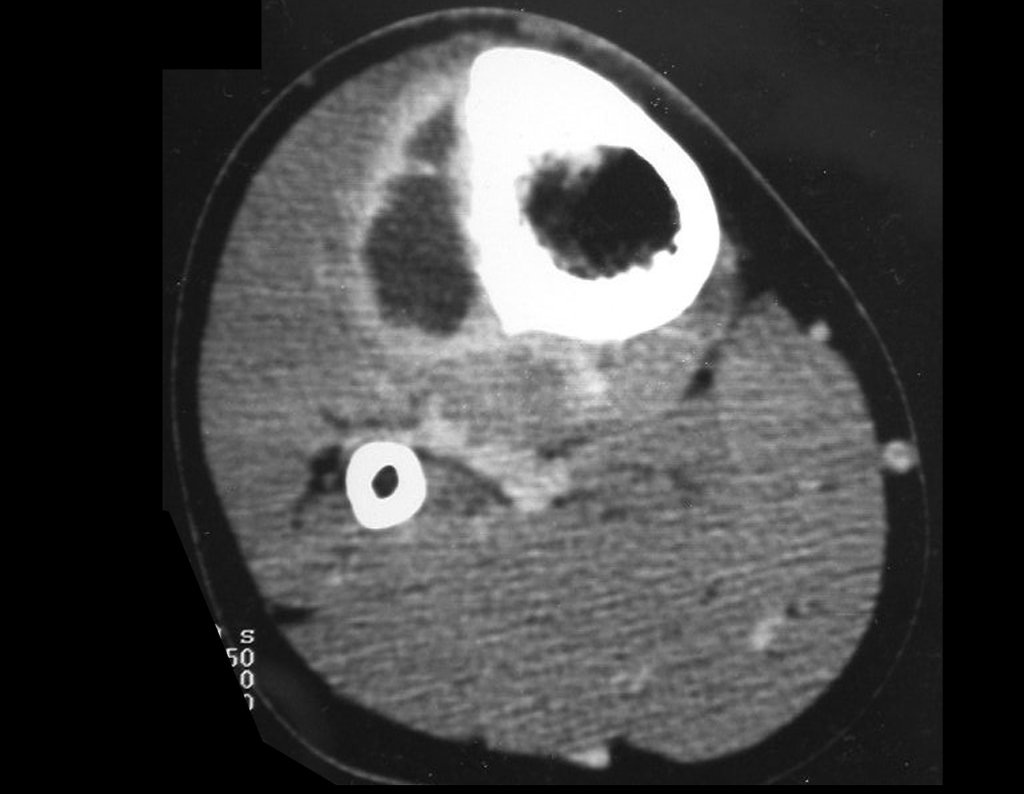
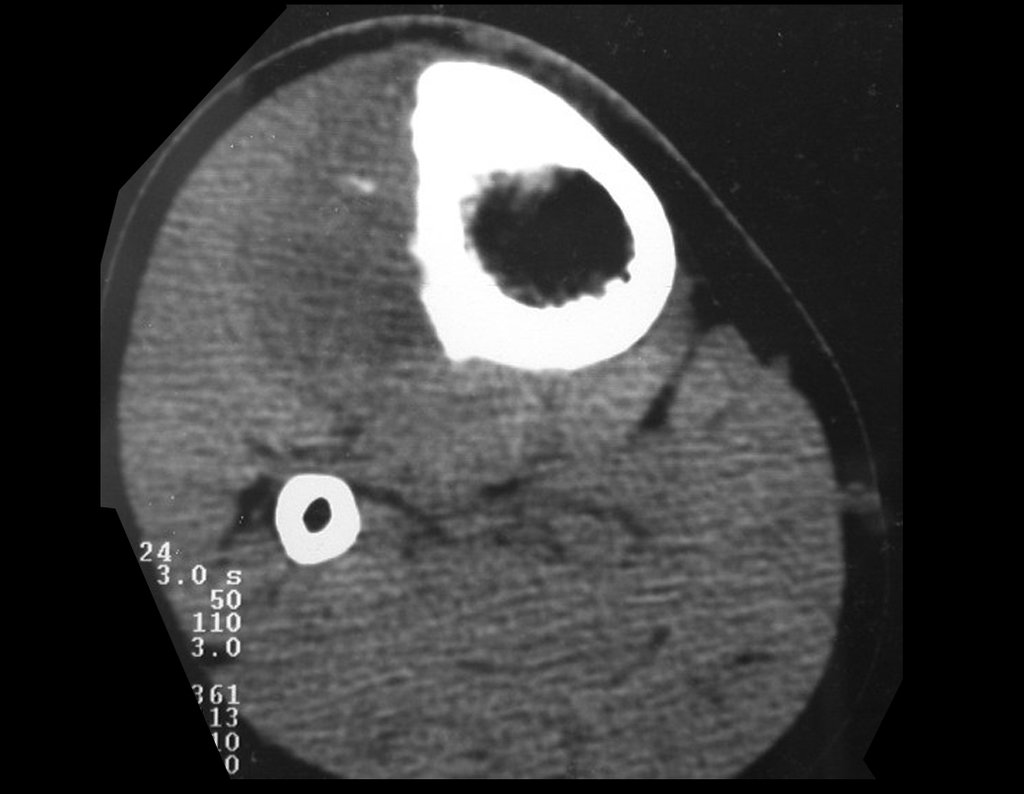
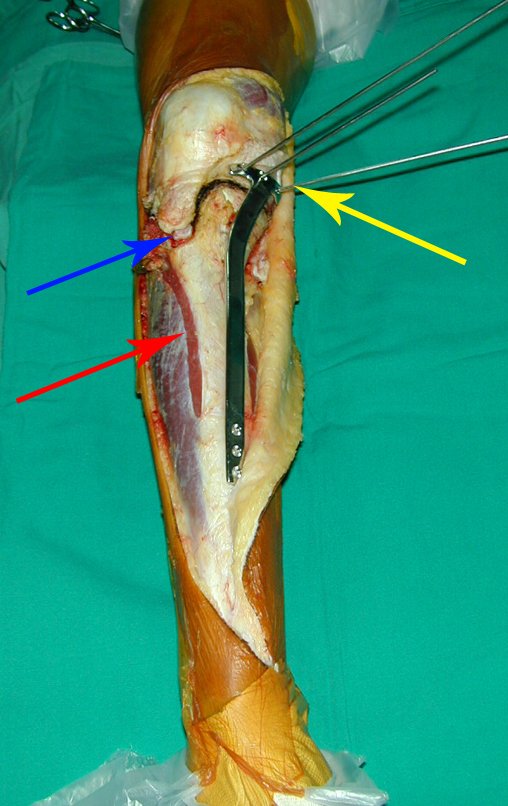
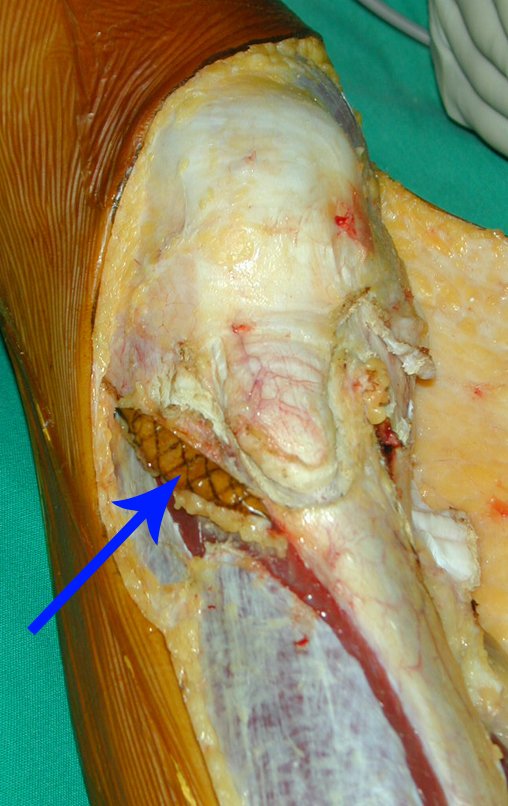
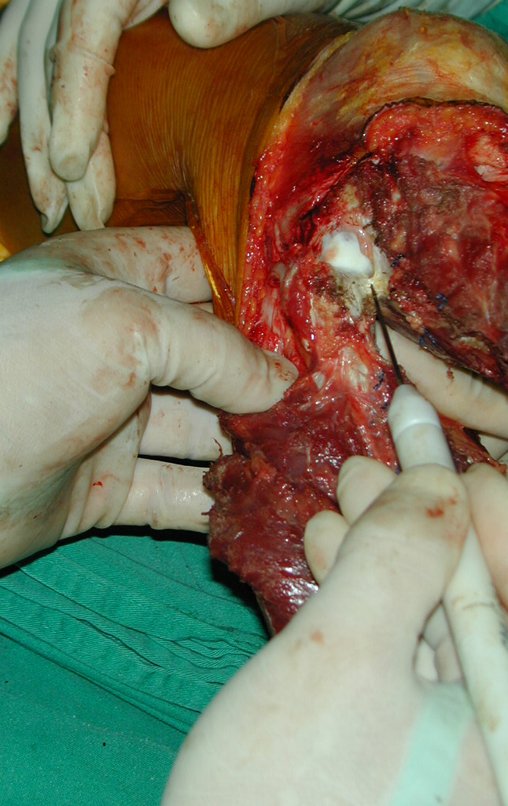
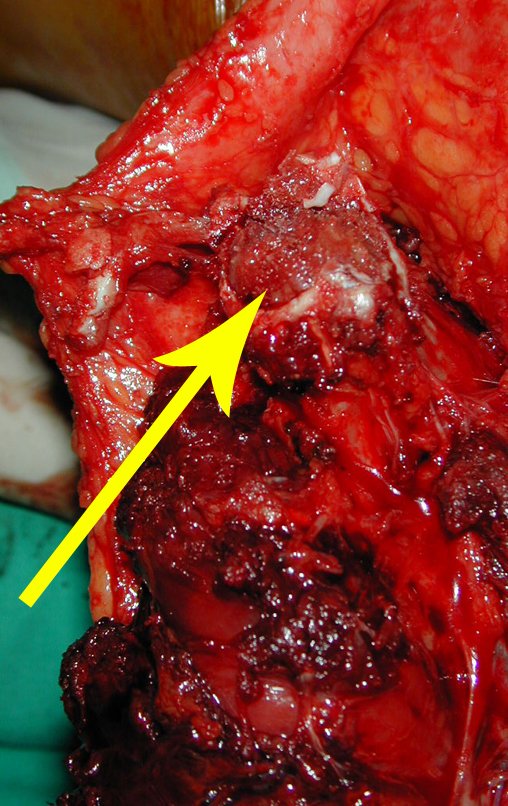
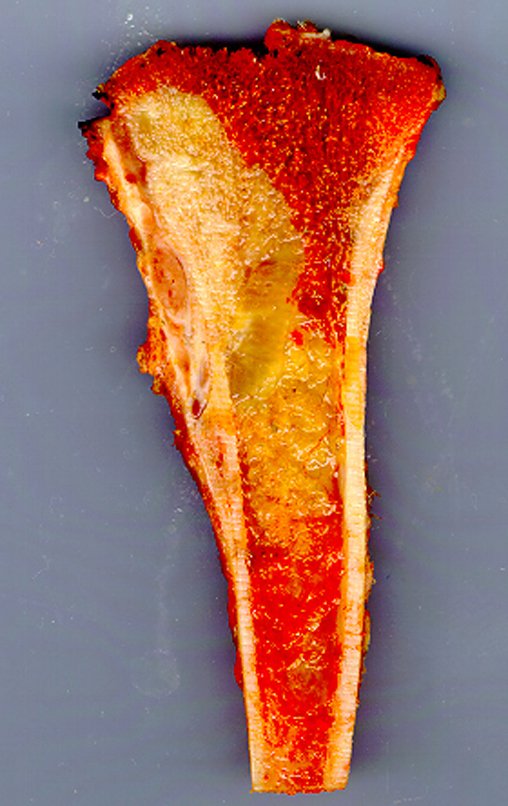
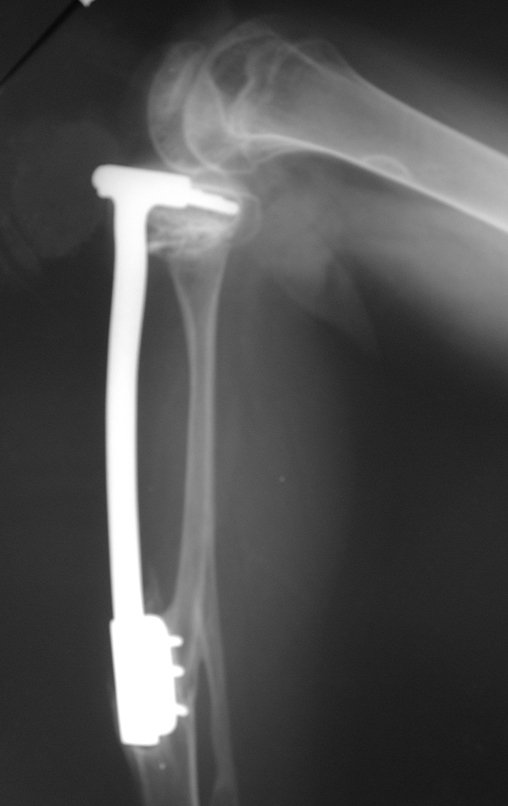
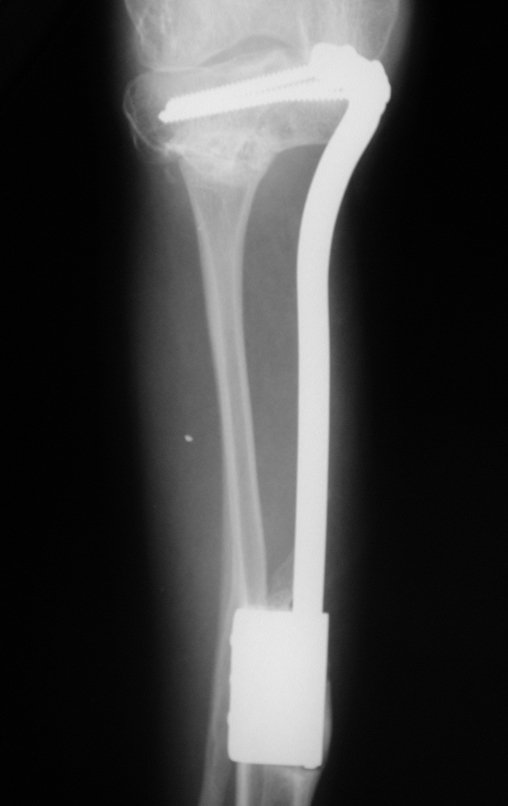
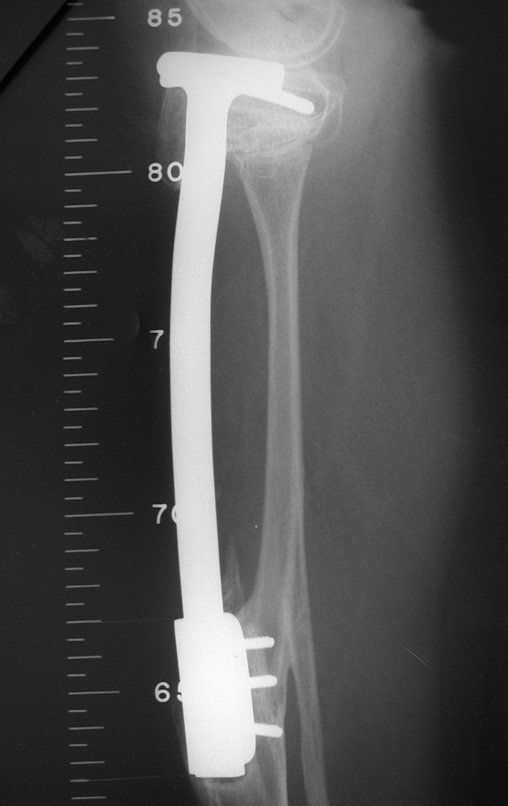
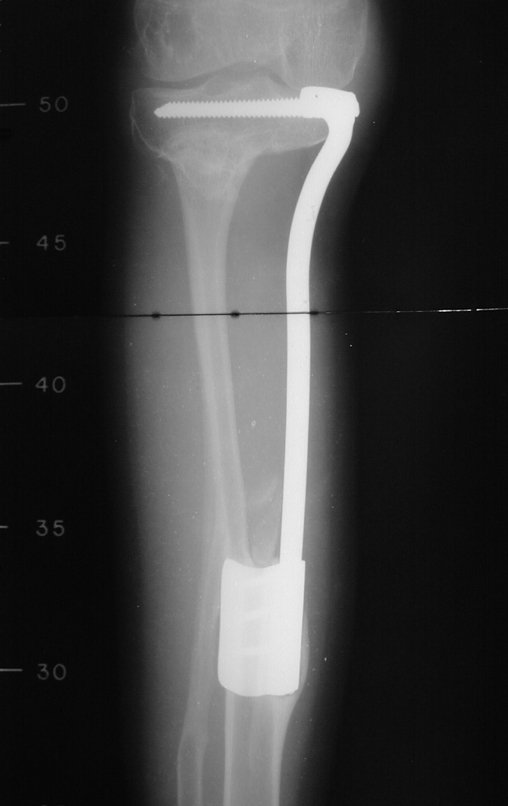
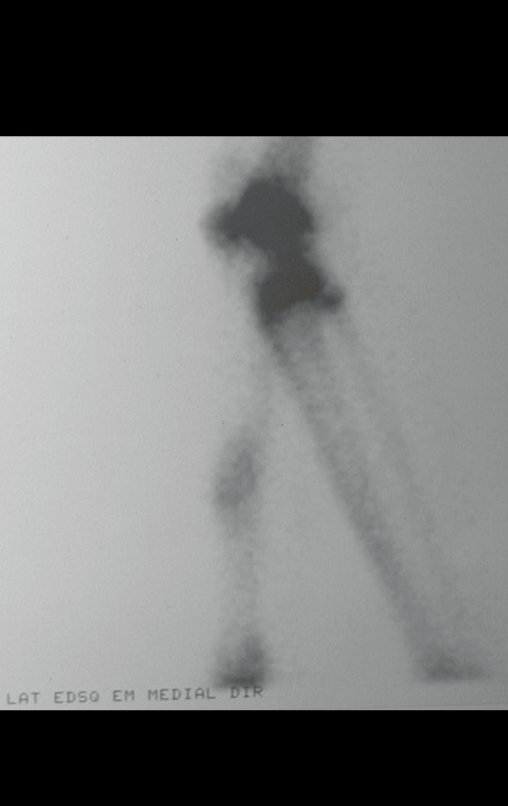
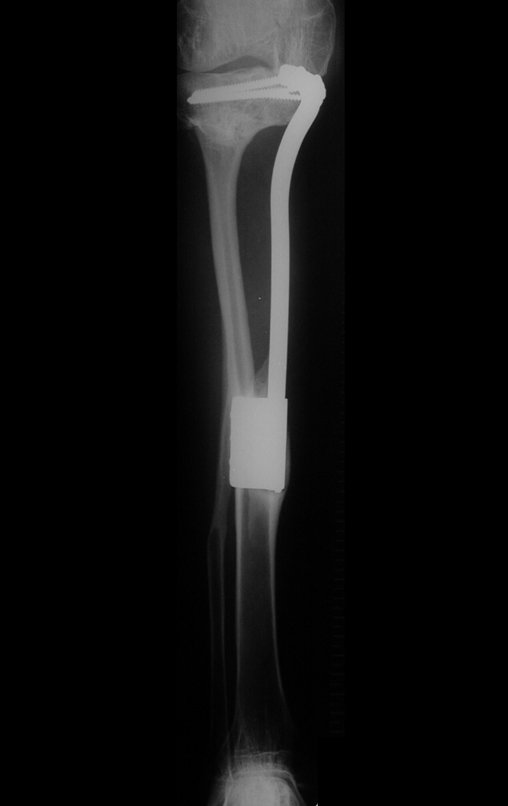
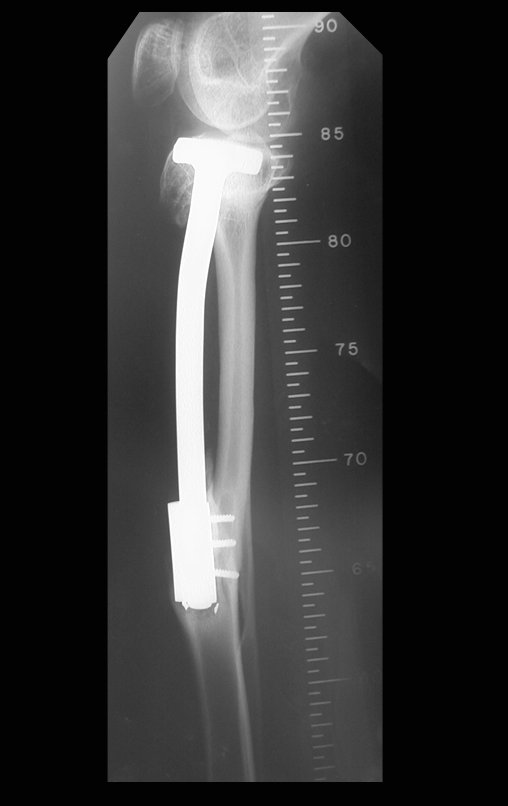
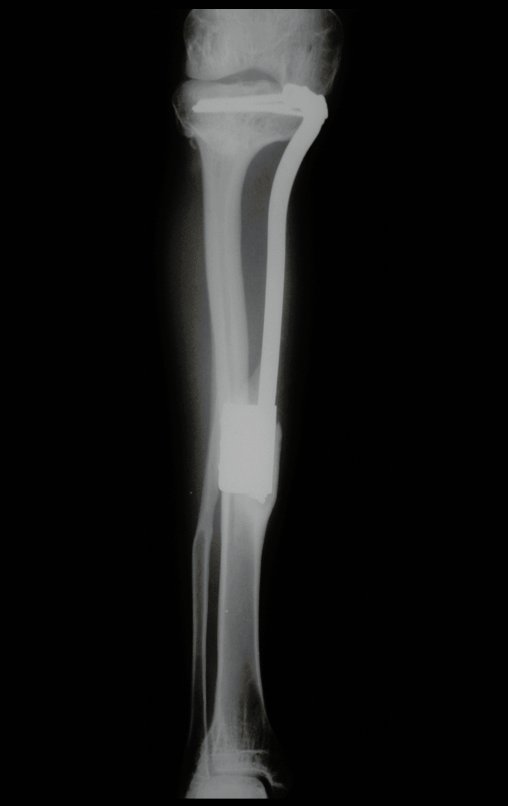
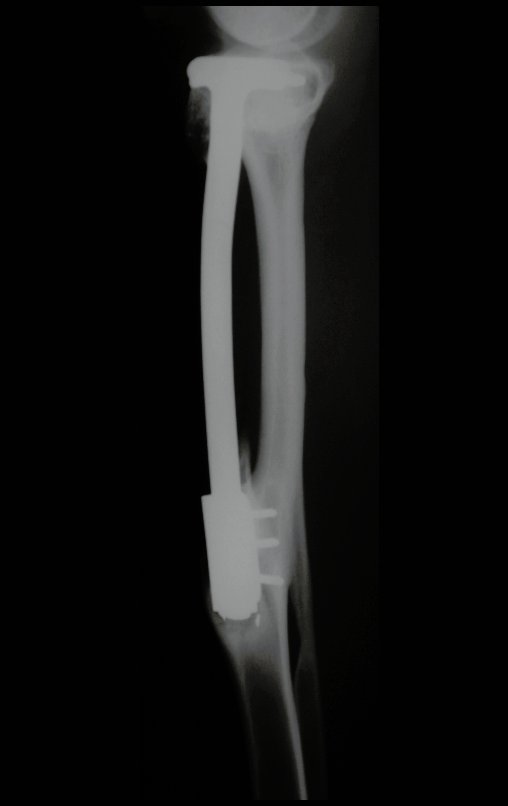
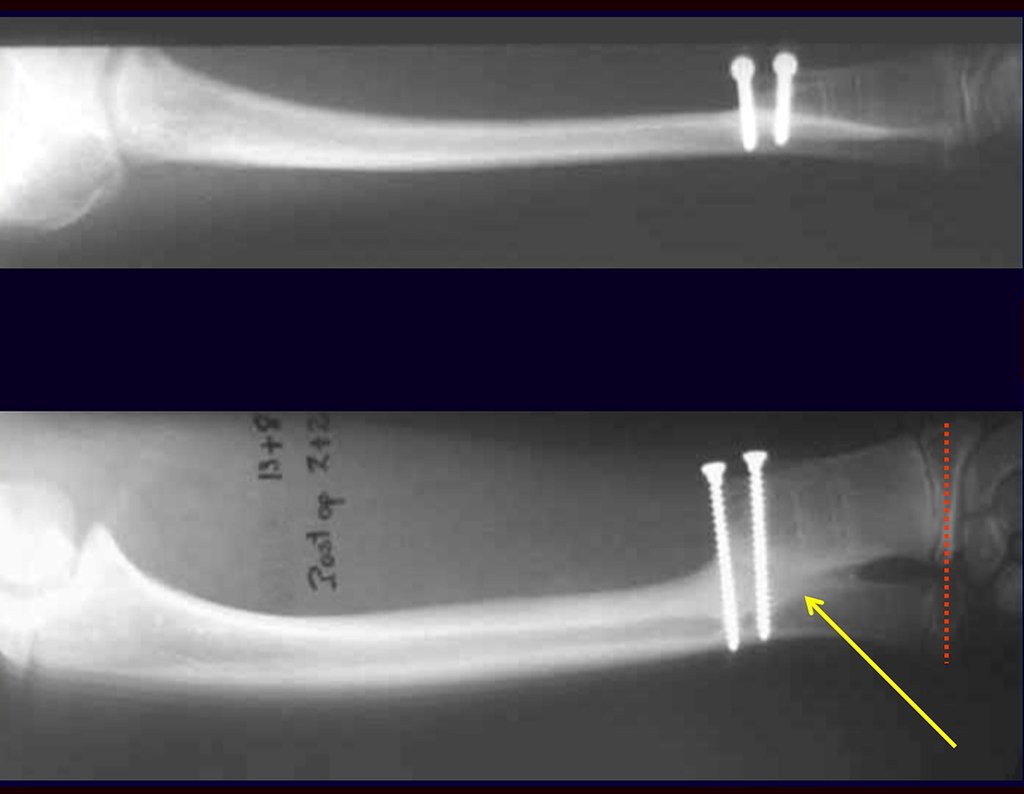
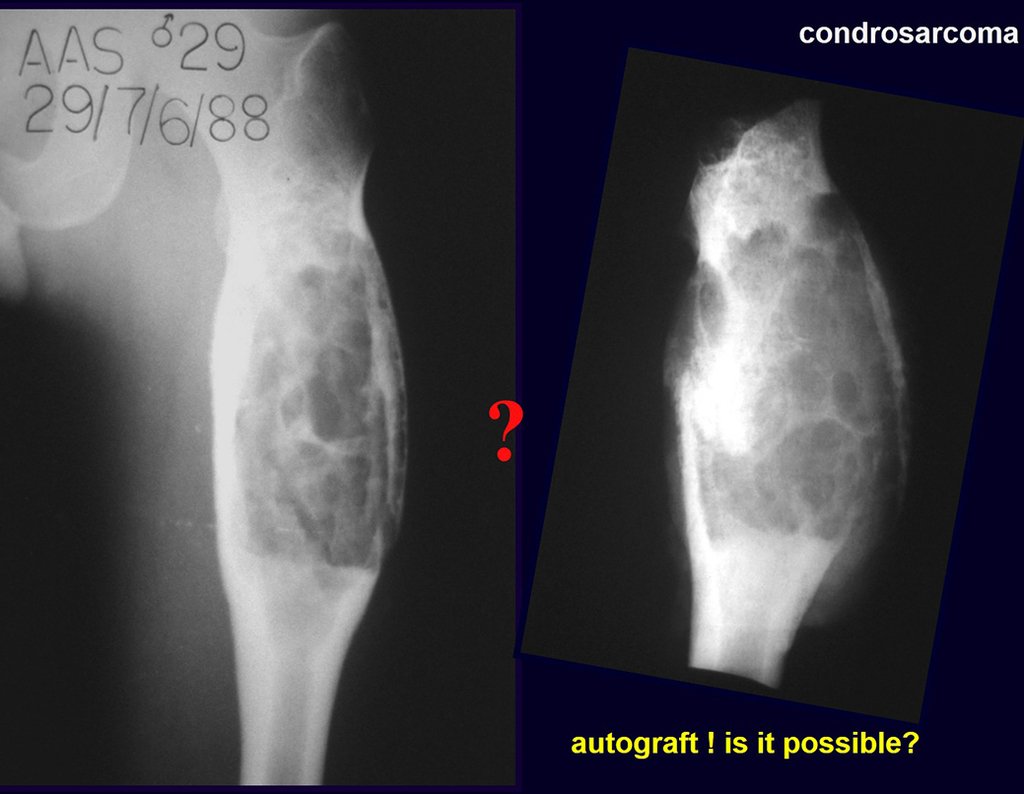
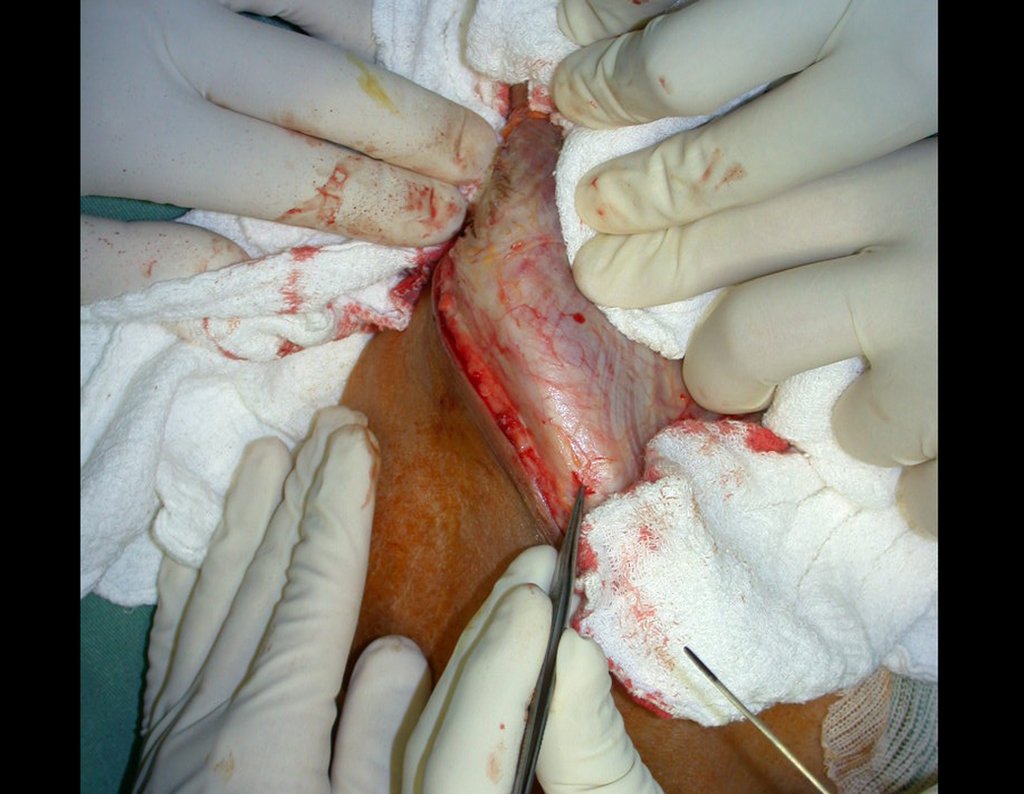
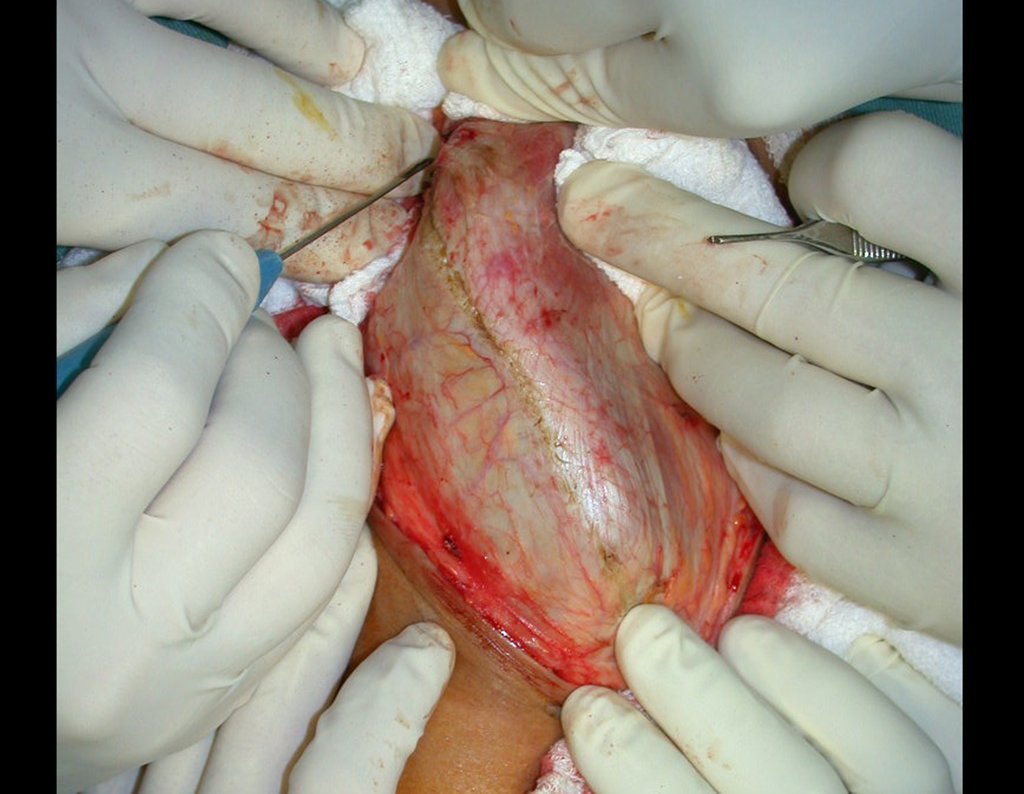
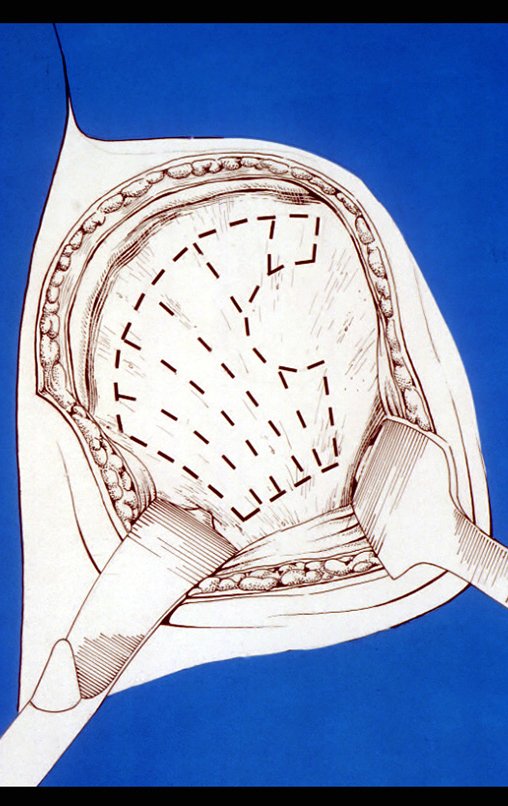
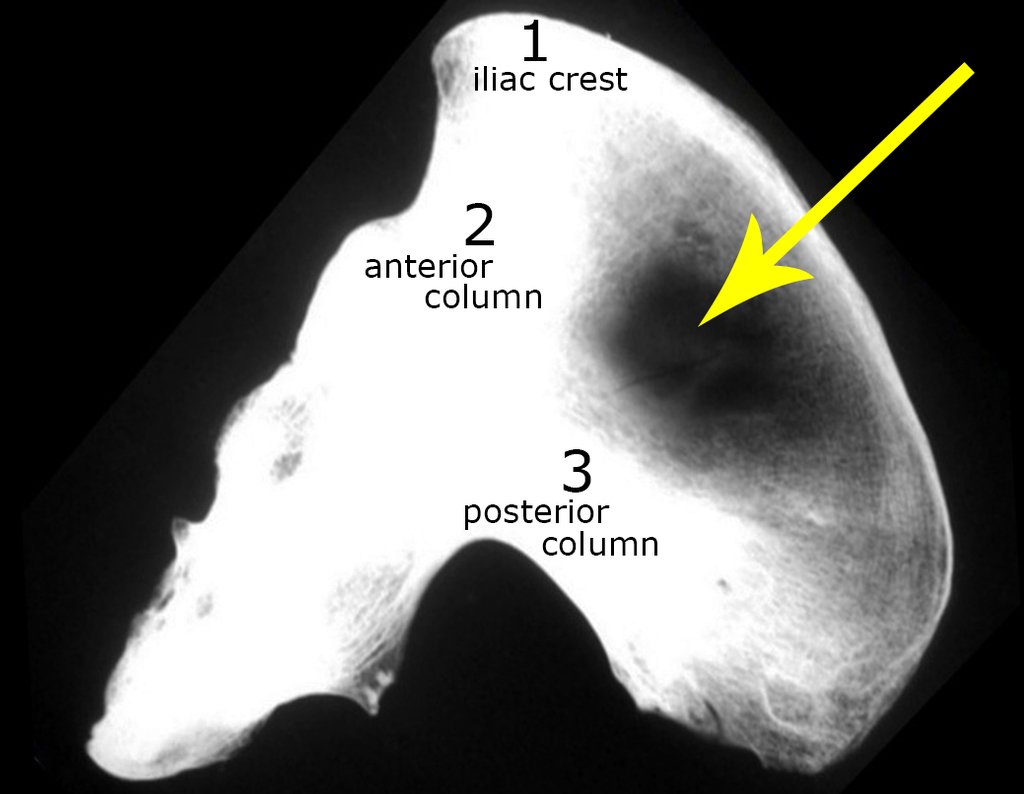
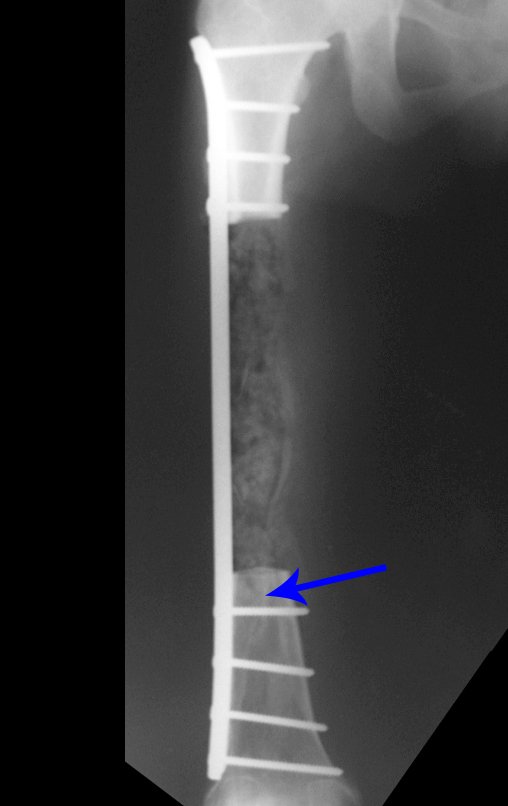
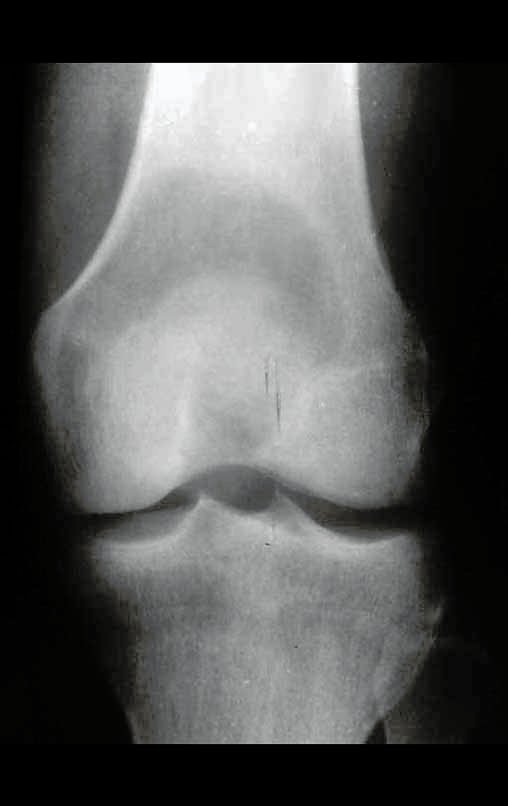
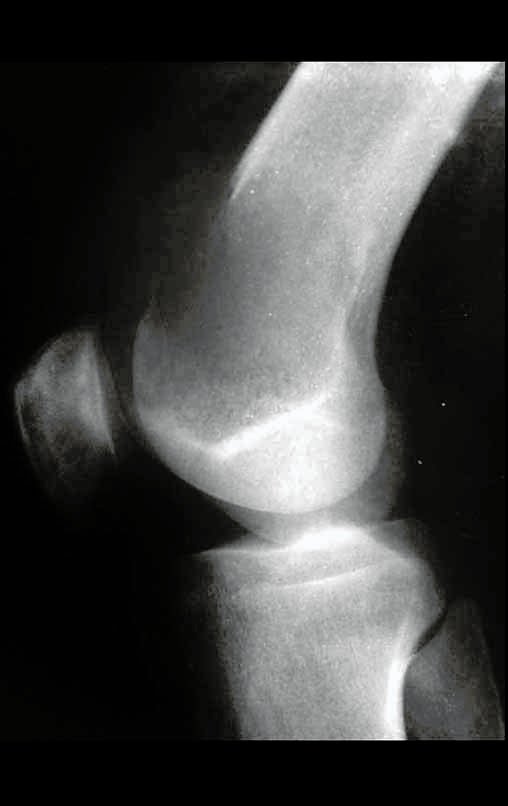
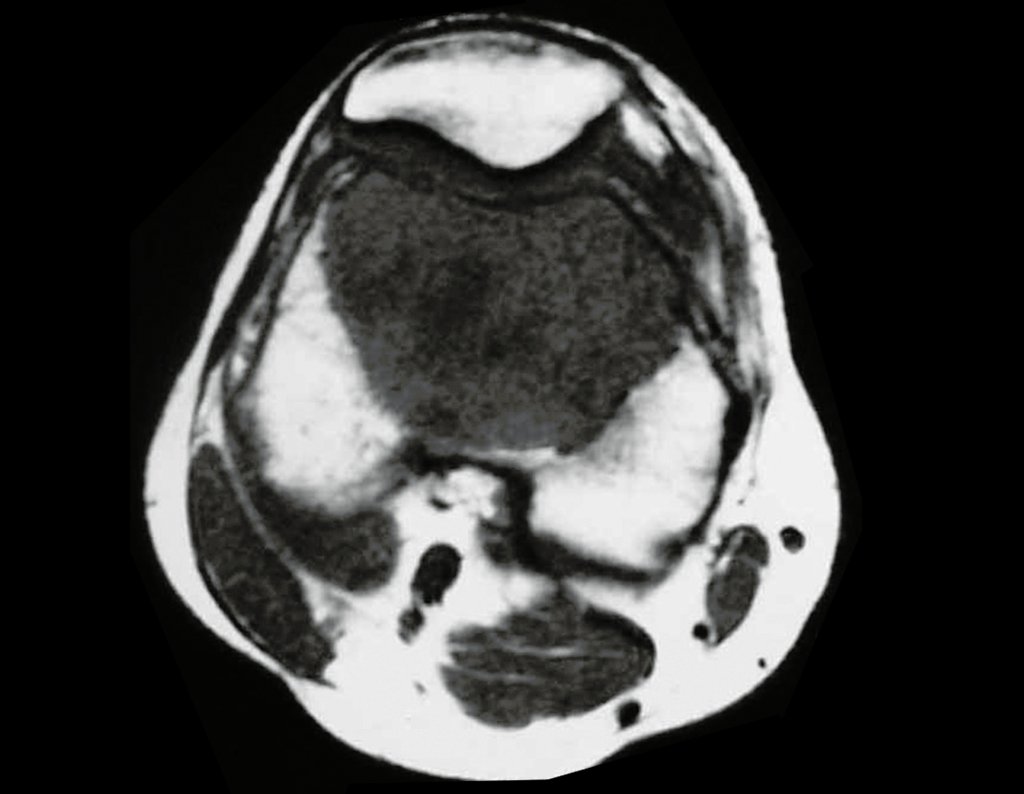
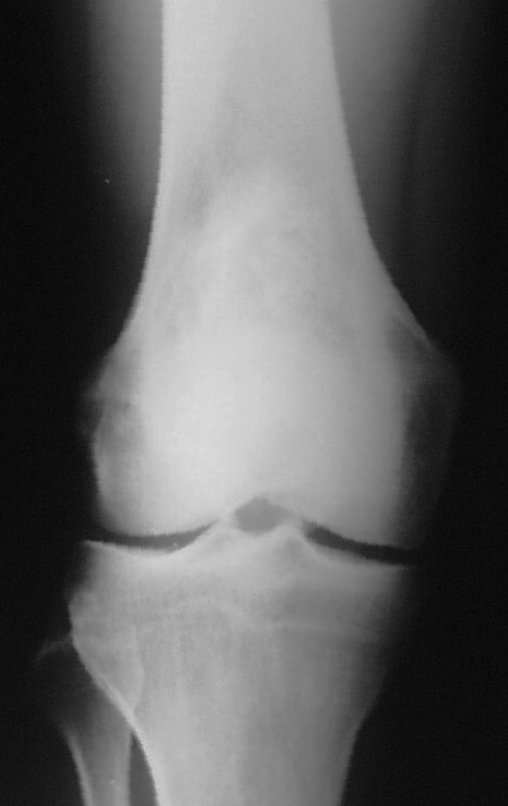
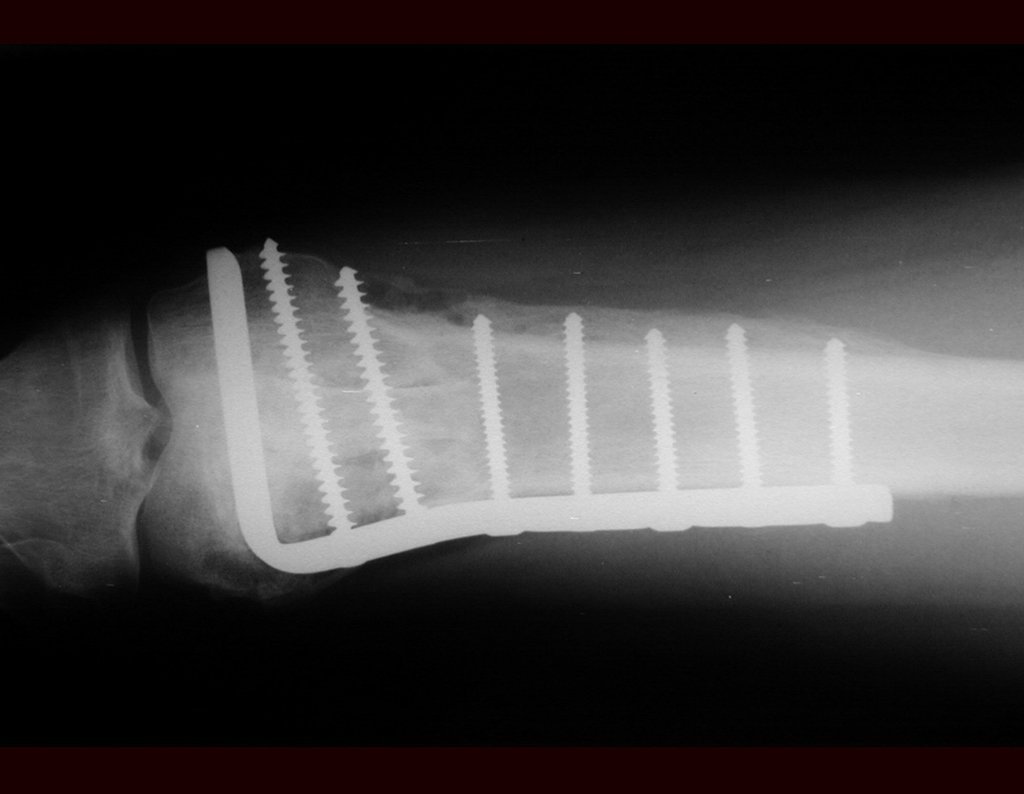
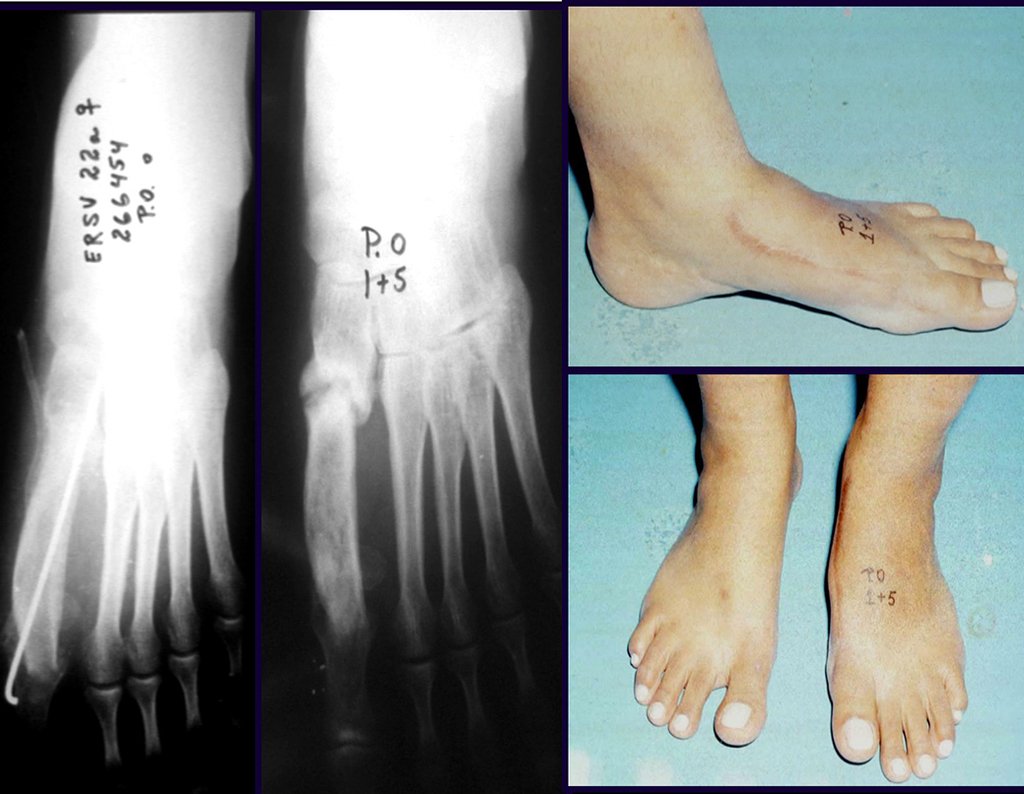
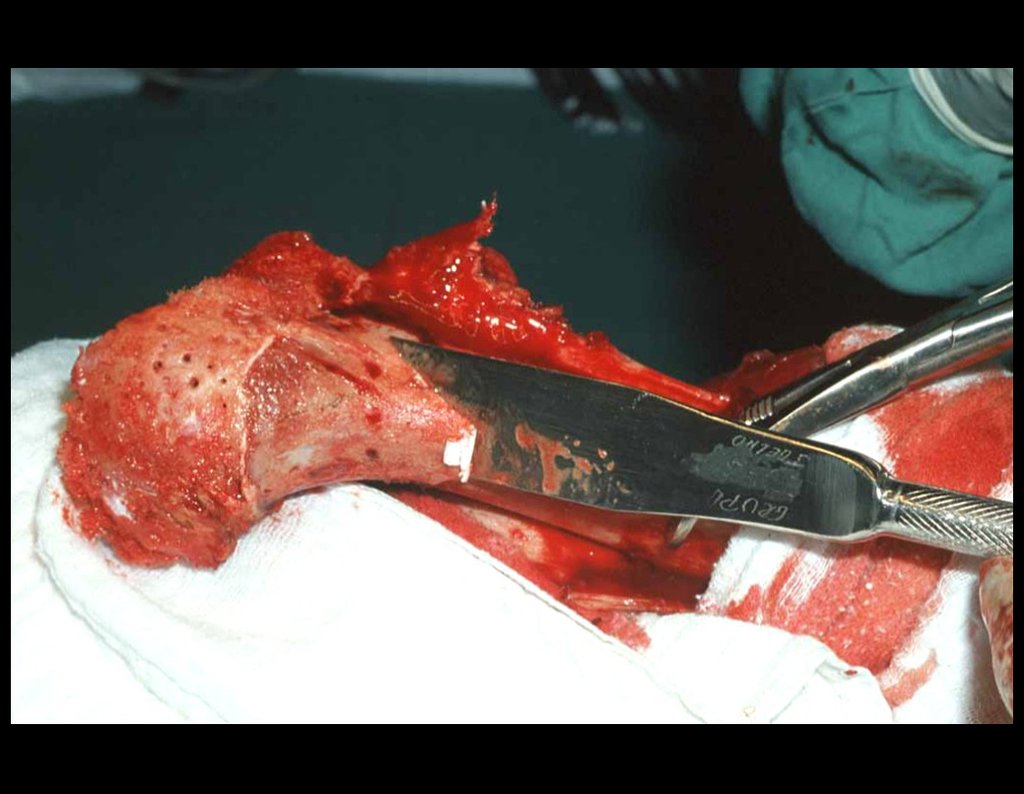
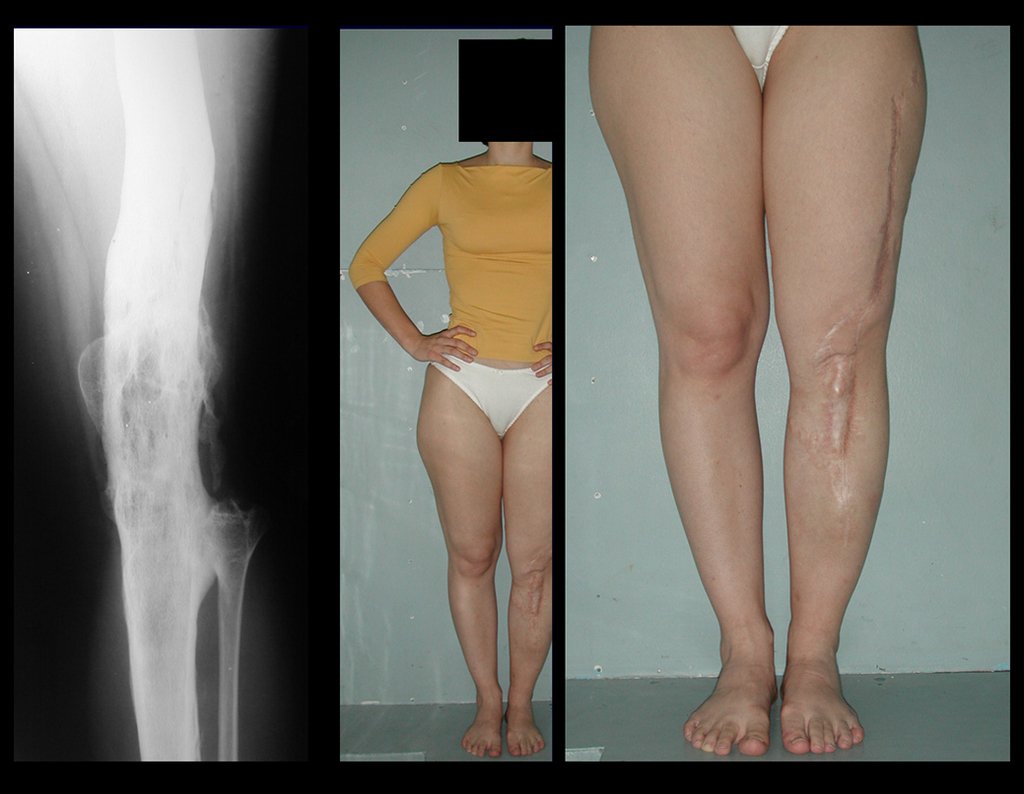
Radiograficamente é descrito como lesão epifisária caracterizada por rarefação óssea, de início excêntrica, inicialmente respeitando os limites da cortical. Com a evolução, pode ocorrer ruptura da cortical e comprometimento articular (fig. 27).
Histologicamente as células gigantes e o estroma são os elementos mais importantes deste tumor. Caracteriza-se por apresentar numerosas células gigantes que se assemelham-se aos osteoclastos em meio a estroma de células fusiformes.
Os principais diagnósticos diferenciais clínico, radiográfico e anatomopatológico são com cisto ósseo aneurismático, osteossarcoma teleangectásico e condroblastoma.
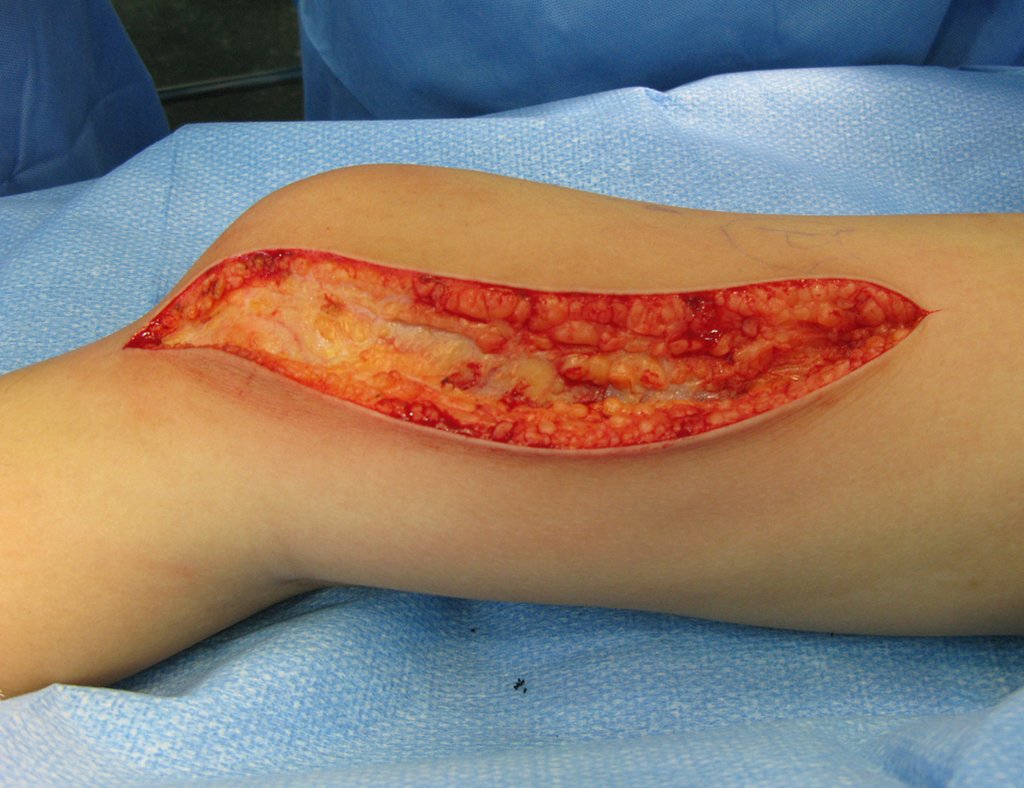
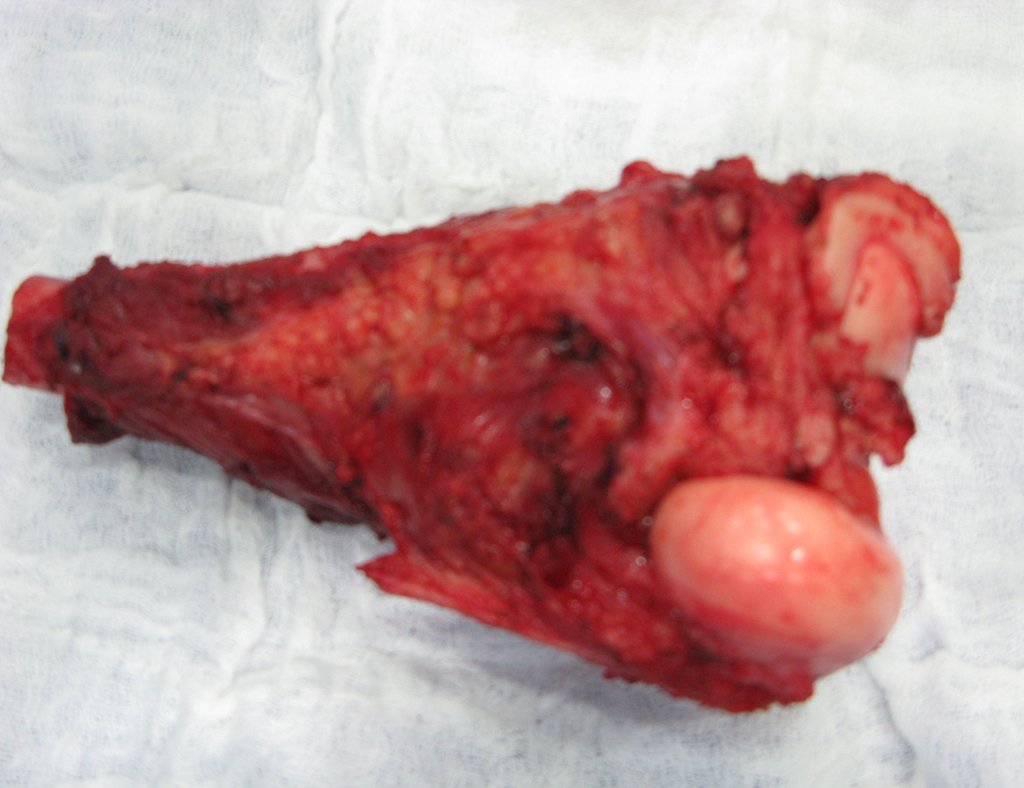
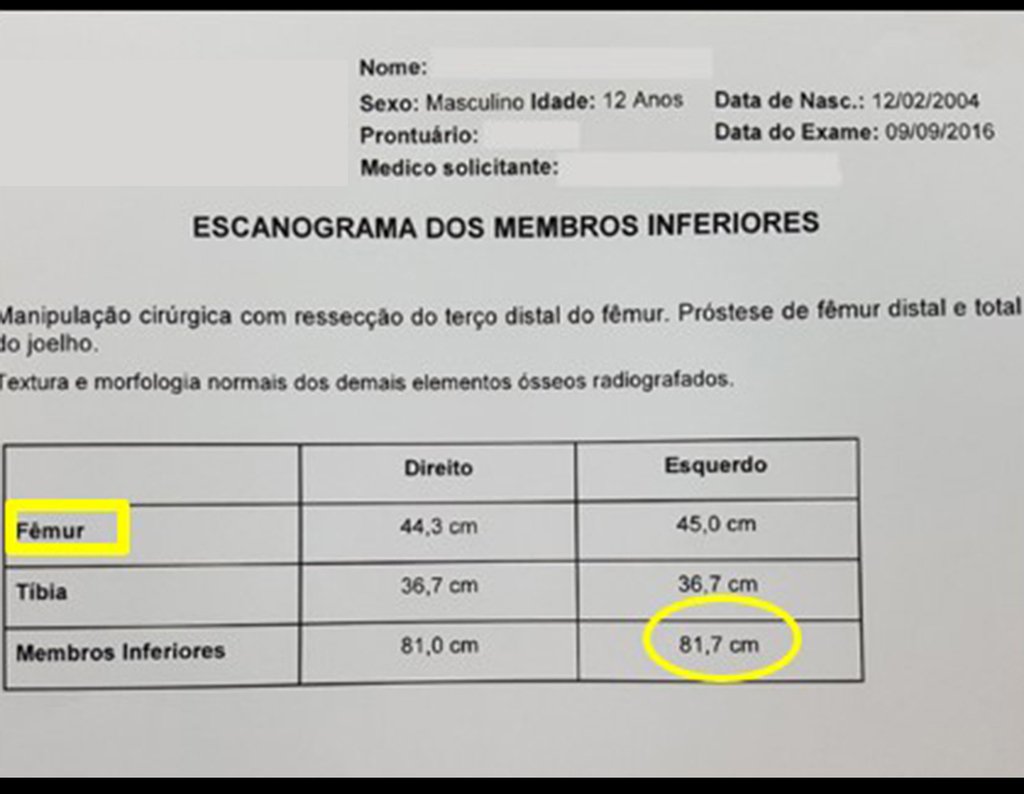
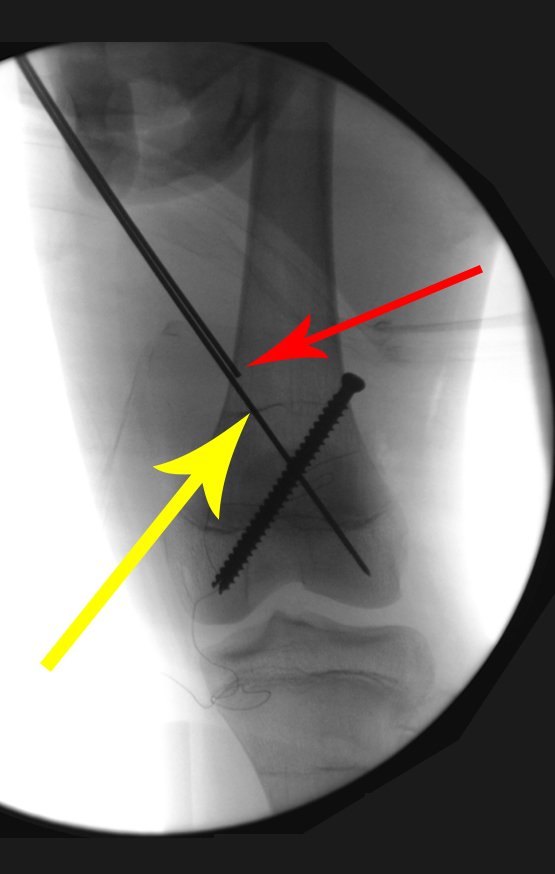
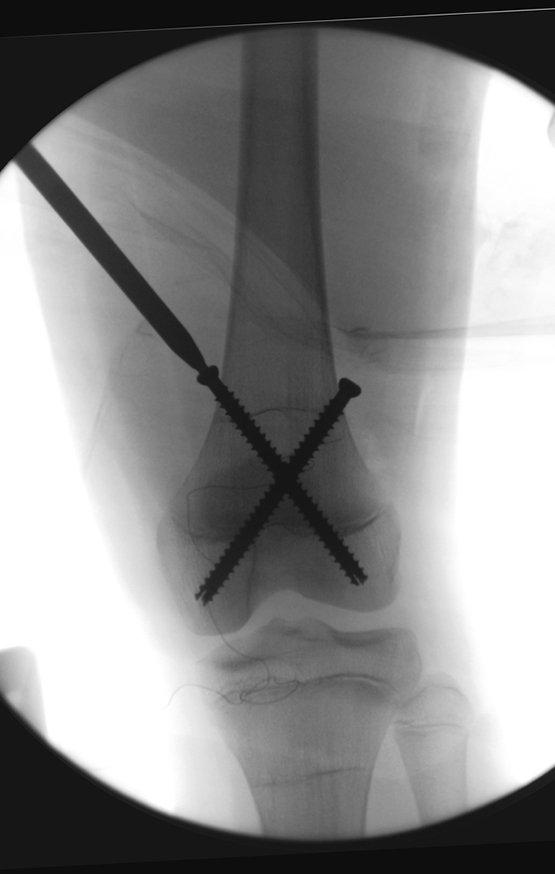
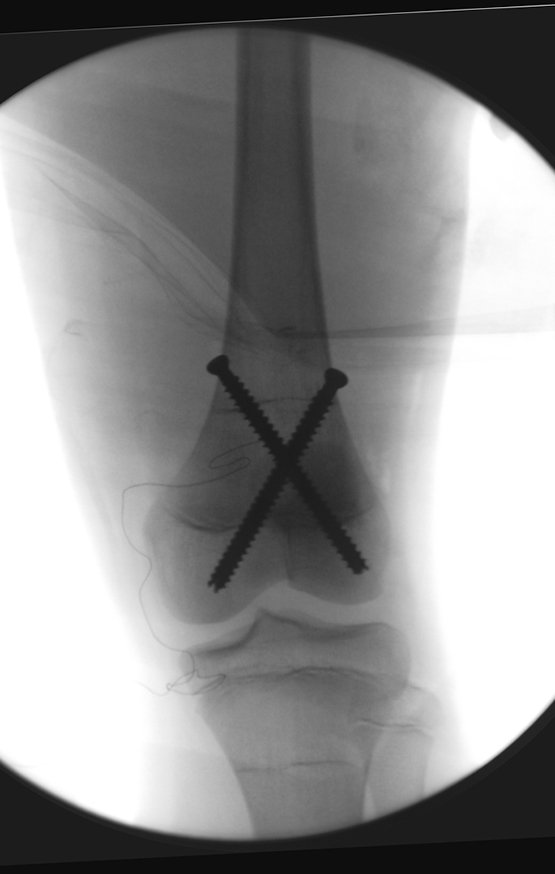
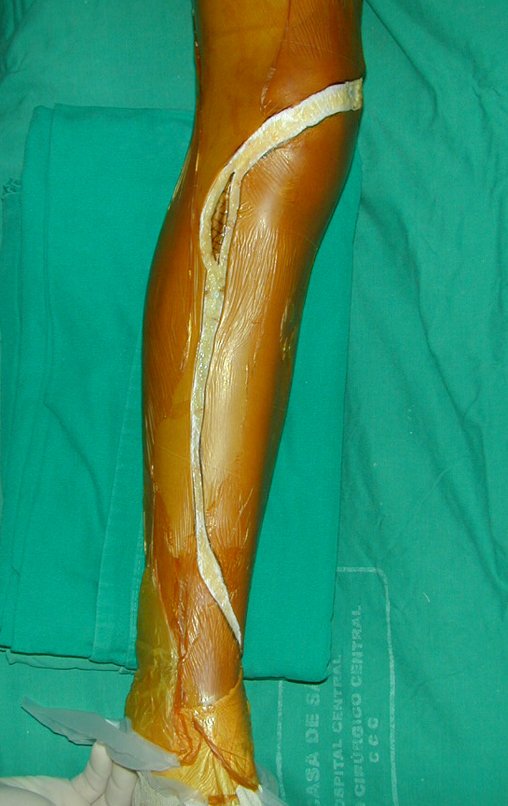
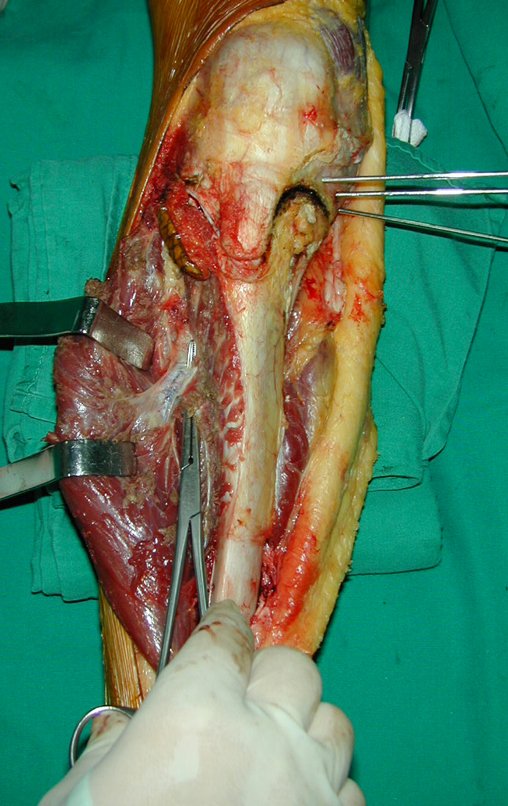
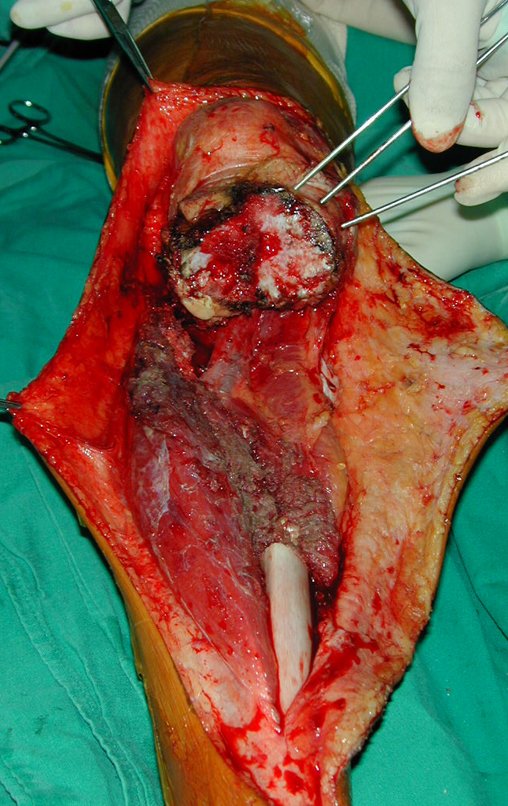
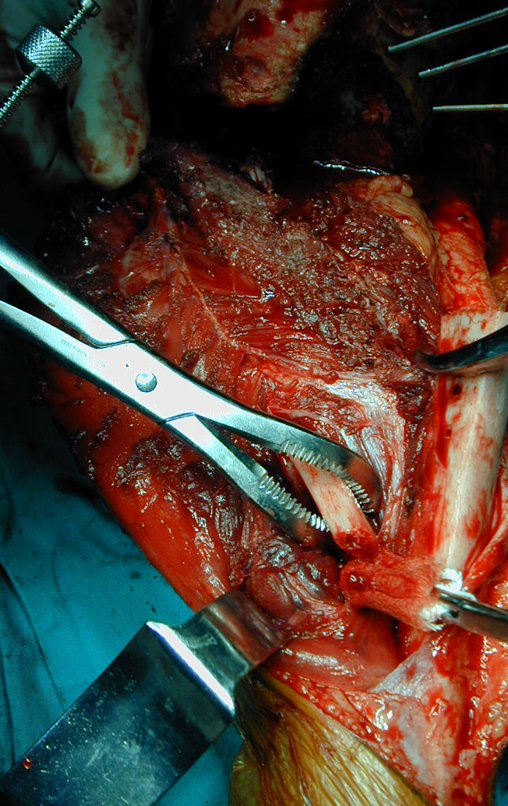
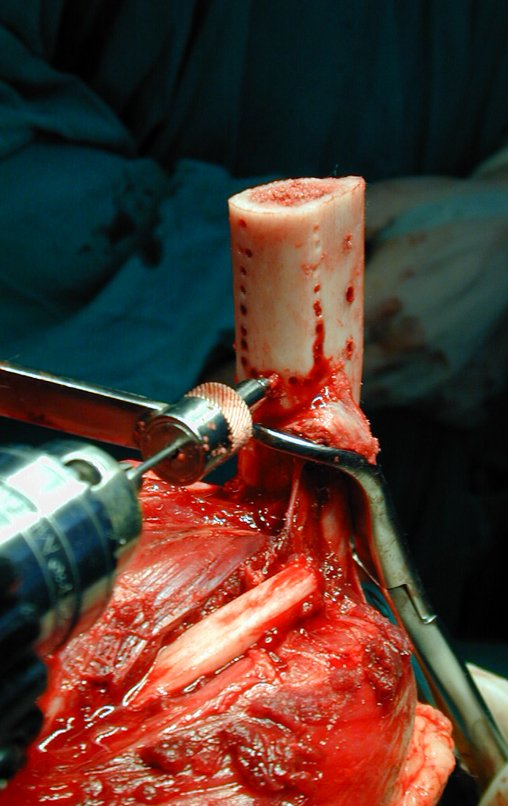
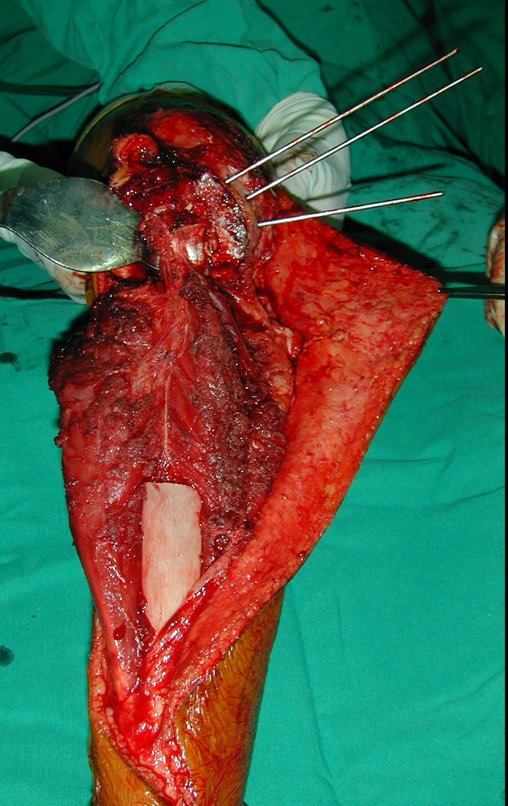
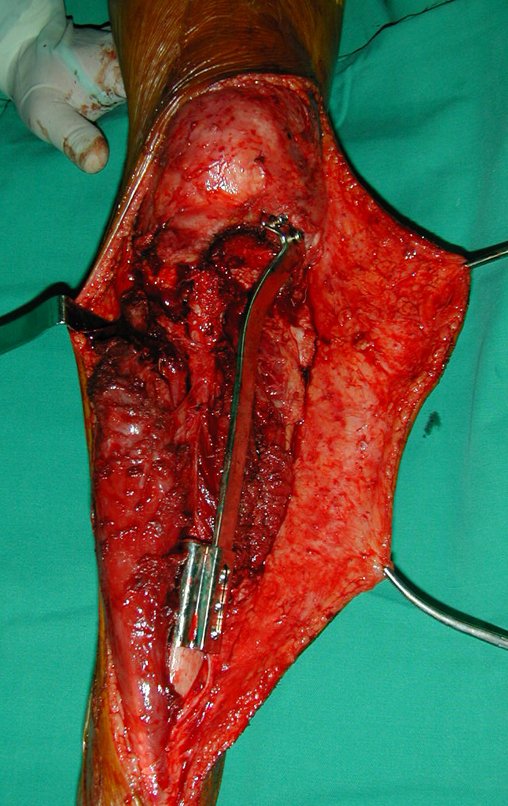
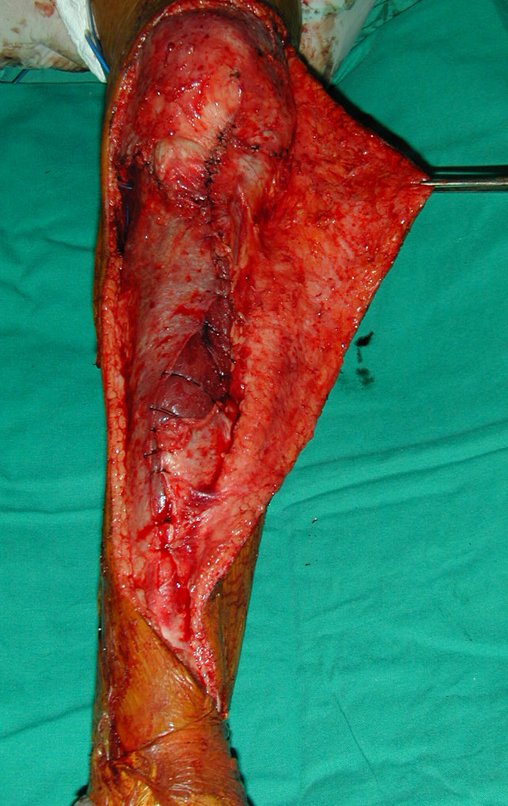
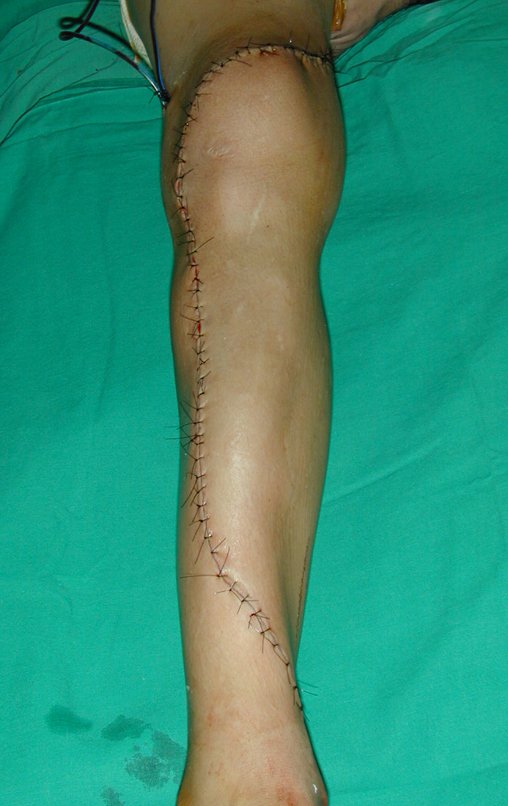
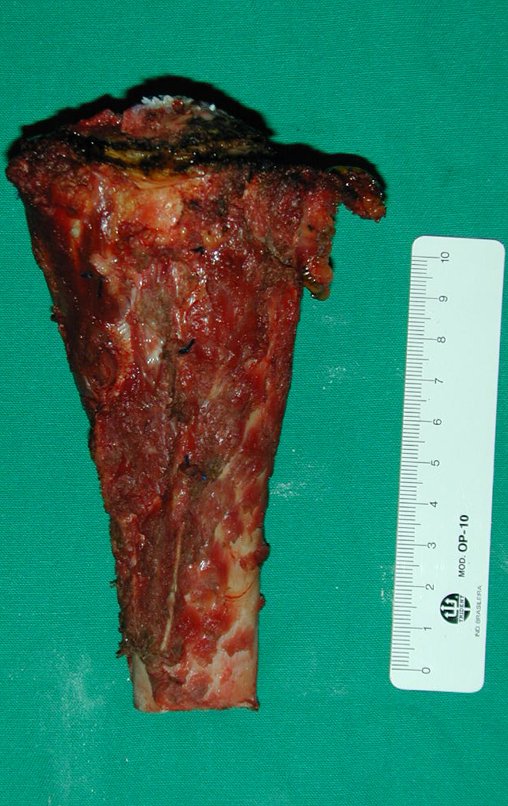
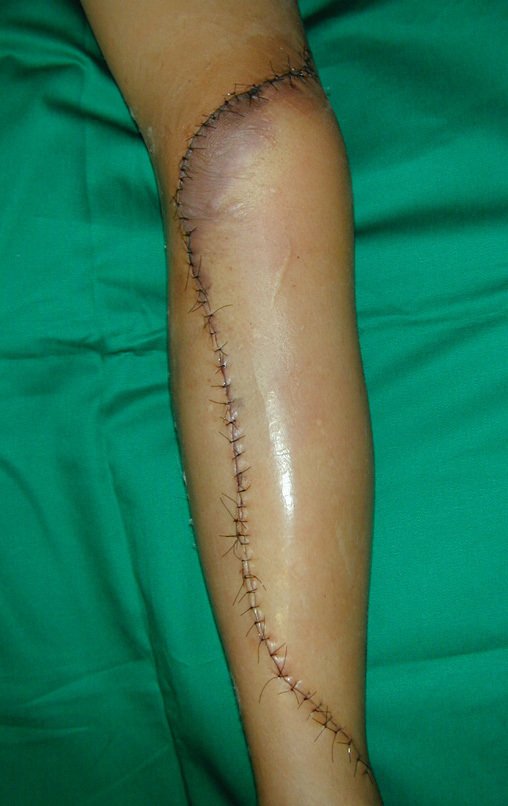
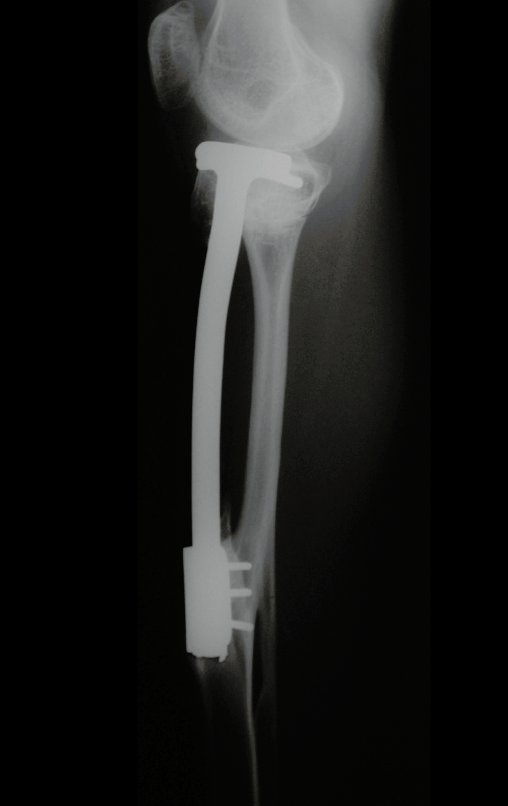
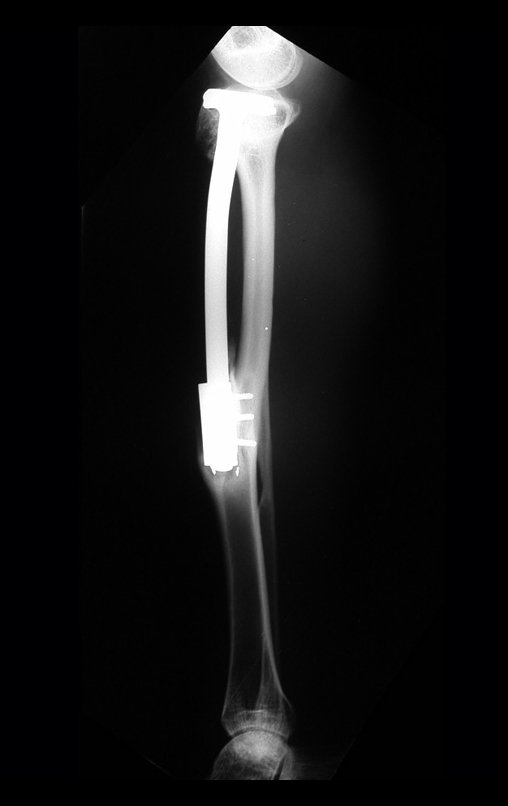
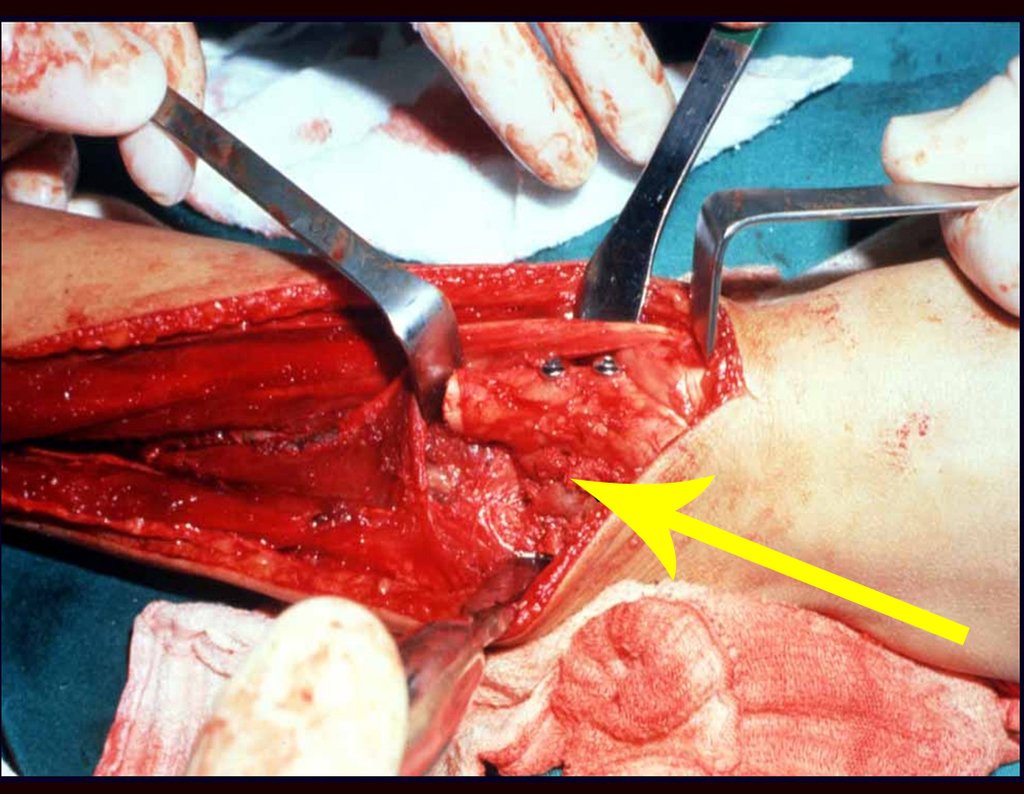
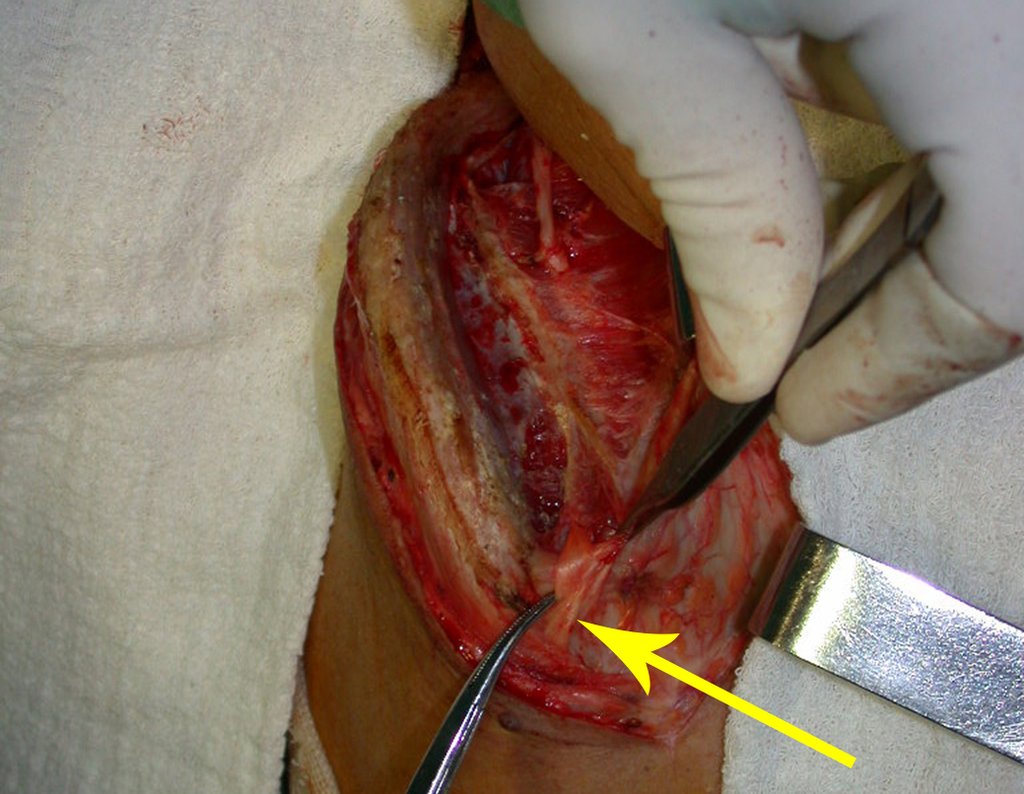
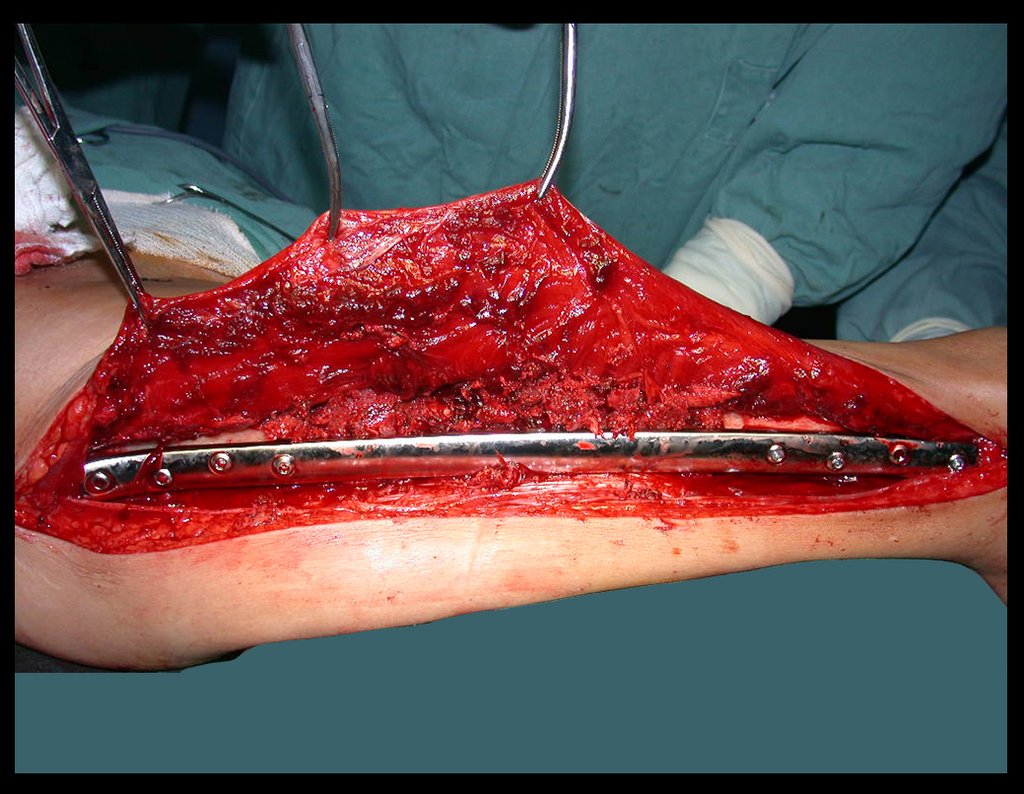
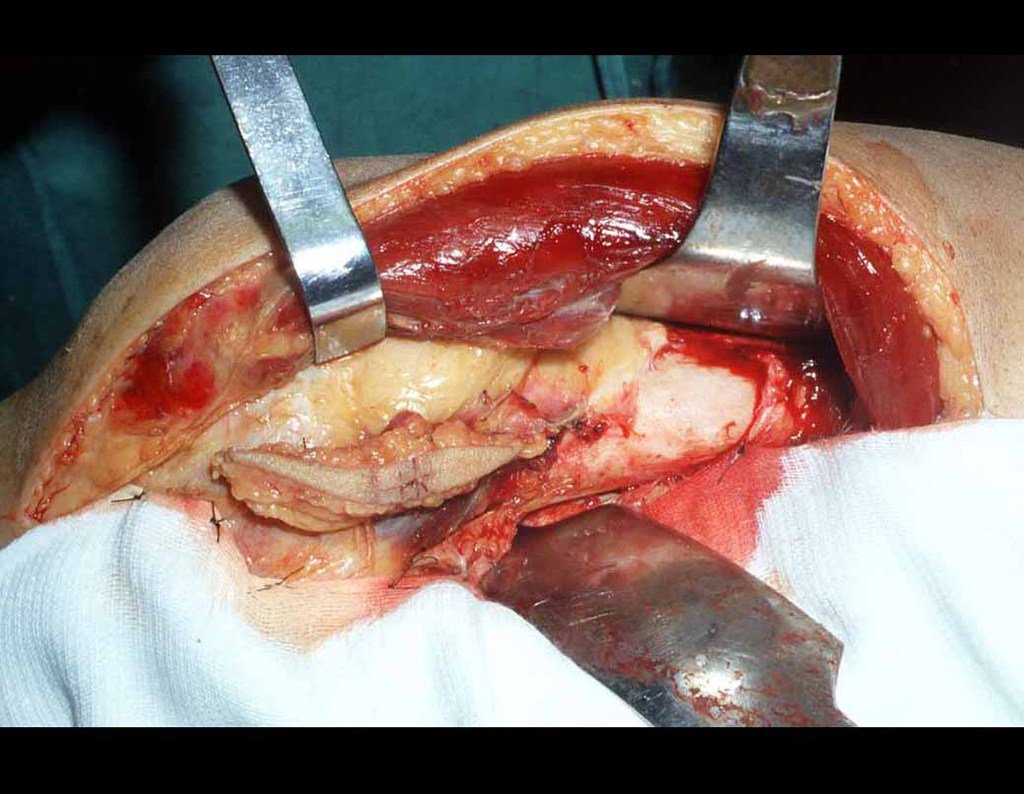
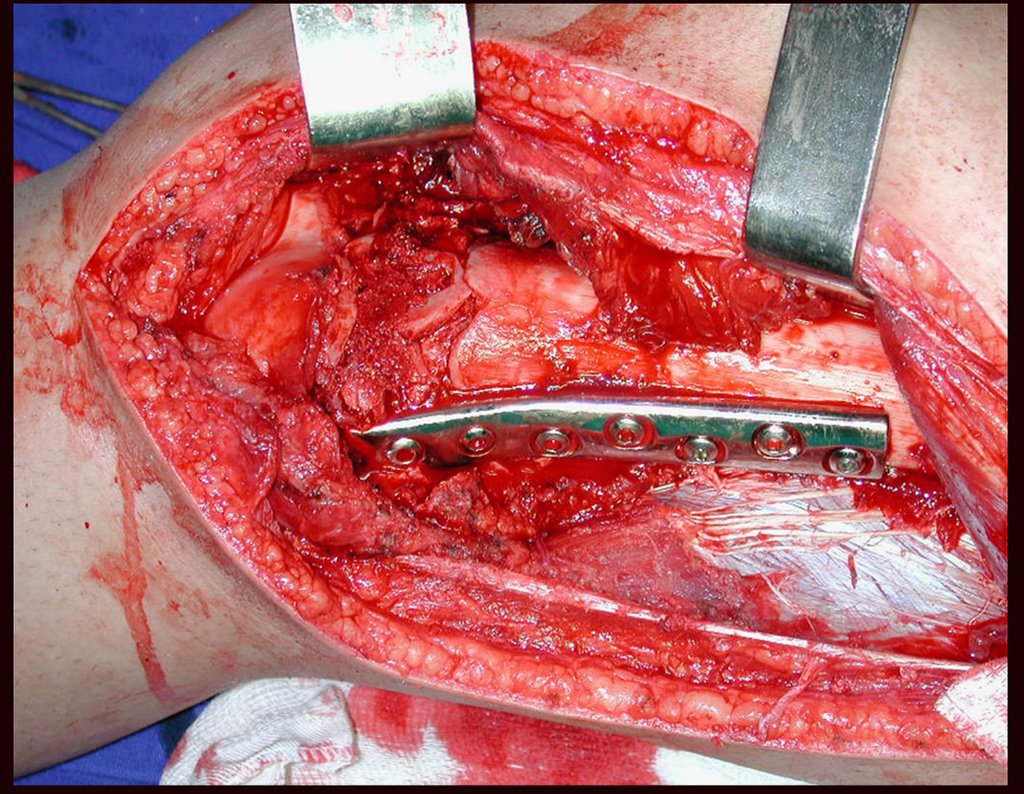
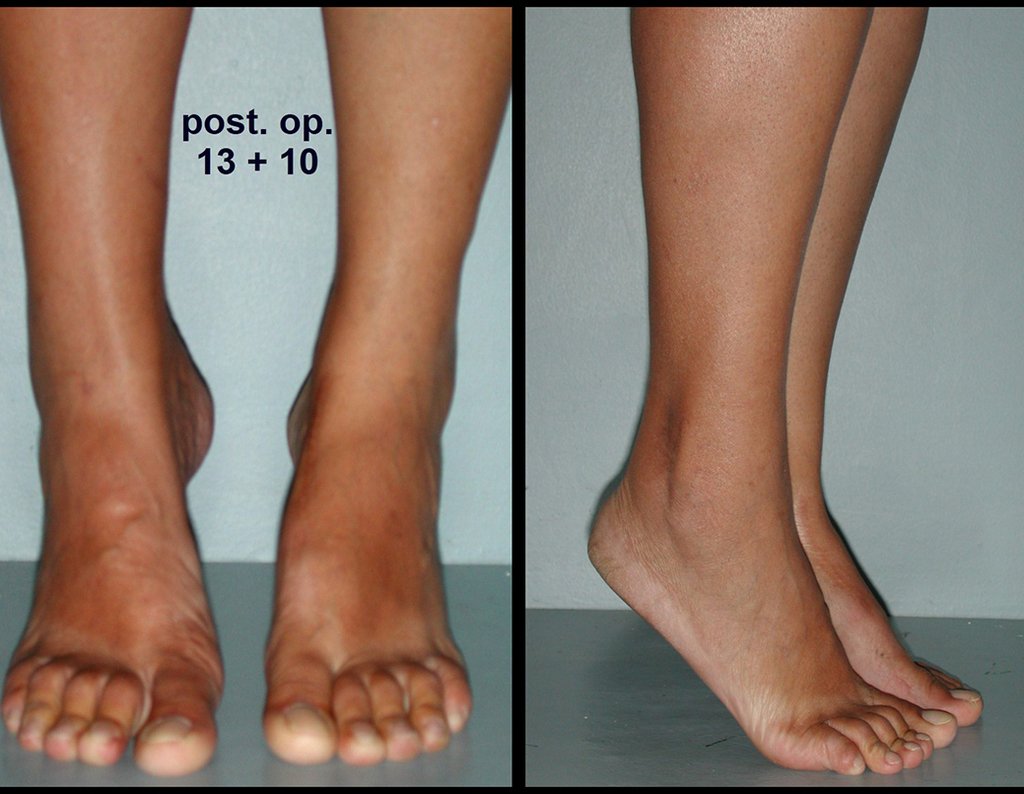
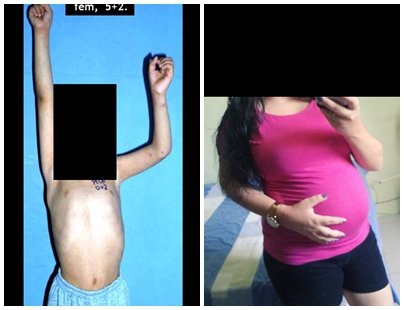
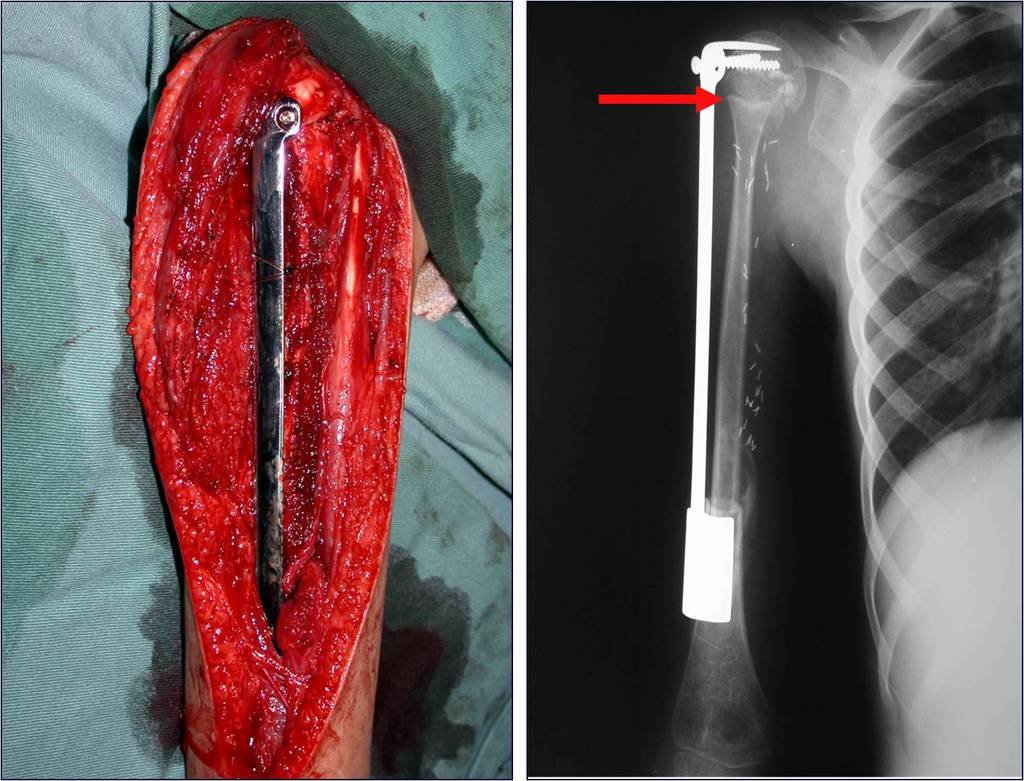
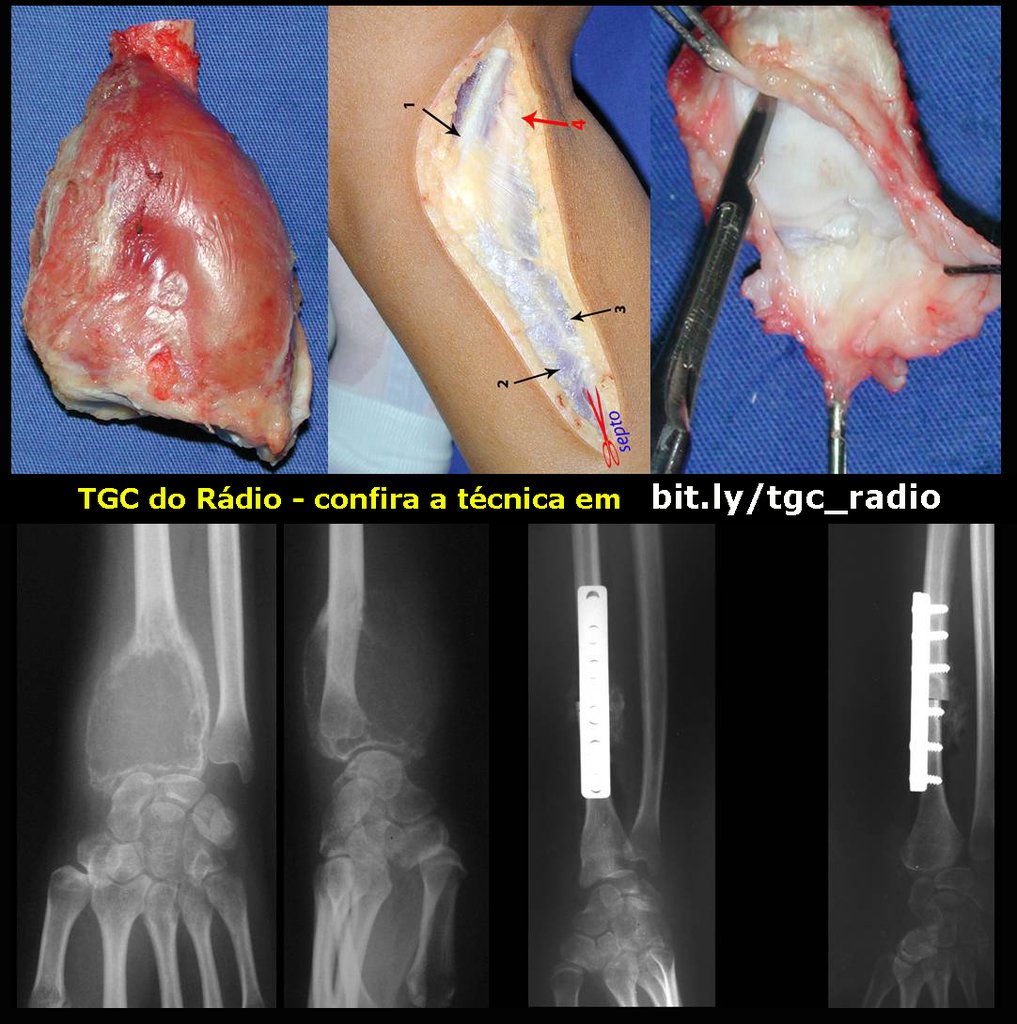
O tratamento do tumor de células gigantes atualmente está bem estabelecido. Deve-se optar, sempre que possível, pela ressecção segmentar da lesão, com margem de segurança oncológica tanto óssea como nas partes moles. Desta forma o cirurgião propiciará a maior oportunidade de cura, sem riscos de recorrência.
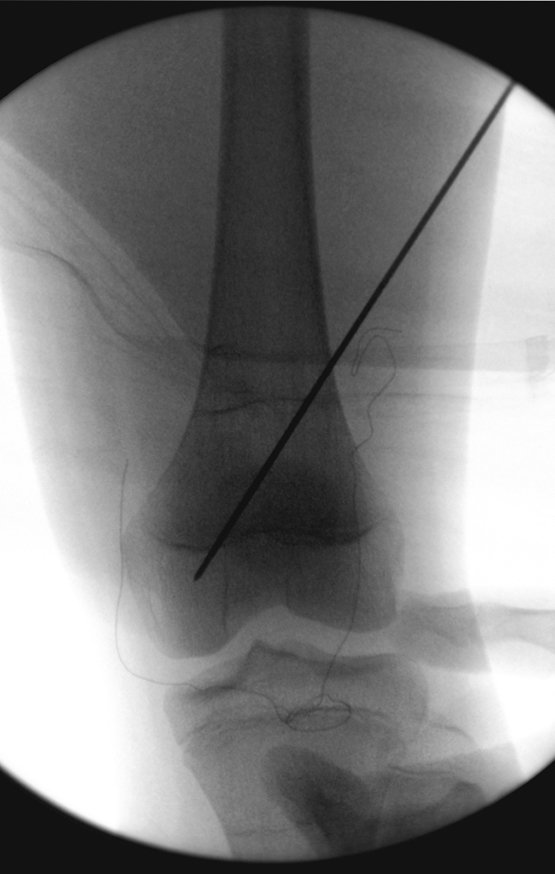
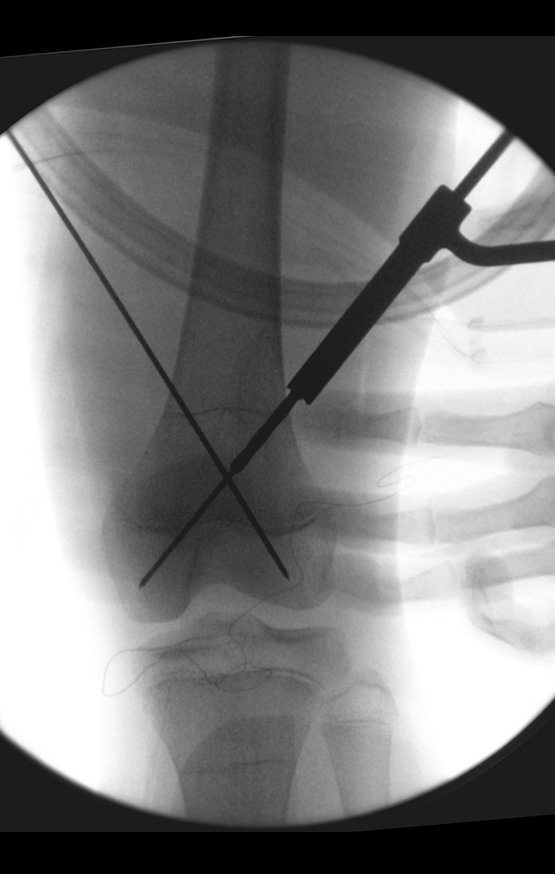
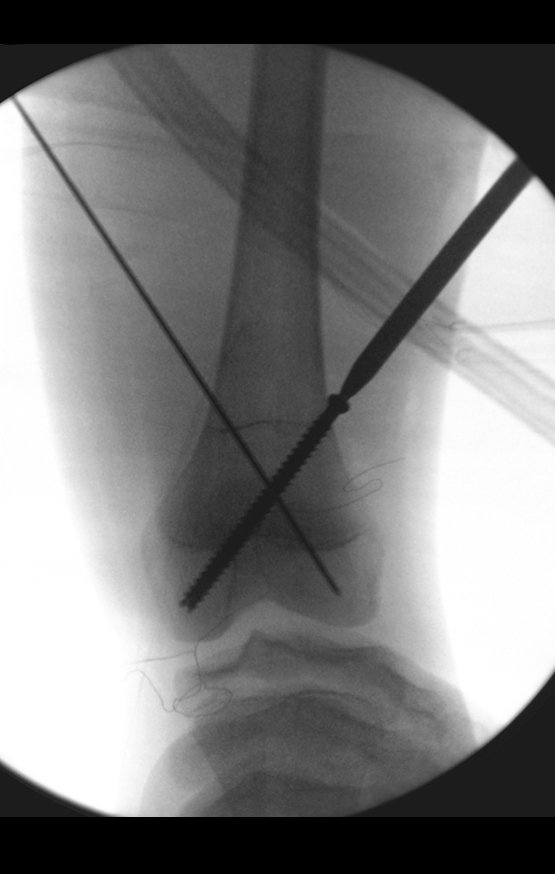
Entretanto, em regiões em que a ressecção segmentar não é factível, coluna cervical por exemplo, deve-se realizar a curetagem endocavitária mais criteriosa possível e complementar com terapia adjuvante tais como o laser CO2, o fenol diluído em álcool à 4 %, o nitrogênio líquido e a eletrotermia. O metilmetacrilato tem baixo efeito adjuvante e, quando empregado para preenchimento da cavidade, deve ser precedido por uma das terapias mencionadas.
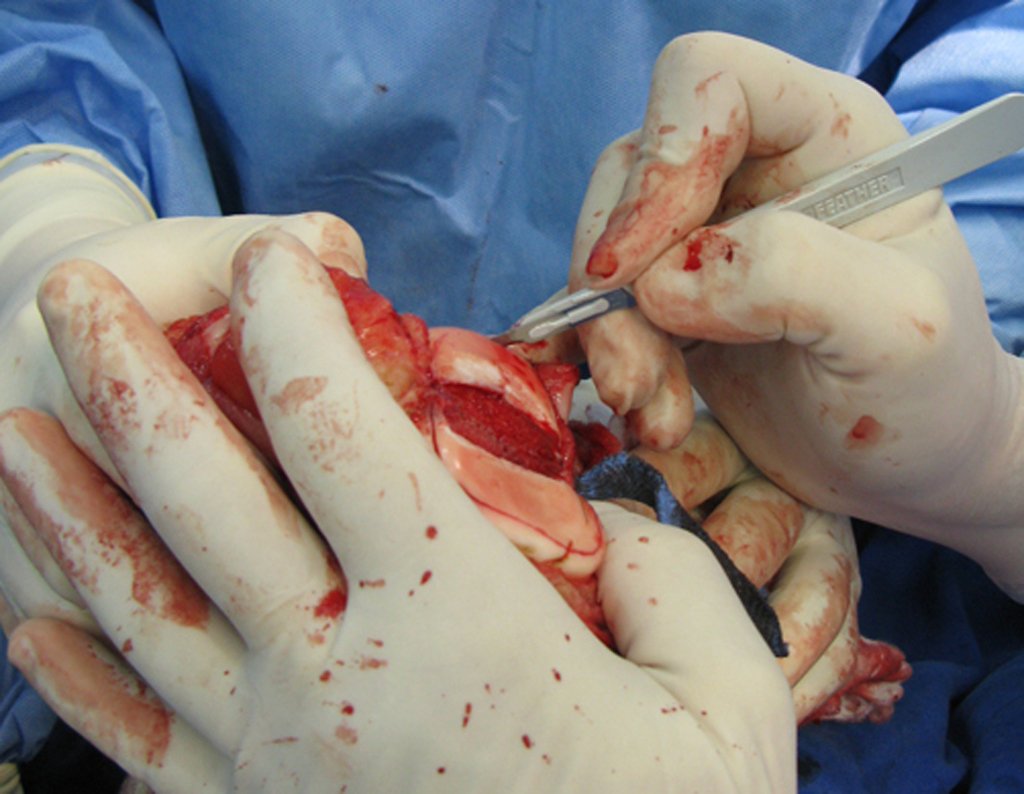
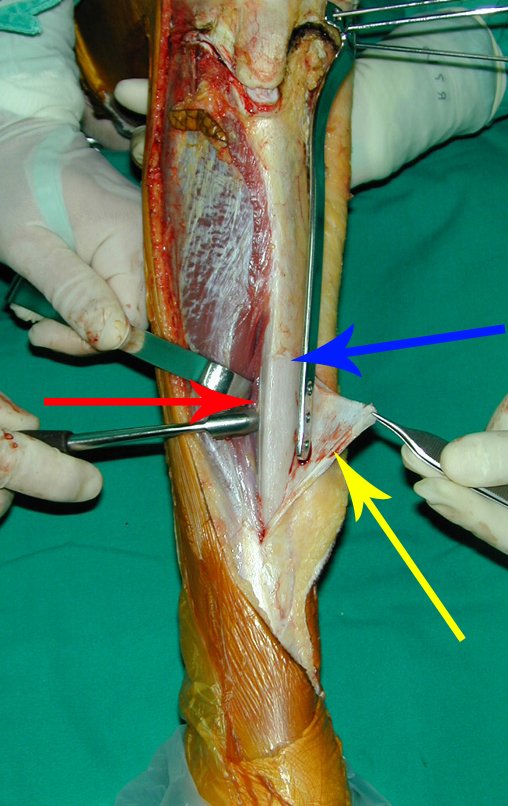
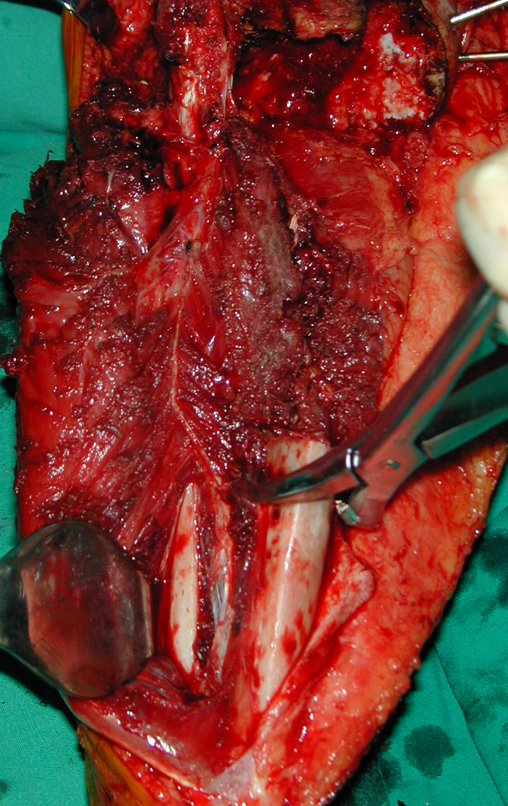
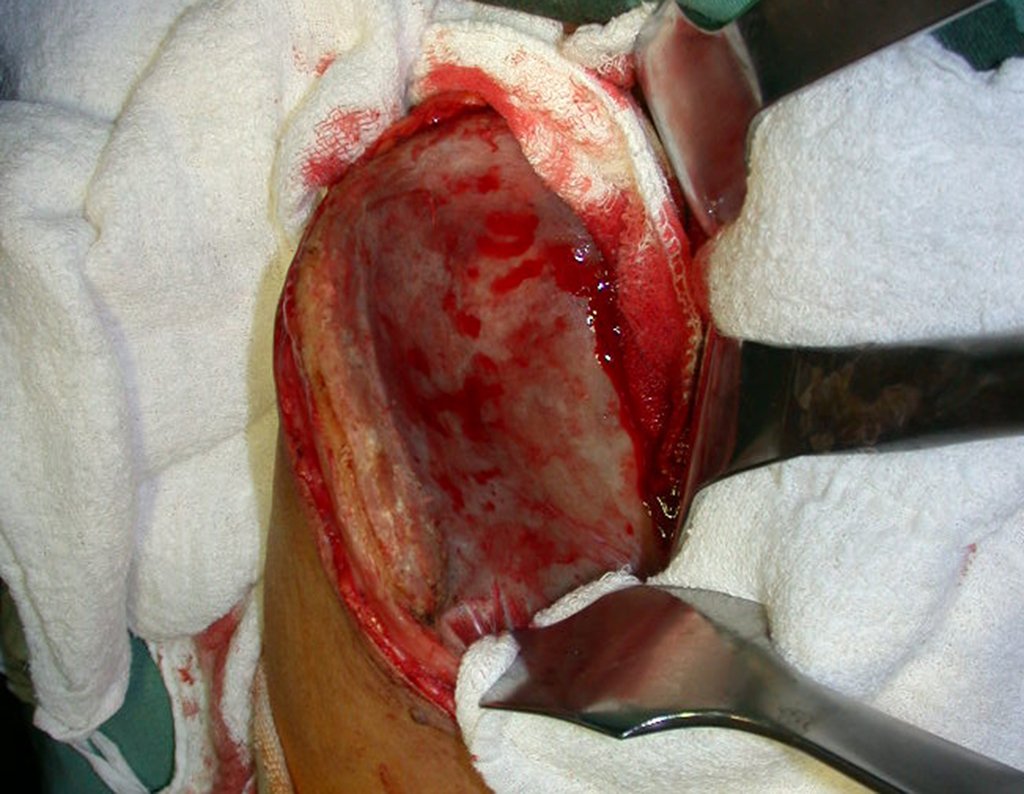
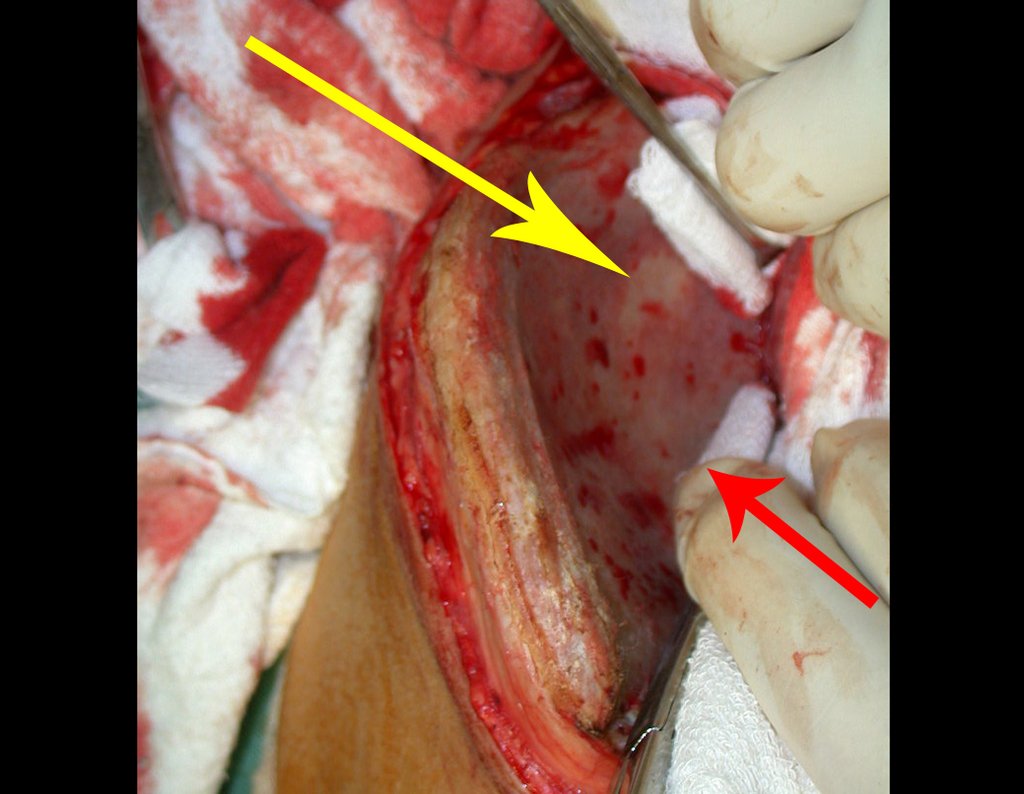
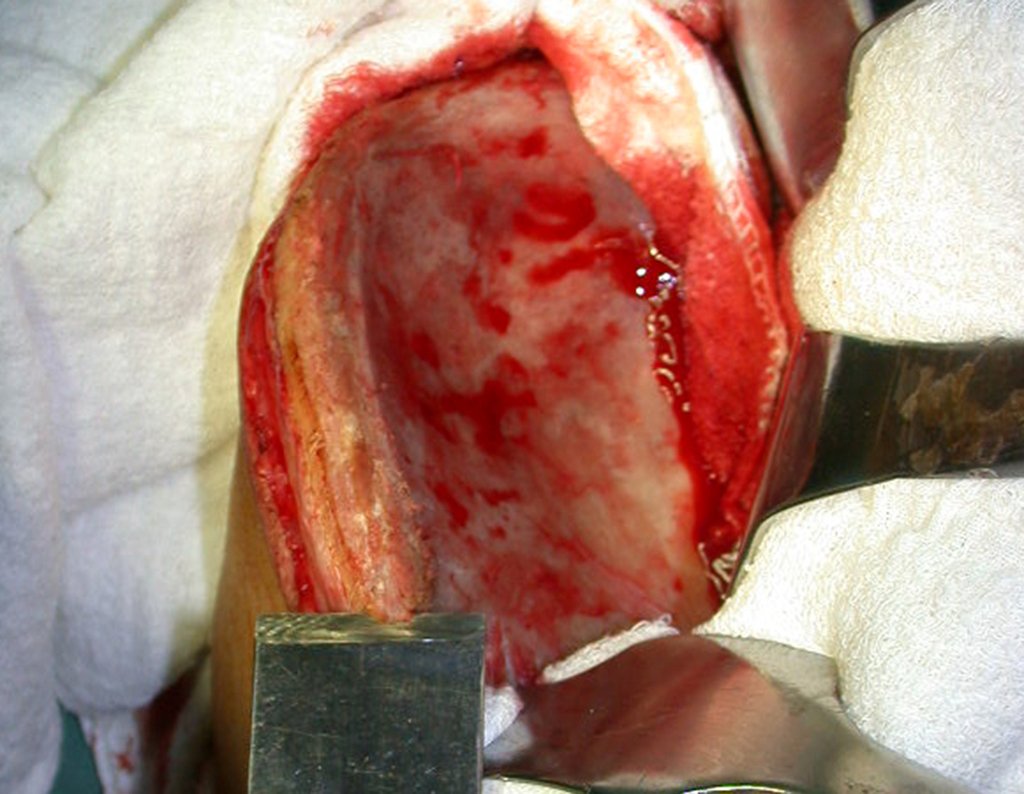
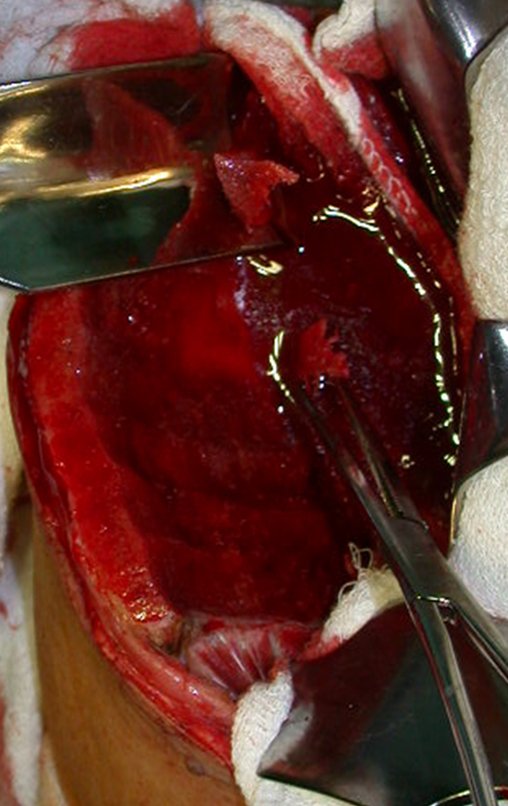
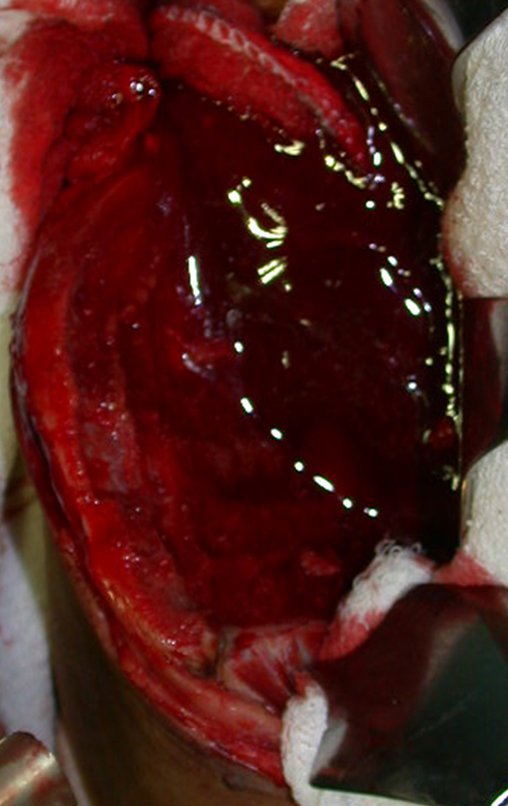
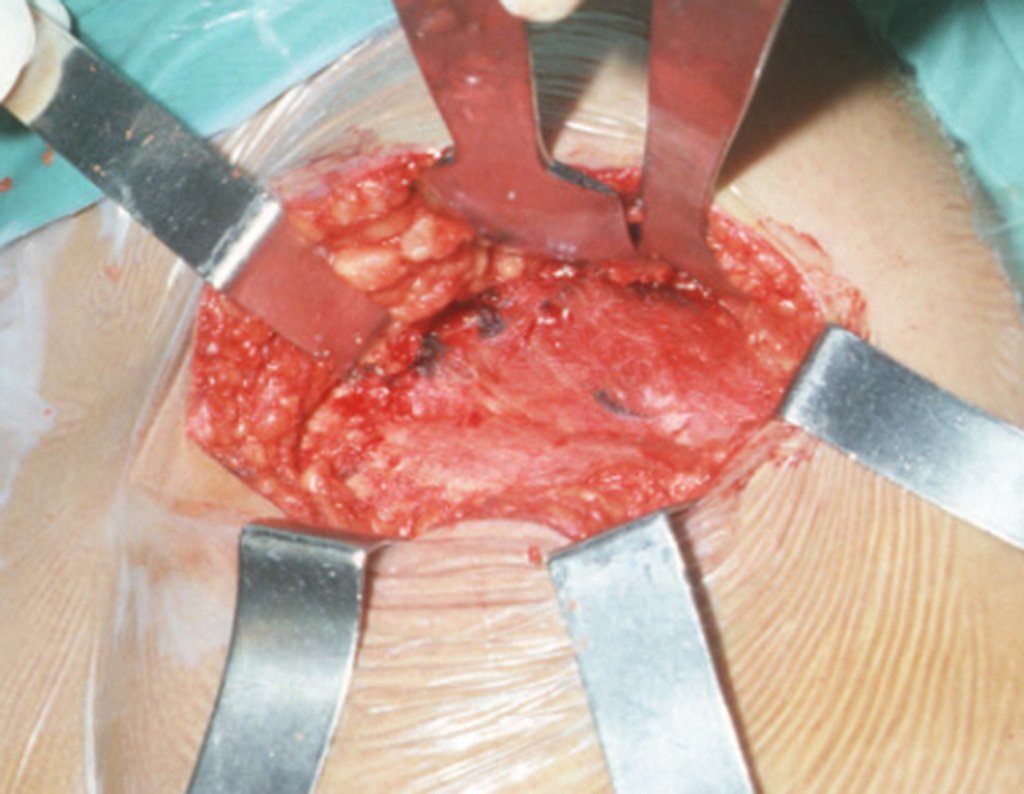
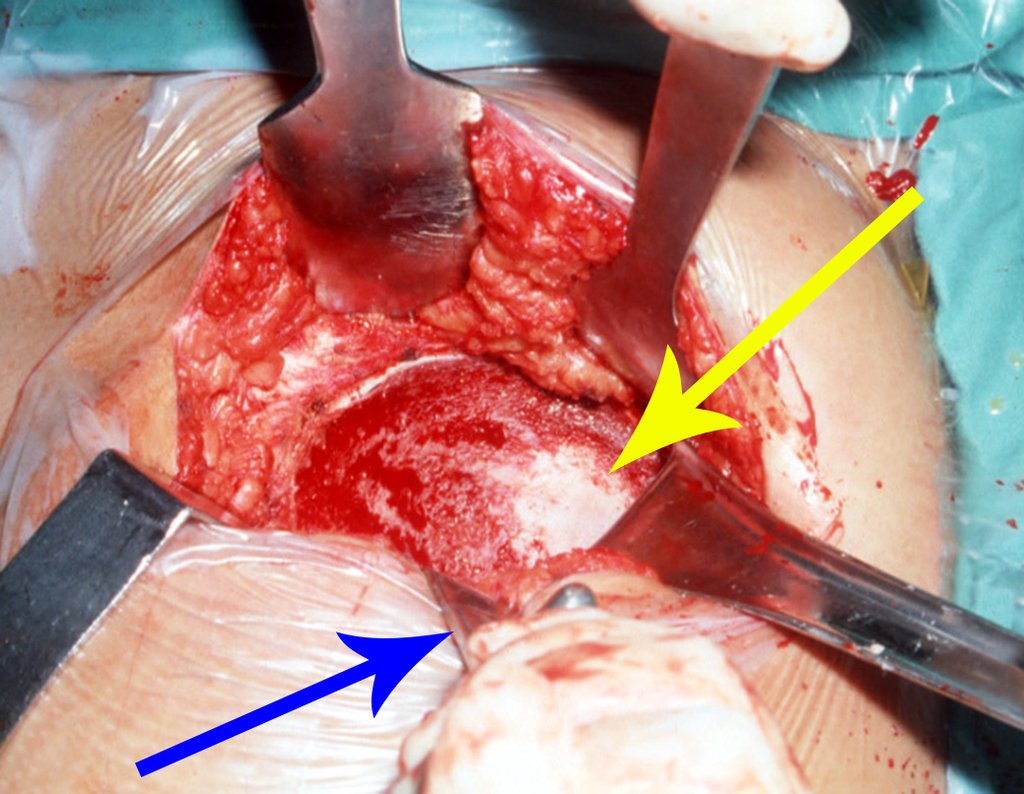
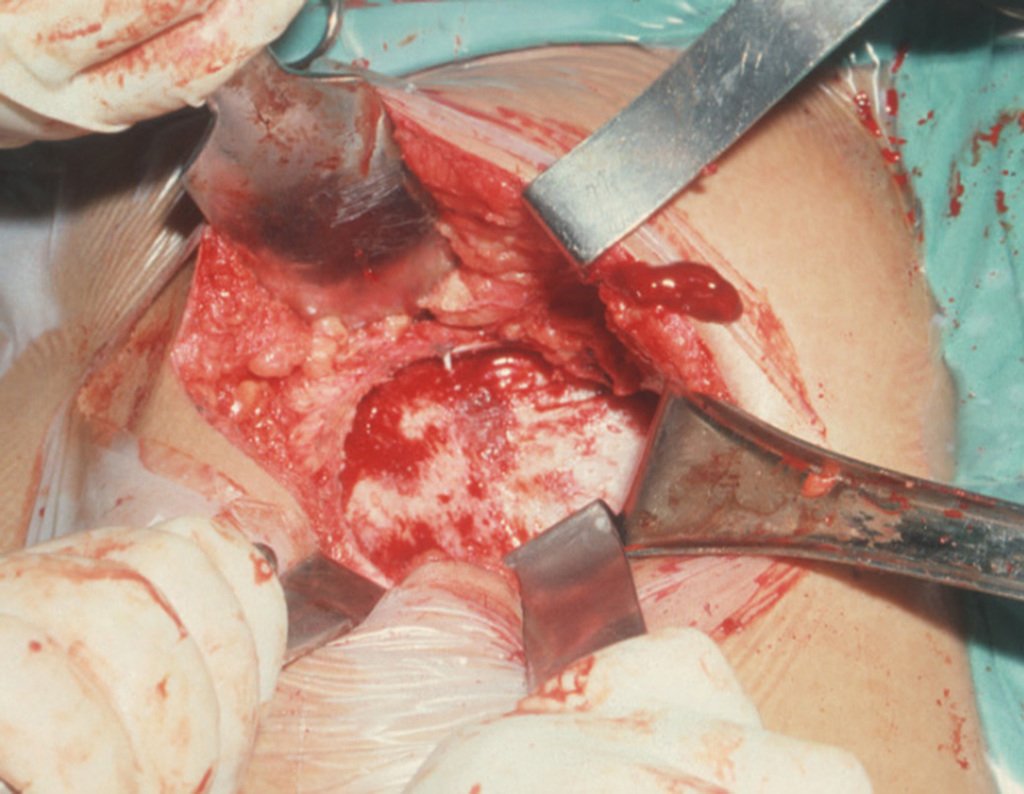
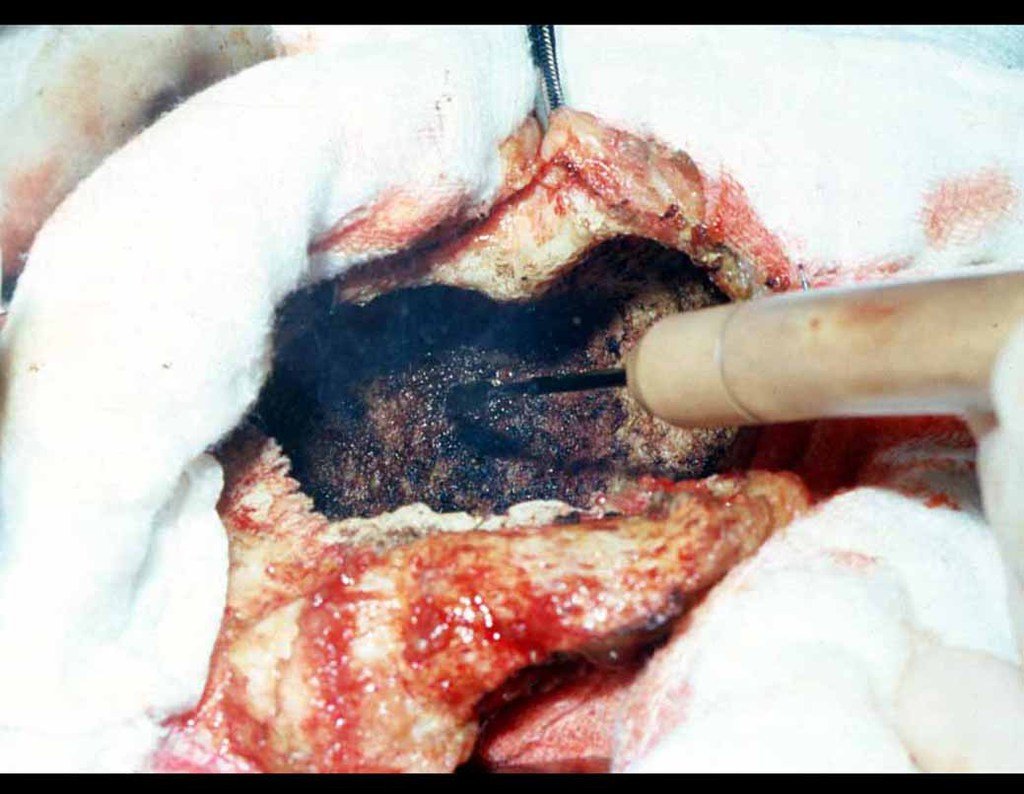
No passado, a curetagem apresentava altos índices de recidiva em virtude de não se fazer aberturas amplas para uma limpeza eficaz e pelo não uso de adjuvantes locais. Hoje, quando se indica a curetagem endocavitária, preconiza-se a execução de grande janela óssea para permitir ao cirurgião ampla visão da cavidade. Realizamos ainda uma complementação desta curetagem com o emprego do bisturi elétrico (eletrotermia).
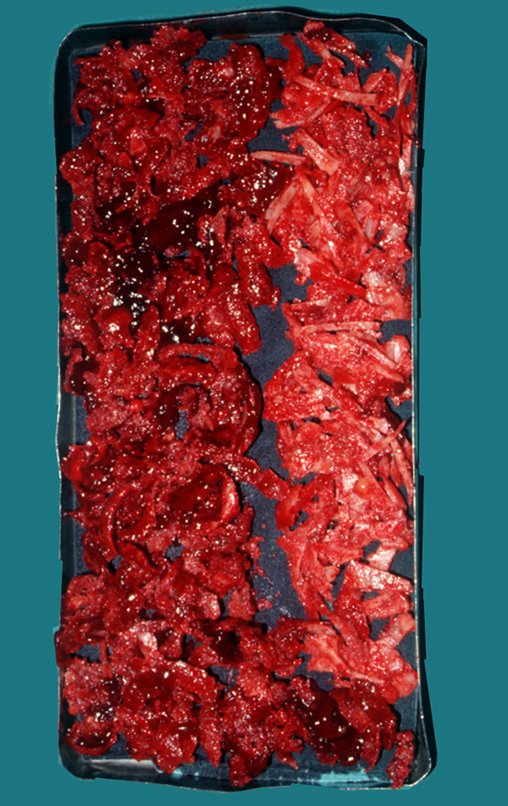
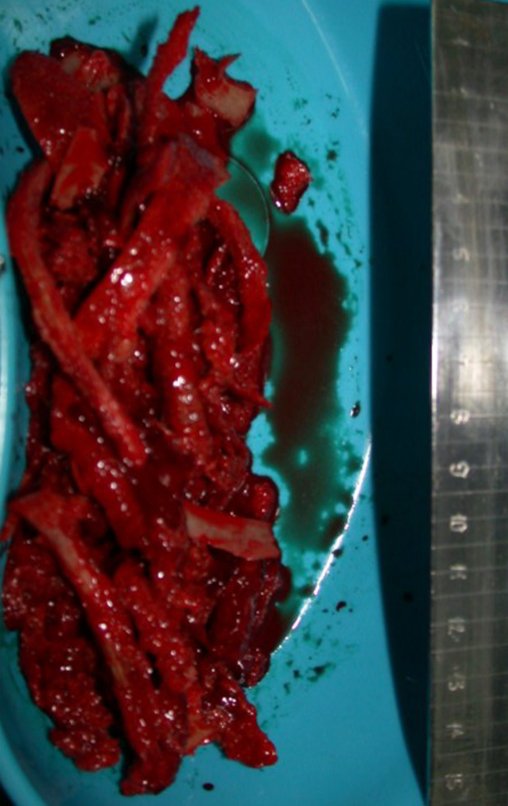
Esta técnica da eletrotermia é bastante eficaz pois com a ponta curvada do bisturi conseguimos atingir áreas de acesso mais difícil . Este bisturi, além da cauterização, realiza também uma complementação da curetagem, à medida que aquelas células tumorais, remanescentes nas pequenas “cáries” da parede óssea, são destruídas e vão desprendendo-se, permitindo sua mais fácil remoção.
Complementamos nossa curetagem, após o emprego da eletrotermia, com a fresagem da cavidade. Utilizamos para isto o lentodril, com fresa odontológica esférica.
Na região do joelho (extremidade distal do fêmur e proximal da tíbia), local de maior incidência do TGC, indicamos freqüentemente a curetagem endocavitária, seguida da eletrotermia e fresagem com lentodril. Isto porque a ressecção segmentar desta região implicaria em artrodese ou substituição por Endopróteses ou enxertos homólogos. A artrodese da articulação do joelho é a que ocasiona maior limitação para o paciente e deve ser evitada. As substituições em pacientes jovens podem traduzir-se em problemas num futuro próximo, e sua indicação deve ser criteriosa.
Desta forma, indicamos primeiramente a terapêutica mais conservadora: – curetagem seguida de adjuvância para está região, exceto em casos avançados, já com destruição importante da estrutura óssea, em que tanto a função quanto o controle local da doença venham a ser comprometidos.
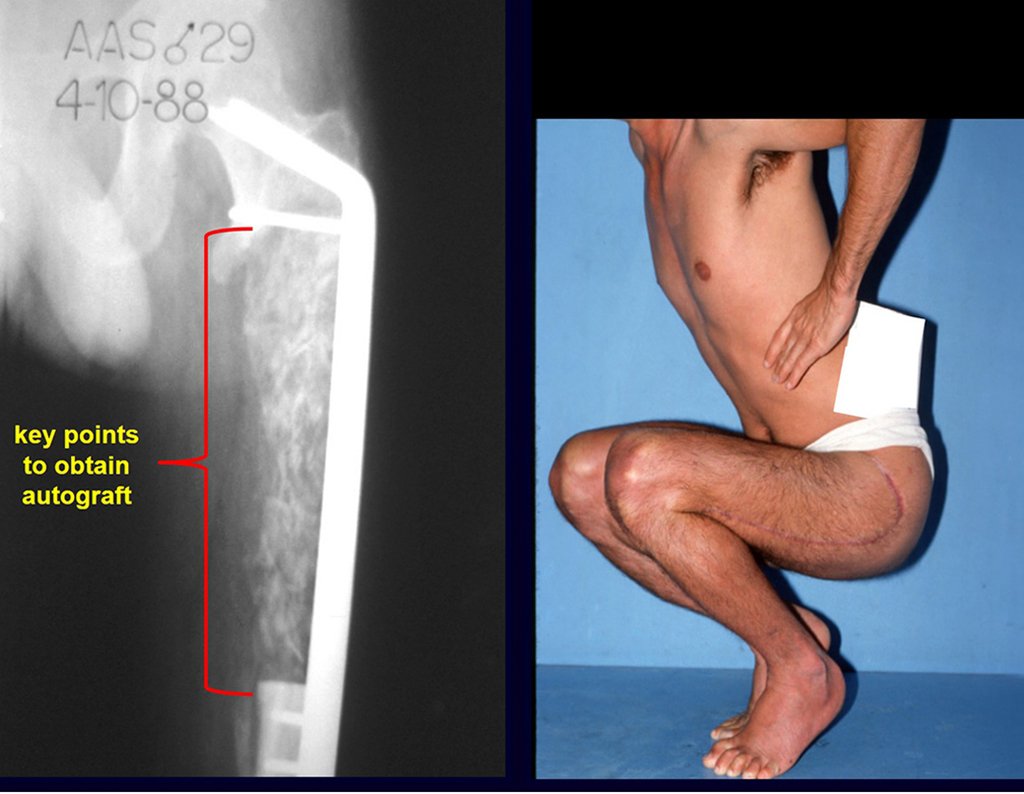
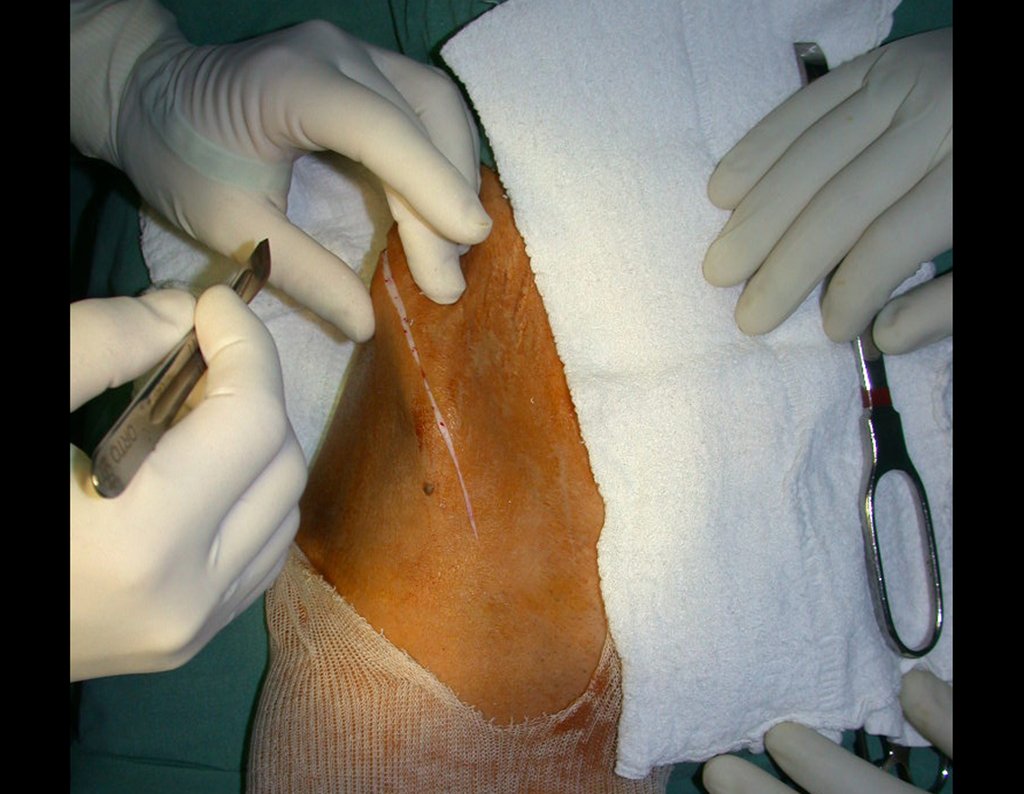
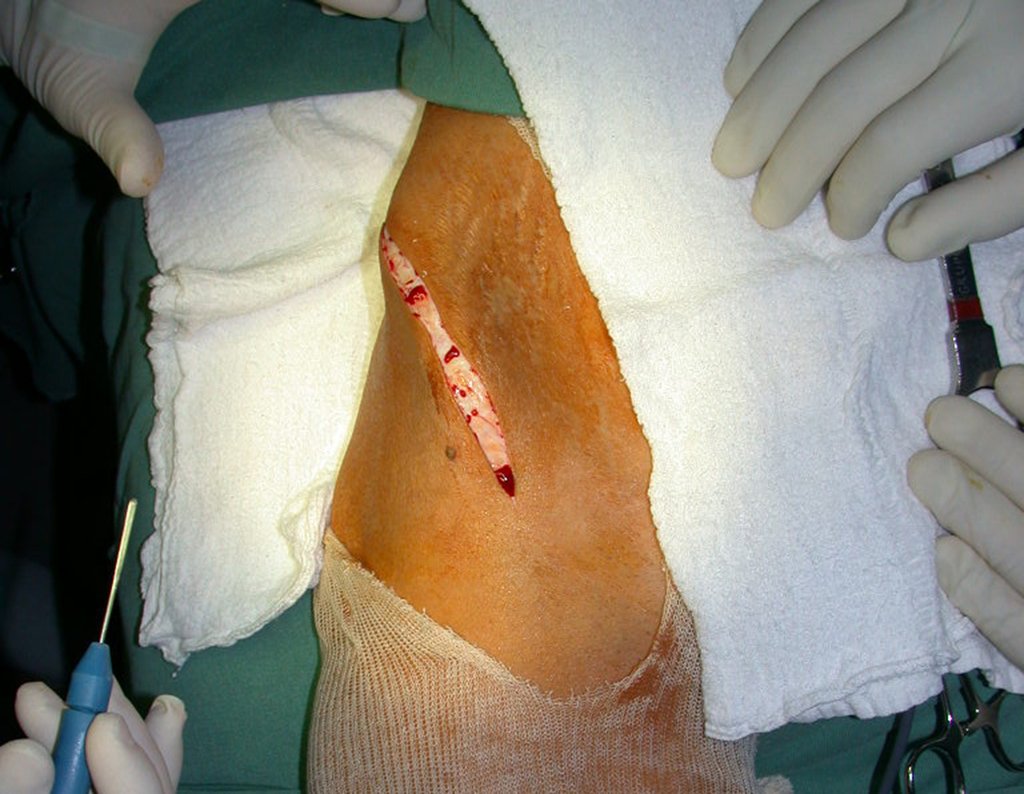
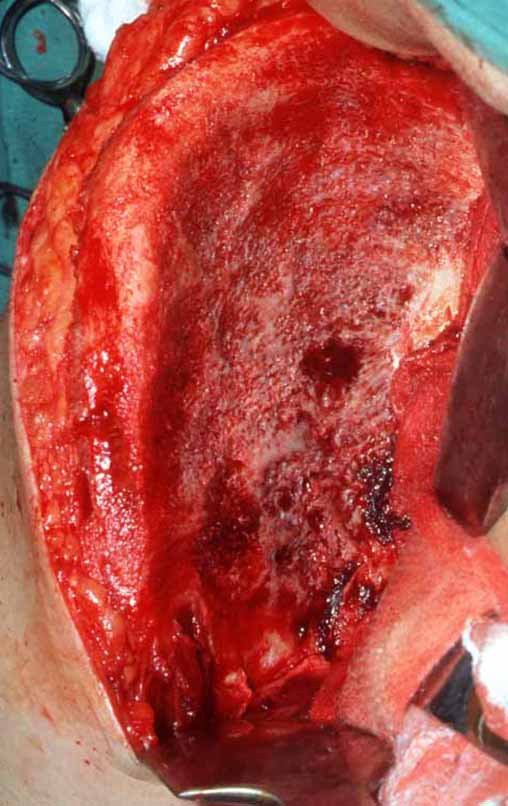
Resta ainda um breve comentário quanto ao preenchimento da cavidade tratada. Este pode ser feito com enxerto ósseo autólogo, heterólogo ou com metilmetacrilato, cada um deles com suas vantagem e desvantagens.
O metilmetacrilato permite visualizar eventuais recidivas com facilidade, é de fácil emprego e permite carga mais precocemente, entretanto não é solução biológica e podem ocorrer fraturas na região.
O enxerto ósseo é solução biológica e definitiva, entretanto dificulta a visualização de possível recidiva precoce, que pode confundir-se com reabsorção/integração do enxerto e ainda requer seis meses em média para carga total. O enxerto homólogo tem maior período de integração, nem sempre é disponível mas por outro lado encurta o tempo cirúrgico. O enxerto autólogo tem a vantagem da biocompatibilidade e da integração mais rápida porém prolonga o tempo cirúrgico.
Autor : Prof. Dr. Pedro Péricles Ribeiro Baptista
Oncocirurgia Ortopédica do Instituto do Câncer Dr. Arnaldo Vieira de Carvalho
Consultório: Rua General Jardim, 846 – Cj 41 – Cep: 01223-010 Higienópolis São Paulo – S.P.
Fone:+55 11 3231-4638 Cel:+55 11 99863-5577 Email: drpprb@gmail.com