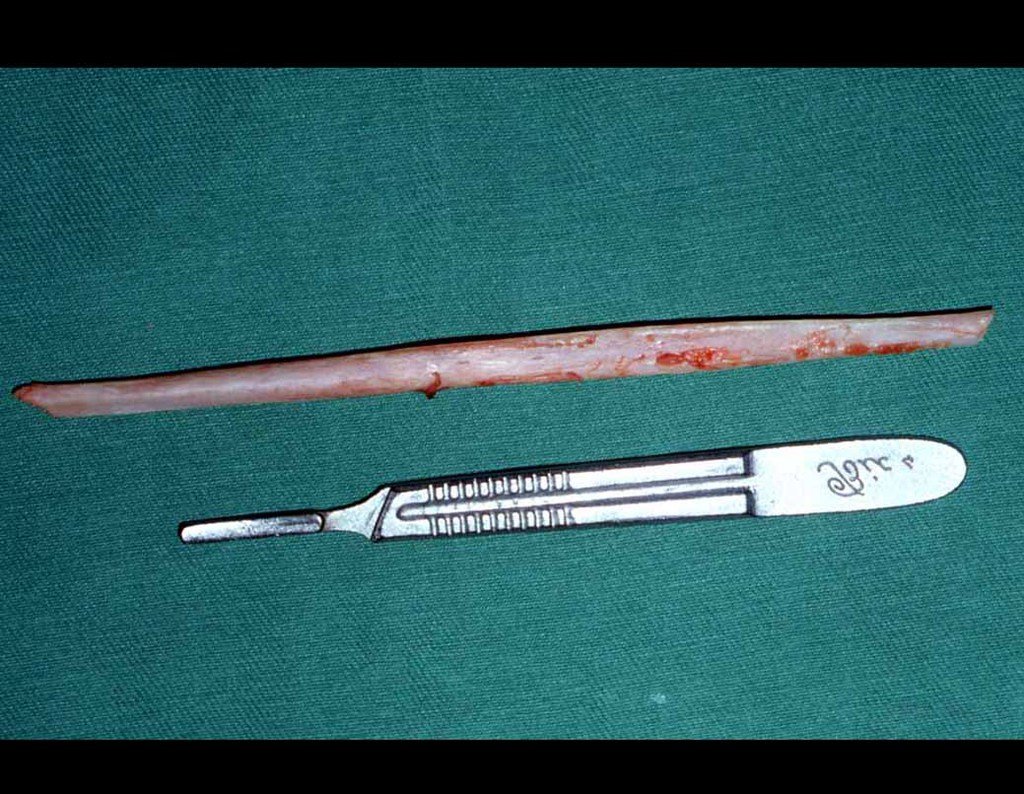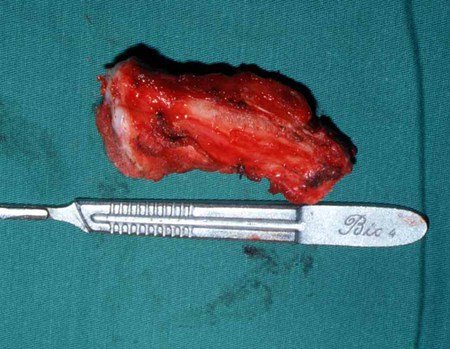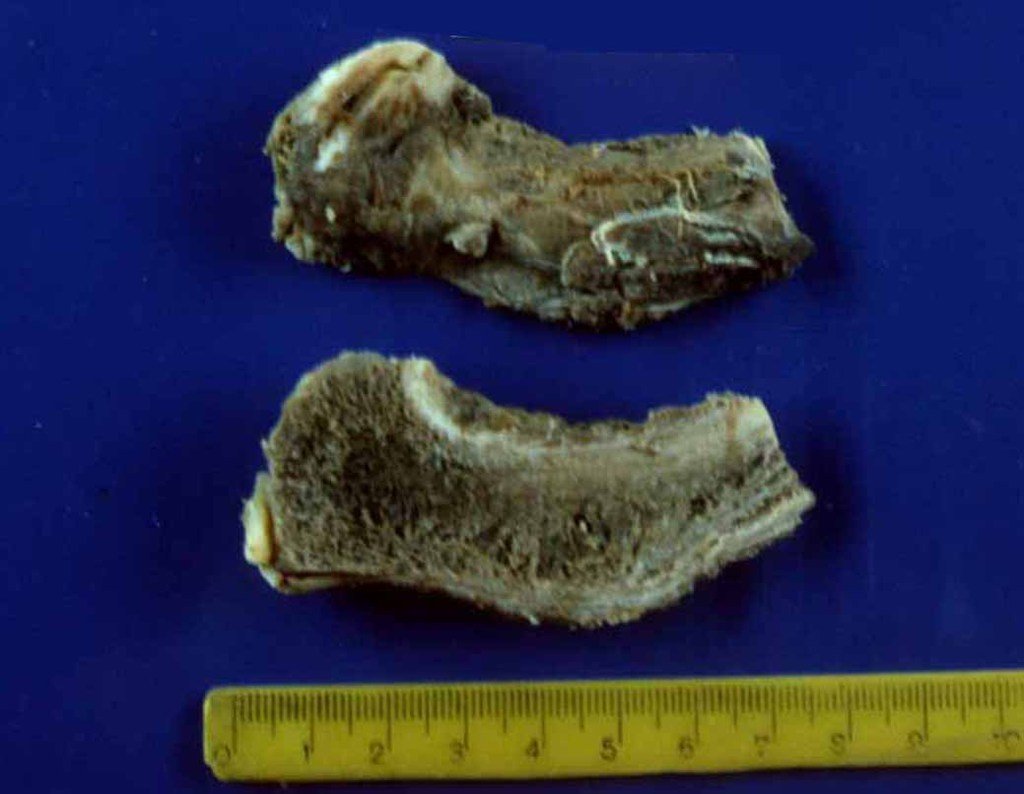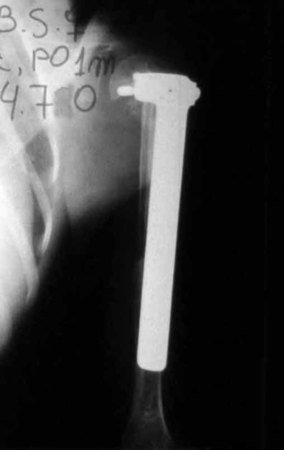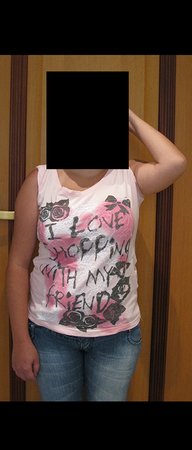
Sacrectomia total sem reconstrução - Parte 2
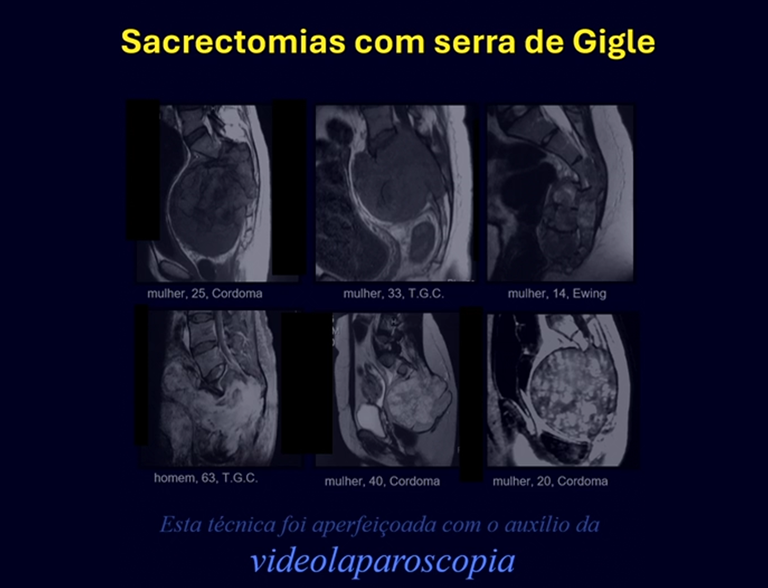
Na segunda parte da técnica de sacrectomia total utilizando serras Gigli, demonstraremos sua evolução, destacando o uso da laparoscopia. Discutiremos sua aplicação para guiar as serras Gigli da cavidade pélvica para a região dorsal do paciente.
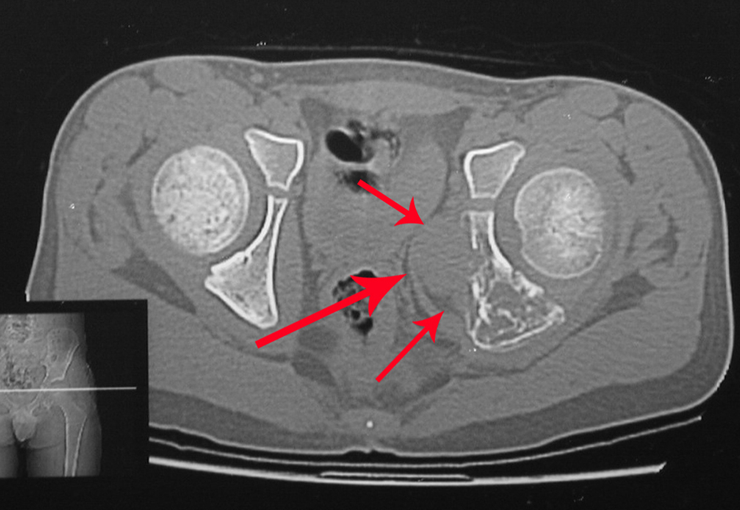
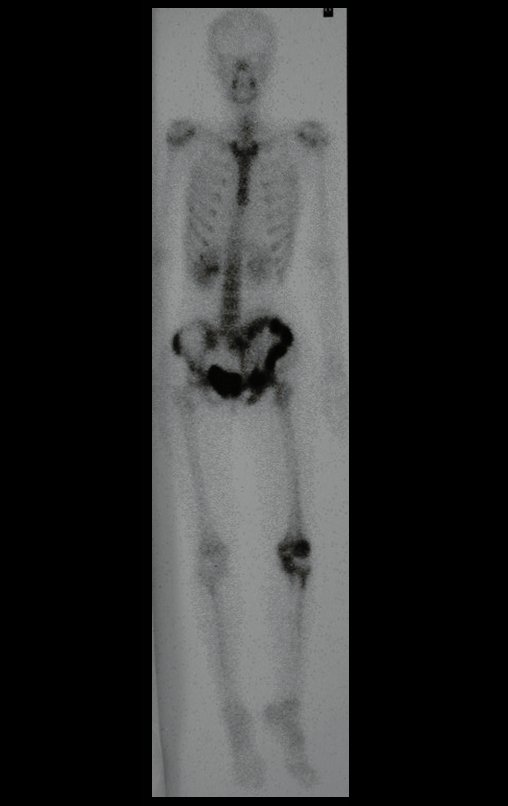
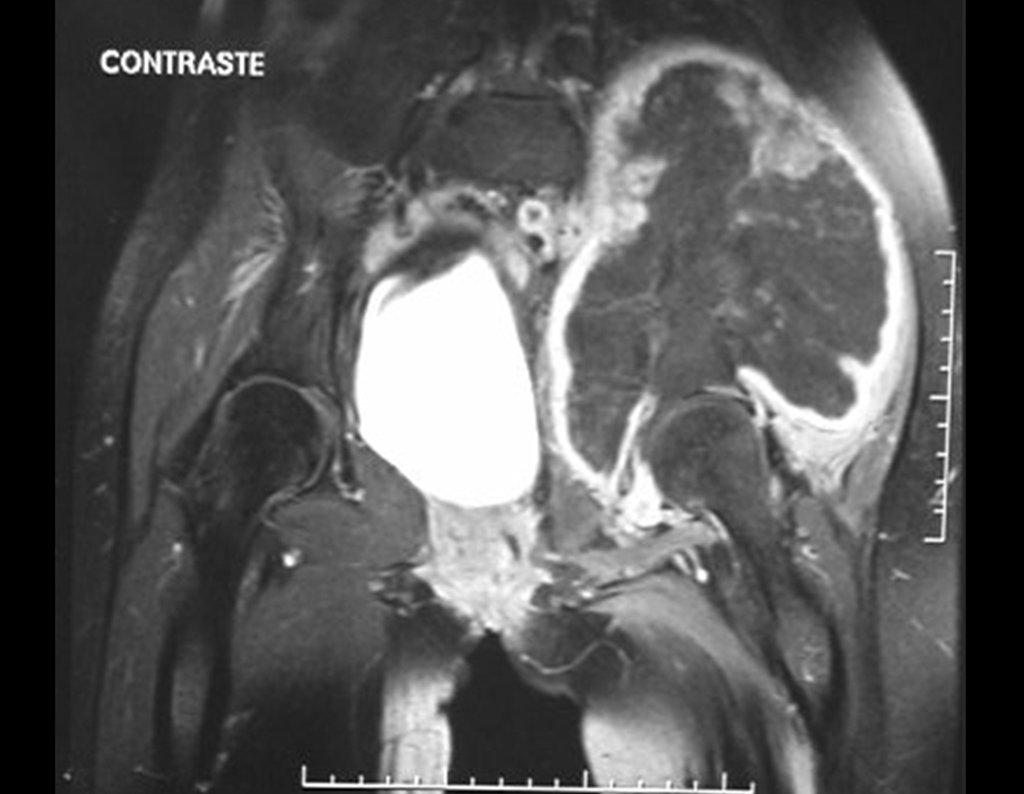
A primeira vez que utilizamos a laparoscopia foi em um caso envolvendo uma paciente com uma lesão osteolítica no forame sacral S-3.
Ela apresentava sintomas clínicos de dor e dormência na perna esquerda. A radiografia revelou um forame aumentado na vértebra sacral S-3. A tomografia computadorizada mostrou uma área bem definida, e a ressonância magnética exibiu uma lesão circunscrita, delimitada por uma pseudocápsula espessa. Na seção sagital, observamos a formação de um tumor sacral e sua continuidade com a raiz nervosa, sugerindo ser um schwannoma. Uma arteriografia foi realizada para um estudo mais aprofundado. A reconstrução por tomografia indicou que a lesão provavelmente era de crescimento lento, crônica e benigna.
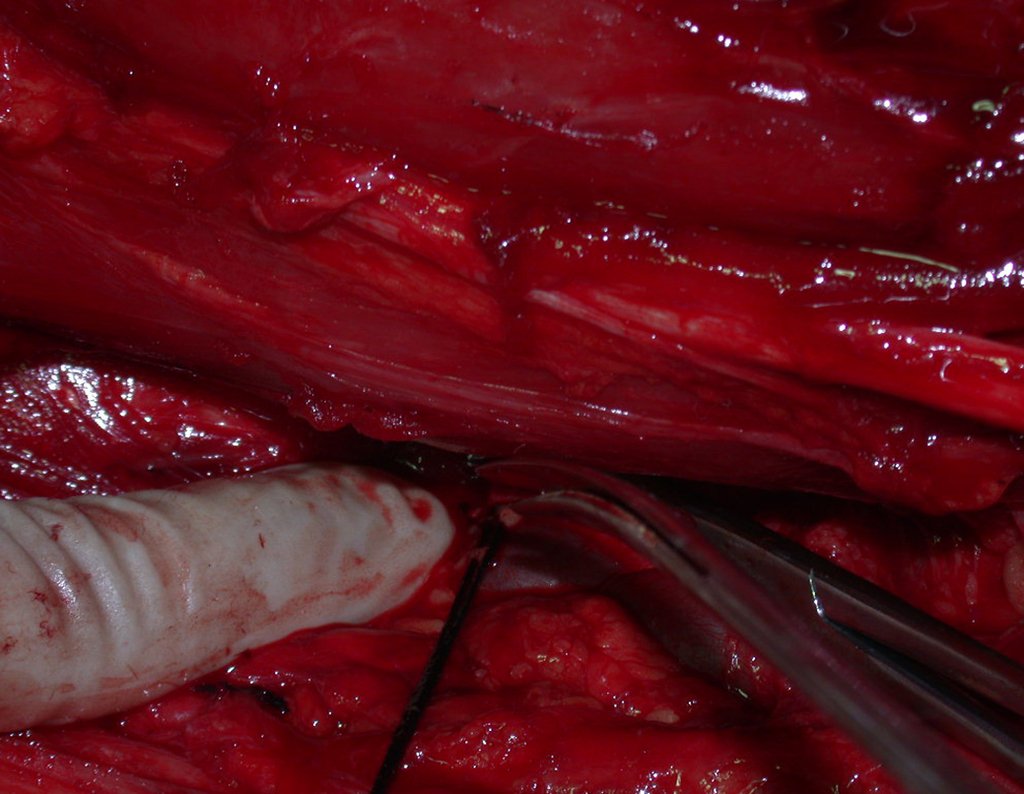
Um cirurgião realizou a laparoscopia, abrindo o retroperitônio e isolando os vasos ilíacos sob nossa orientação, para ligar e cortar a artéria e veia ilíacas internas esquerdas. Em seguida, o tumor foi exposto, e confirmamos sua continuidade com a raiz S-3, assemelhando-se a uma cauda de cavalo. Em seguida, ele colocou o tumor dentro de uma luva cirúrgica e aspirou o conteúdo, removendo tudo pelo tubo laparoscópico. A paciente conseguiu andar no segundo dia após a cirurgia.
Discutimos a possibilidade de realizar a dissecção de tumores sacrais passando as serras Gigli laparoscopicamente. Para adquirir a curva de aprendizado, começamos com um caso de sarcoma de Ewing afetando o sacro abaixo de S-3. Nesse caso, só precisávamos passar uma serra horizontalmente. O tumor foi ressecado com sucesso oncologicamente.
Um fio de Kirschner é colocado como guia, e posicionamos dois segmentos do tubo: o primeiro é mais curto e sairá pelas costas do paciente, enquanto o segundo empurrará o primeiro e será removido primeiro, conforme o diagrama. Repetimos essa operação para a passagem das outras serras. Dessa forma, temos as três serras posicionadas com segurança para realizar as osteotomias pela abordagem posterior. Atualmente, usamos a laparoscopia para realizar todos os procedimentos que anteriormente eram feitos pela abordagem anterior.
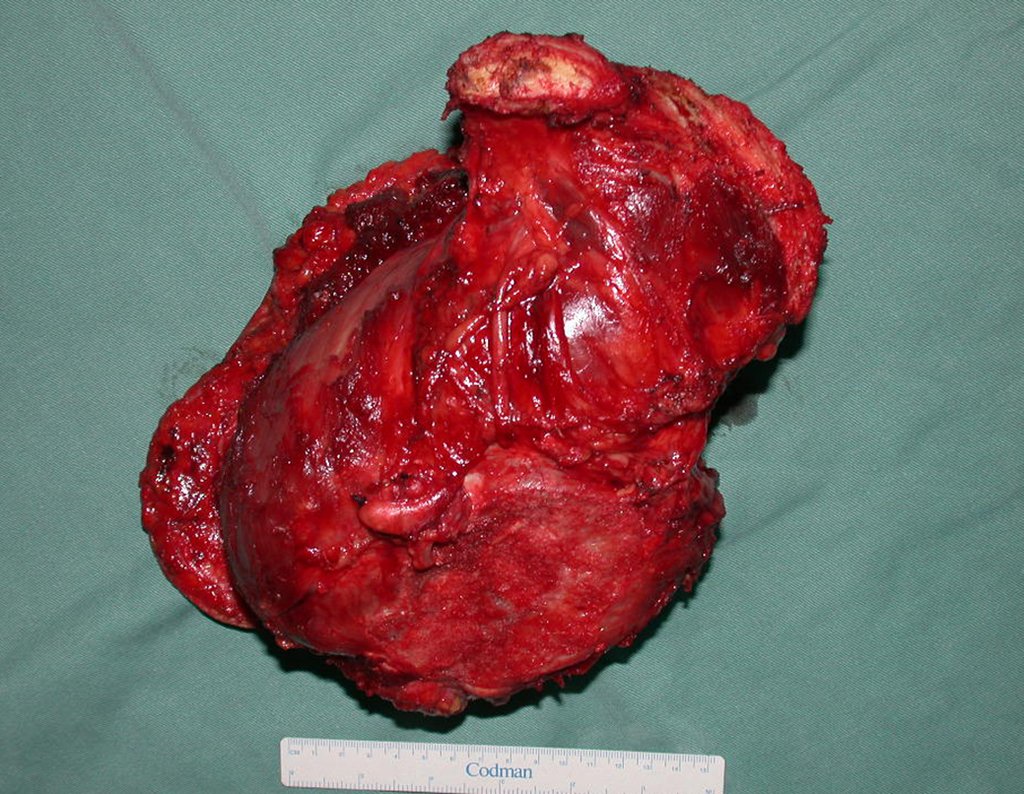
O caso de uma paciente com um cordoma de grande volume, envolvendo todo o sacro e com dificuldade para defecar e urinar, que estava acamada há oito meses em outro hospital, foi decisivo na aprovação dessa técnica. A paciente tinha úlceras de pressão e postura de flexão de quadril e joelho. Ela foi operada utilizando a técnica da serra Gigli, posicionada laparoscopicamente, e então realizamos a liberação e alongamento dos flexores do quadril e joelho, realinhando os membros inferiores. Este caso de cordoma, apesar de sua gravidade, foi operado com sucesso, e a sacrectomia total com assistência laparoscópica foi bem-sucedida. A paciente iniciou fisioterapia e reabilitação das funções excretoras da bexiga e intestino por meio de manobras abdominais. Ela pode andar com a ajuda de um andador e está reintegrada à vida diária, de forma independente, apesar dos déficits motores nos músculos dorsiflexores do tornozelo.
A sacrectomia com assistência laparoscópica é vantajosa, apresentando tempos de cirurgia mais curtos, redução da necessidade de transfusões de sangue e resultados funcionais satisfatórios. Atualmente, não vemos necessidade de realizar reconstruções.
Confira abaixo o vídeo da conferência.

Sacrectomia total sem reconstrução - Parte 1
Em alguns casos de tumores ósseos e de traumas graves, as falências de próteses ou osteossíntese podem representar um desafio significativo. É nesse cenário que a artrodese do joelho emerge como uma alternativa viável. Esta técnica pode ser realizada de diversas maneiras, sendo uma delas com uma prótese do tipo diafisária ou através de uma solução biológica empregando-se enxerto autólogo e osteossíntese.
Por exemplo, quando nos deparamos com a falência de uma prótese primária infectada ou em situações de tumores ósseos agressivos ou traumas, a artrodese pode se tornar uma alternativa à amputação.
Consideremos este caso de condrossarcoma recidivado, após duas tentativas cirúrgicas, sem sucesso, em que a necessidade de uma ressecção ampla se faz presente, e a reconstrução com uma artrodese, pode ser a única alternativa para evitarmos a amputação. Nesses casos, a artrodese empregando uma prótese diafisária pode oferecer a chance de preservação deste membro.
O sucesso exige uma ressecção cuidadosa, com a remoção dos tecidos comprometidos, preservando os vasos poplíteos e nervos da região. Em seguida, é realizada a reconstrução com uma prótese modular do tipo diafisária, neste caso foi especialmente moldada, com a confecção de um segmento de polietileno, visando dar um formato mais estético para a região do “neo joelho”, minimizando o defeito deixado pela extensa ressecção do segmento afetado pelo tumor e atendendo ao objetivo de garantir uma ressecção ampla, com margens oncológicas seguras.
Neste outro exemplo de um tumor de células gigantes, que destruiu todo o planalto tibial e o 1/3 proximal da tíbia, a abordagem pode ser biológica. Nesse paciente, aproveitamos o osso autólogo do próprio local, no caso dos côndilos femorais, para preencher a falha óssea deixada pela ressecção da neoplasia.
É importante ressaltar que a técnica exige precisão e cuidado, tanto na ressecção quanto na reconstrução. A placa utilizada na fixação deve ser posicionada de forma a garantir um alinhamento adequado e evitar rotações indesejadas. A integração da artrodese com o enxerto autólogo biológico é fundamental para o sucesso do procedimento.
Em casos de traumatismos graves, com grande destruição óssea devido a traumas de alta energia, a artrodese pode ser a única opção viável para restaurar a estabilidade do membro e evitar a amputação. Esses casos, que estamos mostrando, foram apresentados no Congresso Internacional de Trauma no Joelho, em Ribeirão Preto – SP, mostrando a nossa experiência com estas duas técnicas de artrodese, empregando próteses diafisária ou osteossíntese com reconstrução biológica. Para mais informações sobre essas técnicas e apreciação de outros casos clínicos semelhantes, visite o site www.oncocirurgia.com.br,
Através do compartilhamento de conhecimento e experiências, poderemos avançar no desenvolvimento para o tratamento de condições ortopédicas complexas.
Confira abaixo o vídeo da conferência.
Sarcoma de Ewing
Diagnóstico e Tratamento
Sarcoma de Ewing Diagnóstico e Tratamento. O sarcoma de Ewing é um tumor maligno composto por células indiferenciadas, pequenas e redondas, que representa um desafio clínico significativo devido à sua natureza agressiva e rápida disseminação. Este tipo de neoplasia tem uma incidência máxima na primeira e segunda décadas de vida, sendo menos comum após a terceira década, e exibindo uma proporção de 2:1 entre os sexos masculino e feminino.
Embora a origem exata das células do sarcoma de Ewing tenha sido objeto de controvérsia, estudos recentes sugerem uma origem neuro ectodérmica. Esses tumores frequentemente surgem na região meta diafisária dos ossos tubulares longos e na pelve, e sua característica macroscópica inclui uma lesão óssea de cor cinza-esbranquiçada e consistência mole. Uma característica distintiva é a formação de reação lamelar fina, resultando em uma aparência radiográfica de “casca de cebola” e com uma quantidade grande de lesão extra cortical.
No exame histológico, o sarcoma de Ewing apresenta células uniformemente distribuídas, pequenas e redondas, semelhantes a linfócitos, mas de tamanho maior. A técnica de impregnação argêntica revela escassez de fibras de reticulina, comumente encontradas apenas ao redor de vasos sanguíneos e no linfoma. Manifestações clínicas incluem dor, tumefação, hipersensibilidade local e aumento na velocidade de hemossedimentação, podendo inicialmente se assemelhar a quadros de osteomielite.
O diagnóstico diferencial envolve distinção com osteossarcoma, granuloma eosinófilo, rabdomiossarcoma e osteomielite. O tratamento atualmente adotado consiste em poliquimioterapia pré-operatória seguida de cirurgia para ressecção da lesão, complementada por poliquimioterapia pós-operatória. A reconstrução do segmento pode ser realizada após a ressecção, utilizando-se endoprótese ou soluções biológicas com enxertos ósseos autólogo. Nas crianças pode-se empregar técnicas de autotransplante da placa de crescimento, transladando a placa da fíbula para a tíbia ou para outras localizações como o ombro e o punho, nestes casos com o auxílio da microcirurgia.
A avaliação da resposta à quimioterapia pré-operatória é fundamental, tendo valor prognóstico e orientando o tratamento subsequente. Esta avaliação é classificada em graus, dependendo do percentual de necrose tumoral observada. Com os avanços no tratamento quimioterápico, os pacientes têm alcançado excelentes respostas e perspectivas de “cura”, o que tem impulsionado o uso de soluções biológicas no tratamento cirúrgico, visando evitar complicações associadas às endopróteses ou enxertos de banco, cuja durabilidade pode ser limitada.
Portanto, a compreensão abrangente do sarcoma de Ewing, desde o diagnóstico até as opções terapêuticas, é essencial para fornecer o melhor cuidado possível aos pacientes afetados por essa neoplasia maligna desafiadora.
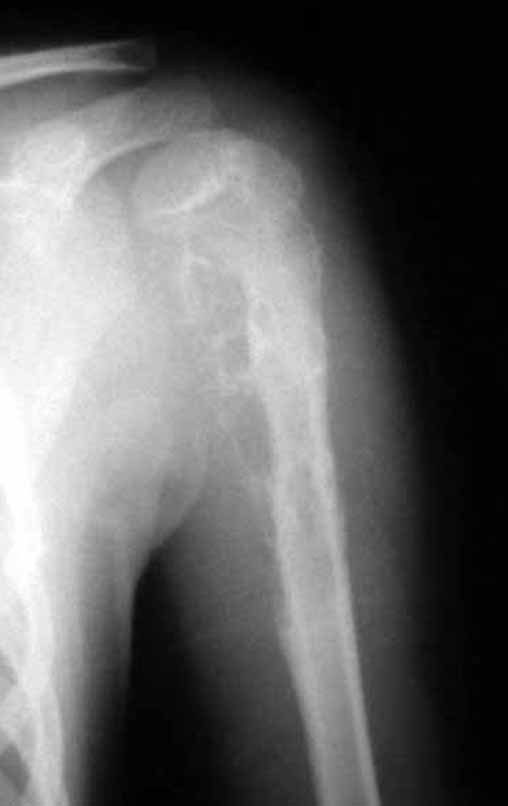
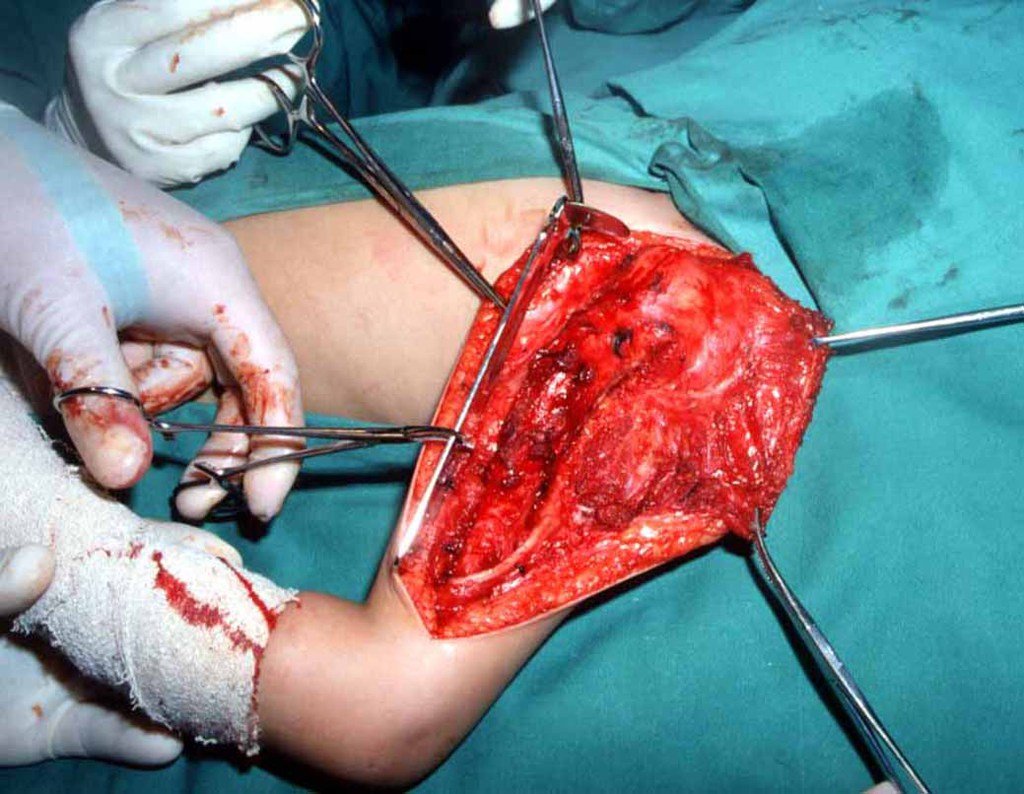
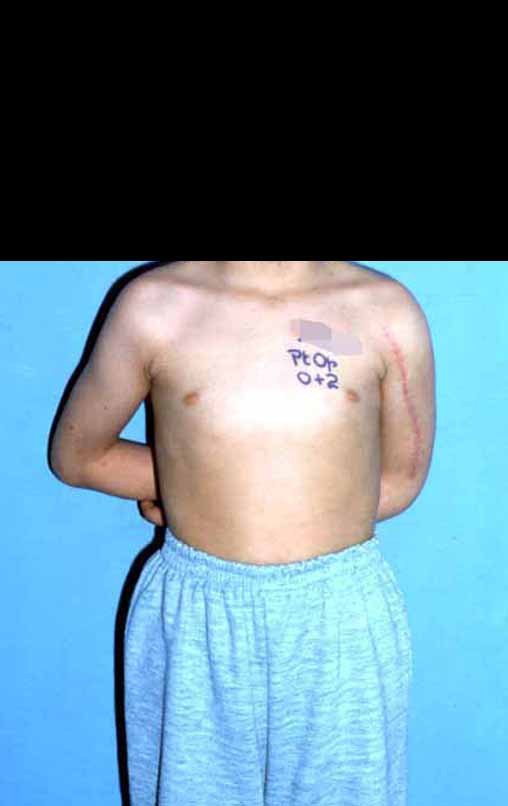
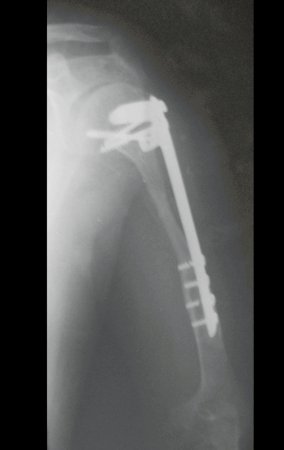
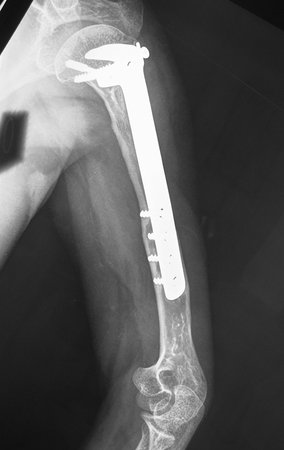
Sarcoma de Ewing do Úmero em Criança. Paciente com quatro anos e cinco meses de idade, apresentou dor e tumor no úmero esquerdo, em janeiro de 1991. A biópsia revelou tratar-se de Sarcoma de Ewing. O estadiamento não revelou outro foco. Submeteu-se a tratamento com quimioterapia neoadjuvante, apresentando boa resposta radiográfica ao tratamento, ocorrendo mineralização da lesão e deformidade angular pela plasticidade neoplásica, figuras 1 a 4.
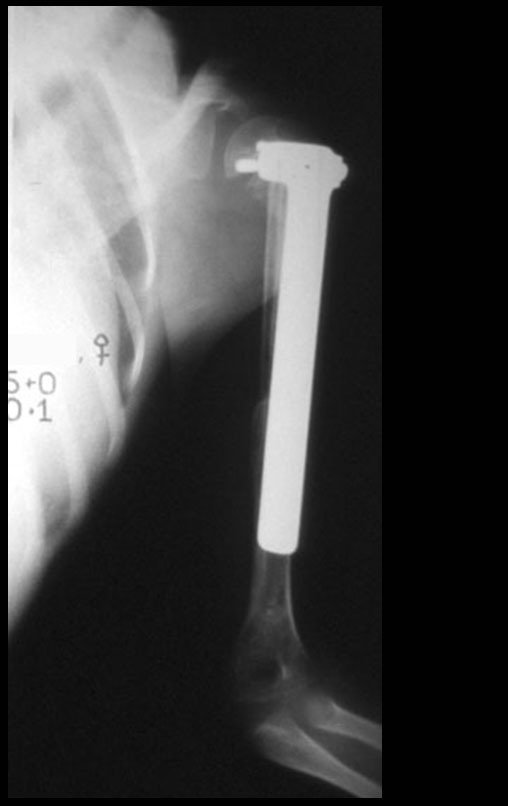
10. Sarcoma de Ewing do úmero em criança – Conduta – Técnicas de ressecção e de reconstrução com placa especial – Enxerto autólogo combinado de fíbula e ilíaco
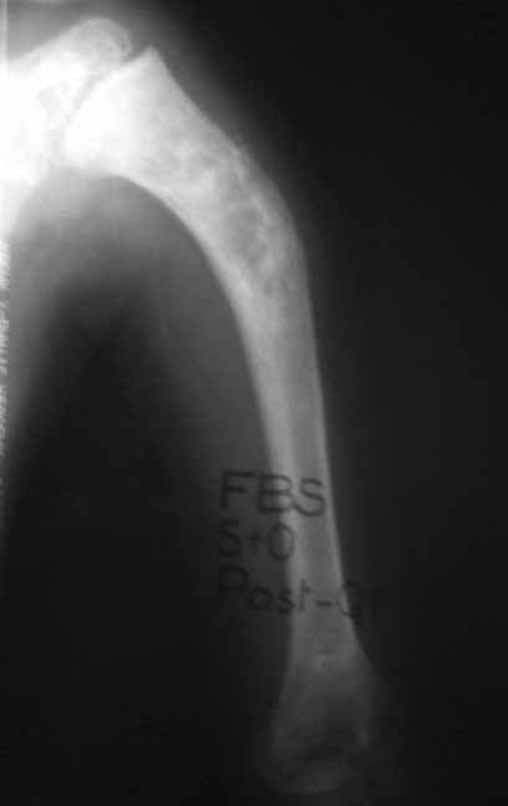
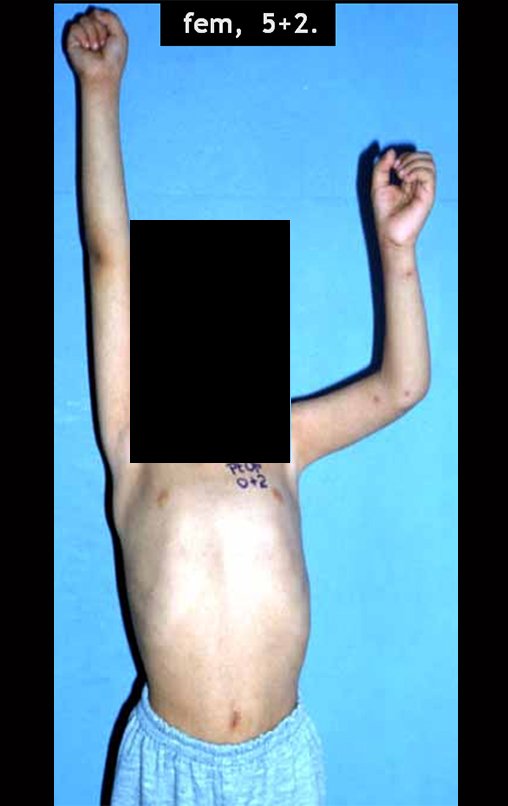
A radiografia de controle com um mês de pós-operatório e a função do membro operado são mostradas nas figuras 11 a 14.
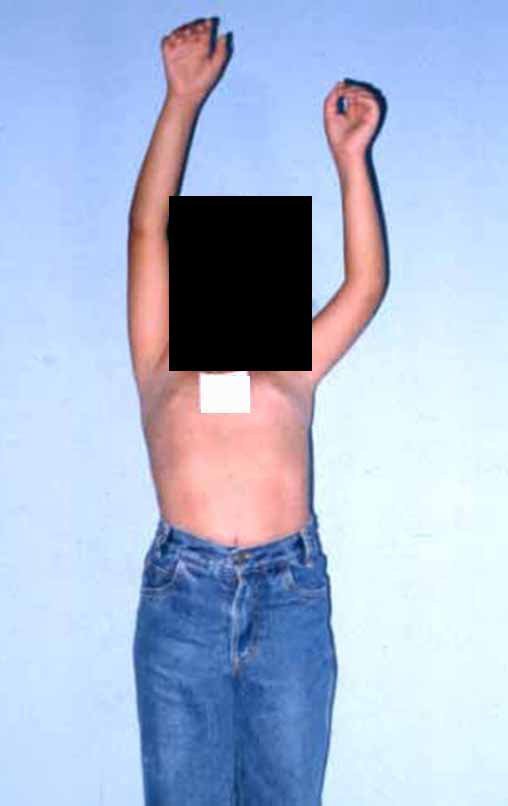
Vídeo 1: Boa estética, apesar do encurtamento, boa função, após 22 anos da cirurgia, em 11/01/2012.
As figuras 37 a 42, ilustram etapas da evolução deste caso de Sarcoma de Ewing, tratado cirurgicamente com uma solução biológica.
Em maio de 2015, a paciente teve o seu primeiro filho, dando luz à um menino. Em 1991 ainda não realizavamos o autotransplante de cartilagem de crescimento, reconstruindo este segmento com fíbula vascularizada com a placa de crescimento, para substituir a placa do úmero que quando esta é ressecada. Entretanto, o membro superior aceita melhor a discrepância de comprimento, coroando a alternativa que empregamos na época.
Autor: Prof. Dr. Pedro Péricles Ribeiro Baptista
Oncocirurgia Ortopédica do Instituto do Câncer Dr. Arnaldo Vieira de Carvalho
Consultório: Rua General Jardim, 846 – Cj 41 – Cep: 01223-010 Higienópolis São Paulo – S.P.
Fone:+55 11 3231-4638 Cel.:+55 11 99863-5577 Email: drpprb@gmail.com
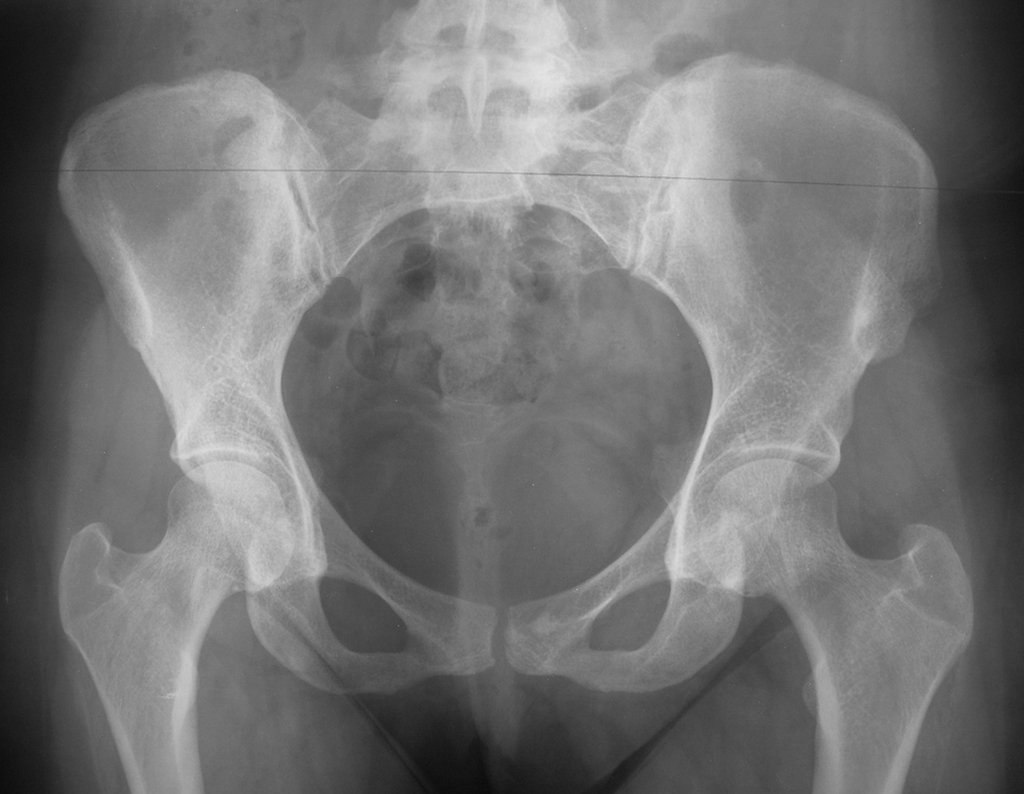
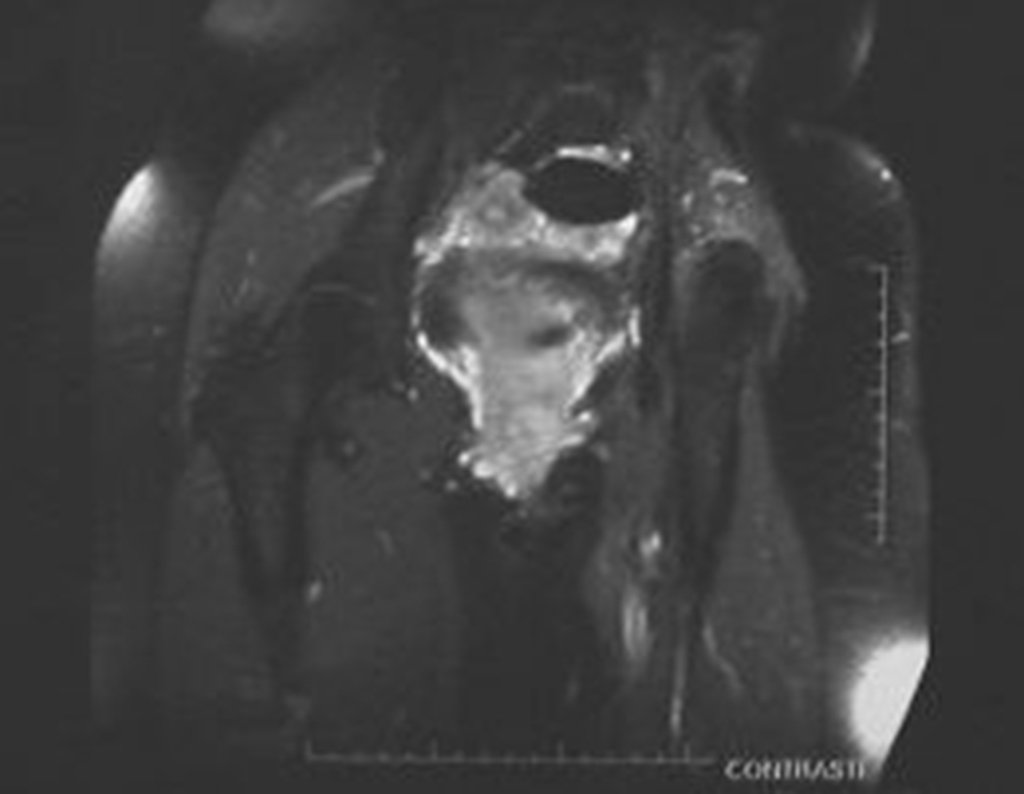
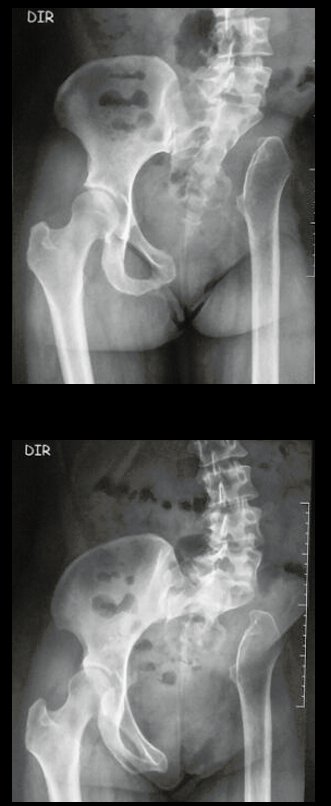
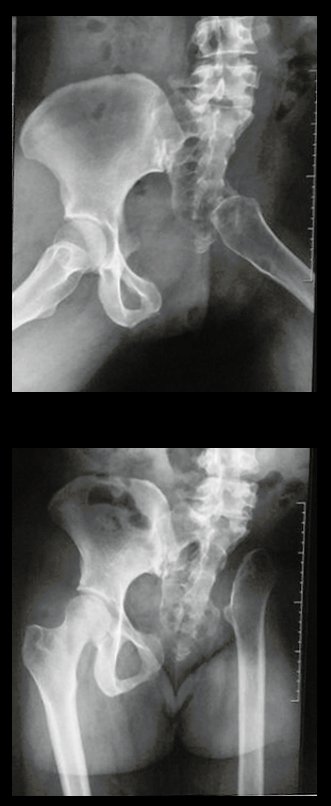
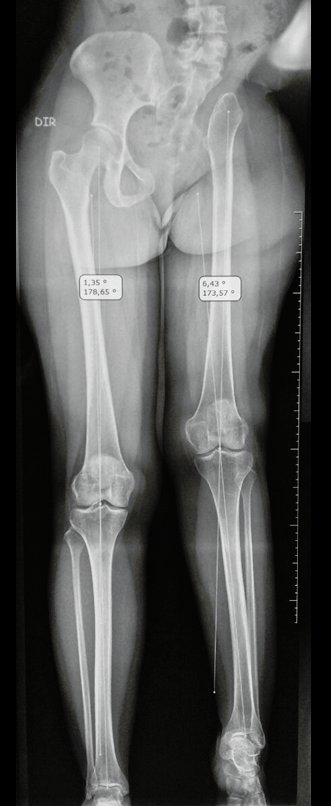
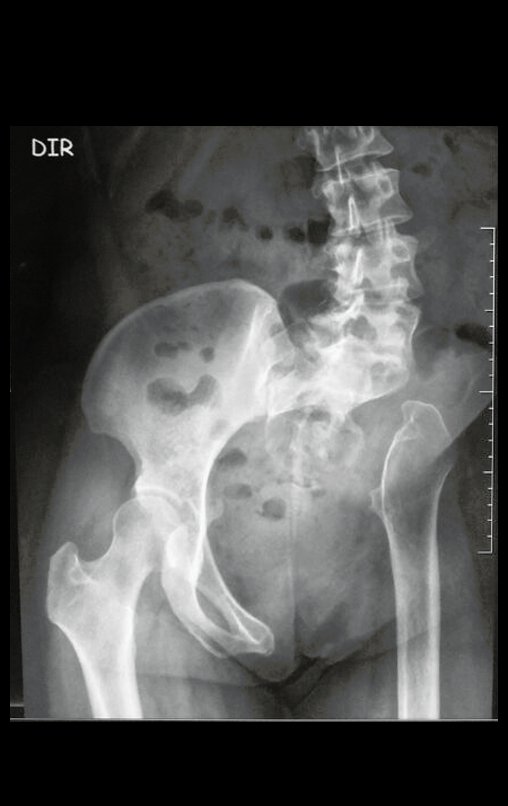
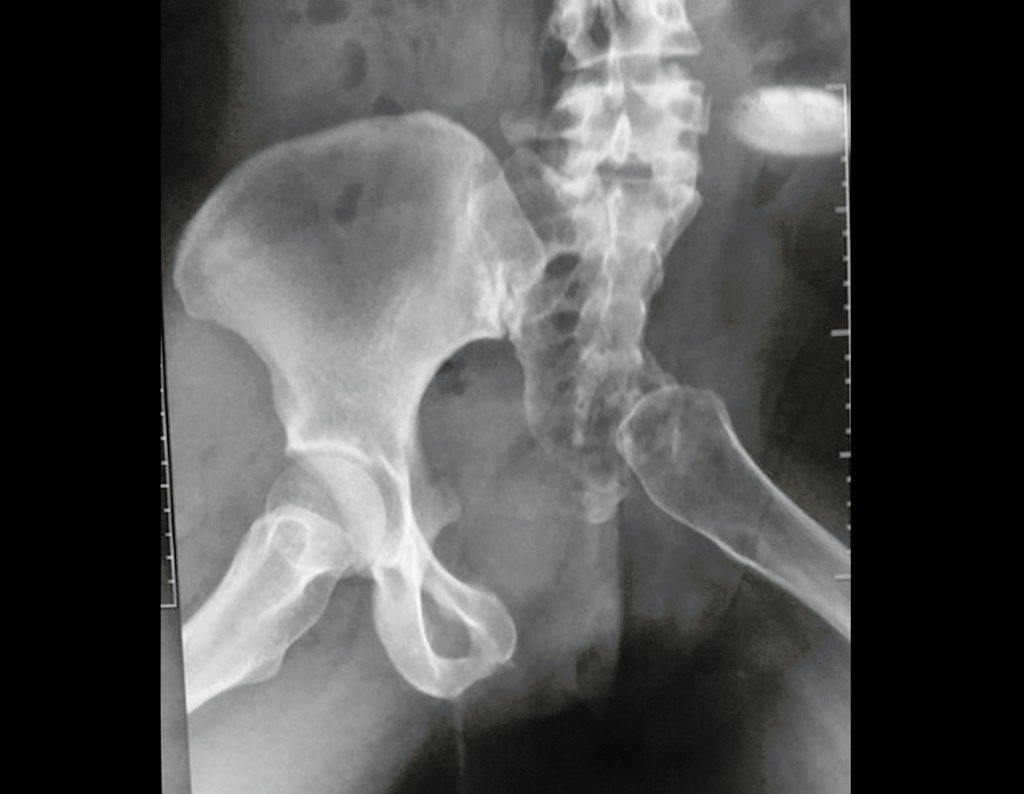
Condrossarcoma da Pelve – Pelvectomia interna total. Paciente feminina, com 19 anos de idade, queixando-se de desconforto e aumento de volume da pelve esquerda. Clinicamente apresentando discreta dor à palpação da asa do ilíaco, com tumor palpável, de consistência dura e aderido. Atendida em 18 de dezembro de 2002, com os exames de imagem a seguir: 13/11/1983 18/12/2002.
03. Condrossarcoma da Pelve – Conduta – Técnica de pelvectomia interna total
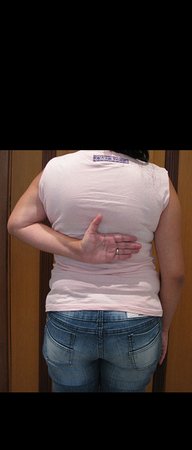
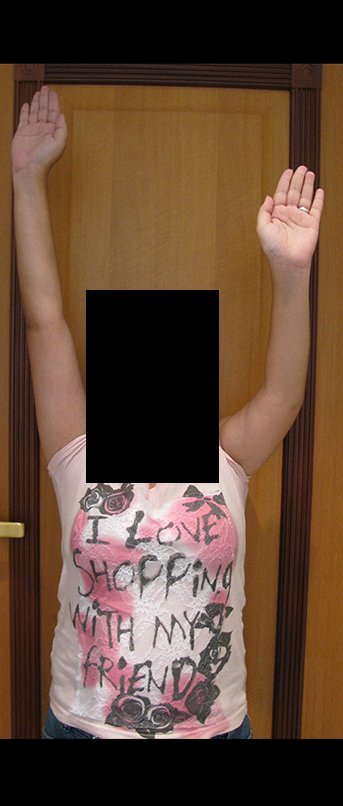
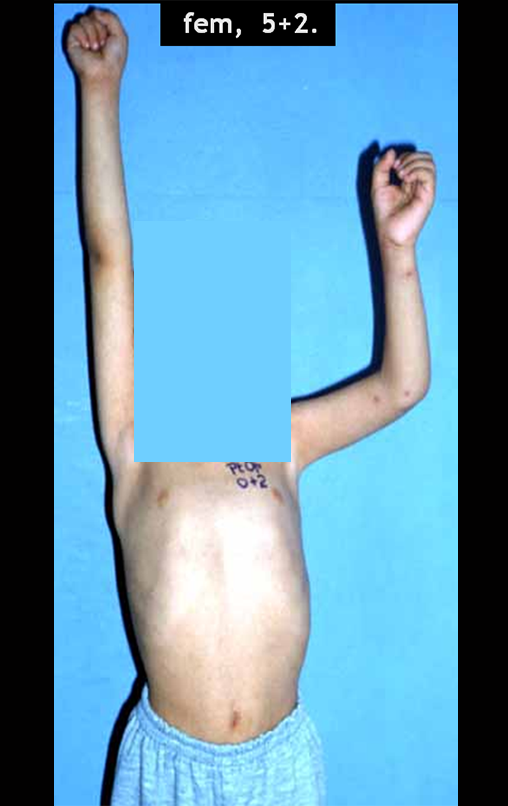
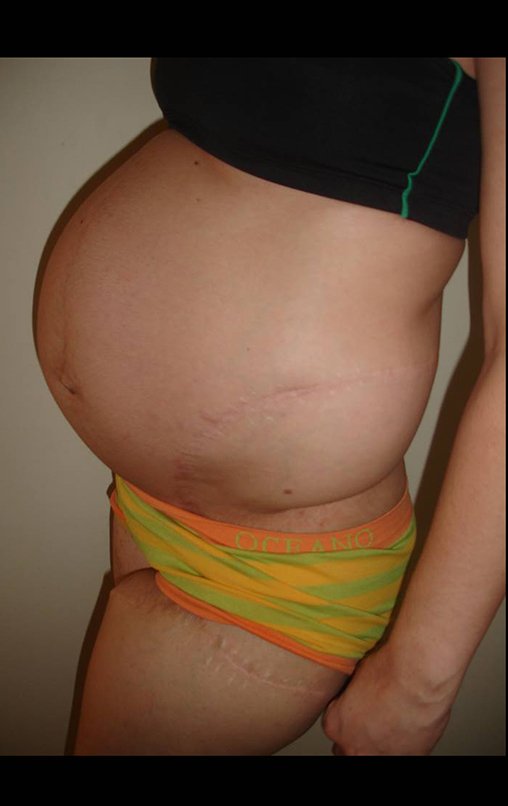
A paciente exibe, com alegria, sua vida sem limitações significativas. Mostra a total superação do déficit funcional, exercendo atividades da vida diária com desenvoltura, figuras 81 a 90.
Vídeo 1: Marcha com apoio total no membro operado, carga monopodal com bom equilíbrio, boa função de flexão dos quadris e joelhos com carga. Excelente resultado funcional para uma hemipelvectomia interna total, sem reconstrução, após 12 anos e três meses da cirurgia.
Autor : Prof. Dr. Pedro Péricles Ribeiro Baptista
Oncocirurgia Ortopédica do Instituto do Câncer Dr. Arnaldo Vieira de Carvalho
Consultório: Rua General Jardim, 846 – Cj 41 – Cep: 01223-010 Higienópolis São Paulo – S.P.
Fone:+55 11 3231-4638 Cel:+55 11 99863-5577 Email: drpprb@gmail.com