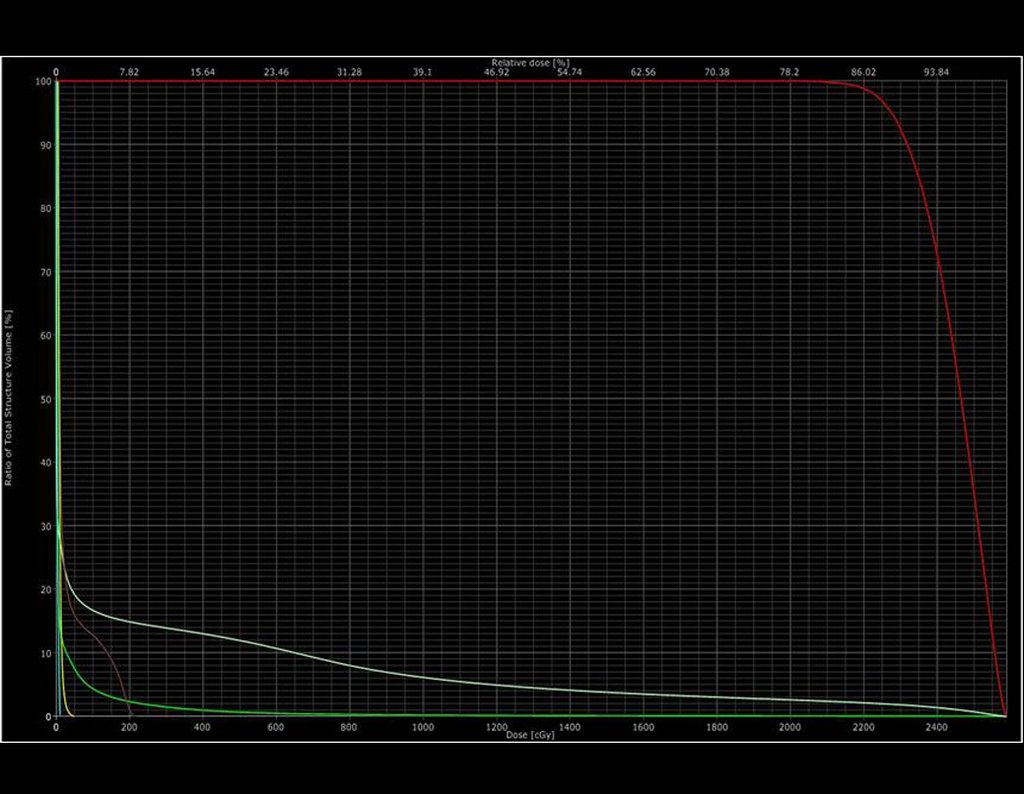
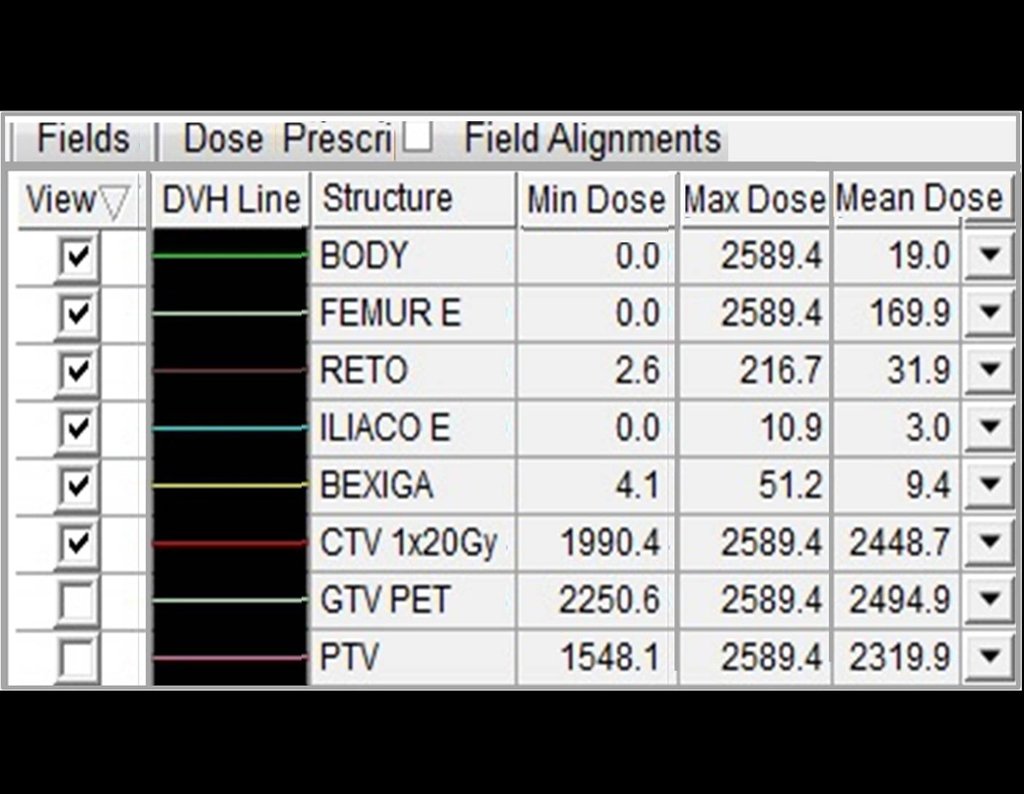
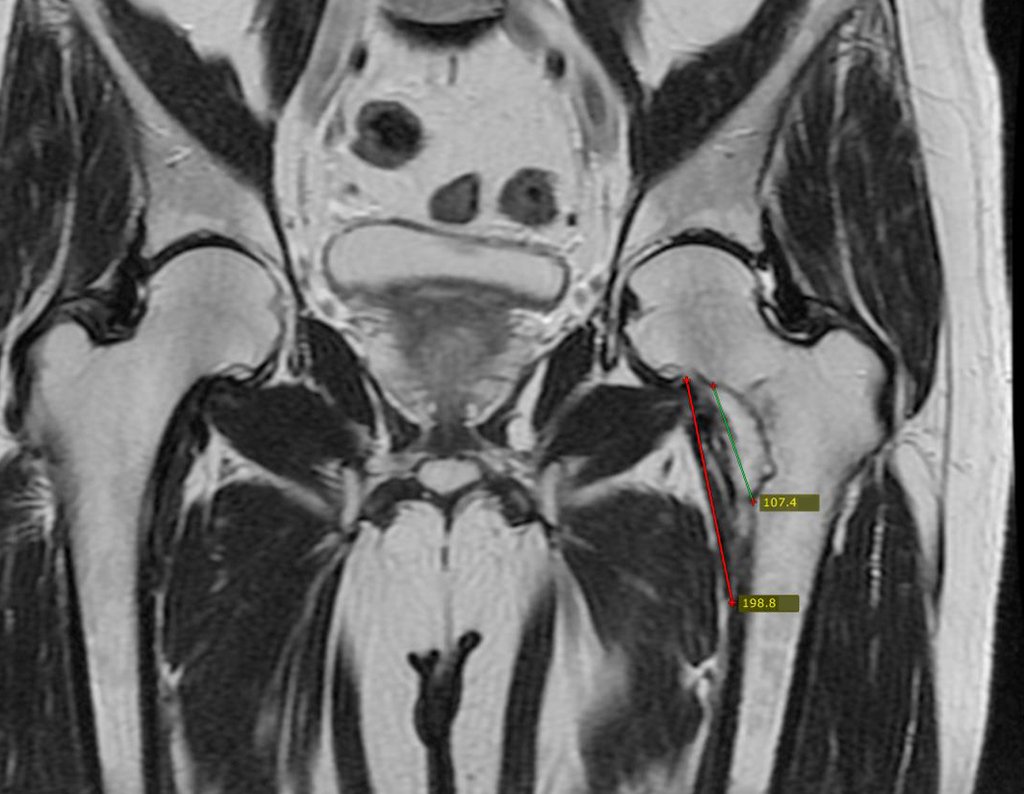
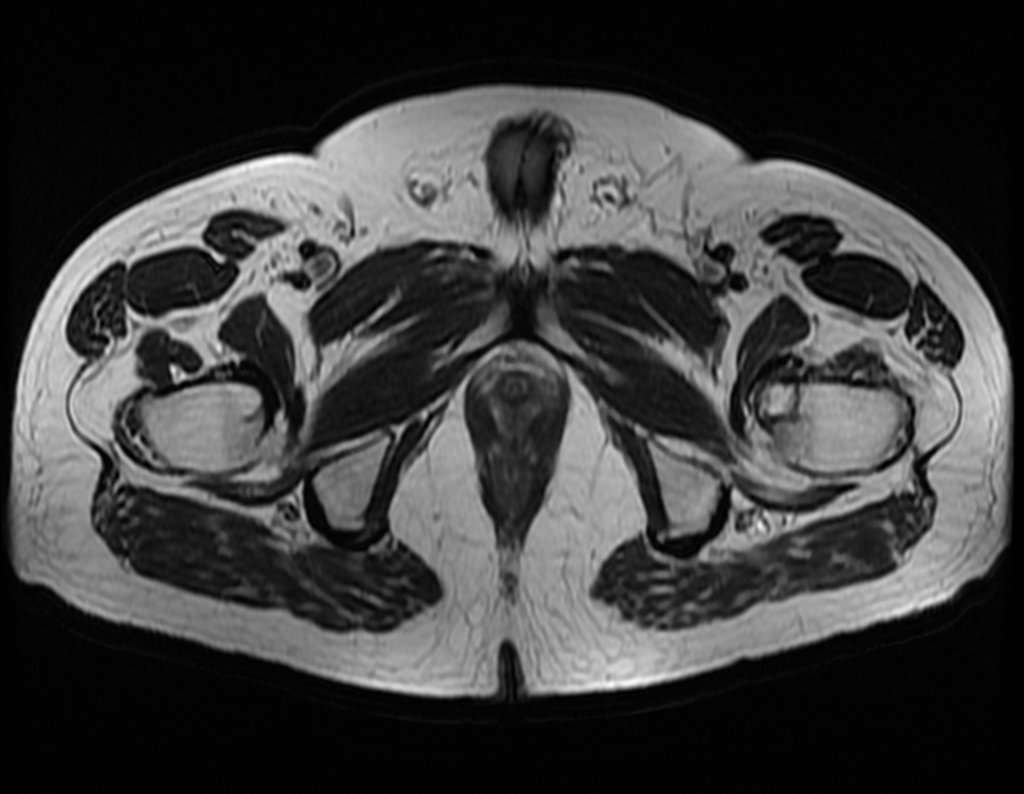
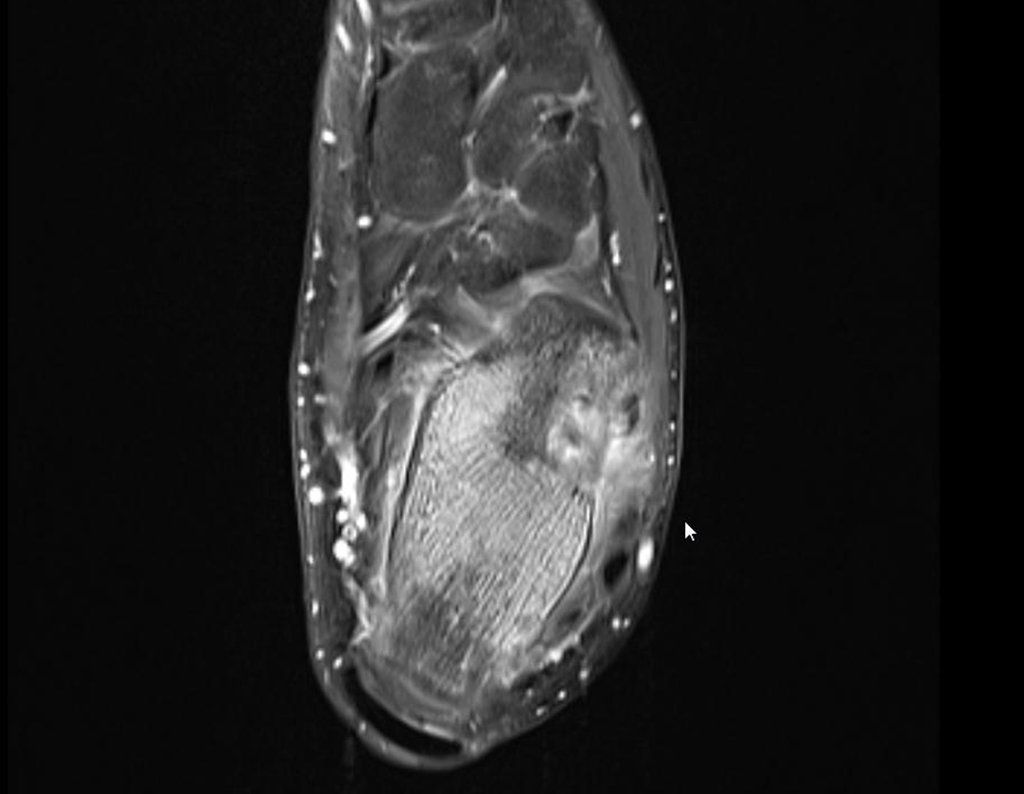
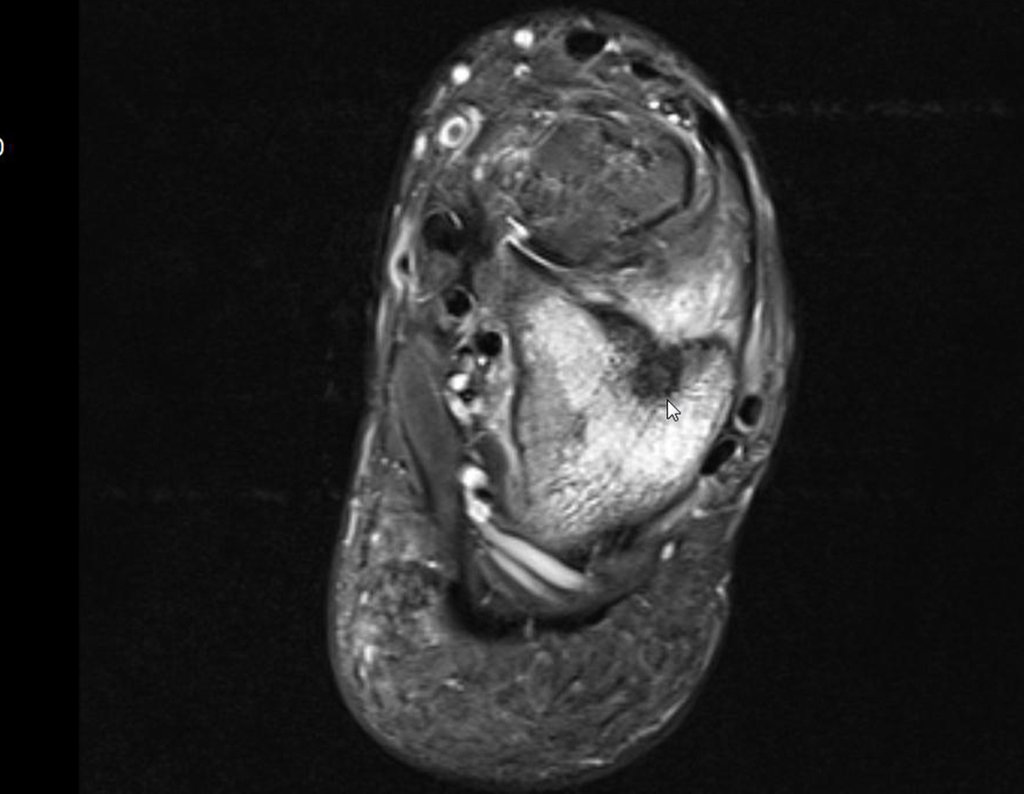
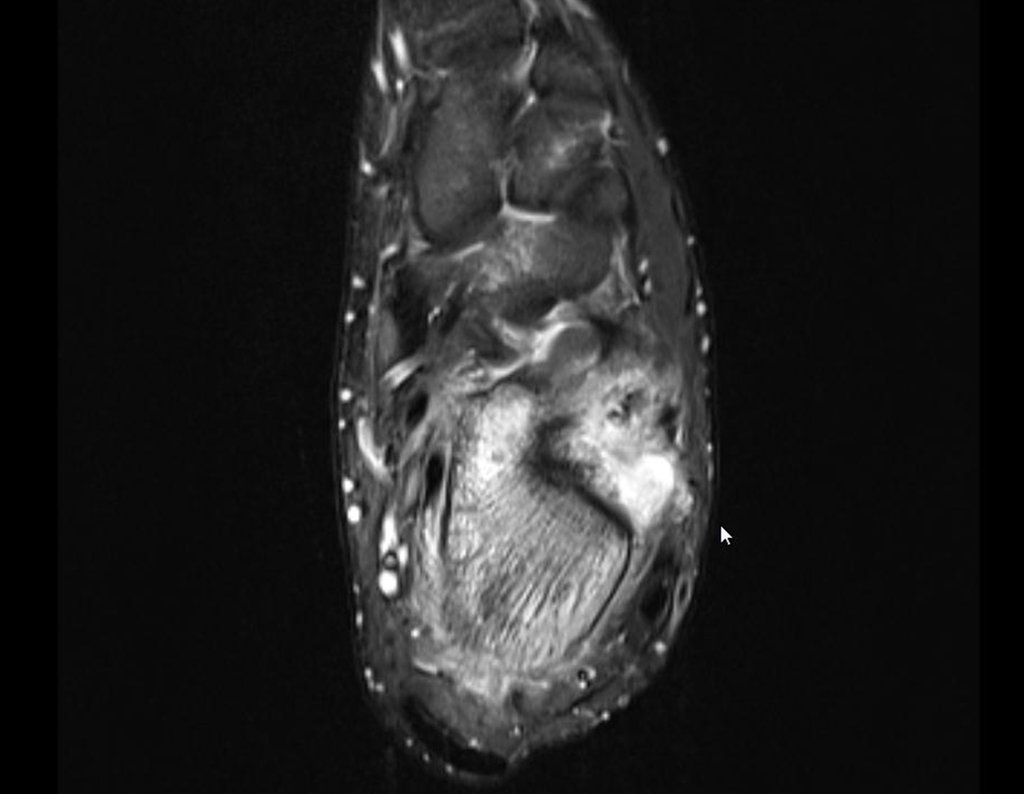
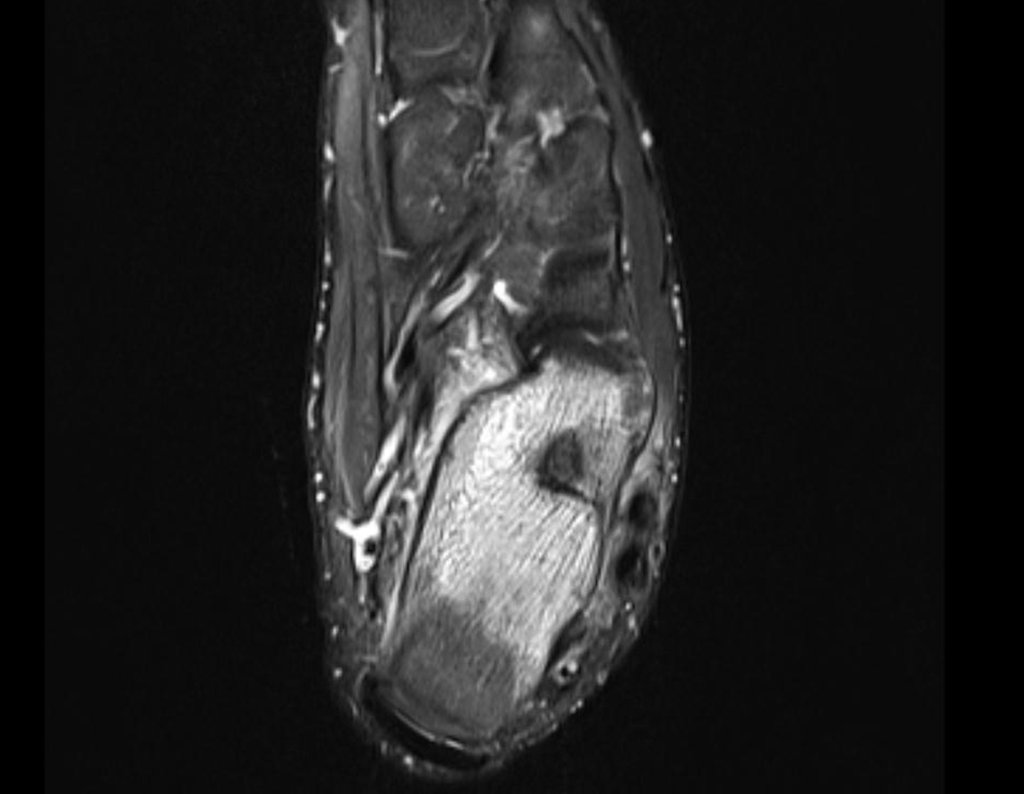
Para melhor compreensão, sugerimos que leia primeiramente os capítulos:
https://oncocirurgia.com.br/introducao-ao-estudo-dos-tumores-osseos/
Considerações sobre Biópsia
1. Somente após a avaliação clínica, com a realização da anamnese e exame clínico cuidadosos, que nos permitirão levantar as hipóteses de diagnósticos, é que deveremos solicitar os exames complementares.
Com a análise dos exames complementares deveremos verificar:
A- Se nossas hipóteses são compatíveis com os exames e continuam se enquadrando como possíveis diagnósticos;
B- Se apareceu nova hipótese, que não havíamos pensado, e teremos que refazer o nosso raciocínio clínico.
C- Se os exames estão corretos, bem-feitos, imagens centradas na lesão, com boa qualidade ou teremos que as repetir.
2. As hipóteses de diagnóstico devem ser feitas primeiramente com a clínica, exames laboratoriais e a imagem.
3. A patologia deve ser colocada como uma “ferramenta” para confirmar ou não a suspeita diagnóstica.
Se o exame anatomopatológico revelar um diagnóstico que não estava em nossa lista, deveremos reanalisar o caso, refazer nosso raciocínio. Caso não haja correlação clínica, radiológica e anatomopatológica algo pode estar errado e precisaremos rever conjuntamente, em equipe multidisciplinar, para determinarmos a melhor conduta. Nova biópsia?
4. Para o raciocínio do diagnóstico é preciso primeiramente enquadrar a afecção que estamos analisando dentro dos cinco capítulos da patologia, figuras 1 e 2.
18. Biópsia – conceito – tipos – indicações – planejamento
5. Se concluirmos que nosso paciente apresenta uma neoplasia, precisamos realizar o exercício de raciocínio já descrito nos capítulos de Introdução ao Estudo dos Tumores e Diagnóstico dos Tumores (Links: https://oncocirurgia.com.br/introducao-ao-estudo-dos-tumores-osseos/ e https://oncocirurgia.com.br/diagnostico-dos-tumores/ ).
Após estas etapas é que podemos pensar na biópsia, como “ferramenta” para o diagnóstico definitivo.
Antes de abordarmos o tema “biópsia” vamos analisar alguns casos.
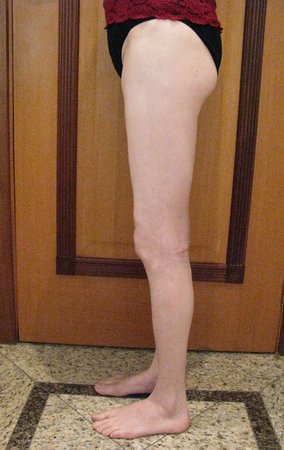
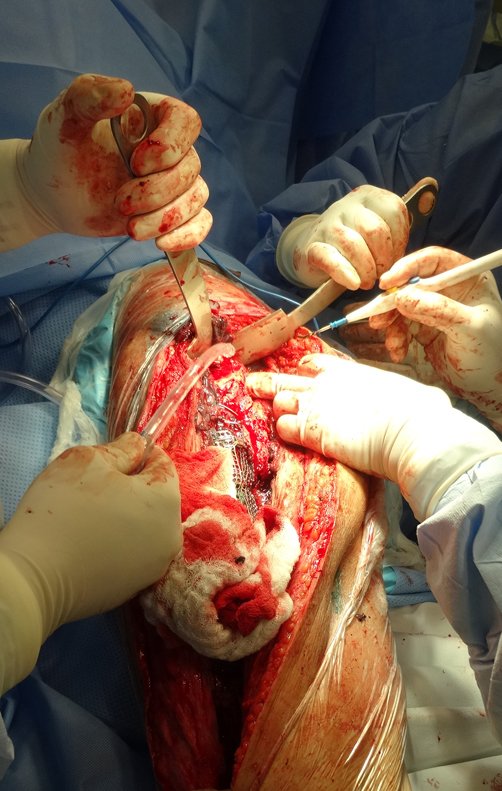
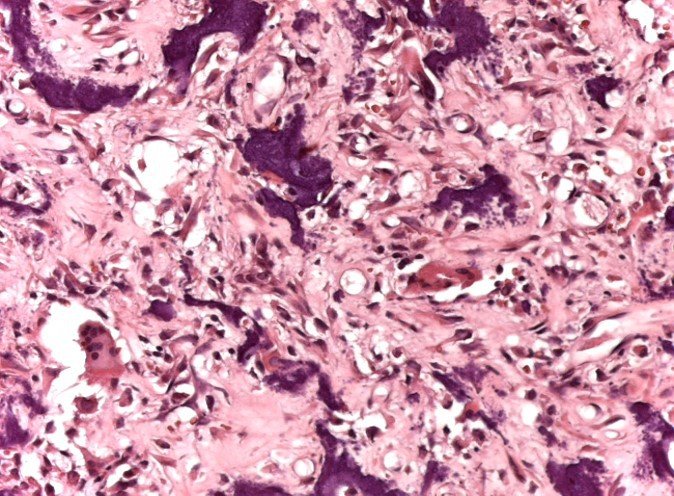
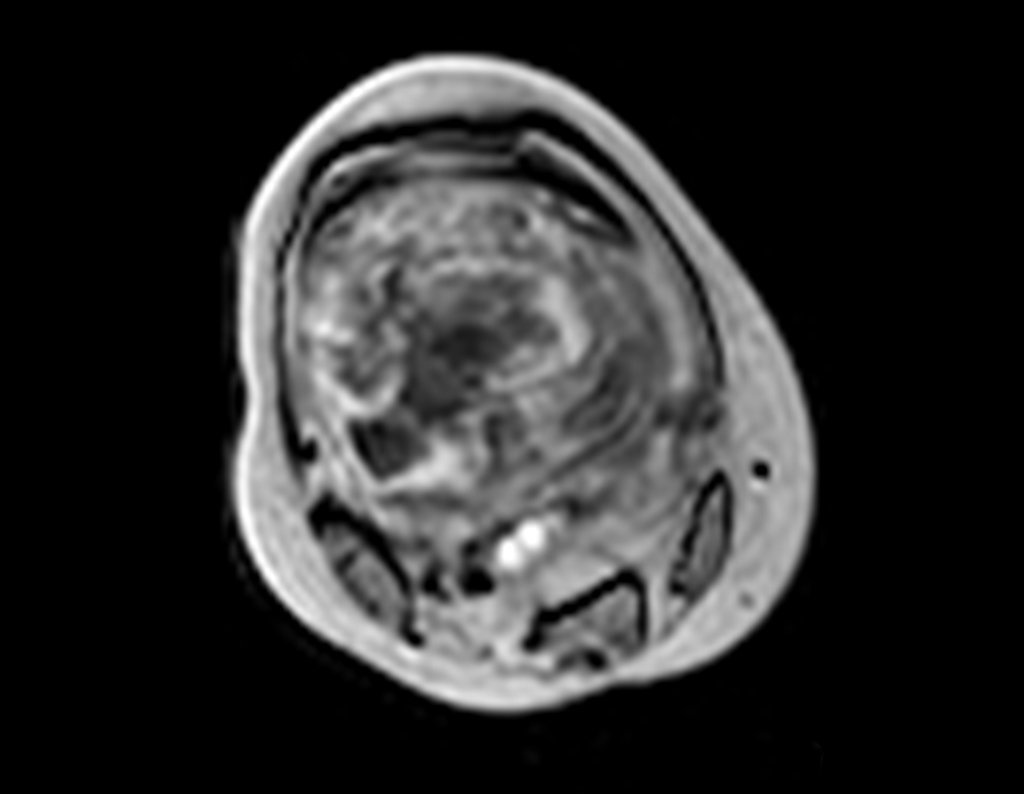
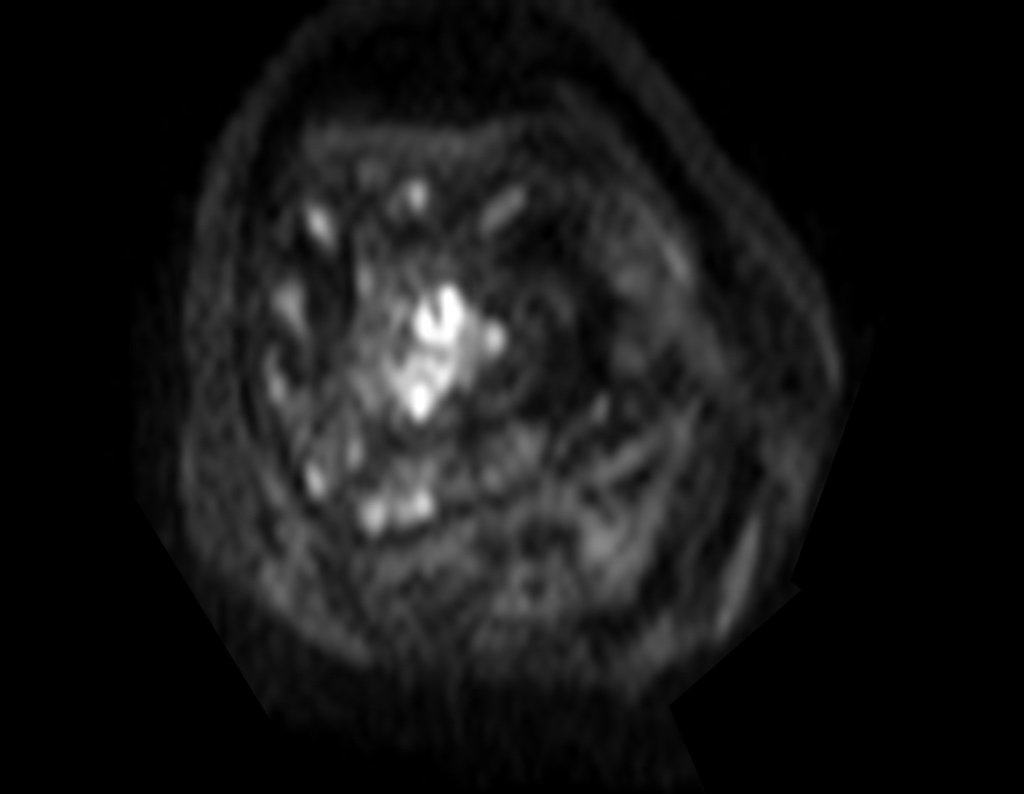
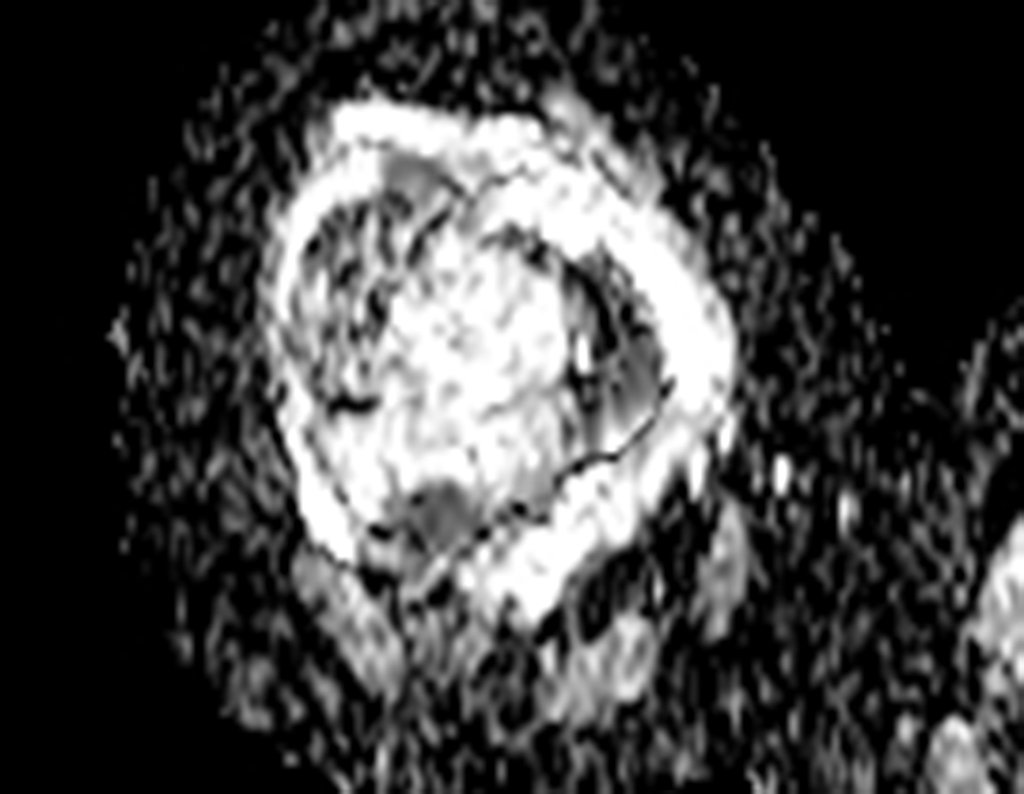
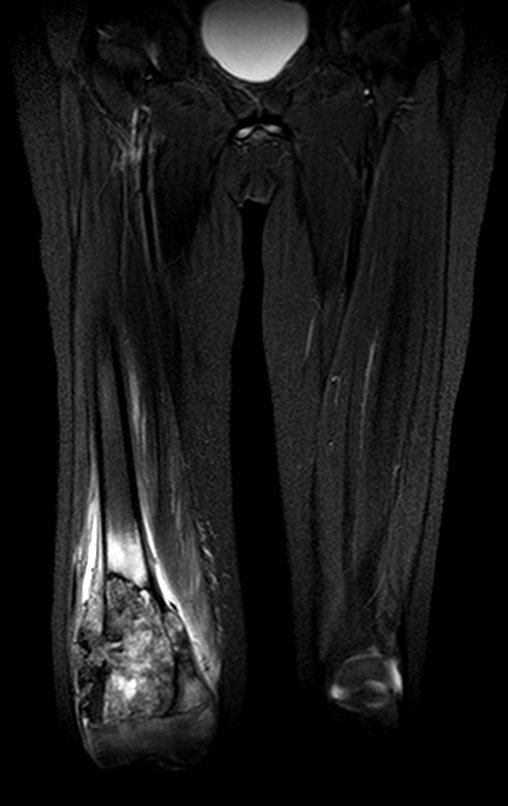
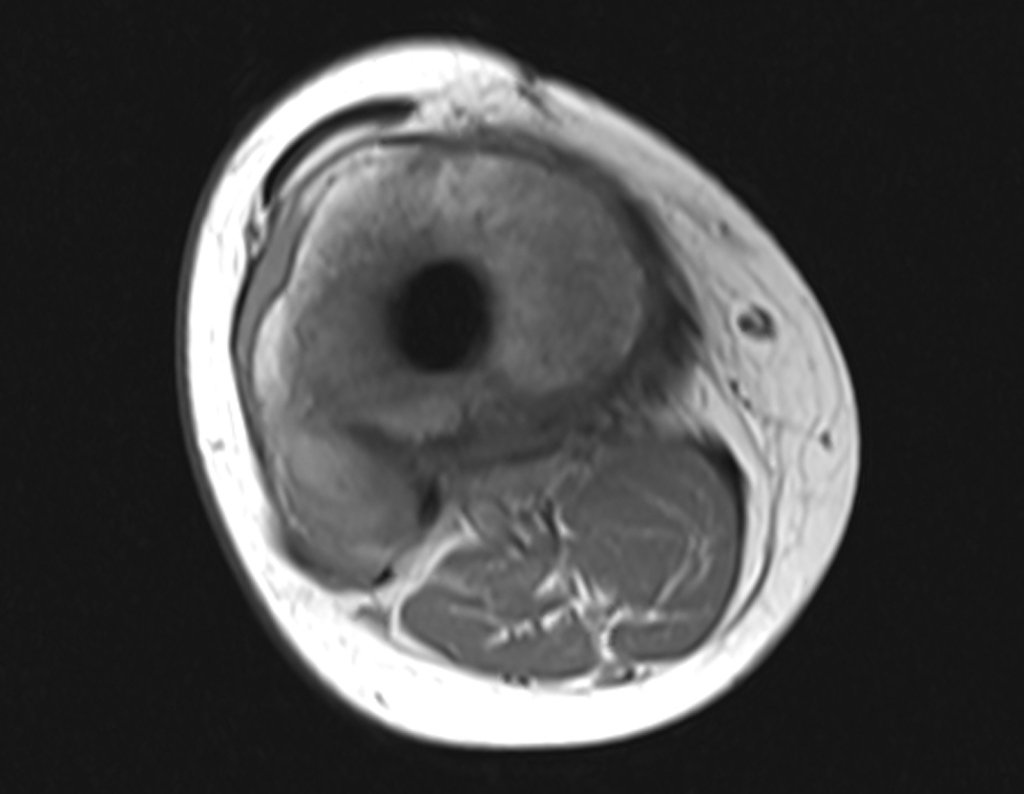
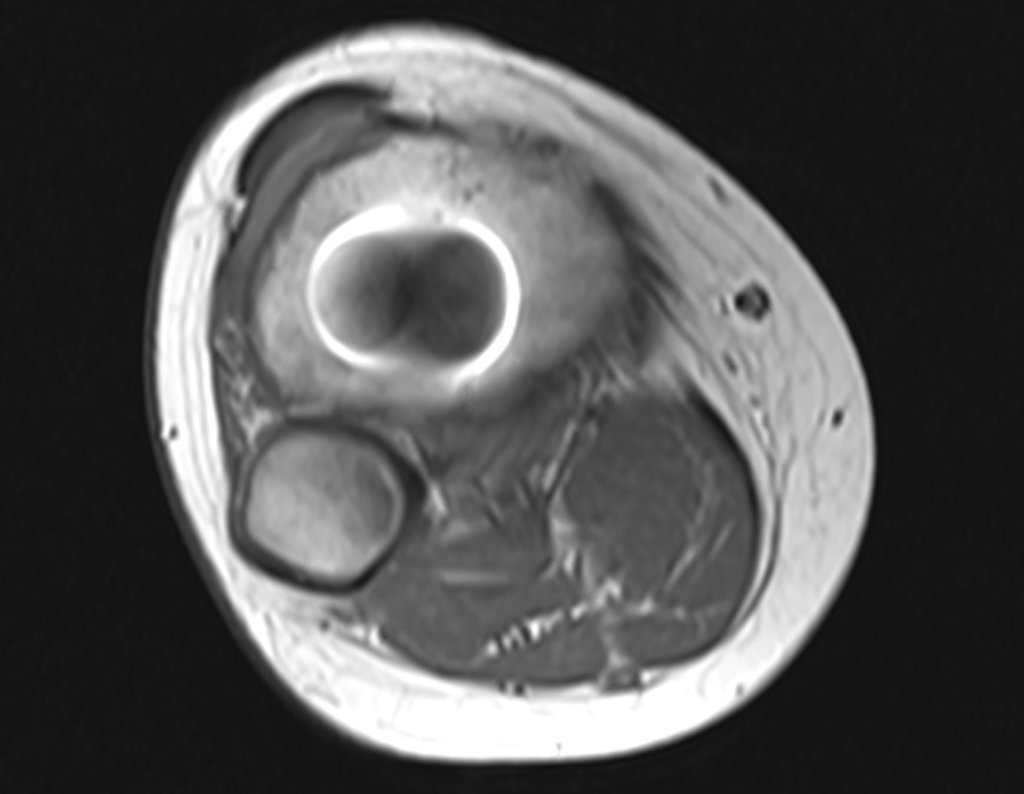
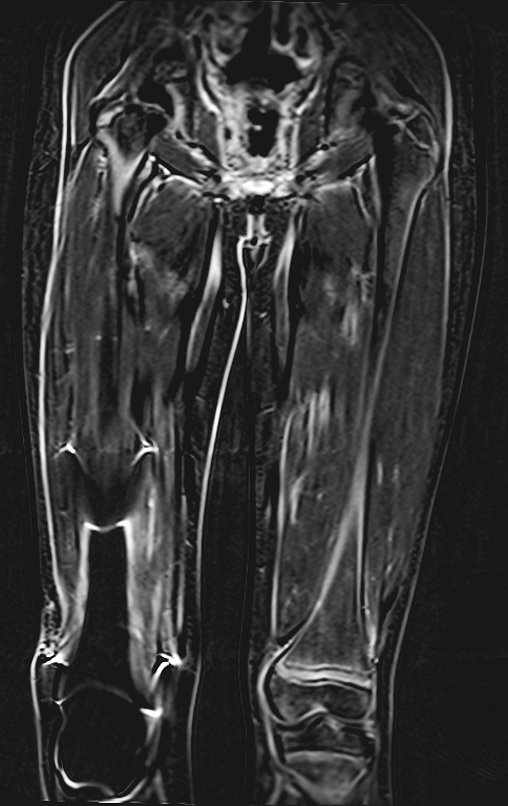
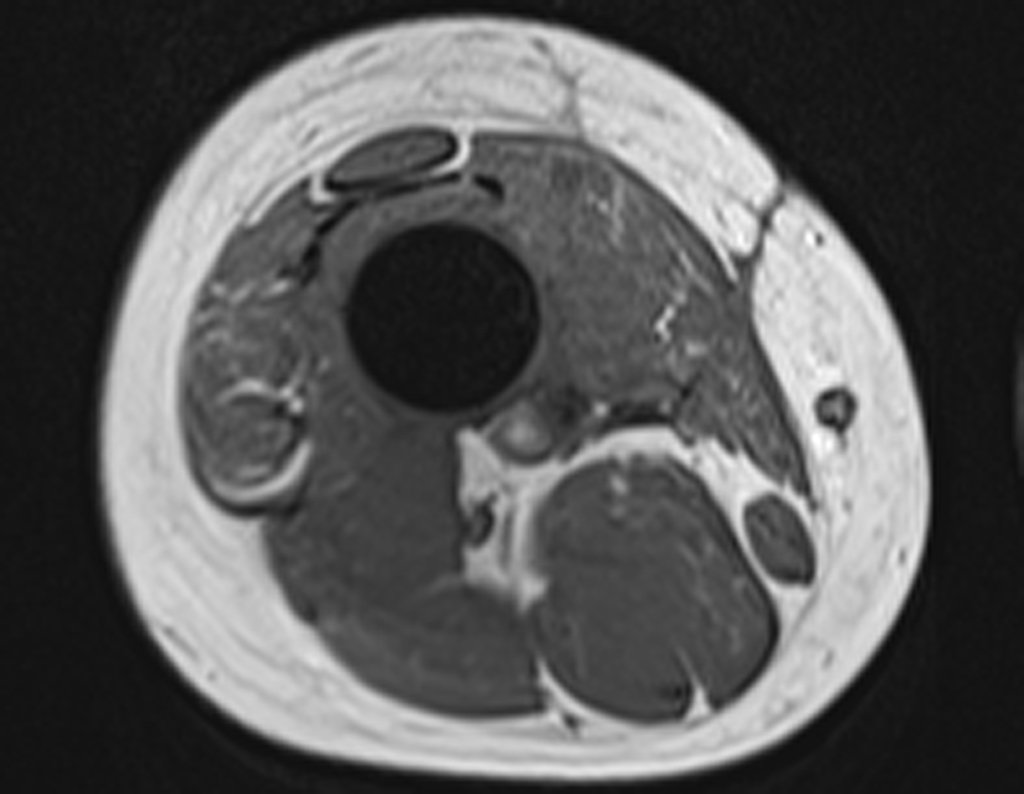
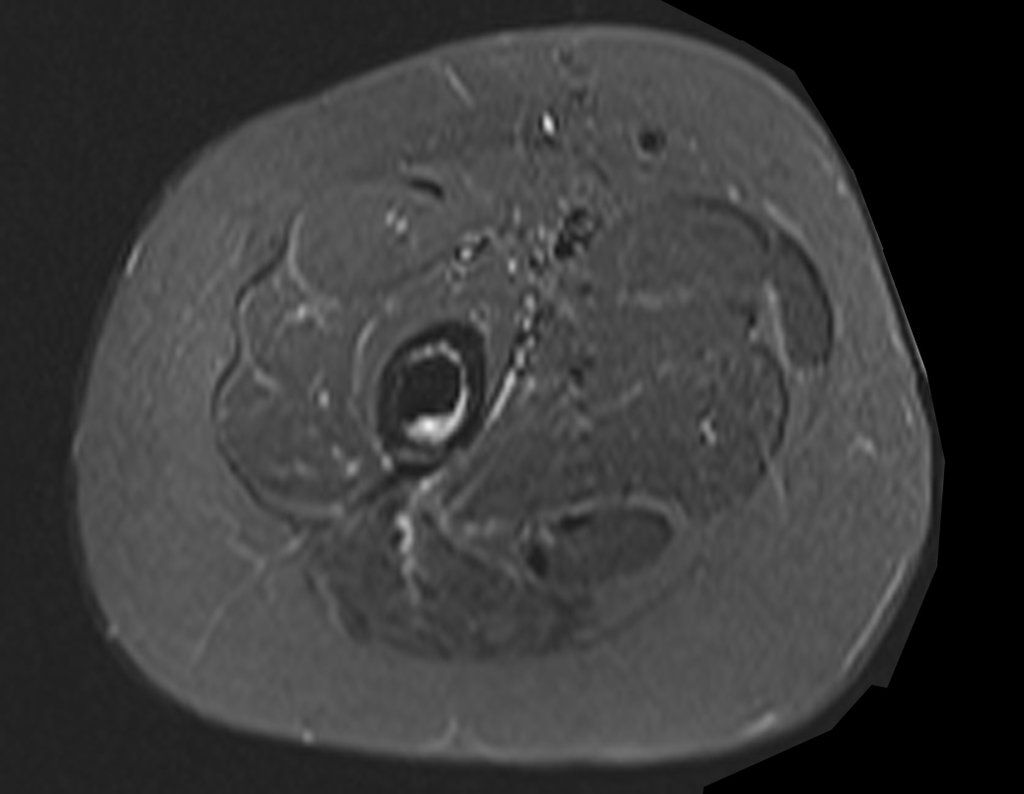
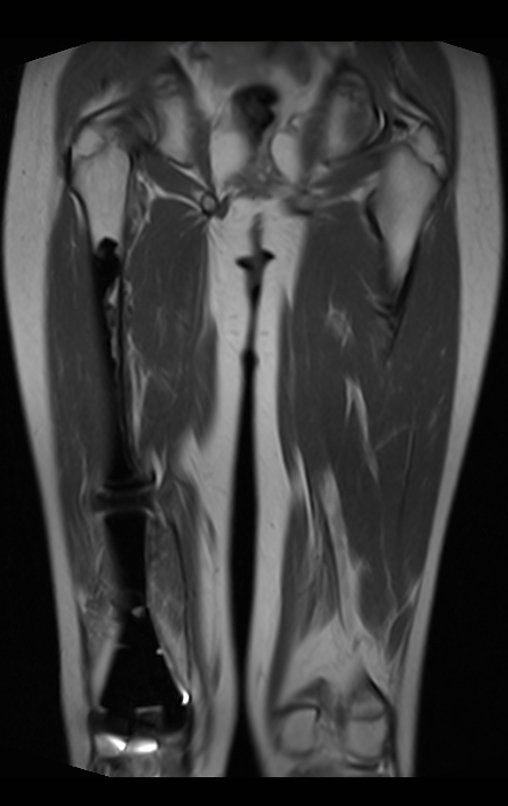
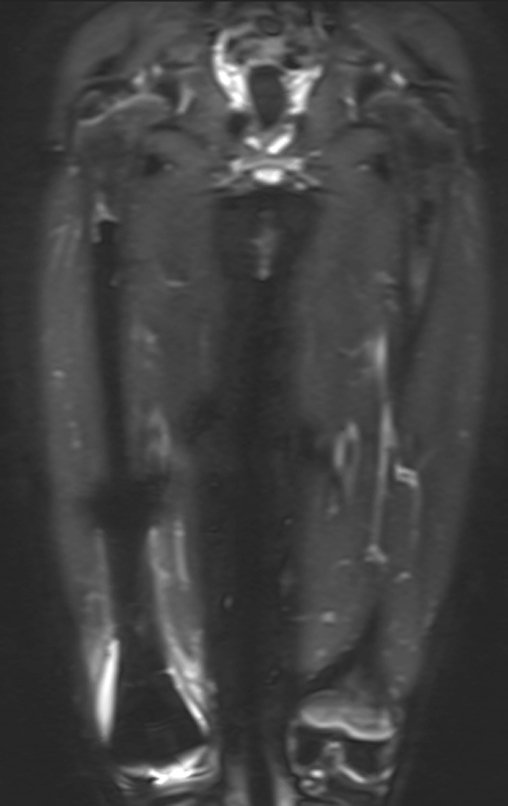
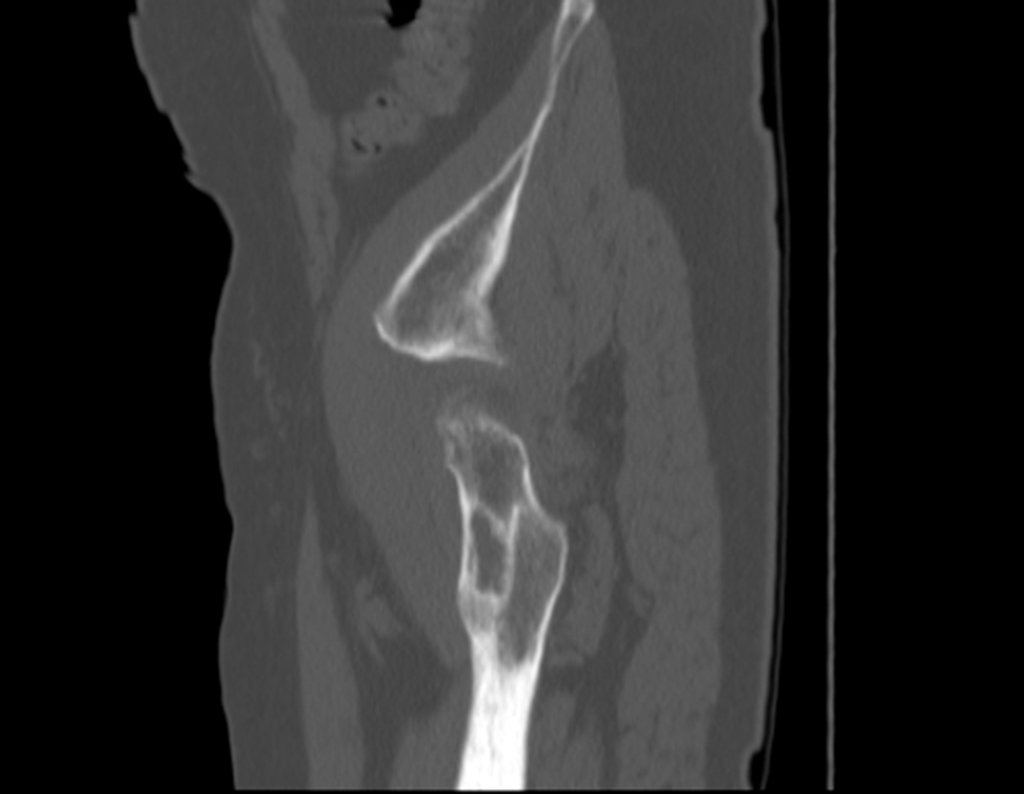
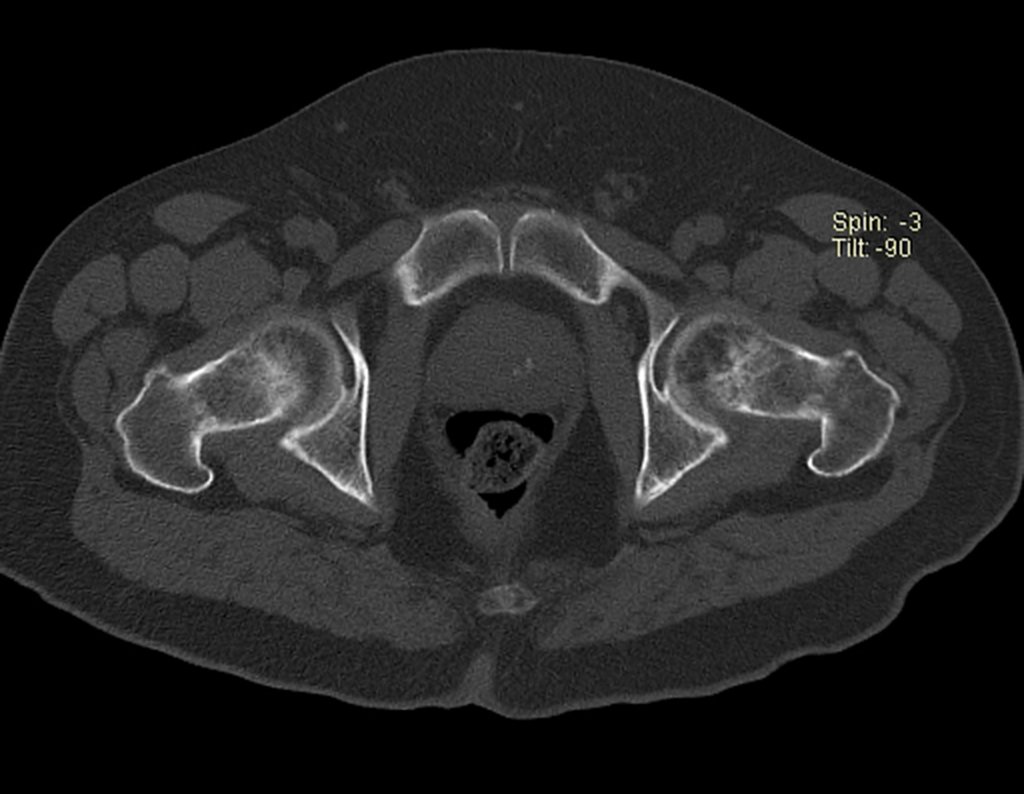
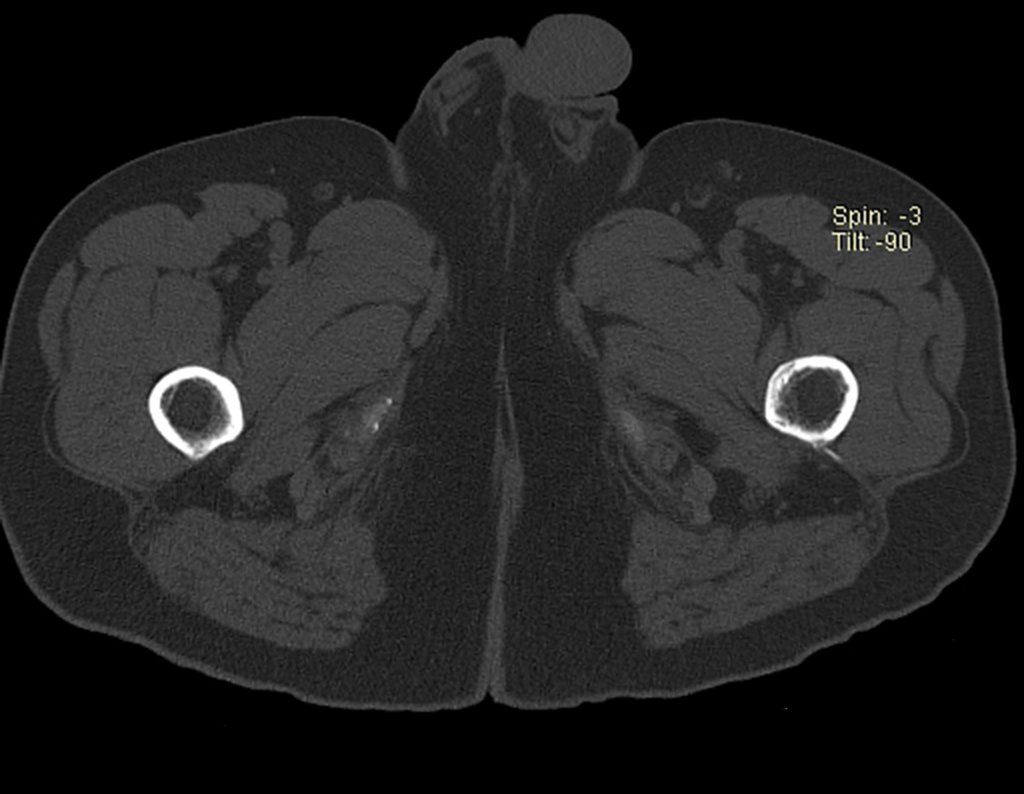
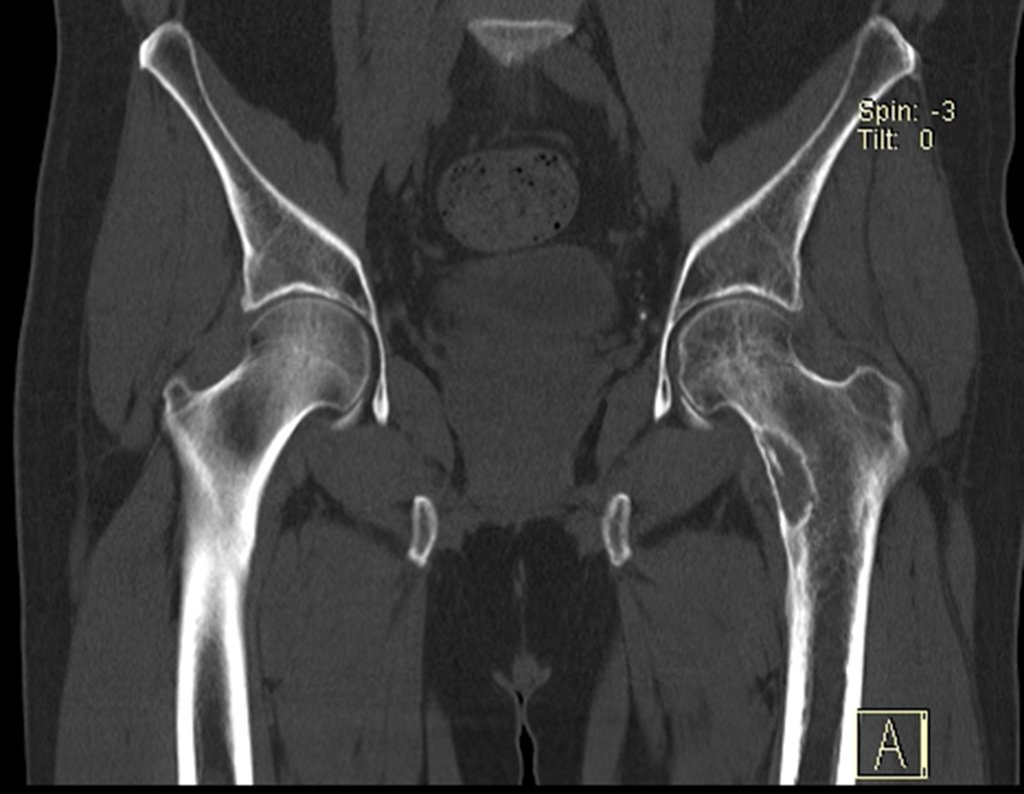
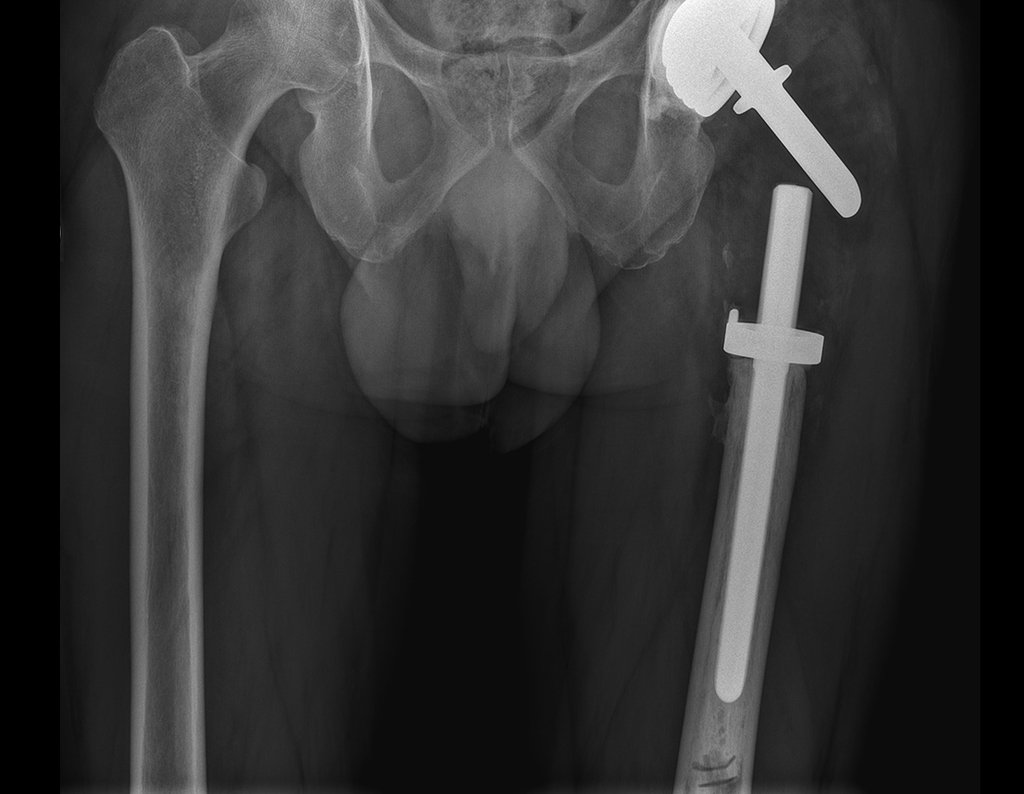
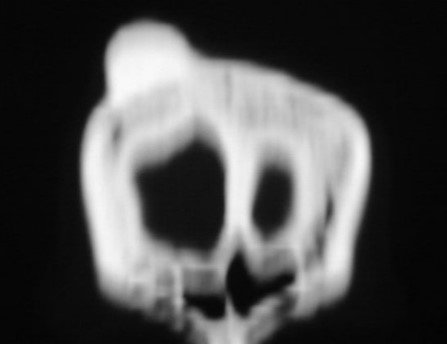
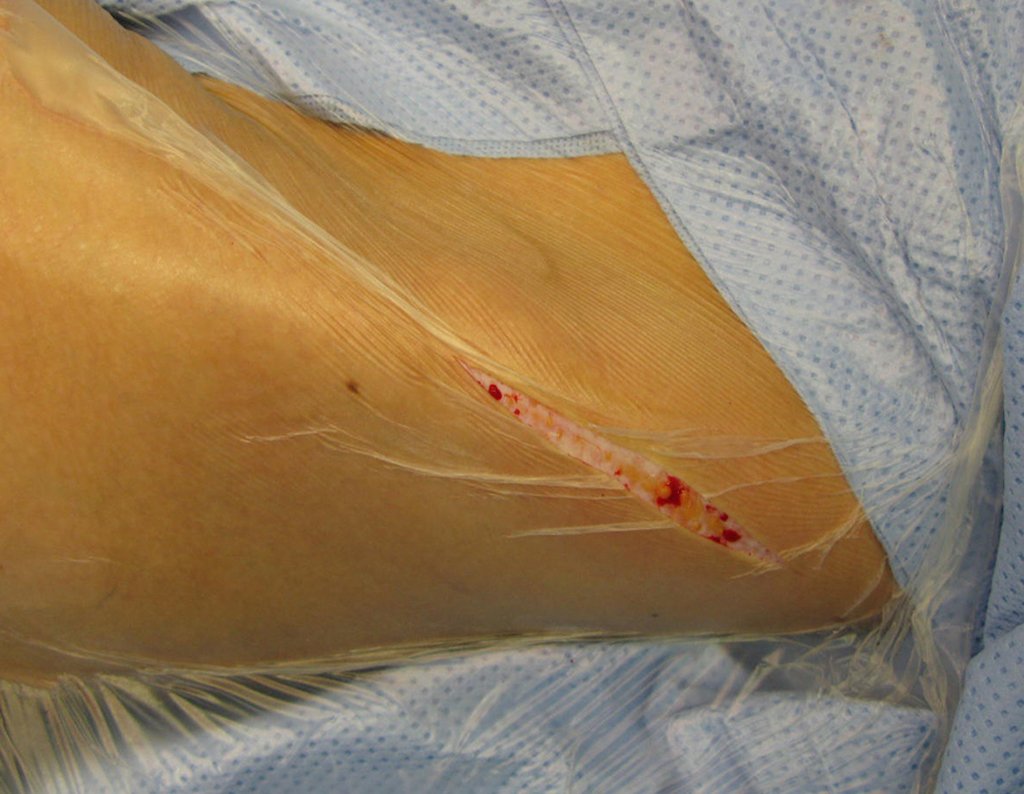
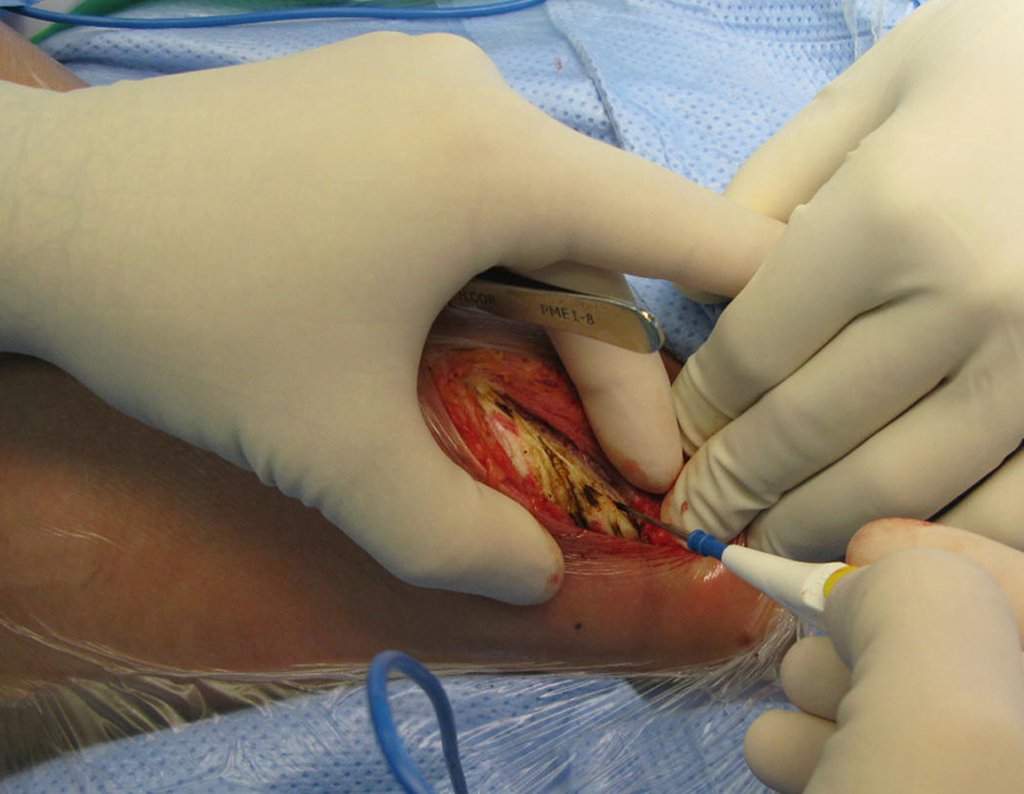
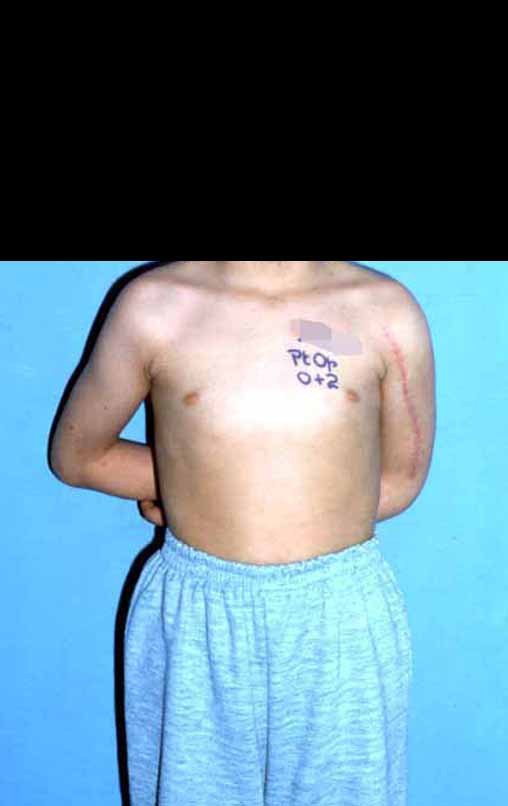
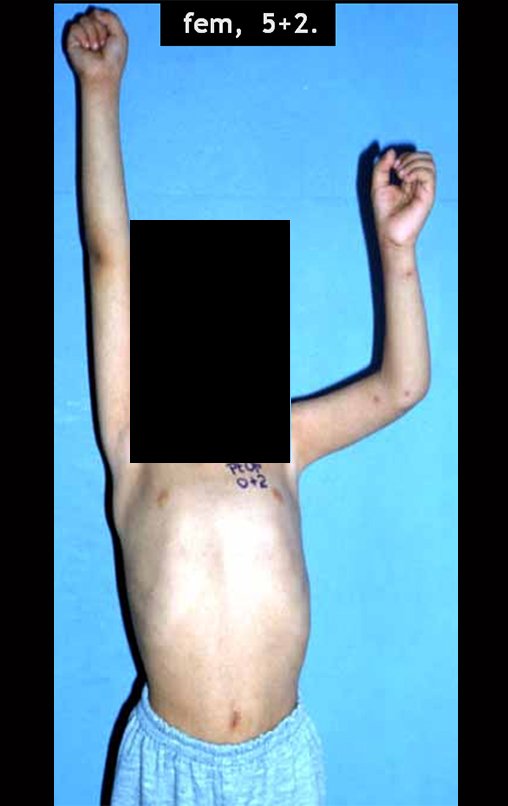
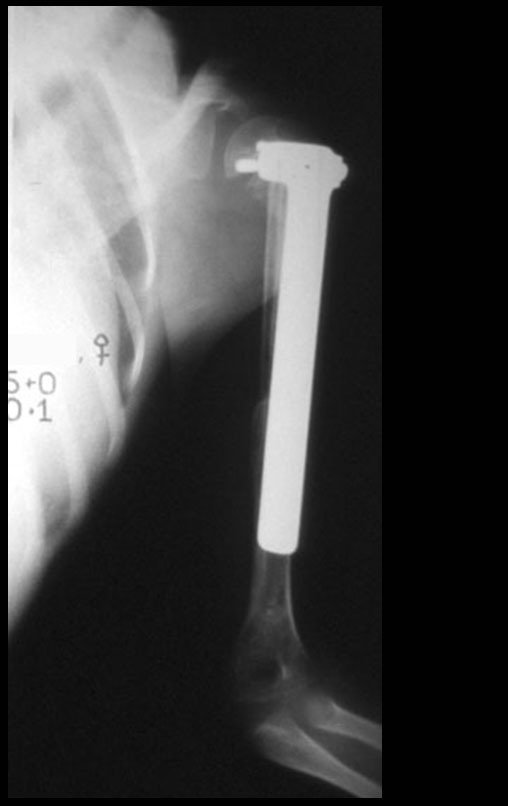
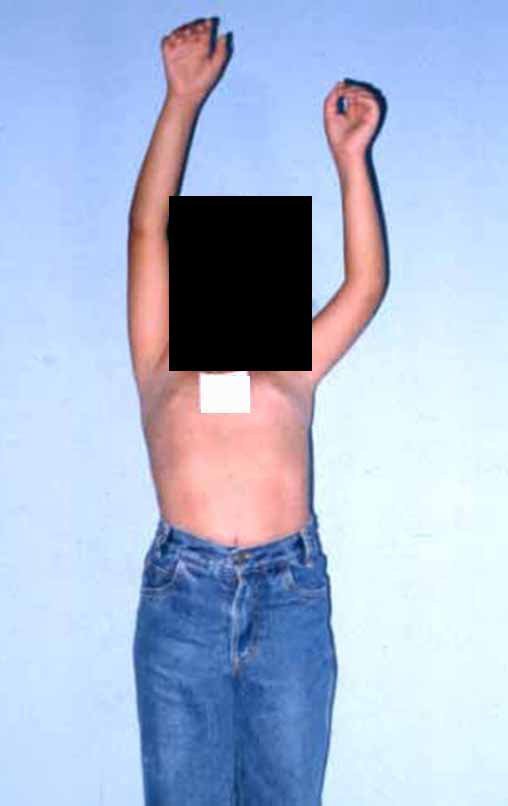
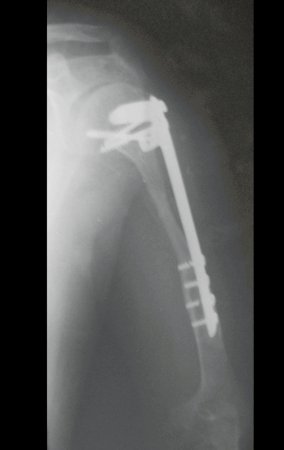
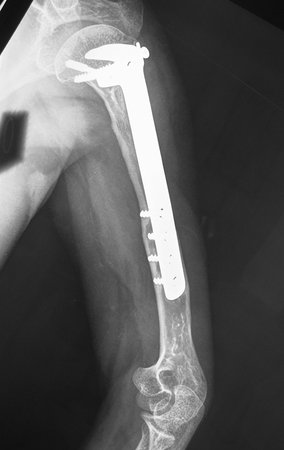
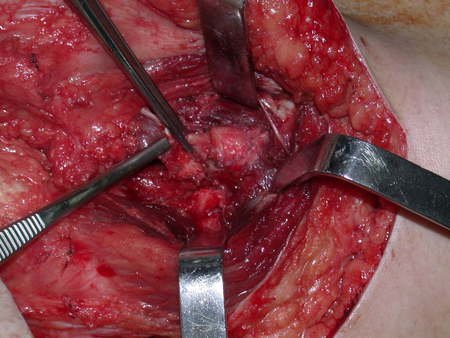
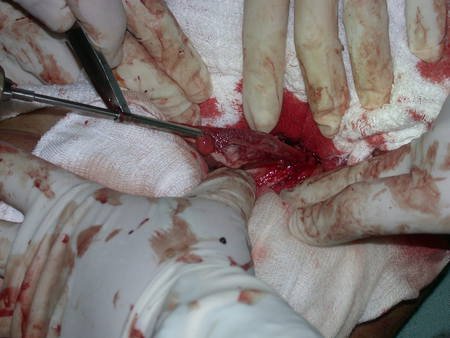
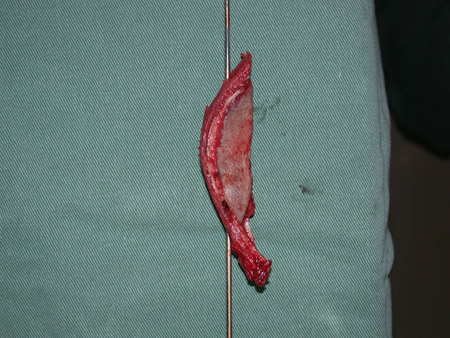
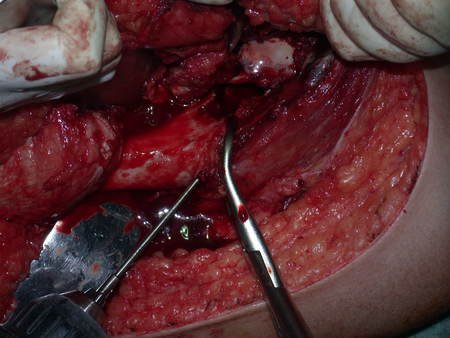
Paciente A: figuras 3 e 4.
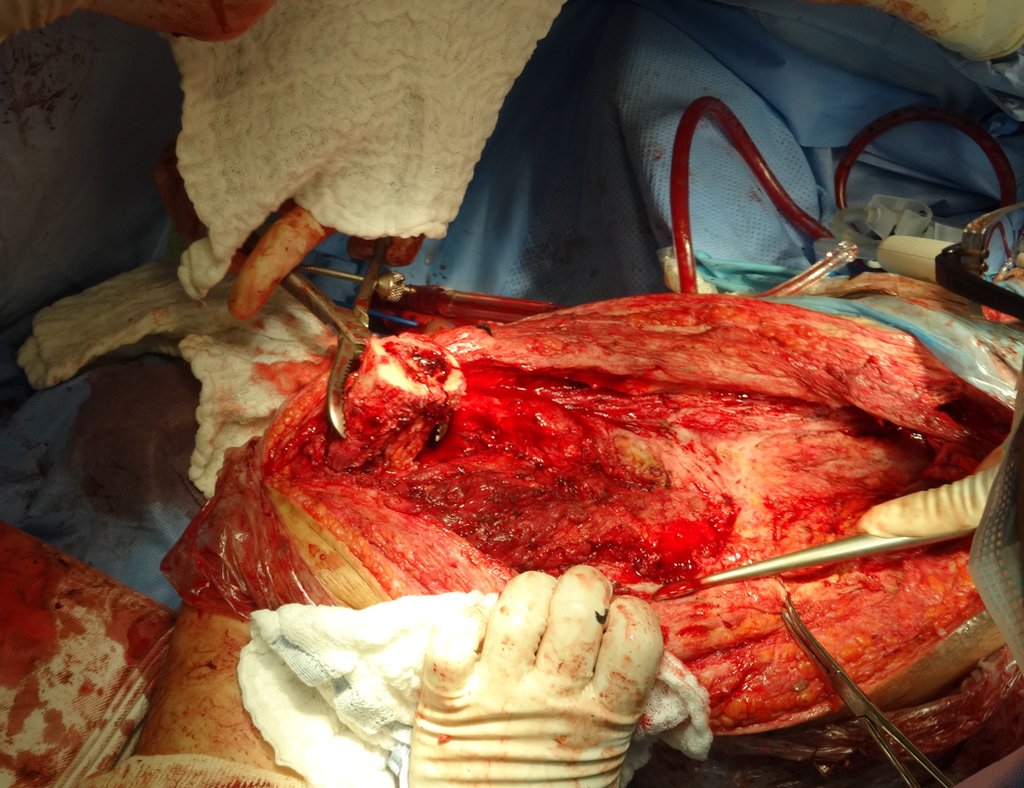
Há trinta dias, solicitaram a realização de biópsia de uma lesão da parede abdominal, em paciente internado para investigação.
O médico do paciente encontrou-me na sala de radiologia, analisando a tomografia.
Seguindo o “como eu penso” sobre as lesões perguntei-me: – que estruturas formam a parede abdominal? a. pele (carcinoma espinocelular, basocelular, melanoma); b. subcutâneo (lipoma, lipossarcoma); c. fáscia muscular (fibroma desmóide); d. músculo estriado (fibroma, fibrossarcoma, fibroma desmóide, rabdomiossarcoma); e. vaso (hemangioma, leiomiossarcoma); f. peritônio e cavidade abdominal (já não é minha jurisdição).
Pareceu-me uma extensa lesão e sugeri que procurasse um cirurgião da área, pois eu não saberia conduzir, caso fosse neoplasia maligna. O ideal é que a biópsia seja realizada por aquele que vai operar o paciente.
Relatou-me que o paciente estava ictérico, havia realizados ultrassom e vários exames laboratoriais, insistindo-me a realizar a biópsia. Perguntei-lhe alguns dados e como não sabia informar-me sugeri que passássemos visita no leito. Poderíamos extrair a história clínica e examinar o paciente.
O paciente referiu ser asmático, relatou que o sintoma começou abruptamente após acesso de tosse havia onze dias, em mudança repentina de tempo, com frio e garoa. Apresentou fortíssima dor na parede anterior do abdome, onde apareceu uma “bola”. O abaulamento e a dor estavam diminuindo e a parede lateral tinha endurecido.
Saindo do quarto sugeri que não fizéssemos biópsia, que desse alta para o paciente, que a icterícia com bilirrubina elevada era resultado de um grande hematoma que havia infiltrado a parede lateral, devido à ruptura espontânea do reto anterior do abdome. Esta lesão já estava em reparação e a biópsia apenas mostraria o processo inflamatório cicatricial (com risco de vir miosite proliferativa).
Ainda não convencido, perguntou-me se eu já tinha visto caso de ruptura espontânea do músculo reto abdominal. Respondi não, mas era o que o bom senso dizia. Descendo pela escada encontramos um cirurgião geral e perguntei-lhe sobre o assunto. Este esclareceu que era comum em paciente com bronquite crônica que tomavam corticoide, como era o caso do nosso paciente. A história clínica fez o diagnóstico.
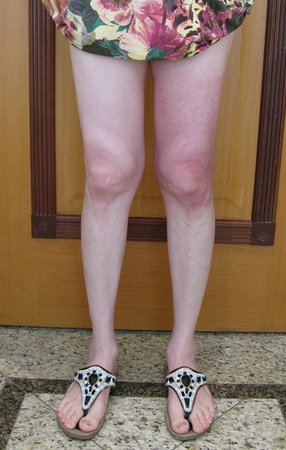
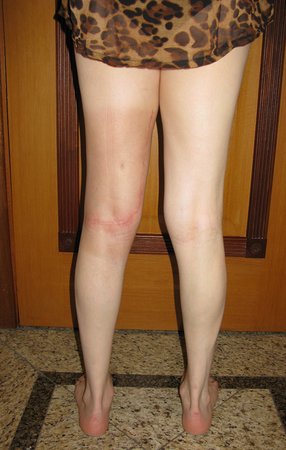
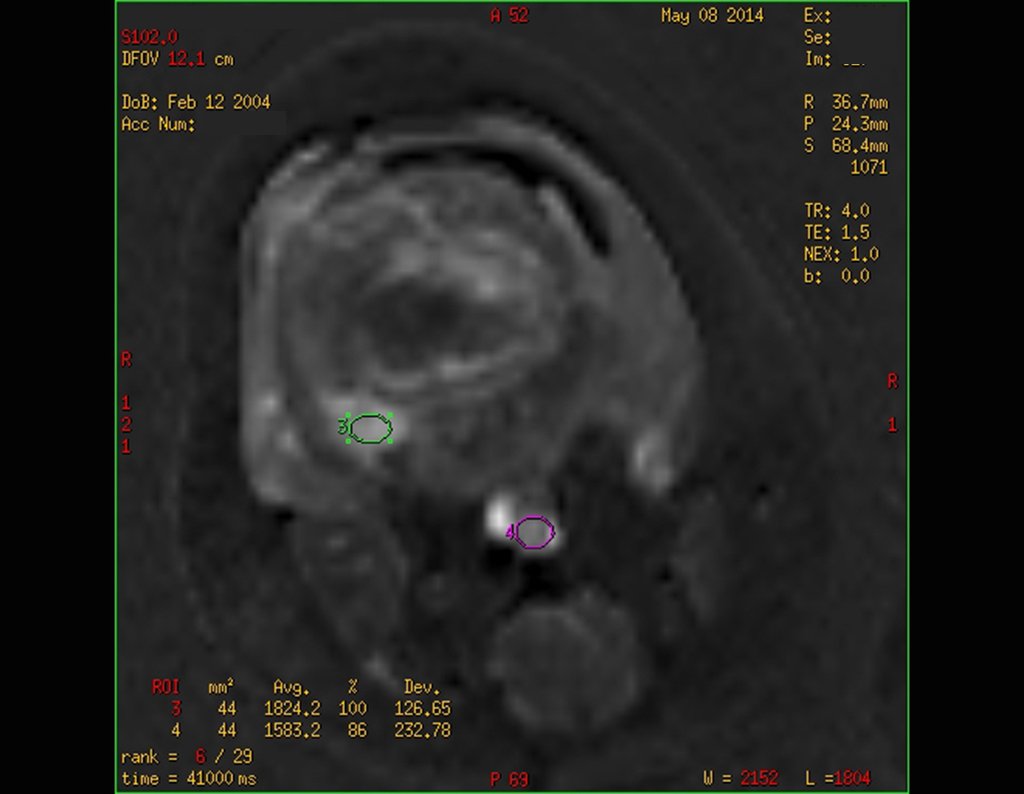
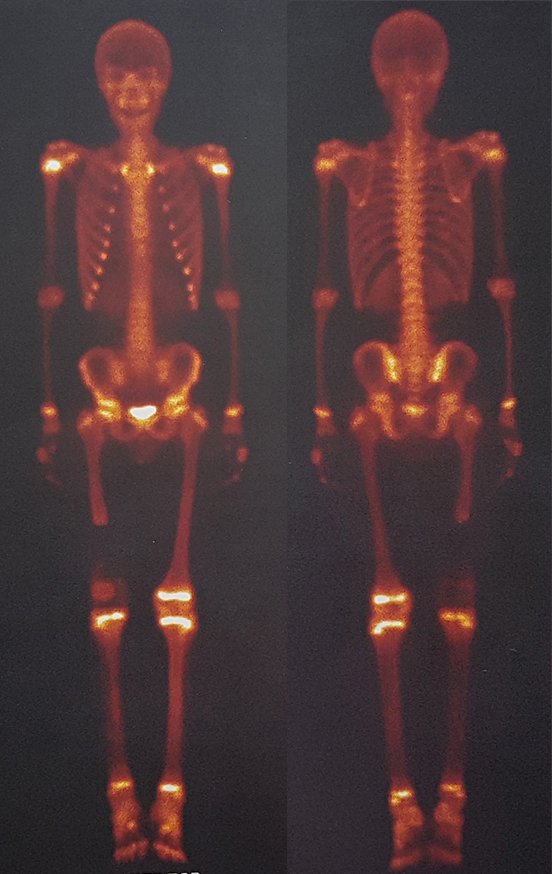
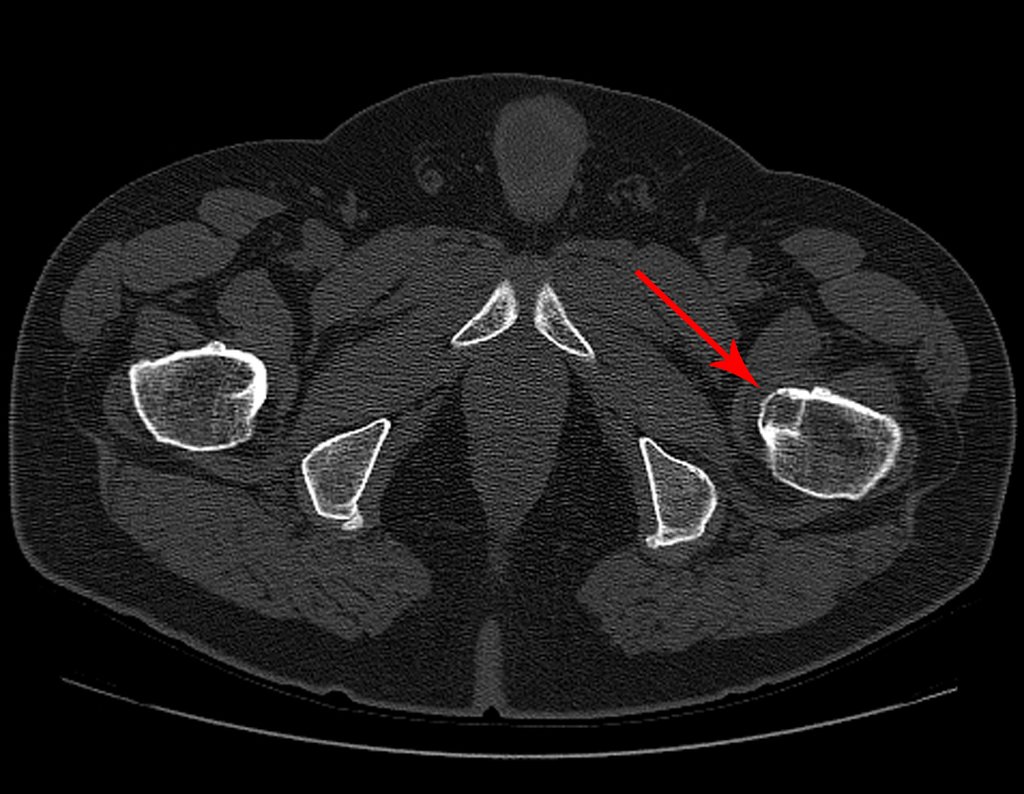
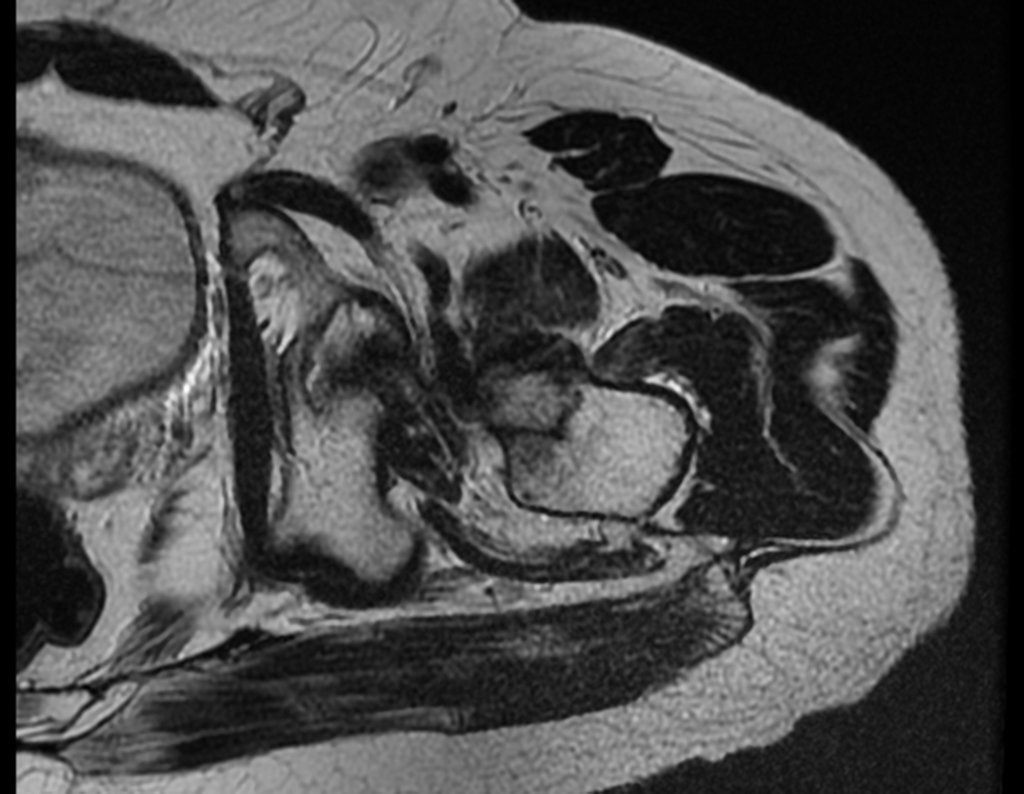
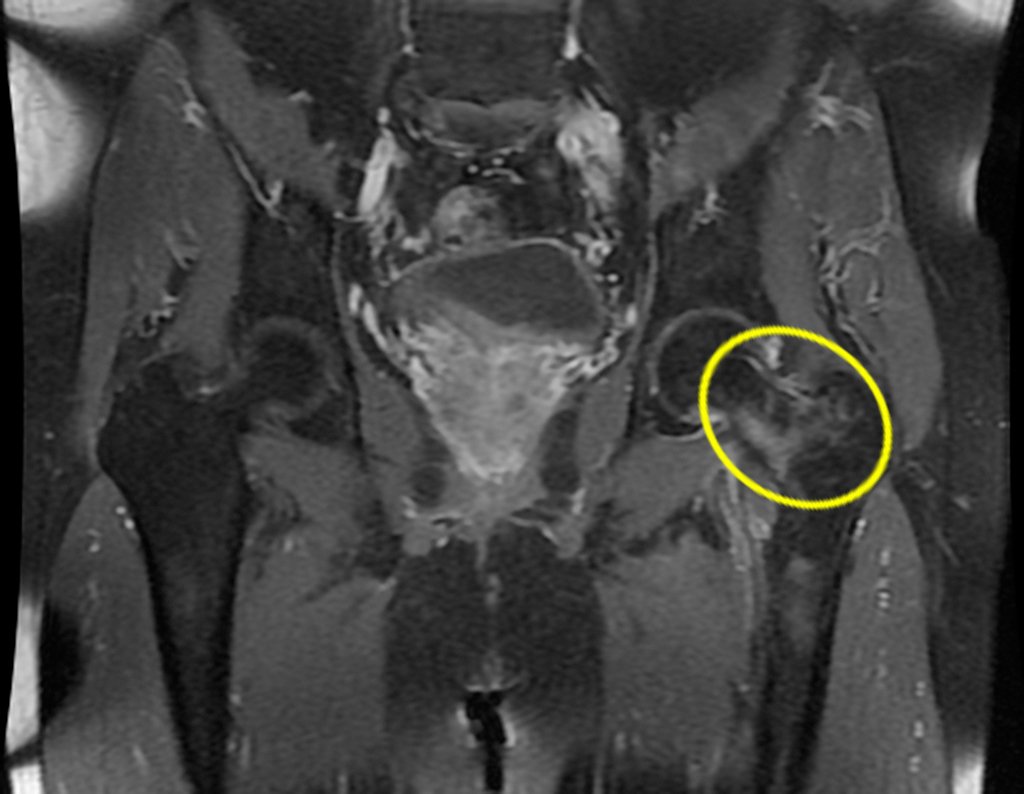
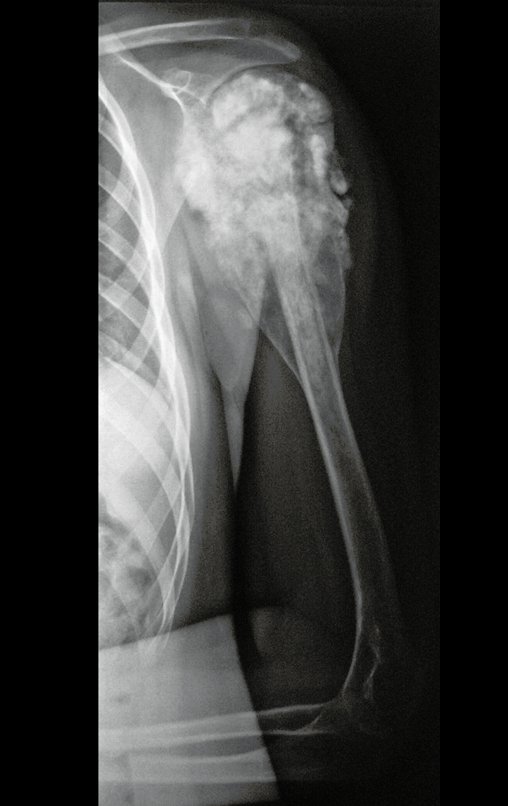
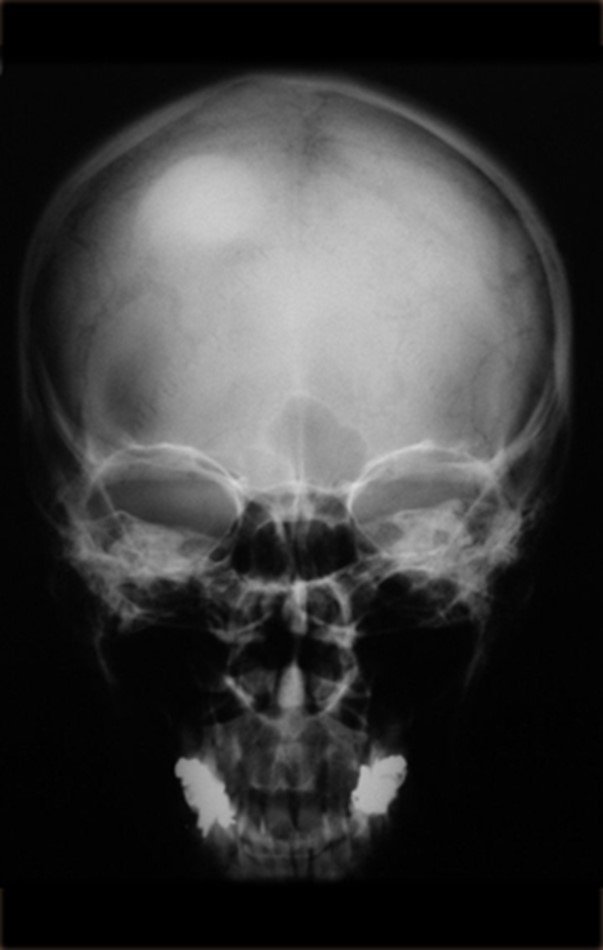
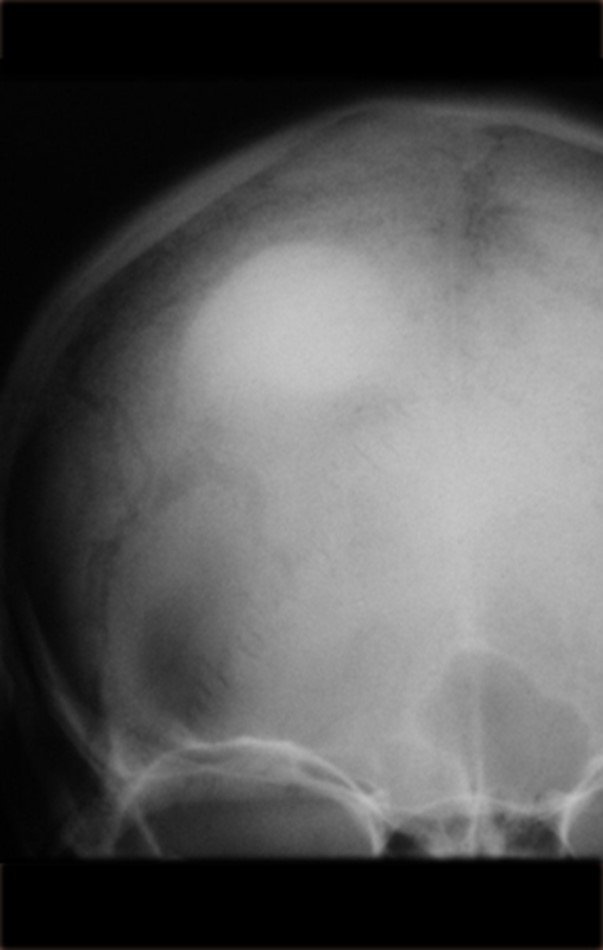
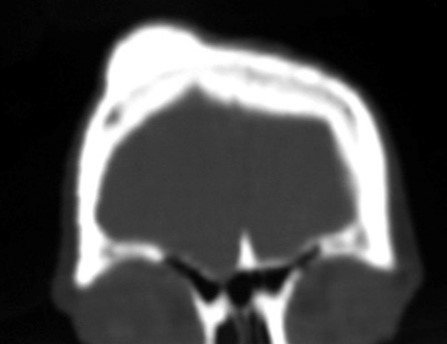
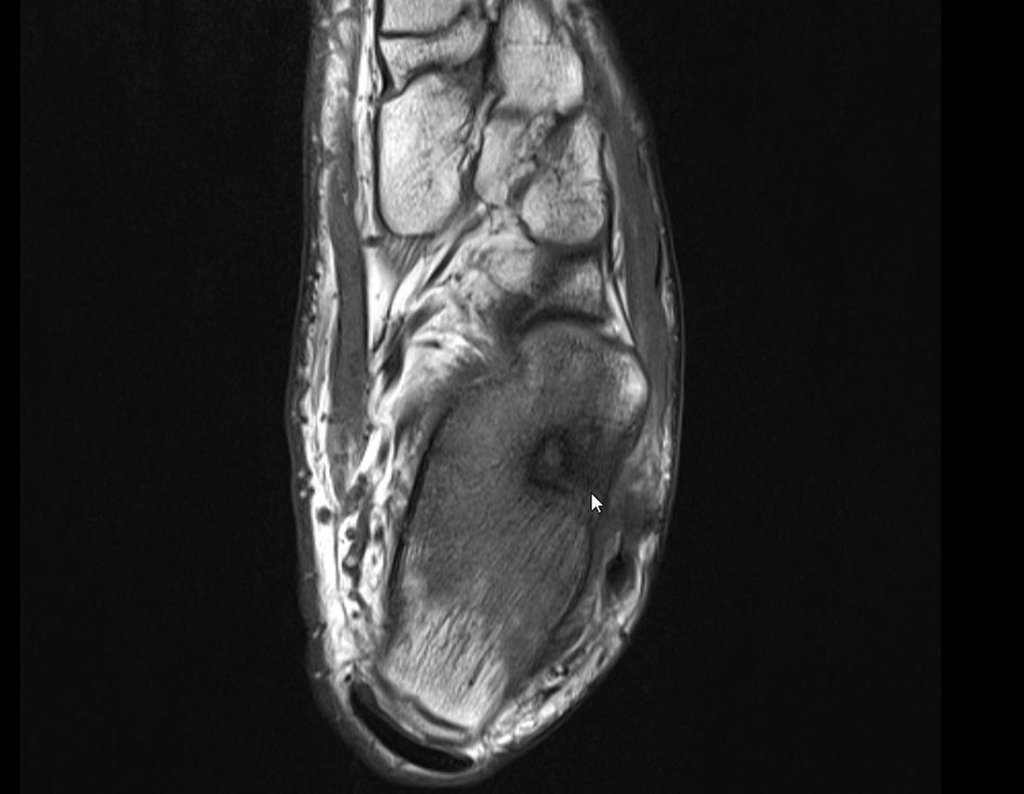
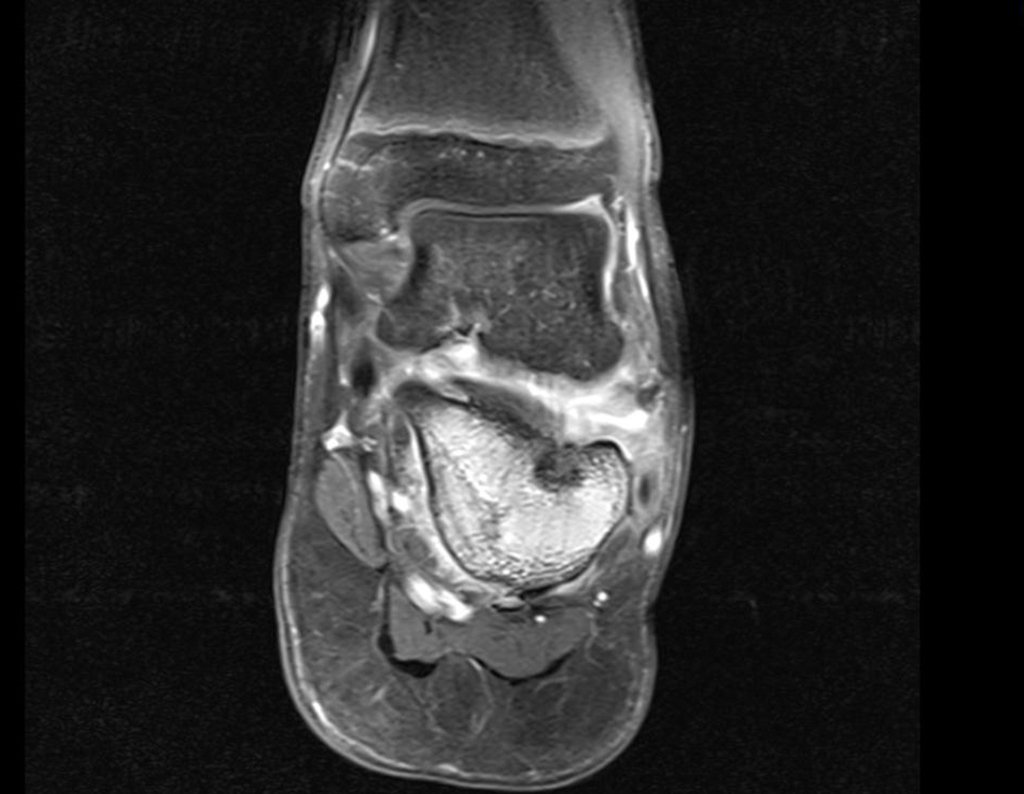
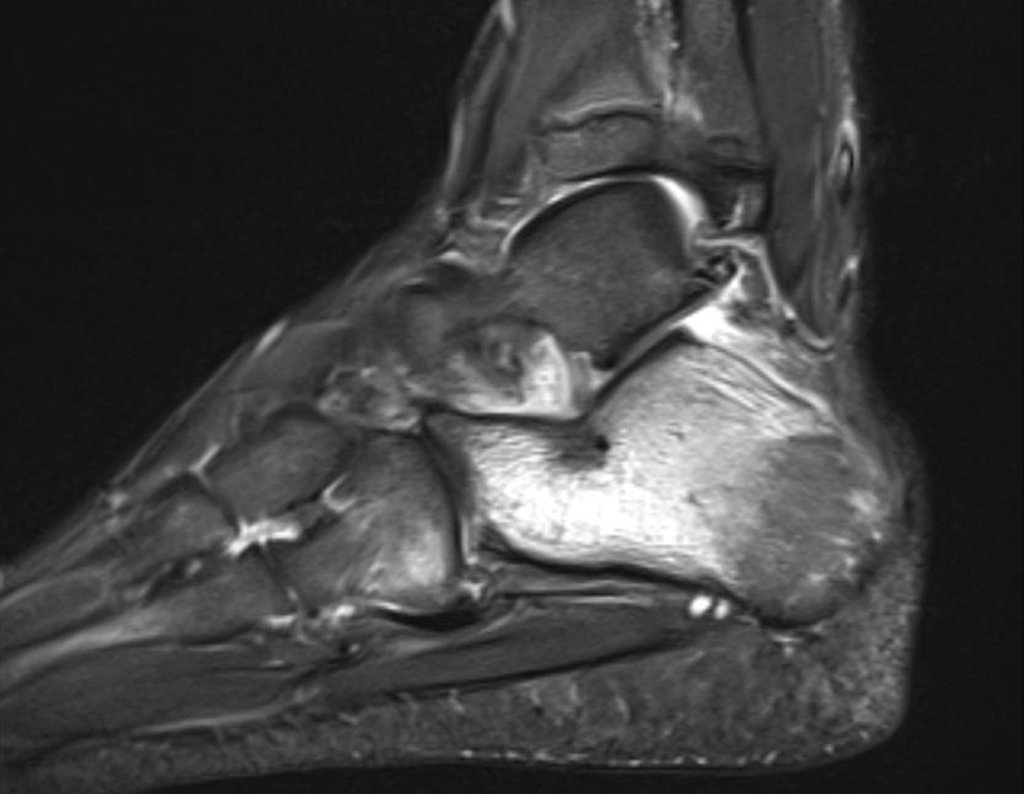
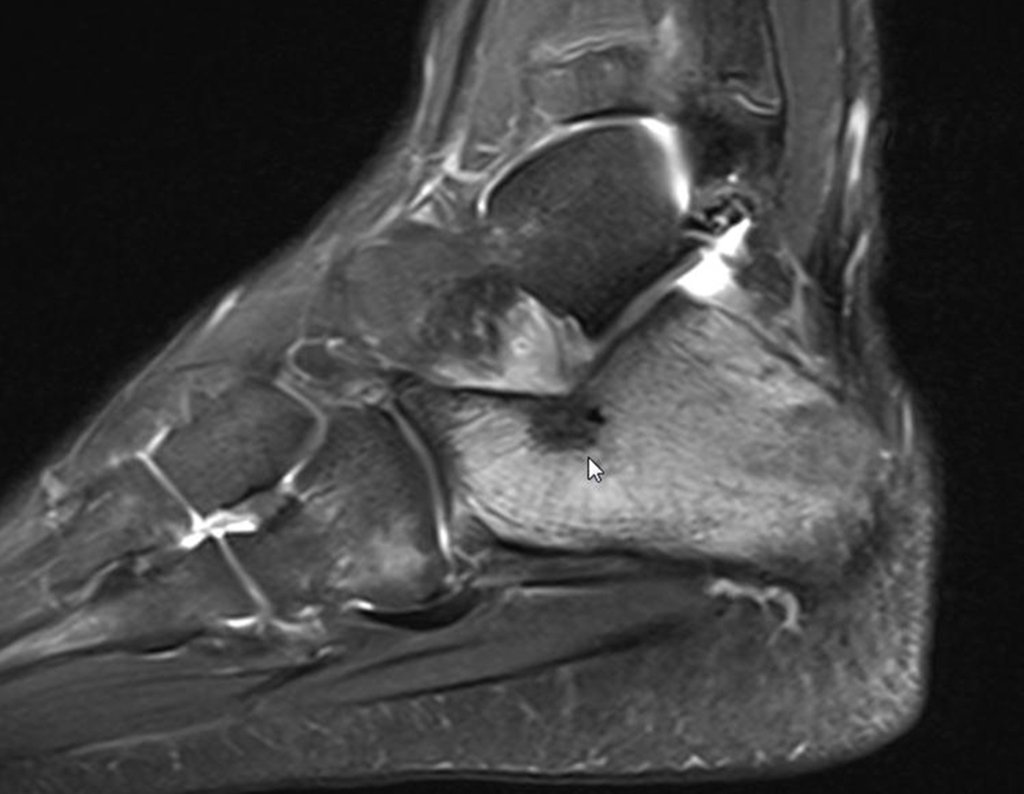
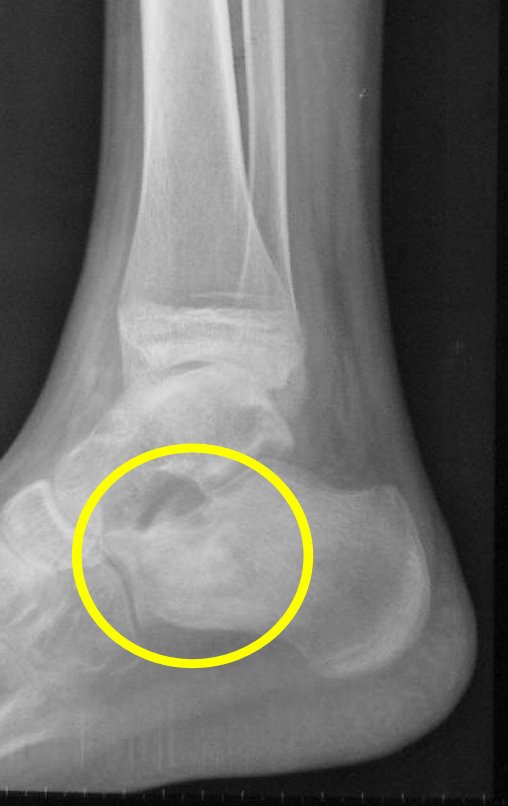
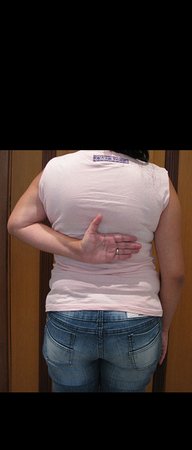
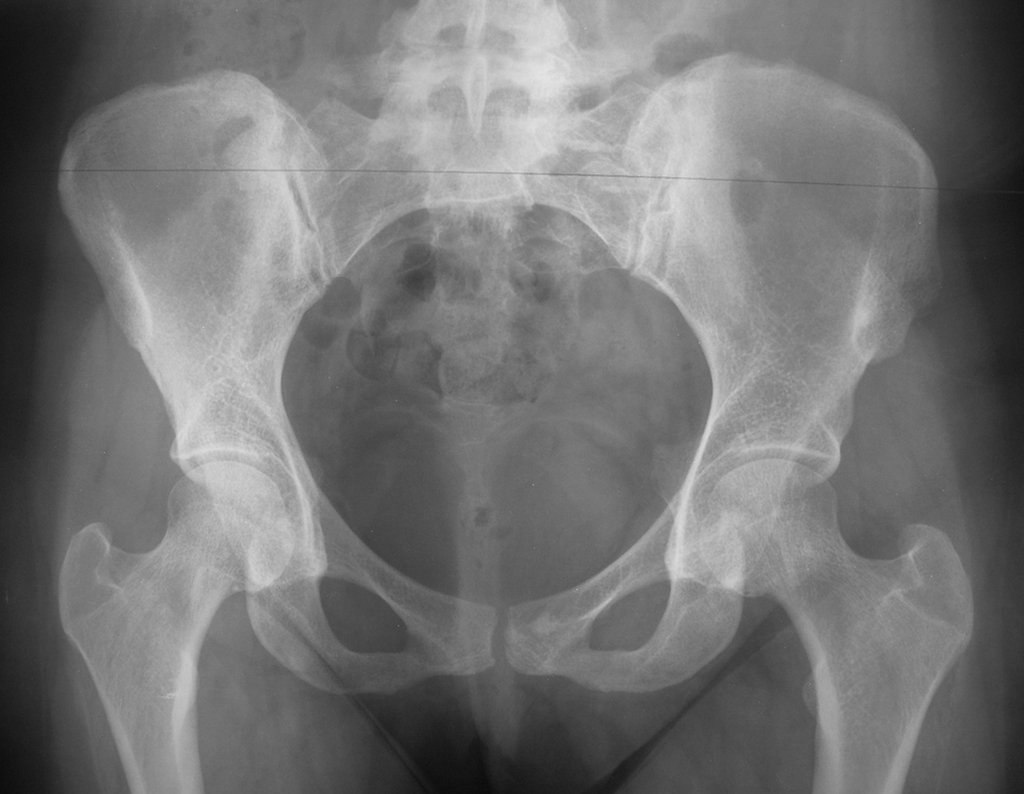
Pacientes B: Figura 5.
No ambulatório a residente pergunta:
– “Por que via de acesso devemos realizar a biópsia?”.
Vejo a imagem e pergunto-lhe: – Qual a idade da paciente?
– “Hum … Dona Maria, quantos anos a senhora tem?”
Reflito em silêncio, avaliando o desconhecimento do aprendiz. A paciente responde 67 anos DOUTOR!
… Sessenta e sete anos, lesões múltiplas, metástase? Mieloma múltiplo? Tumor marrom do hiperparatireoidismo? – Há quanto tempo ela tem os sintomas?
– “Hum … Dona Maria, há quanto tempo a senhora tem esse problema?”
No prontuário vejo anotado sintomas de dor na tuberosidade isquiática, realizado dosagem de Ca++, P++, FA, Na+, K+, eletroforese de proteínas, hemograma, VHS, glicemia, ureia, creatinina, ultrassom, radiografias, …, …
Ao examinar a paciente observo que o “tumor” é anterior, na região inguinal, e não posterior, como estava anotado no prontuário, “tuberosidade isquiática”. A paciente não havia sido examinada!!! Apresentava hérnia ínguino-crural. As imagens da radiografia da pelve representam gases do intestino. A “biópsia” resultaria em perfuração intestinal. O exame físico fez o diagnóstico.
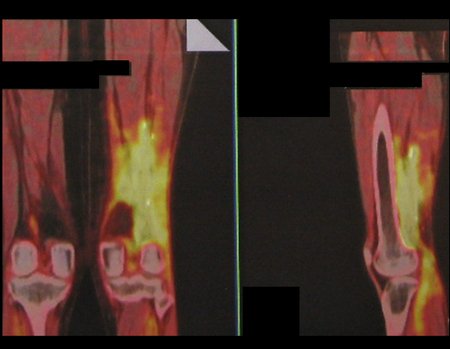
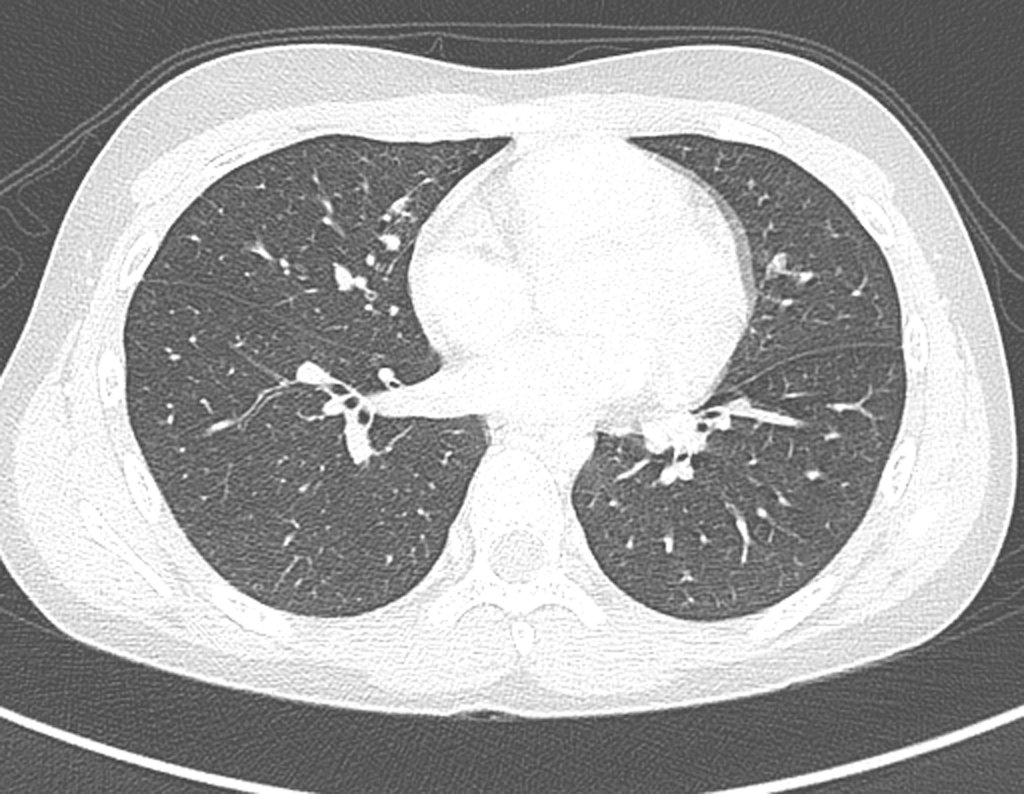
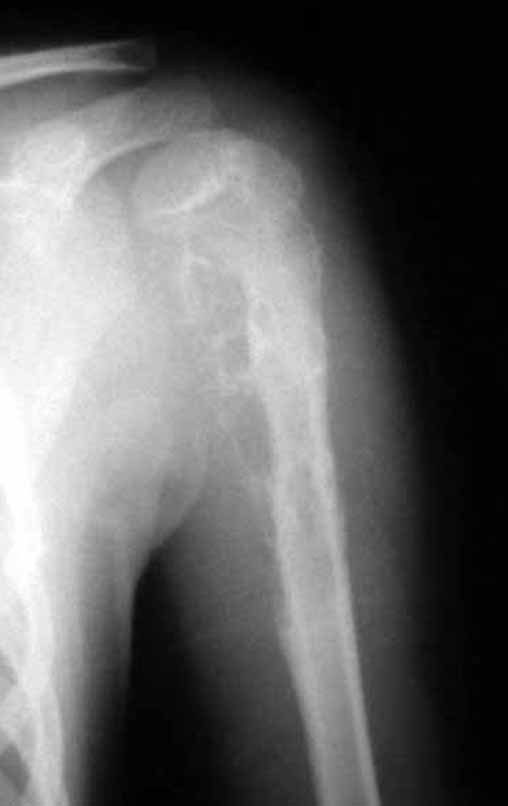
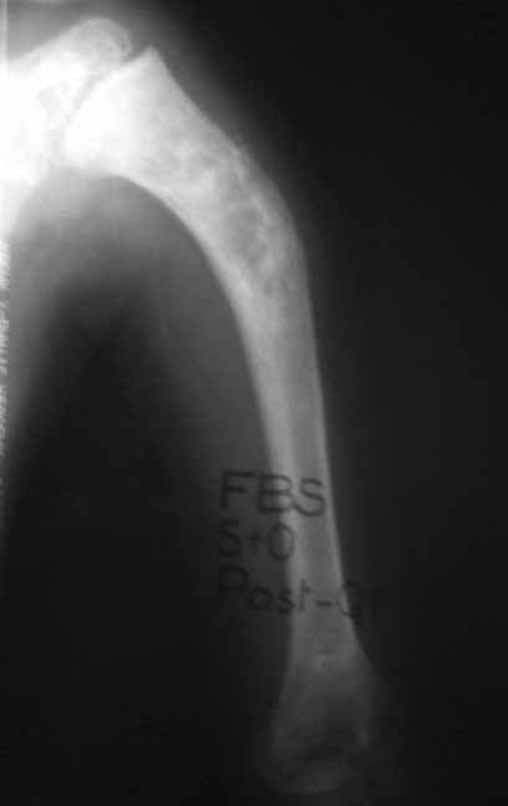
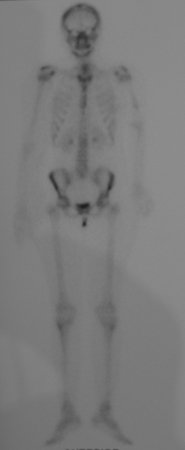
Paciente C: Figura 6.
Passando pelo pronto socorro a plantonista pergunta:
– “Doutor, que tumor o senhor acha que este paciente tem? Podemos agendar a biópsia?”.
Nenhum dado de história o residente sabia relatar e havia feito apenas a radiografia de frente!!! Perguntado, o paciente informa que os sintomas inflamatórios começaram havia seis meses, com dor calor e saída de secreção purulenta. Quando estava aberto, secretando, os sintomas melhoravam. Quando fechava a fístula começava a inchar, doer e tinha febre.
Com dificuldade, pois o paciente muitas vezes sonega informação, soubemos que ele tinha sido ferido na coxa havia dois anos, ao pular a grade de proteção de uma casa, que sangrou bastante, mas não procurou atendimento (história clínica). Pedimos uma radiografia de perfil que comprovou tratar-se de corpo estranho. A ponta da lança da grade estava envolta por reação periosteal sólida, dando a falsa impressão de tumor esclerótico. O exame de imagem adequado confirmou o diagnóstico.
Após estas importantes considerações, vamos estudar o controverso tema da biópsia.
PRECISAMOS:
1- Definir as hipóteses de possíveis diagnósticos, para o nosso caso, primeiramente com a história clínica e exame físico;
2- Realizar os exames laboratoriais e de imagens, para corroborar ou não nossas hipóteses, nosso raciocínio e
3- Somente após estas etapas, poderemos realizar a biópsia, para a patologia “reconhecer a firma” do diagnóstico, previamente pensado com a nossa anamnese, exame físico, laboratoriais e de imagem.
“A anatomia patológica não é caminho curto para o diagnóstico. Devemos correlacioná-la sempre com a clínica, exames laboratoriais e de imagem”.
Quanto à biópsia, podemos subdividir as lesões músculo esqueléticas em três grupos:
- Casos em que o diagnóstico CLÍNICO – RADIOLÓGICO (imagem) é suficiente para o diagnóstico e tratamento, não sendo indicada a biópsia.
- Casos que podem prescindir deste procedimento por dificuldade de diagnóstico histológico, e que pelas características de agressividade clínica e radiológica não se deve alterar a conduta cirúrgica necessária.
- Casos que necessitam da confirmação patológica para tratamento quimioterápico prévio à cirurgia
Vamos discorrer sobre os três grupos, analisando alguns exemplos, figuras a seguir.
GRUPOS 1 e 2: A biópsia não é necessária ou não altera a conduta.
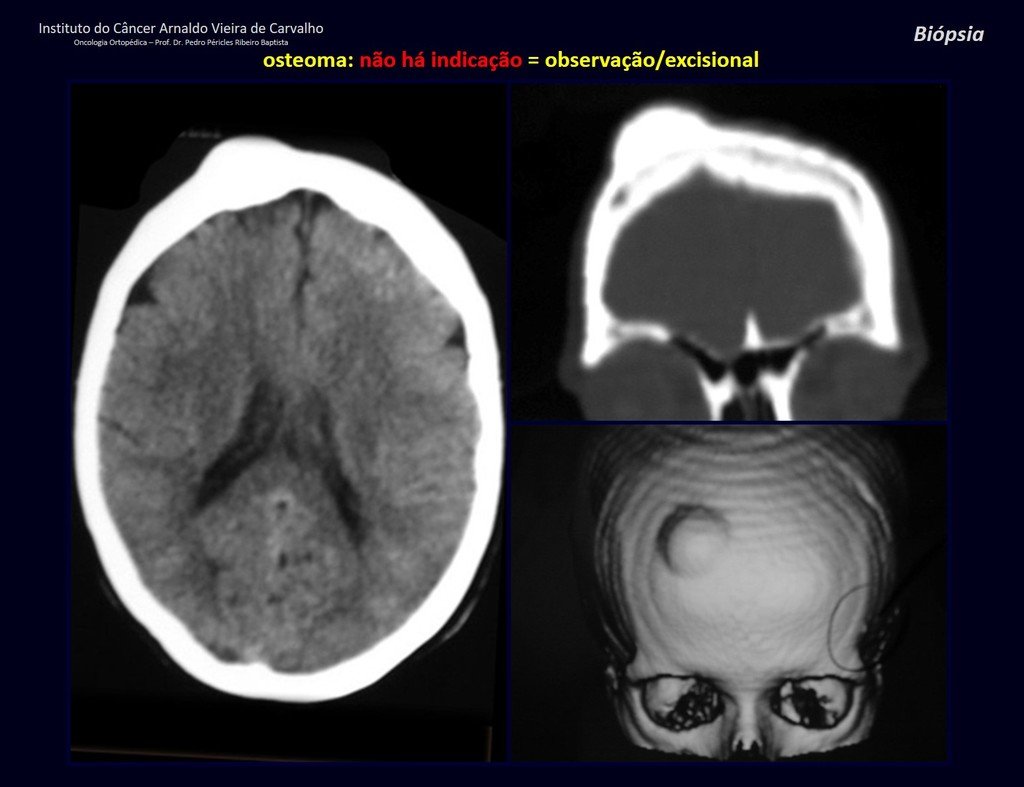
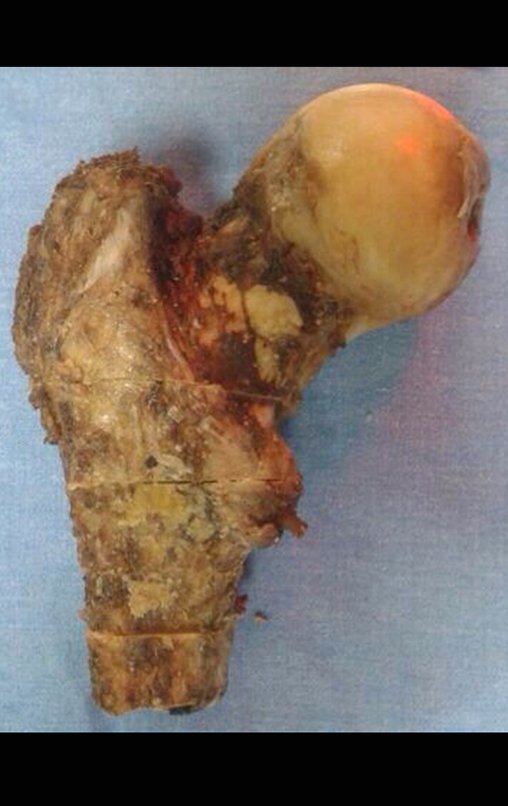
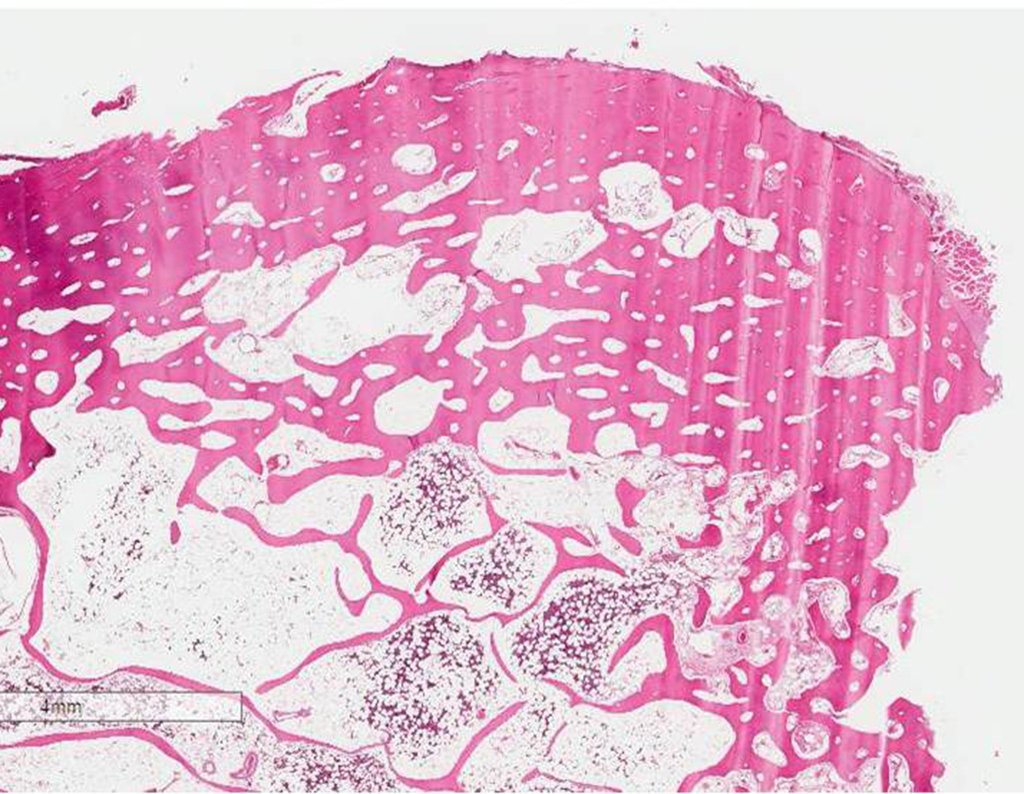
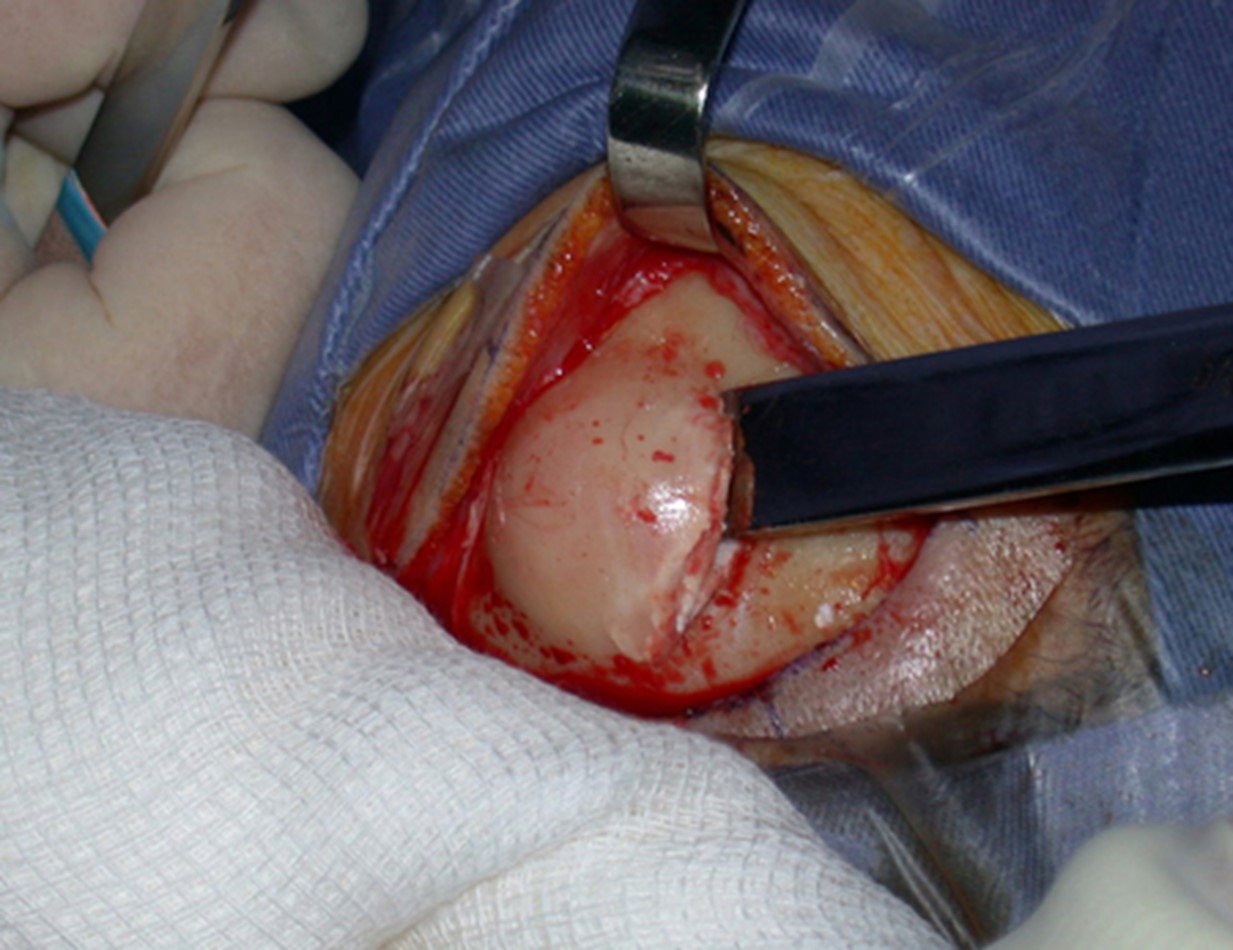
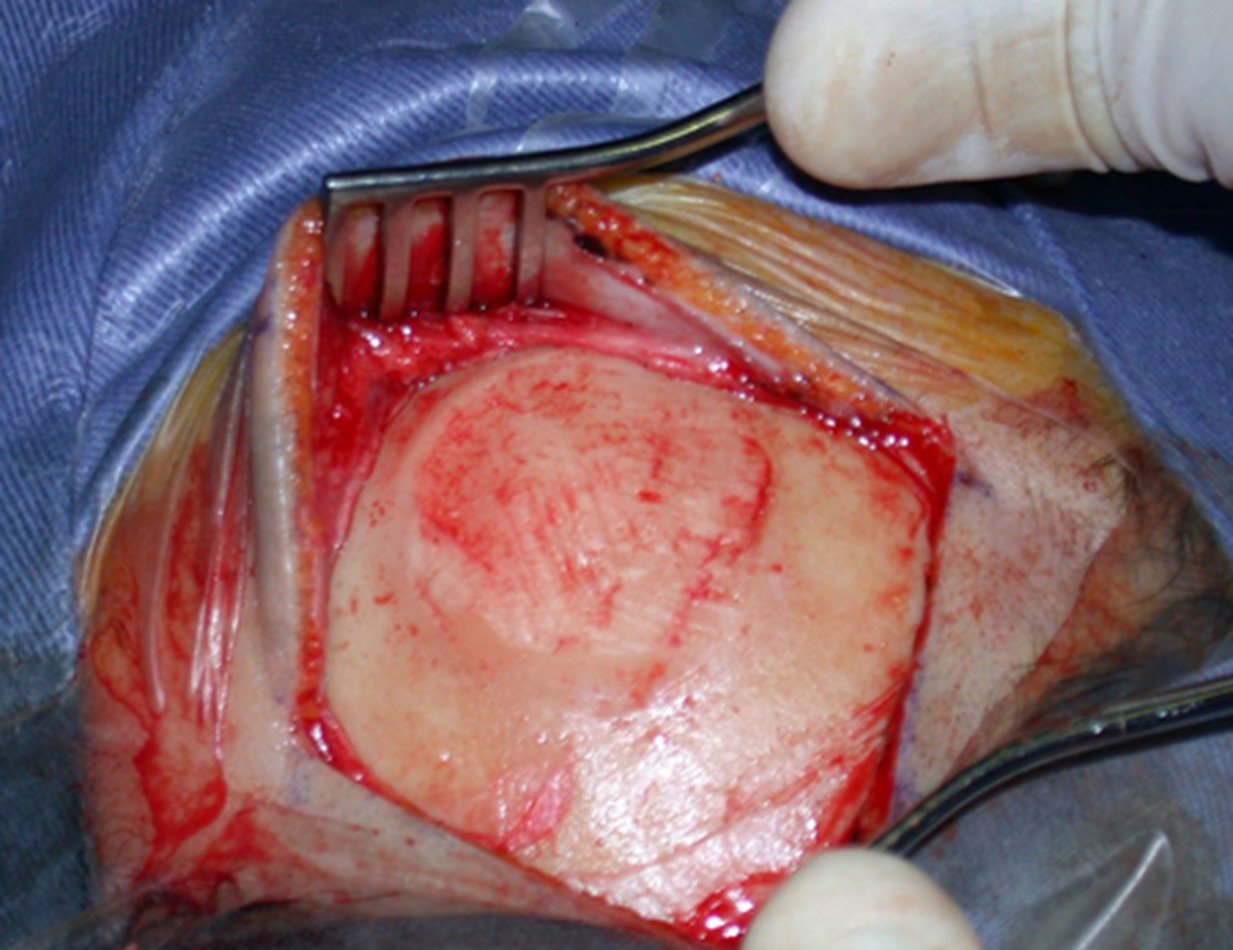
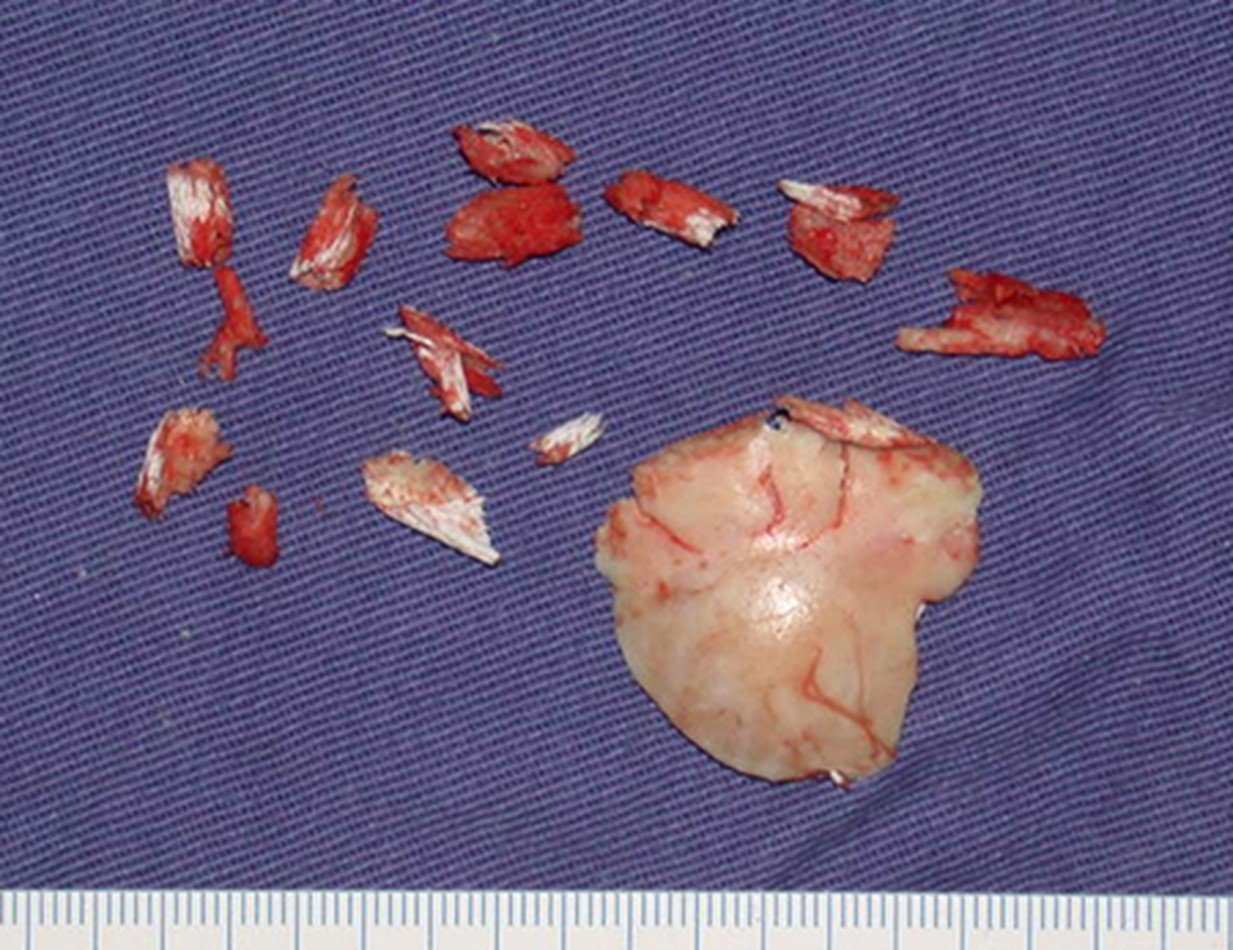
1a. OSTEOMA, figuras 13 a 18.
IDENTIDADE: Lesão neoplásica benigna, bem delimitada, caracterizada por tumor homogêneo, esclerótico e denso, tecido ósseo maduro. É osso dentro de osso.
Estas lesões são bem delimitadas, homogêneas, sem sintomas. São diagnosticadas por achados ocasionais de exames de imagem ou por apresentarem alterações estéticas. Eventualmente podem ser sintomáticos, como num caso que obstruiu a fossa nasal dificultando a respiração. O diagnóstico é clínico e radiológico, não necessitam de biópsia. O tratamento restringe-se à observação e acompanhamento. São raros e eventualmente operados.
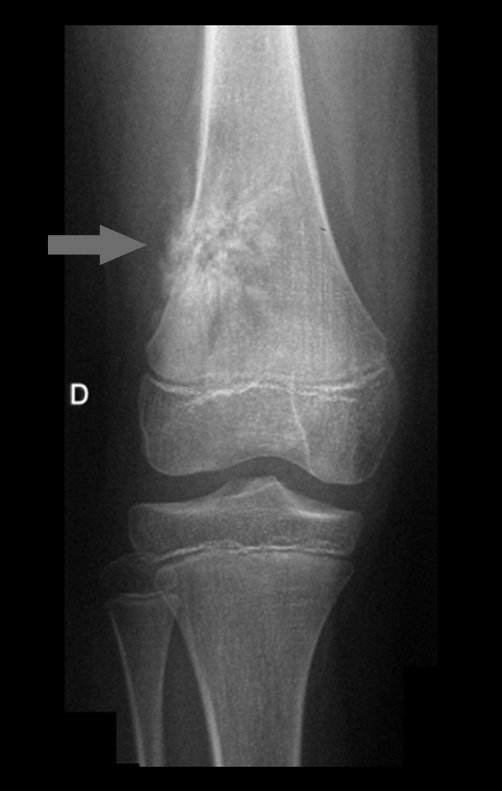
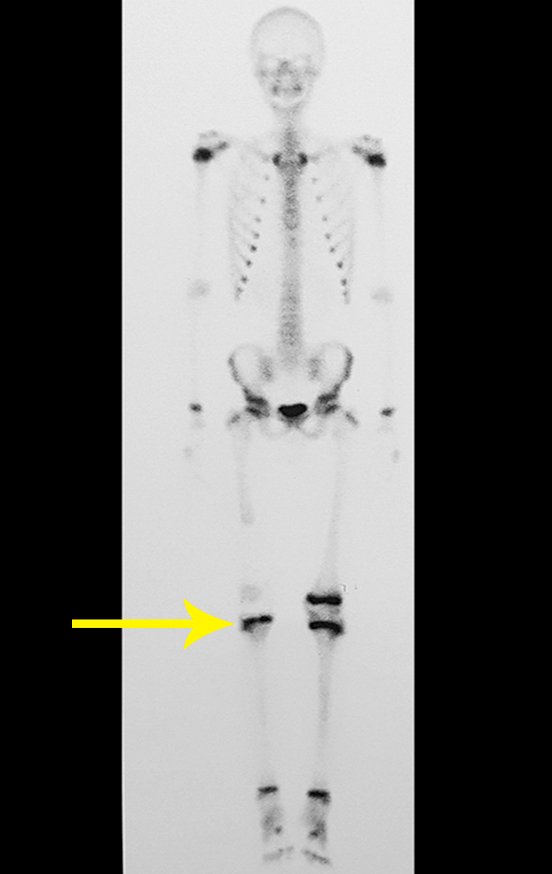
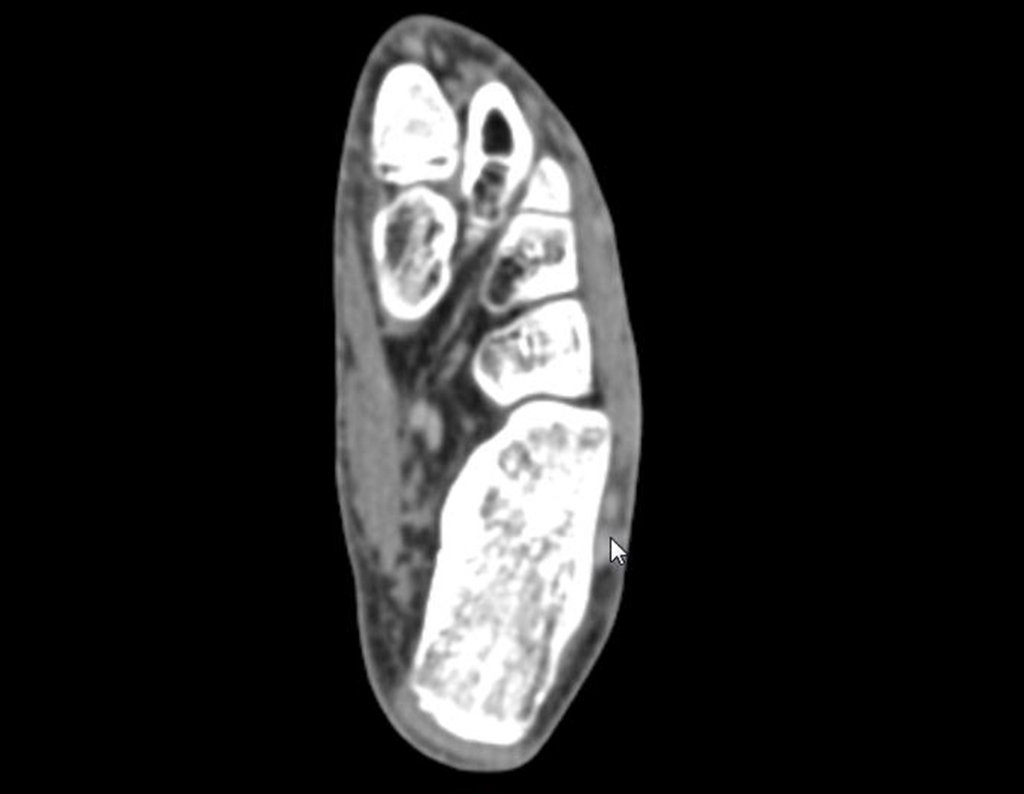
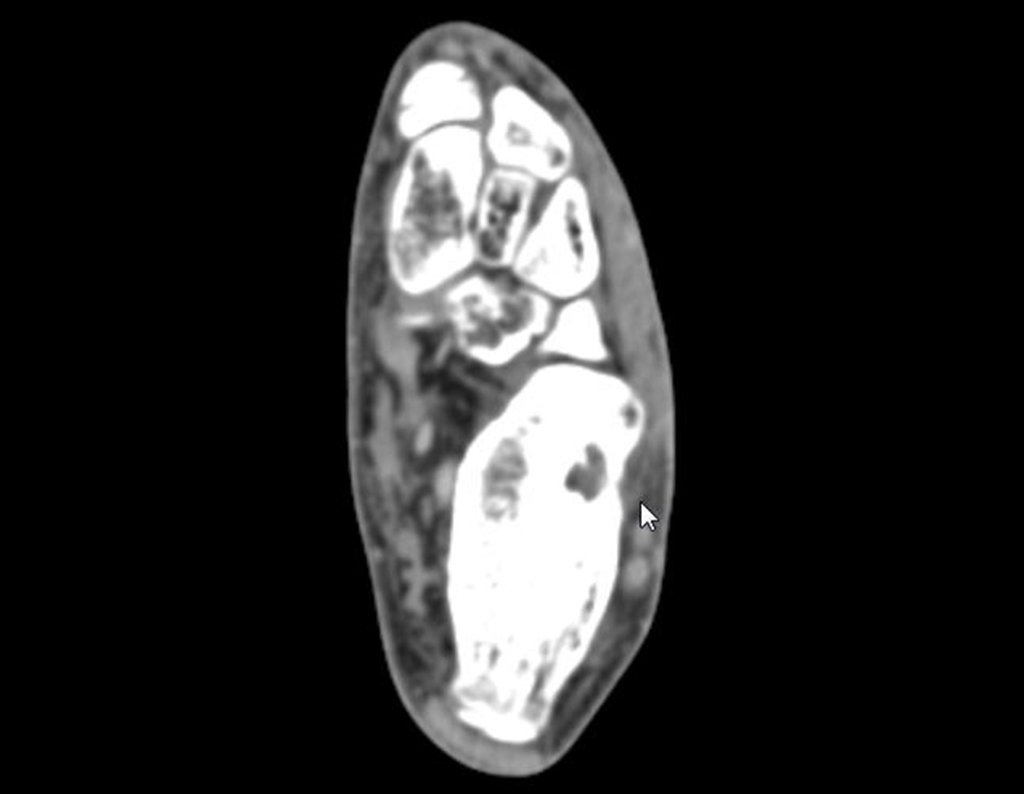
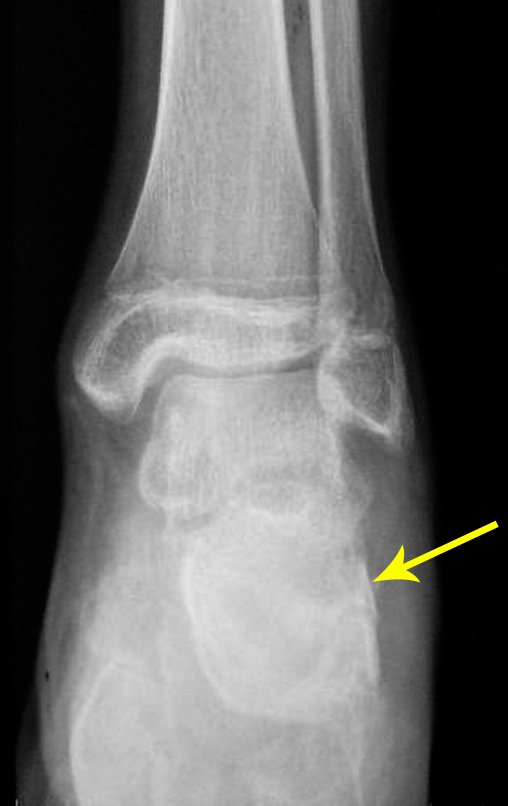
1b. OSTEOMA OSTEÓIDE, figuras 19 a 26.
IDENTIDADE: Lesão neoplásica benigna, caracterizada por um tumor circunscrito, com até aproximadamente um centímetro de diâmetro, que apresenta um nicho osteóide central, circundado por halo de esclerose e localizado na cortical dos ossos longos, parte mais compacta.
A região do colo femoral é revestida por um periósteo delgado que não apresenta reação periosteal. Isto dificulta a localização da lesão na cirurgia.
A realização de um orifício na cortical óssea, perto da lesão, guiado por radioscopia, facilitará a operação.
Após esta marcação, fazemos uma tomografia para mensurar a distância do orifício ao centro da lesão, localizando-o. Veja a técnica completa em: http://técnica de ressecção de osteoma osteóide
O osteoma osteóide é uma lesão da cortical óssea. Na coluna vertebral ocorre no pedículo, que é a parte mais compacta, mais dura, assemelhando-se à cortical.
Apresenta um nicho central com halo de esclerose ao redor e não ultrapassa um centímetro.
Não existe “osteoma osteóide gigante”, maior que 1,5 cm, pois nesta situação há erosão da cortical, não há delimitação pelo halo de esclerose e, apesar de poder apresentar histologia semelhante, estamos diante de um osteoblastoma, que é uma lesão benigna, porém agressiva localmente. O osteoblastoma pode ou não estar associado a um cisto ósseo aneurismático e ainda fazer diagnóstico diferencial com osteossarcoma teleangiectásico. Leia também: http://osteoma osteóide
1c. OSTEOCONDROMA, figuras 27 a 32.
IDENTIDADE: É uma exostose em que o osso esponjoso central continua-se com a medular do osso afetado e a camada densa periférica, cortical do tumor, continua-se com a cortical do osso comprometido. Apresenta-se com base alargada, séssil, ou estreita, pediculada. Pode ser único ou múltiplo (osteocondromatose hereditária).
Os osteocondromas são de tratamento cirúrgico quando alteram a estética ou a função, deslocando e comprimindo estruturas vásculo-nervosas, limitando os movimentos ou gerando deformidades angulares. É a lesão óssea benigna mais frequente.
Geralmente crescem enquanto o paciente encontra-se em fase de crescimento. Quando um osteocondroma aumenta de tamanho, depois de terminada a maturidade esquelética pode significar bursite pós-traumática ou malignização para condrossarcoma e deve ser tratado como tal, ressecando-se com margem oncológica.
O osteocondroma solitário apresenta 1% de taxa de malignização. A osteocondromatose múltipla, pode chegar a 10%.
O diagnóstico do osteocondroma é clínico e radiológico e não necessita de biópsia para o seu tratamento.
Leia: http://osteocondroma
1d. CONDROMA, figuras 33 a 50.
IDENTIDADE: Tumor benigno, indolor, formador de cartilagem com focos de calcificação nos ossos curtos das mãos e pés, diagnosticado por acaso ou devido à deformidade ou fratura. Pode ser solitário ou múltiplo (encondromatose, síndrome de Maffucci, doença de Ollier).
Nos dedos das mãos e dos pés, as lesões cartilaginosas geralmente têm comportamento benigno.
A eventual evolução indesejada para um condrossarcoma, de uma cirurgia de curetagem nestas localizações, não compromete a possibilidade de cura, pois a ressecção completa do dedo, que é o tratamento do condrossarcoma, continuaria sendo possível.
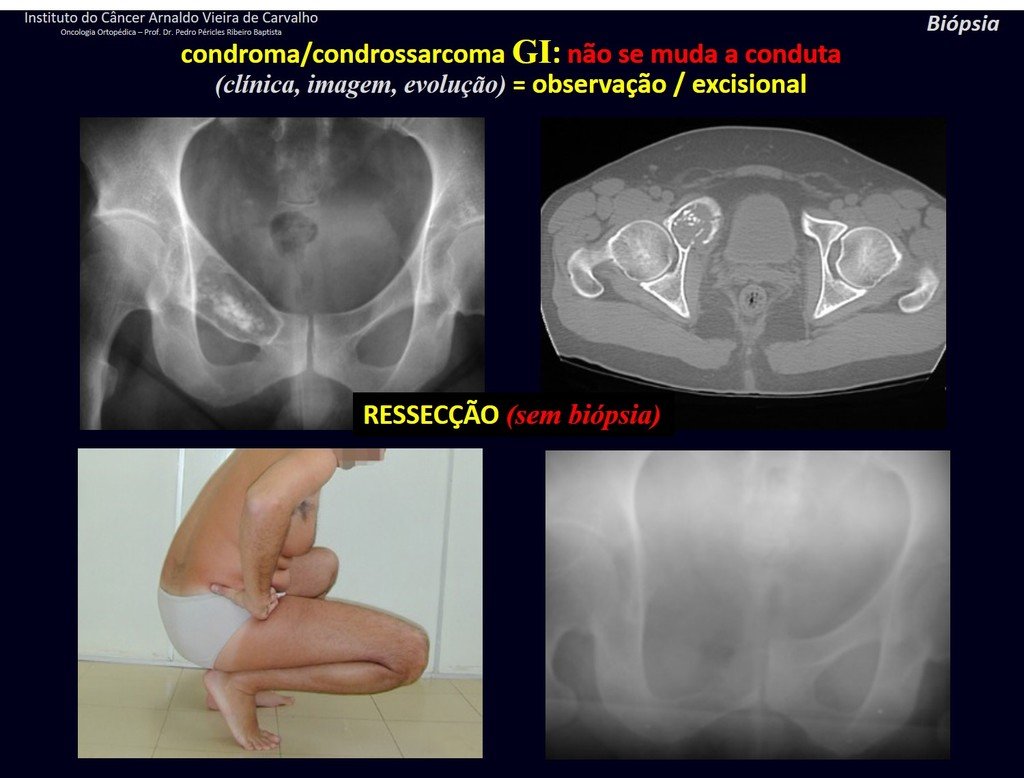
CONTROVÉRSIA: CONDROMA OU CONDROSSARCOMA GRAU I?
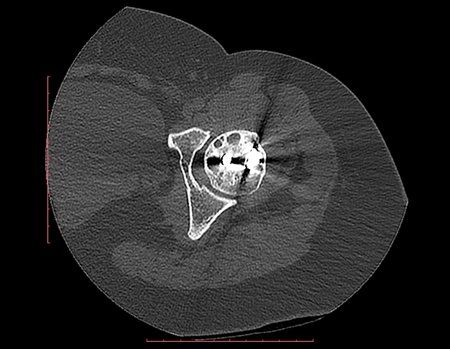
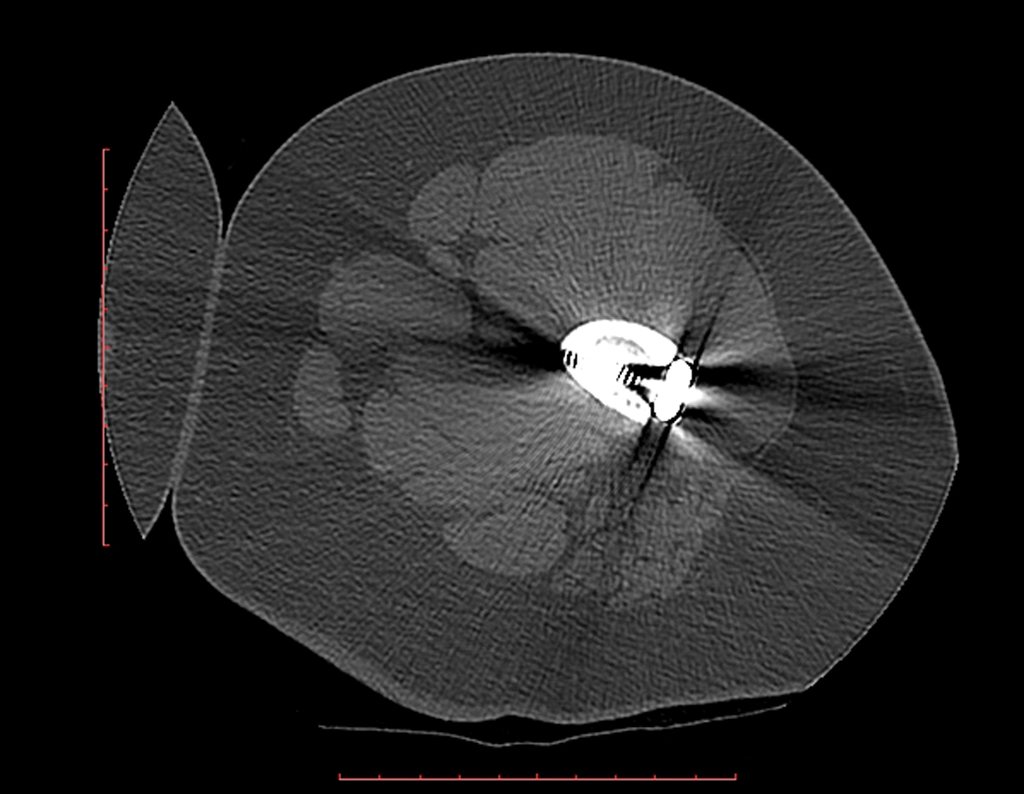
O condroma ocorre eventualmente na metáfise dos ossos longos (fêmur distal, úmero e tíbia proximal) e raízes dos membros (ombro, pelve). Nestes casos, pode confundir-se com infarto ósseo ou condrossarcoma grau I.
Nos achados ocasionais, como o diagnóstico anatomopatológico entre condroma e condrossarcoma grau I é controverso, é preferível não realizar a biópsia e acompanhar clínica e radiograficamente se há evolução.
O condrossarcoma grau I é de evolução lenta, o que permite este acompanhamento, possibilitando a observação para o diagnóstico seguro da sua atividade ou não.
Repete-se os exames com um, três e seis meses, e depois anualmente. O tumor deve ser tratado cirurgicamente como condrossarcoma em qualquer momento, se a comparação entre as imagens revelar alteração da lesão.
Caso a lesão continue inalterada, a melhor conduta é continuar acompanhando. Alguns pacientes questionam até quando? A resposta é: – Sempre. A reavaliação deverá continuar de qualquer forma, quer o paciente seja operado ou não.
Tratar uma lesão, assintomática, achado casual, sem mudança de imagem com cirurgia menor é “overtreatment”, o qual também precisará de acompanhamento ou pior, caso o anatomopatológico revelar histologia maligna.
Exemplificando esta conduta, vamos analisar o seguinte caso, acompanhado há 14 anos, figuras 39 a 42.
CONDROMA ou CONDROSSARCOMA? Nestes casos o bom senso deve prevalecer, ele nos adverte que o papel aceita qualquer escrita.
Devemos nos basear no comportamento clínico da lesão. Houve ou não alteração? De uma eventual biópsia, que se optar por realizar, só poderemos acrescentar que se trata ou não de uma “lesão cartilaginosa”. Não podemos mudar a nossa conduta: OBSERVAR OU OPERAR COMO CONDROSSARCOMA. Por segurança, se optarmos por operar, devemos tratar cirurgicamente como condrossarcoma, que é a nossa única “ferramenta”, pois não respondem à quimioterapia nem à radioterapia.
Continuando, analisemos as figuras 43 a 50.



A mensagem que pretendemos deixar é:
¨O médico pode realizar a biópsia, pois é uma conduta acadêmica, que lhe dá mais respaldo quanto a ser uma lesão cartilaginosa. Mas não deve operar com técnica de curetagem, como condroma, pois os condromas latentes dos ossos longos, achados casuais não requerem tratamento cirúrgico e sim observação. A biópsia atrapalha esta observação pois não saberemos se a dor e alteração da imagem, que eventualmente ocorrer posteriormente à biópsia, seria devido a agressão da biópsia ou se é um condrossarcoma manifestando-se. Concluindo, se o médico optar por intervir, deve operar como condrossarcoma. Lembramos ainda que a cirurgia, realizada por qualquer técnica, não eliminará a necessidade de observação e acompanhamento¨.
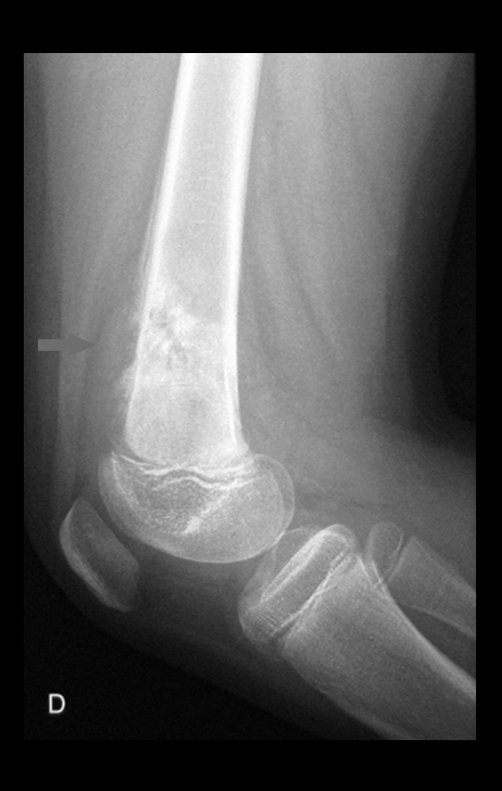
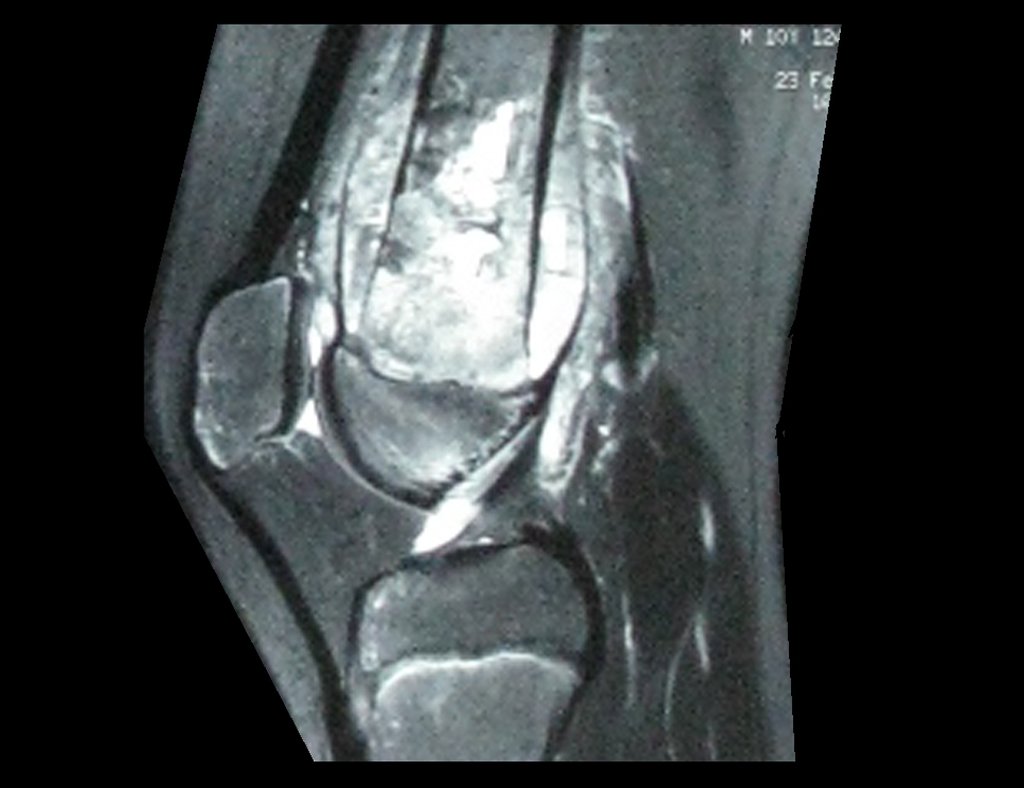
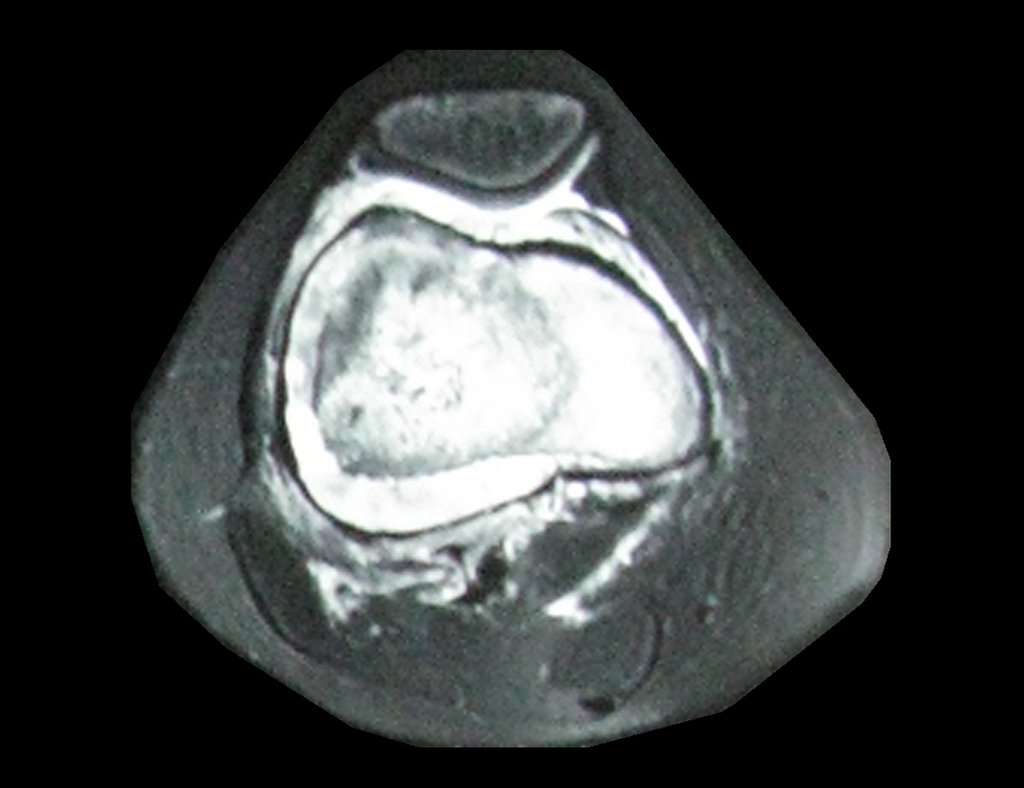
1e. CONDROBLASTOMA, figuras 51 a 54.
IDENTIDADE: Lesão neoplásica epifisária benigna, do esqueleto em crescimento, (1a e 2a décadas), caracterizada por rarefação óssea, erosão da cartilagem articular com insuflação, células cartilaginosas (condroblastos), células gigantes e focos de calcificação.
1f. CISTO ÓSSEO SIMPLES – C.O.S. , figuras 55 a 58.
IDENTIDADE: Lesão pseudoneoplásica, unicameral, circundada por membrana, bem delimitada, preenchida com líquido seroso, de localização metafisária central, que não ultrapassa a sua largura e ocorre em crianças e adolescentes.
Leia: http://cisto ósseo simples
1g. CISTO ÓSSEO JUSTAARTICULAR – GANGLION, figuras 59 a 62.
IDENTIDADE: Lesão pseudoneoplásica, de localização epifisária, unicameral, circundada por membrana sinovial, bem delimitada e preenchida com líquido seroso, que se comunica com a articulação adjacente.
Estas lesões não requerem a realização de biópsia para o tratamento.
1h. DEFEITO FIBROSO CORTICAL / FIBROMA NÃO OSSIFICANTE, figuras 63 e 64.
IDENTIDADE: Lesão pseudoneoplásica na cortical óssea de limites precisos, assintomática. Achado ocasional.
1i. DISPLASIA FIBROSA DA TÍBIA / OSTEOFIBRODISPLASIA, figuras 65 a 70.
IDENTIDADE: Lesão pseudoneoplásica na diáfise da tíbia com rarefação óssea de densidade intermediária, como se o osso tivesse sido “apagado”, aspecto de vidro fosco. Pode ocorrer em mais de uma localização. Sua evolução é variável podendo causar deformidade, desdiferenciar-se ou ter um crescimento harmônico, estabilizando-se na maturidade esquelética.
1J. MIOSITE OSSIFICANTE, figuras 71 e 72.
IDENTIDADE: Lesão localizada próxima de um osso e em tecidos moles, relacionada a traumatismo pregresso, cuja ossificação inicia-se na periferia.
1k. TUMOR DE TECIDOS MOLES – ALGUNS, figuras 73 a 78.
IDENTIDADE: Lesões delimitadas, homogêneas, com imagens típicas, sem captação de contraste ou com captação apenas na periferia, podem ser operadas sem biópsia prévia, quando a conduta cirúrgica não seria diferente, mesmo em tratando-se de neoplasia maligna.
Os tumores malignos de tecidos moles teriam o mesmo procedimento de ressecção cirúrgica, com as margens exíguas apresentadas no caso acima e seriam complementados com radioterapia local. Os sarcomas de tecidos moles, até o presente momento, não respondem a quimioterapia nem apresentam melhora no índice de sobrevivência do paciente.
Uma eventual biópsia poderia provocar lesão nervosa e não mudaria a conduta.
A biópsia pode ser realizada, é acadêmica, complementa os estudos do caso, mas a conduta cirúrgica de ressecção deve prevalecer, mesmo em se tratando de neoplasia maligna. Os sarcomas de tecidos moles, até o presente momento, não se beneficiam com tratamento neoadjuvante e a cirurgia ablativa não altera a sobrevivência.
GRUPOS 3: A biópsia é necessária para o tratamento (cirurgia; com/ sem neoadjuvancia)
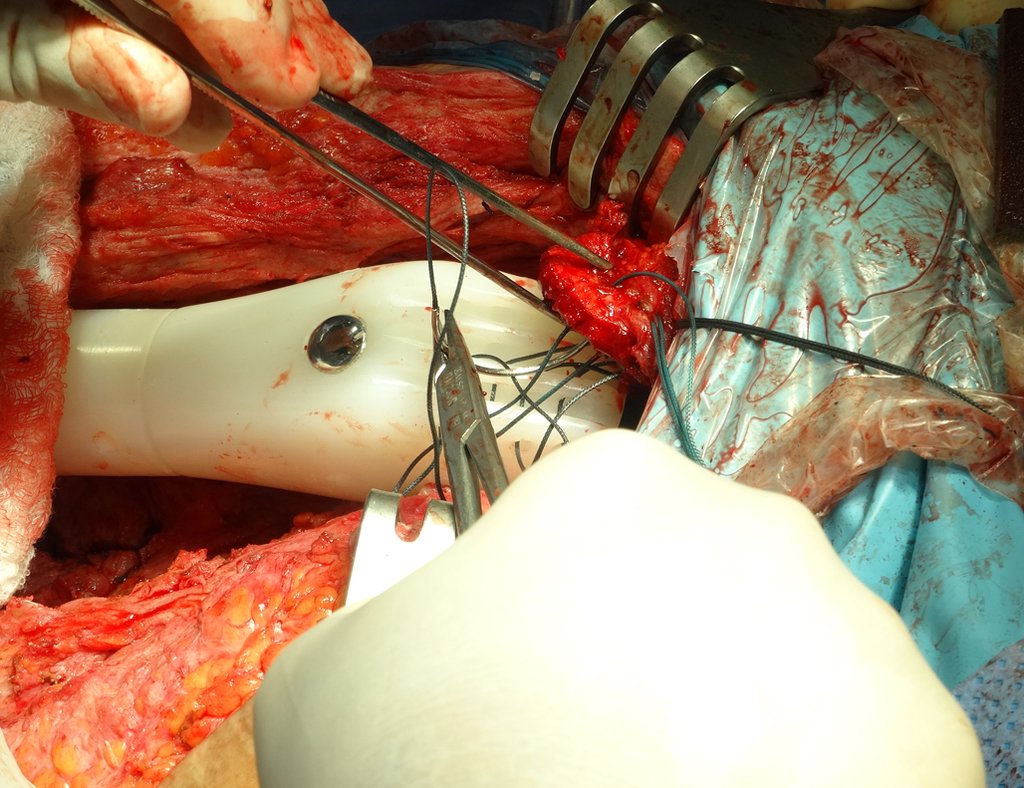
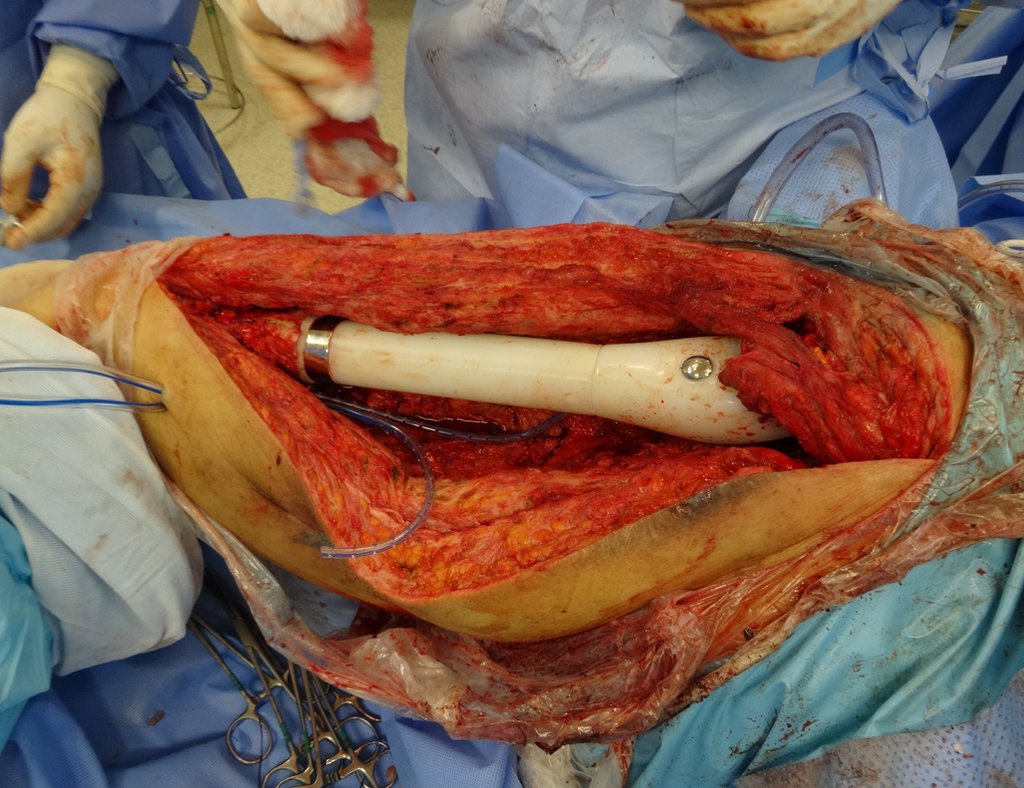
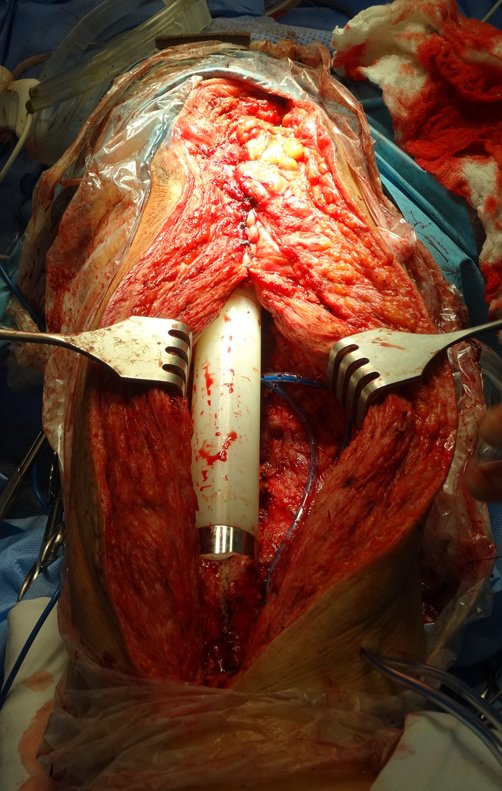
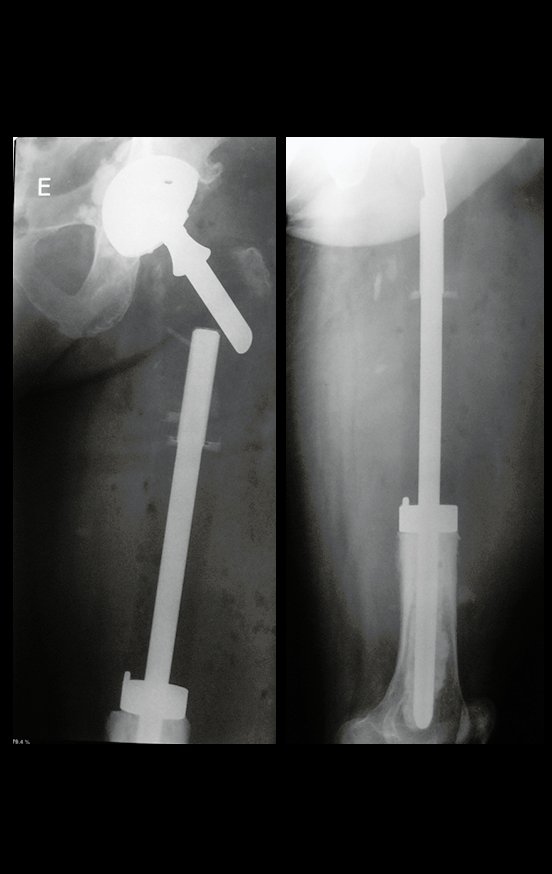
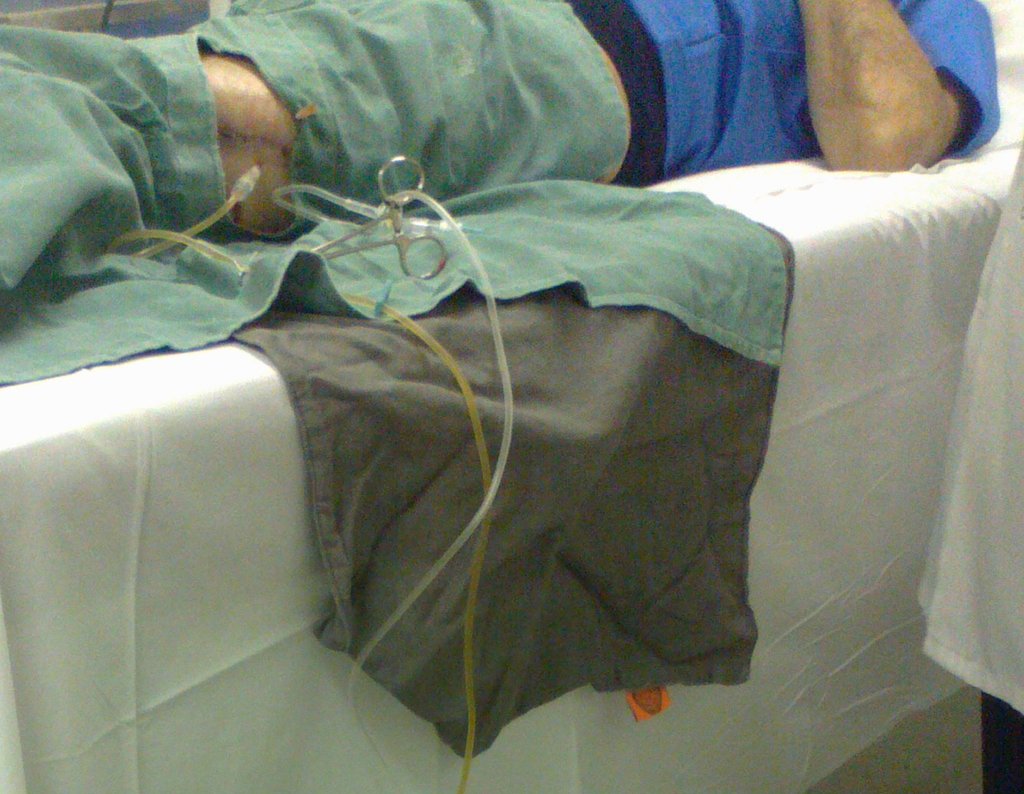
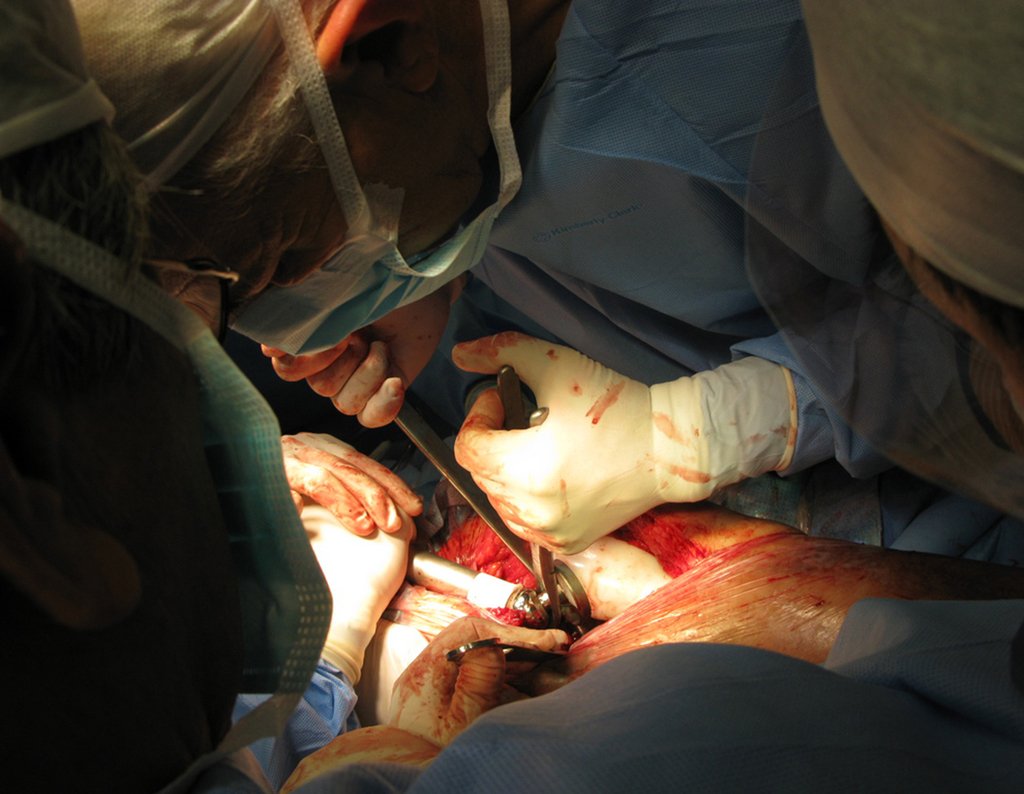
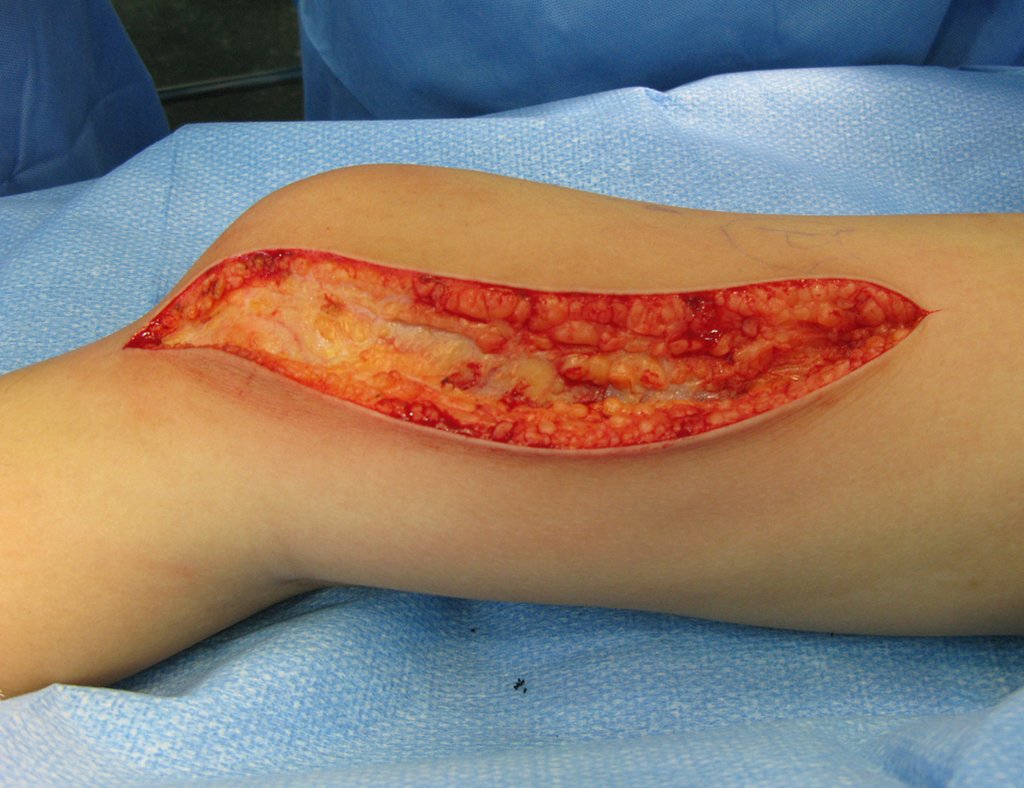
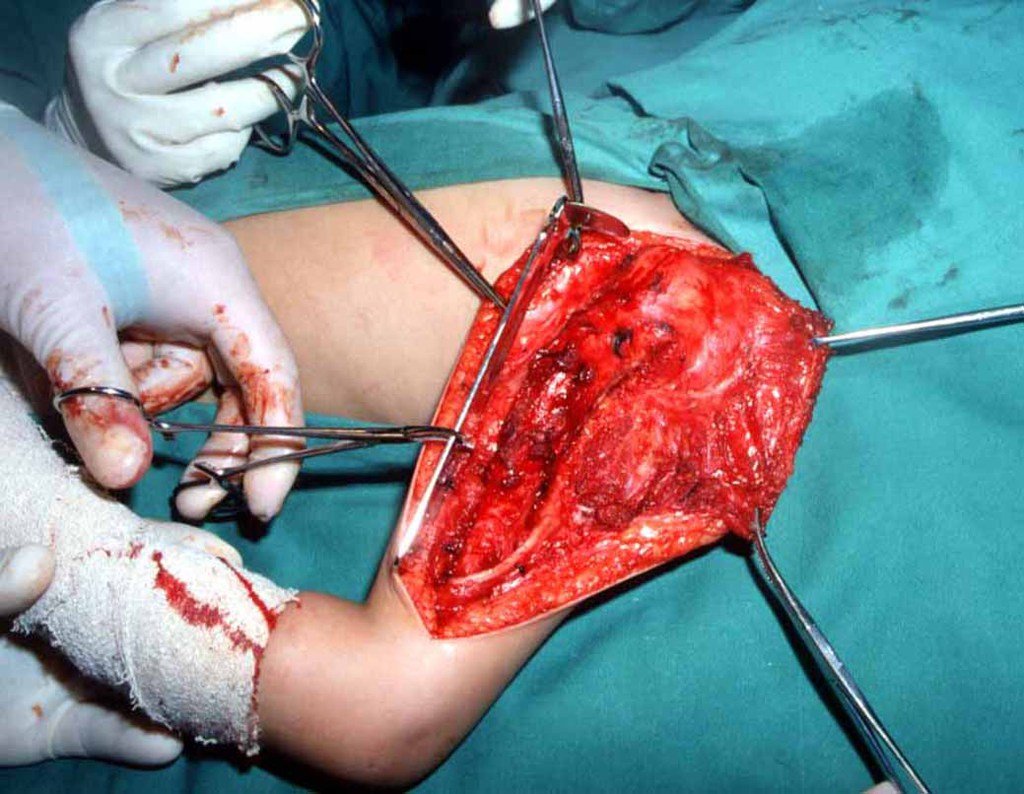
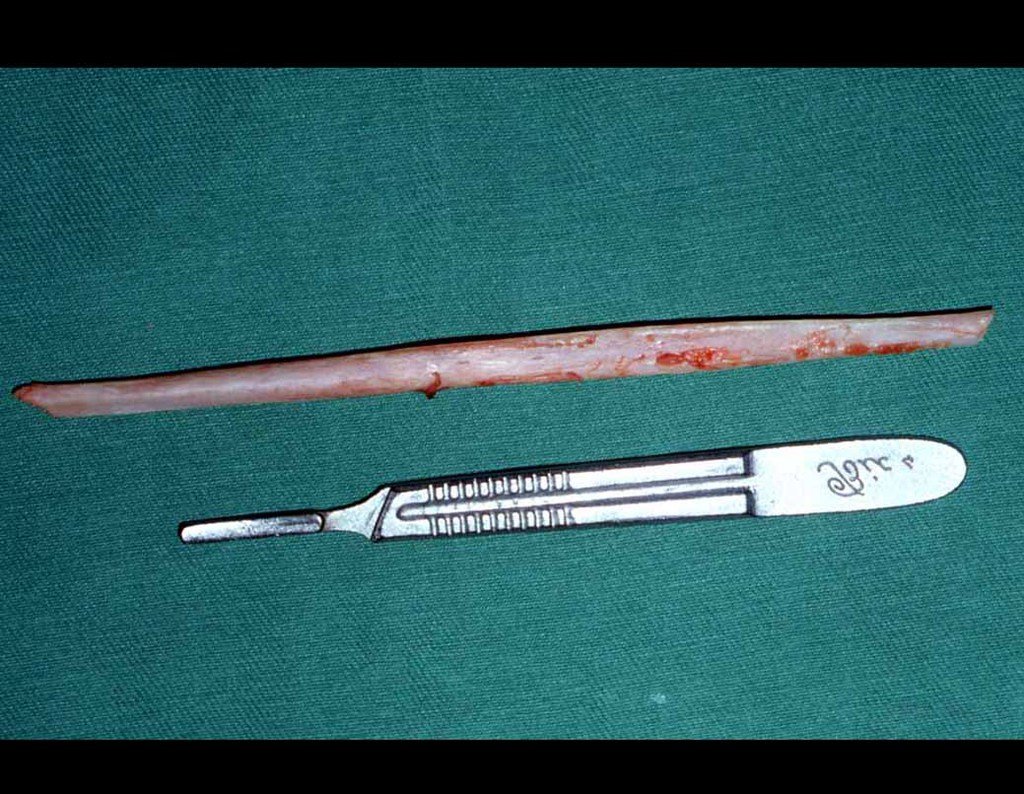
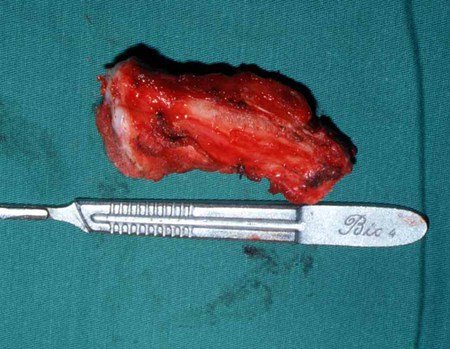
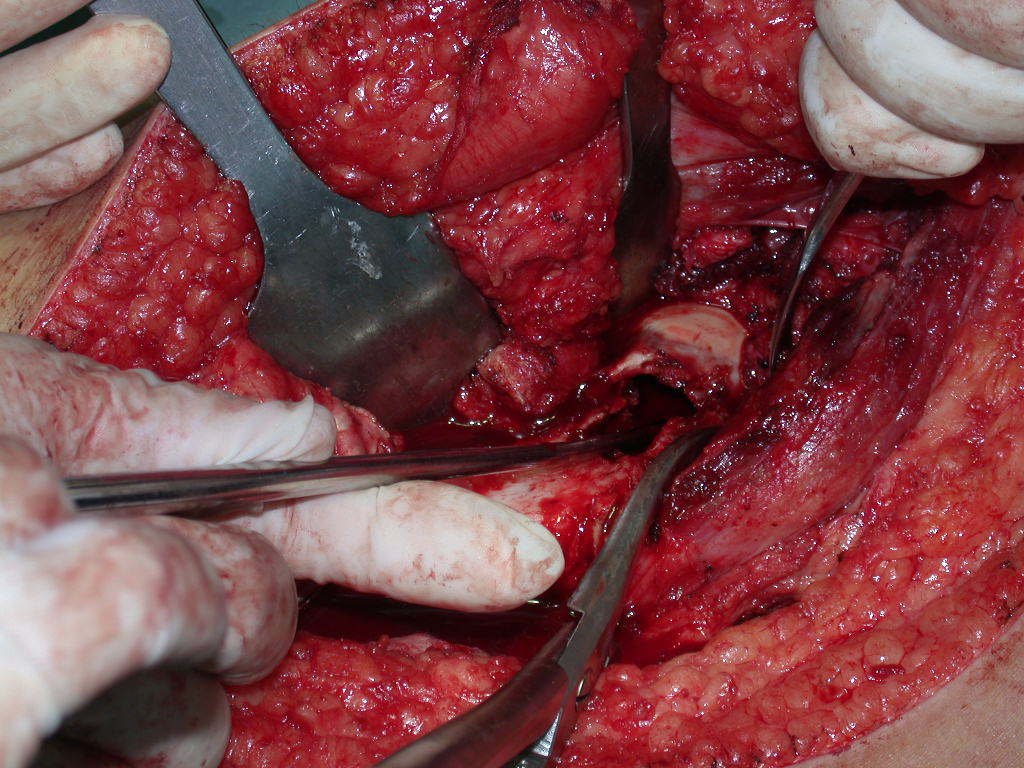
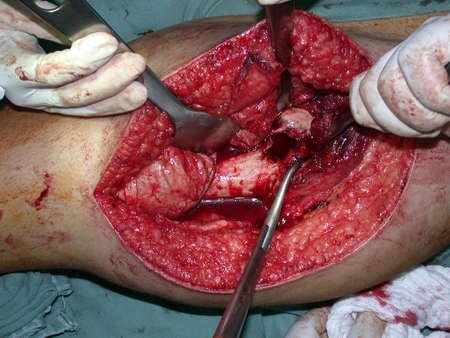
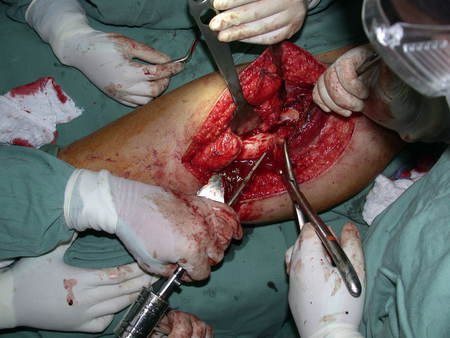
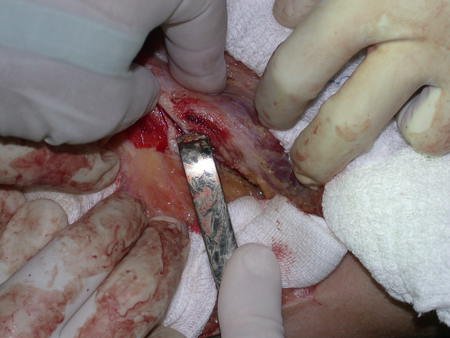
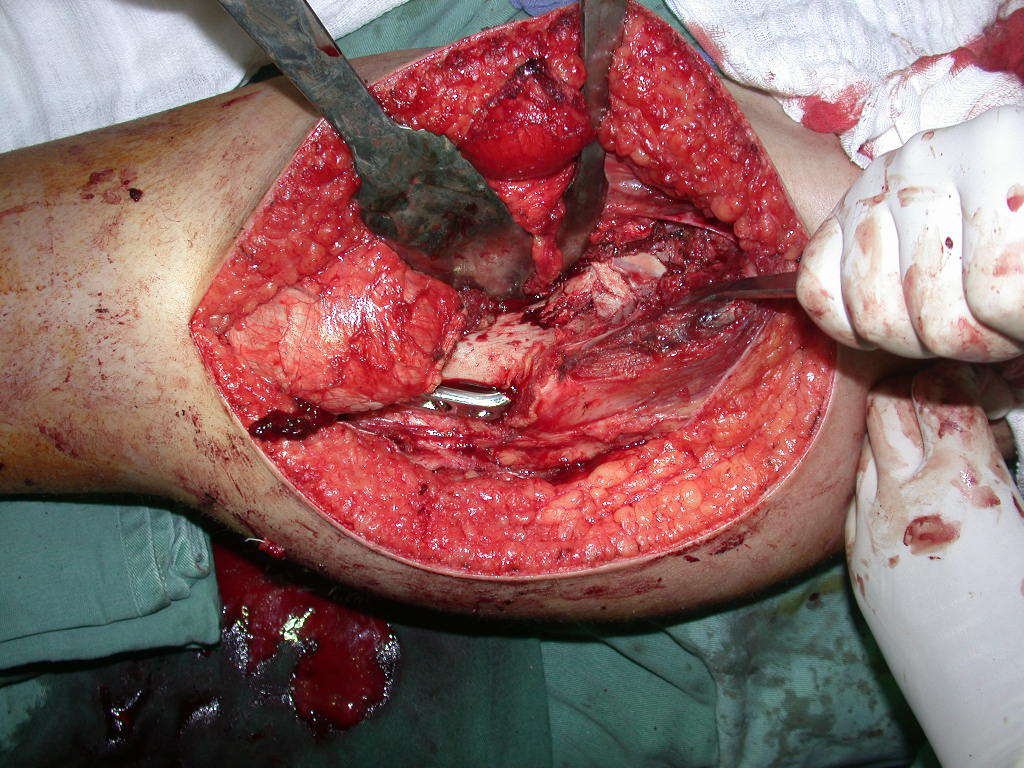
Precisamos ressaltar que a biópsia deve ser executada/acompanhada pelo cirurgião que vai realizar a cirurgia. Sua presença é essencial para que esta seja realizada de acordo com o planejamento da cirurgia.
Não se deve realizar incisões transversas, nem incisões extensas onde não há musculatura para posterior cobertura, como na perna por exemplo. A sutura não deve ter pontos distantes da incisão, pois isto exigirá uma ressecção mais larga de tecido e muito menos realizar-se mais de uma incisão, figuras 79 (quadros A, B, C e D) e 80.
Veja o caso completo da figura 80 em: http://tgc-prótese intraepifisária
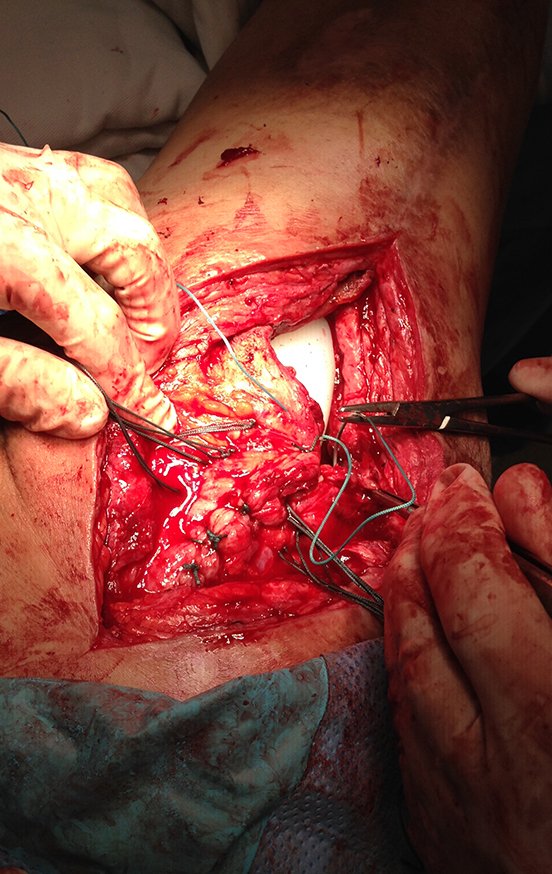
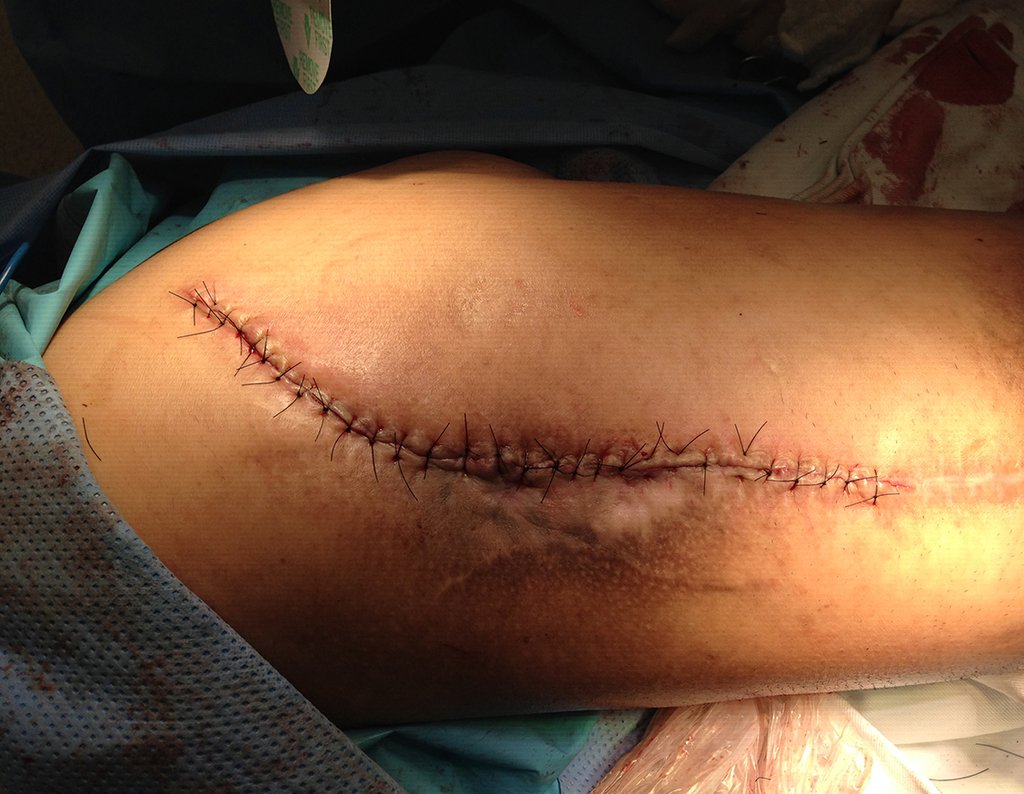
A seguir, exemplificamos dois casos de biópsias realizadas corretamente, figuras 83 a 86.
*Veja o caso completo da figura 83 e 84 em: http://transplante de cartilagem de crescimento
*Veja o caso completo da figura 85 e 86 em: http://prótese parcial rotatória
PLANEJAMENTO E EXECUÇÃO DAS BIÓPSIAS: CONSIDERAÇÕES – COMO EXECUTAR
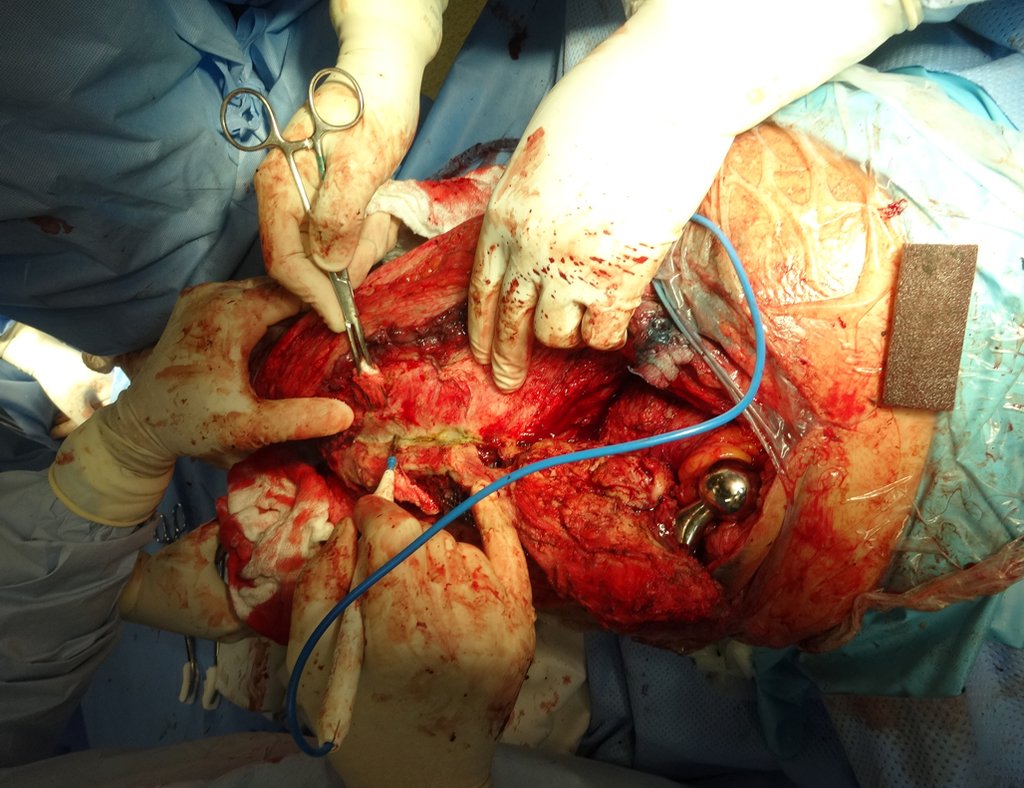
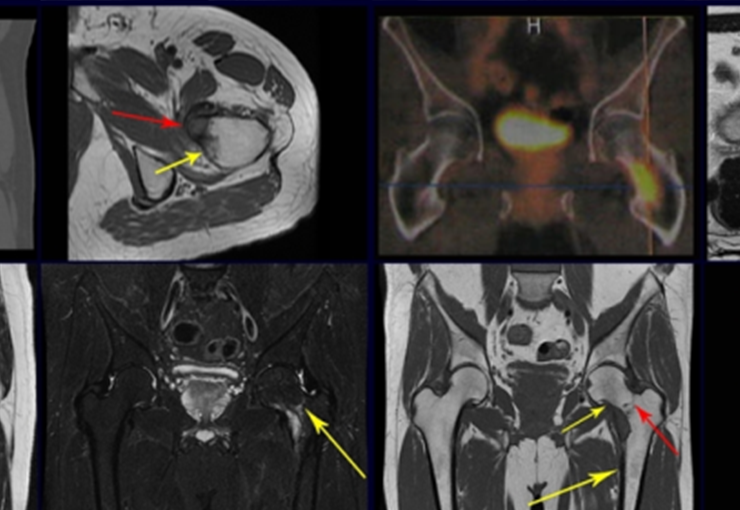
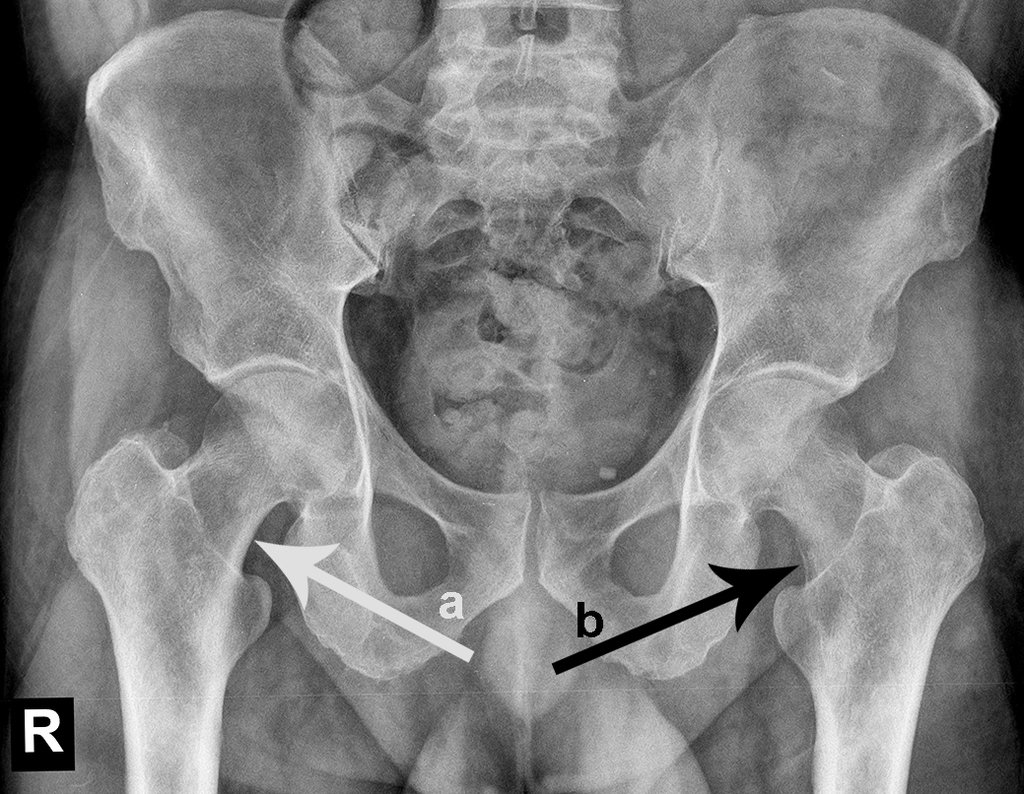
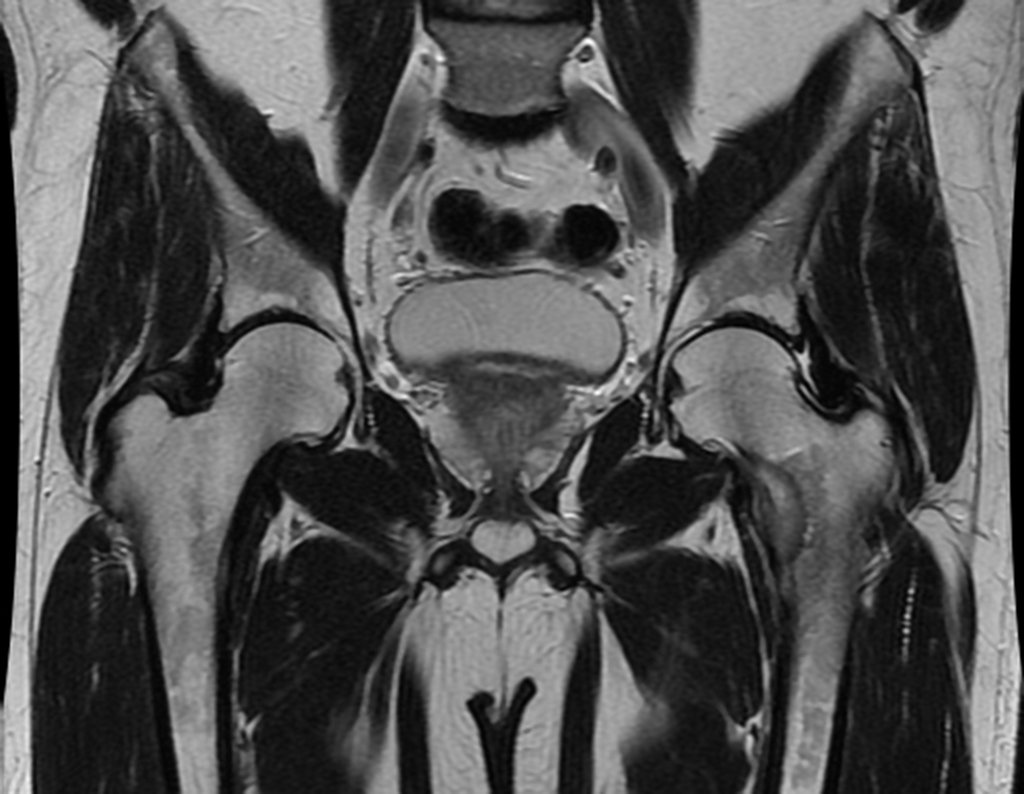
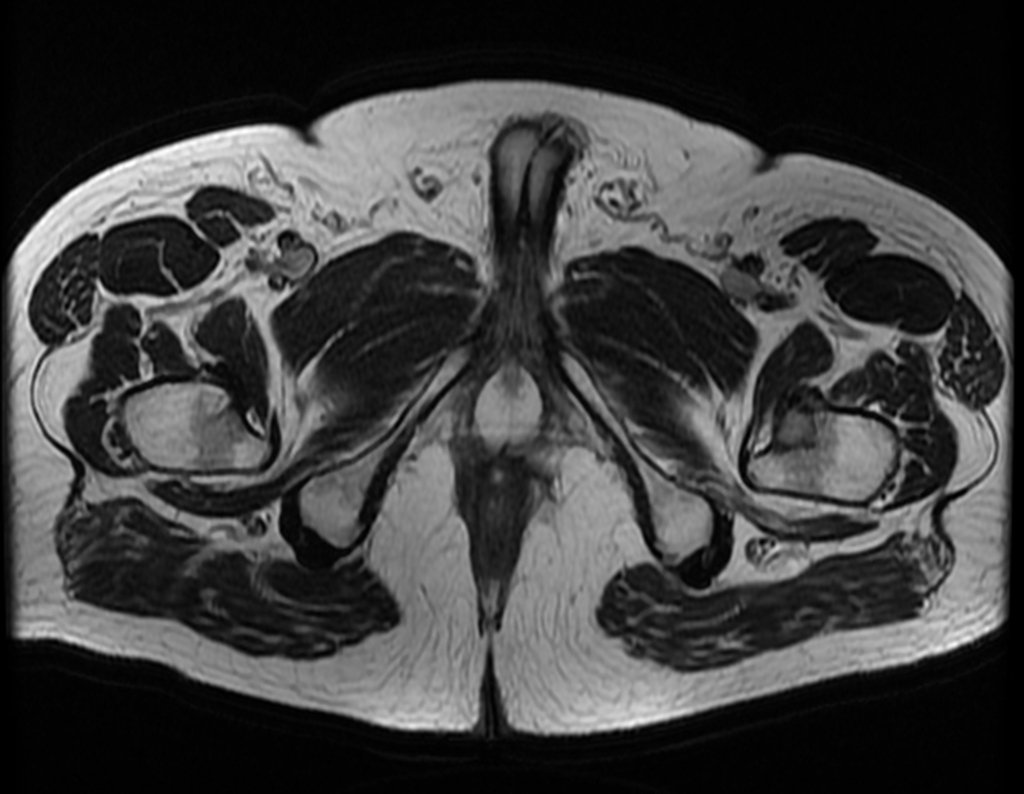
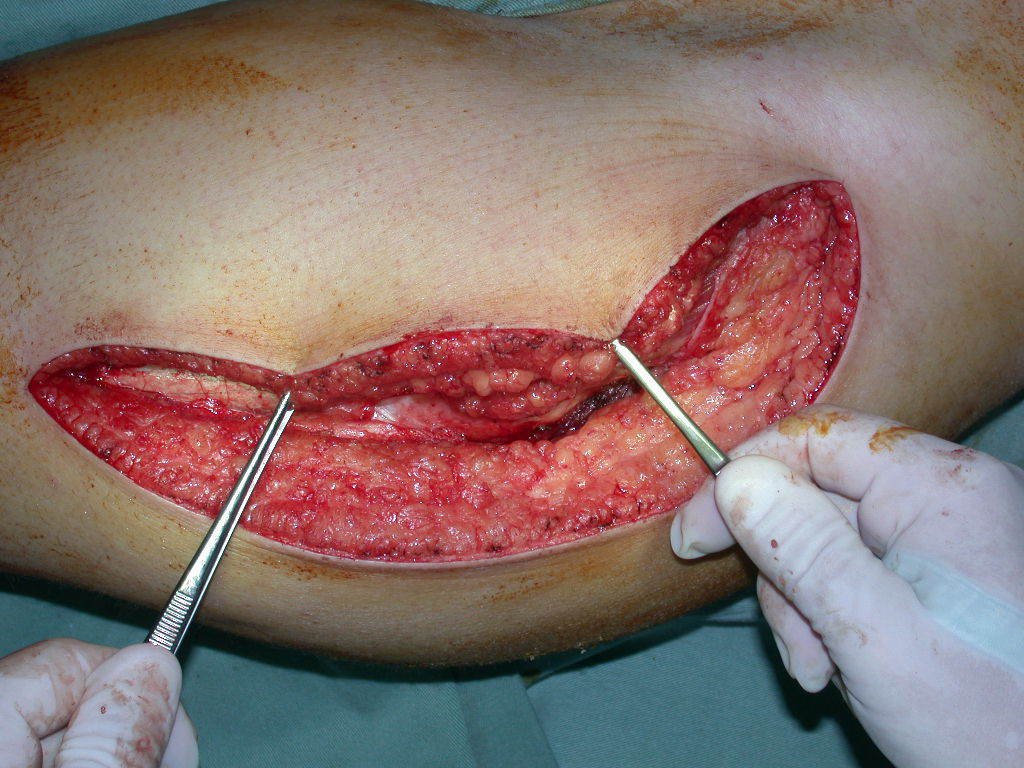
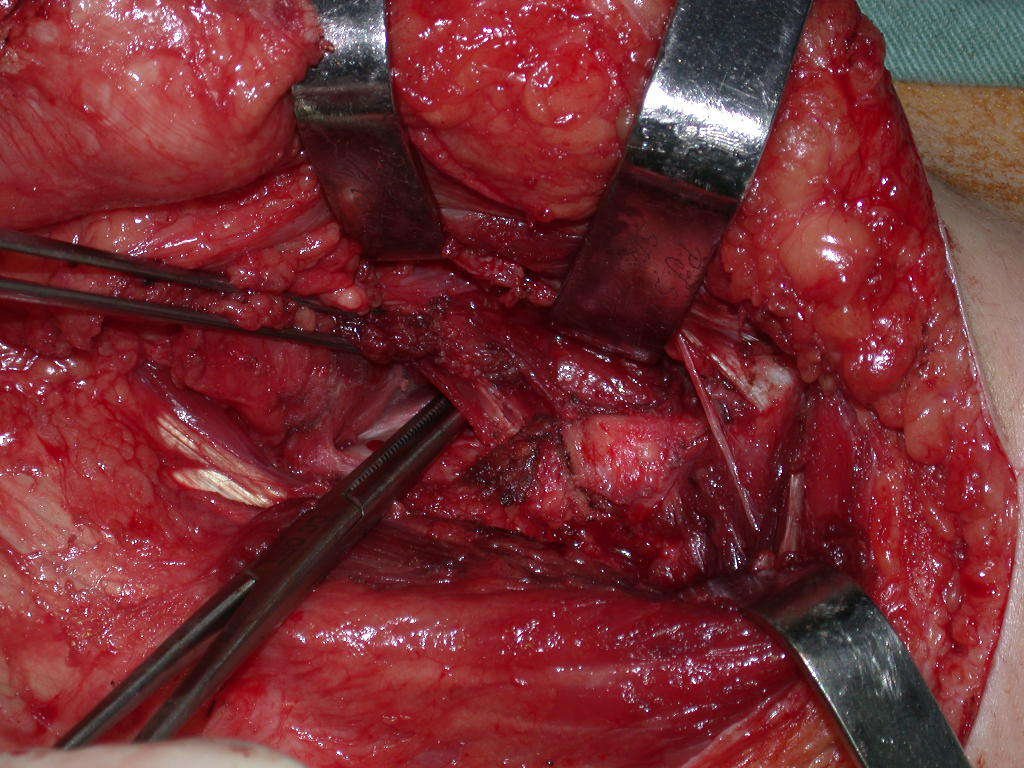
Considerações do Caso 1: Vamos descrever como procedemos nesta paciente feminina, 40 anos de idade, dor na crista ilíaca póstero superior a direita, havia seis meses, figuras 87 a 116.
Na análise da ressonância estudamos o comprometimento da lesão, planejamos o acesso cirúrgico e a tática de ressecção com margem, para então escolhermos o trajeto mais adequado e seguro para a nossa biópsia, figuras 91 e 92.

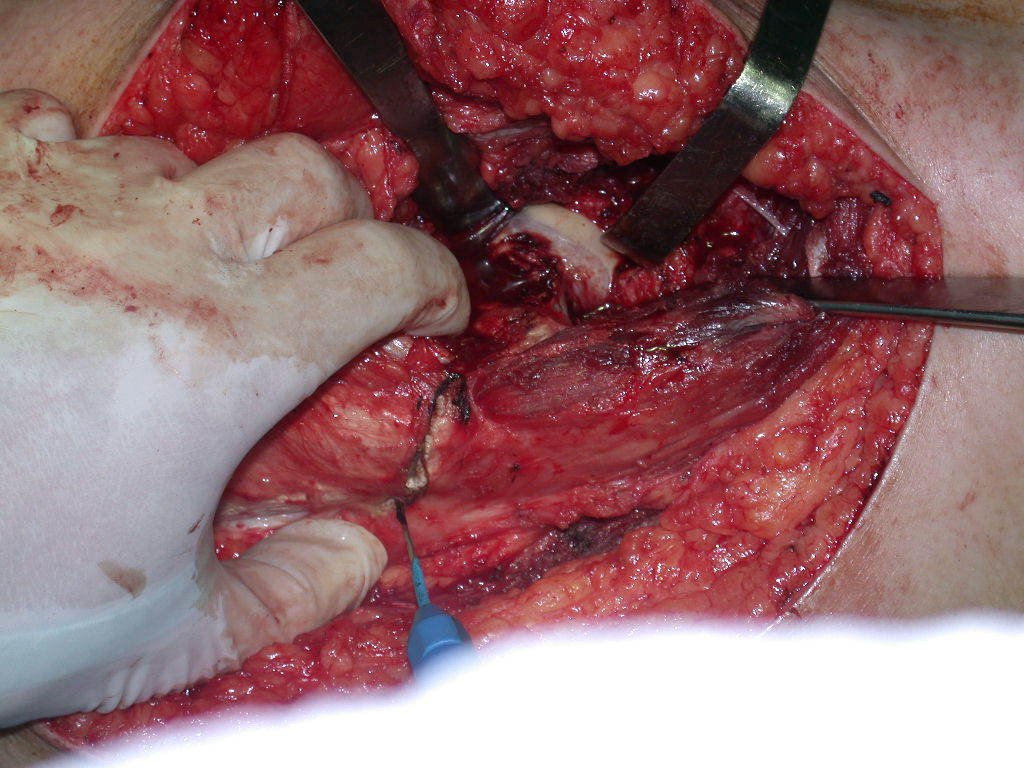
Assim a ressecção planejada é de se acessar por incisão seguindo pela crista ilíaca, dissecando externamente pelo plano gorduroso e internamente descolando o peritônio. Pretendíamos colocar a paciente em decúbito dorsal, mas enquanto paramentava a paciente foi anestesiada e posicionada em decúbito prono, o que dificultava o procedimento, a nosso ver, figuras 93 e 94.
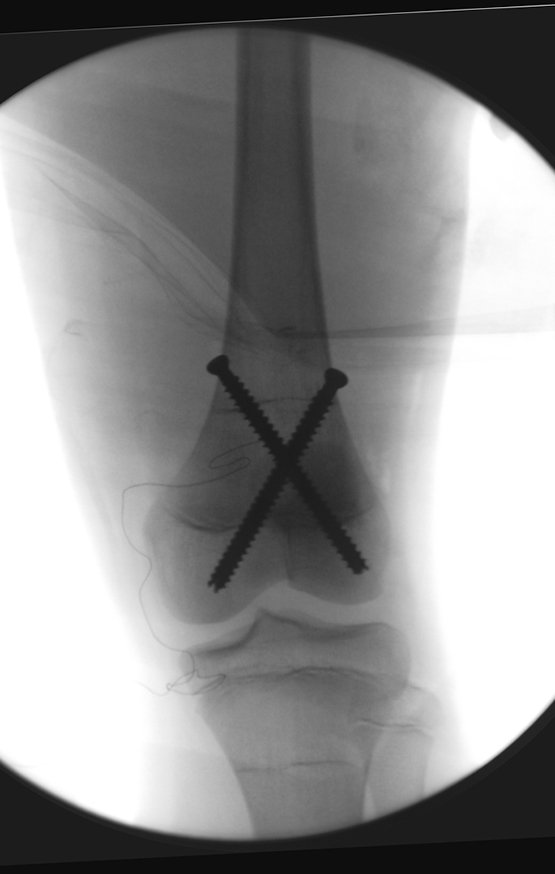
O operador de Rx argumentou que aquela posição era a melhor e que conseguiríamos facilmente o material para o estudo histológico e … fez um X por onde iria obter a amostra! Figuras 95 e 96.
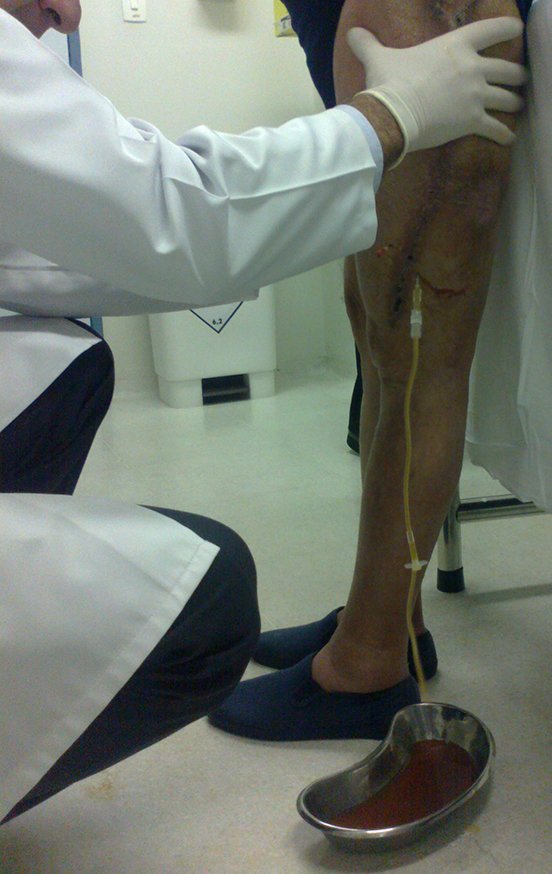
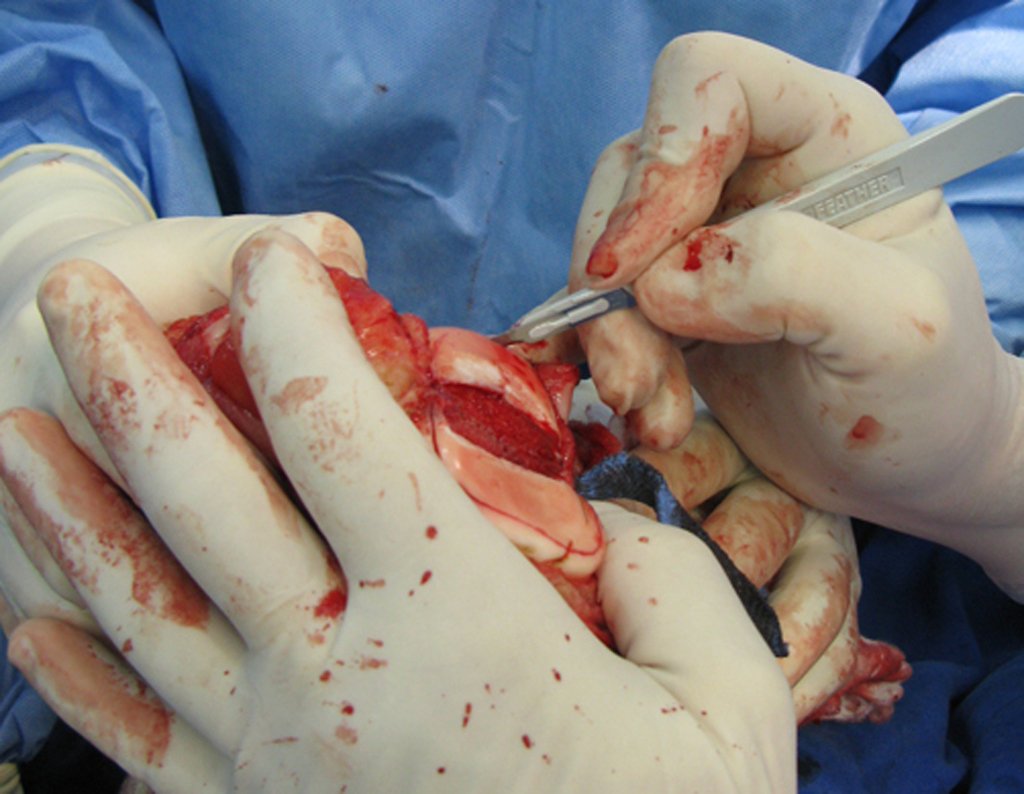
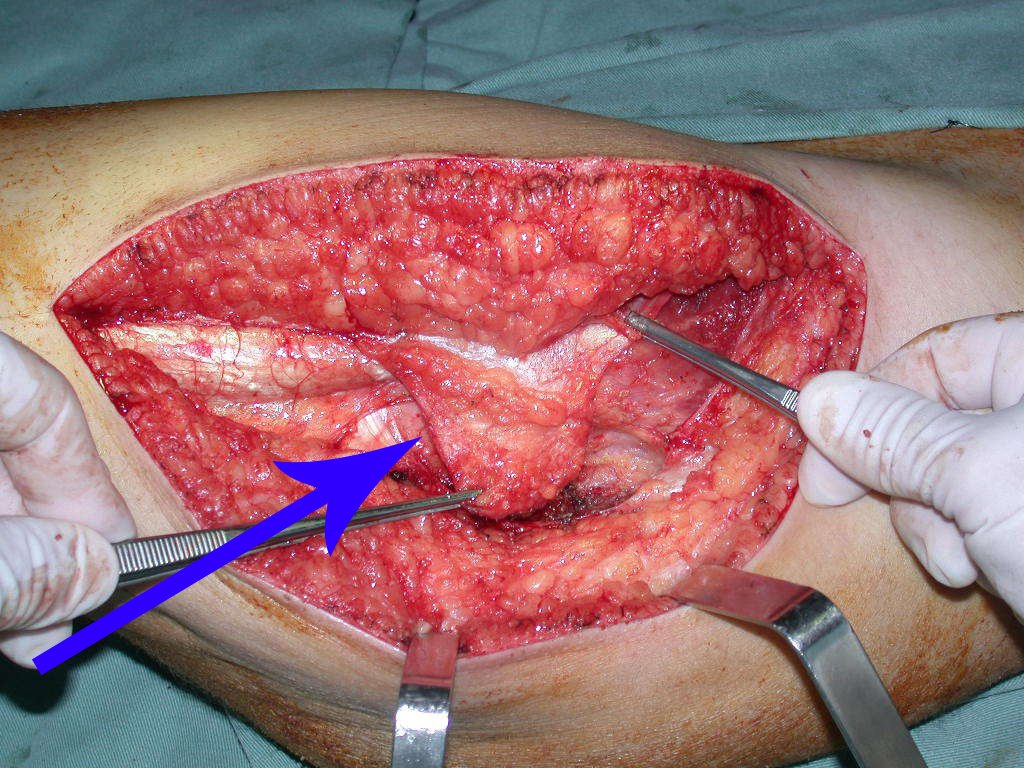
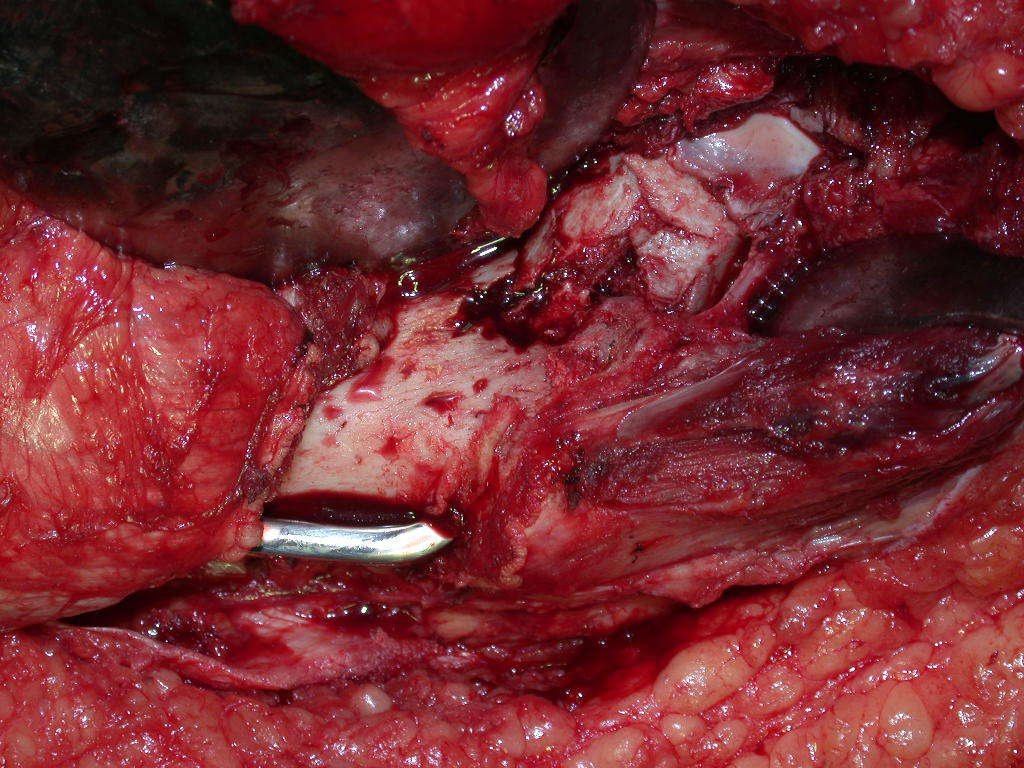
Expliquei-lhe que não deveríamos mudar a direção da incisão cirúrgica planejado, pois isto dificultaria o acesso interno à pelve. Orientamos para puncionar no ponto lateral da crista, apesar da dificuldade de angulação da agulha, devido ao decúbito prono. Este procedimento é descrito como ¨biópsia de congelação¨, figuras 97 a 102.
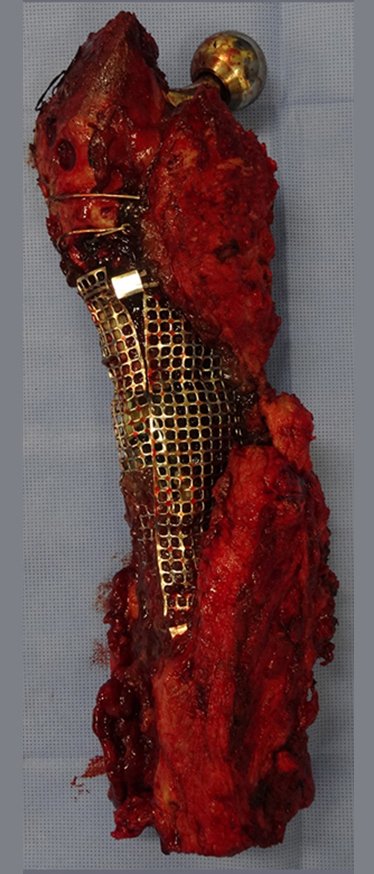
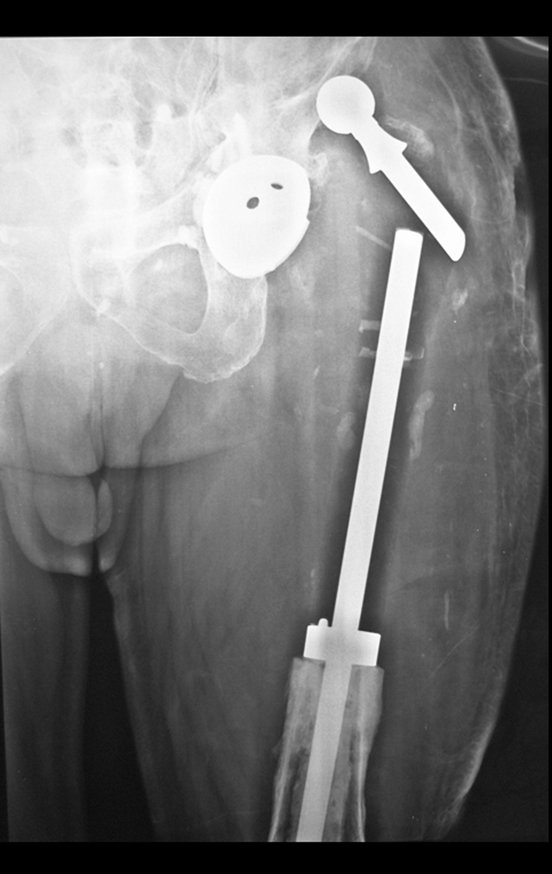
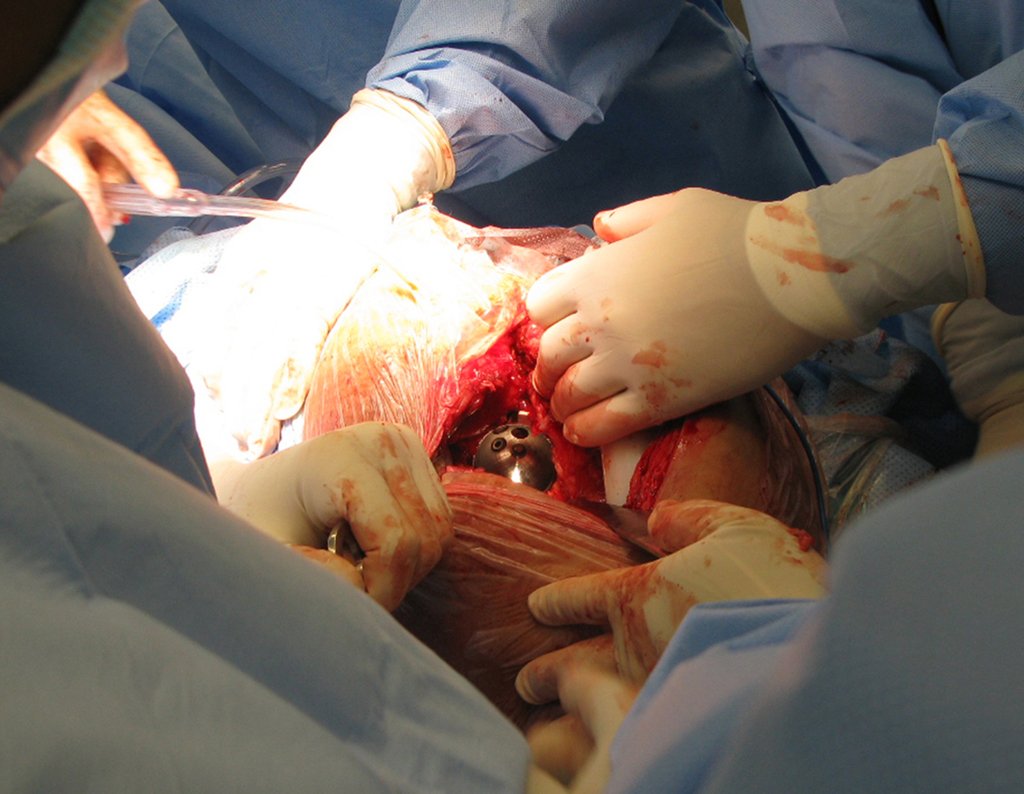
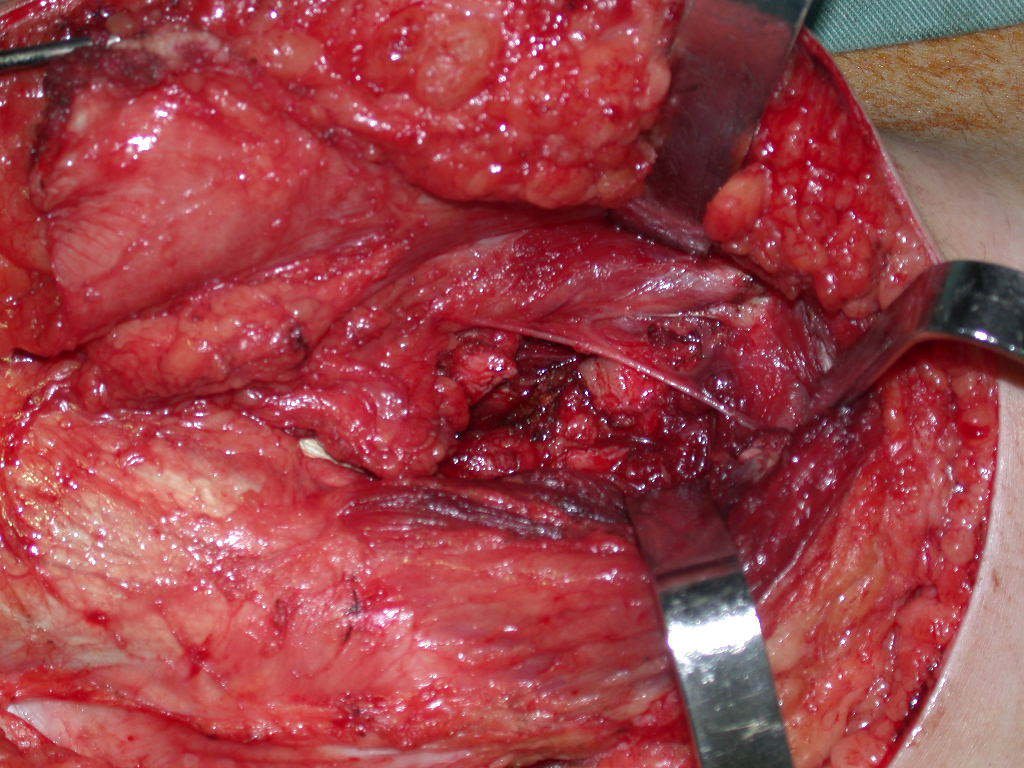
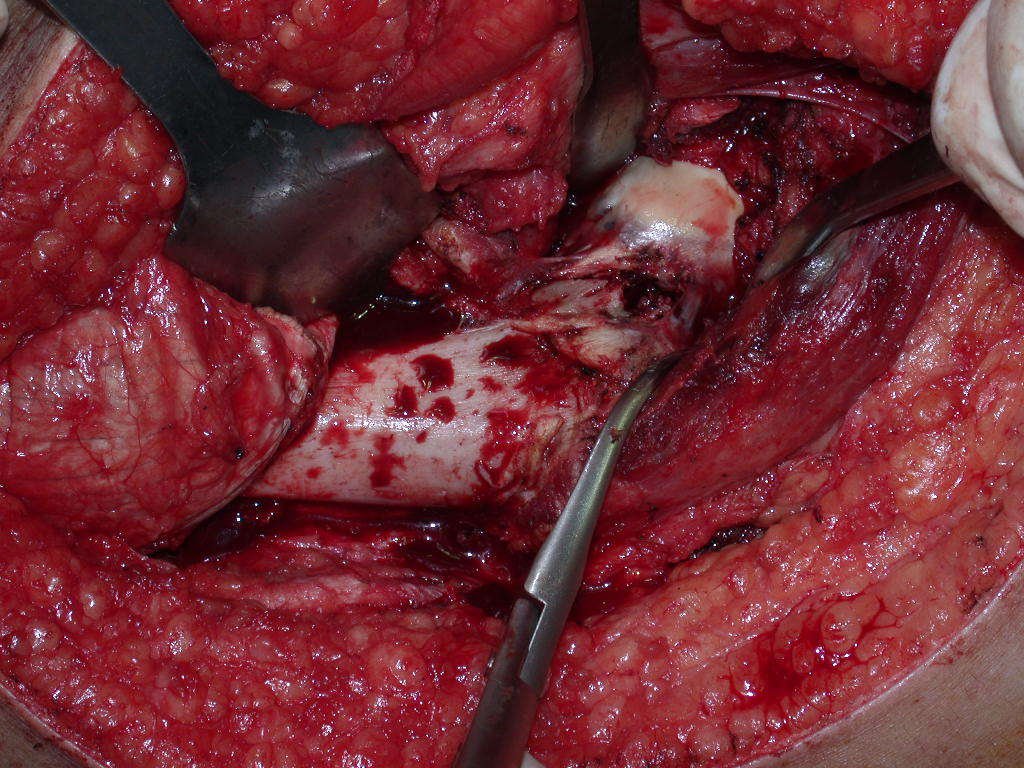
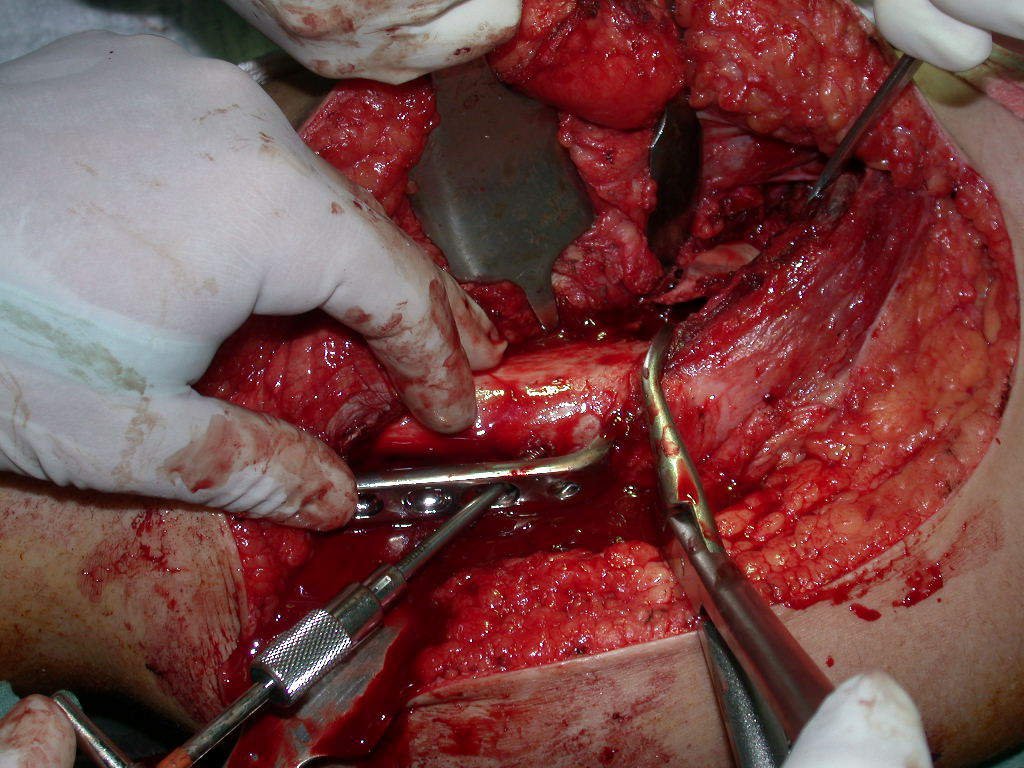
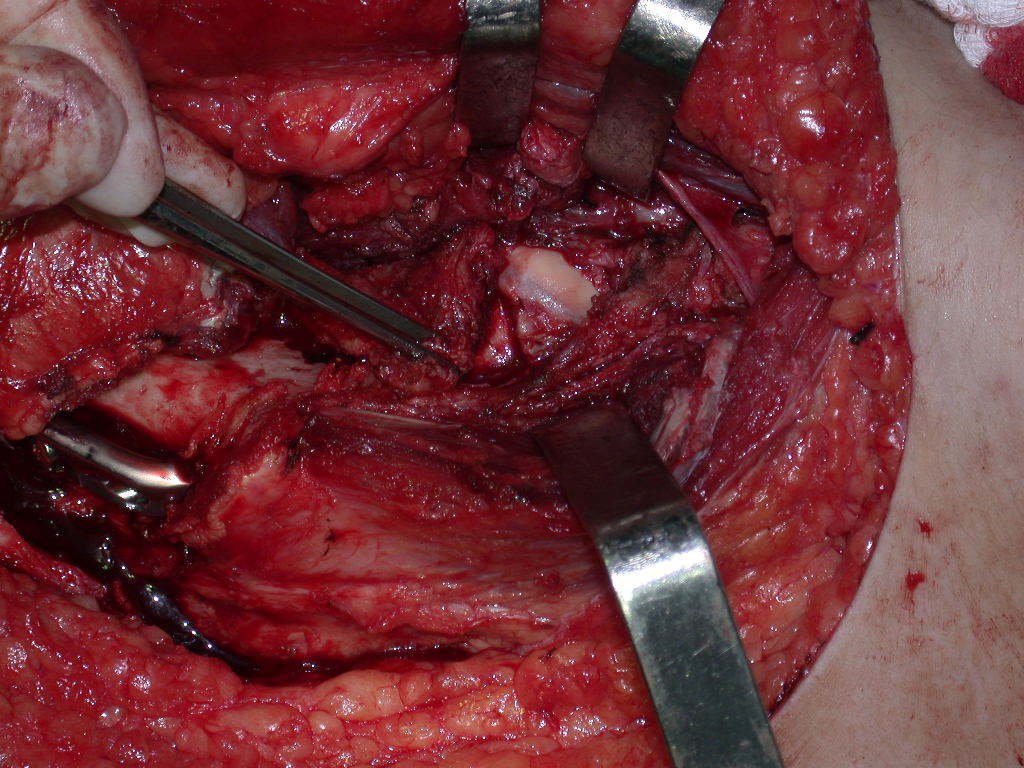
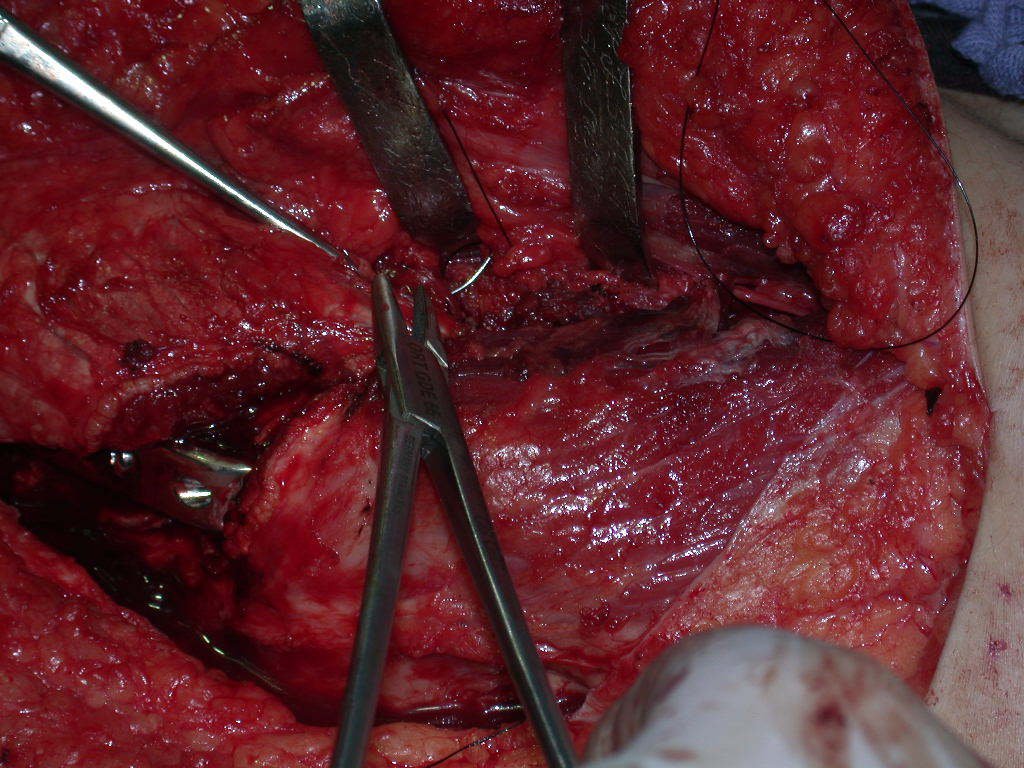
Com a confirmação de tumor cartilaginoso, provável condrossarcoma GII, realizamos a ressecção parcial da pelve direita, conforme planejado, sem neoadjuvancia, figuras 103 a 116.
Video 1: Exposição da face interna da pelve e osteotomia delicada, realizada com brocas minimamente invasivas.
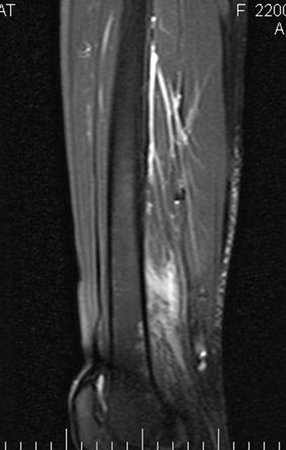
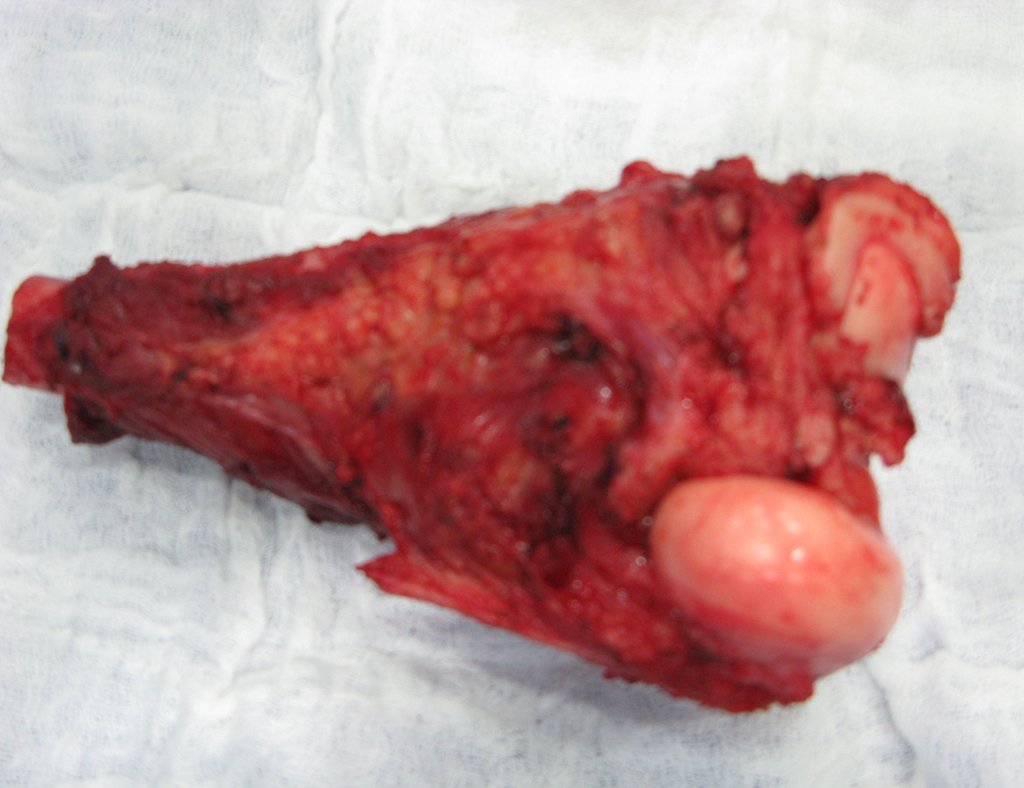
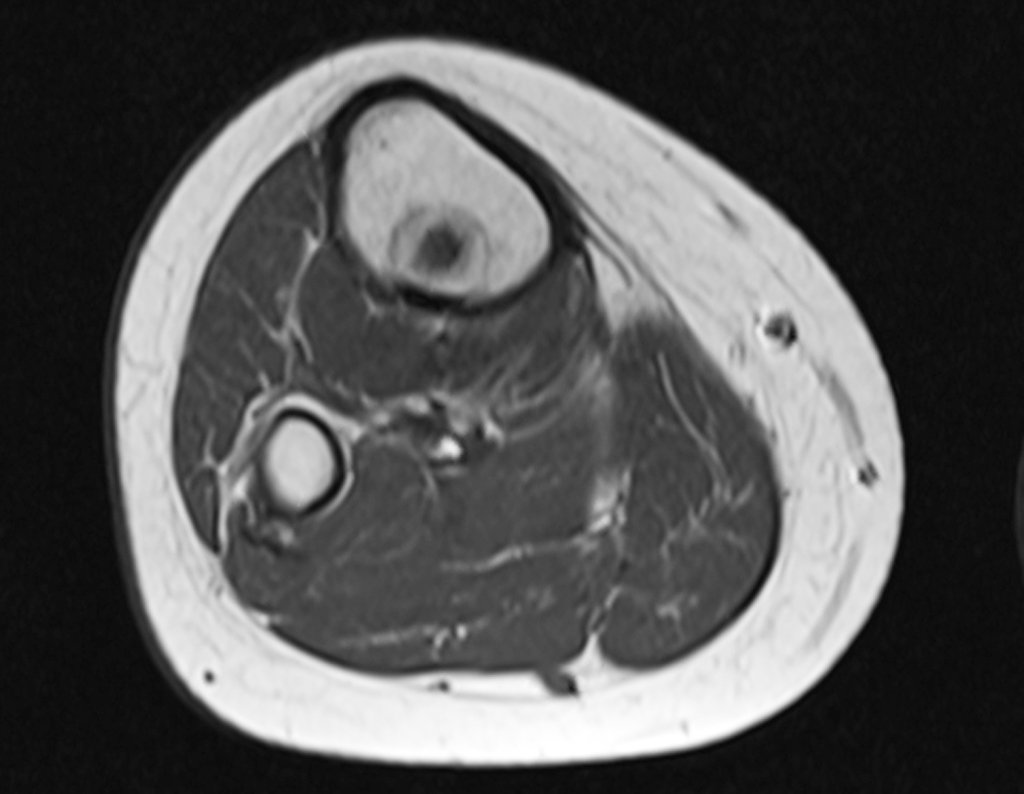
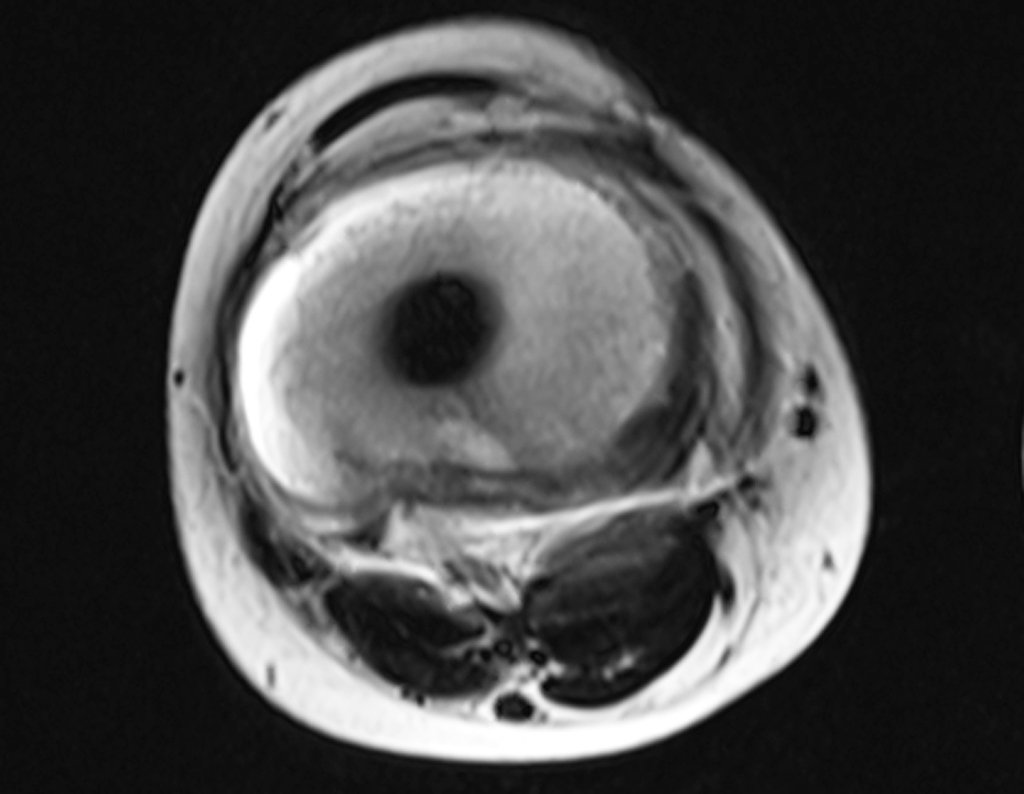
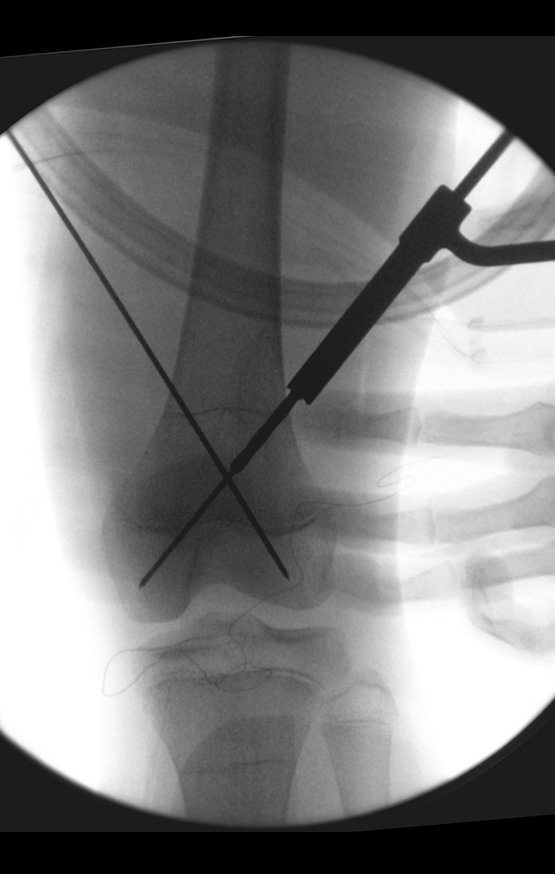
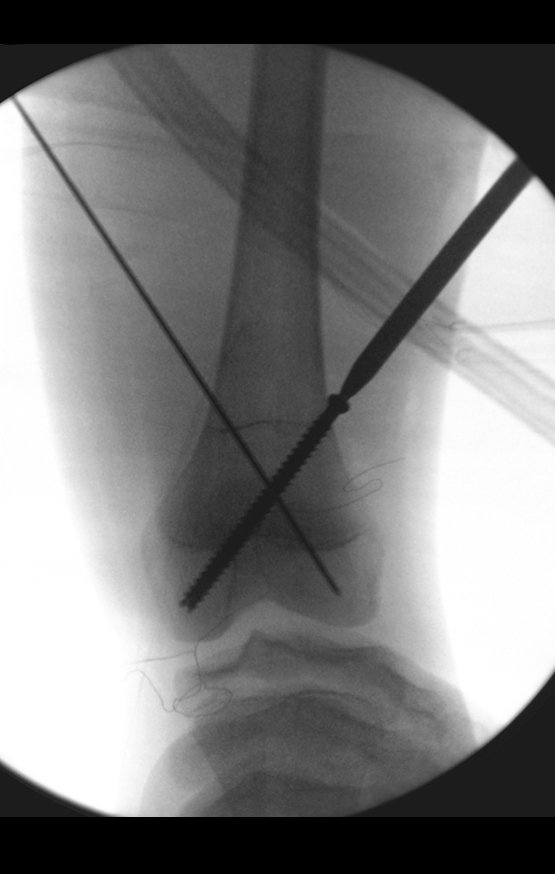
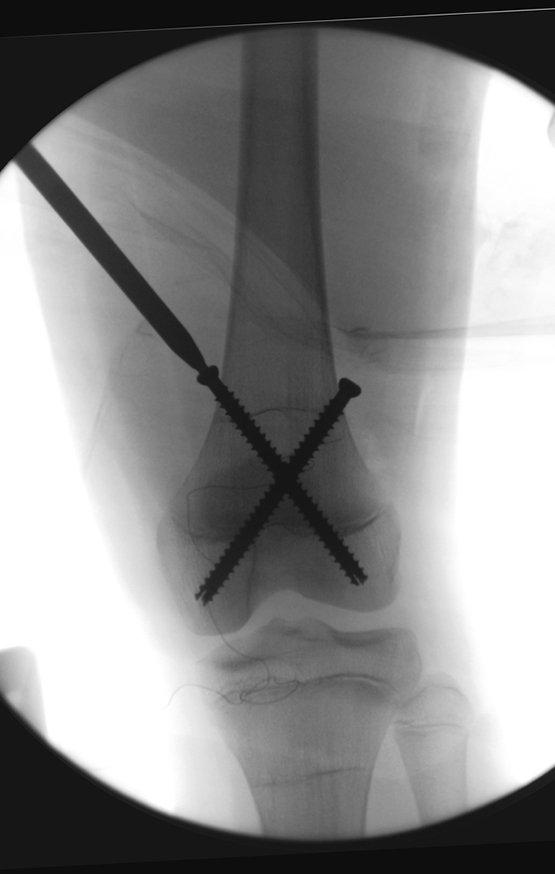
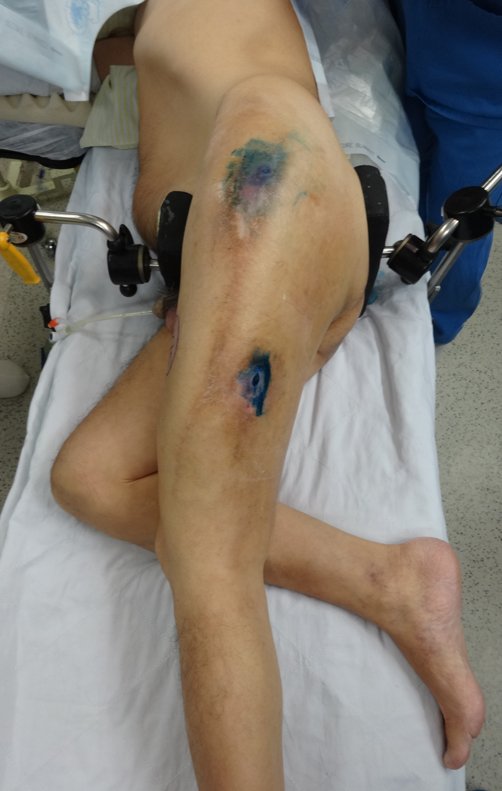
Considerações do Caso 2: Vamos agora discutir a biópsia neste paciente com onze anos de idade, com dor e tumor na coxa esquerda havia duas semanas. Provável osteossarcoma, figuras 115 a 118.
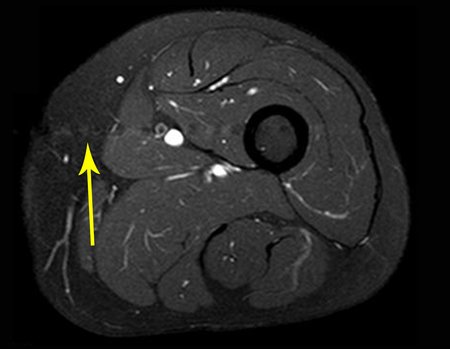
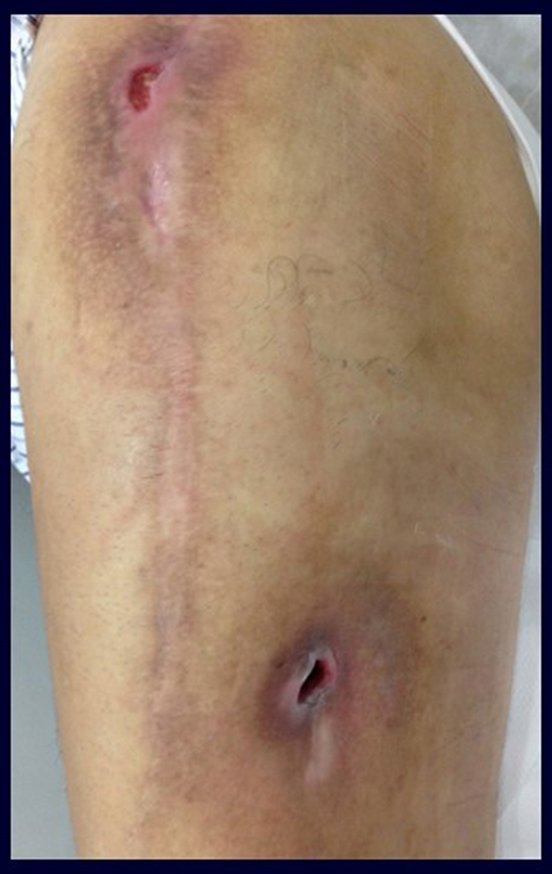
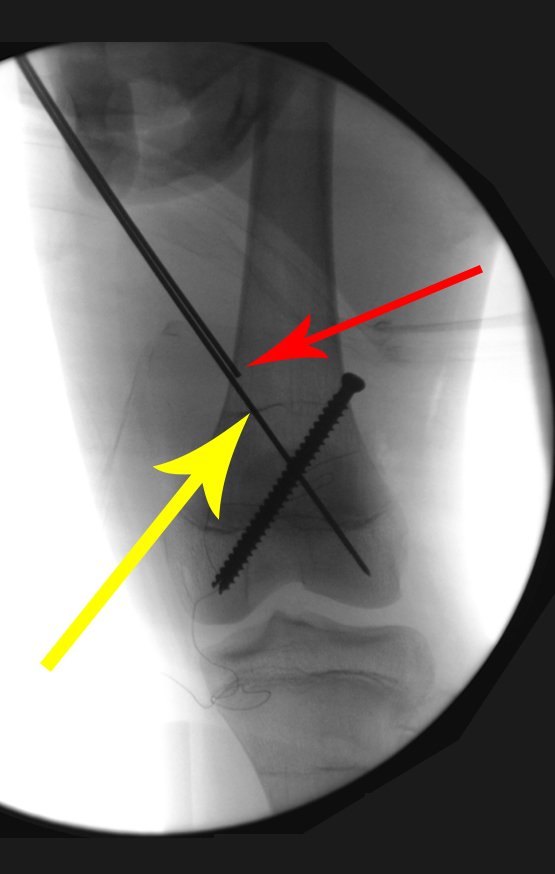
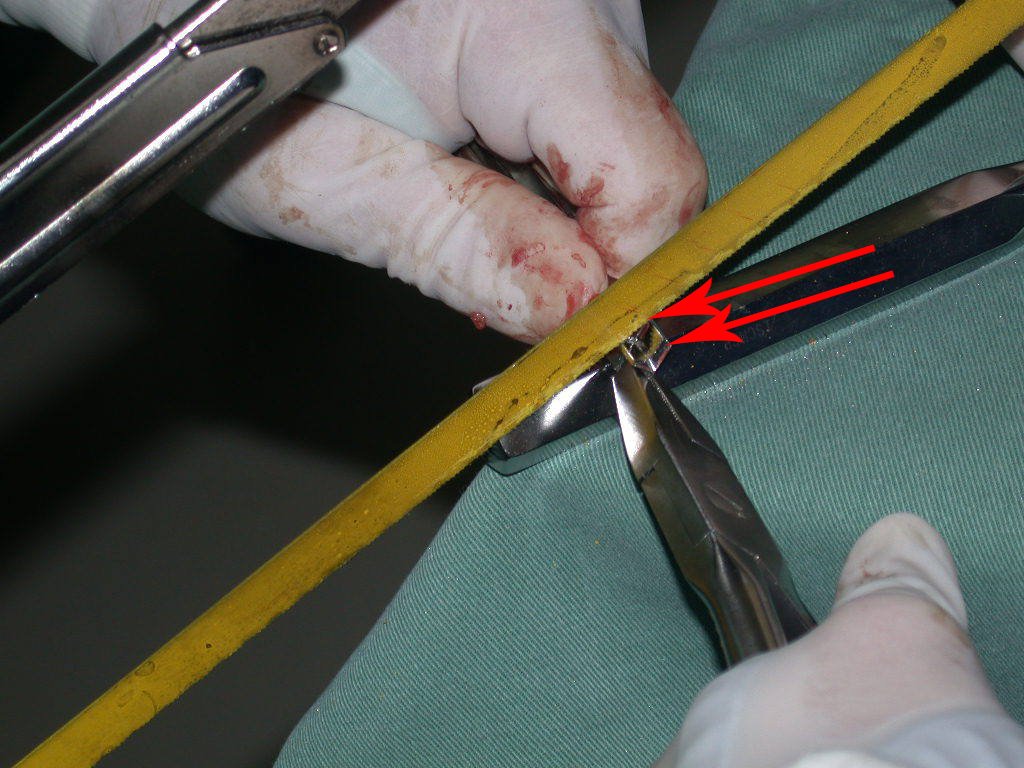
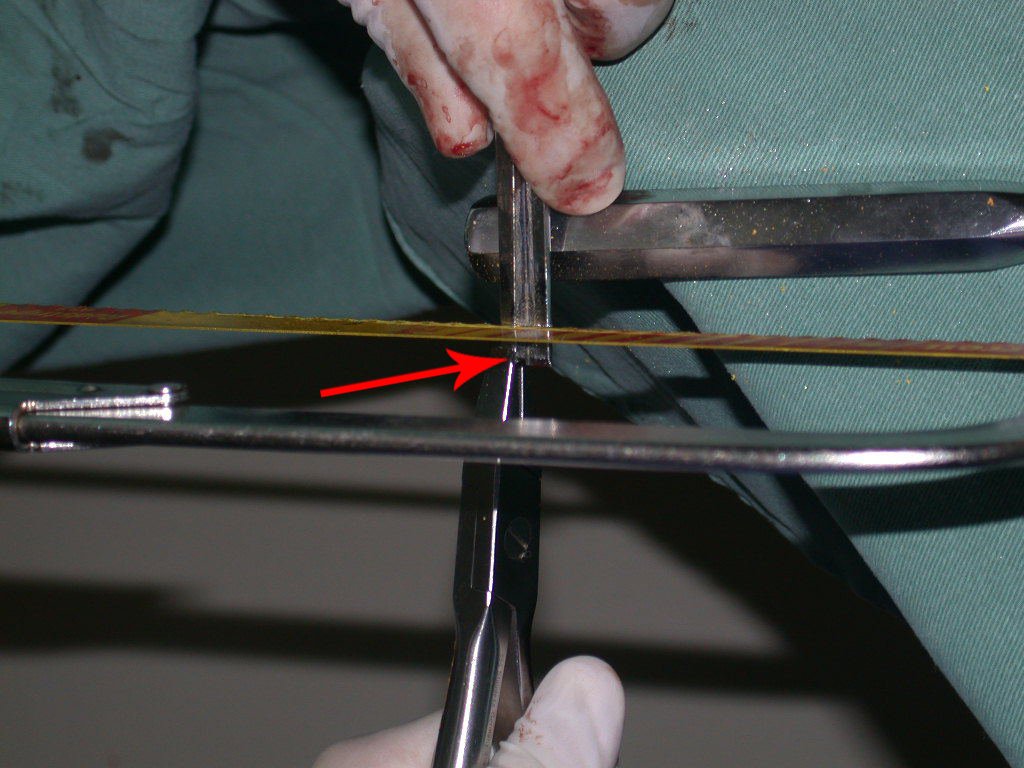
Vemos, com muita frequência, pacientes com cicatrizes de biópsia realizadas na região ântero-lateral da metáfise distal do fêmur. A seta vermelha aponta a fáscia lata, que na maioria das vezes é interrompida pelo trajeto da biópsia, realizada por profissionais que não vão operar o paciente, dificultado a cobertura da futura cirurgia e a função deste membro que precisará ser reconstruído.
A seta amarela indica o trajeto póstero-lateral, mais adequado para a biópsia e para a reconstrução, propiciando a melhor cobertura e função.
Para a realização da biópsia por este trajeto o posicionamento adequado do paciente é em decúbito prono, figuras 119 a 122.
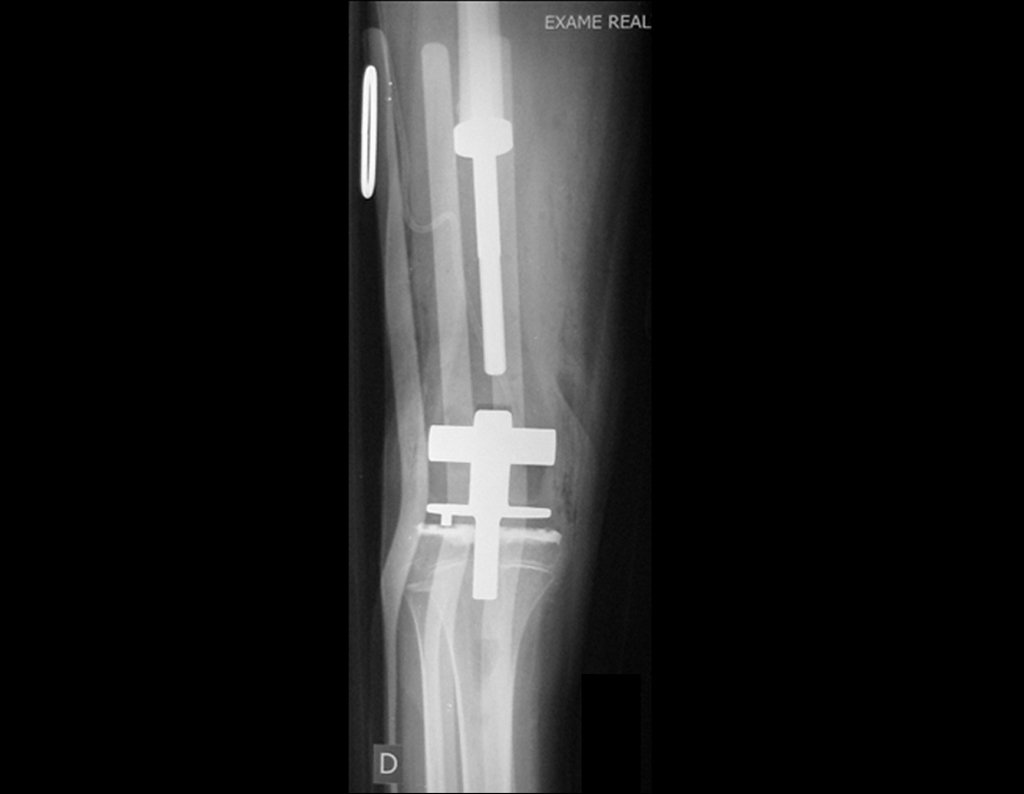
O tratamento de tumores da extremidade distal do fêmur, como esta lesão, com este grau de comprometimento e localização, indicamos a biópsia conforme descrevemos e a realização de quimioterapia neoadjuvante de indução, ressecção com margem oncológica e reconstrução com prótese modular e quimioterapia adjuvante.
O paciente deste exemplo está fora de tratamento, com excelente função, podendo-se ver o caso completo no Link: http://osteossarcoma-discrepância de comprimento .
A realização de biópsia musculoesquelética, visando o diagnóstico e tratamento adequado das neoplasias, deve ser muito bem planejada e executada por profissionais experientes
“A realização de biópsias musculoesqueléticas, visando o diagnóstico e tratamento adequado das neoplasias, deve ser muito bem planejada e executada por profissionais experientes e com a participação do cirurgião que estará conduzindo o caso”.
Autor: Prof. Dr. Pedro Péricles Ribeiro Baptista
Oncocirurgia Ortopédica do Instituto do Câncer Dr. Arnaldo Vieira de Carvalho
Consultório: Rua General Jardim, 846 – Cj 41 – Cep: 01223-010 Higienópolis São Paulo – S.P.
Fone:+55 11 3231-4638 Cel.:+55 11 99863-5577 Email: drpprb@gmail.com
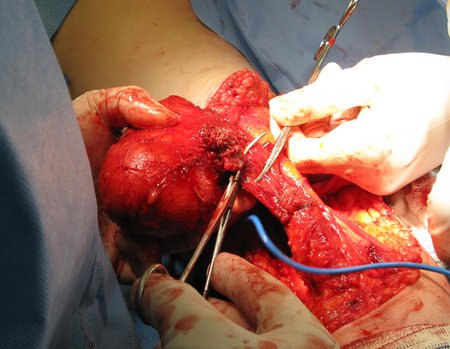
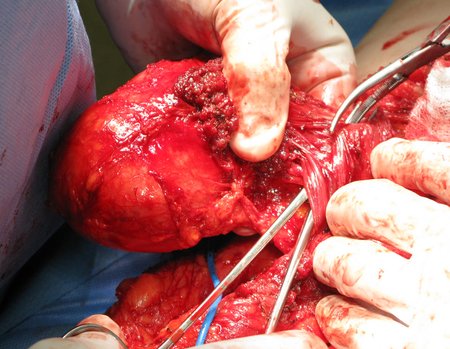
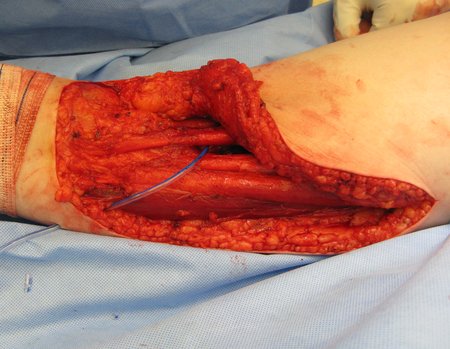
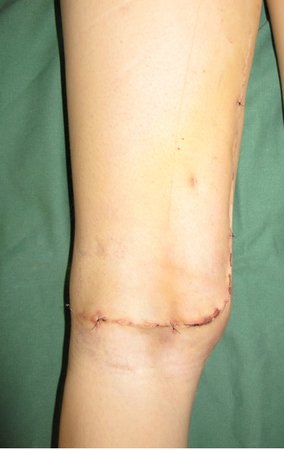
Técnica de Ressecção de Sarcoma de Tecidos Moles da Coxa. Paciente feminina, 33 anos de idade, refere tumor na face posterior e distal da coxa esquerda há um ano, com maior crescimento nos últimos três meses, durante o final da gravidez. Após atendimento com outro profissional, em que realizou exames de ultrassom, cintilografia óssea, ressonância magnética e biópsia, Figuras 1-20, foi-nos encaminhada para avaliação e tratamento.
17. Técnica de ressecção de sarcoma de tecidos moles da coxa

A análise da história, quadro clínico e imagens de uma lesão homogênea, compacta, com limites precisos, produtora de osso maduro permitiu o diagnóstico de osteoma, realizando-se a ressecção desta lesão por indicação estética. A cirurgia foi realizada sob anestesia geral e infiltração local, para diminuir o sangramento (figuras 10 à 20).
Autor : Prof. Dr. Pedro Péricles Ribeiro Baptista
Oncocirurgia Ortopédica do Instituto do Câncer Dr. Arnaldo Vieira de Carvalho
Consultório: Rua General Jardim, 846 – Cj 41 – Cep: 01223-010 Higienópolis São Paulo – S.P.
Fone:+55 11 3231-4638 Cel:+55 11 99863-5577 Email: drpprb@gmail.com
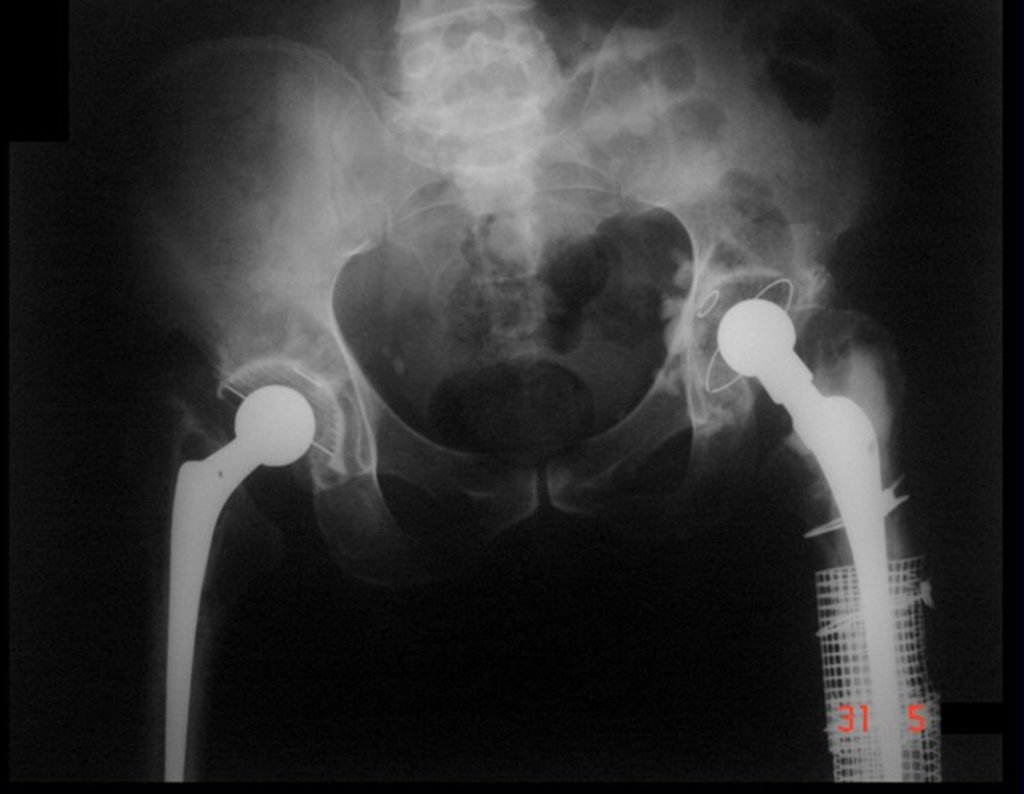
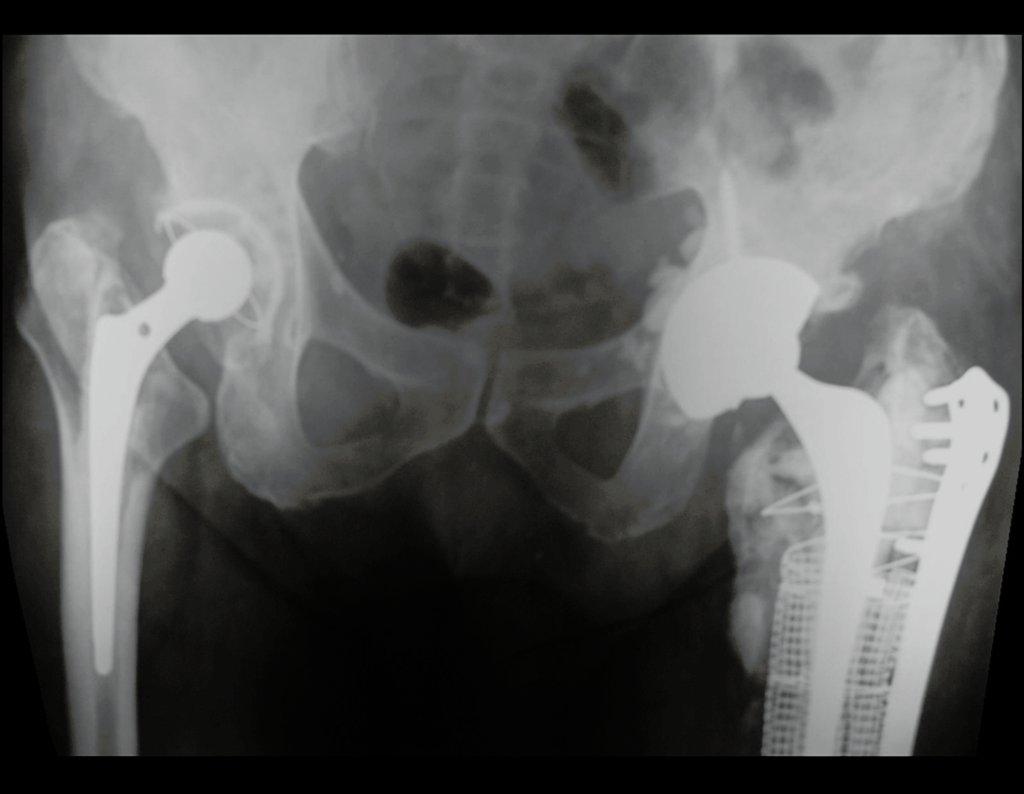
Técnica de Revisão de Prótese Infectada do Quadril. Paciente com 52 anos de idade, com quadro de artrose bilateral dos quadris, devido a necrose asséptica das cabeças femorais, com dor e incapacidade mais acentuada à esquerda, é submetido a artroplastia total do quadril E, figuras 1 e 2.
16. Técnica de revisão de prótese infectada do quadril – Artrose por necrose da cabeça femoral – Soltura e quebra de prótese, infecção e fratura.
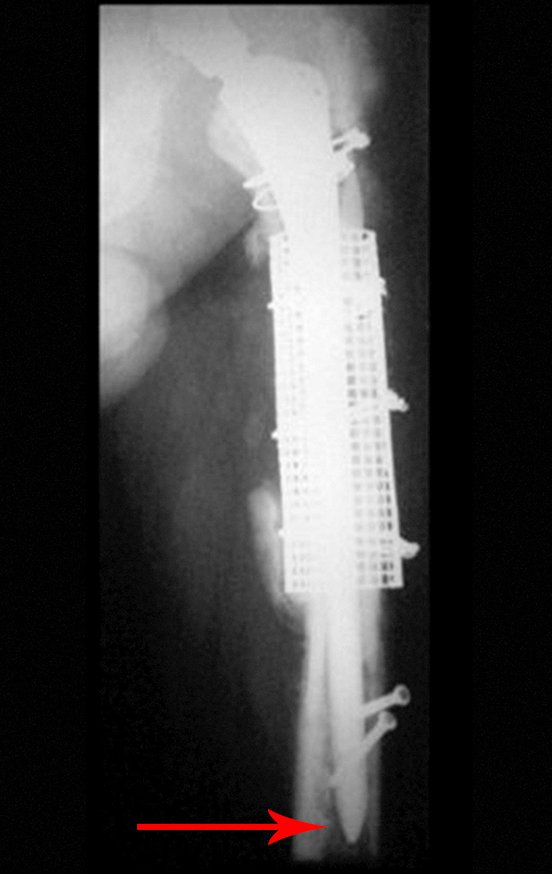
Posteriormente foi operado do quadril do lado direito. No acompanhamento apresentou soltura do componente femoral à esquerda e, em fevereiro de 2008, ocorreu quebra da haste. Em maio foi realizada a primeira revisão, com nova prótese utilizando colo longo e haste curta, figuras 3 e 4.
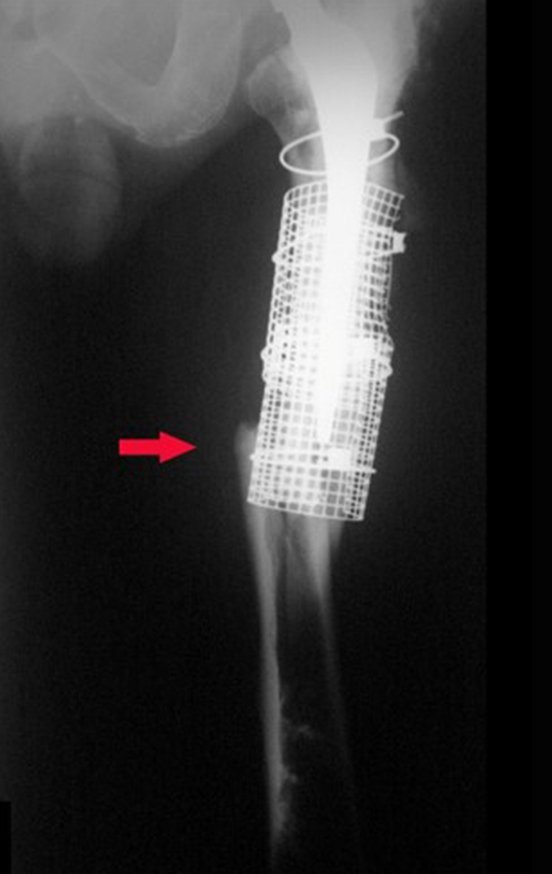
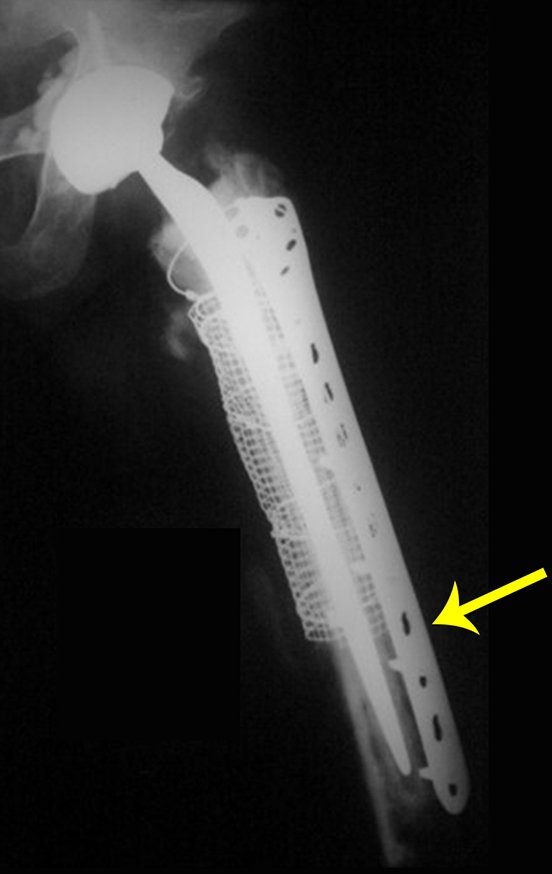
Em fevereiro de 2010 ocorre soltura da haste femoral longa, nova revisão com placa, tela, enxerto homólogo e placa reforçada. Infecção com fístula ativa e novas solturas, agora com o paciente apresentando diabetes, figuras 9 a 12.
De 2010 a 2014 o paciente submeteu-se a limpezas cirúrgicas e antibioticoterapia sistêmica, com acompanhamento de infectologista, em sucessivas internações, visando conseguir o controle da infecção para uma revisão em dois tempos cirúrgicos.
Em março de 2014, avaliamos o paciente e analisamos o caso.
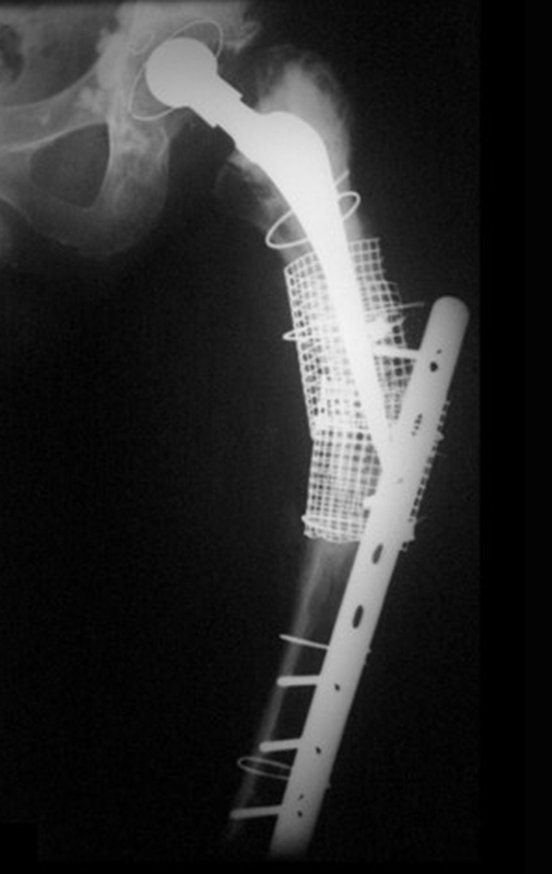
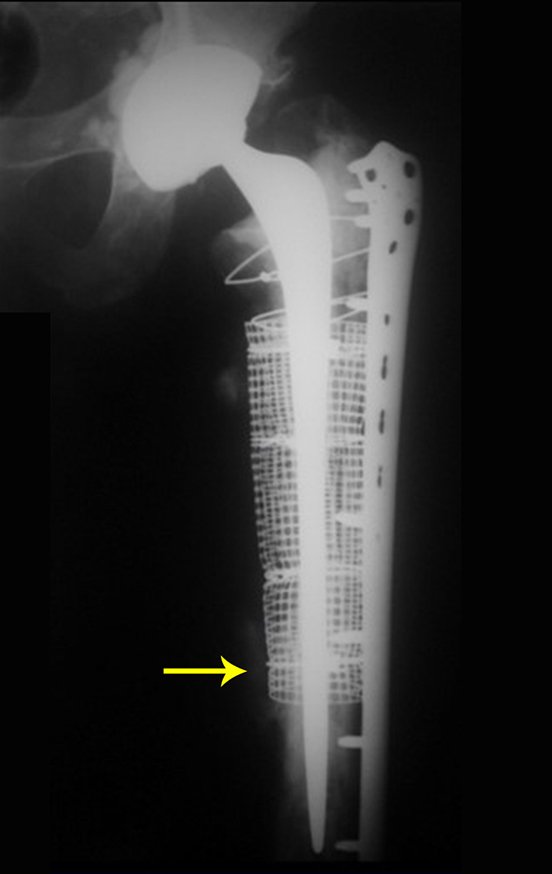
Indicamos a revisão em um tempo único, ressecando o segmento proximal em bloco, com prótese, placa, parafusos, telas, arames, enxertos, sequestros e tecidos necrótico, como se fosse uma neoplasia, e substituindo por uma endoprótese não convencional de polietileno.
Esta endoprótese nada mais é do que um espaçador, com a vantagem de preencher de imediato o espaço morto e propiciando função imediata do membro operado, figuras 13 a 15.
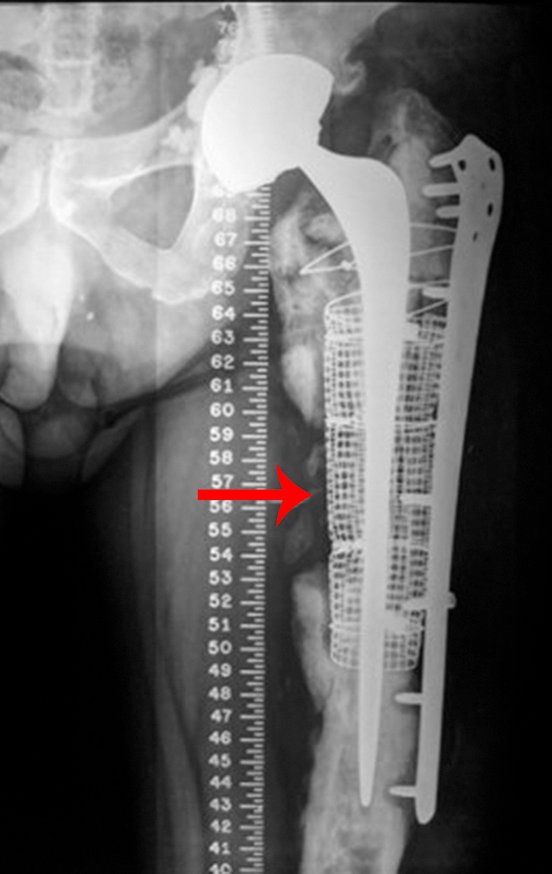
Radiografias do pré-operatório da revisão em um tempo cirúrgico, em abril de 2014, figuras 19 a 128.
Cirurgia de revisão, 08 de abril de 2014, figuras 19 a 15.
Após o teste com a prótese de prova e a escolha dos módulos definitivos, passamos a cimentação dos componentes da endoprótese, figuras 42 a 53.
Ao redor de qualquer endoprótese ocorre a formação de uma fibrose consequente a reação de corpo estranho, resultando em espessa pseudo cápsula, formando um estojo, que praticamente isola esta endoprótese do organismo.
Os músculos e tendões, que foram inicialmente inseridos na prótese com fios de ethibond, acabam por se aderirem definitivamente nesta pseudo cápsula. Esta pseudo cápsula apresenta um revestimento de epitélio sinovial secretor de líquido, o qual acaba por revestir a endoprótese. Esta fibrose reacional da pseudo cápsula, pode atingir 5 mm de espessura.
Nas revisões e mesmo em cirurgias com grande descolamento muscular pode ocorrer aumento do espaço morto, resultando na formação de excesso deste líquido sinovial, que aumenta o ¨estojo¨ que envolve a prótese.
Este aumento de volume, associado à fraqueza da musculatura abdutora, pode facilitar a luxação do quadril.
Em 15 maio de 2014, após um mês da cirurgia, o paciente retornou com aumento de volume da coxa, sem febre, sem calor local, com clínica de excesso de conteúdo líquido ao redor da prótese.
Este líquido, quando em excesso, deve ser drenado. Por vezes é necessário mais de um procedimento.
Deve ser feito com toda a assepsia, empregando-se agulha de grande calibre e esvaziando-se o máximo possível aquele conteúdo, figuras 62 a 64.
Uma nova drenagem foi realizada por punção, em 28/05/2015, após duas semanas.
O paciente já deambulava com andador e não apresentou recorrência da infecção, figuras 65 a 67.
Vídeo 1: Paciente deambulando com andador após dois meses da revisão.
Em junho de 2014 realizou movimento de hiperflexão e rotação interna, ao sentar-se em vaso sanitário baixo, apresentando luxação do quadril. Foi realizada redução incruenta e reorientamos novamente quanto aos movimentos que facilitam a luxação, pois apresentava uma grande hipotrofia do médio glúteo, o que dificultava ainda mais a estabilização da prótese.
Novo episódio de luxação em julho de 2014, após três meses da cirurgia. Realizamos manobras de redução sob radioscopia, sem necessidade de sedação e obtínhamos fácil redução e também fácil deslocamento, confirmando a incapacidade de contenção do quadril reduzido, devido à insuficiência da musculatura abdutora e a cabeça femoral que utilizamos, de tamanho pequeno, figuras 65 a 67.
Não havíamos trocado o acetábulo na cirurgia anterior, mantendo uma cabeça menor que era a medida do acetábulo anterior, o que também poderia estar contribuindo para a instabilidade.
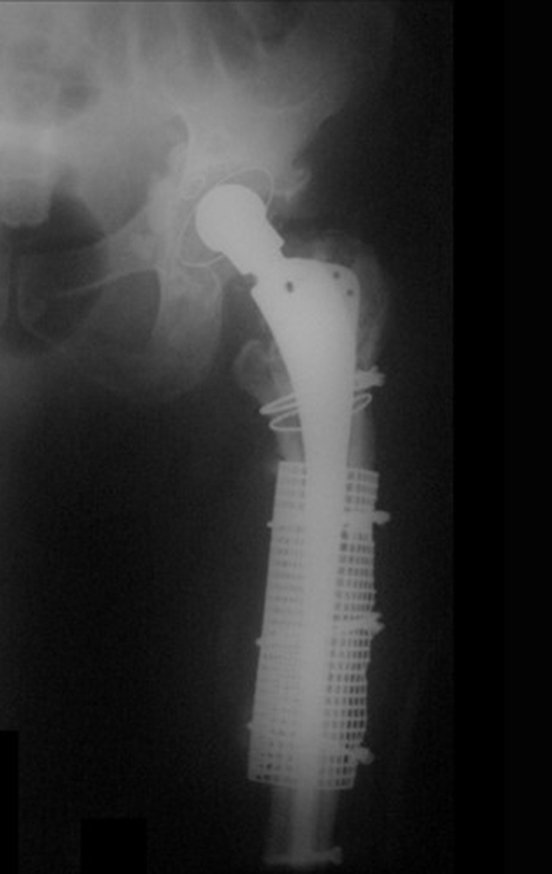
Decidimos por re-intervenção com substituição do acetábulo para um módulo constrito, empregando também uma cabeça maior.
O paciente evoluiu bem, sem intercorrência, sendo avaliado após um ano, figuras 83 a 86.
Vídeo 2: Paciente caminhando com trendelenburg, após um ano da última cirurgia, acetábulo bloqueado, para suprir a insuficiência de médio glúteo.
Vídeo 3: Paciente andando sem apoio, apesar do trendelemburg, após um ano, em 27/07/2015.
Até a presente data de 02 de abril de 2017, o paciente encontra-se bem, deambulando com discreta claudicação devido ao trendelemburg, sem nenhuma intercorrência, após três anos da última cirurgia.
Autor: Prof. Dr. Pedro Péricles Ribeiro Baptista
Oncocirurgia Ortopédica do Instituto do Câncer Dr. Arnaldo Vieira de Carvalho
Consultório: Rua General Jardim, 846 – Cj 41 – Cep: 01223-010 Higienópolis São Paulo – S.P.
Fone:+55 11 3231-4638 Cel:+55 11 99863-5577 Email: drpprb@gmail.com
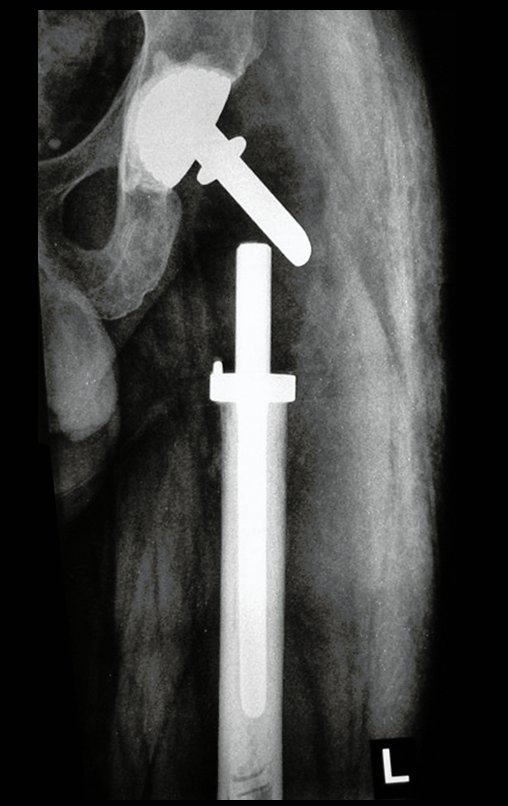
Técnica de Epifisiodese e Prótese parcial rotatória. Paciente com 11 anos de idade, apresentando dor no joelho e aumento de volume no terço inferior do fêmur direito. as radiografias de fevereiro de 2014 evidenciaram lesão produtora de tecido ósseo na metáfise, figuras 1 e 2. A cintilografia constatou tratar-se de lesão única com intensa captação na região metafisária distal do fêmur, figuras 3 e 4.
15. Técnica de Epifisiodese e Prótese parcial rotatória, com preservação da fise de crescimento da tíbia, em osteossarcoma do fêmur.
Para ampliar o estudo da lesão, foi realizado exame de Pet-Ct, figuras 5 a 8.
Continuando o estadiamento foi realizada a ressonância magnética, figuras 9 a 18.
Foi realizada biópsia por punção, por via lateral, por outro profissional.
Observe que o local da biópsia, figura 20, é bem anterior, passando pelo meio da fáscia lata, dificultando a futura cobertura da cirurgia, pois o segmento inferior da fáscia ficaria seccionado tanto na área da biópsia, acima, quanto na borda abaixo.
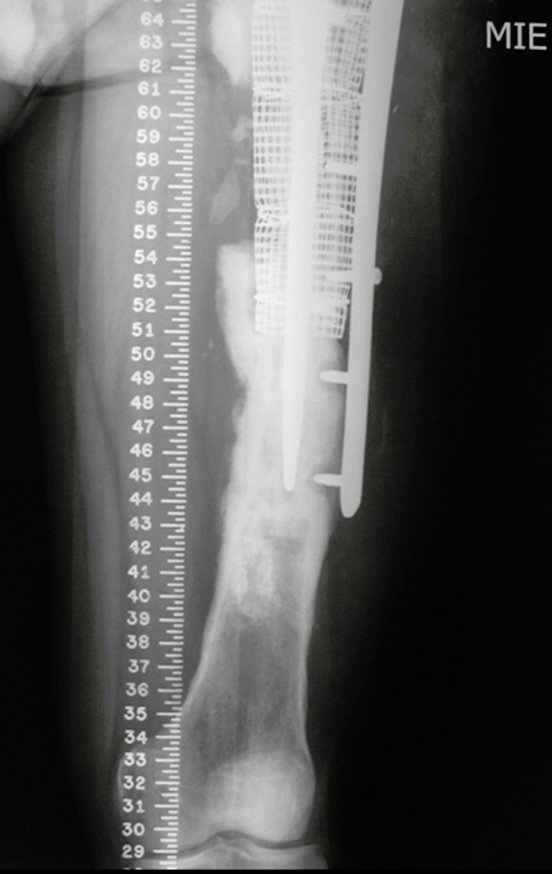
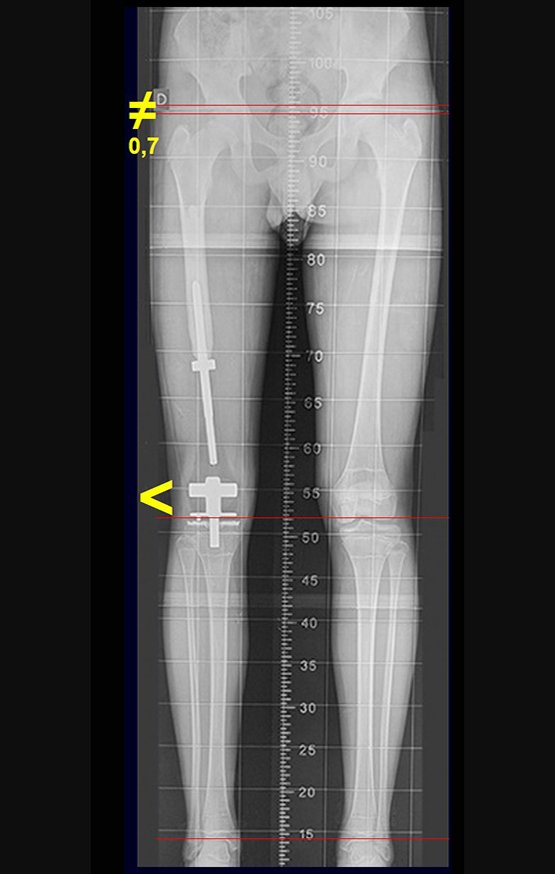
Antes da última etapa da quimioterapia neo-adjuvante, realizamos radiografias com régua do segmento a ser ressecado, para o planejamento da cirurgia e a confecção de prótese especial, quando necessária, figuras 23 e 24. Nas crianças em crescimento, este procedimento geralmente é necessário devido às diferentes larguras do canal medular, variados tamanhos dos côndilos femorais, além de dispositivos especiais que permitem preservar o potencial de crescimento da placa epifisial.
Nesta etapa realizamos também uma nova ressonância magnética para o estudo por imagem da evolução da lesão, figuras 26 a 41. É raro, mas o tumor pode ter aumentado durante a quimioterapia e precisará ser ressecado com margem oncológica. Entretanto, o segmento a ser removido com margem, nunca poderá ser menor do que o tamanho planejado com a ressonância inicial, dimensionado na incidência em T1.
A cirurgia de ressecção do tumor foi realizada por via medial, retirando-se todo o trajeto da biópsia e a incisão da pele lateral juntamente com a peça cirúrgica. A técnica cirúrgica é explicada nas figuras 42 a 98.
A abordagem deve ser realizada sem garroteamento do membro e com uma criteriosa hemostasia, visando o mínimo de perda sanguínea em paciente imunodeprimido.
Vídeo 1: Flexão e extensão livres, sem limitação.
Vídeo 2: Colocação de hemostático de tecidos moles.
Vídeo 3: Paciente quimioterapia pós-operatória e em fisioterapia, boa extensão e boa flexão do joelho.
Vídeo 4: Paciente em quimioterapia e fisioterapia após onze meses da cirurgia. Função de flexão ativa, com carga, de aproximadamente 45 graus.
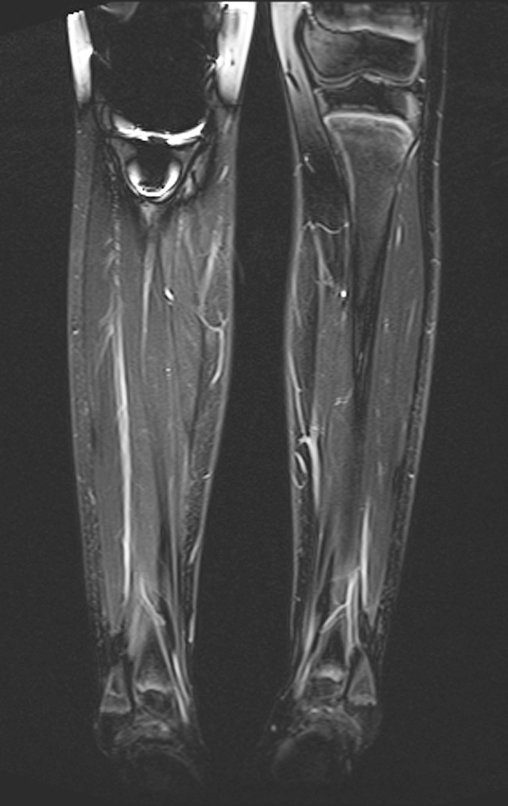
Observe que já houve crescimento da tíbia. A seta vermelha aponta a cicatriz onde se encontrava a placa de crescimento. A seta branca aponta a posição atual da placa de crescimento. A barra amarela marca o quanto este segmento ósseo cresceu, figura 130.
Vídeo 5: Extensão ativa de 180 graus e flexão de 90 graus, em 29/09/2015, após dezesseis meses da cirurgia.
Vídeo 6: Função de deambulação e flexão de 90 graus, ativa e com carga, após dezesseis meses da operação.
Vídeo 7: Bom equilíbrio e boa função para as atividades da vida diária.
O trajeto da haste atravessando a linha epifisial é correto, e está de acordo com a técnica empregada. A presença da haste pode preocupar quanto a possibilidade de interferência no crescimento da fise, por tratar-se de técnica pouco conhecida, mas isto não ocorre.
A passagem cuidadosa desta haste de 1,0 cm de diâmetro, protegida por uma “camisa” de polietileno e não cimentada, não bloqueia a cartilagem de crescimento.
Pode-se certificar que a fise proximal da tíbia segue o seu crescimento, sem bloqueio, apesar de ter recebido no seu ponto central a passagem do componente tibial rotatório, protegido pela camisa de polietileno, figura 155.
É evidente este crescimento, principalmente se compararmos com a figura 130, de 16/06/2015, quatro meses antes.
A seta vermelha aponta a cicatriz onde se encontrava a placa de crescimento. A seta branca aponta a posição atual da placa de crescimento. A barra amarela marca o quanto este segmento ósseo cresceu. Nesta ocasião indicamos a epifisiodese, para controlar a discrepância.
Vídeo 8: Função em dezembro de 2016, após dois anos da cirurgia. Marcha sem claudicação, boa função de flexão com carga.
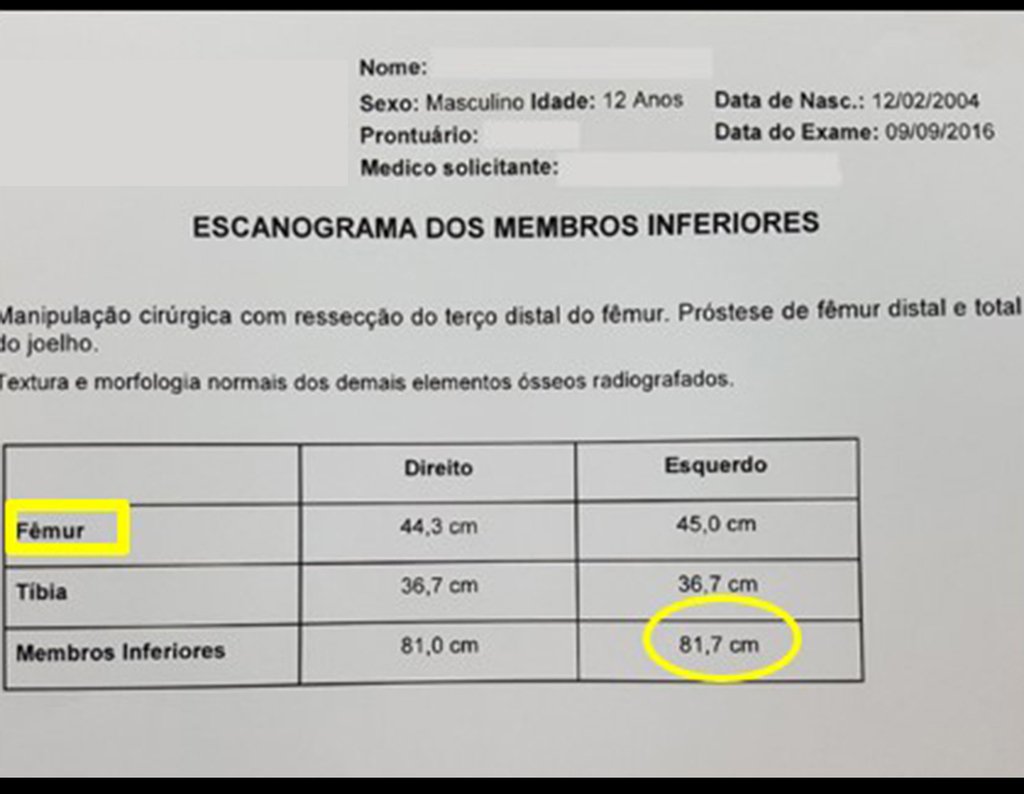
Entre a indicação da epiofisiodese e a sua realização passaram cinco meses. Neste período o paciente apresentou um estirão de crescimento significativo, aumentando a discrepância dos membros inferiores, passando agora para 1,5 cm. Escanograma de janeiro de 2017, figura 165.
Vídeo 9: Equilíbrio e função, em janeiro de 2017, após três anos da cirurgia.
Vídeo 10: Evidente discrepância dos membros inferiores.
Programamos a epifisiodese para bloquear definitivamente apenas o crescimento da cartilagem de crescimento distal, do fêmur contralateral.
Este procedimento é realizado com o paciente anestesiado, sob controle de radioscopia, conforme descrito nas figuras abaixo.
Repete-se o mesmo procedimento para o fio de medial para lateral, tomando-se o cuidado de conferir o paralelismo entre eles, deixando espaço para que não se choquem no cruzamento.
Inicia-se, a seguir, a perfuração da cortical com a broca calibrada para a passagem do parafuso canulado de rosca total.
Autor: Prof. Dr. Pedro Péricles Ribeiro Baptista
Oncocirurgia Ortopédica do Instituto do Câncer Dr. Arnaldo Vieira de Carvalho
Consultório: Rua General Jardim, 846 – Cj 41 – Cep: 01223-010 Higienópolis São Paulo – S.P.
Fone:+55 11 3231-4638 Cel.:+55 11 99863-5577 Email: drpprb@gmail.com
Técnica de Ressecção de Metástase Óssea de Tumor Renal no Fêmur. Paciente masculino, com 57 anos de idade, refere aparecimento de lombalgia, em final de outubro de 2014, com irradiação para o MIE. Devido a progressão dos sintomas, realizou uma ressonância da coluna que relatou presença de hérnia discal L5-S1. Iniciou fisioterapia e com a piora dos sintomas realizou uma tomografia em 18/02/2015, com relato de artrose facetaria L2-L3, L3-L4 e discopatia L5-S1 com protrusão ao canal medular e radiografias da bacia, figuras 1 e 2.
14. Radioterapia – Técnica de ressecção de metástase óssea de tumor renal no fêmur – Reconstrução com endoprótese de polietileno
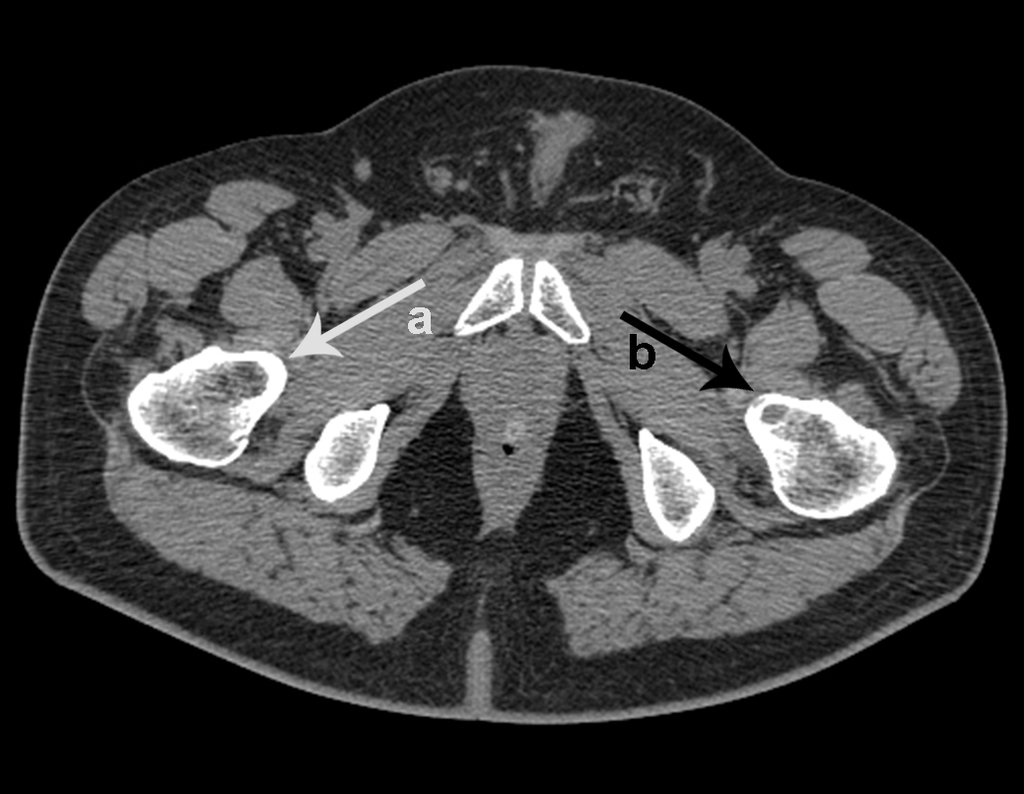
No dia seguinte, em 19/02/2015, fez ressonância, agora do quadril, onde aparece lesão osteolítica no colo femoral esquerdo e região do trocânter menor, de 3,6 cm de diâmetro, com componente de tecidos moles infiltrando tendões e músculos, figuras 3 a 9.
Repetiu a radiografia e realizou tomografia em 20/02/2015, figuras 10 a 13.
O paciente procura atendimento em Hospital especializado na área de oncologia.
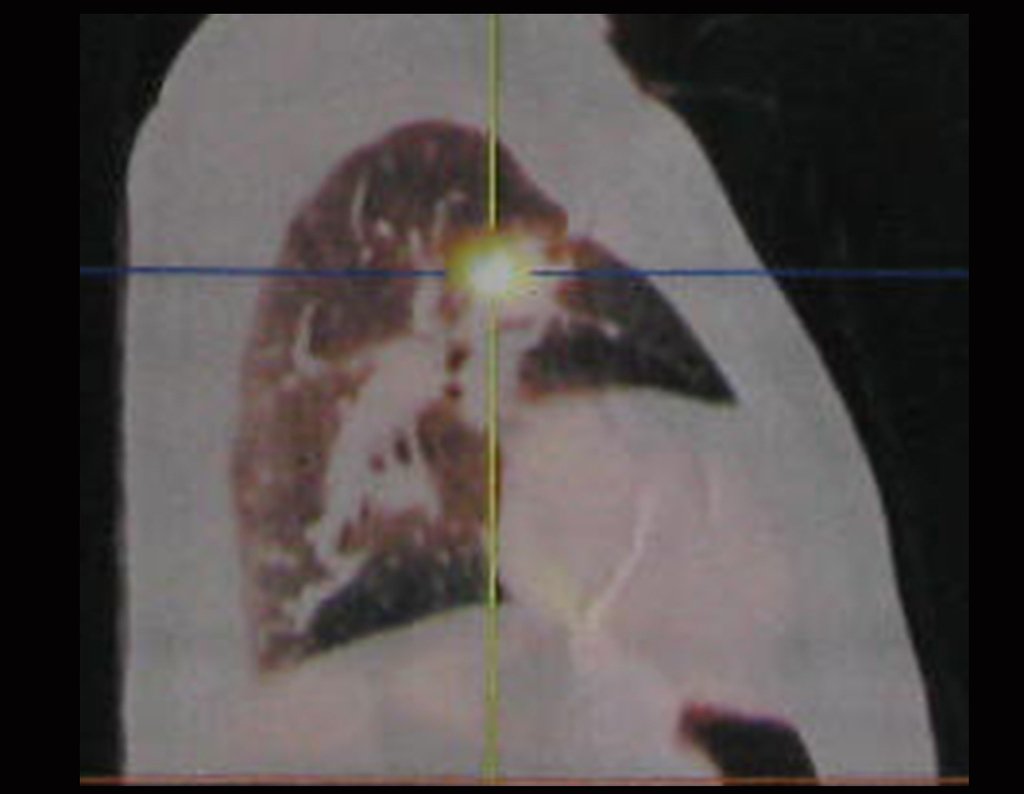
Em 23/02/2015, após a avaliação clínica e das imagens que possui, solicitamos exame de Pet-Ct, para completar os estudos de imagem e estadiamento da lesão.
Este exame mostrou lesões hipermetabólicas: pulmonar à esquerda, SUV=13,2 (provável processo primário) e lesão no colo femoral esquerdo, SUV=10,7 (provável processo secundário), figuras 16 a 21.
Realizou biópsia do pulmão e fêmur, cujo anátomo patológico diagnosticou adenocarcinoma invasivo, com padrão acinar, infiltrando tecido pulmonar e adenocarcinoma metastático em tecido ósseo. Presença de mutação no éxon 21 c2573T>G(L858R) do gene EGFR. Ausência de rearranjo no gene ALK. Em 05/03/2015, Foundation One: Mutação do EGFR: amplificação do ERBB3: amplificação do CDK4: TP53L257P, MYSTT3. Sem mutação em RET: ALKBRAF; Kras; ERBB2; MET, laudos figuras 22 a 24.
Após a avaliação, foi instituído o tratamento com radioterapia estereotáxica extracraniana para controle da lesão do colo femoral e quimioterapia com: Pemetrexede (500 mg/m2) + Cisplatina inj (75 mg/m2) a cada 21 dias. C1D1 25/02/2015; C2D1 18/03/2015, relatório figura 25 e reavaliação clínica em 08/04/2015, figuras 26a e 26b.
O planejamento do tratamento radioterápico executado foi:
1- Técnica: Radioterapia Estereotáxica Extra Craniana (SBRT)
2- Dose de prescrição: 2000 cGy em fração única
3- Energia: 15 MV
4- Técnica: 3D
5- Dose máxima no PTV: 2362 cGy
6- Dose mínima: 1808 cGy
7- Dose mediana: 2195 cGy
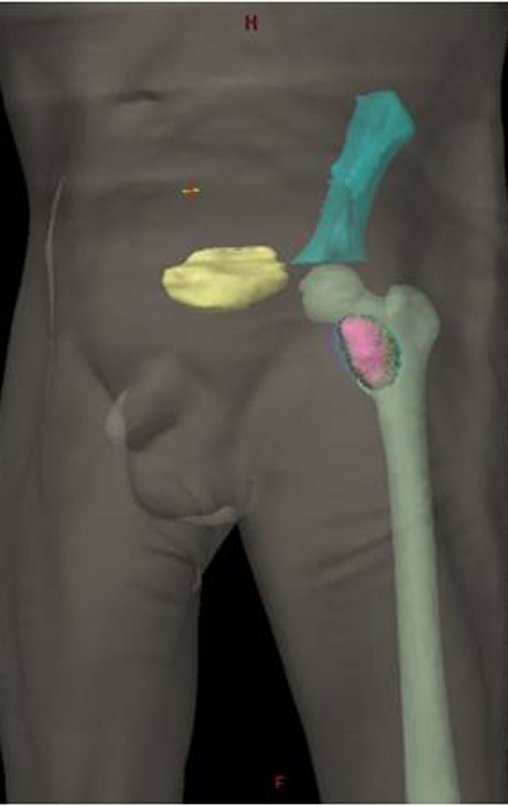
As figuras 26 c à 26j documentam o tratamento adjuvante instituído.
A tomografia do tórax de abril, as radiografias e a tomografia do quadril de maio de 2015 podem ser analisadas nas figuras 33 a 38.
Na avaliação ortopédica desta época, o paciente não apresentava sintomatologia significativa.
Ponderamos quanto ao pouco tempo decorrido da radioablação e do tratamento quimioterápico, bem como quanto ao risco de fratura.
A irrigação medular do colo femoral no adulto é retrógada, da metáfise para a epífise. A principal irrigação da epífise é pela artéria circunflexa posterior, que pode ter sido a via da disseminação metastática e inclusive estar comprometida. Para dificultar mais, o colo femoral possui um periósteo muito débil, com escassa capacidade de regeneração óssea, causa de muitos insucessos na consolidação óssea, quando ocorre fratura nesta região.
Juntamente com o paciente e familiares, decidimos aguardar, procurando dar maior tempo e oportunidade para a reparação óssea. Optamos por reavaliar em julho, com novos exames de imagem, atentos à sintomatologia.
Postergar a cirurgia é uma decisão difícil. A expectativa e ansiedade é compartilhada e vivenciada por todos.
O paciente retorna em 22 de julho de 2015, com queixa de dor quando passa da posição sentada para em pé, dor à rotação do quadril e claudicação. Os exames de imagem, da ressonância de 18 de julho se 2015, são analisados nas figuras 39 a 59.
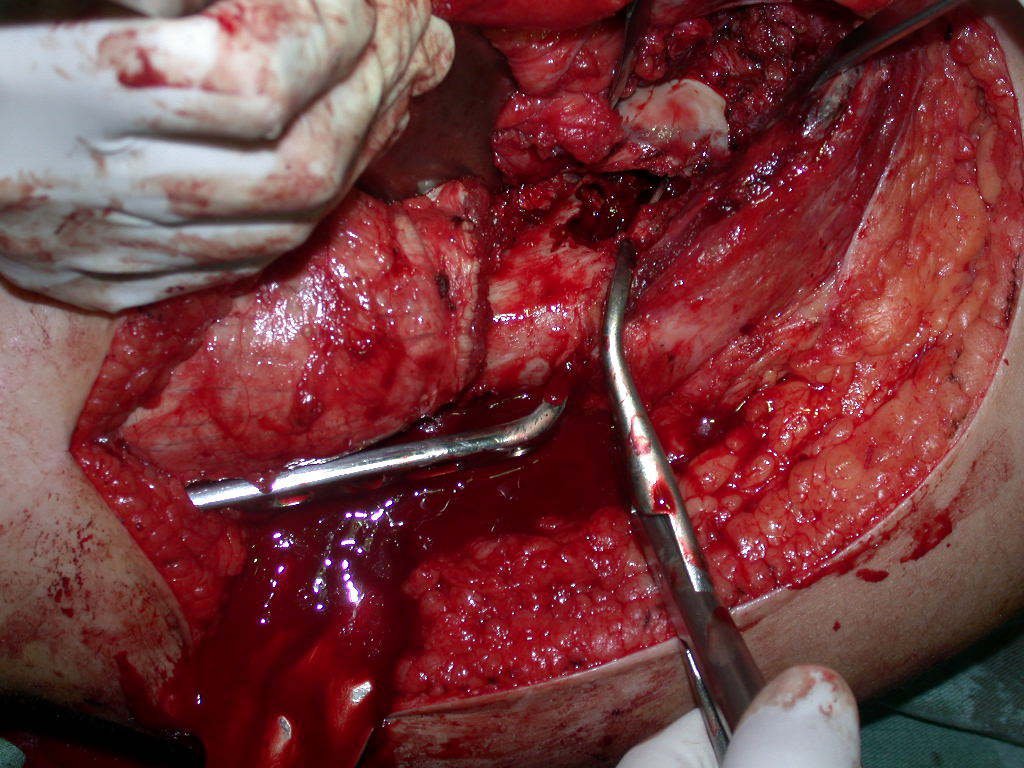
A cirurgia deve ser executada com cautela, aprofundando-se a incisão pouco a pouco, para poder realizar a hemostasia por planos. A anestesia adequada não deve induzir hipotensão, pois somente assim o cirurgião pode observar bem os capilares seccionados e certificar-se de que está realizando uma operação sem perda sanguínea, nem naquele momento e nem em tempos posteriores.
Nas cirurgias oncológicas o cirurgião não pode ter a mão “pesada”. O paciente já está debilitado pela enfermidade, pela quimioterapia, eventualmente já realizou transfusões e deve ser evitada a necessidade de reposição sanguínea. O emprego de garroteamento não deve ser empregado, a não ser em cirurgias de amputação.
Durante a anestesia o paciente não pode sentir dor. Não basta estar sedado, pois se tiver dor ela eleva a pressão, dificultando a hemostasia com eletrocautério.
Nas cirurgias de metástases ósseas do terço proximal do fêmur, podemos desinserir o tendão conjunto dos músculos glúteo médio e vasto lateral, com o bisturi elétrico, bem próximo do periósteo. É uma margem suficiente por se tratar de lesão secundária, exceto quando o tumor primitivo for melanoma.
Observem que a cirurgia com cautela permite uma adequada hemostasia. A perda de sangue está controlada, apesar de uma cirurgia de grande porte, com exposição ampla. O ato cirúrgico é como um namoro, o cirurgião oncológico não pode ser apressado.
A osteotomia pode ser realizada com serra elétrica ou com serra de Giglê.
Ela deve ser perpendicular à diáfise, para a correta adaptação da prótese. Como não há guia de corte, depende de habilidade da equipe, vídeo 1.
Vídeo 1: Corte perpendicular da diáfise, com serra de giglê.
Após a osteotomia colhe-se amostra do canal medular, para estudo da margem distal e prepara-se a exposição do acetábulo, figuras 85 e 86.
Vídeo 2: Fresagem do acetábulo e remoção da cartilagem articular.
Vídeo 3: Realização dos orifícios de contensão do cimento, para fixação da prótese acetabular.
Vídeo 4: Acetábulo preparado para cimentação. Irrigação final.
Vídeo 5: Cimentação do componente acetabular, utilizando-se o posicionador.
Vídeo 6: Retirada do excesso de cimento.
Vídeo 7: Excesso de cimento retirado.
Vídeo 8: Frezagem do canal femoral com brocas flexíveis.
Vídeo 9: Escovação das paredes e limpeza do canal femoral.
Vídeo 10: Cimentação da haste femoral no módulo de polietileno.
Vídeo 11: Colocação de cimento no canal femoral com pistola.
Vídeo 12: Orientação para realizar contração isométrica e exercícios ativos com os membros inferiores desde o pós-operatório imediato.
Vídeo 13: Flexão ativa dos quadris e joelhos.
Vídeo 14: Movimentação ativa também do membro contralateral.
Vídeo 15: Início de marcha, carga total com auxílio de andador, a partir do segundo dia pós-operatório.
Vídeo 16: Deambulando no terceiro dia após a cirurgia.
Vídeo 17: Terceiro dia de pós-operatório.
Vídeo 18: Paciente no consultório, no décimo dia após a cirurgia, em 07/08/2015.
Vídeo 19: Paciente sem queixas, trabalhando e caminhando com auxílio de bengala, em 17/09/2015, pós-operatório de sete semanas.
Vídeo 20: Paciente sem queixas, bem, caminhando com discreto Trendelenburg, em 03/08/2017, após dois anos da cirurgia.
Autor: Prof. Dr. Pedro Péricles Ribeiro Baptista
Oncocirurgia Ortopédica do Instituto do Câncer Dr. Arnaldo Vieira de Carvalho
Consultório: Rua General Jardim, 846 – Cj 41 – Cep: 01223-010 Higienópolis São Paulo – S.P.
Fone:+55 11 3231-4638 Cel.:+55 11 99863-5577 Email: drpprb@gmail.com
Técnica de Prótese Total do Úmero em Osteossarcoma. Paciente masculino, com 57 anos de idade, refere aparecimento de lombalgia, em final de outubro de 2014, com irradiação para o MIE. Devido a progressão dos sintomas, realizou uma ressonância da coluna que relatou presença de hérnia discal L5-S1. Iniciou fisioterapia e com a piora dos sintomas realizou uma tomografia em 18/02/2015, com relato de artrose facetaria L2-L3, L3-L4 e discopatia L5-S1 com protrusão ao canal medular e radiografias da bacia, figuras 1 e 2.
13. Técnica de Prótese Total do Úmero em Osteossarcoma.
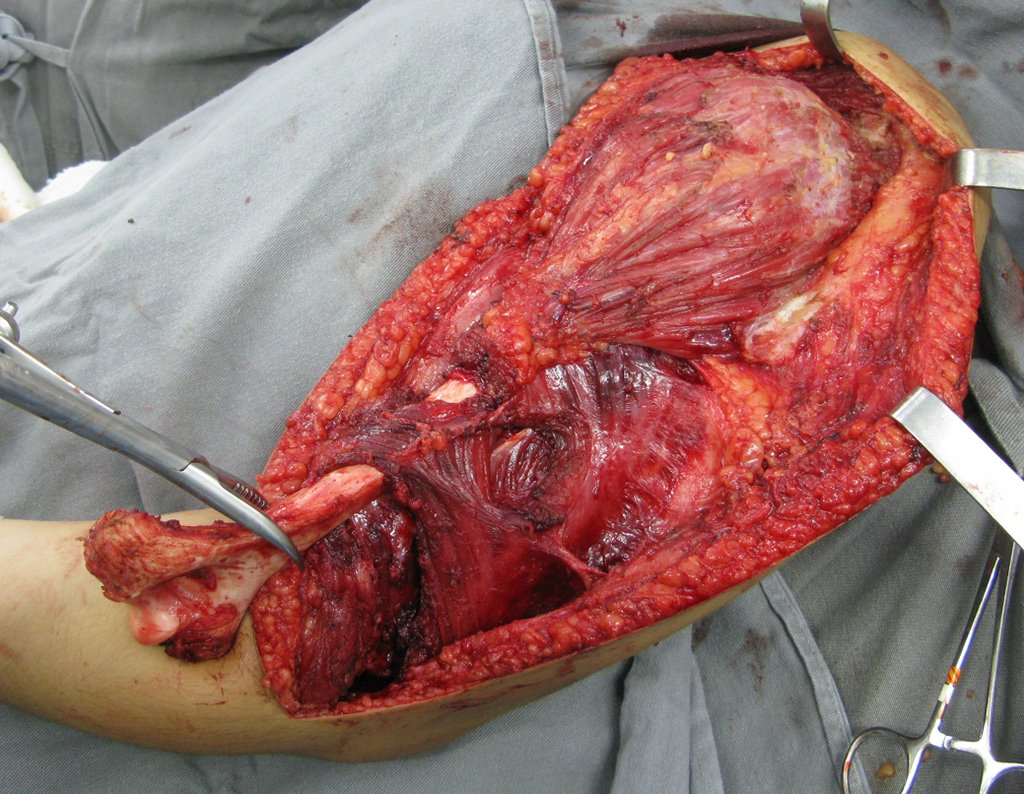
O aspecto clínico e a função do membro superior esquerdo, podem ser observados nas figuras 27 a 29.
O estudo das imagens e a análise do exame clínico, evidenciaram o comprometimento do músculo deltoide, porém com viabilidade de cirurgia conservadora, com margem, desde que se fizesse a ressecção completa do músculo envolvido e a substituição total do úmero por endoprótese modular de polietileno.
Apesar da necessidade do sacrifício funcional parcial do ombro, e da necessidade de reconstrução artroplástica, com tela de marlex para a cobertura proximal da prótese e estabilidade do ombro, a preservação do membro superior foi nossa indicação, visando oferecer um aspecto cosmético e funcional remanescente do membro satisfatório.
A cirurgia de resseção total do úmero esquerdo, incluindo todo o músculo deltoide e a reconstrução com endoprótese e tela de marlex podem ser estudadas nas figuras 31 a 75.
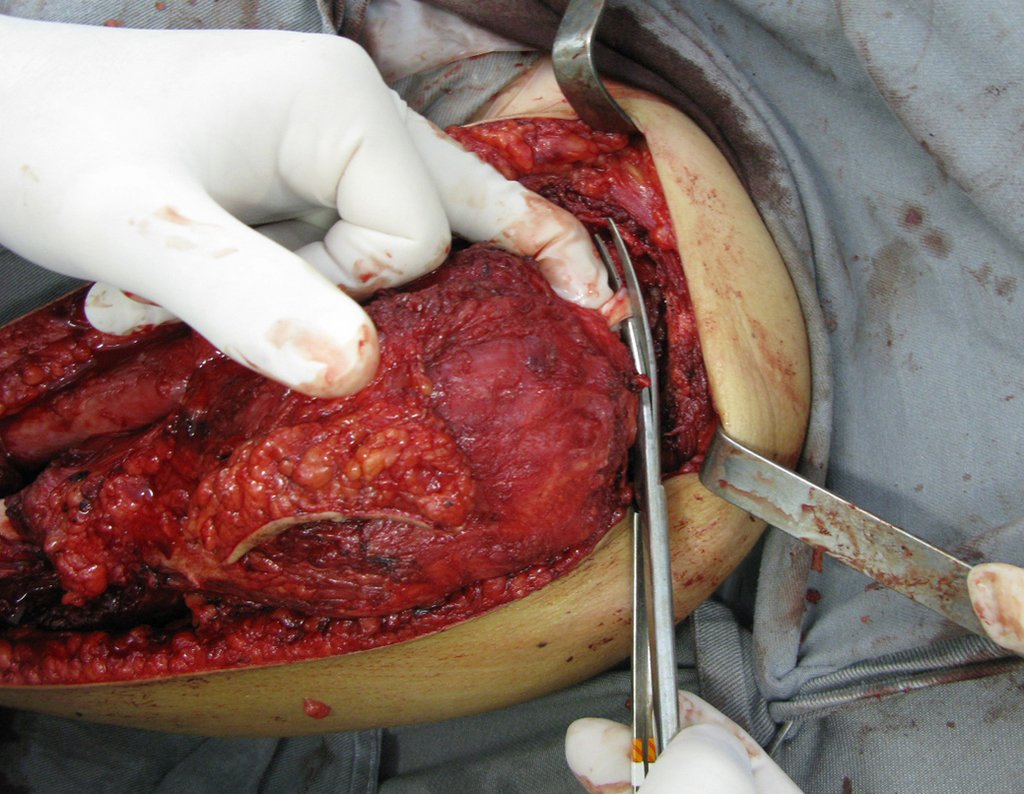
O vídeo 1 demonstra a reinserção do cabo longo do músculo bíceps braquial.
Vídeo 1: Sutura de tela de marlex ao redor da glenóide.
Como pudemos observar, todo o músculo deltoide e trajeto da biópsia, juntamente com a cápsula articular, foram ressecados. Restou apenas pele e tecido celular sub-cutâneo para a cobertura proximal da reconstrução umeral.
É preciso criar uma contenção ao redor da glenóide para estabilizar a prótese, evitando o seu deslocamento. Este mecanismo de contensão precisa permitir os movimentos rotacionais do úmero para propiciarmos uma função adequada.
Para obter este resultado vamos descrever em detalhes nossa técnica. O vídeo 2 ilustra a sutura de uma tela de marlex ao redor da glenóide, visando criar um ponto de fixação da porção proximal da prótese umeral que empregamos nesta reconstrução.
Vídeo 2: Fixação da tela de marlex na porção anterior da glenóide.
Vídeo 3: Cimentação e montagem da prótese de úmero proximal, definindo neste momento os 20 graus de rotação interna. Existe um respiro distal para a saída do excesso de cimento.
A prótese de polietileno é mais adequada por sua leveza em relação à uma totalmente metálica. O polietileno tem a elasticidade semelhante à do osso e permite que realizemos orifícios em pontos estratégicos para a reinserção de tendões e ligamentos, que eventualmente restaram mais encurtados, devido a necessidade de margem cirúrgica na ressecção.
Vídeo 4: Evidenciamos a boa fixação dos fios e da tela de marlex na região proximal da prótese total de úmero. Esta sutura é realizada com um pregueamento semelhante à saia escocesa, para permitir os movimentos de rotação.
Vídeo 5: Paciente no pós-operatório de uma semana, bom aspecto cosmético, iniciando fisioterapia.
Vídeo 6: Função do punho após 15 dias da cirurgia. Realiza por enquanto, apenas movimentos da mão e punho.
Vídeo 7: Função em agosto de 2015, após nove meses da cirurgia de ressecção total do úmero esquerdo, com exérese de todo o deltoide e reconstrução com endoprótese total de úmero com emprego de tela de marlex, para estabilização da articulação gleno protésica. Boa flexão do cotovelo, excelente função da mão e prono-supinação e boa rotação do úmero.
Vídeo 8: Paciente em fisioterapia, fazendo flexão do ombro com ajuda do membro contralateral, em 09-09-2015
Vídeo 9: Elevação do ombro com ajuda da bola e apoio na parede, em 09-09-2015
Autor: Prof. Dr. Pedro Péricles Ribeiro Baptista
Oncocirurgia Ortopédica do Instituto do Câncer Dr. Arnaldo Vieira de Carvalho
Consultório: Rua General Jardim, 846 – Cj 41 – Cep: 01223-010 Higienópolis São Paulo – S.P.
Fone:+55 11 3231-4638 Cel.:+55 11 99863-5577 Email: drpprb@gmail.com
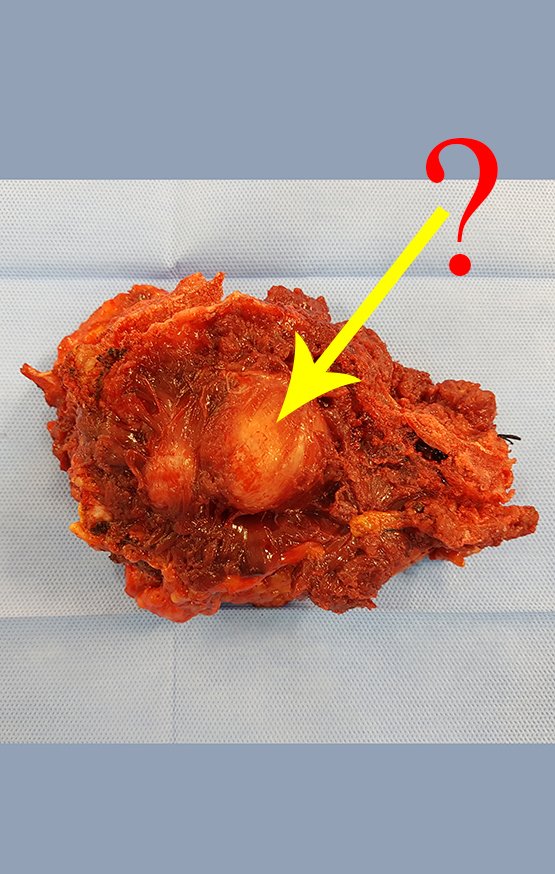
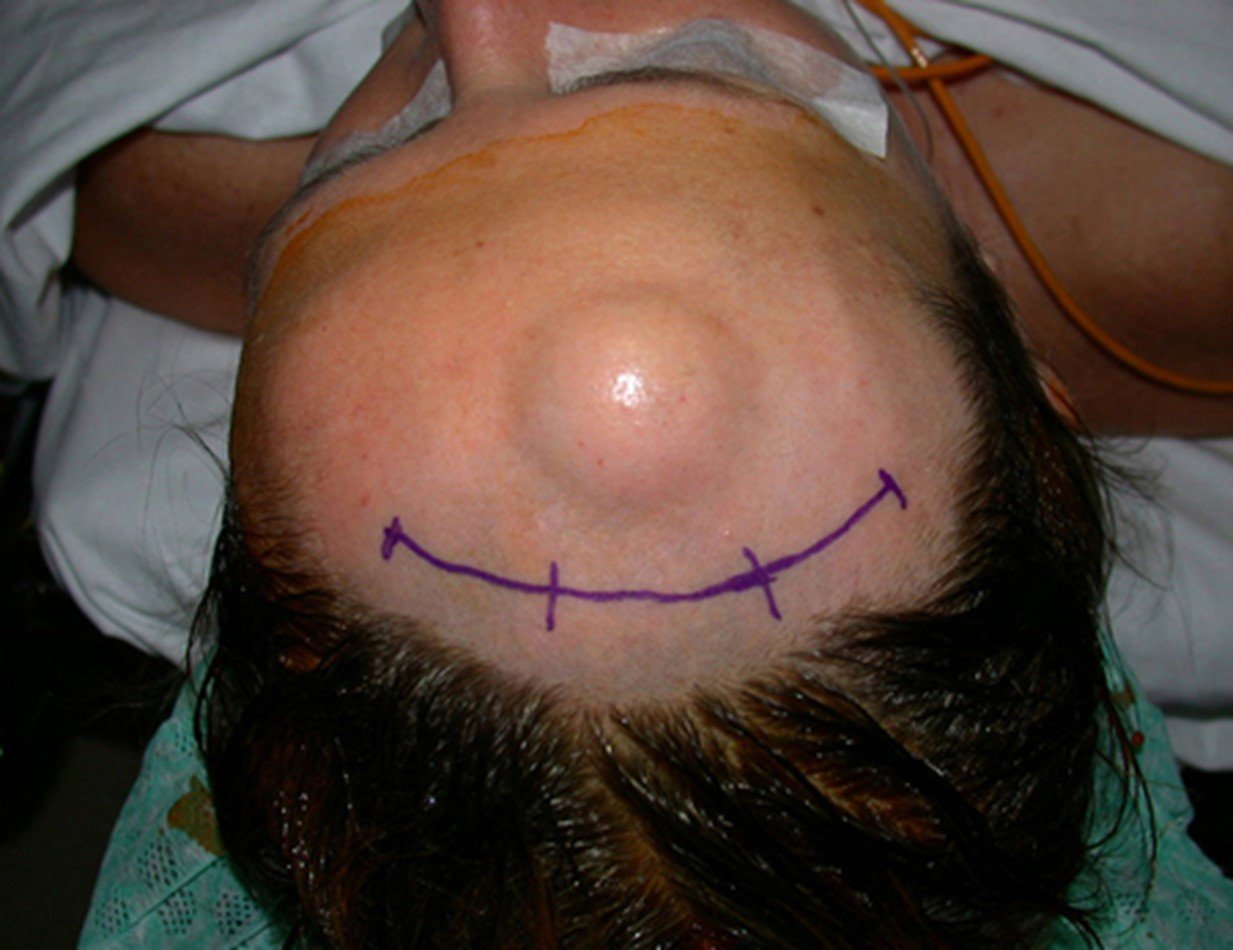
Técnica de Ressecção de Osteoma do Crânio. Paciente feminina, 48 anos de idade, com tumor na fronte havia três anos. Refere aparecimento lento e progressivo, indolor, que dificulta apenas a estética. Não observou crescimento no último ano. Lesão nodular, dura, aderida a planos profundos, com aproximadamente três centímetros de diâmetro. As figuras 1, 2 e 3 ilustram o aspecto clínico da lesão e as figuras 4 e 5 mostram o aspecto radiográfico da imagem.
12. Técnica de ressecção de osteoma do crânio
Para documentar melhor estas imagens, realizamos uma tomografia computadorizada (Figuras 6,7,8 e 9).
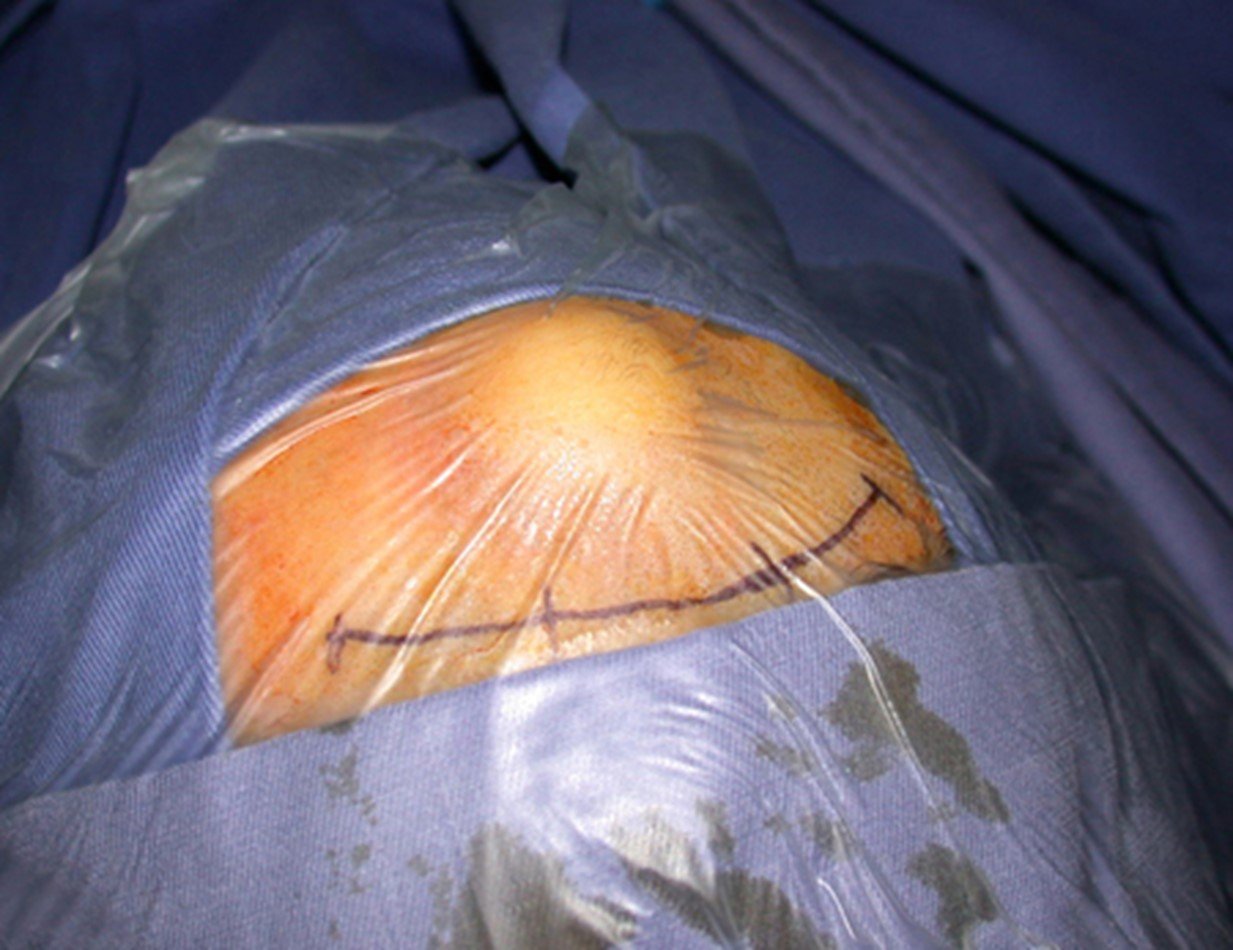
A análise da história, quadro clínico e imagens de uma lesão homogênea, compacta, com limites precisos, produtora de osso maduro permitiu o diagnóstico de osteoma, realizando-se a ressecção desta lesão por indicação estética. A cirurgia foi realizada sob anestesia geral e infiltração local, para diminuir o sangramento (figuras 10 à 20).
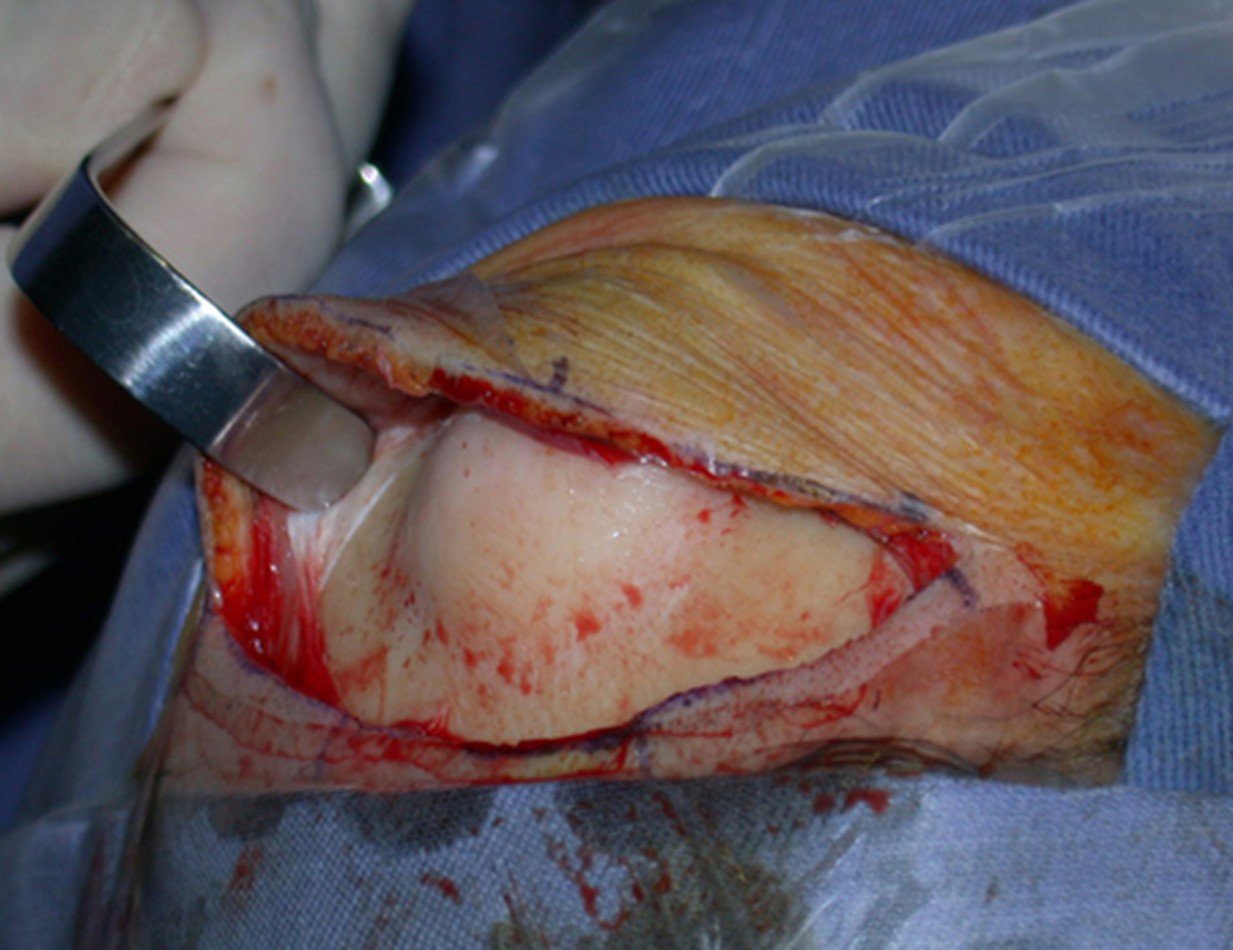
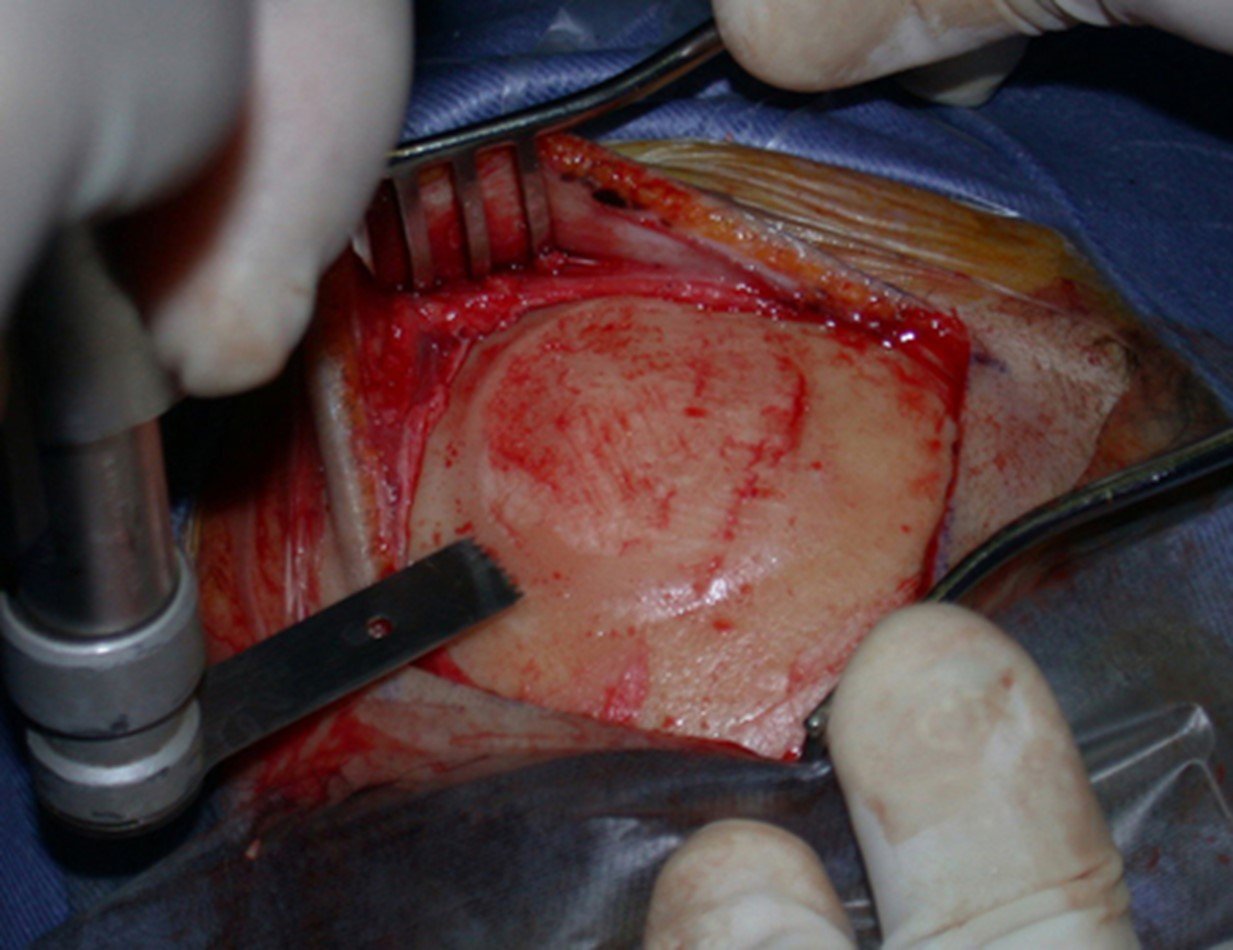
Ostectomia com serra elétrica
A Serra elétrica não se mostrou como o instrumento mais adequado para a realização da ostectomia e regularização, como podemos observar. Isto foi melhor executado com o formão (figura 17).
Autor : Prof. Dr. Pedro Péricles Ribeiro Baptista
Oncocirurgia Ortopédica do Instituto do Câncer Dr. Arnaldo Vieira de Carvalho
Consultório: Rua General Jardim, 846 – Cj 41 – Cep: 01223-010 Higienópolis São Paulo – S.P.
Fone:+55 11 3231-4638 Cel:+55 11 99863-5577 Email: drpprb@gmail.com
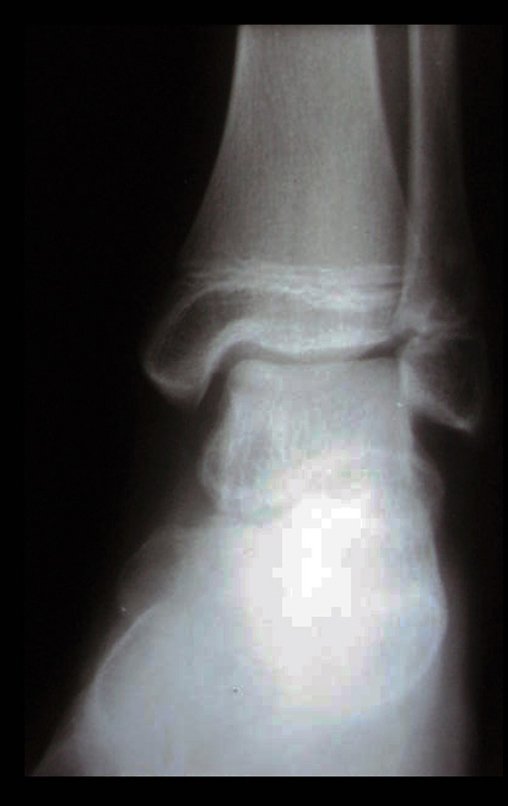
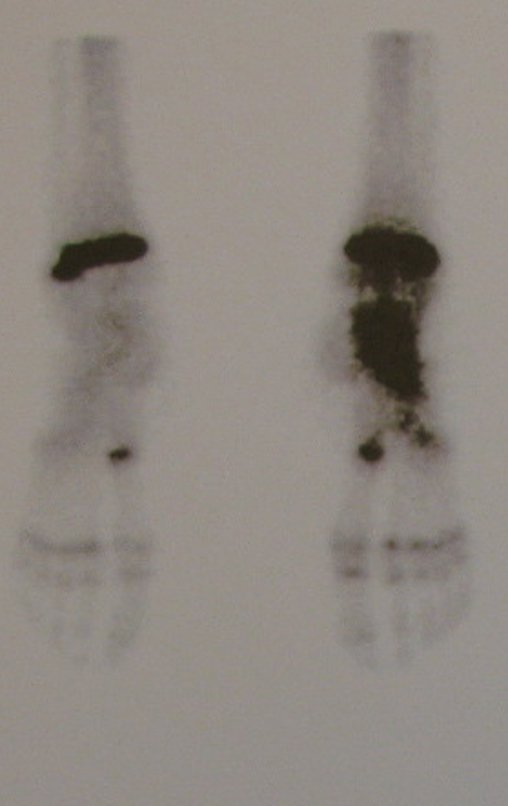
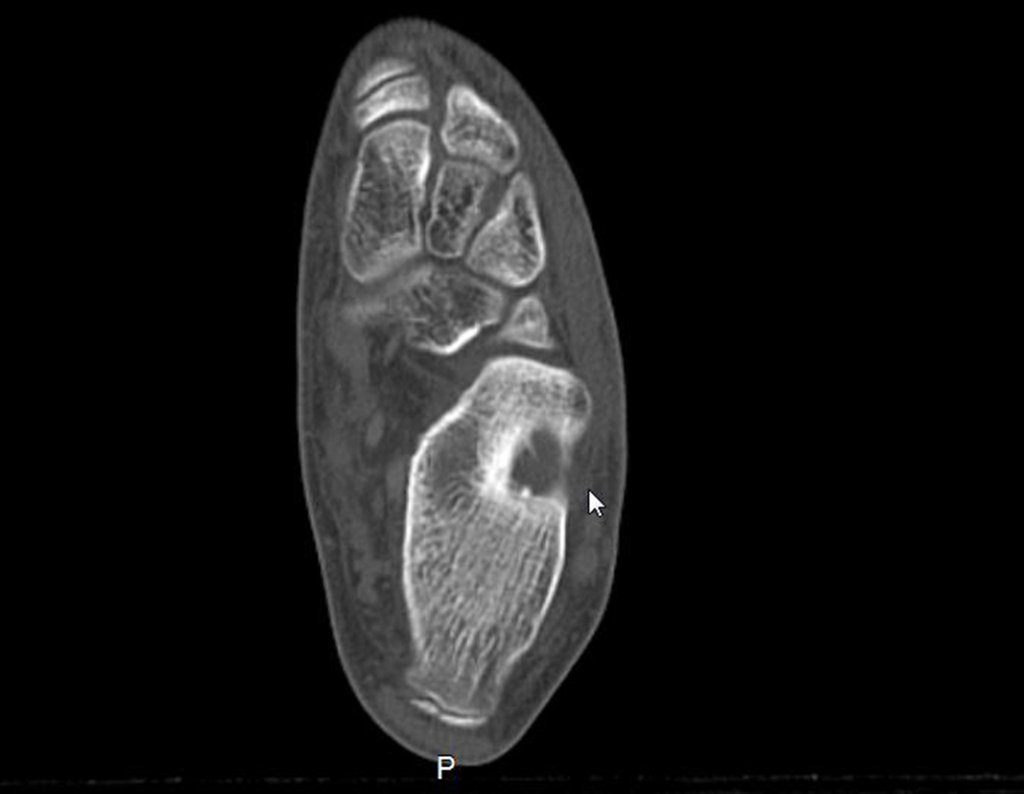
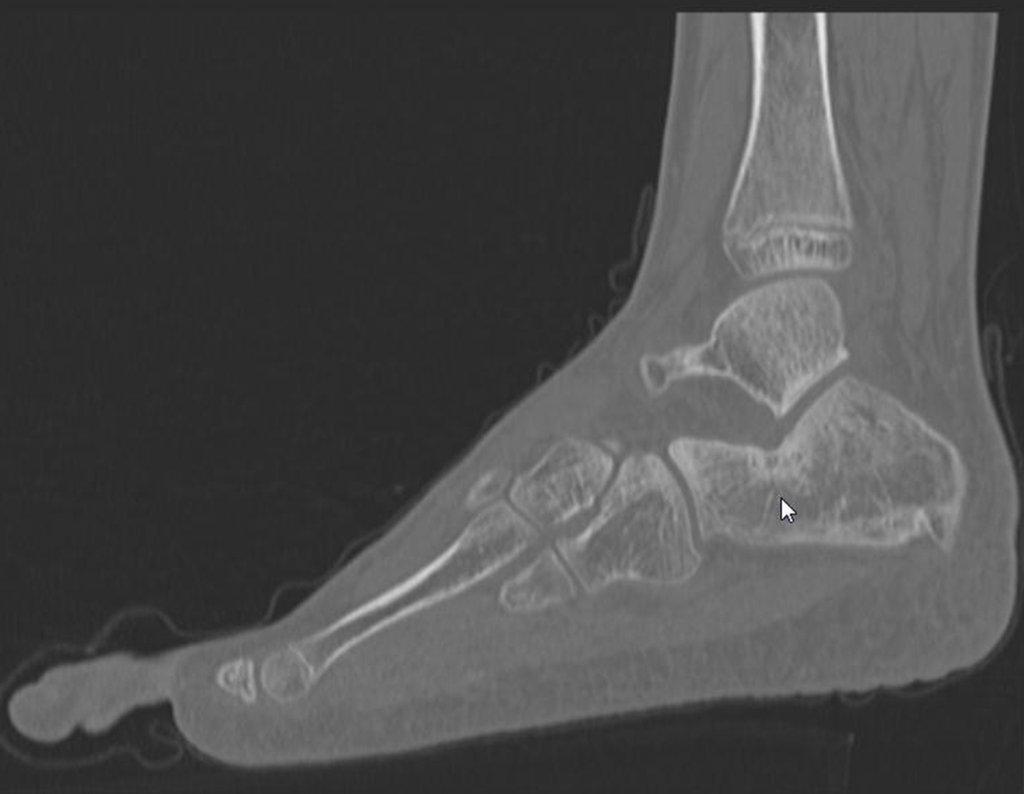
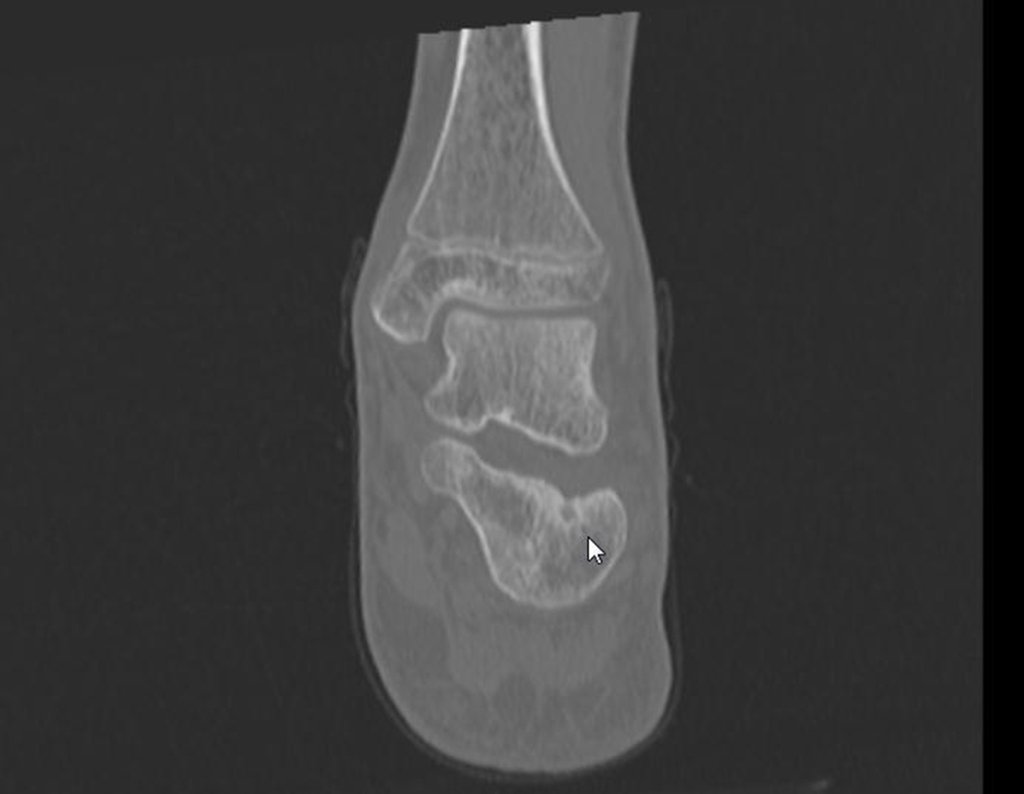
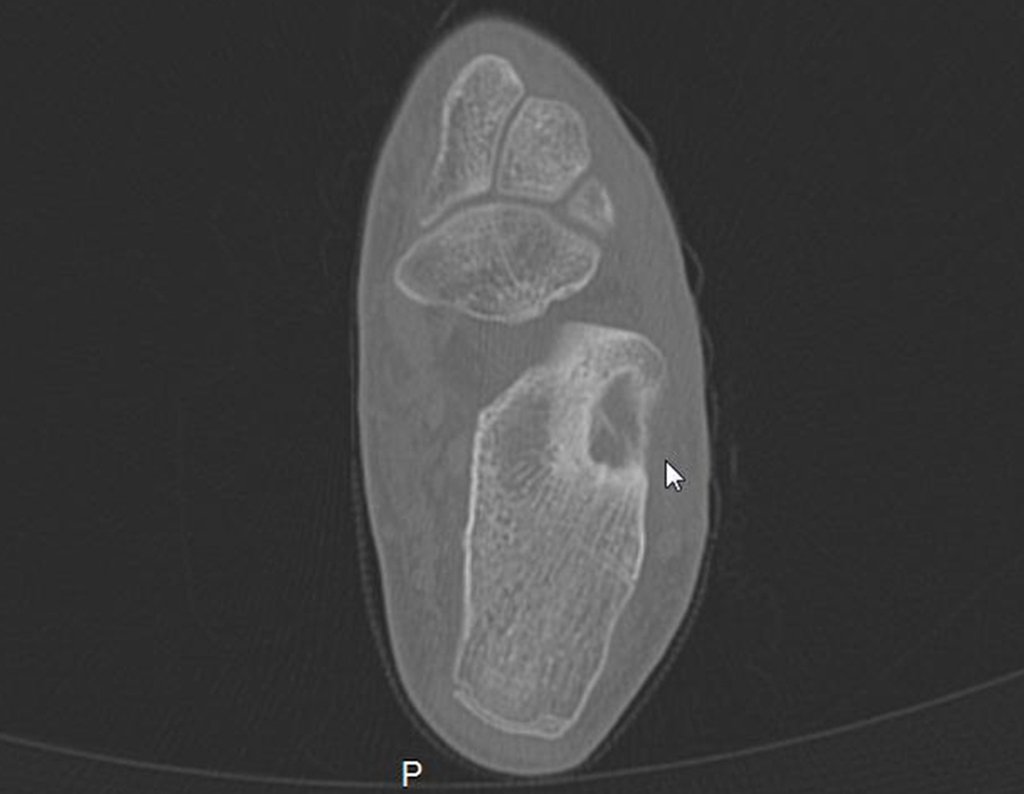
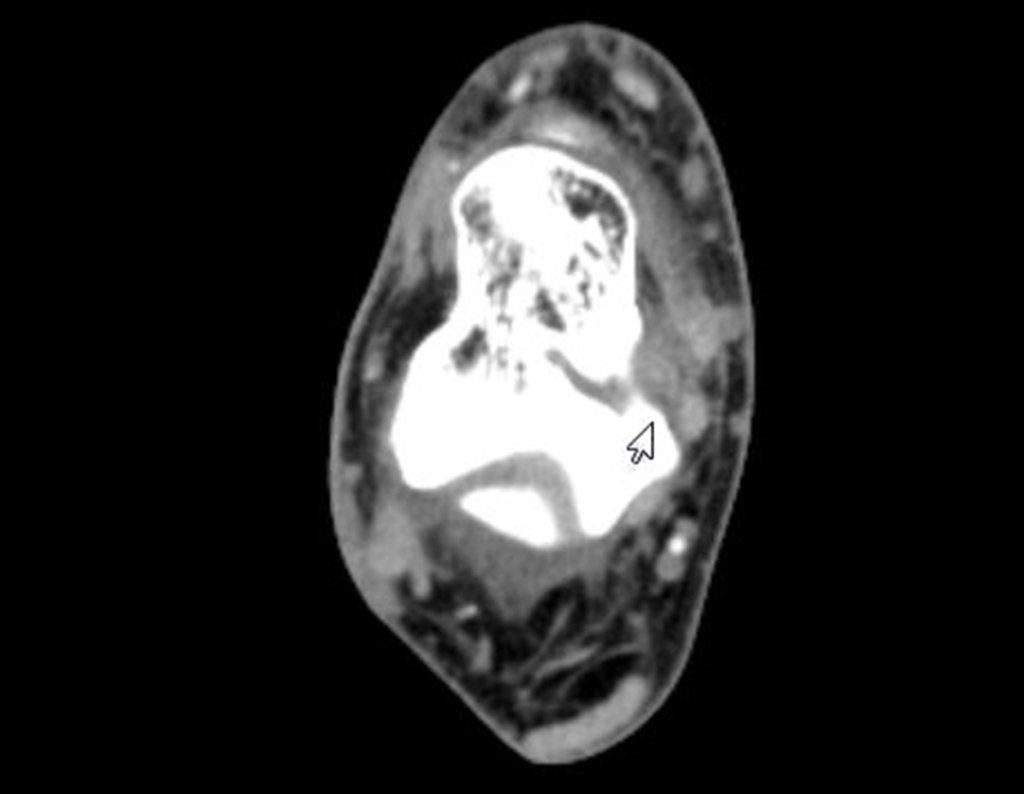
11. Radioablação em osteoma osteóide do calcâneo – Técnica de ressecção e reconstrução com enxerto autólogo
Para melhor estudo da lesão, foi realizado exame de tomografia óssea, figuras 9 a14.
Com a hipótese diagnóstica de osteoma osteóide, o ortopedista que o acompanhava indicou tratamento com radioterapia. Em abril de 2014, submeteu-se a radioablação. Durante os primeiros três meses usou analgésicos de forma intermitente.
Após quatro meses da radioablação, devido à persistência do quadro doloroso, realizou nova tomografia, em 17/08/2014.
As imagens desta tomografia computadorizada, após a radioablação, são analisadas nas figuras 15 a 20.
Qual é o significado desta imagem? Cicatriz? Persistência da lesão? O paciente continua com a mesma sintomatologia?
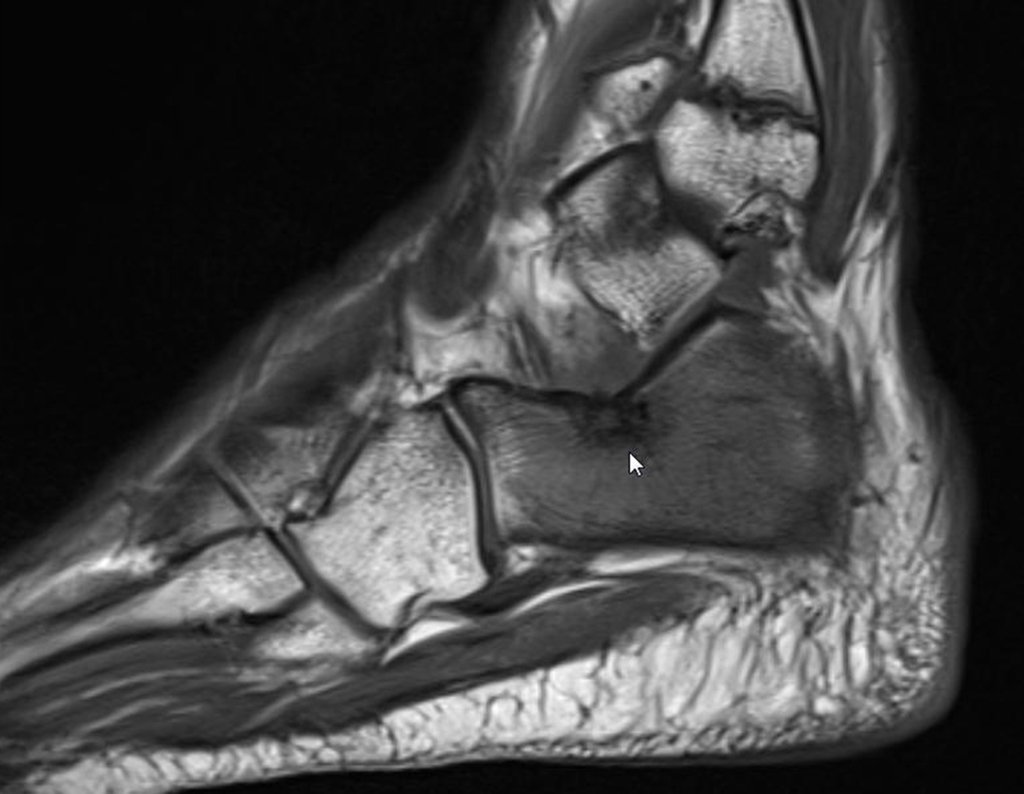
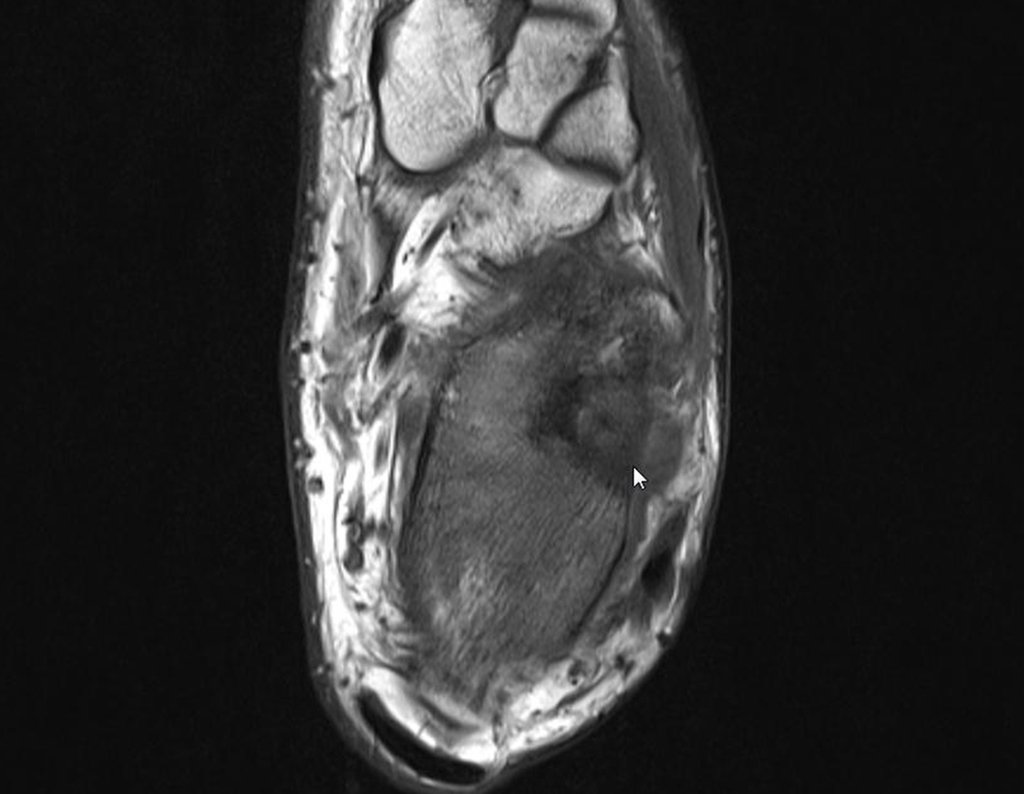
Indicado fisioterapia analgésica e troca de medicação. Sem obter melhora da sintomatologia, foi realizada uma ressonância magnética, para melhor avaliação do quadro.
O paciente é encaminhado para uma segunda opinião, sendo avaliado em dezembro de 2014, figuras 35 a 39.
Após cuidadosa análise do caso e com a evolução insatisfatória, o paciente foi submetido a cirurgia em janeiro de 2015, para ressecção da lesão e colocação de enxerto autólogo do Ilíaco.
A retirada de enxerto de ilíaco também deve ser feita com acesso cirúrgico e hemostasia adequada. Para isto é preciso incisar a pele por sobre a crista ilíaca, apenas pele e subcutâneo, realizar hemostasia cuidadosa com eletrocautério e rebater a pele distalmente, contornando a inserção do músculo oblíquo do abdome. Este deve ser desinserido da crista, como se estivéssemos “ruginando” o osso, com o bisturi elétrico. Não se deve cortar o músculo, como habitualmente fazem os cirurgiões iniciante, pois haverá sangramento.
Desta maneira poderemos realizar um acesso amplo, seguro e sem perda sanguínea desnecessária, figuras 51 a 58.
Vídeo 1: Preparando o enxerto.
O calcâneo é um osso de carga, e a sua reconstrução com enxerto ósseo autólogo tem a melhor integração, permitindo a recuperação precoce da função do paciente.
Retorno ao consultório no pós-operatório de 8 dias.
Vídeo 2: Pós-operatório de seis semanas, em 25/02/2015.
Vídeo 3: Mobilidade normal do tornozelo.
Vídeo 4: Paciente deambulando com carga total – pós-operatório de três meses.
Autor: Prof. Dr. Pedro Péricles Ribeiro Baptista
Oncocirurgia Ortopédica do Instituto do Câncer Dr. Arnaldo Vieira de Carvalho
Consultório: Rua General Jardim, 846 – Cj 41 – Cep: 01223-010 Higienópolis São Paulo – S.P.
Fone:+55 11 3231-4638 Cel.:+55 11 99863-5577 Email: drpprb@gmail.com
Sarcoma de Ewing do Úmero em Criança. Paciente com quatro anos e cinco meses de idade, apresentou dor e tumor no úmero esquerdo, em janeiro de 1991. A biópsia revelou tratar-se de Sarcoma de Ewing. O estadiamento não revelou outro foco. Submeteu-se a tratamento com quimioterapia neoadjuvante, apresentando boa resposta radiográfica ao tratamento, ocorrendo mineralização da lesão e deformidade angular pela plasticidade neoplásica, figuras 1 a 4.
10. Sarcoma de Ewing do úmero em criança – Conduta – Técnicas de ressecção e de reconstrução com placa especial – Enxerto autólogo combinado de fíbula e ilíaco
A radiografia de controle com um mês de pós-operatório e a função do membro operado são mostradas nas figuras 11 a 14.
Vídeo 1: Boa estética, apesar do encurtamento, boa função, após 22 anos da cirurgia, em 11/01/2012.
As figuras 37 a 42, ilustram etapas da evolução deste caso de Sarcoma de Ewing, tratado cirurgicamente com uma solução biológica.
Em maio de 2015, a paciente teve o seu primeiro filho, dando luz à um menino. Em 1991 ainda não realizavamos o autotransplante de cartilagem de crescimento, reconstruindo este segmento com fíbula vascularizada com a placa de crescimento, para substituir a placa do úmero que quando esta é ressecada. Entretanto, o membro superior aceita melhor a discrepância de comprimento, coroando a alternativa que empregamos na época.
Autor: Prof. Dr. Pedro Péricles Ribeiro Baptista
Oncocirurgia Ortopédica do Instituto do Câncer Dr. Arnaldo Vieira de Carvalho
Consultório: Rua General Jardim, 846 – Cj 41 – Cep: 01223-010 Higienópolis São Paulo – S.P.
Fone:+55 11 3231-4638 Cel.:+55 11 99863-5577 Email: drpprb@gmail.com
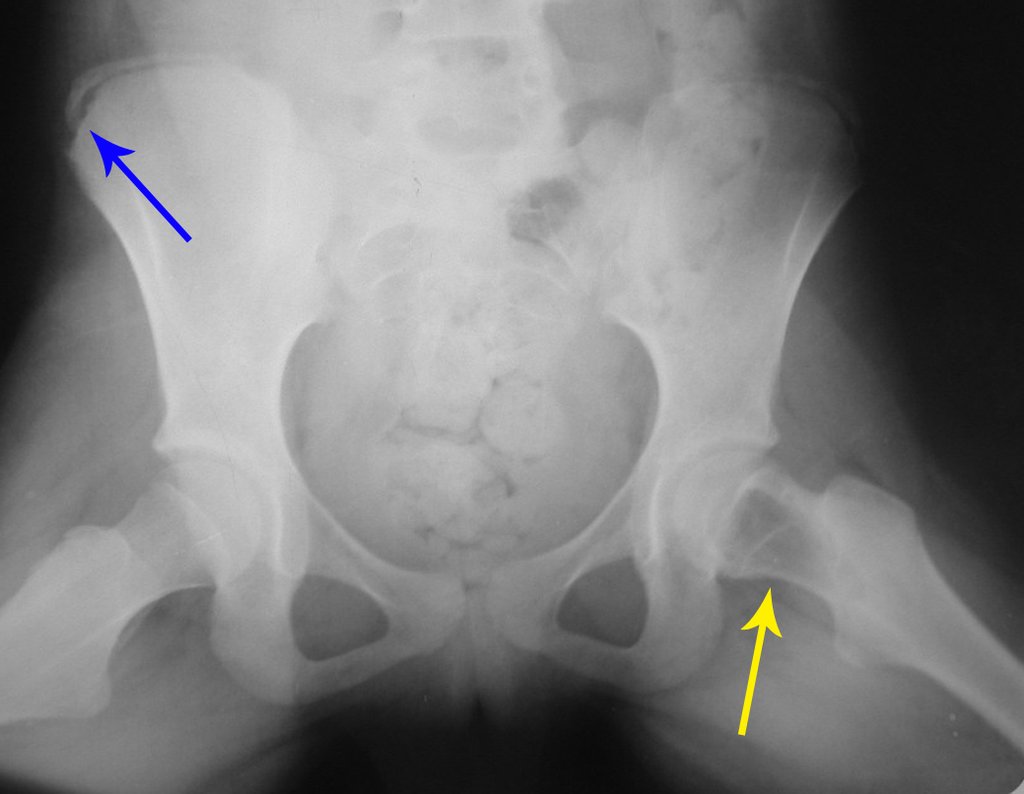
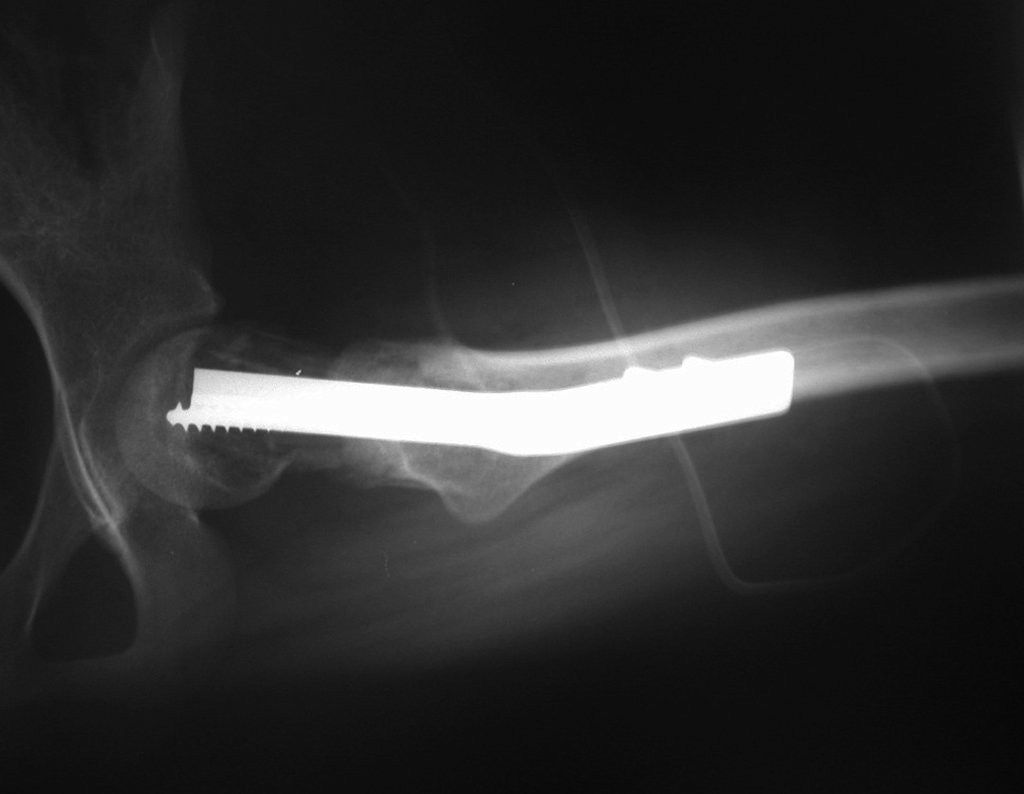
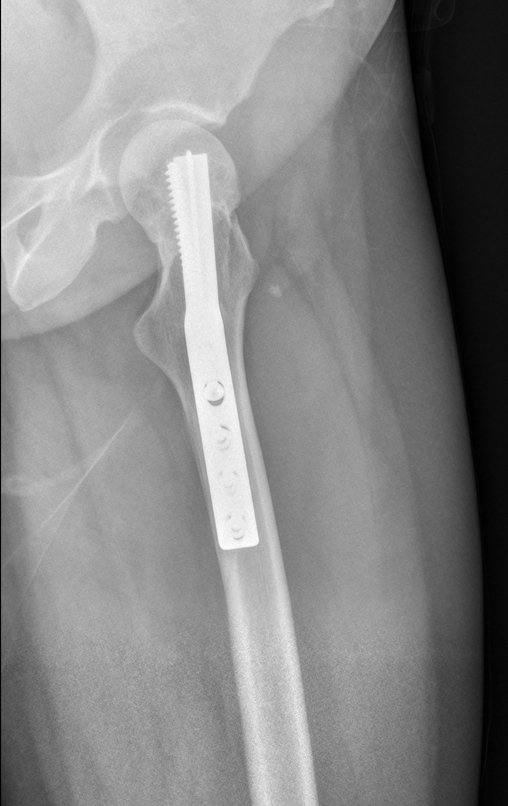
Reconstrução De Lesão Do Colo Femoral Com Fratura. Paciente com 09 anos de idade, referindo dor no membro inferior esquerdo, avaliada em janeiro de 2001, realiza radiografia da bacia, figura 1.
09. Reconstrução de lesão do colo femoral com fratura; Via de acesso e placa especial com enxerto autólogo; Cisto ósseo do colo femoral com fratura em criança.
Na radiografia, daquela ocasião, podemos observar uma lesão de rarefação óssea no colo femoral, que não foi percebida. A queixa foi interpretada como dor do crescimento, e a paciente foi sendo acompanhada durante três anos.
Em meados de 2004, o médico que a acompanhava pede a outro colega que avalie a radiografia da paciente, em um encontro no corredor do hospital. Ambos não visualizam a lesão e julgam poder tratar-se de uma “báscula de bacia”, devido à provável discrepância dos membros e optam por solicitar um escanograma dos membros inferiores, figuras 2 a 4.
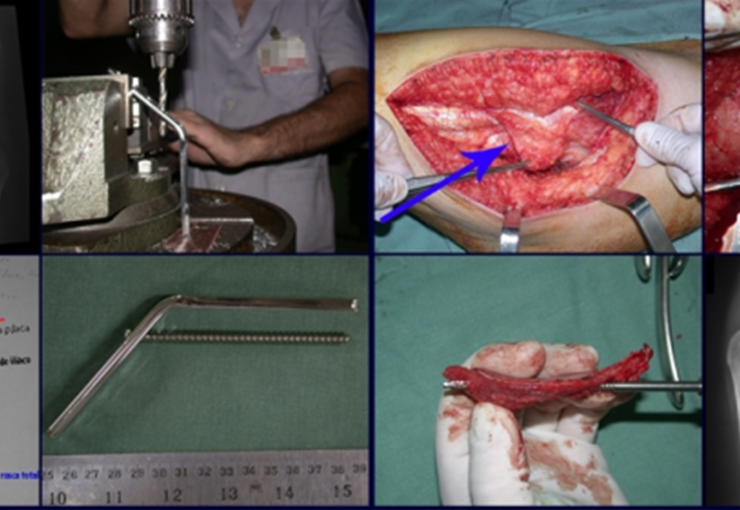
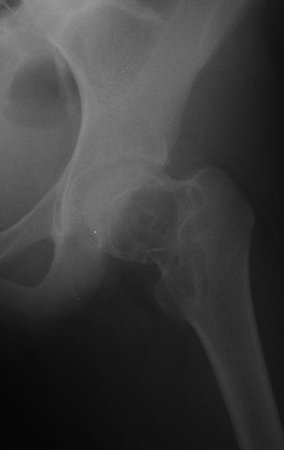
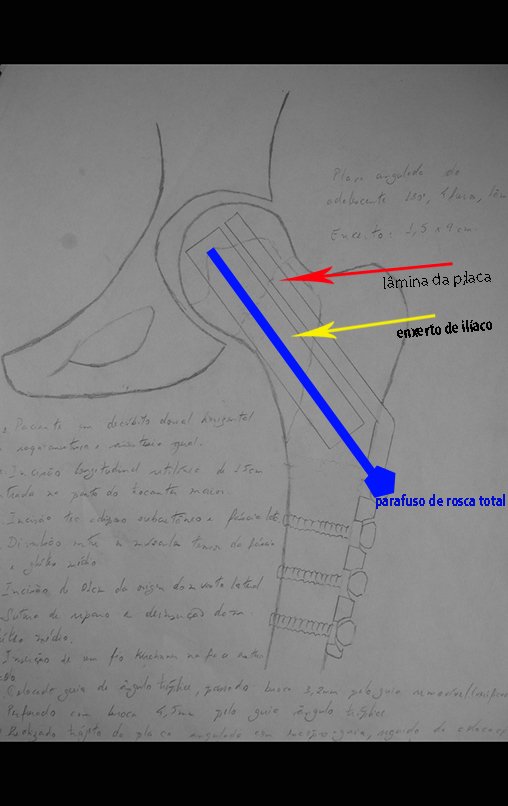
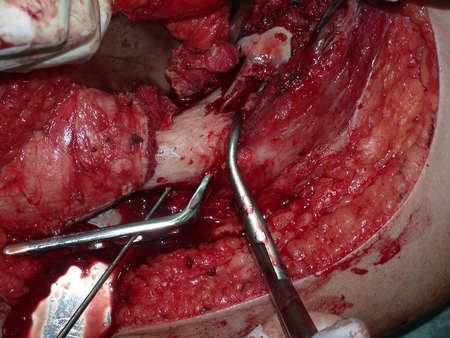
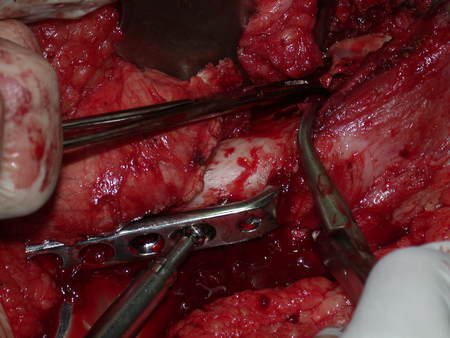
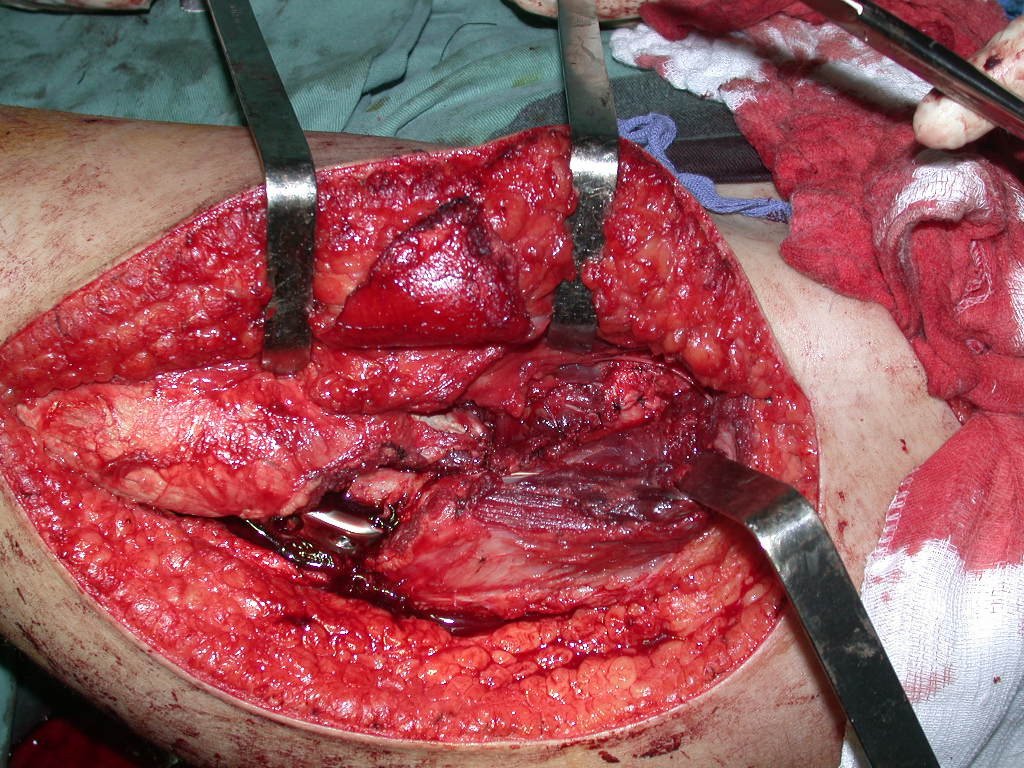
Após estas radiografias, foi feito o diagnóstico de cisto ósseo simples com fratura do colo femoral. A paciente foi encaminhada para nossa avaliação e propusemos a cirurgia para a reconstrução do defeito ósseo, a ser realizada a curetagem da lesão e a reconstrução com enxerto ósseo autólogo retirado da crista ilíaca, do mesmo lado, com a correção da deformidade angular. Para esta cirurgia fizemos um planejamento e confeccionamos uma placa especial que permitisse a colocação de um parafuso de rosca total, fixando internamente o bloco de enxerto, que serviria como uma coluna, na reconstrução, figuras 11 a 19.
Para a execução desta técnica, é preciso um acesso cirúrgico adequado, que permita realizar uma abordagem ampla e que este acesso tenha uma boa exposição, de modo a não dificultar a reconstrução nem a redução ou a osteossíntese.
O acesso cirúrgico e a reconstrução são mostrados nas figuras 20 a 81.
Esta incisão permite um acesso que deixa a face lateral da coxa totalmente exposta, sem a necessidade do afastamento da parte posterior da fáscia lata. Esta situação é fundamental para facilitar a redução e a fixação com a placa angulada.
Observe que a fáscia lata não aparece no campo operatório. Se não utilizarmos deste tipo de acesso, estaríamos com uma corda por sobre a face lateral da coxa, dificultando o posicionamento da placa e a redução dos fragmentos.
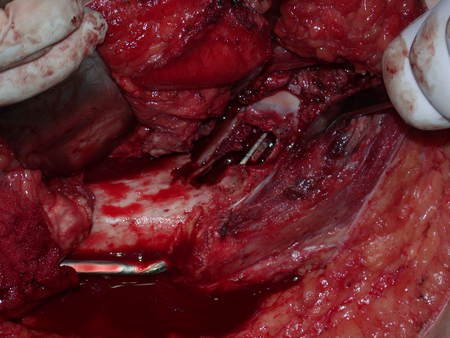
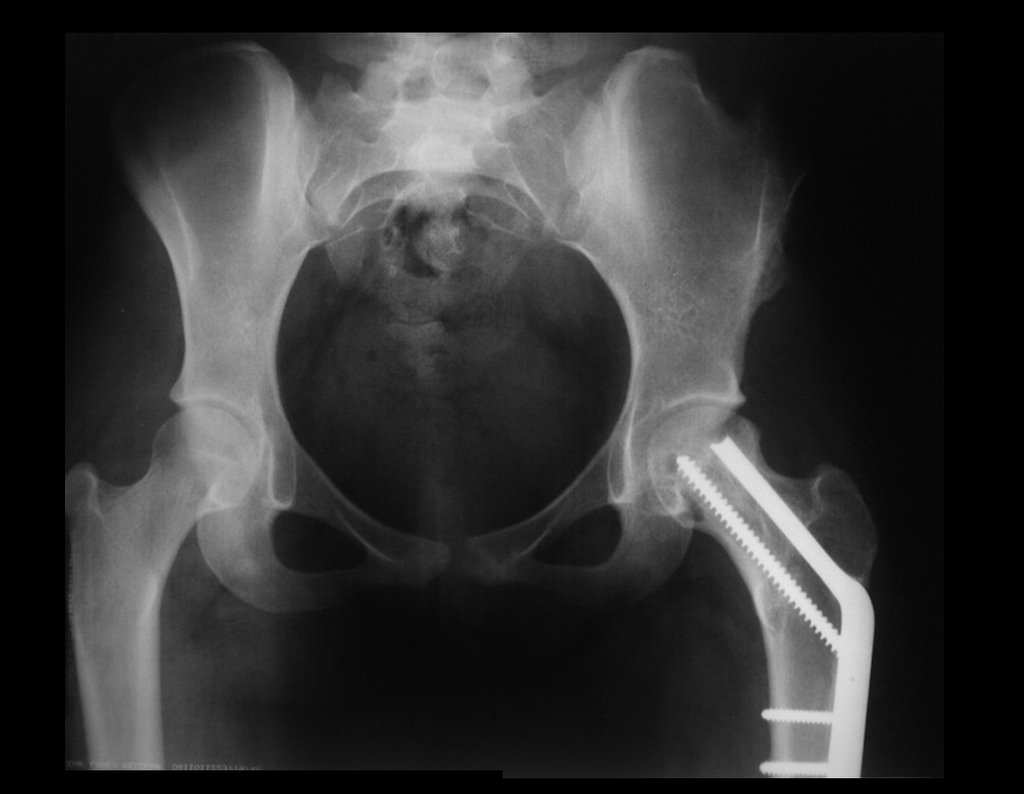
Após a cirurgia, foram realizadas radiografias de controle, figuras 82 e 83.
O enxerto autólogo propicia uma integração óssea mais precoce e melhor. A paciente encontra-se bem, com movimentação normal do quadril operado.
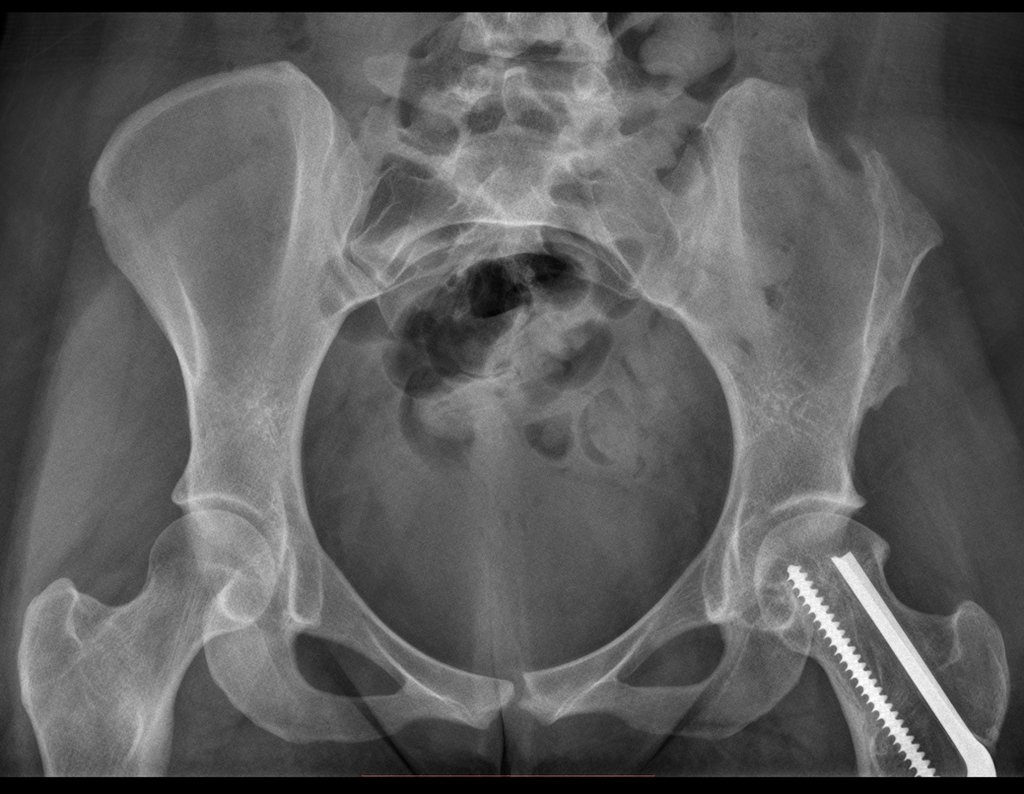
Em 19 de março de 2016, reavaliamos a paciente clinicamente e com estudo de imagens, figuras 98 a 108 e vídeo 1.
Vídeo 1: Paciente em 19/03/2016, após doze anos de pós-operatório. Boa função do quadril.
A paciente, agora casada, encontra-se bem e satisfeita com a sua função. Sem queixa.
Autor: Prof. Dr. Pedro Péricles Ribeiro Baptista
Oncocirurgia Ortopédica do Instituto do Câncer Dr. Arnaldo Vieira de Carvalho
Consultório: Rua General Jardim, 846 – Cj 41 – Cep: 01223-010 Higienópolis São Paulo – S.P.
Fone:+55 11 3231-4638 Cel.:+55 11 99863-5577 Email: drpprb@gmail.com