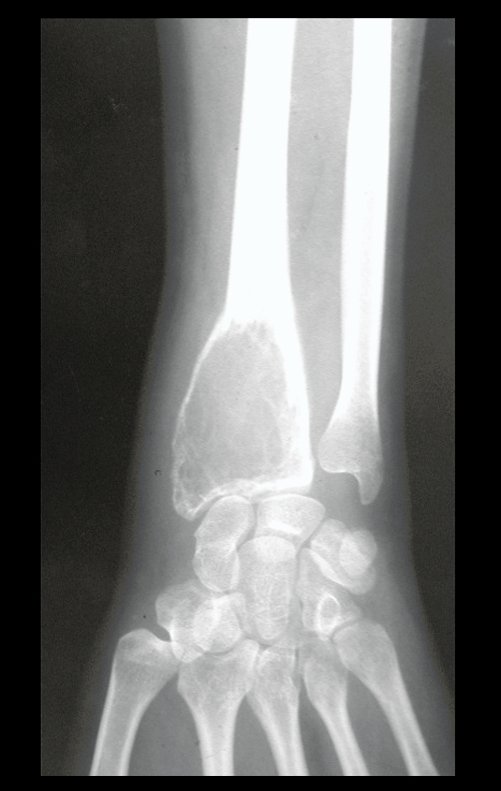
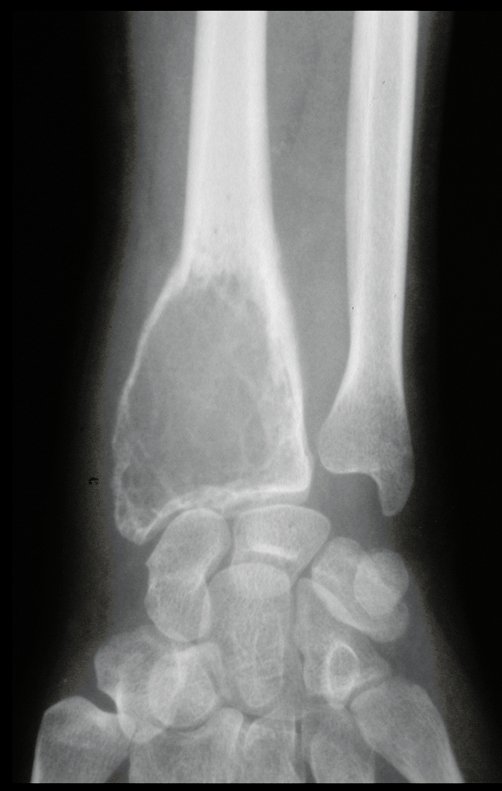
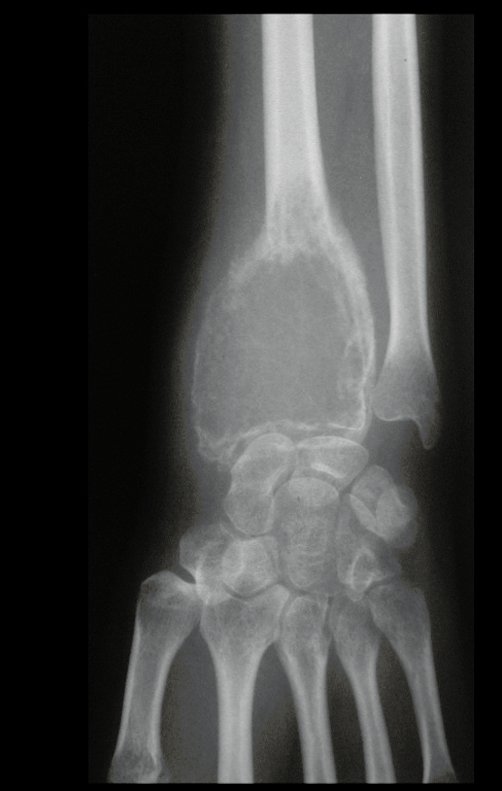
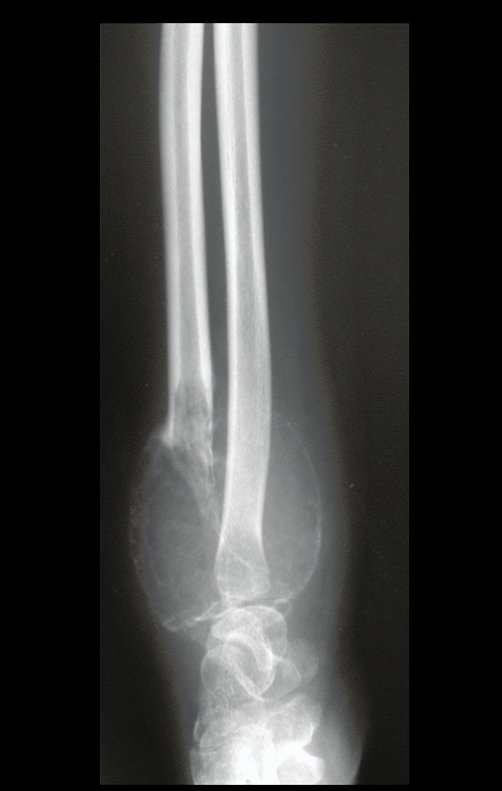
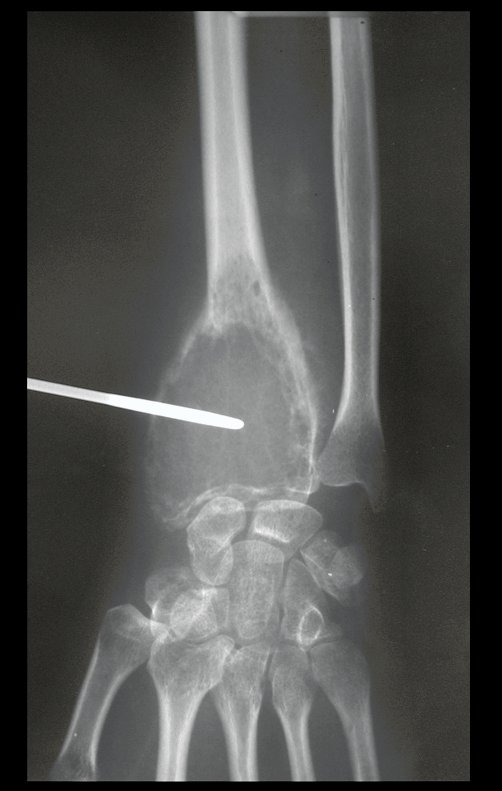
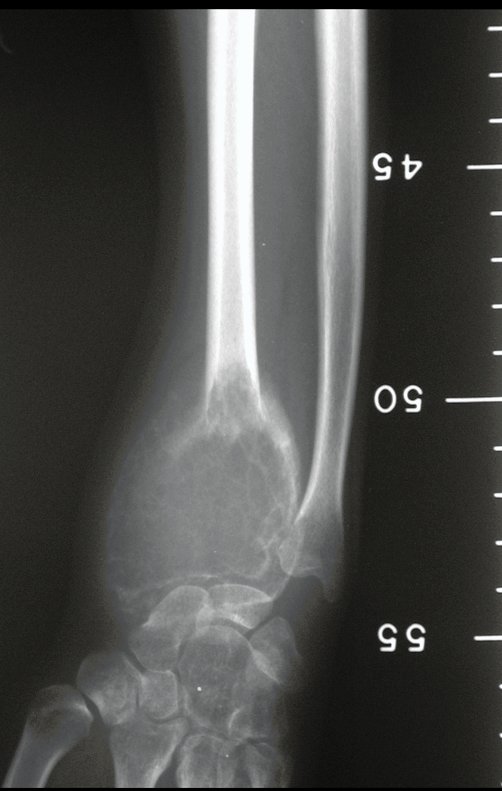
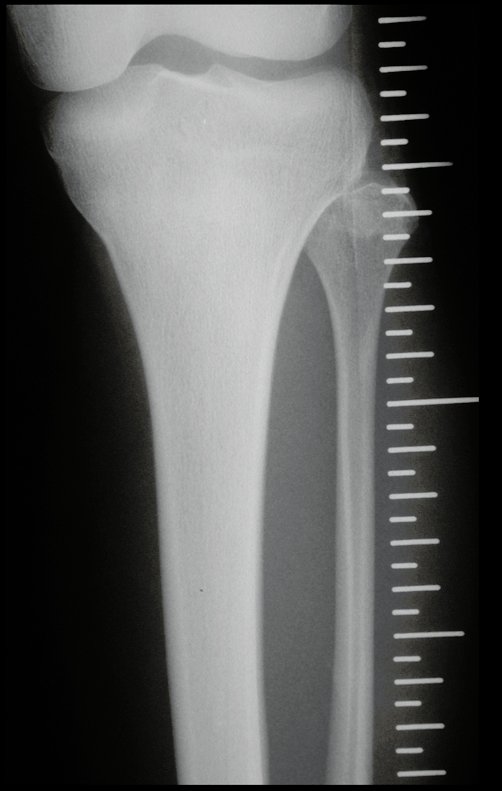
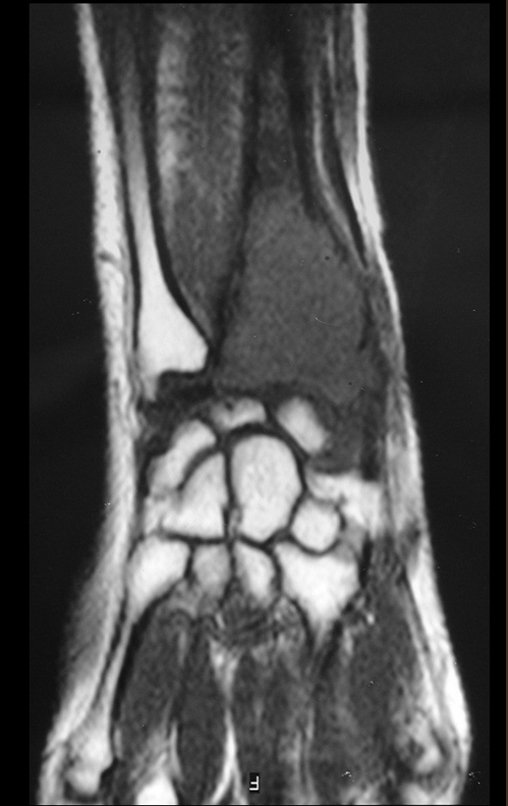
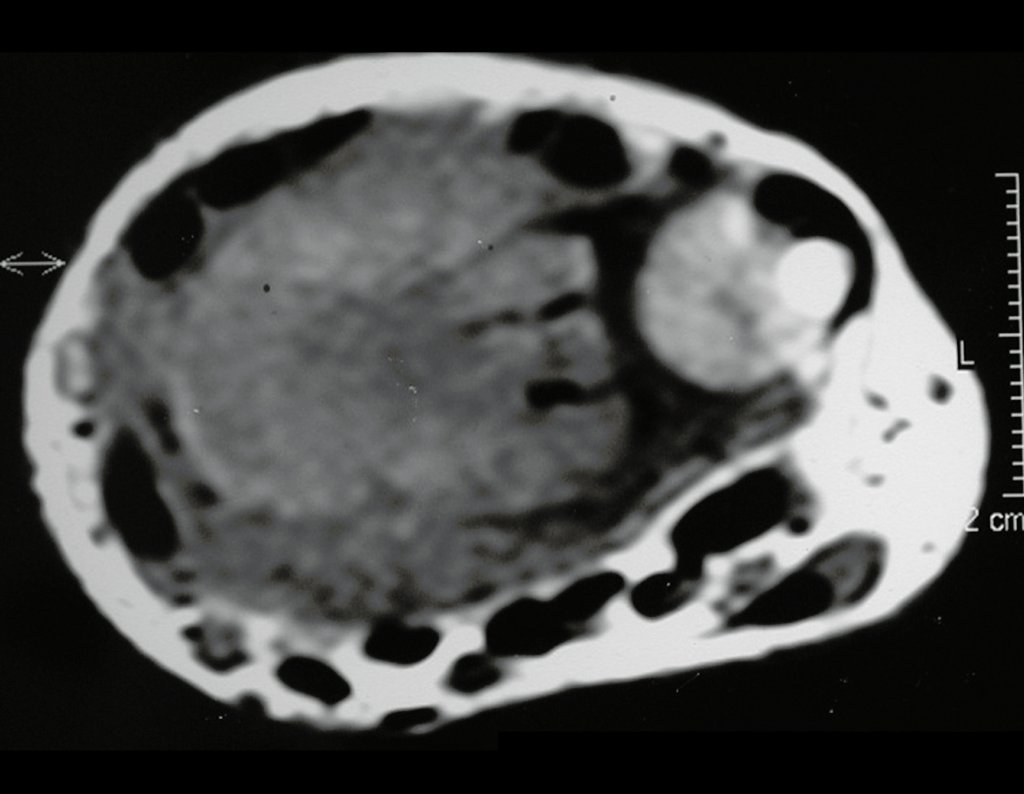
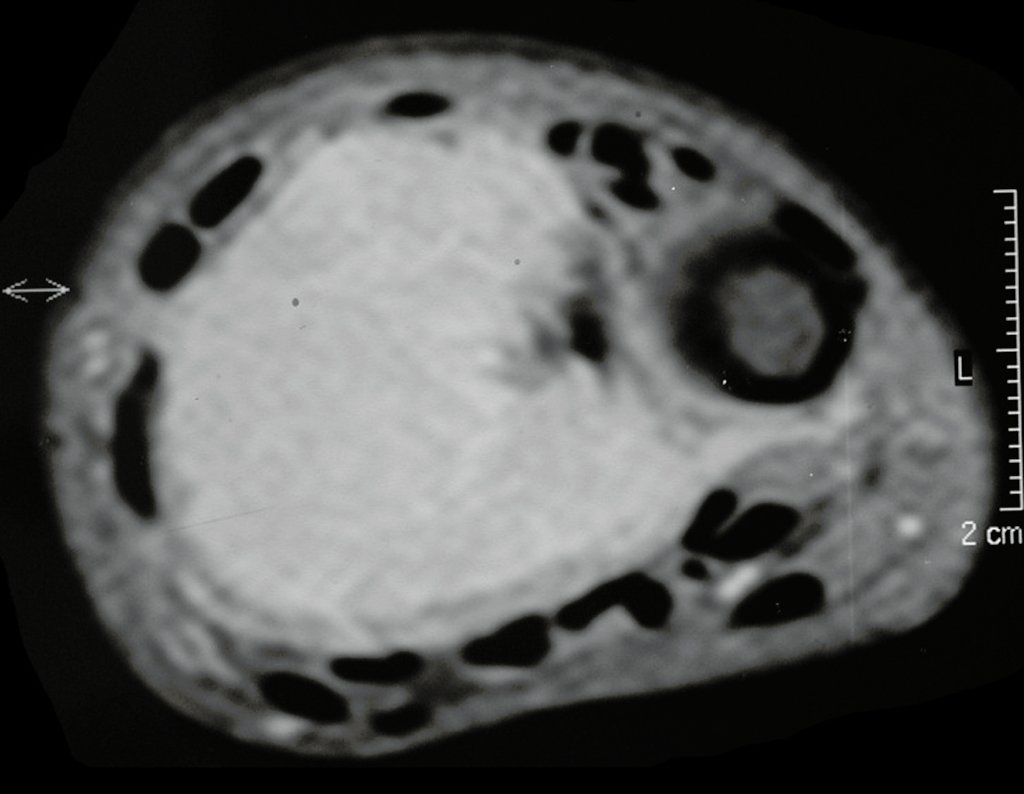
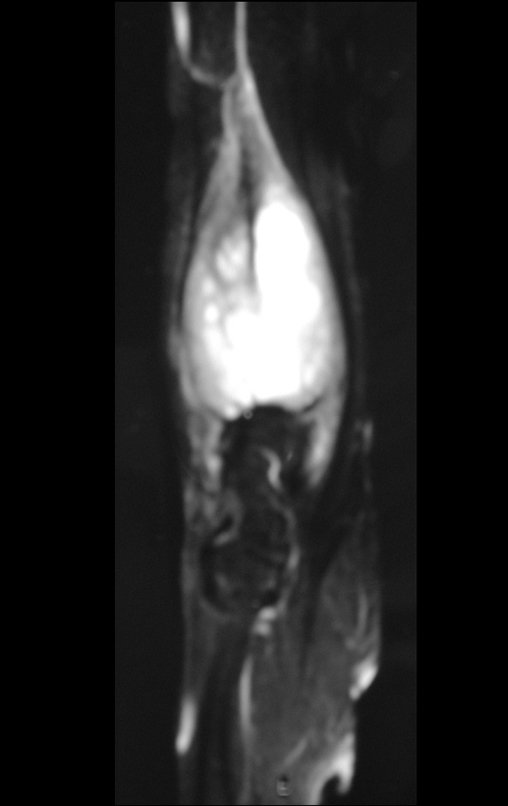
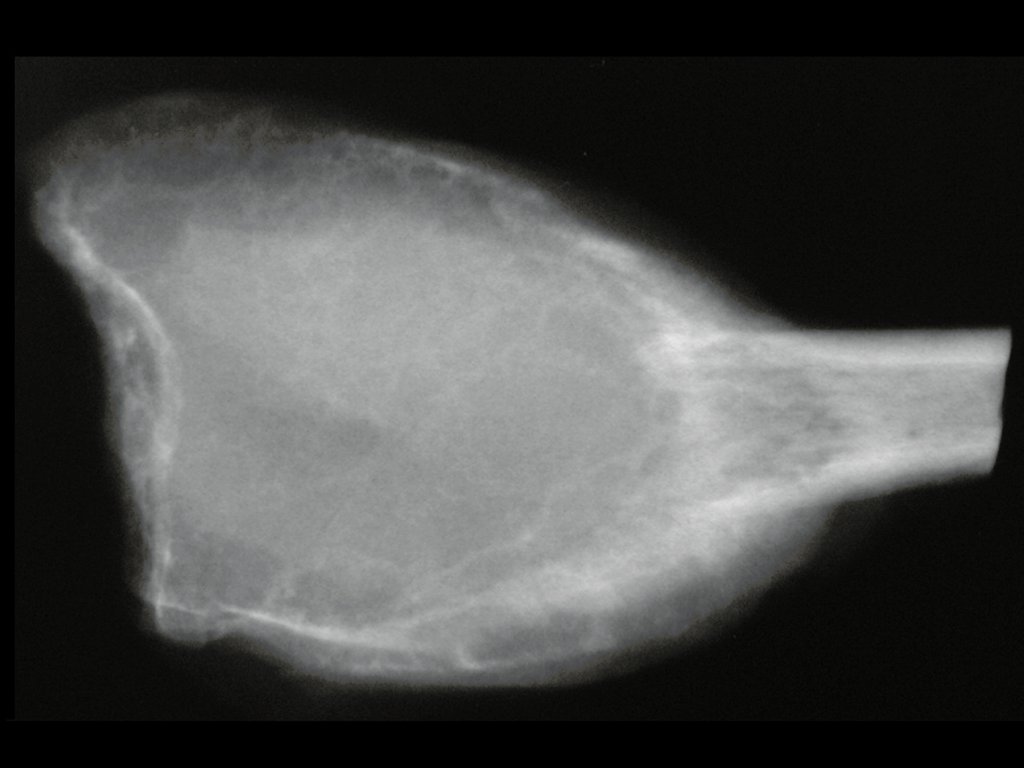
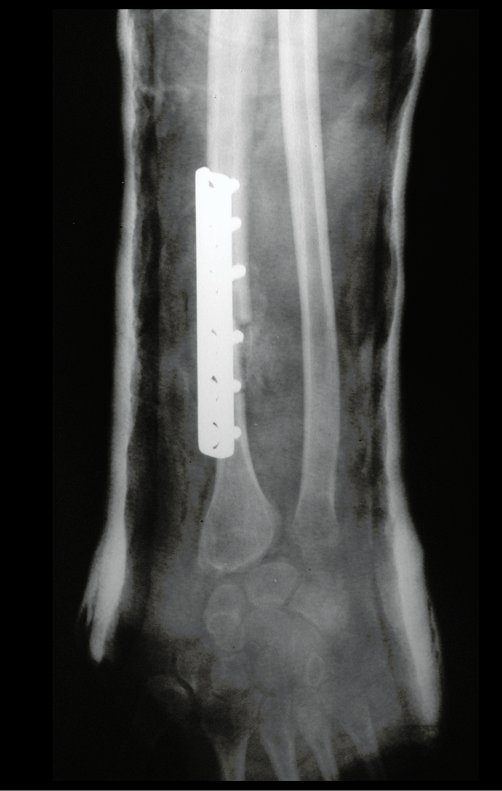
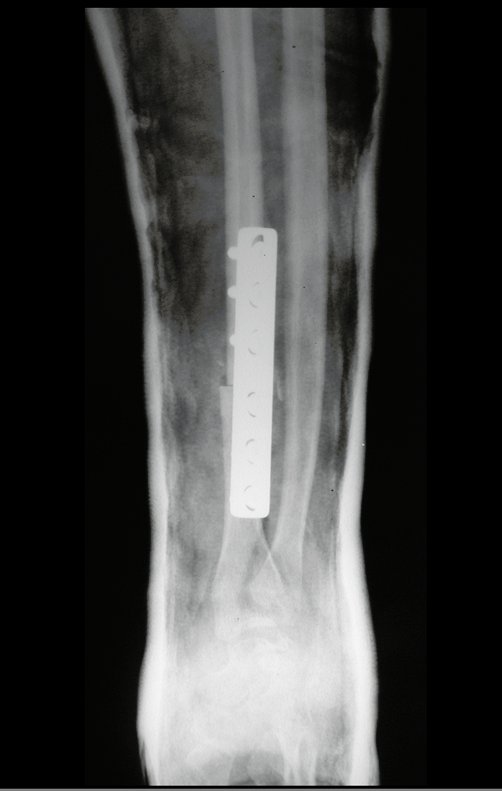
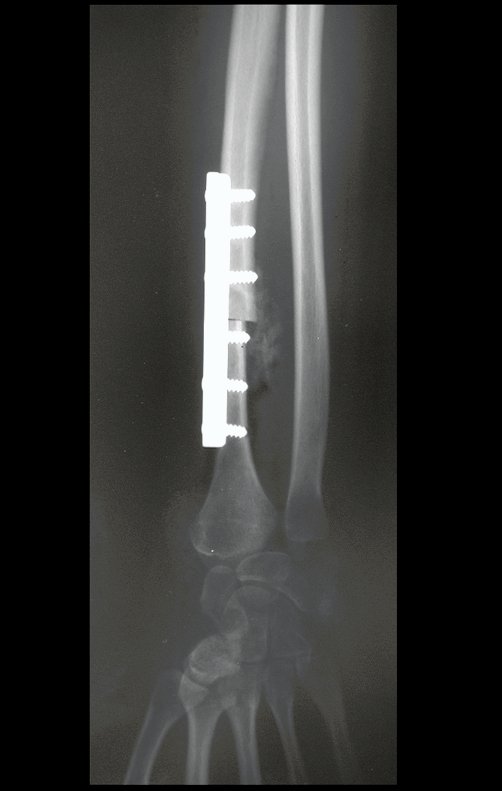
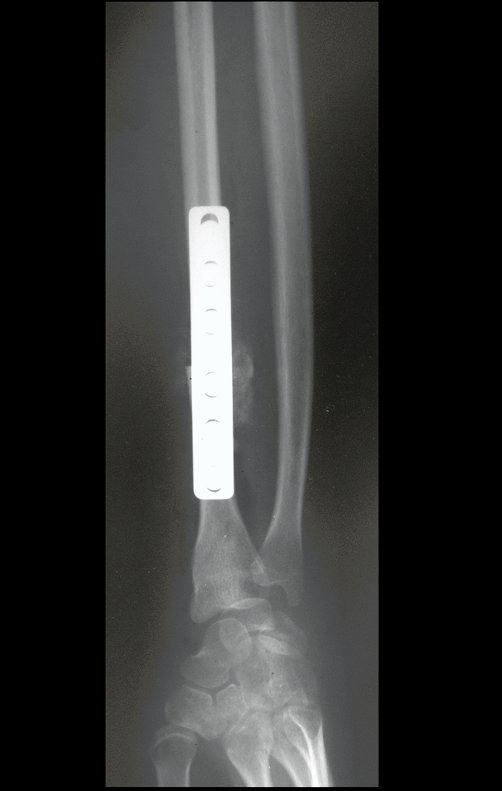
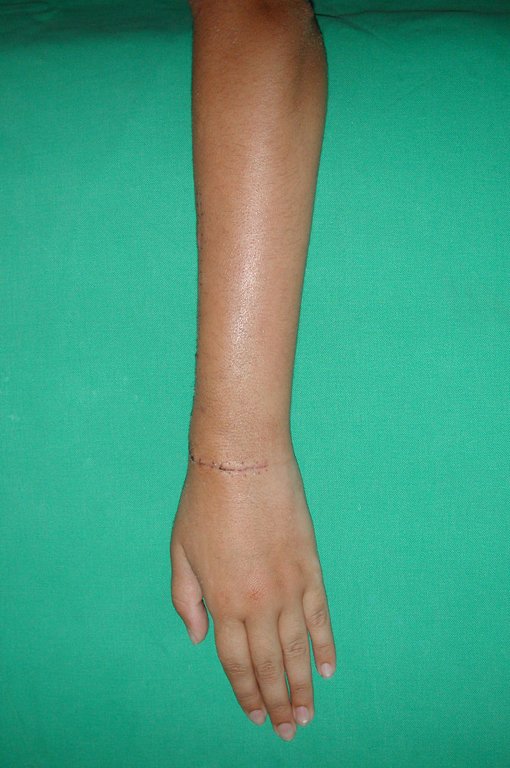
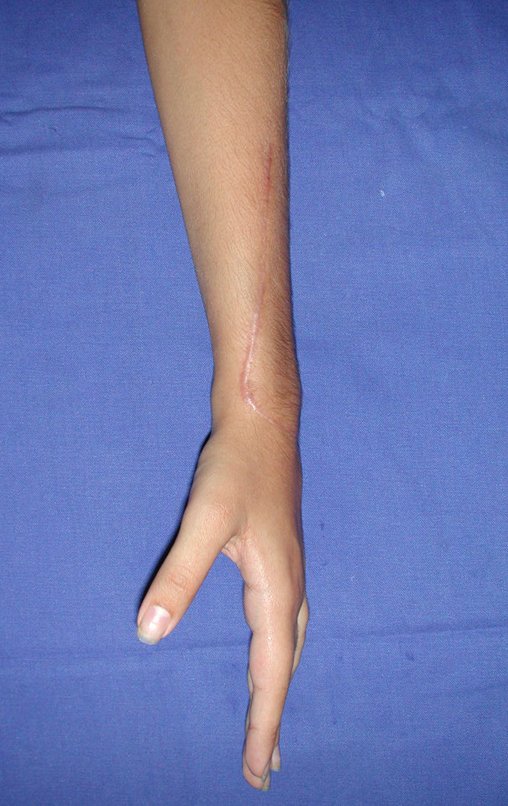
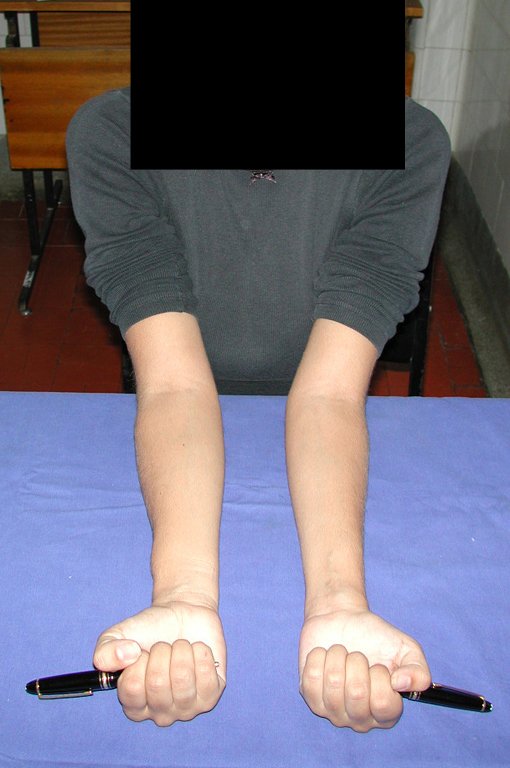
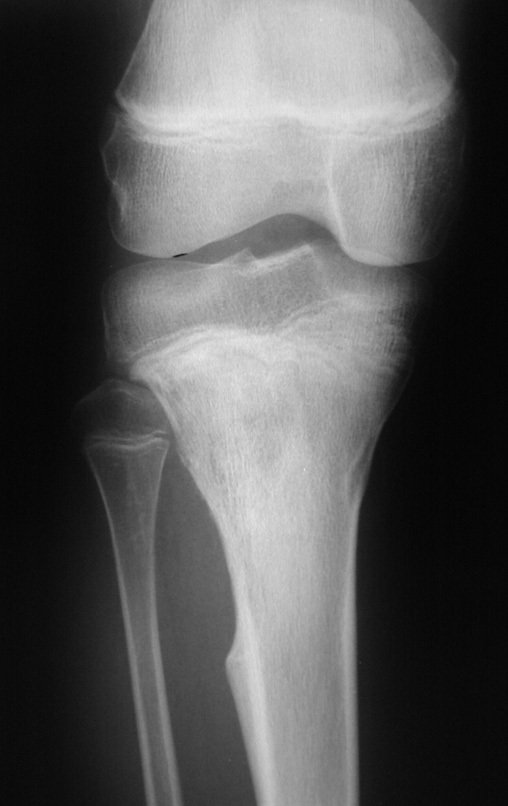
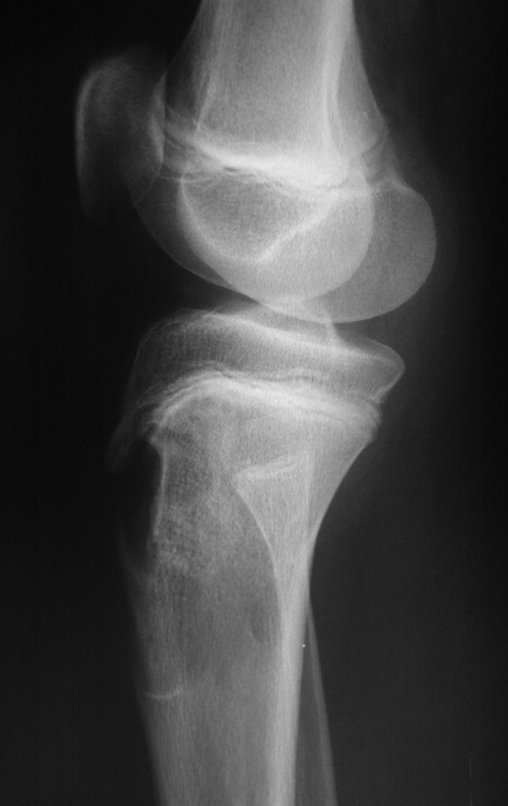
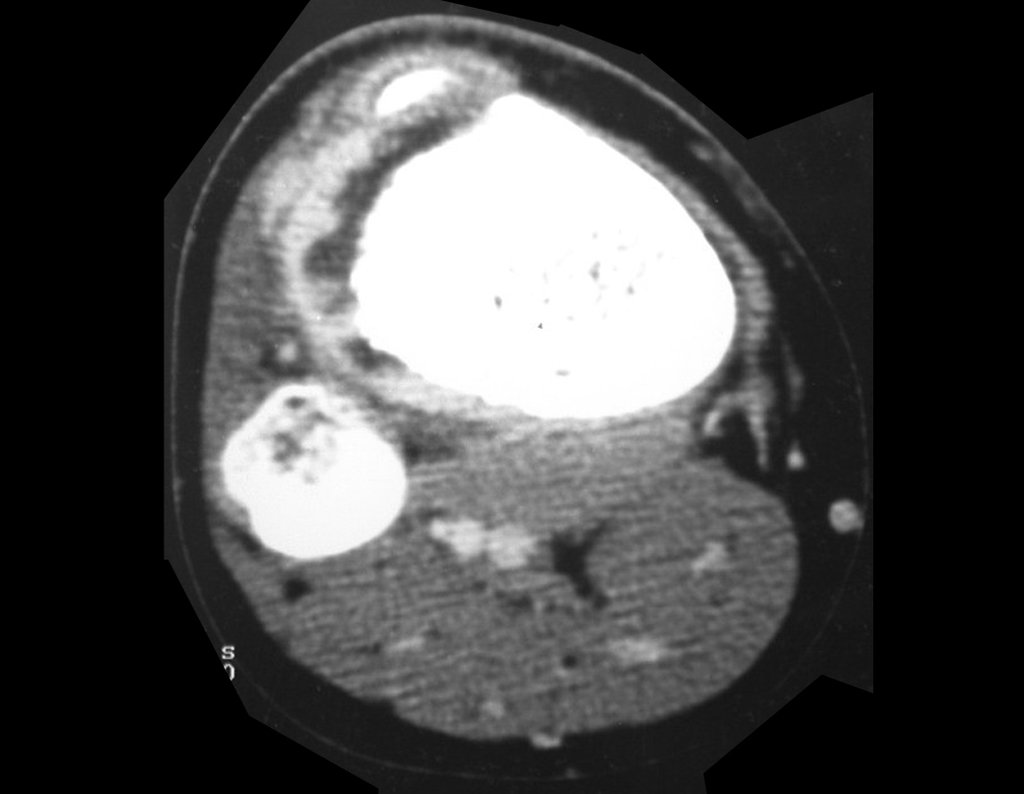
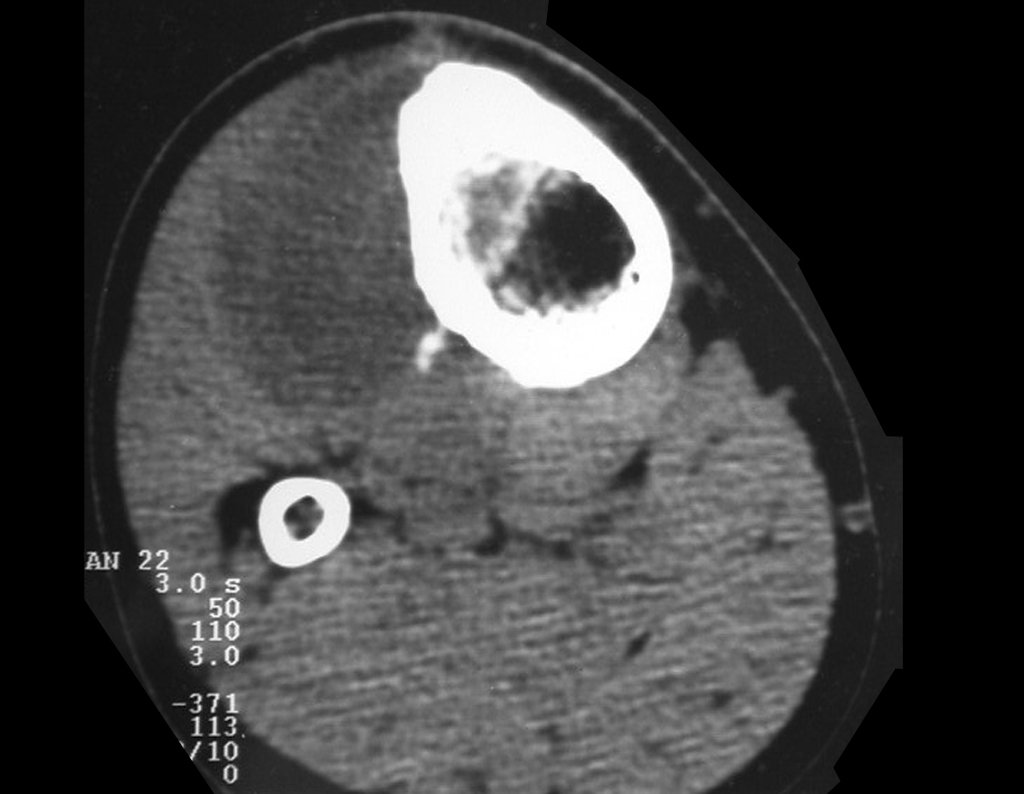
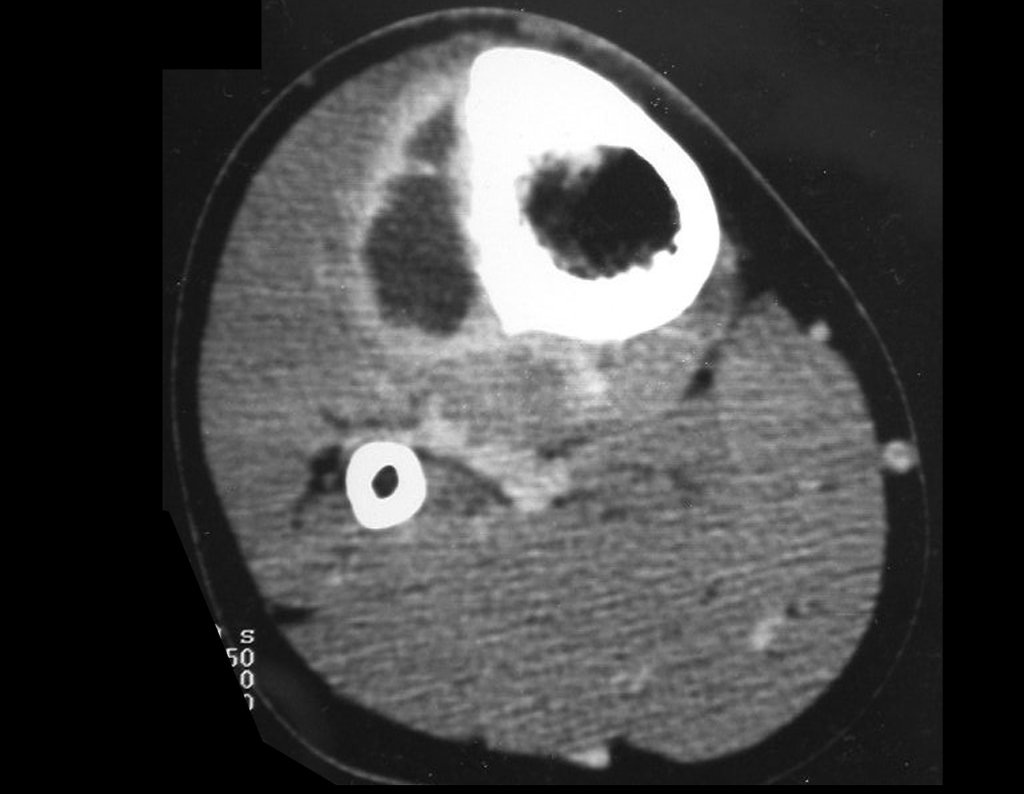
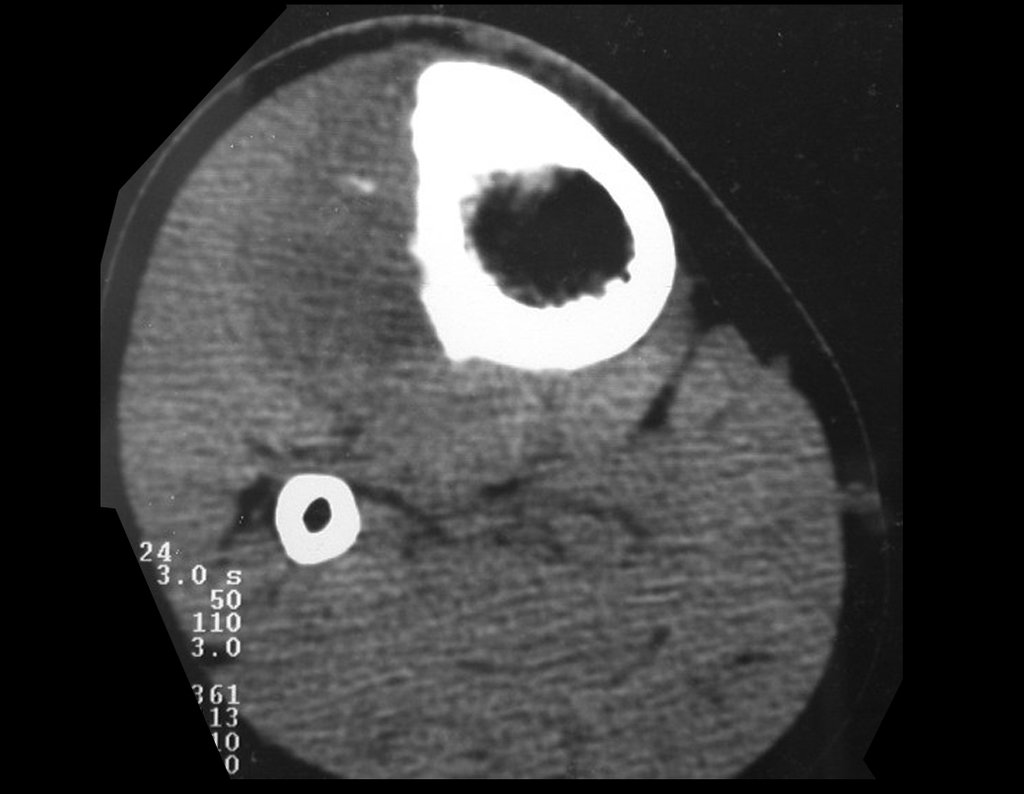
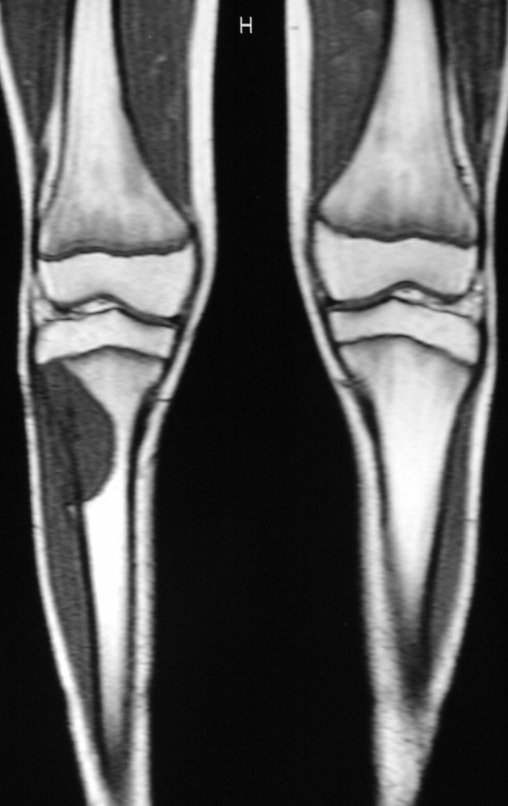
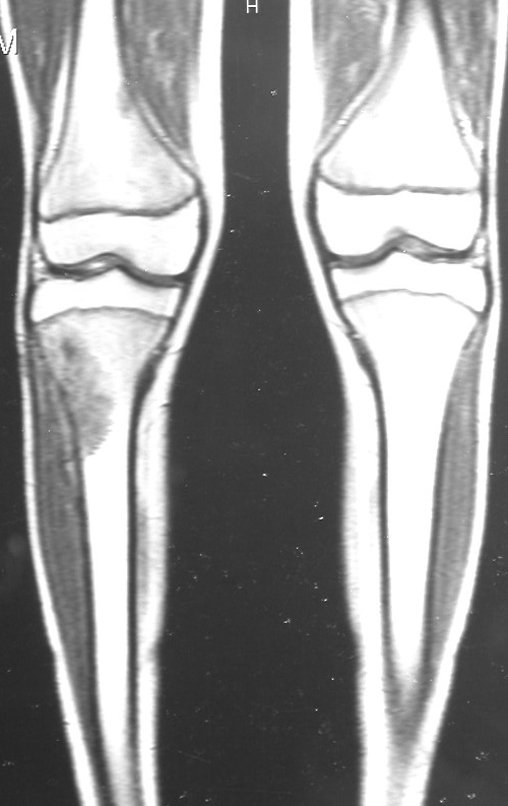
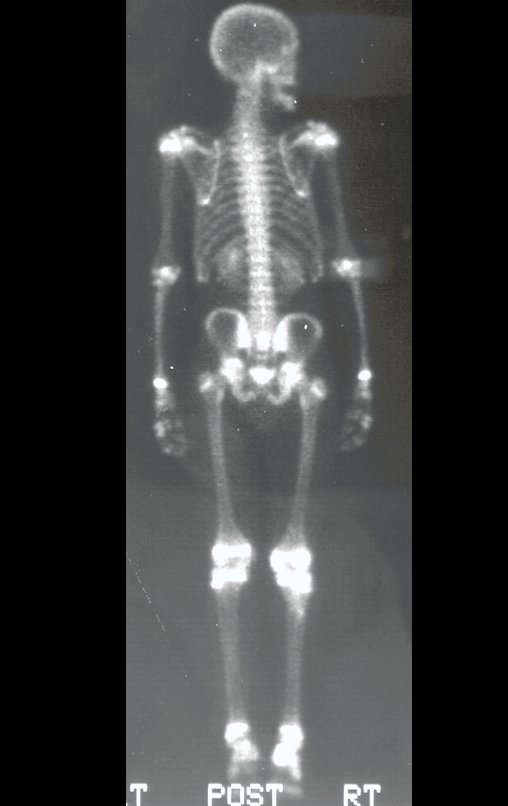
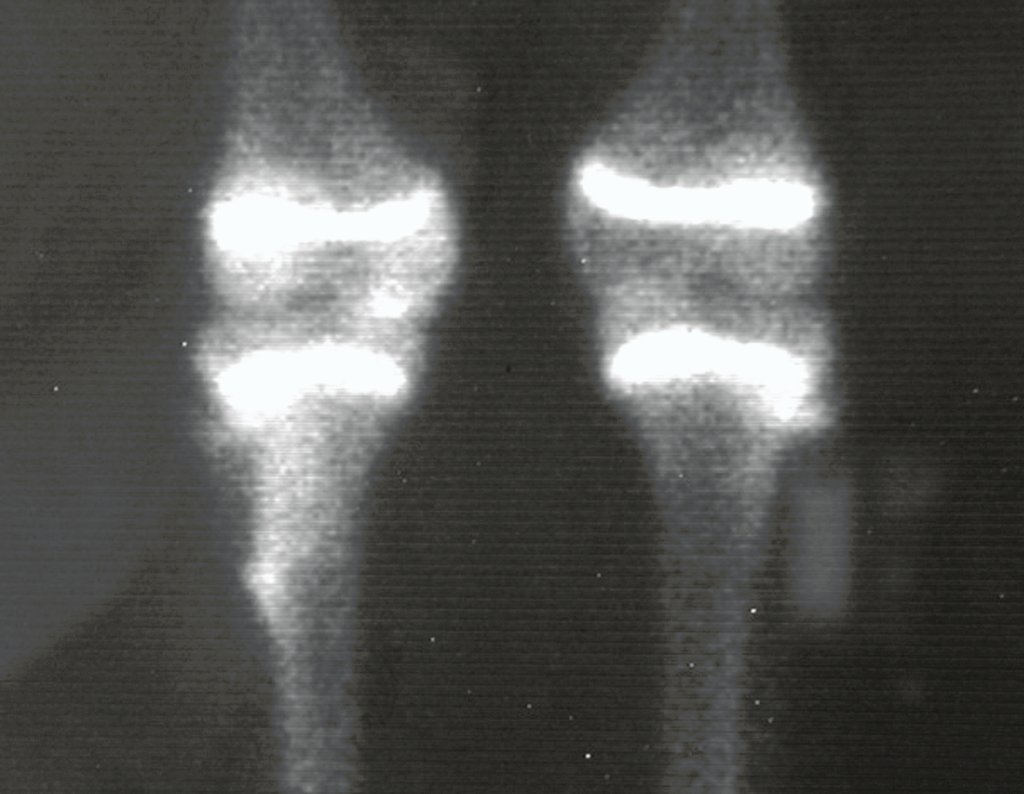
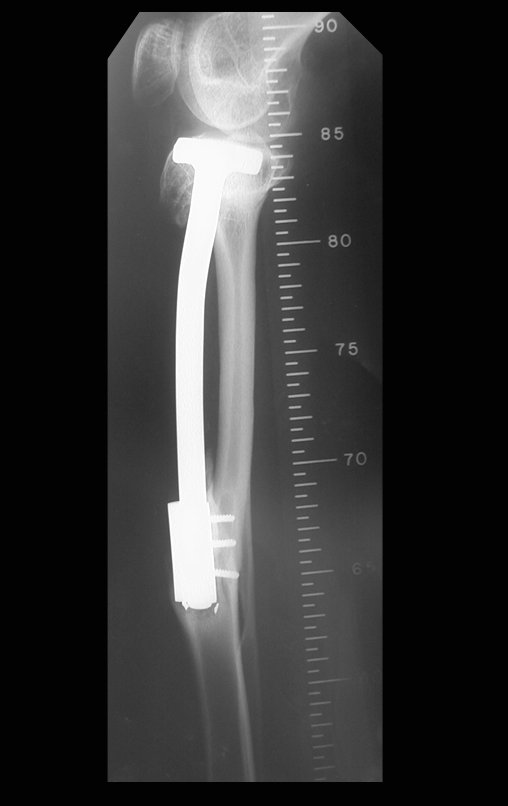
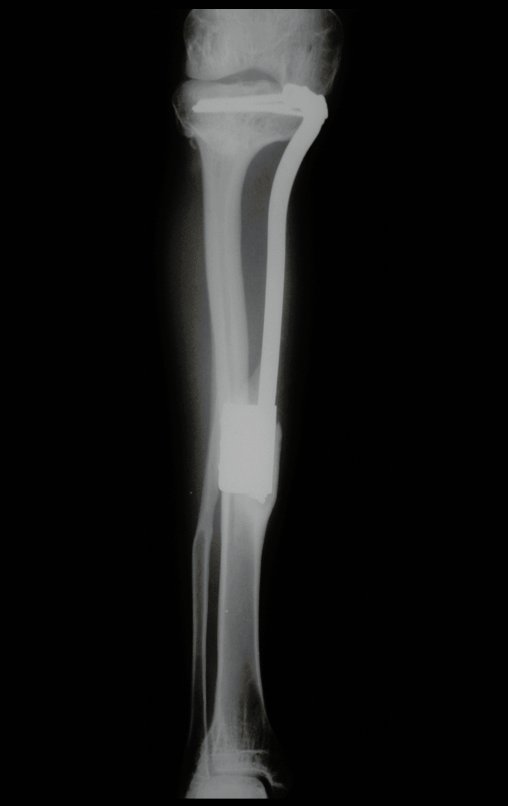
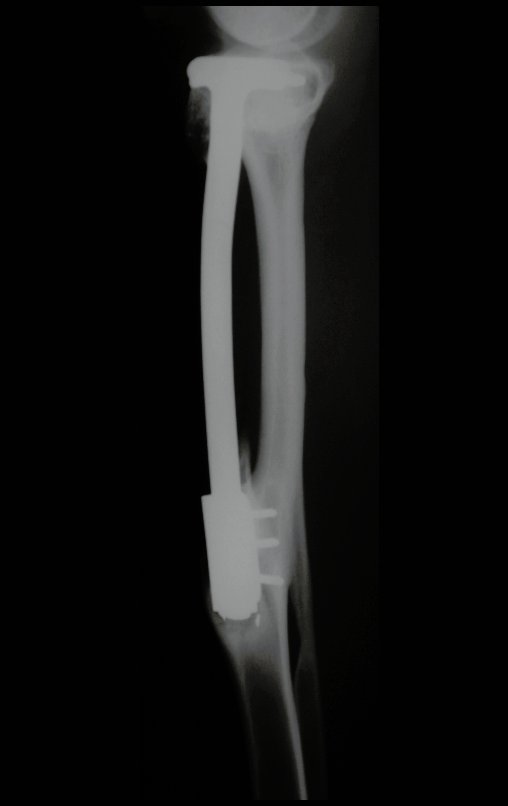
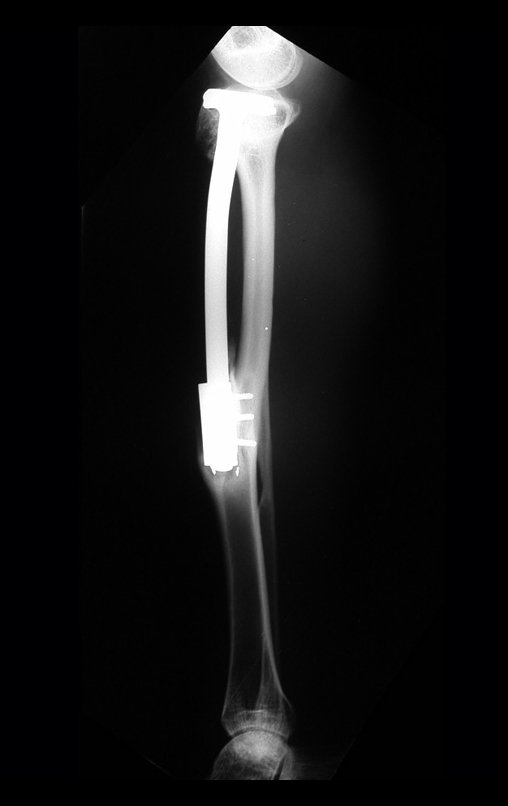
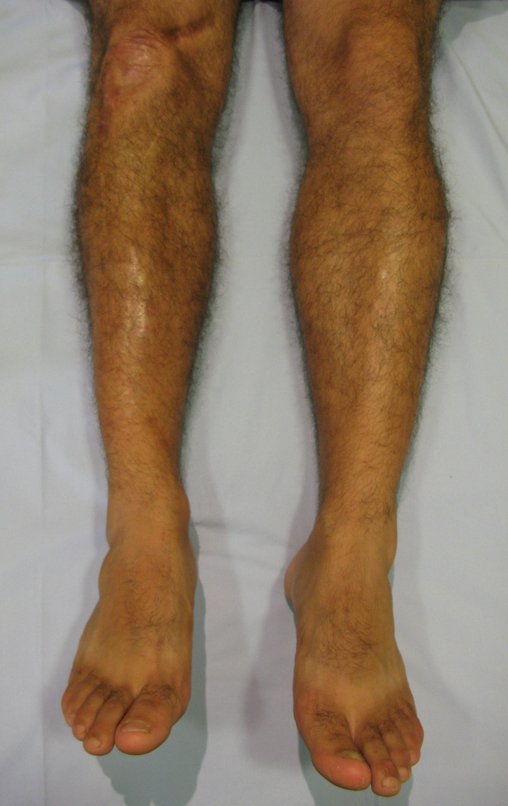
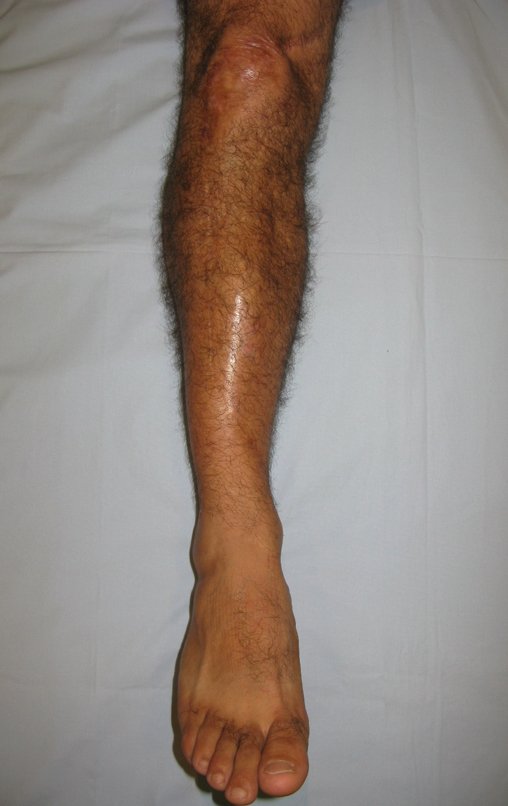
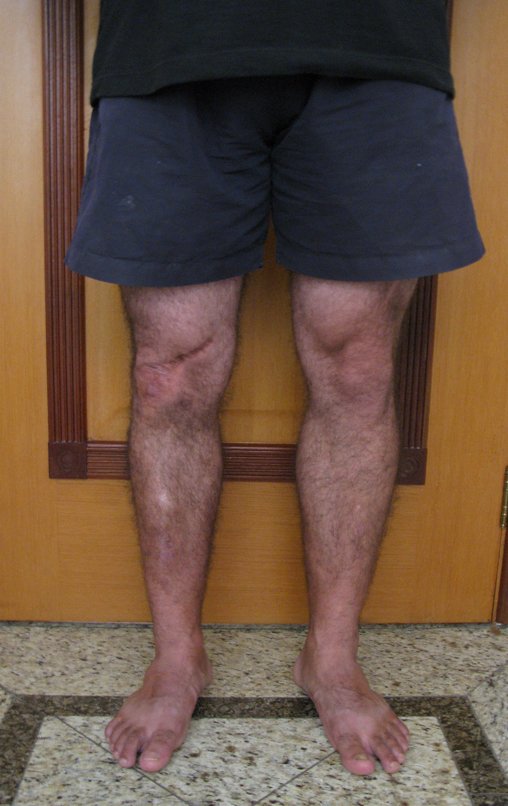
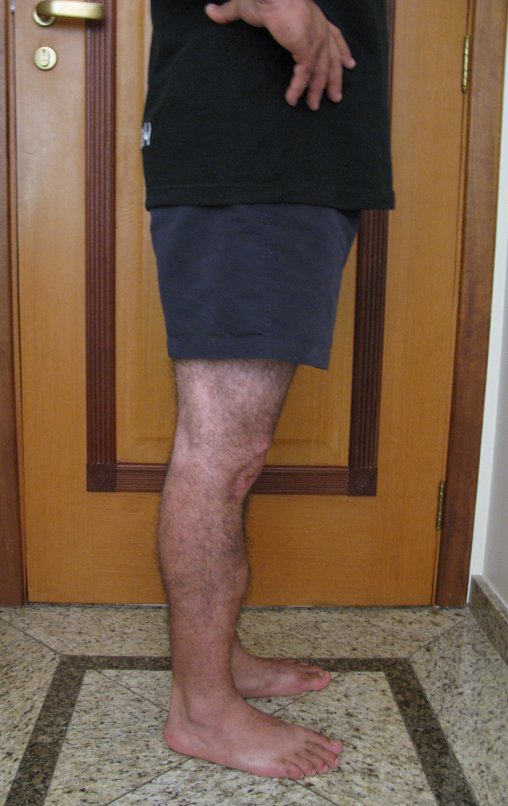
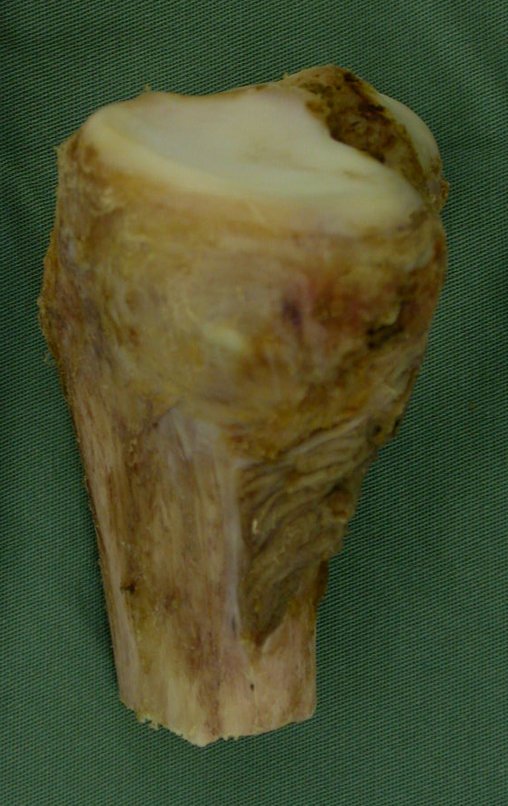
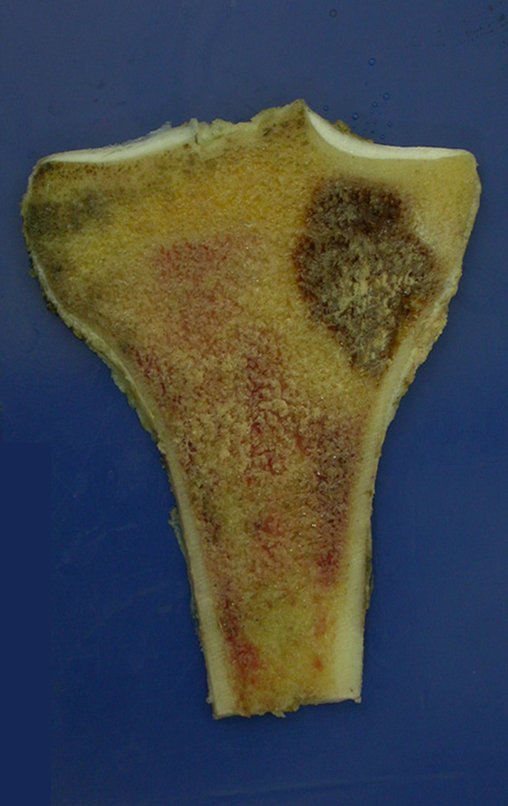
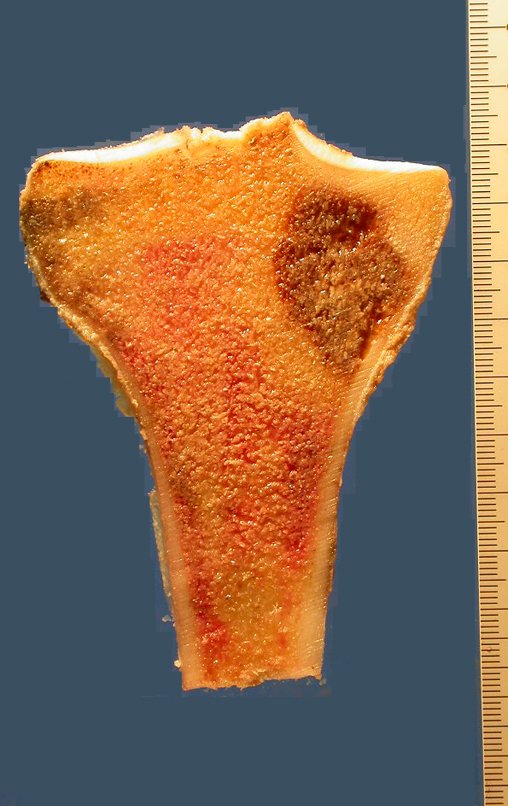
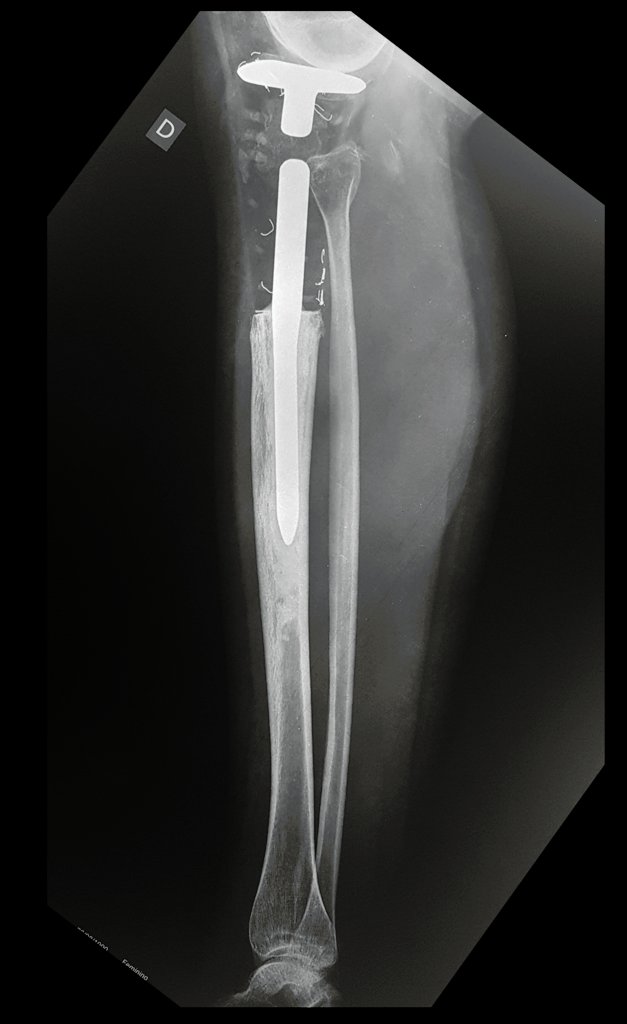
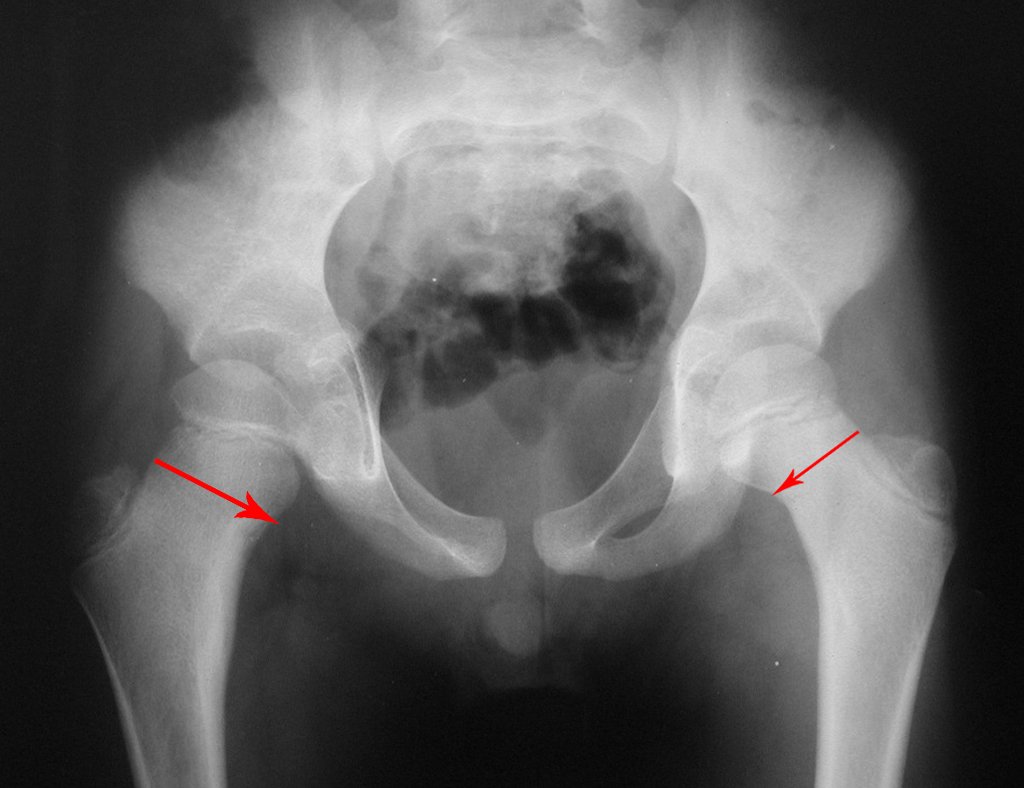
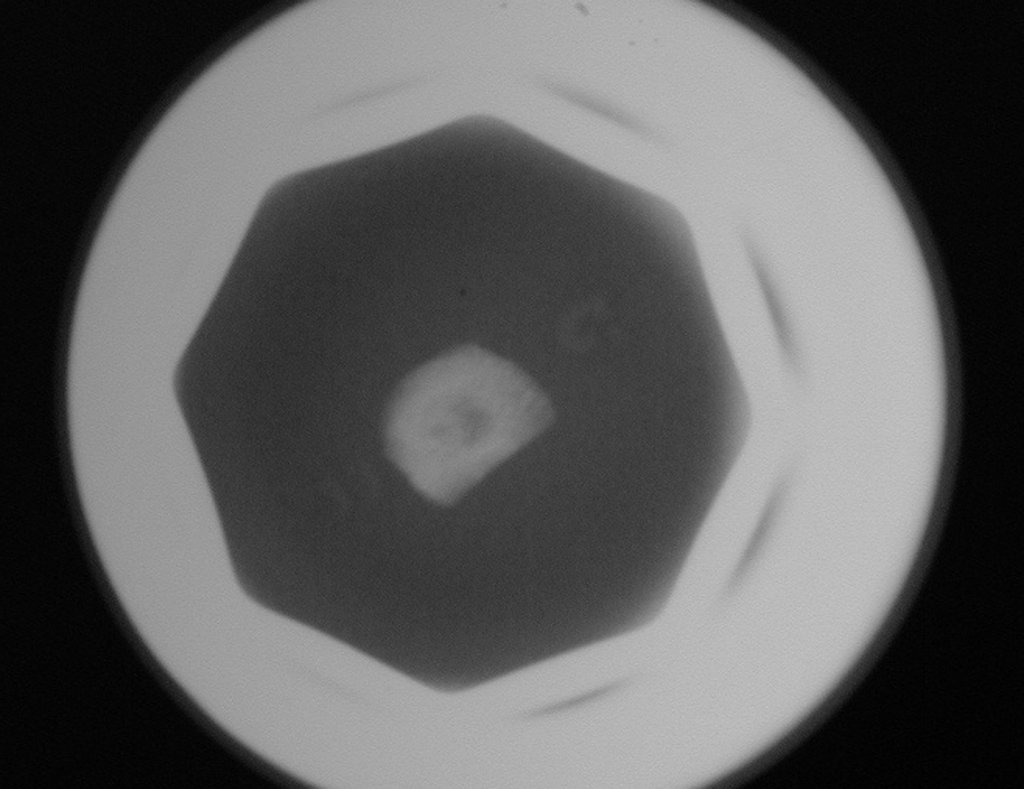
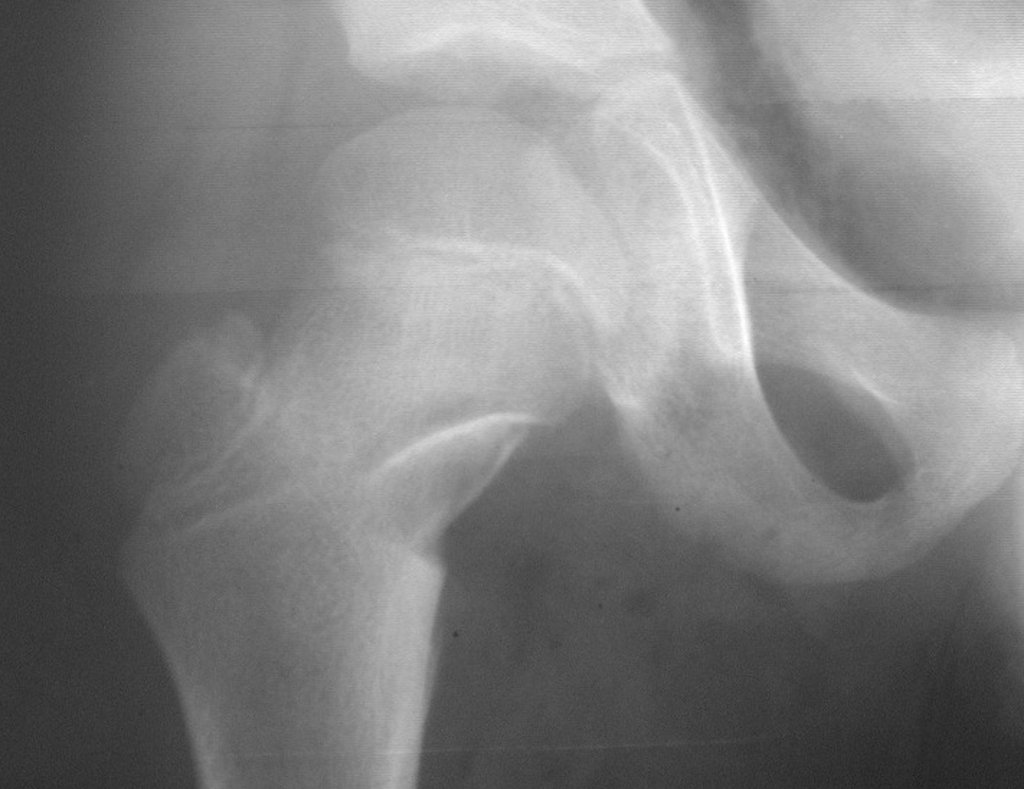
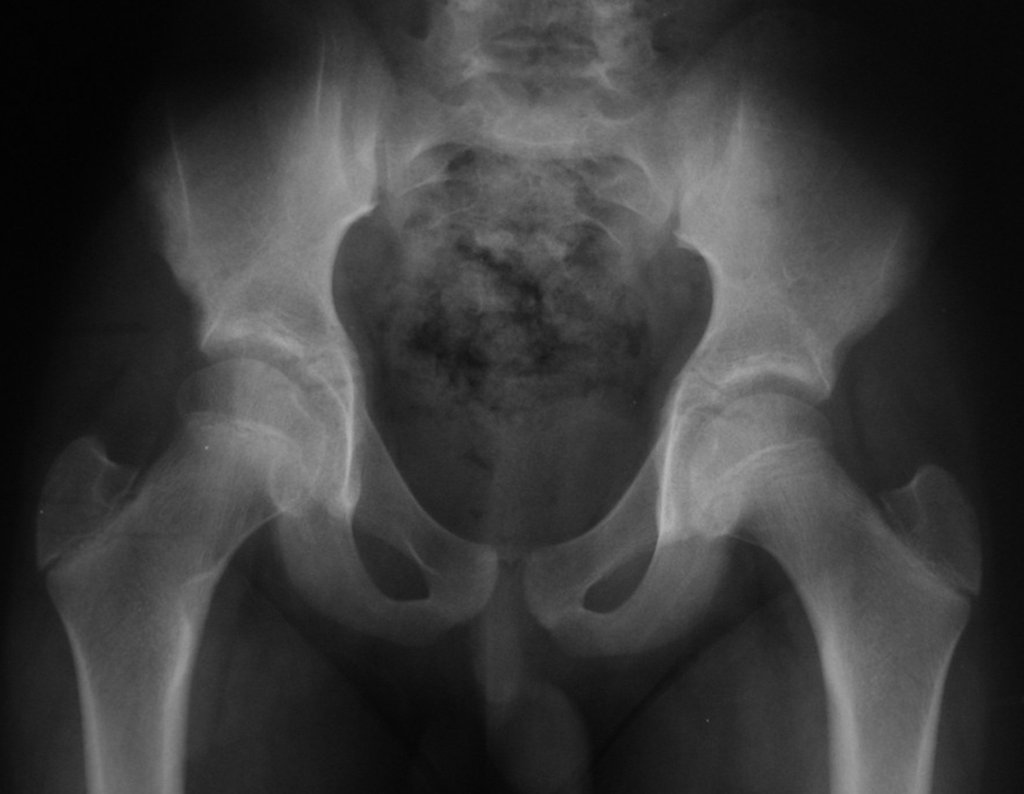
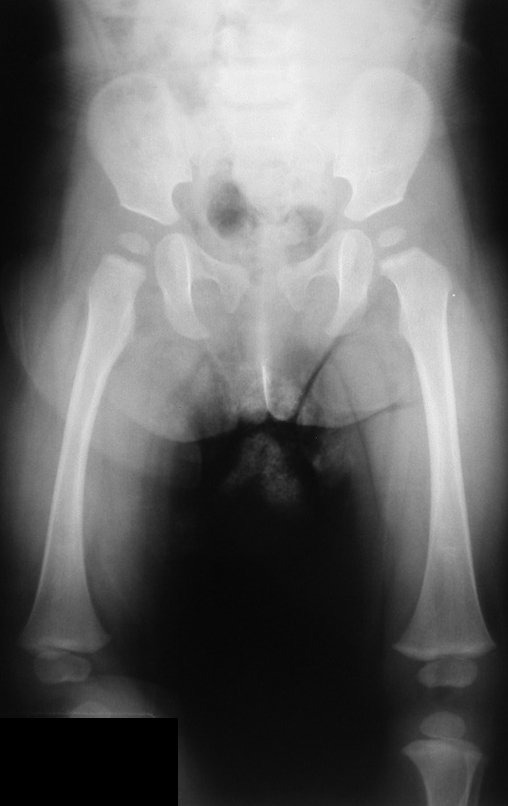
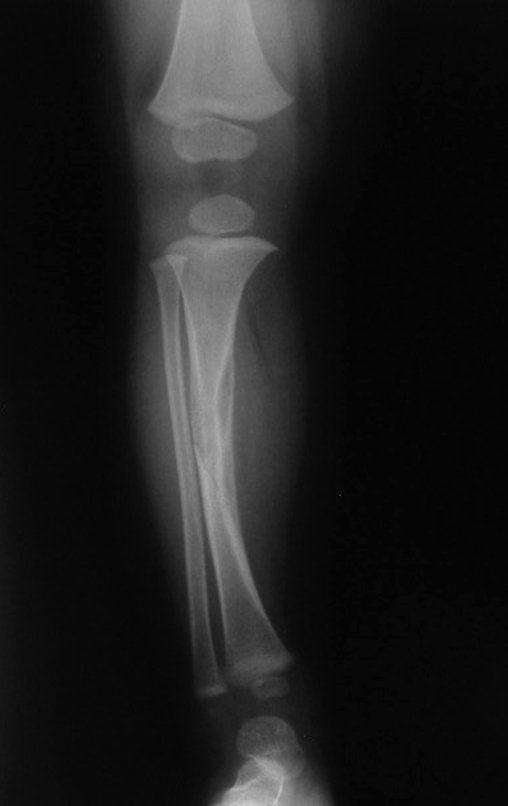
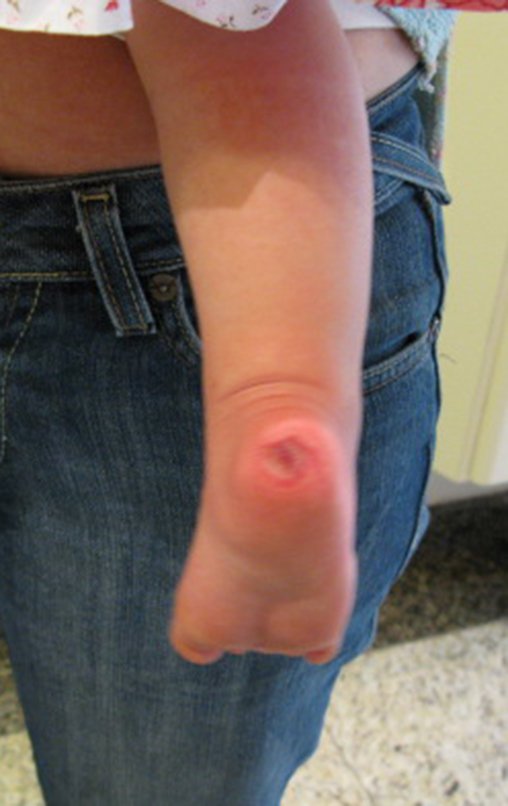
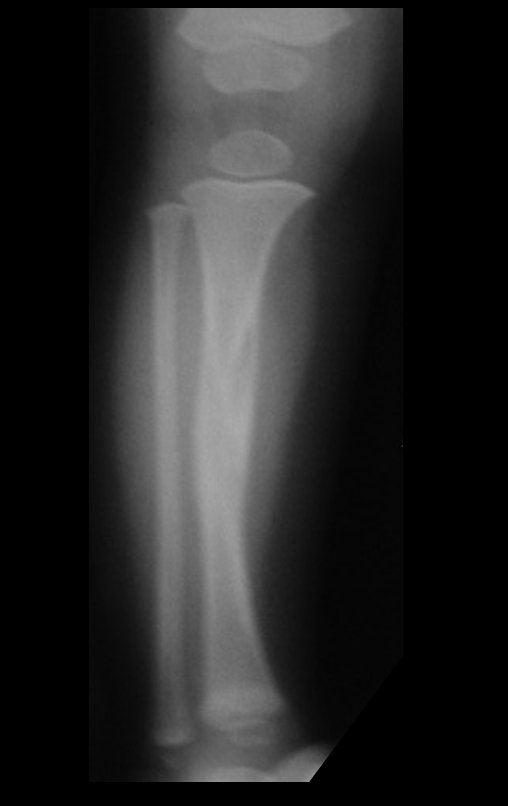
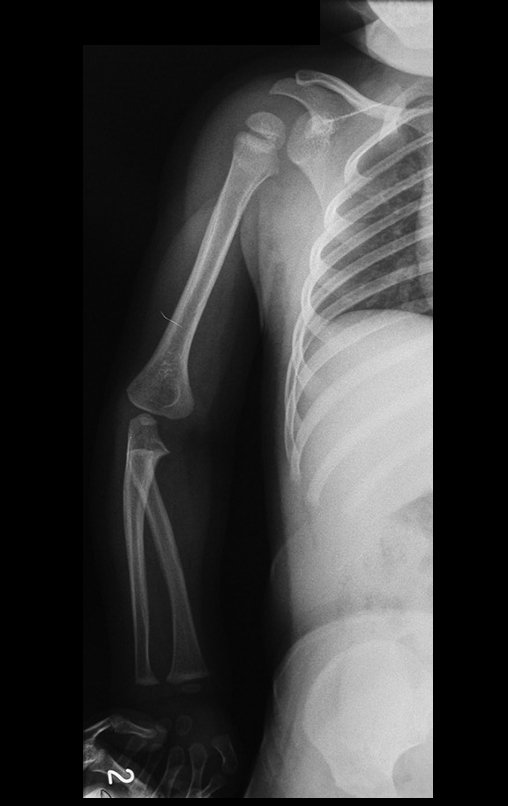
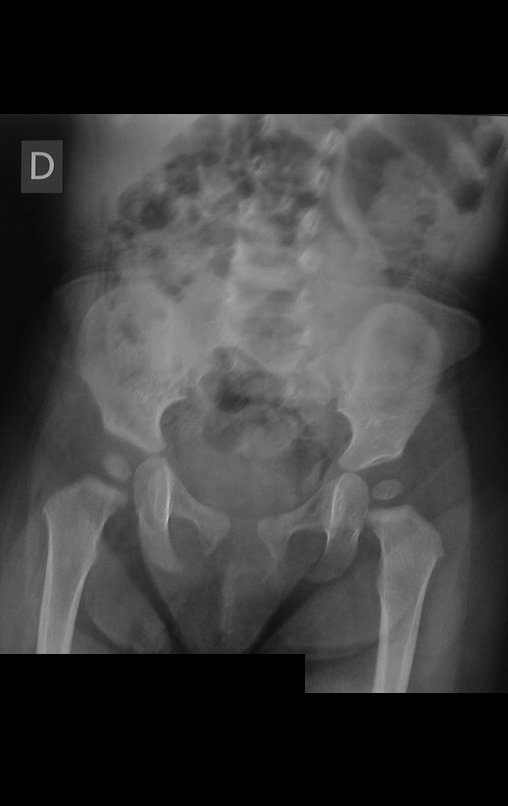
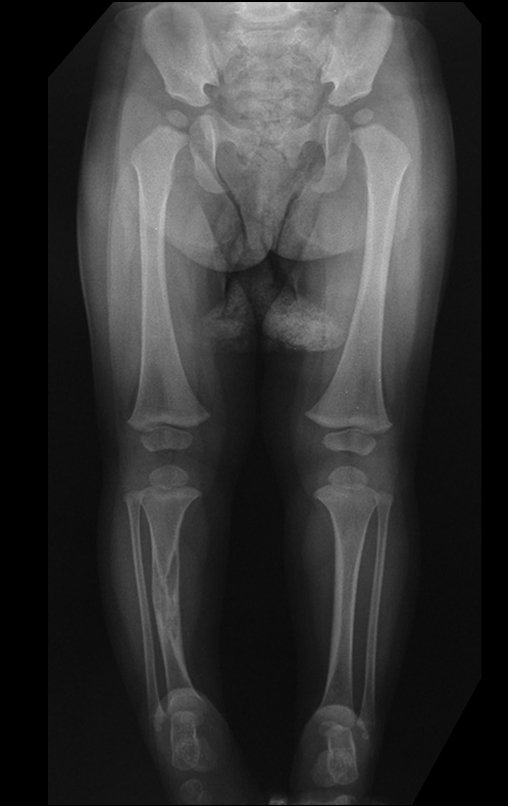
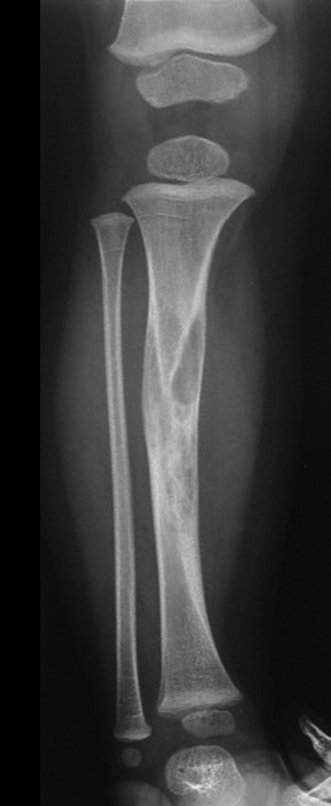
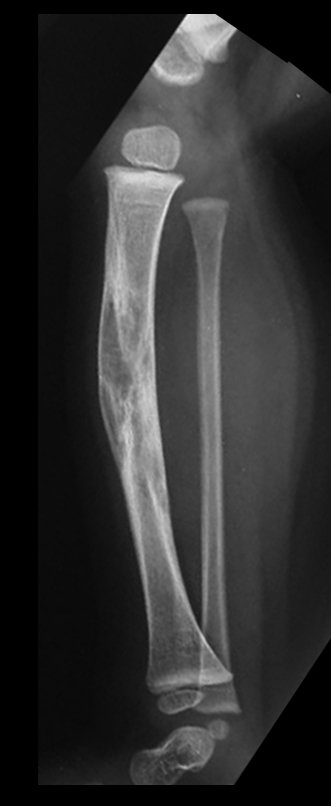
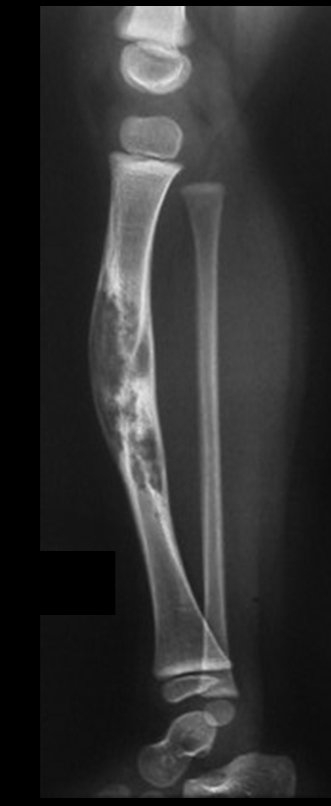
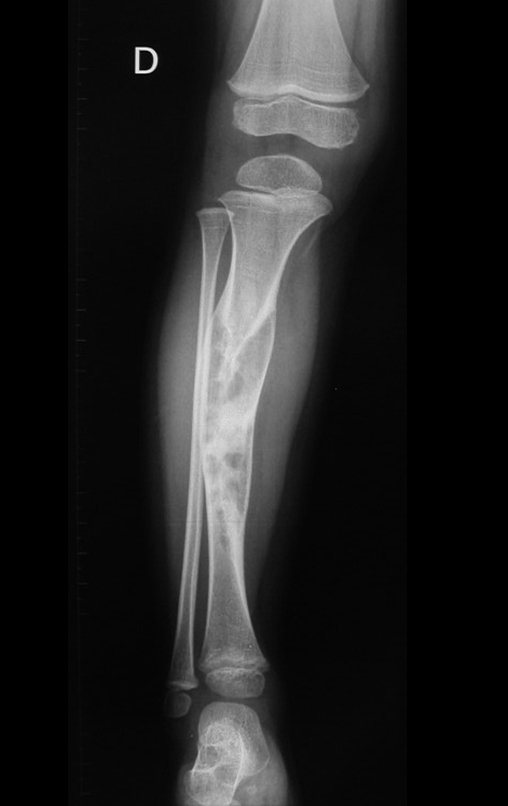
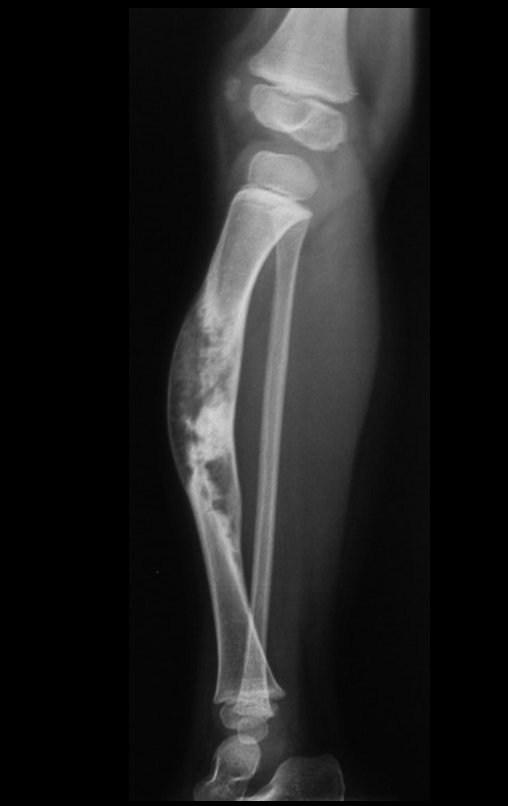
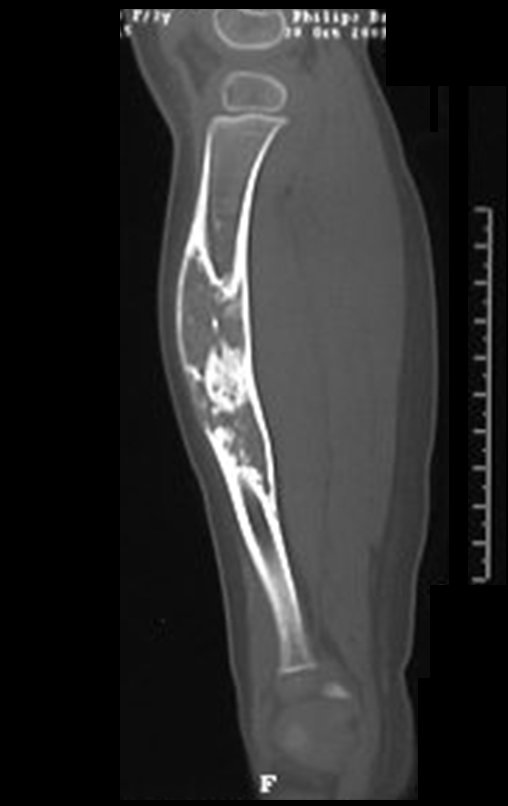
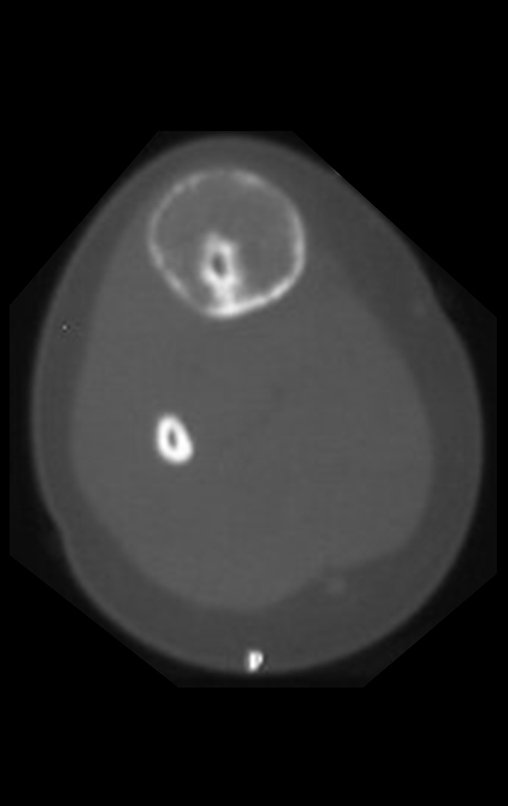
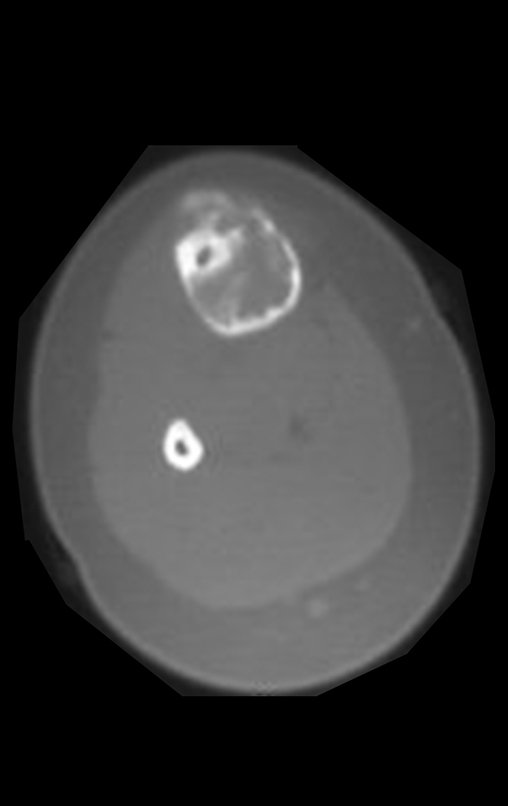
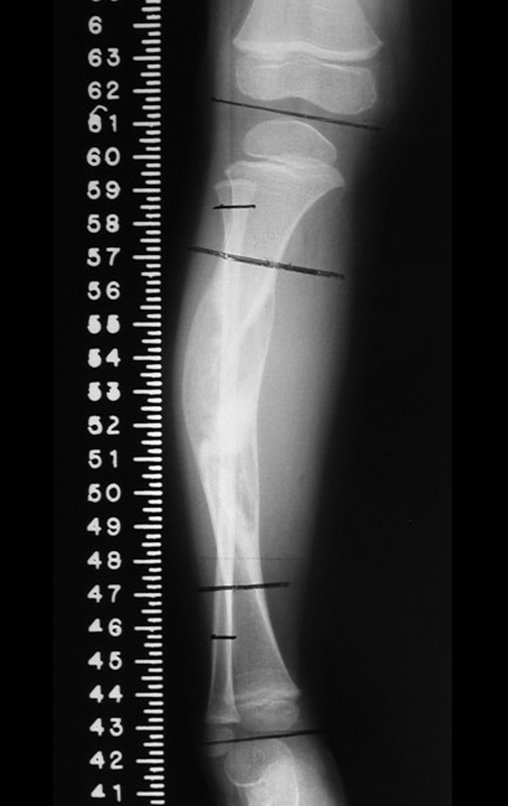
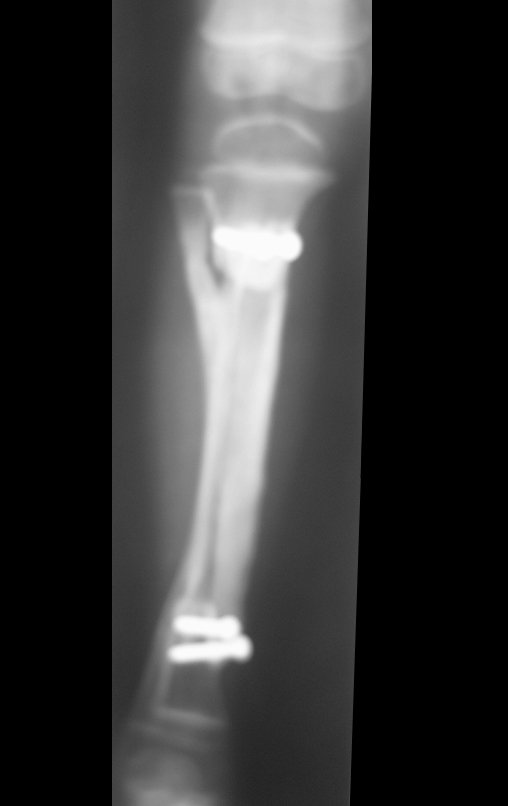
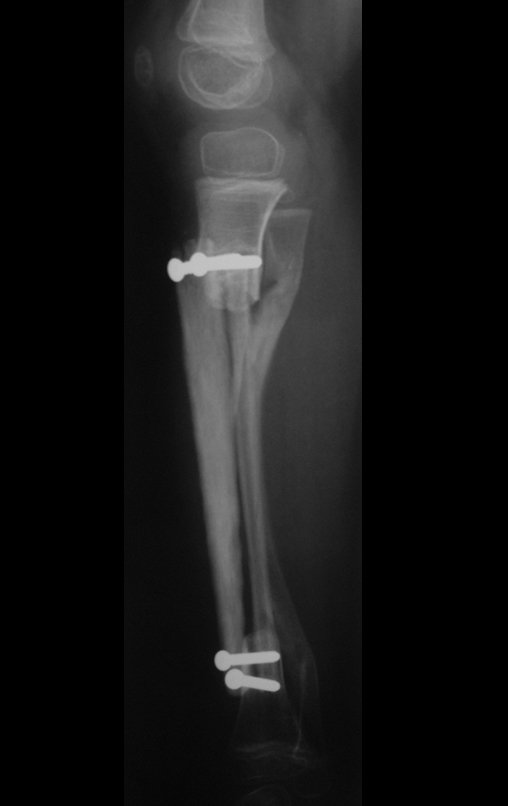
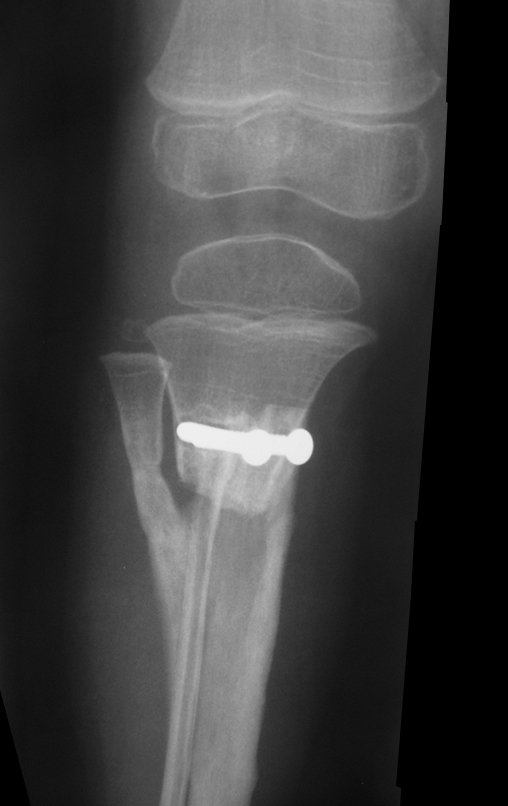
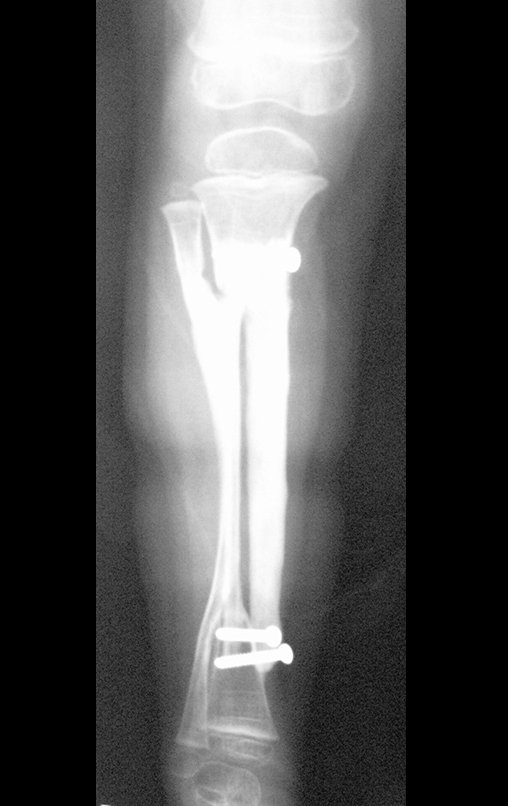
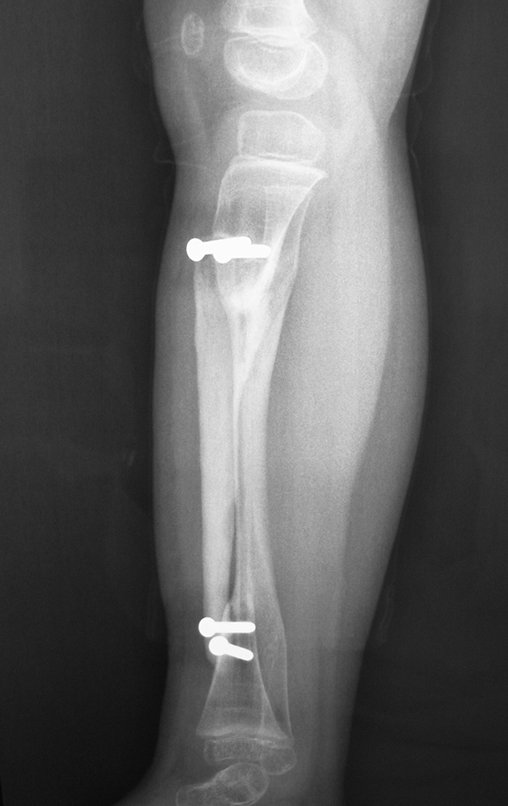
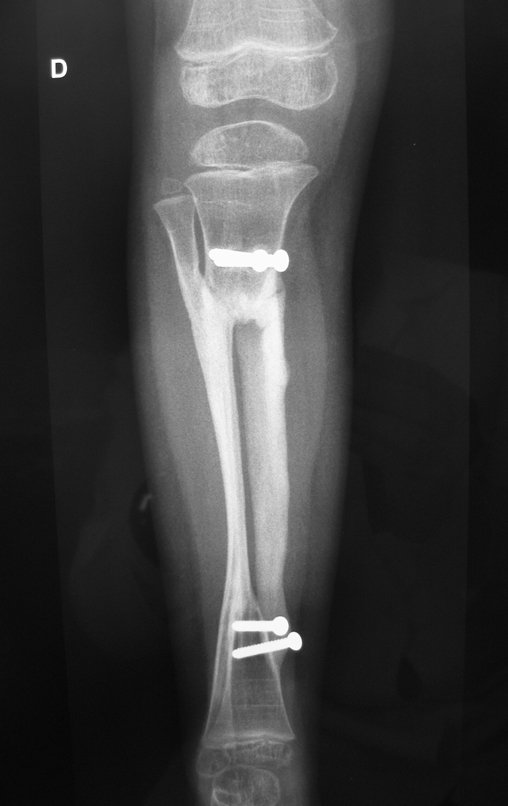
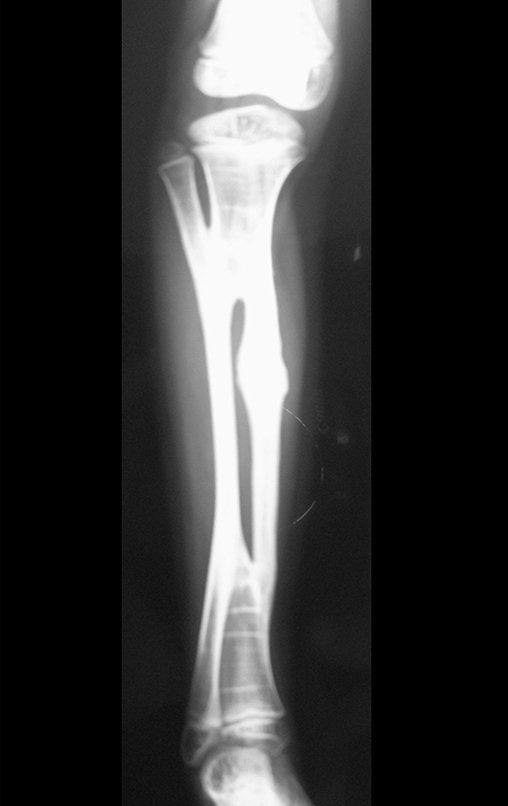
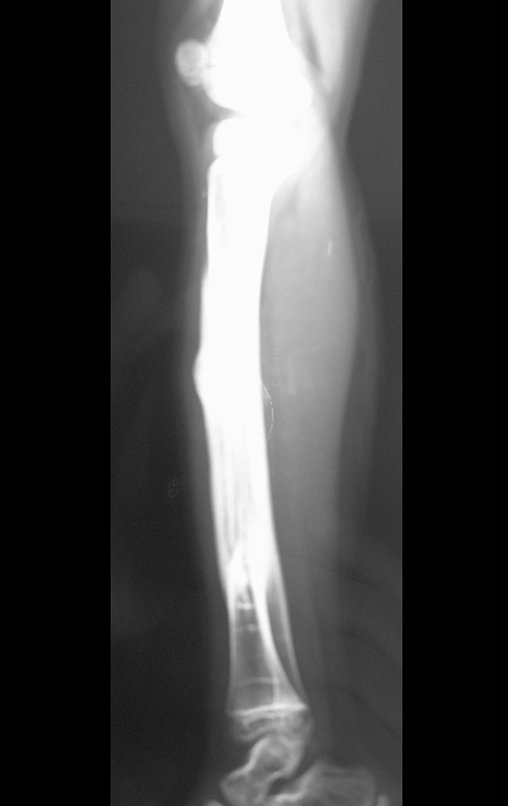
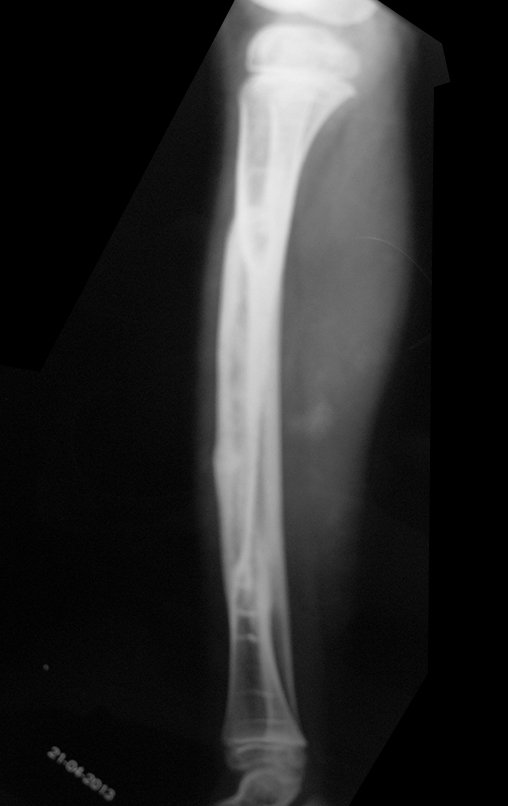
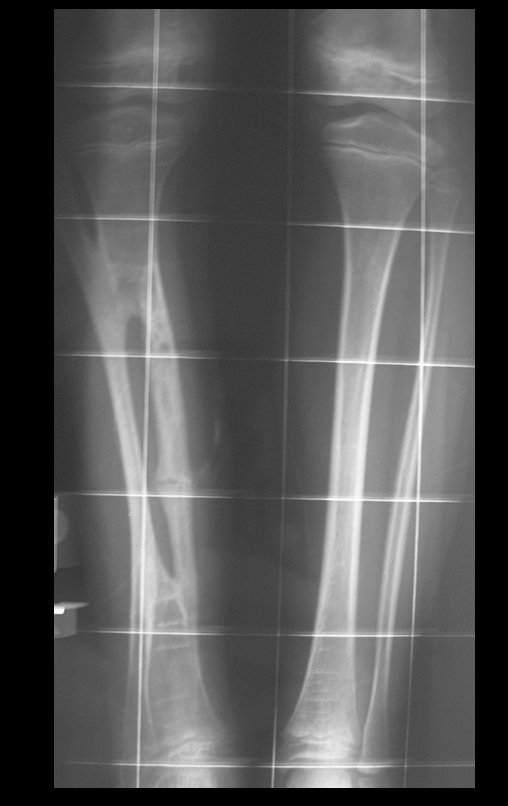
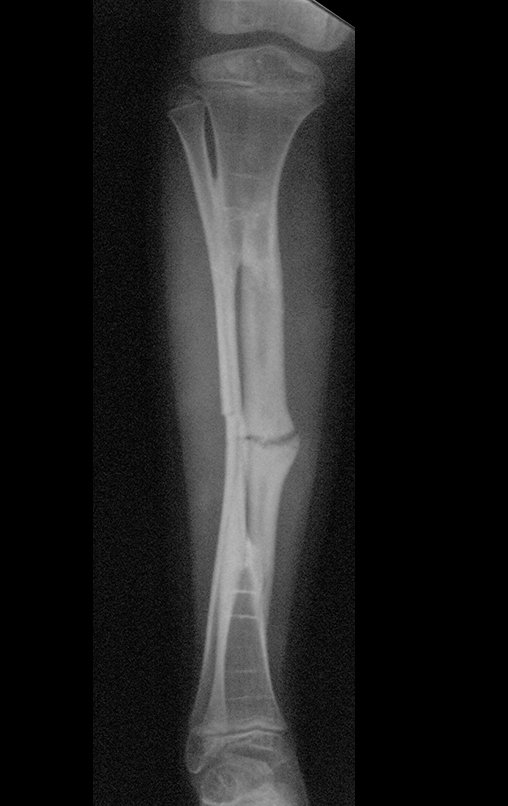
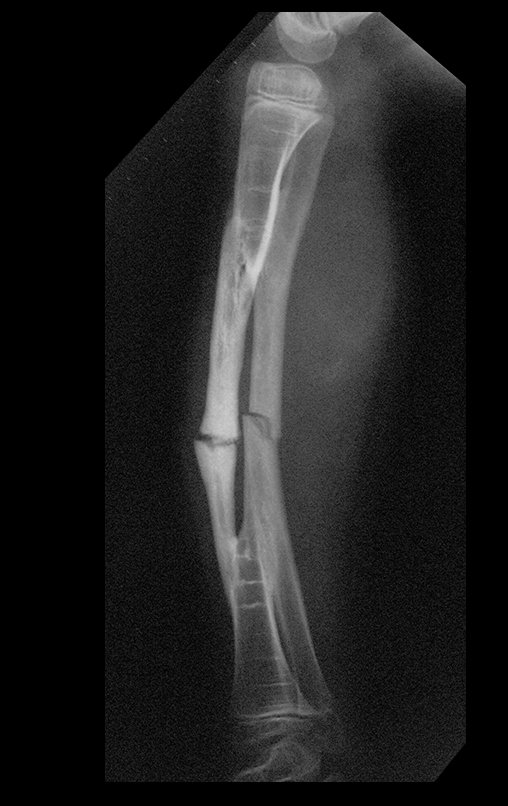
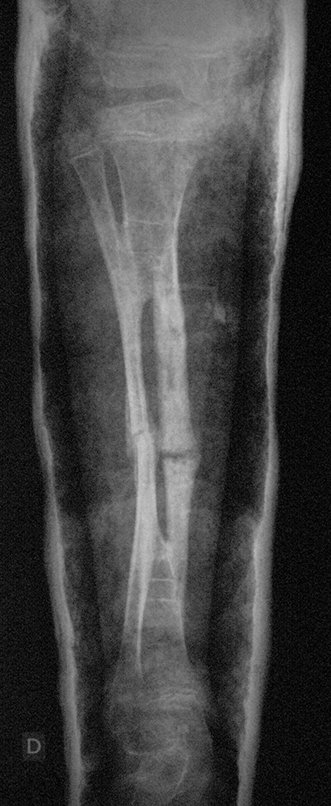
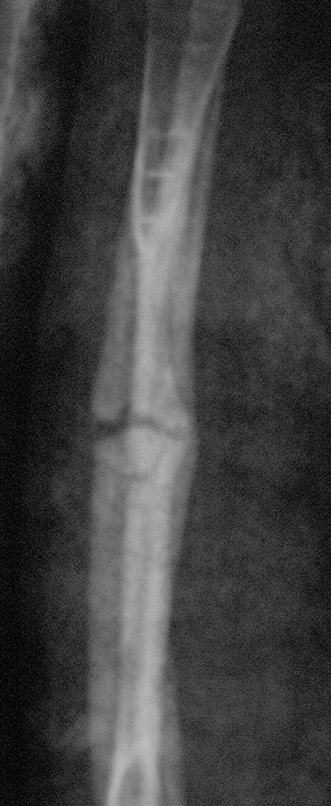
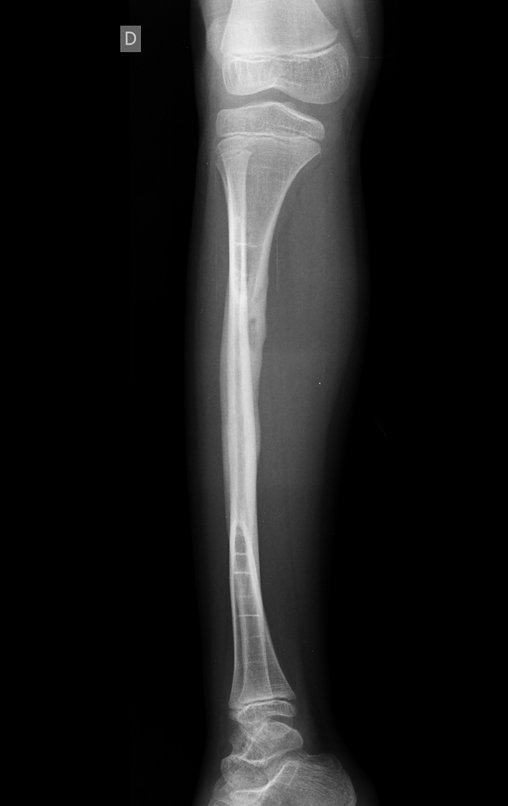
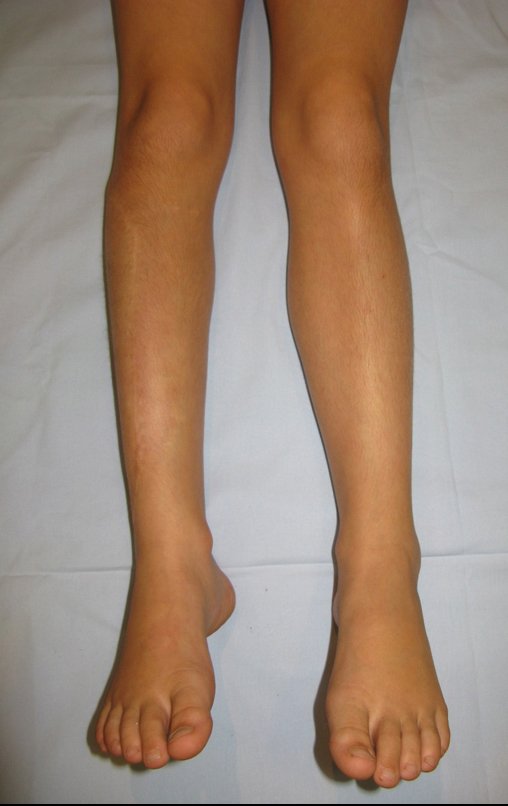
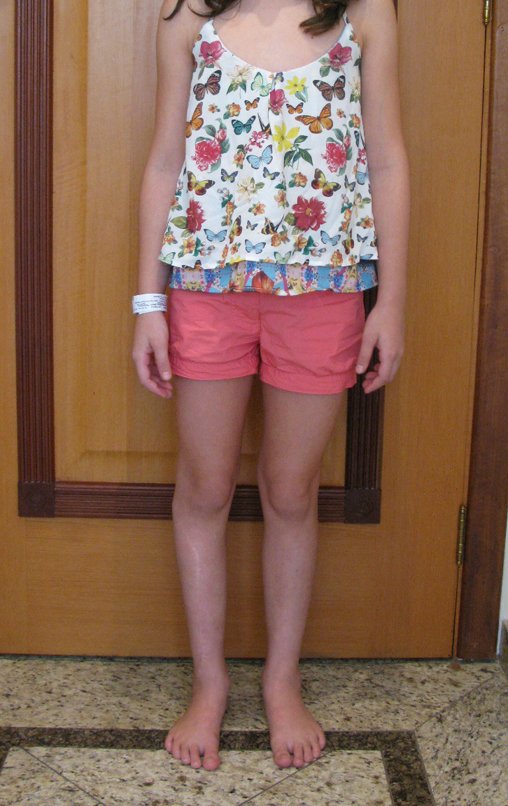
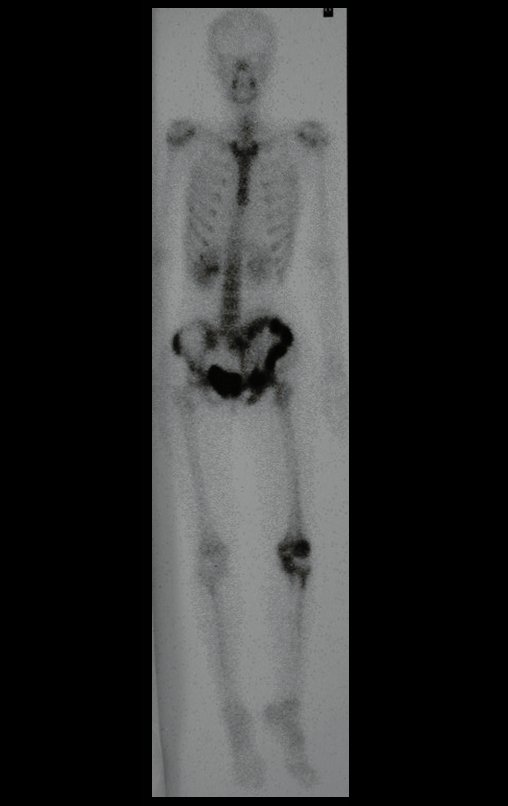
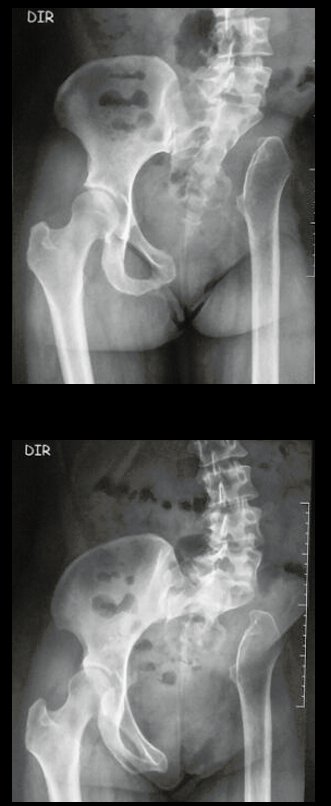
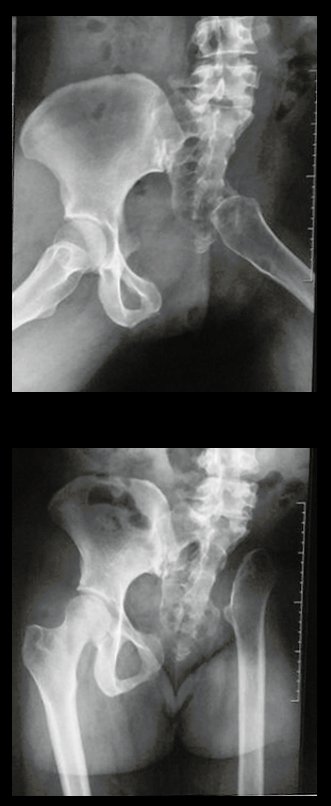
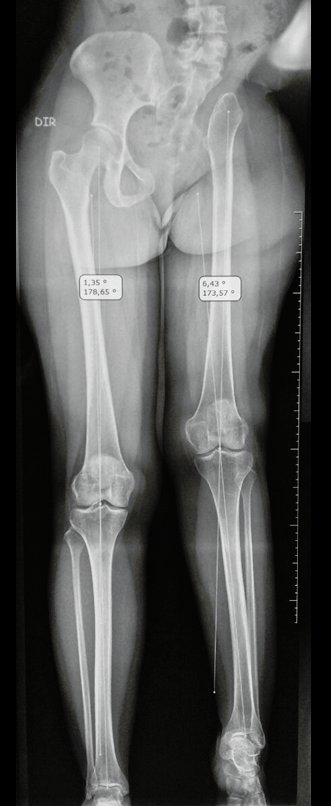
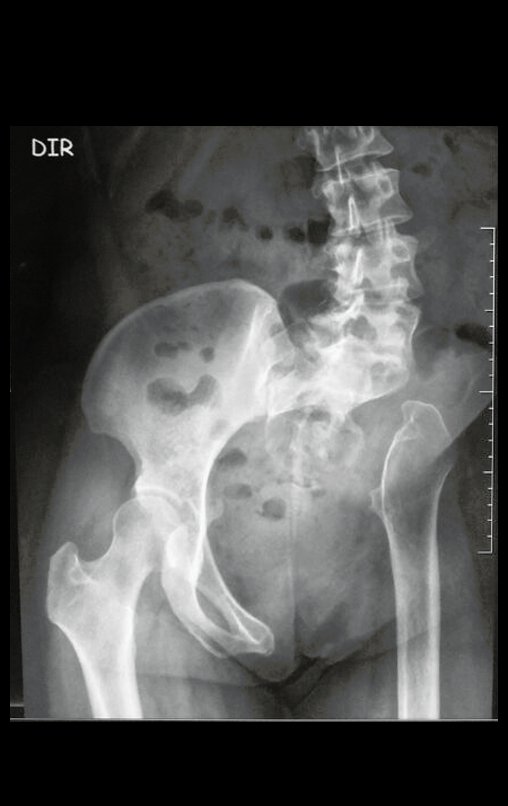
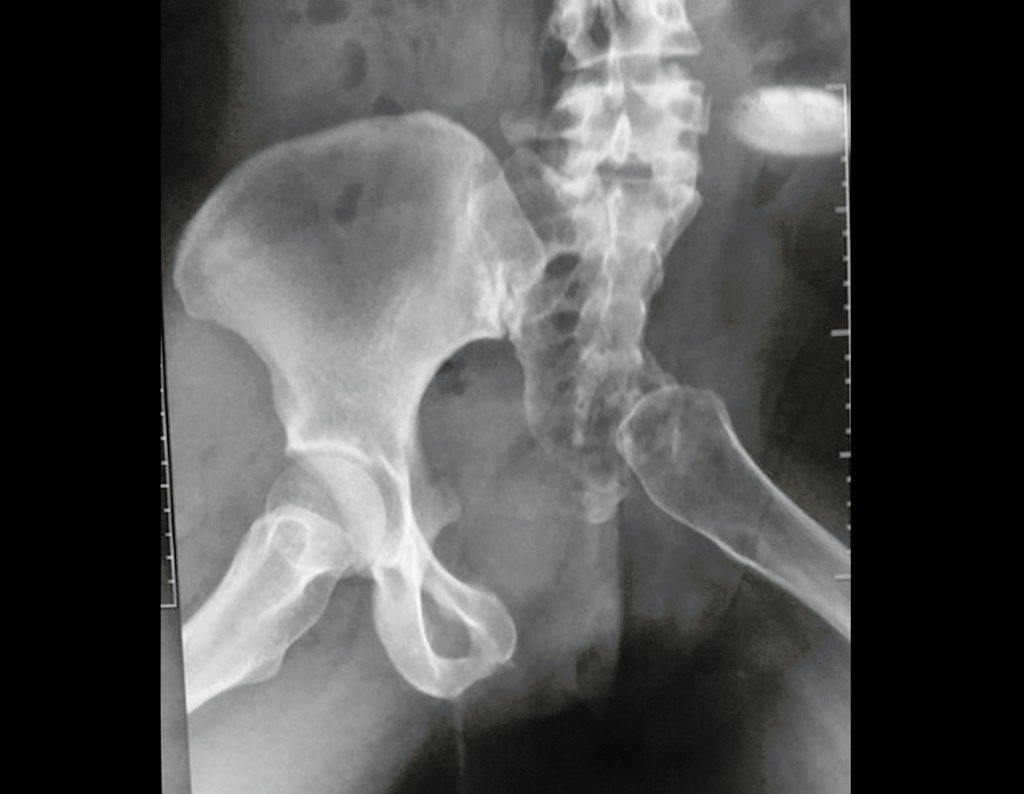
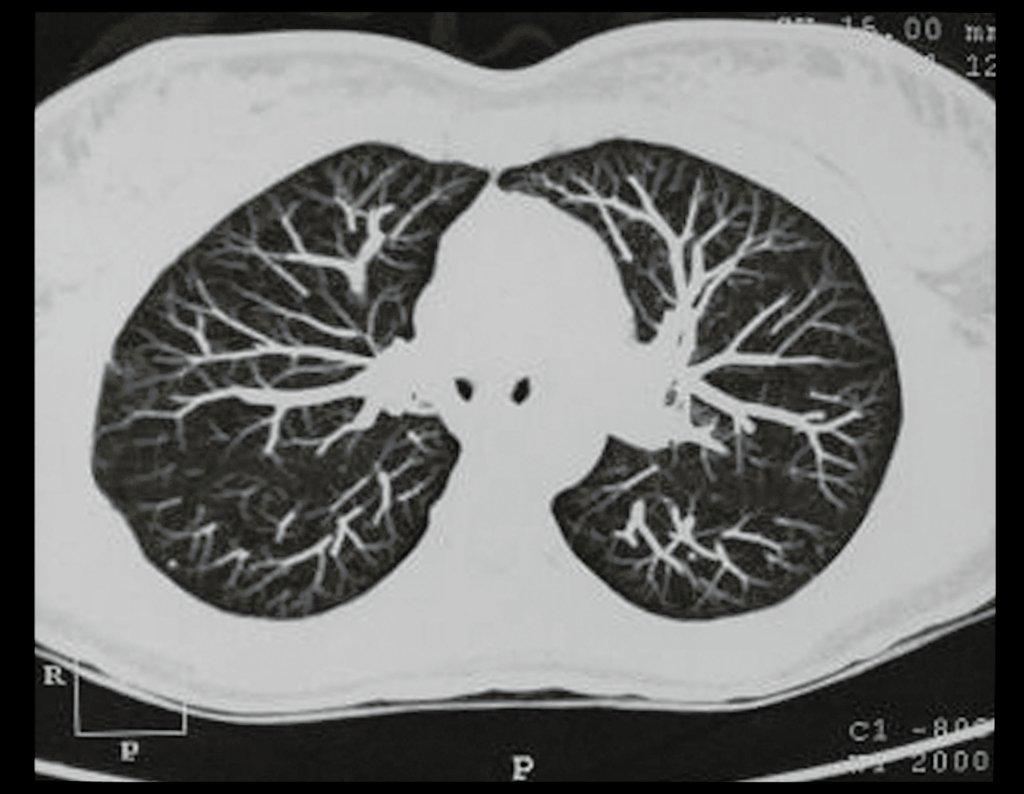
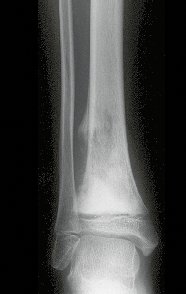
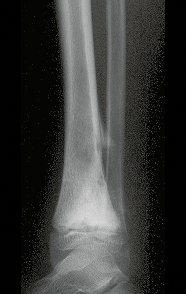
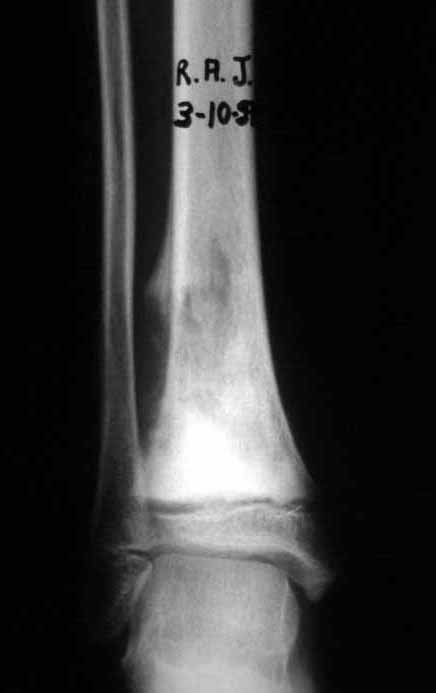
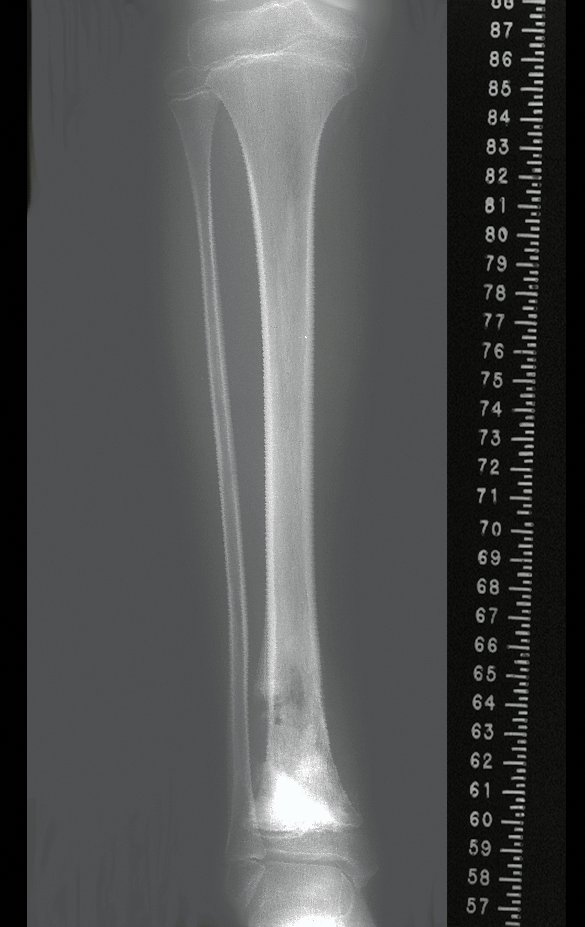
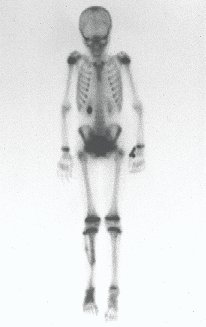
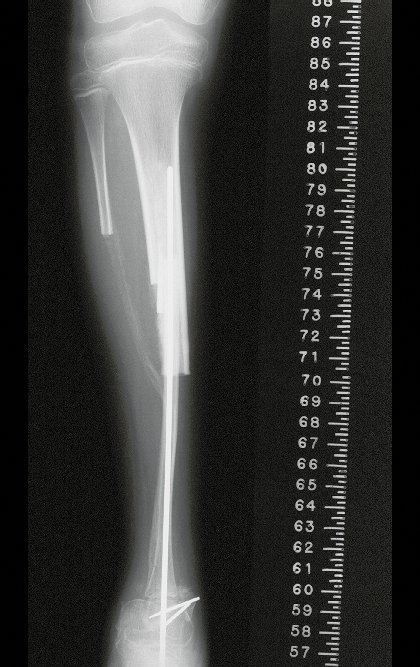
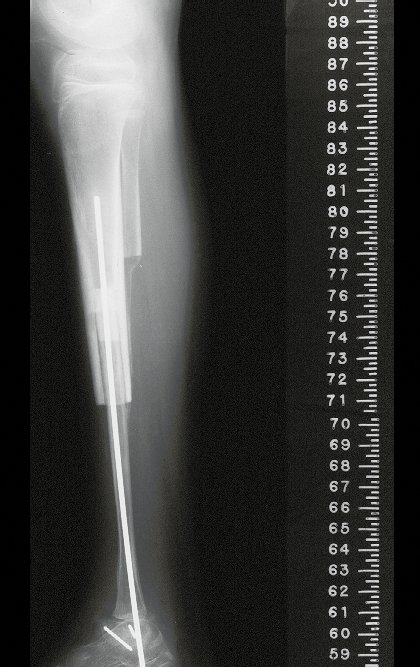
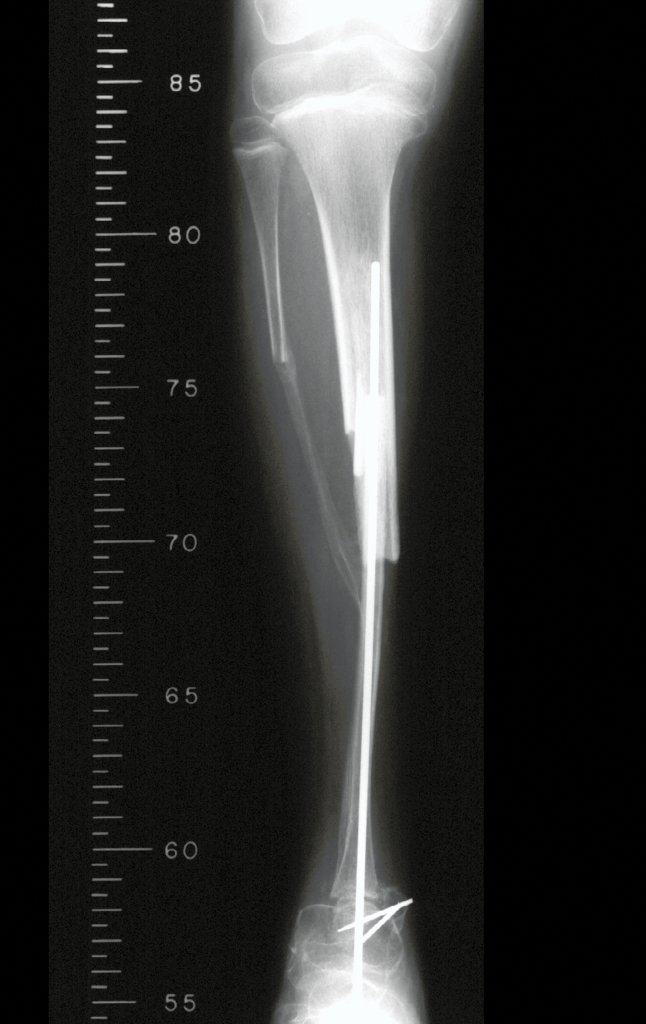
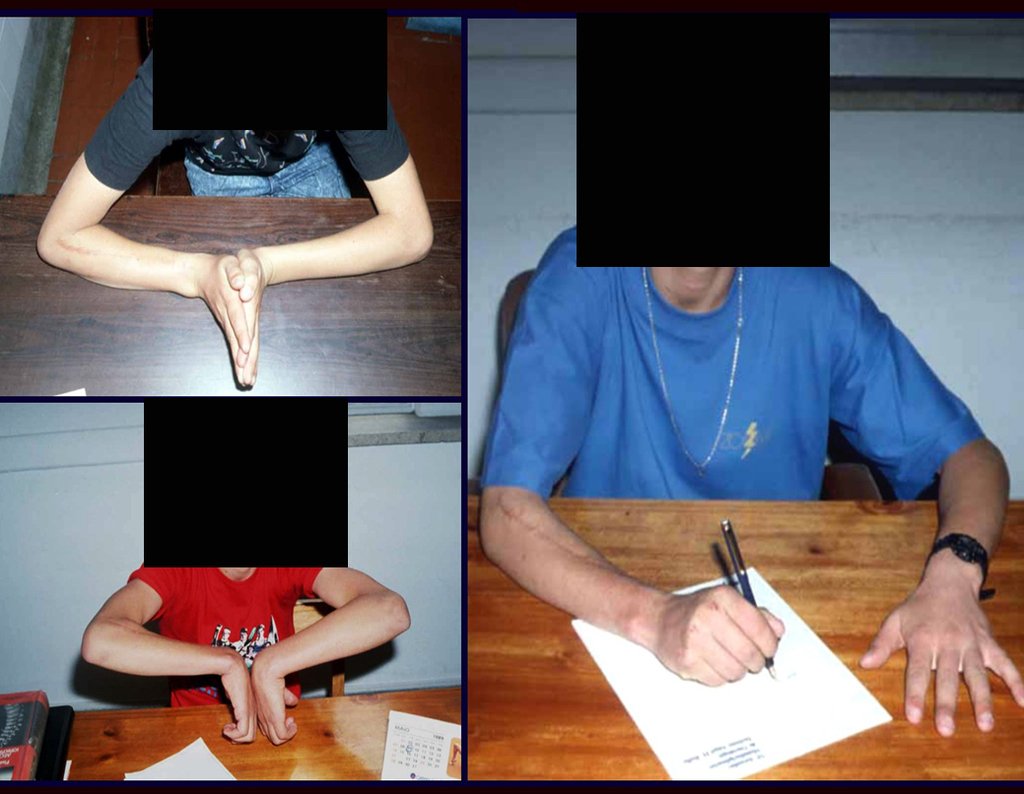
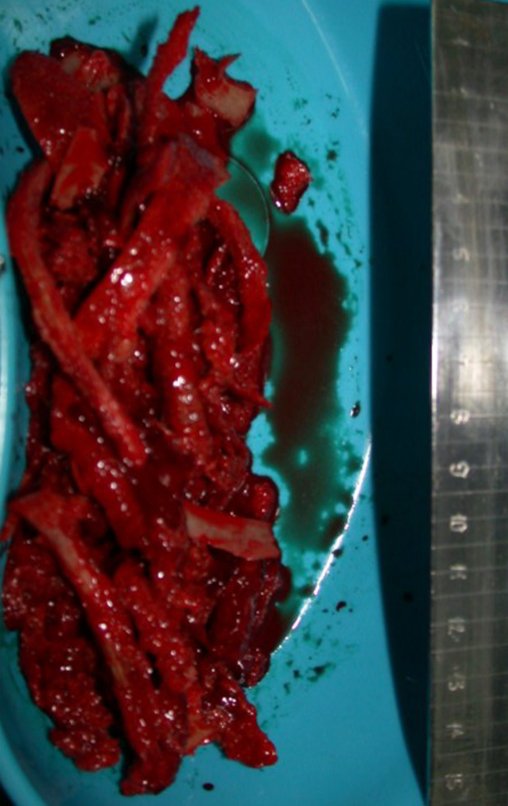
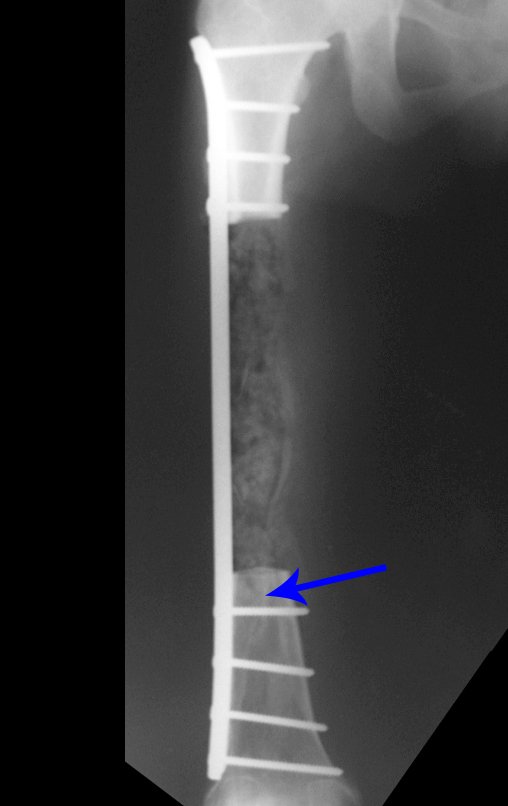
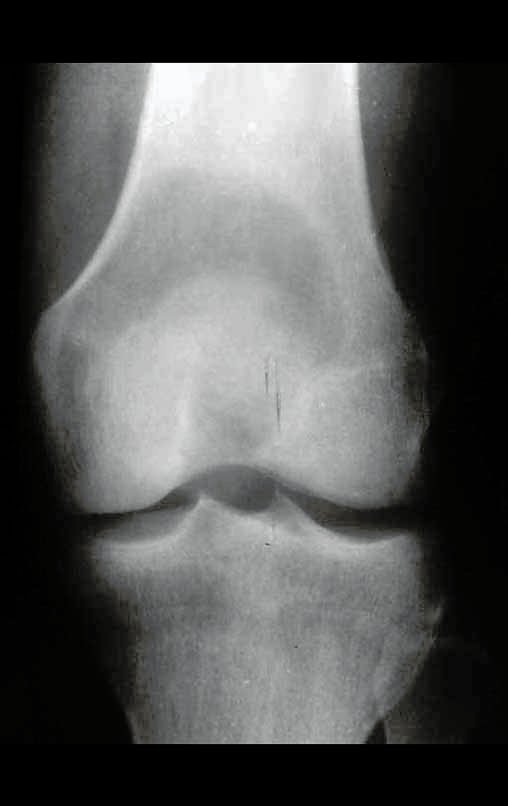
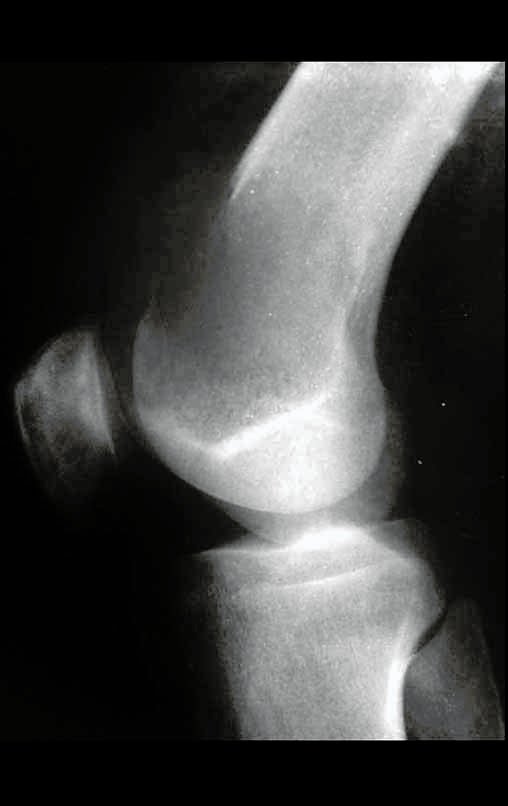
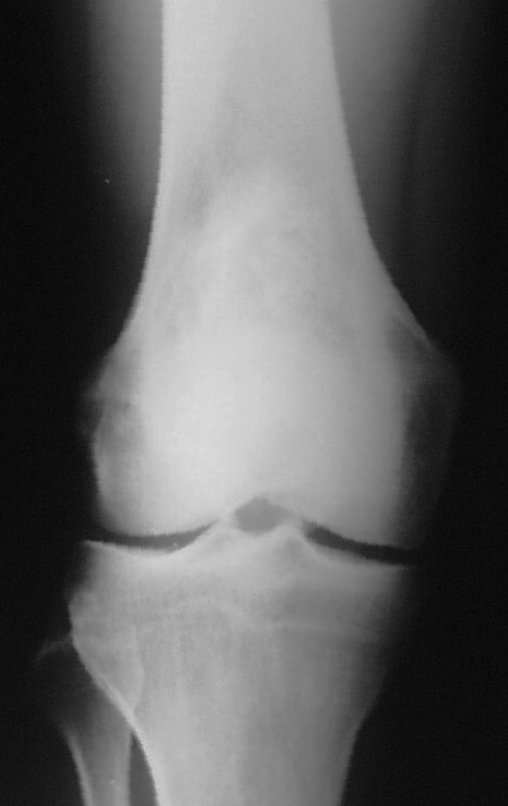
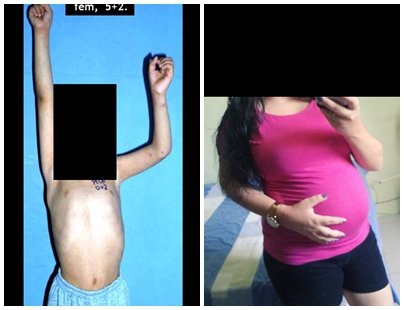
Tumor de células gigantes do rádio: Paciente feminina, 26 anos de idade, com dor no punho esquerdo havia dois meses. Procurou atendimento inicial em janeiro do ano 2000, quando foram feitas radiografias e tomografia, apresentando as seguintes imagens (Figuras 1 a 6).
08. Tumor de Células Gigantes do Rádio – Técnica de ressecção do tumor – Técnica de obtenção do enxerto autólogo da fíbula – Técnica de reconstrução do punho
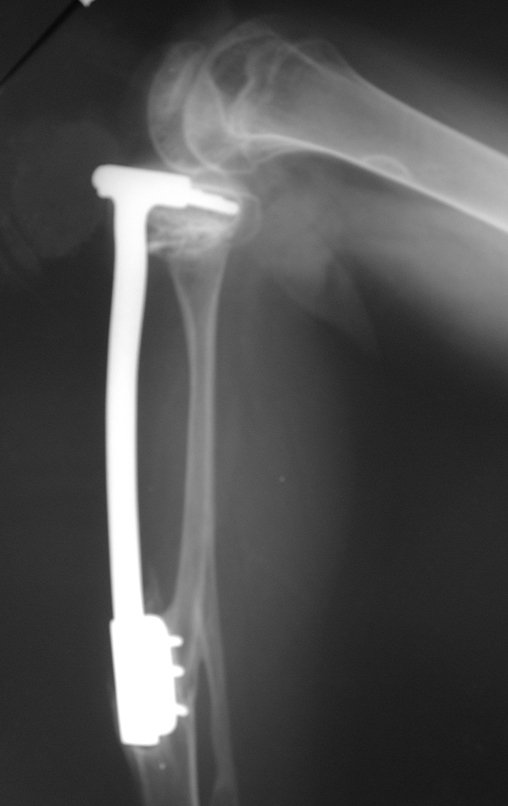
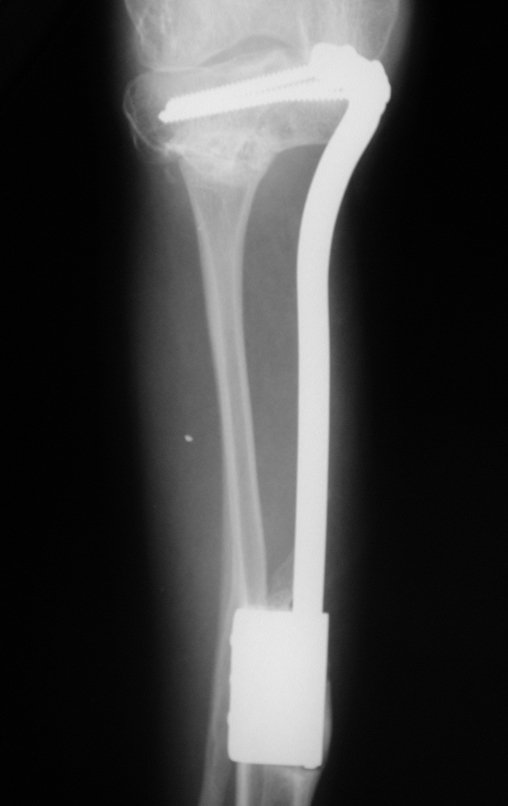
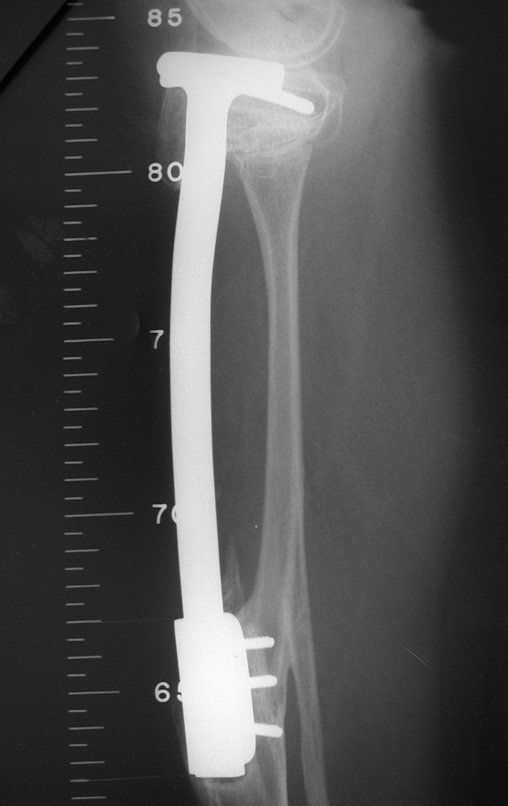
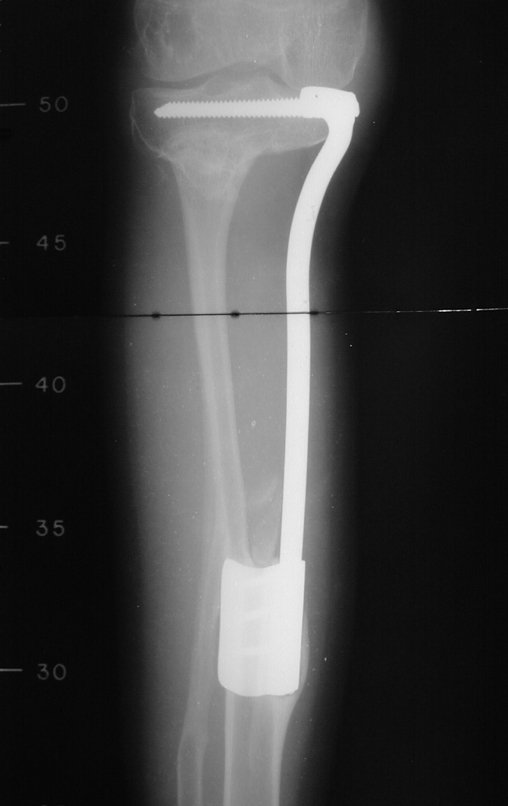
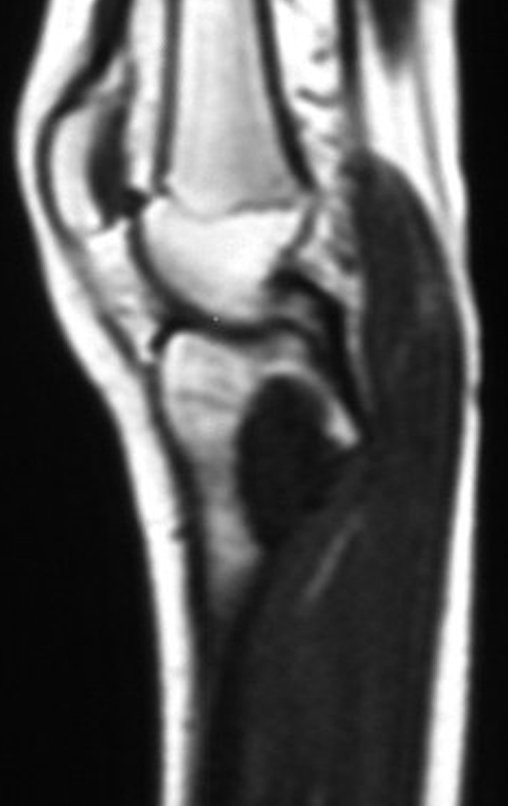
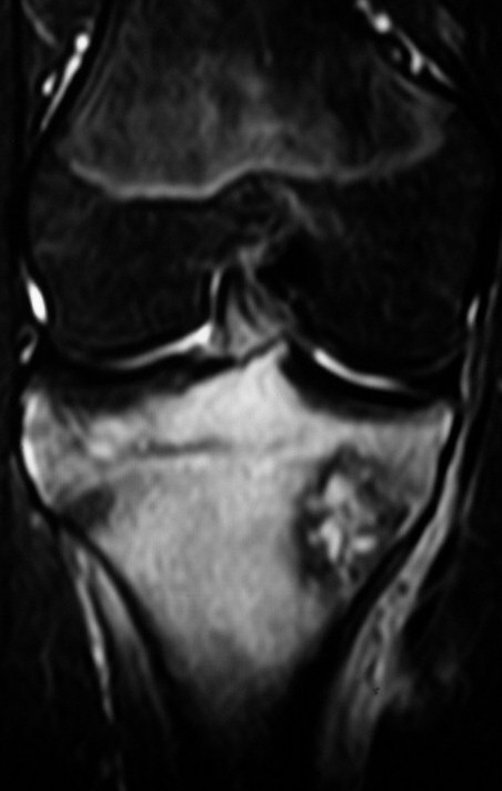
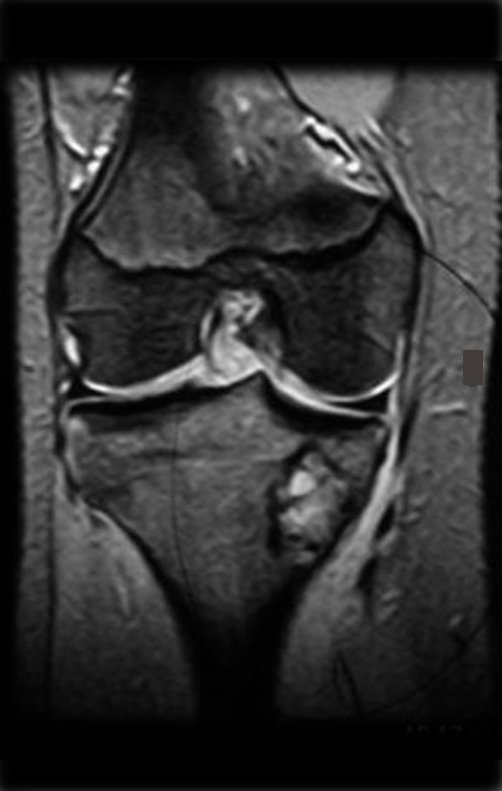
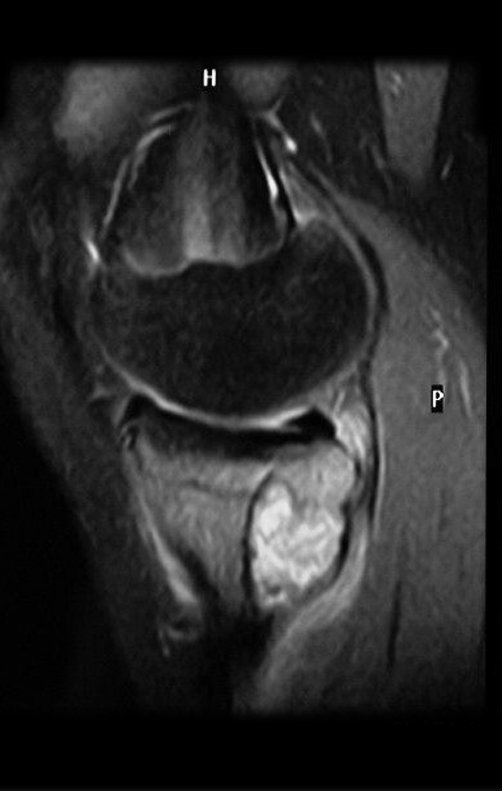
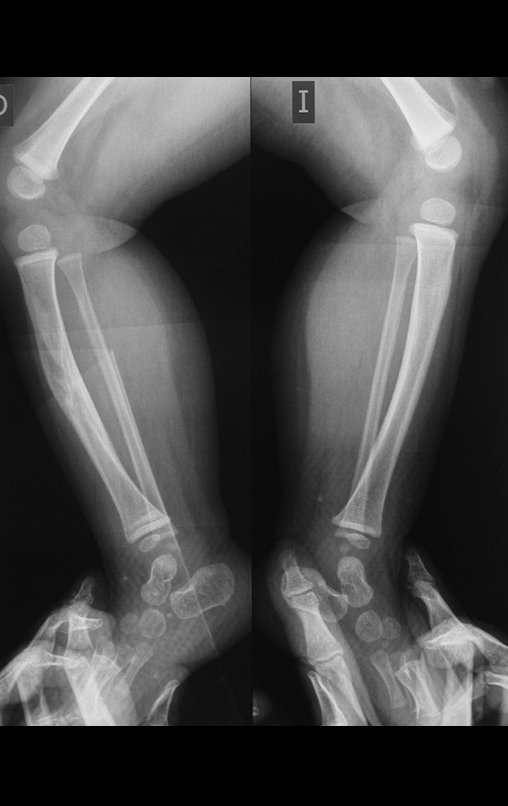
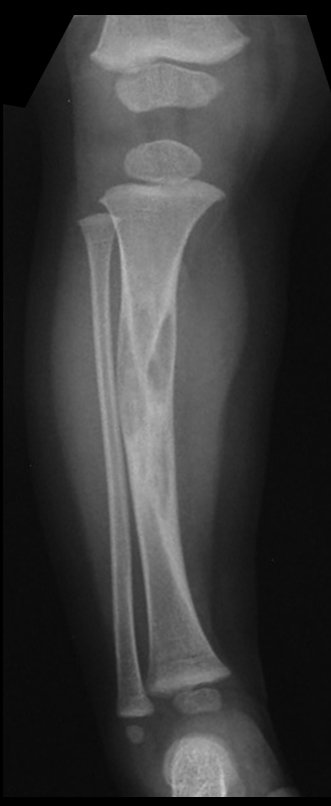
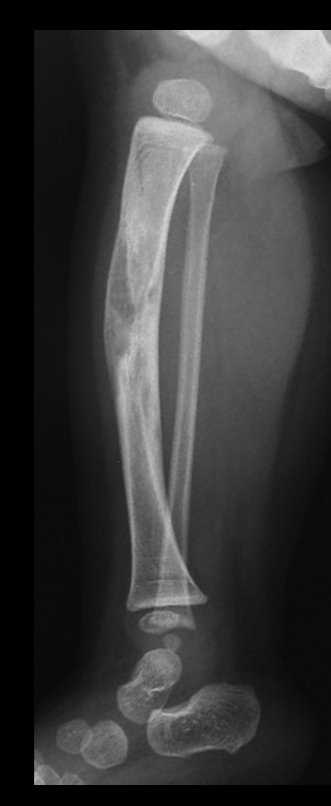
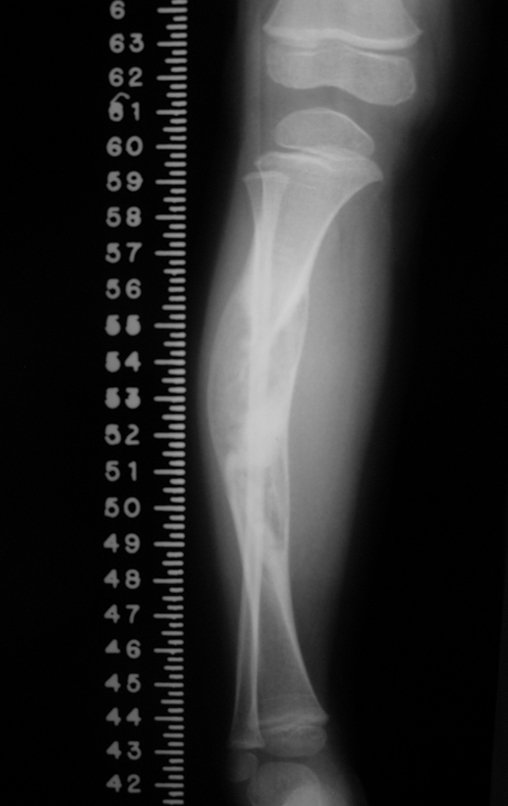
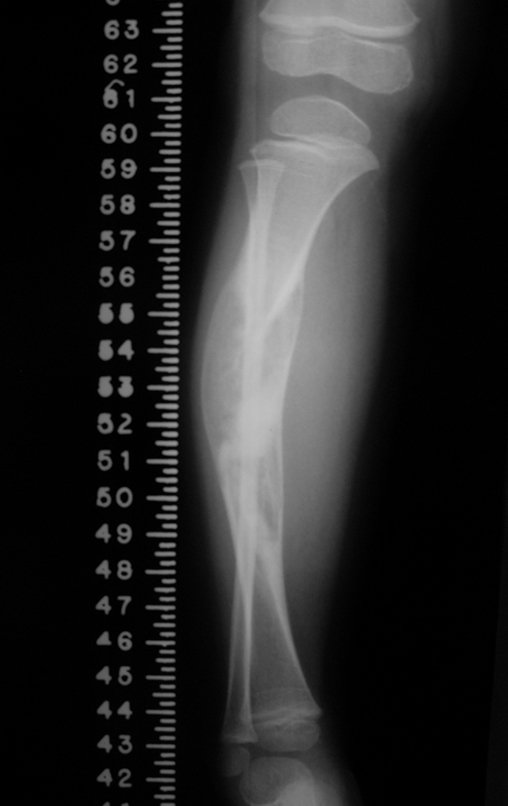
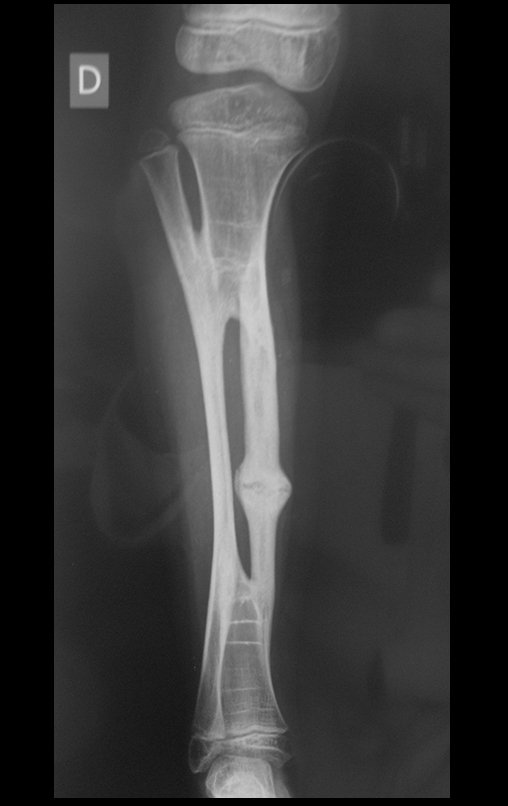
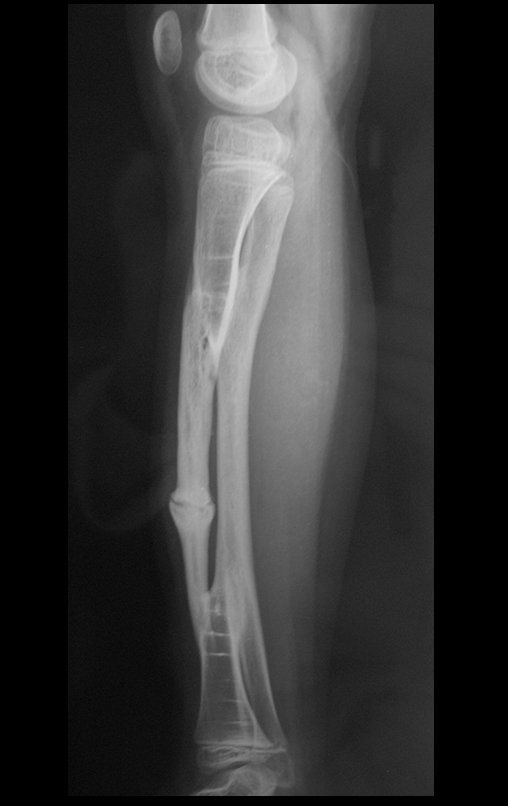
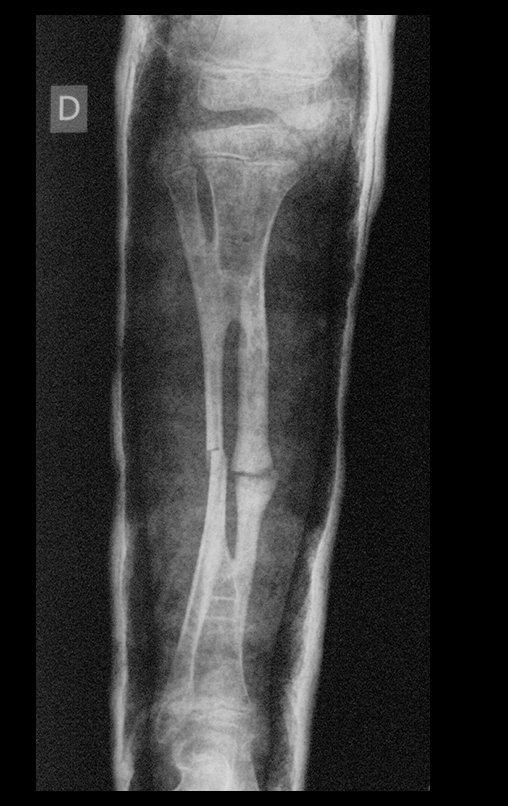
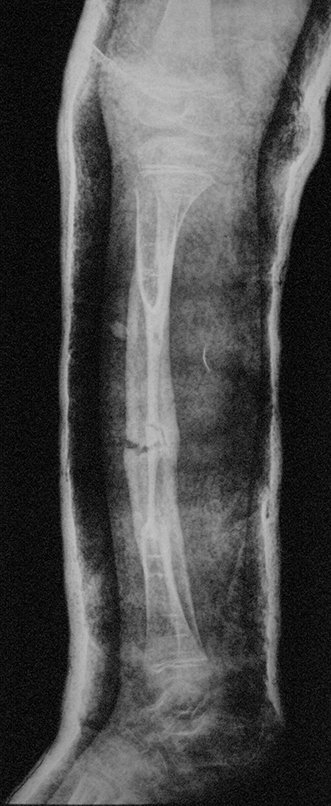
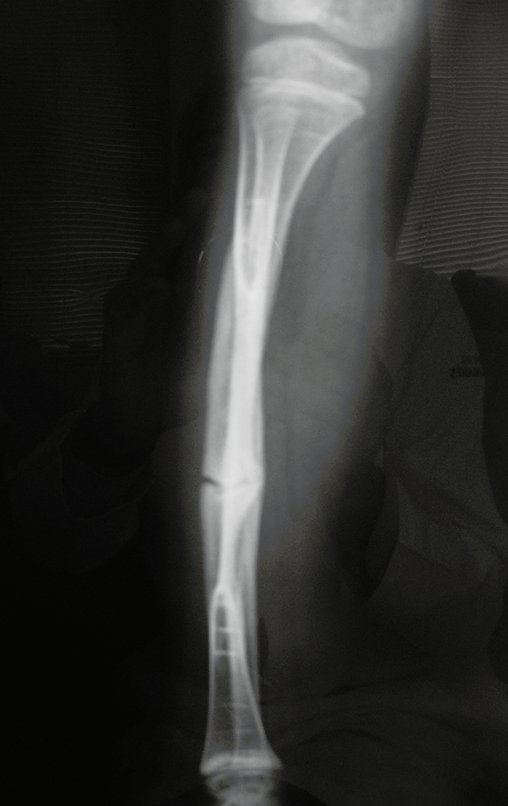
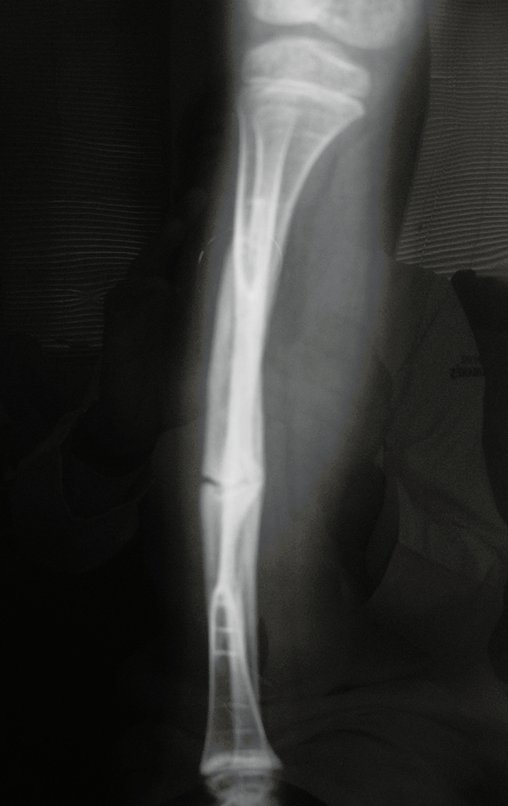
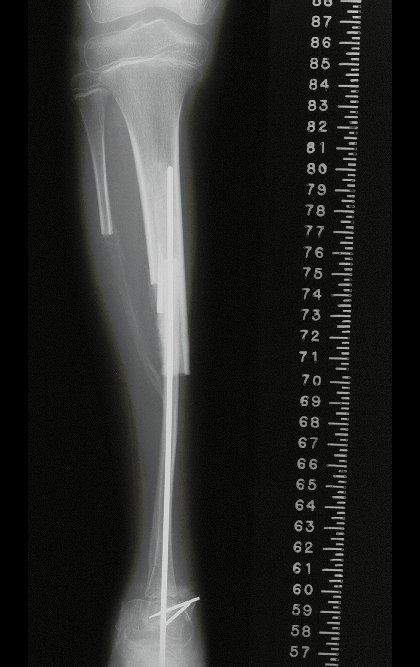
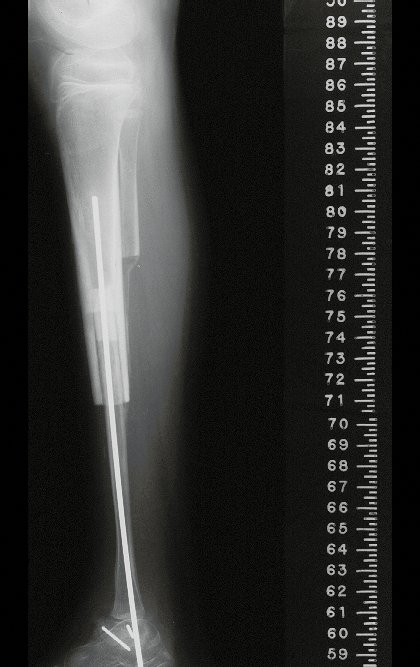
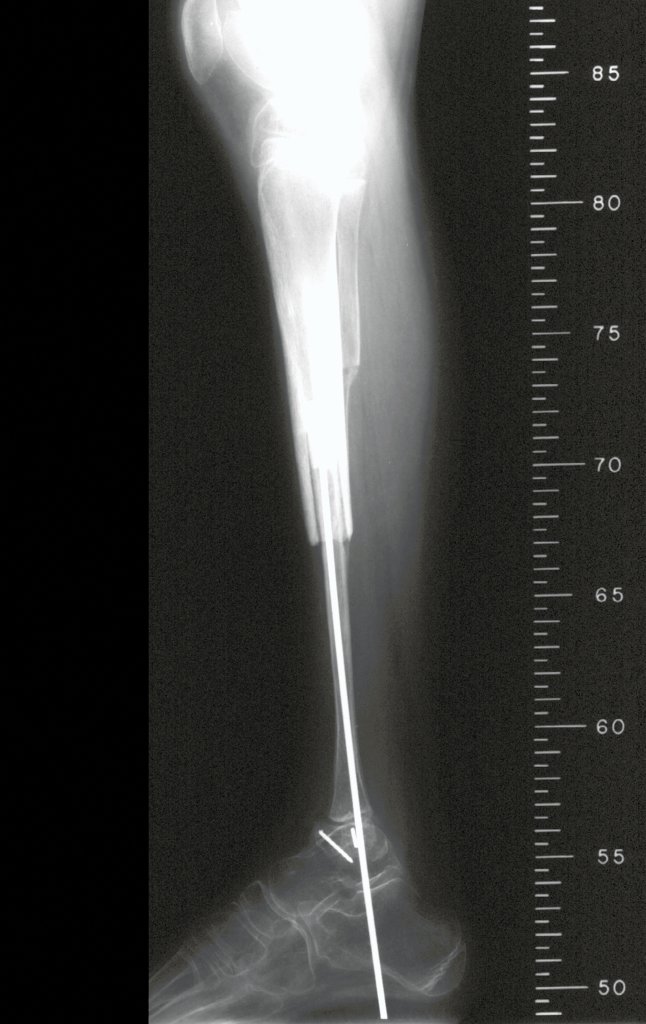
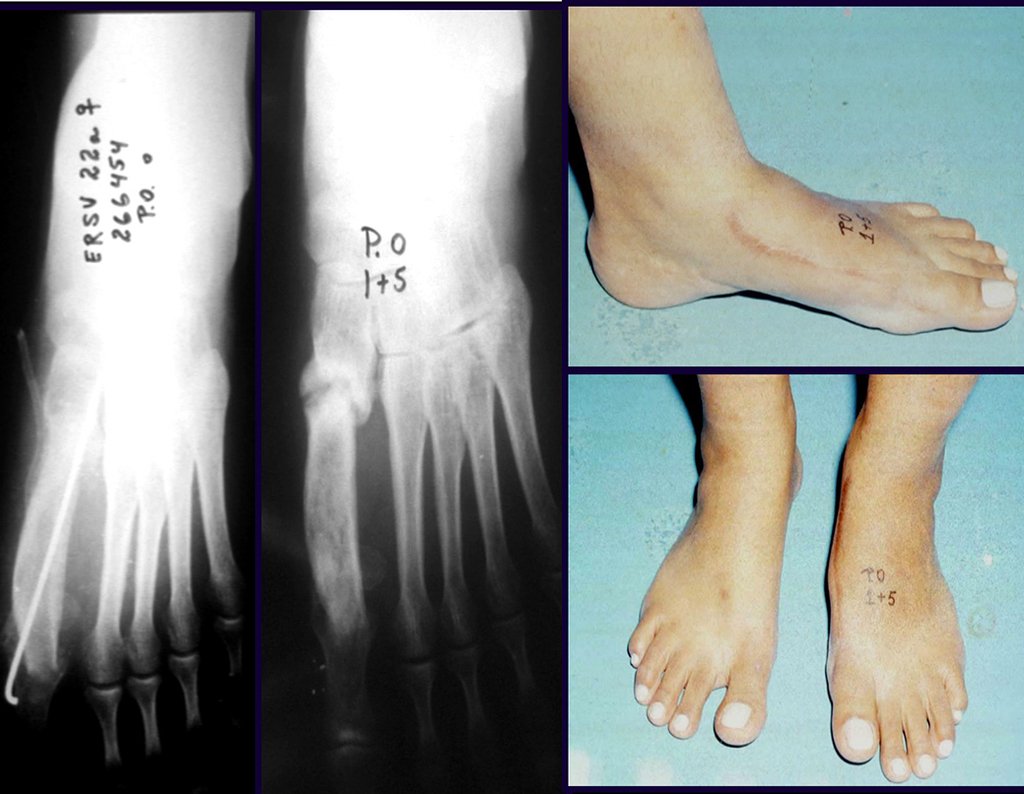
Em maio de 2005, com a suspeita de tumor de células gigantes, foi encaminhada para um segundo hospital, cinco meses do primeiro atendimento. Novo encaminhamento foi feito, agora para nosso atendimento, em outubro daquele ano (Figuras 7 à 10).
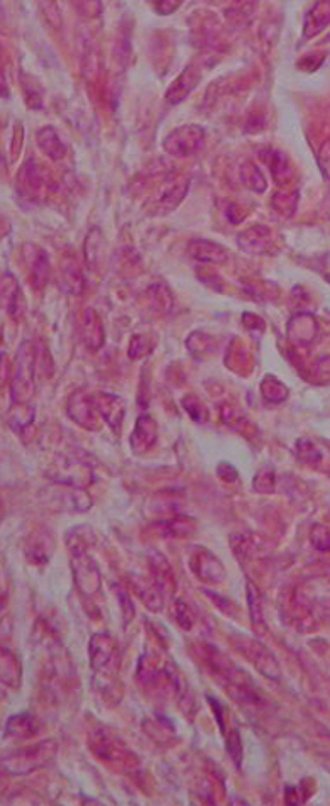
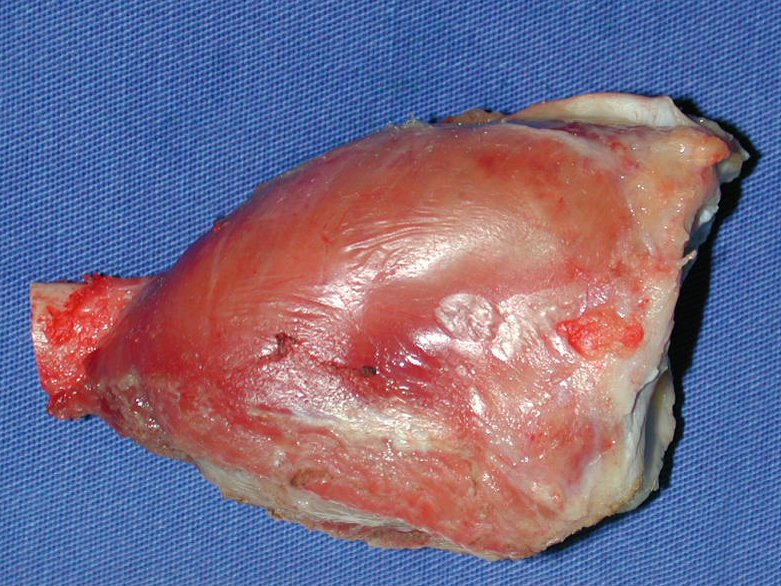
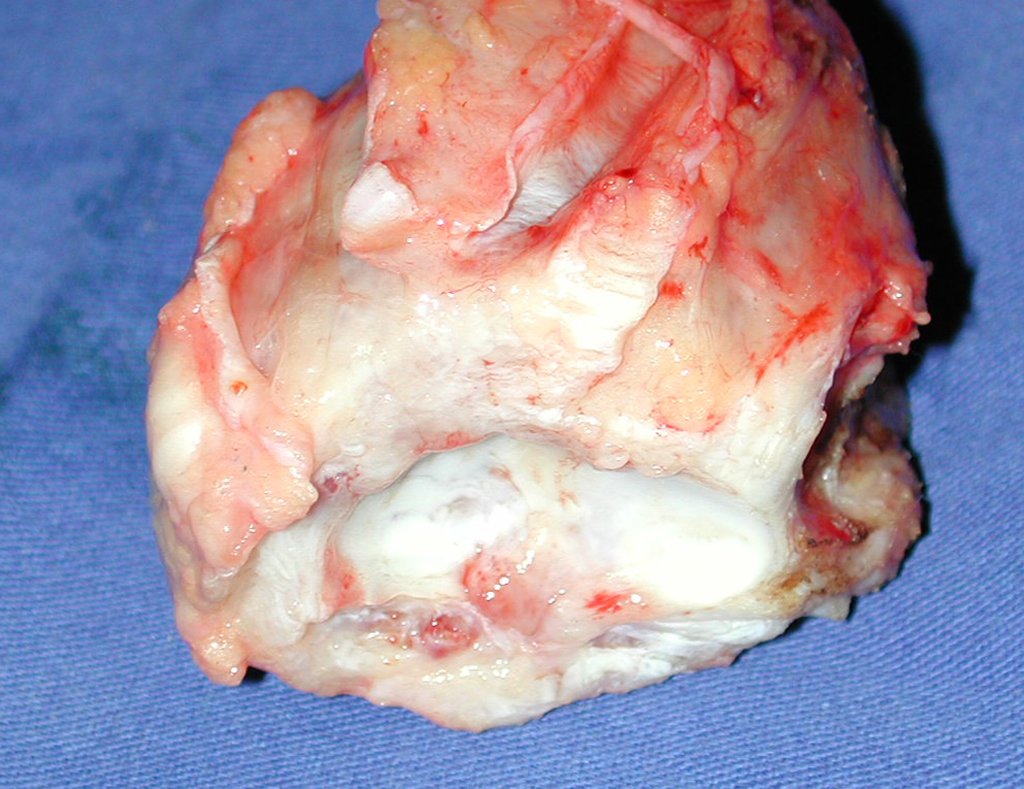
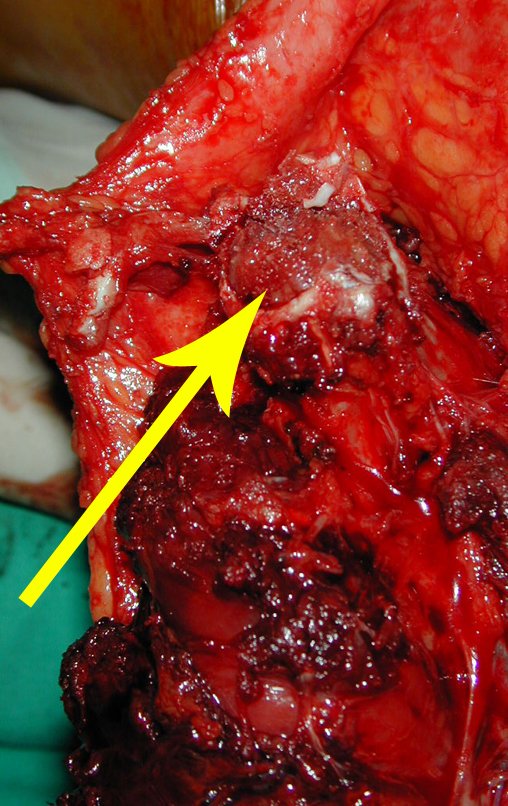
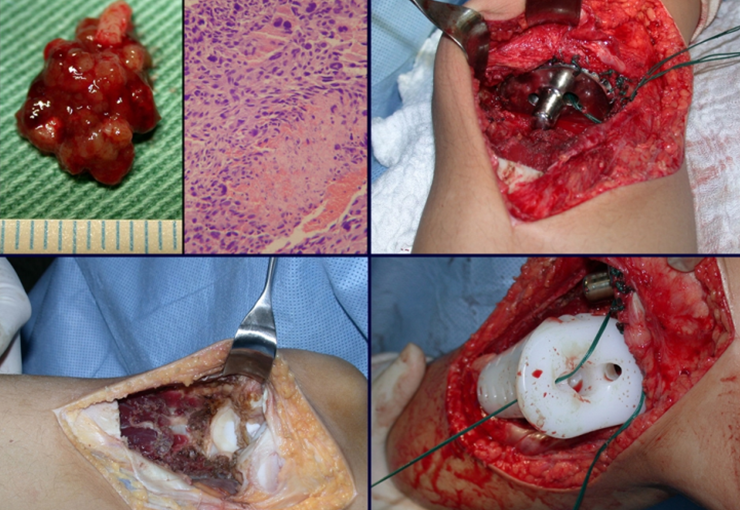
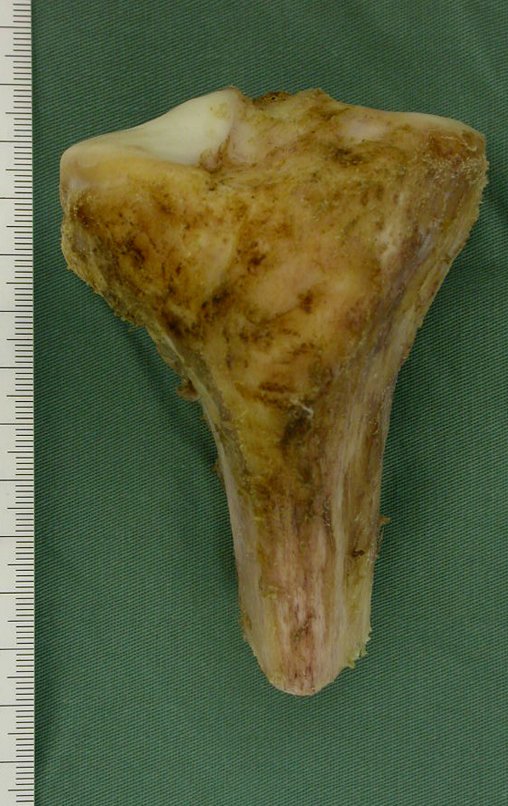
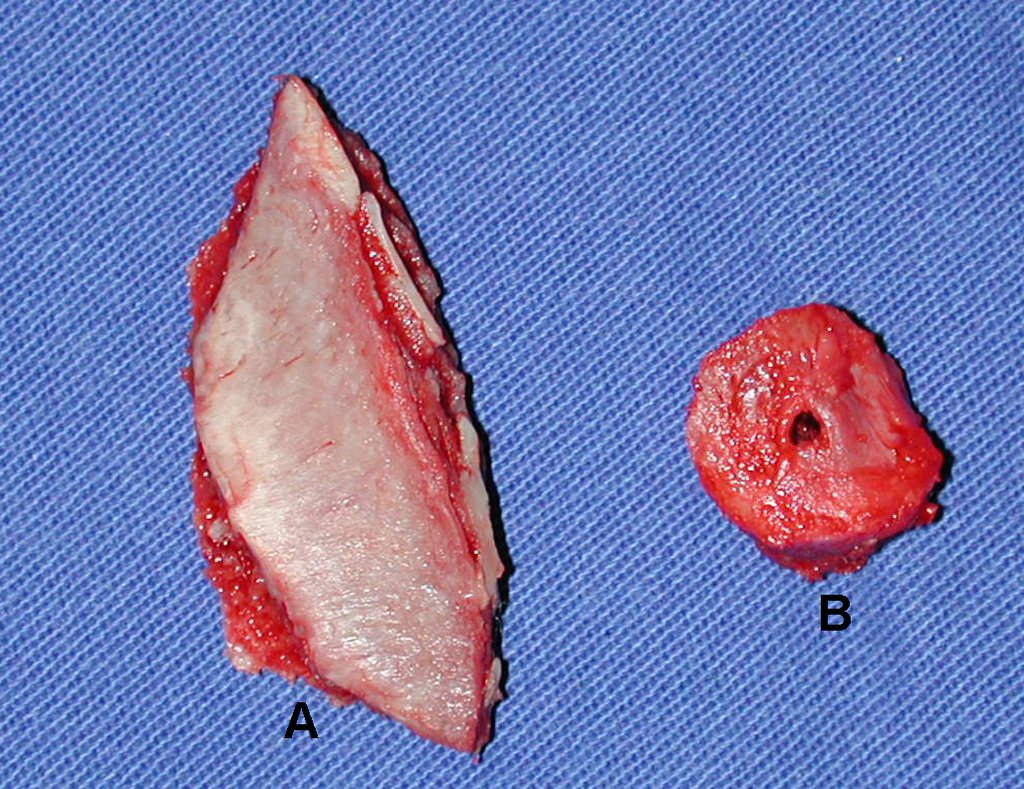
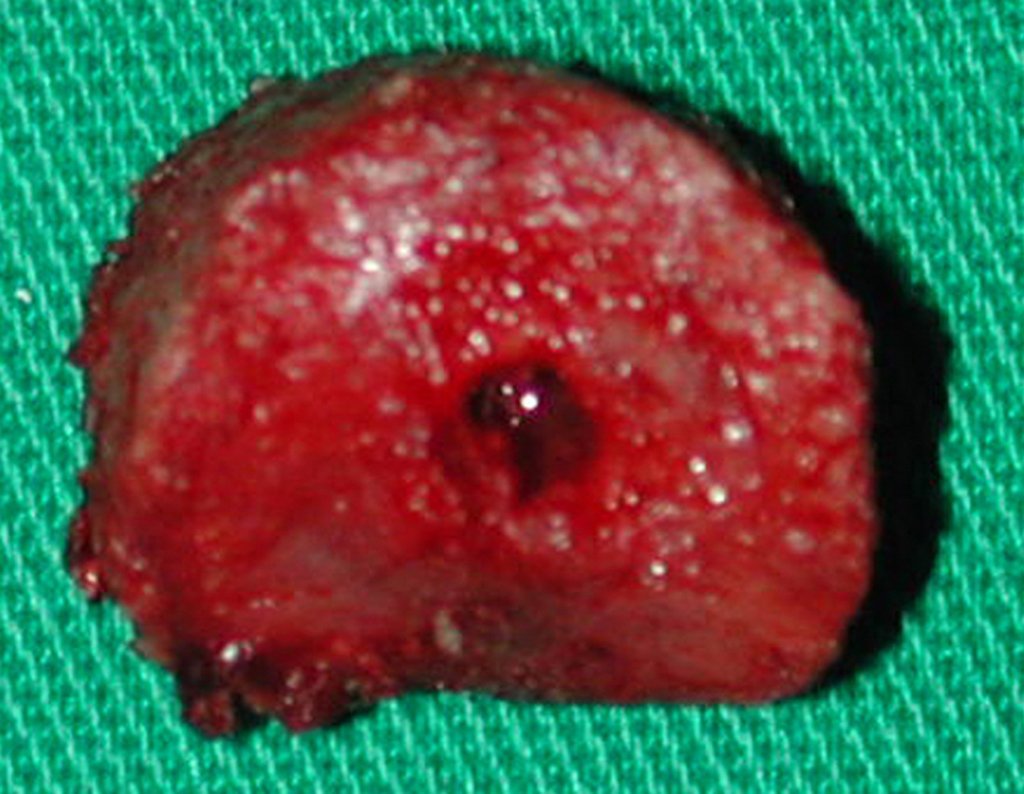
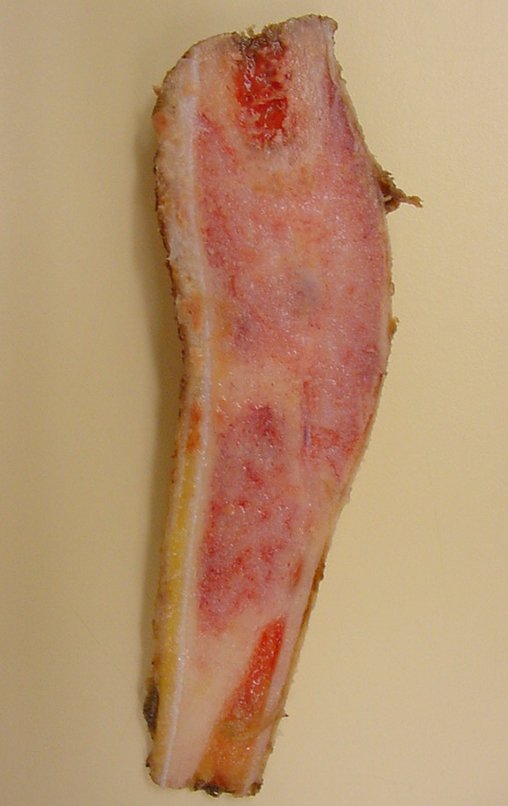
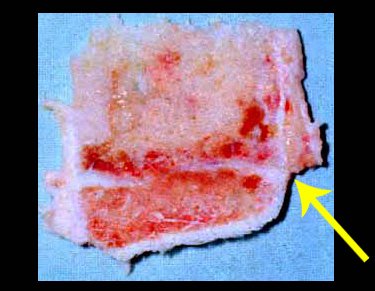
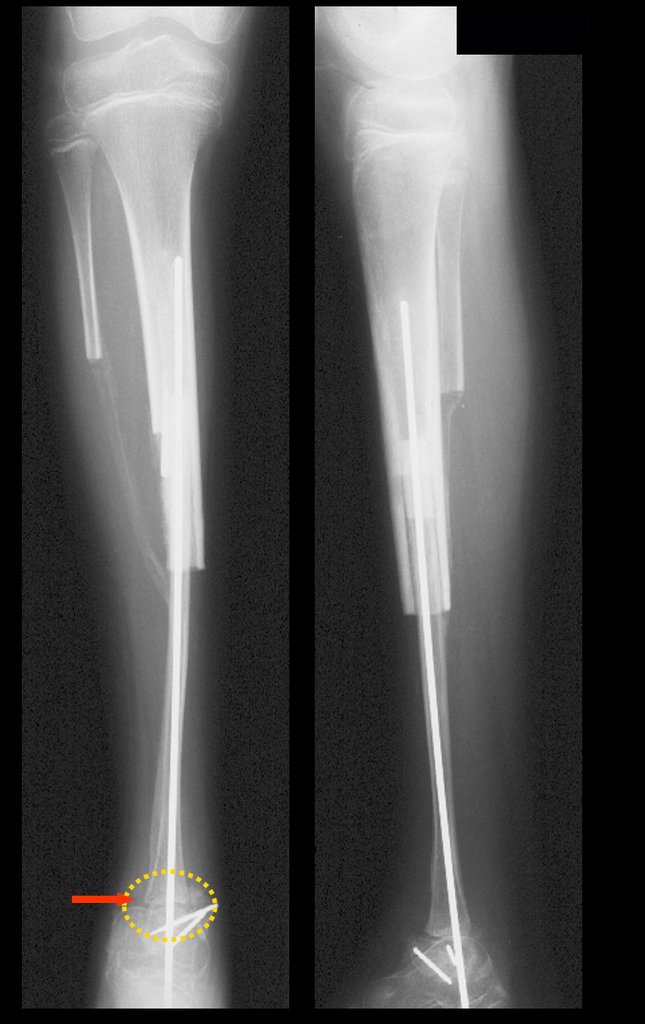
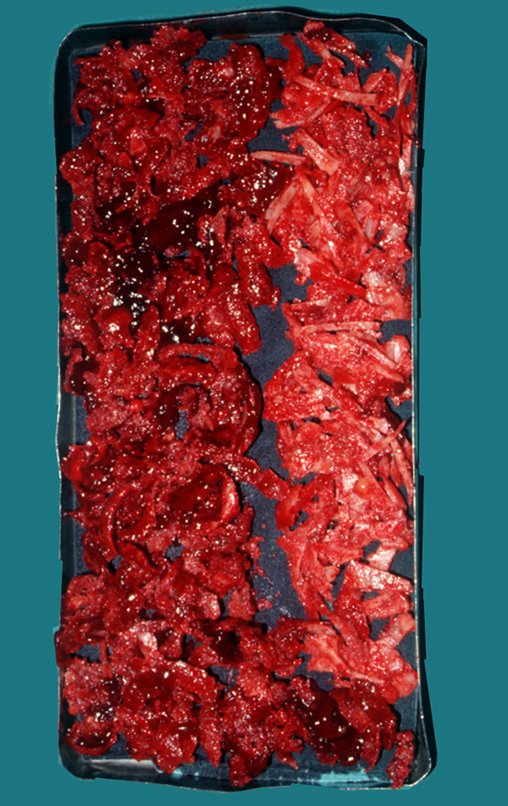
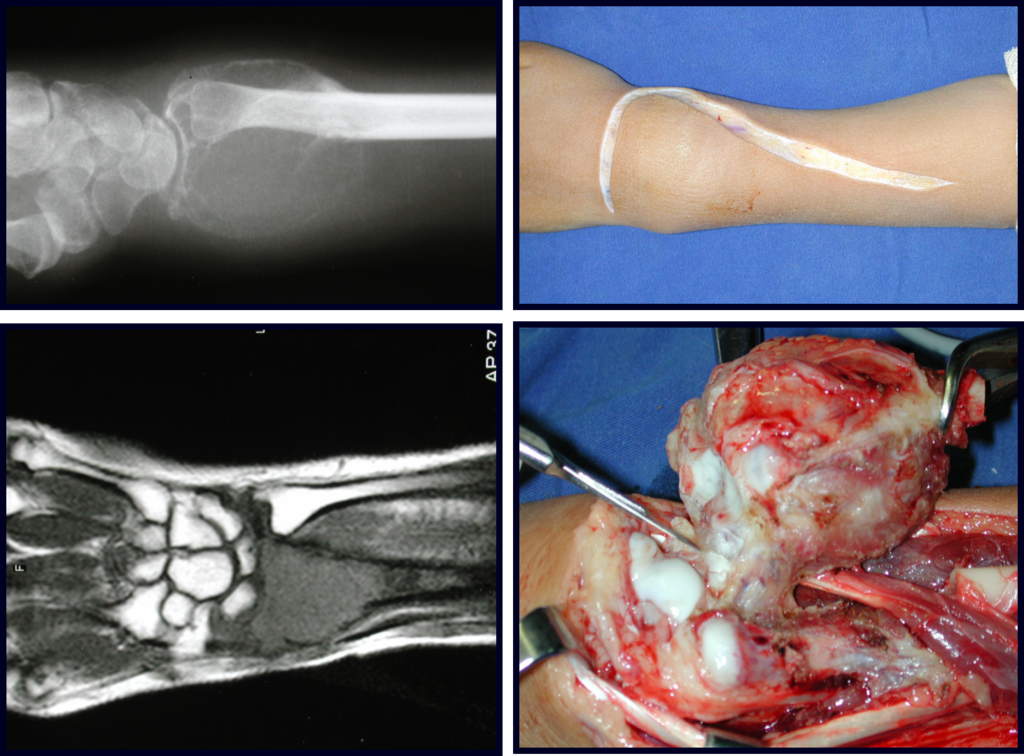
O diagnóstico histológico da biópsia confirmou a suspeita clínica de tumor de células gigantes (Figuras 19 a 24).
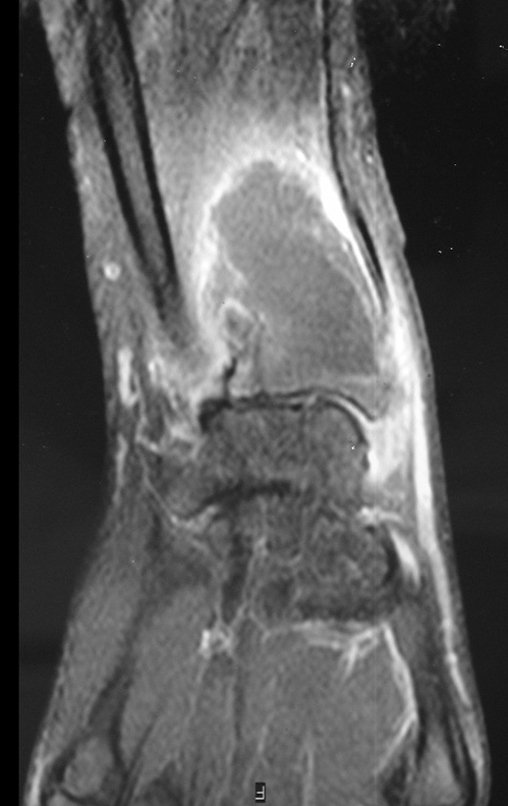
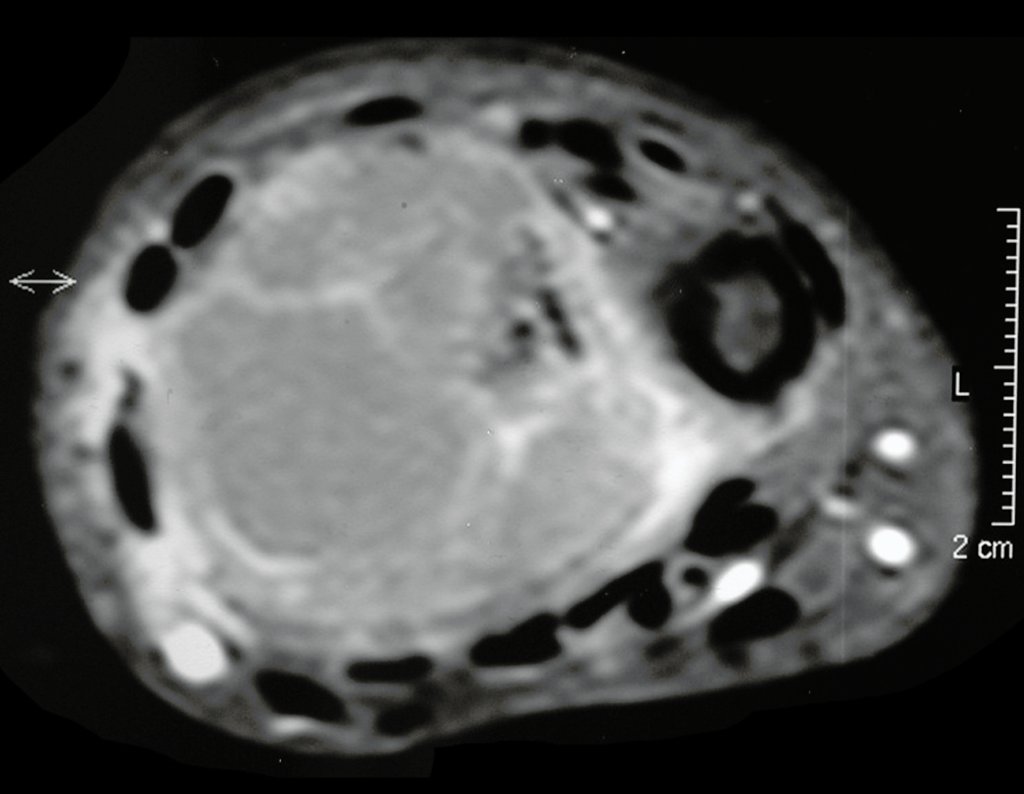
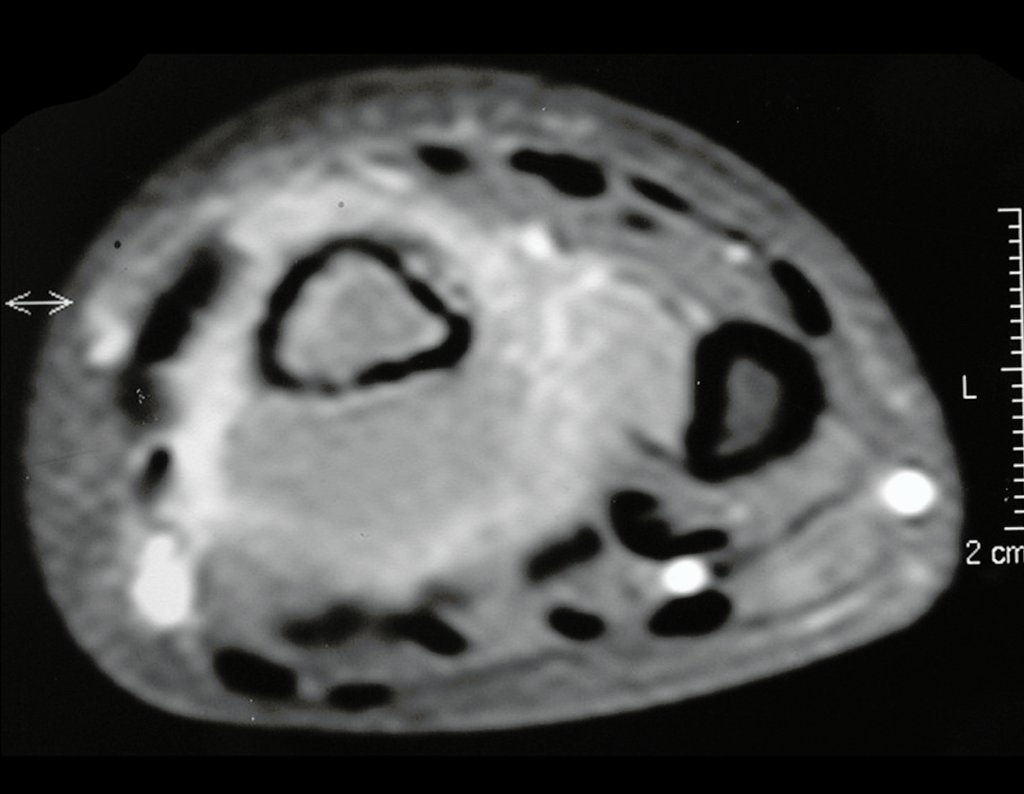
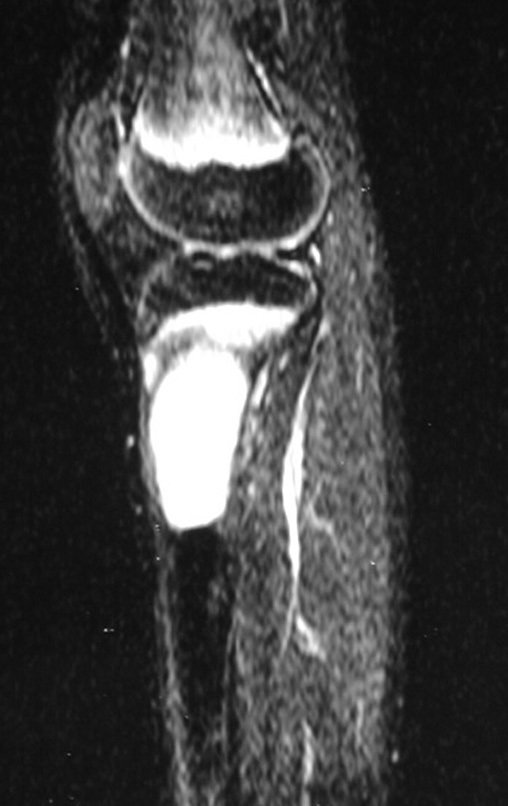
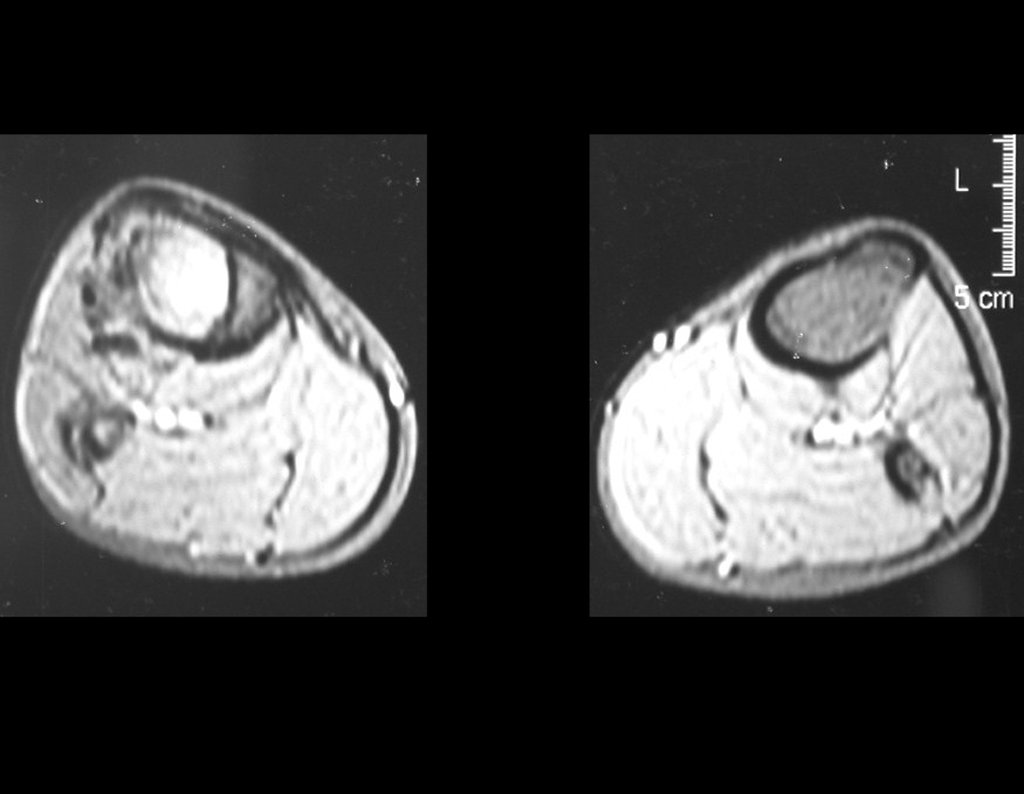
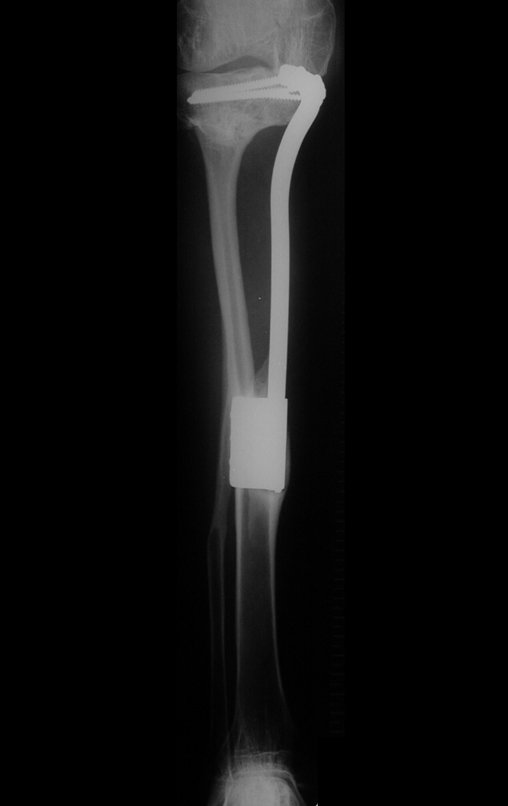
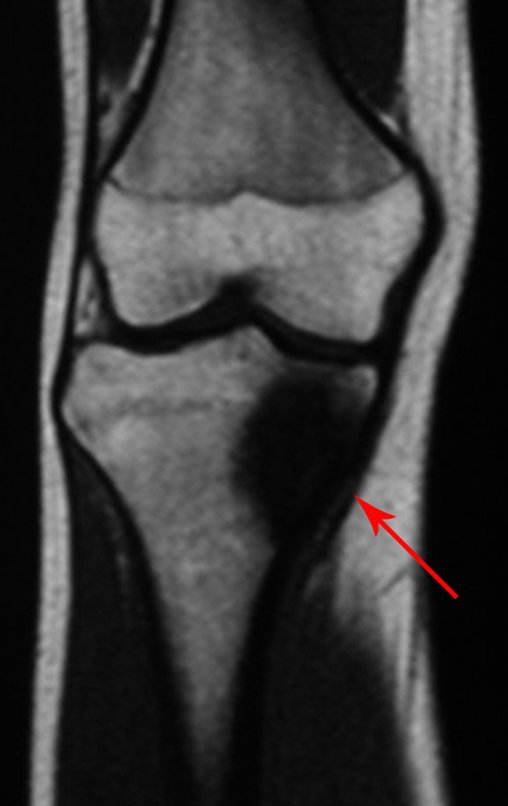
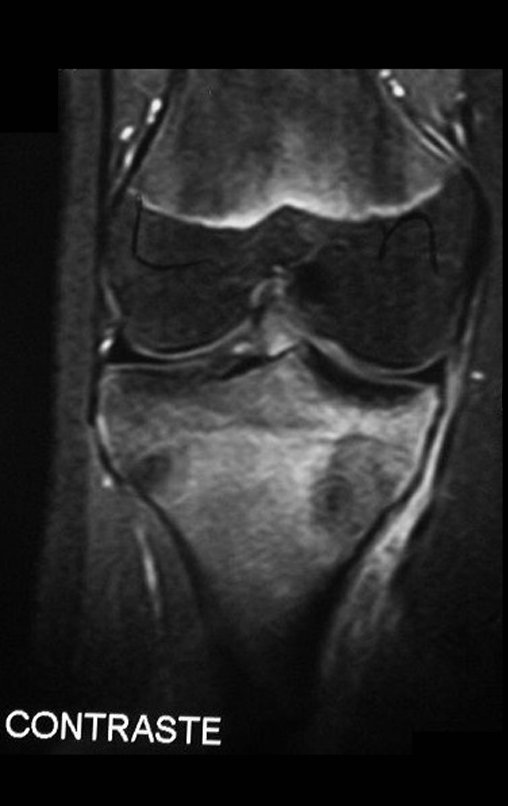
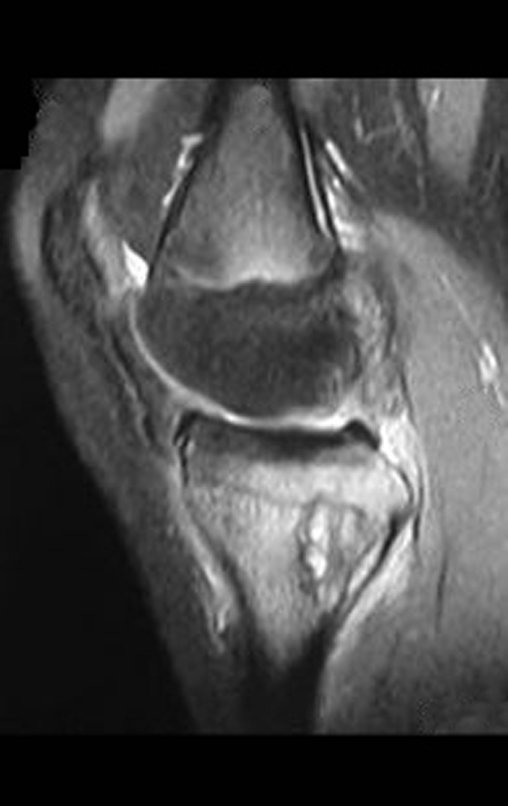
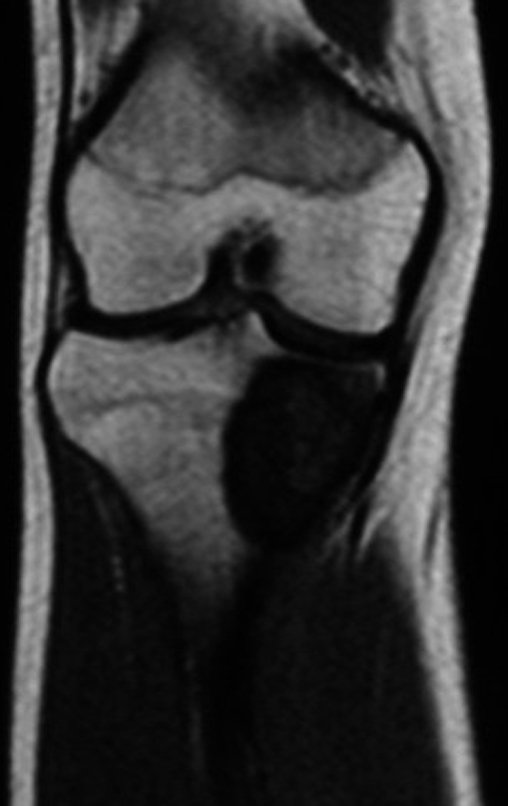
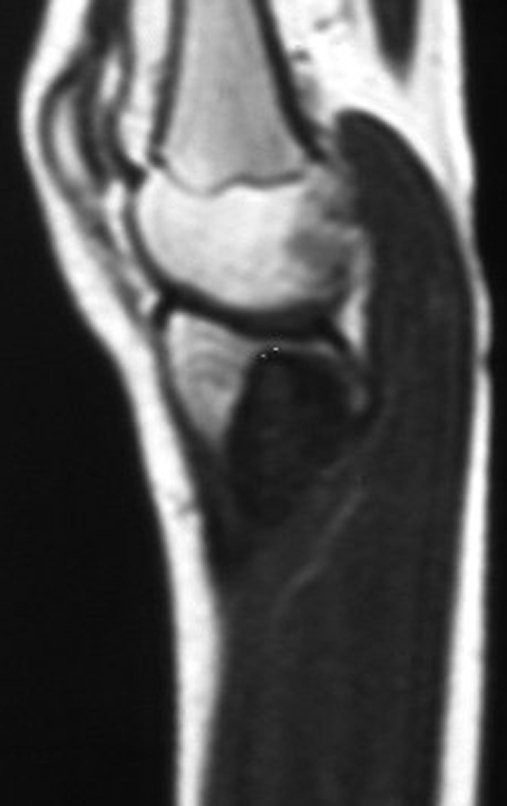
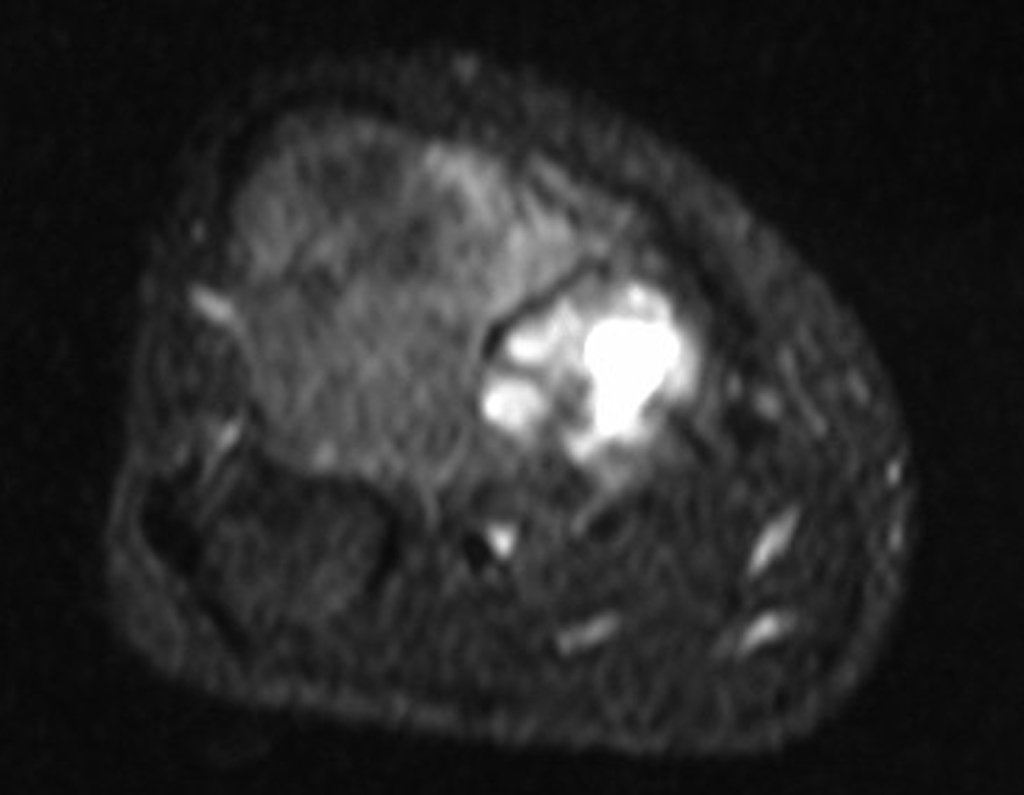
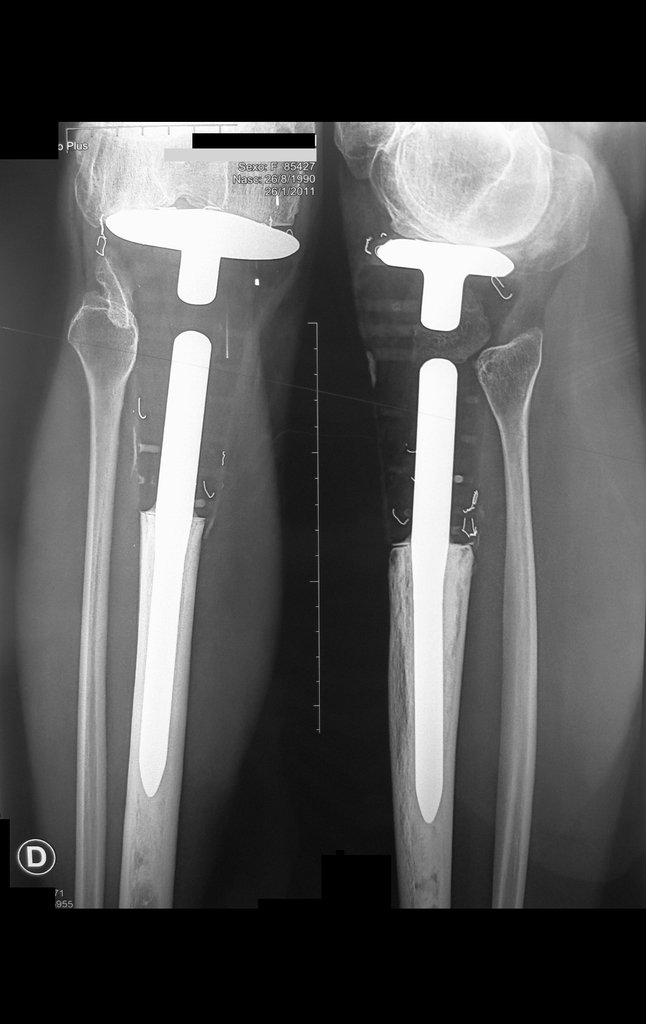
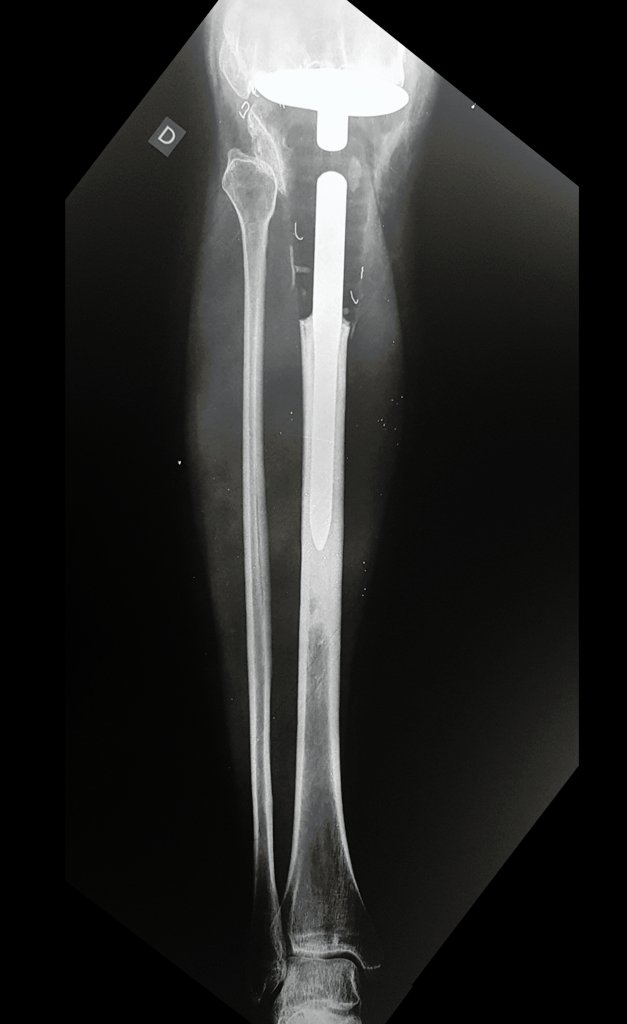
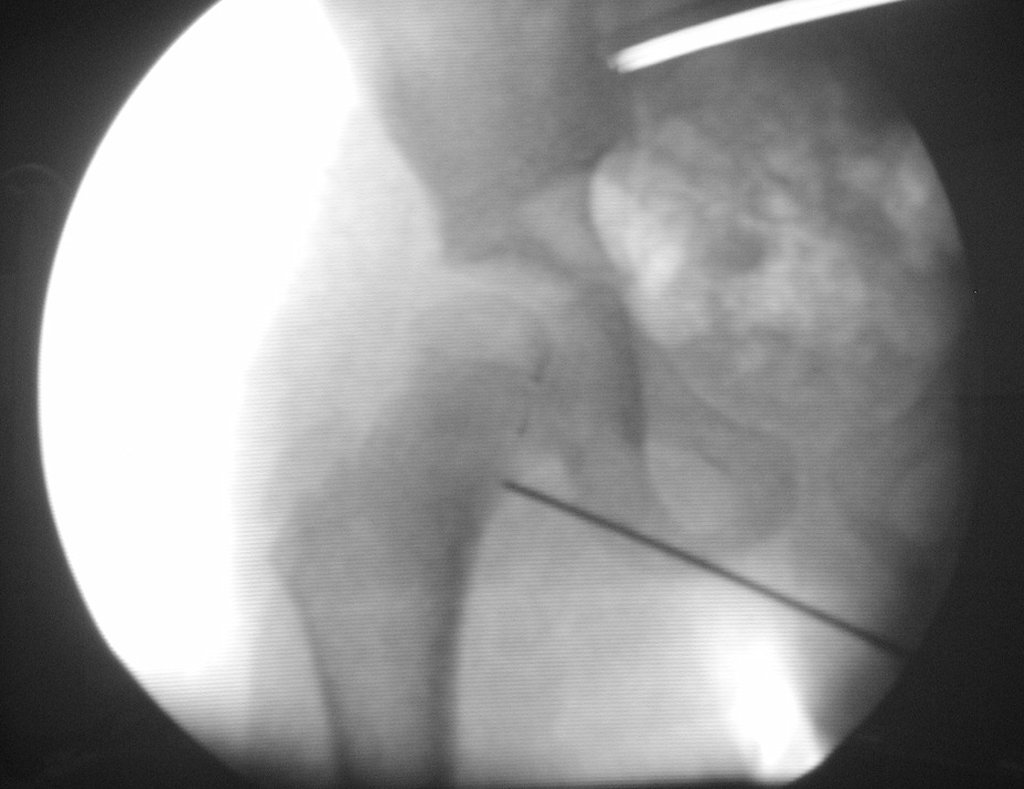
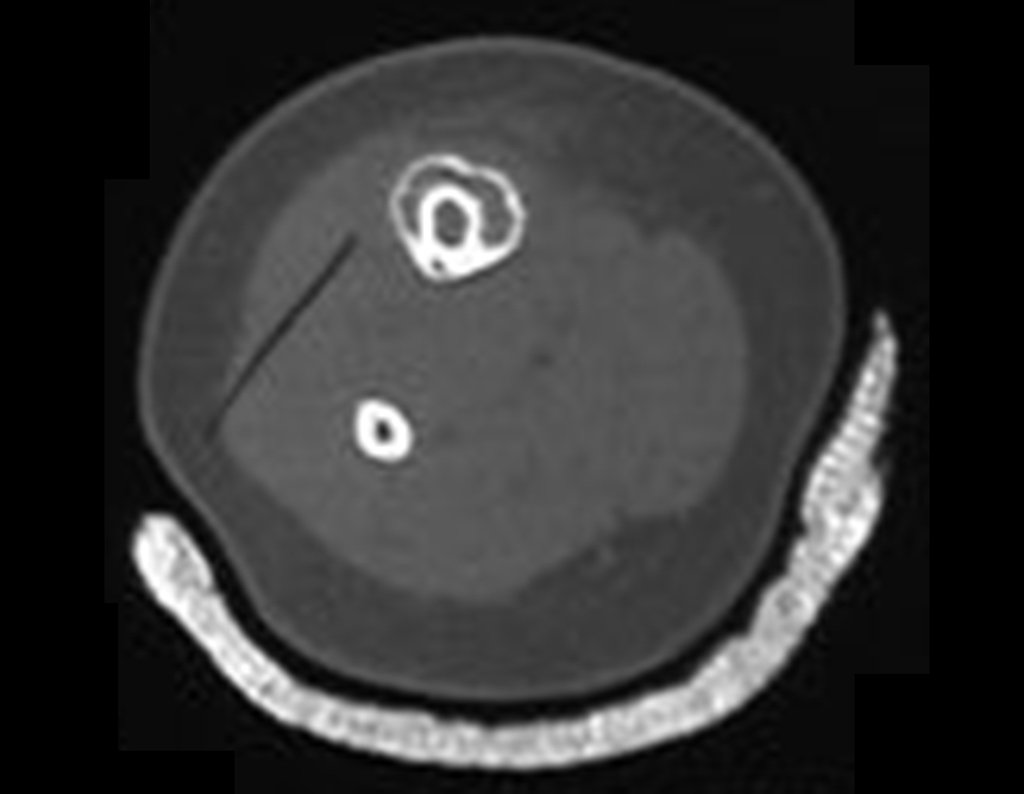
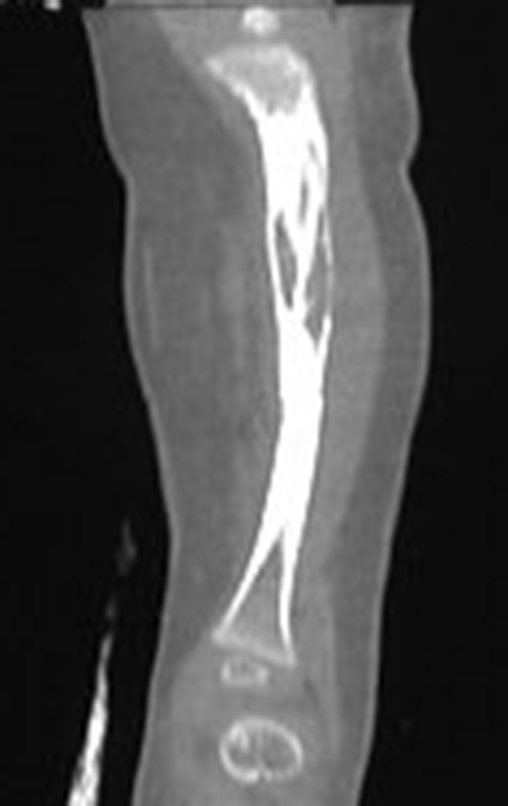
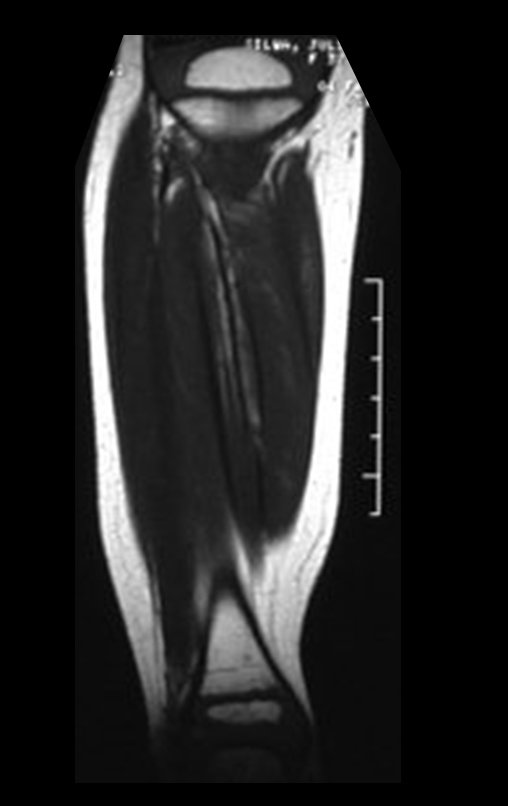
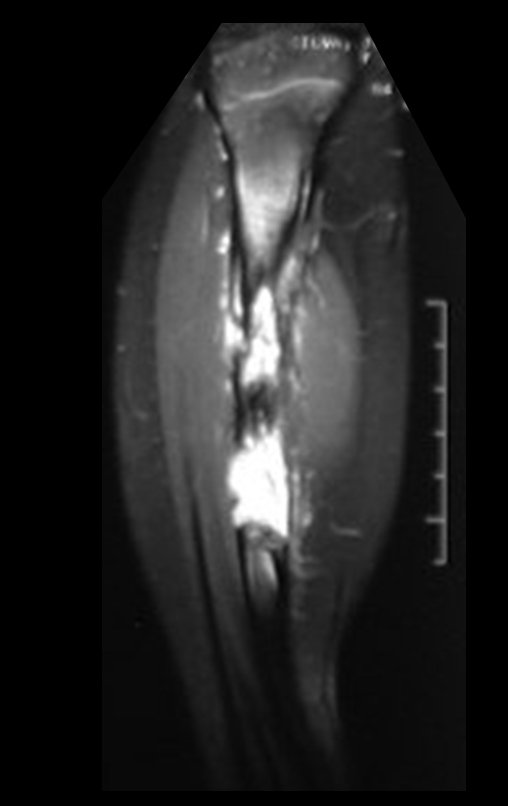
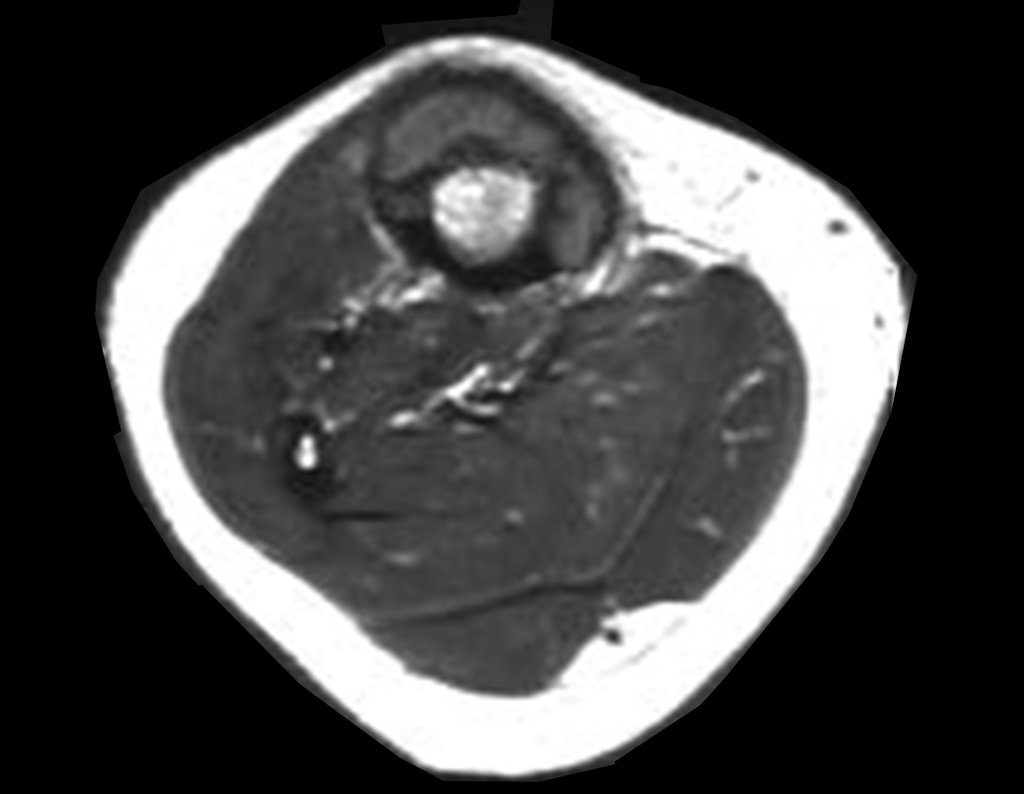
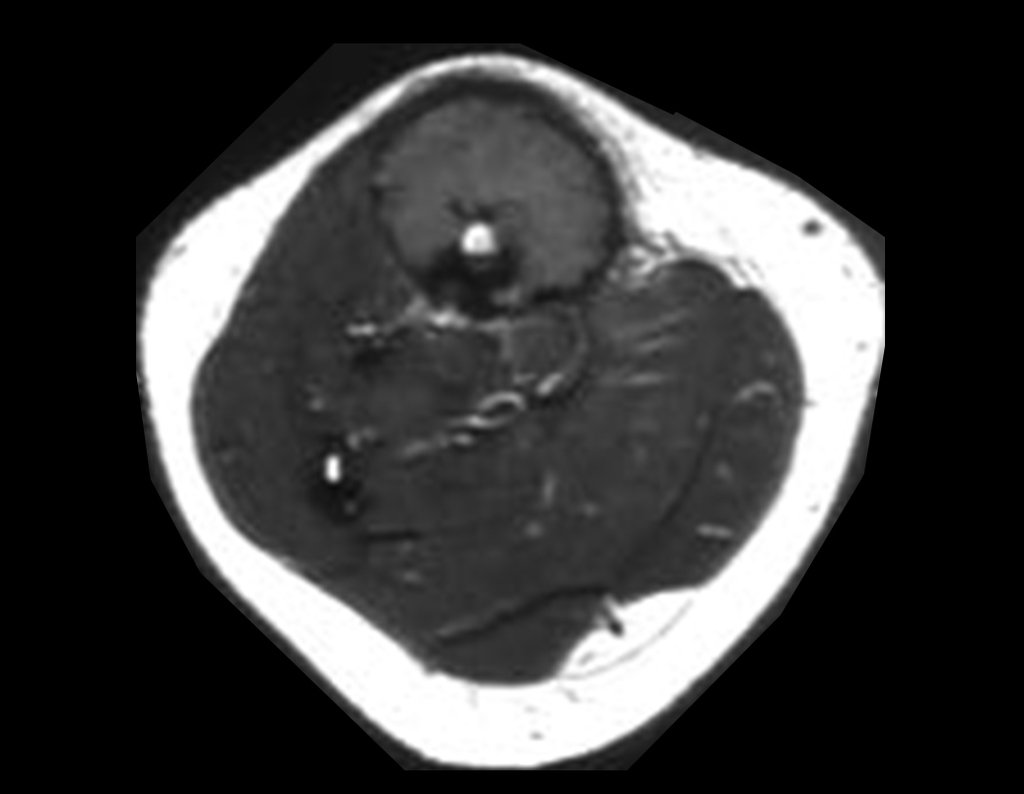
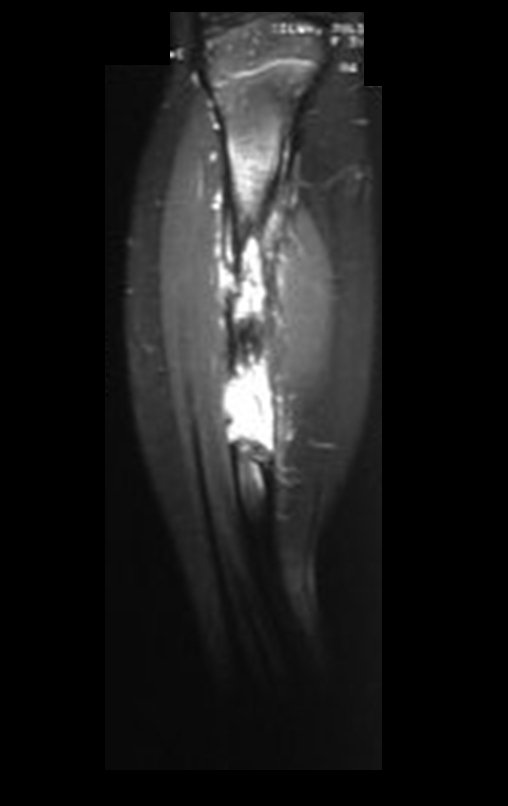
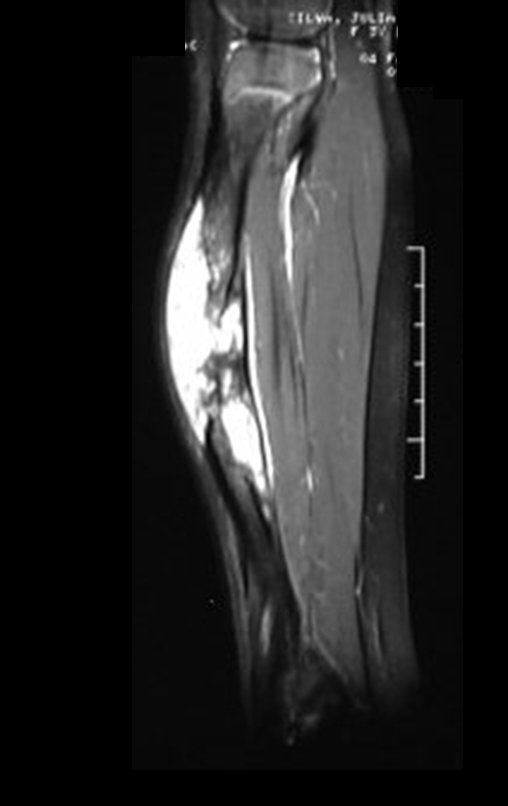
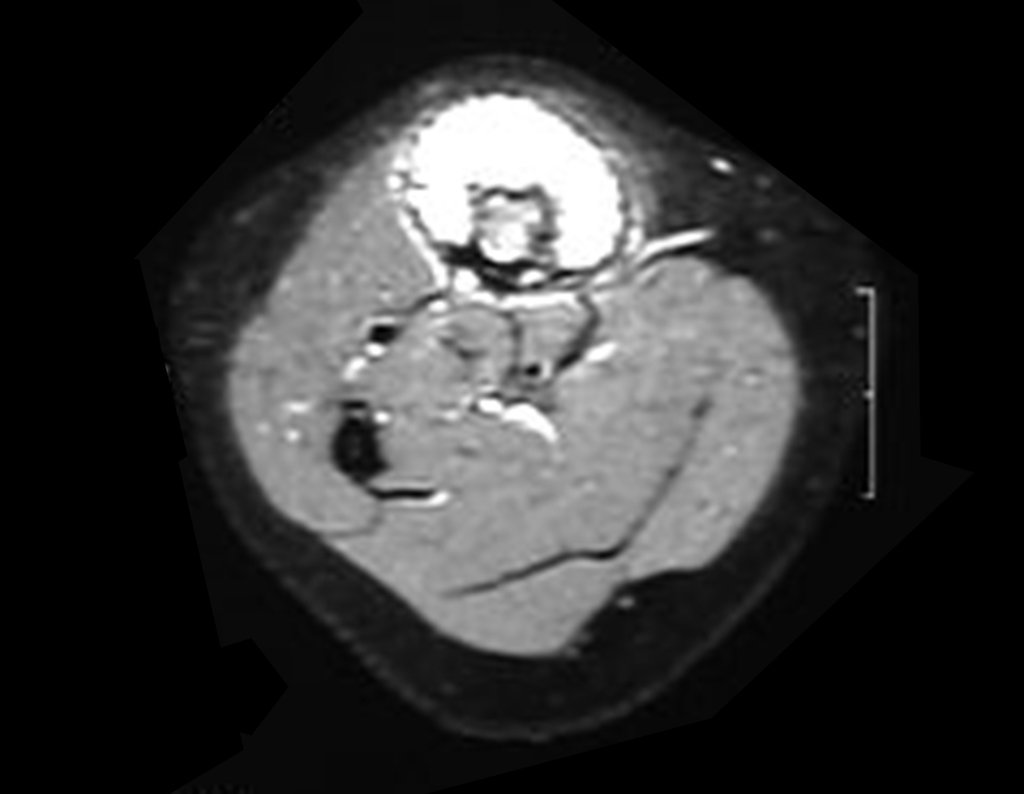
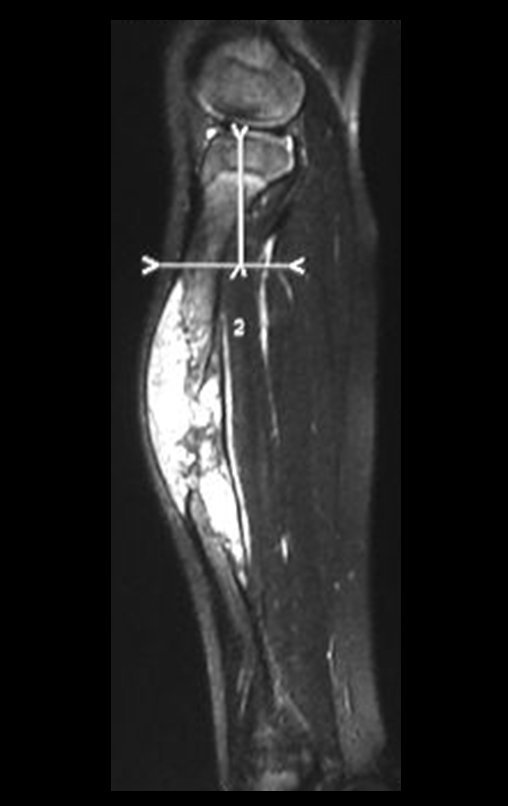
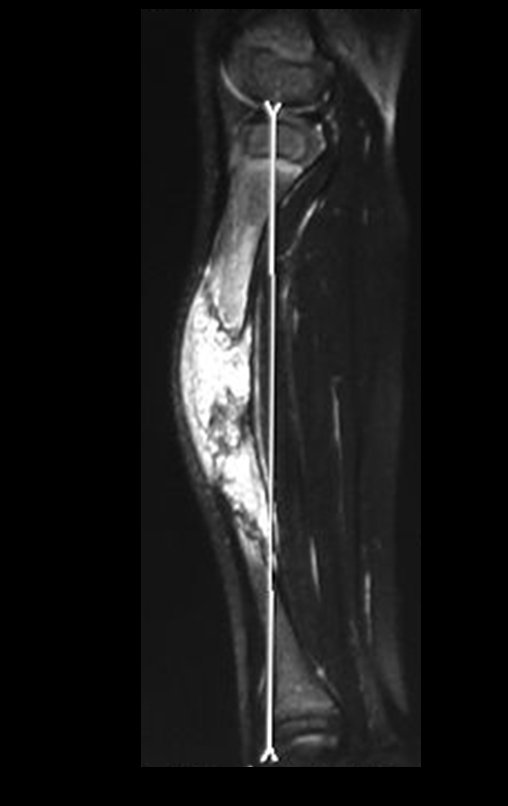
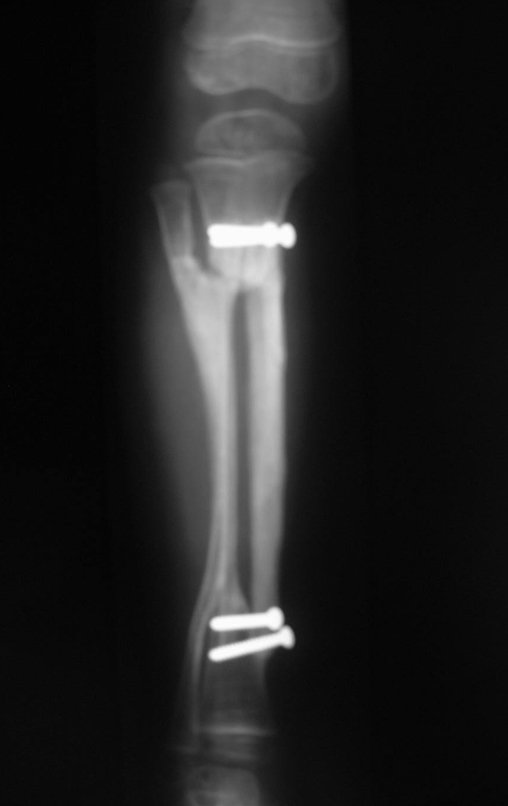
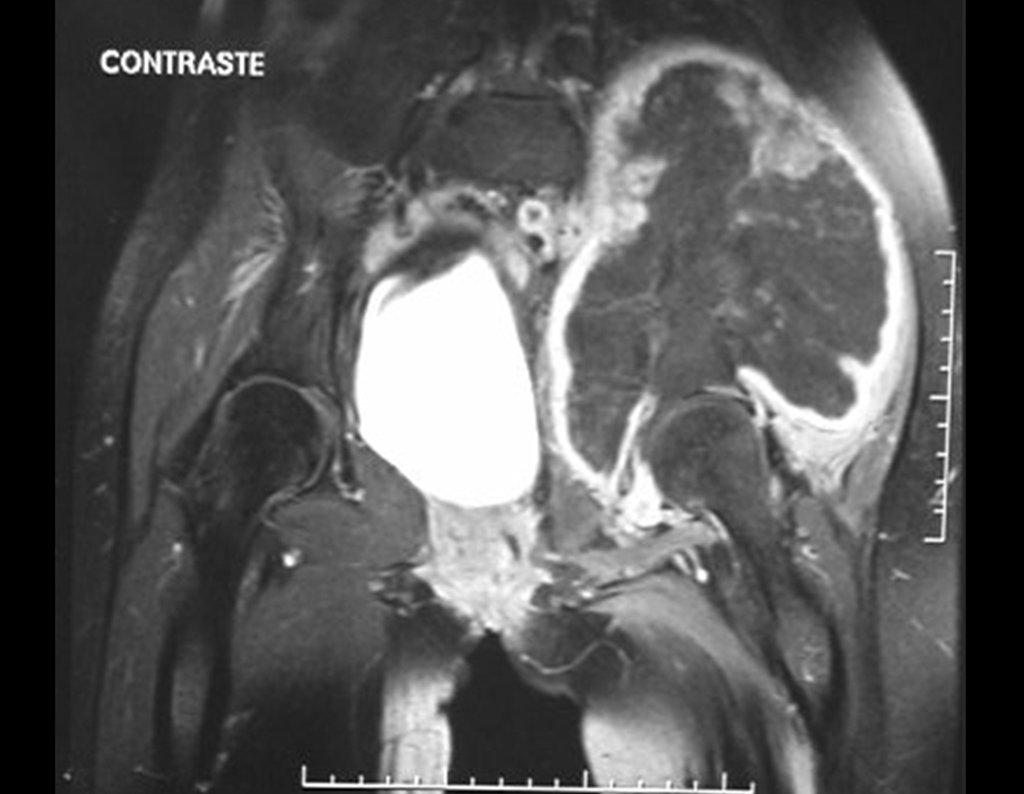
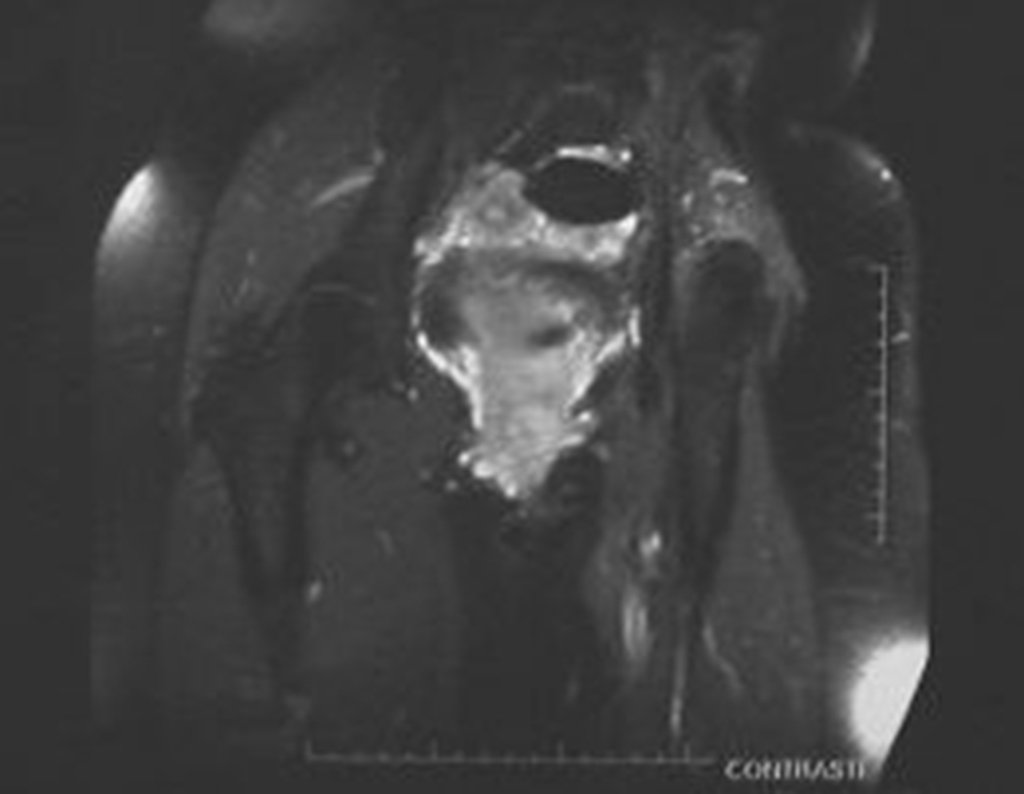
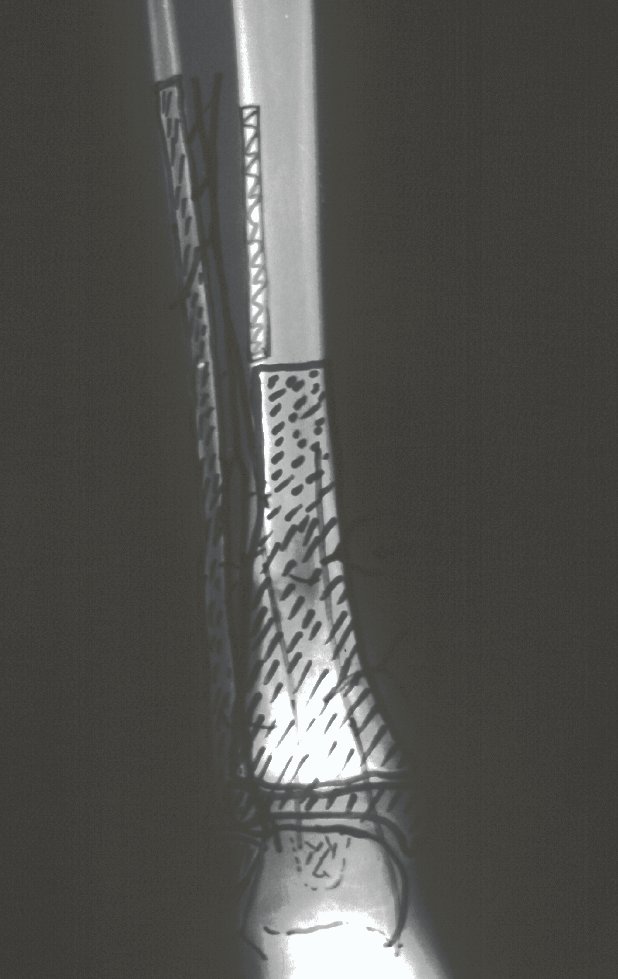
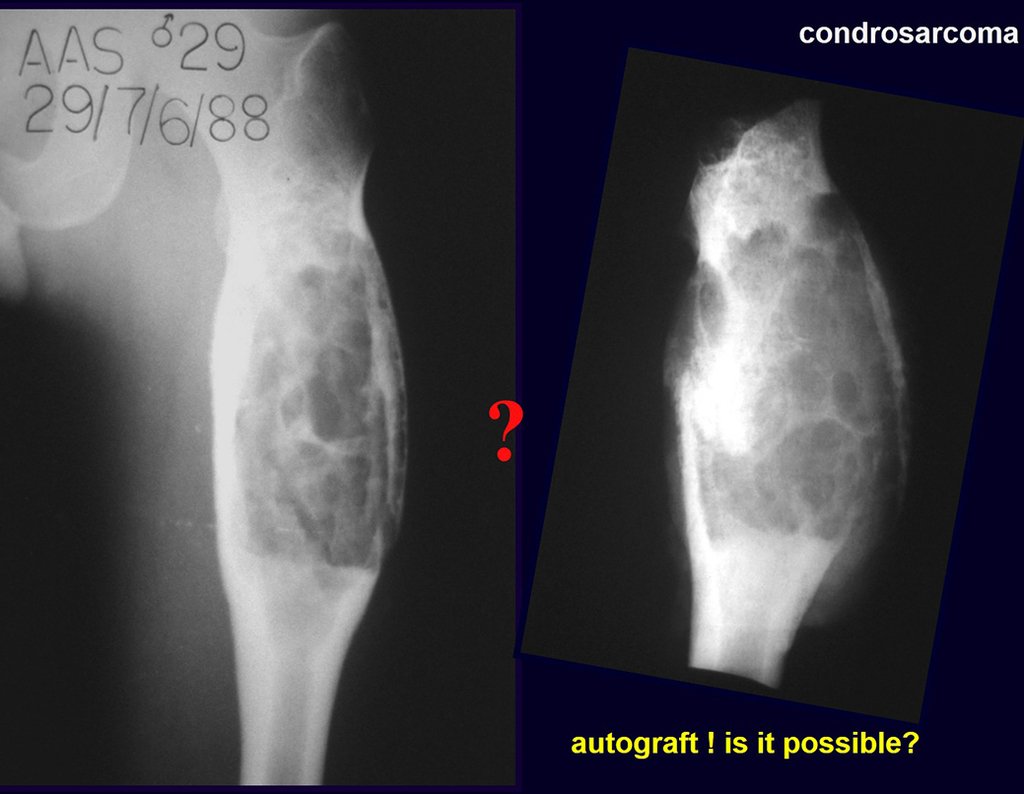
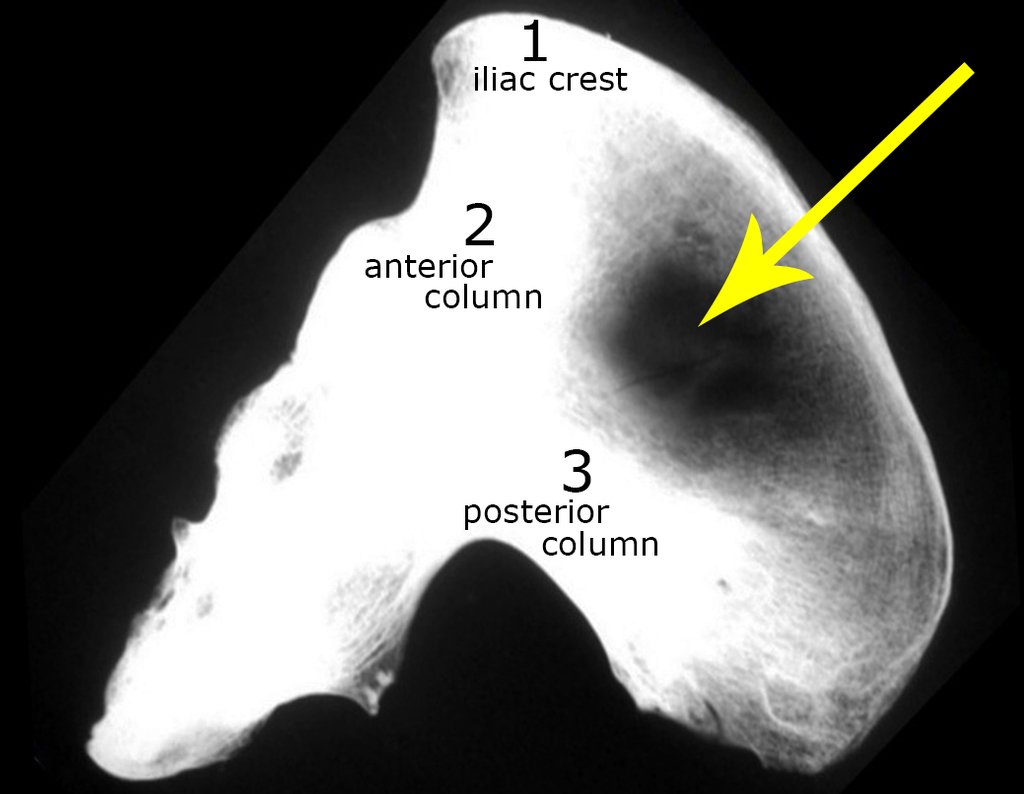
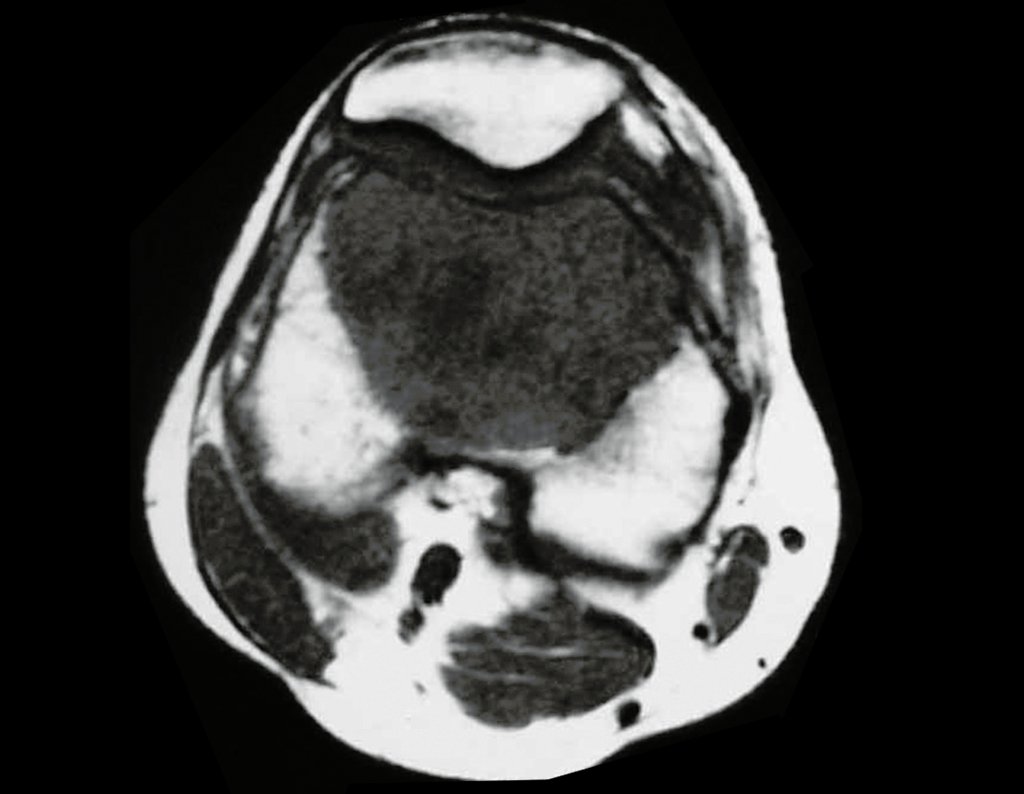
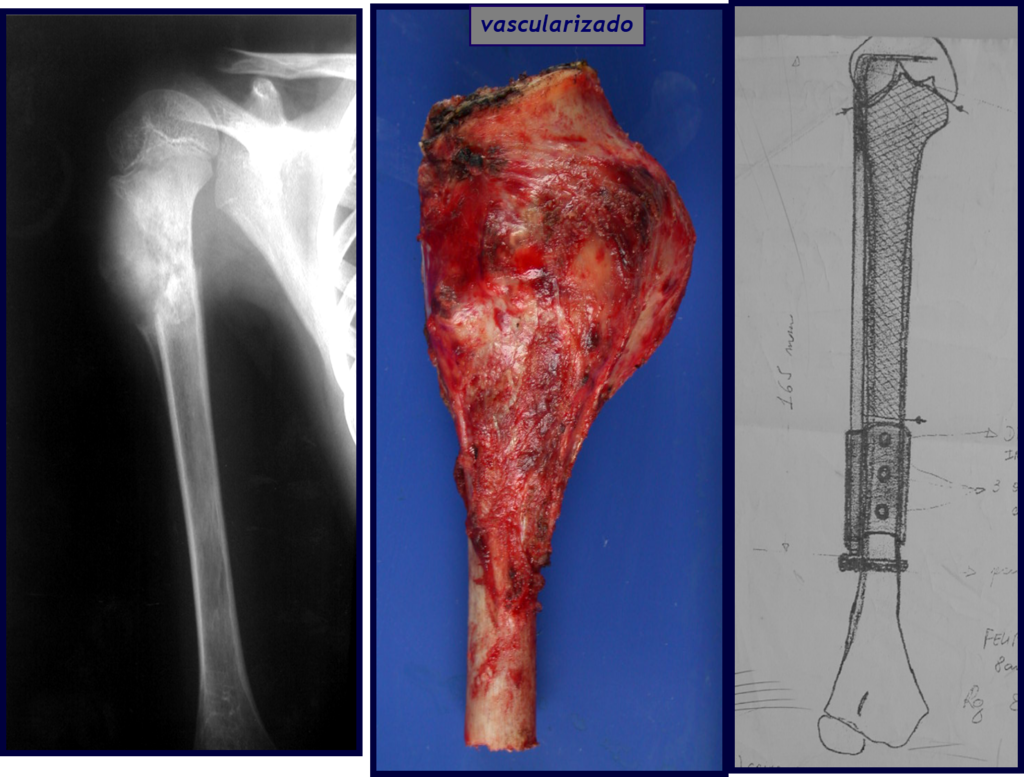
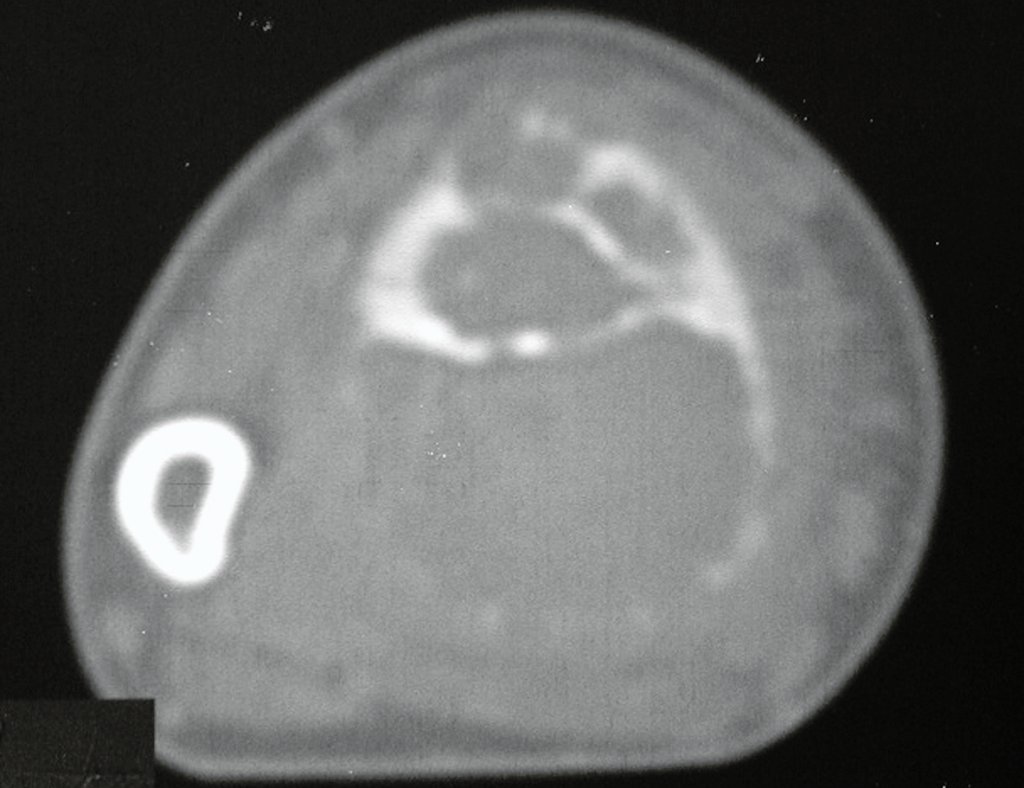
O estudo de ressonância magnética mostra lesão de rarefação óssea, com áreas de necrose, erosão, insuflação e fratura infracção da cortical, com deformidade e afundamento da superfície articular (figuras 25 a 36).
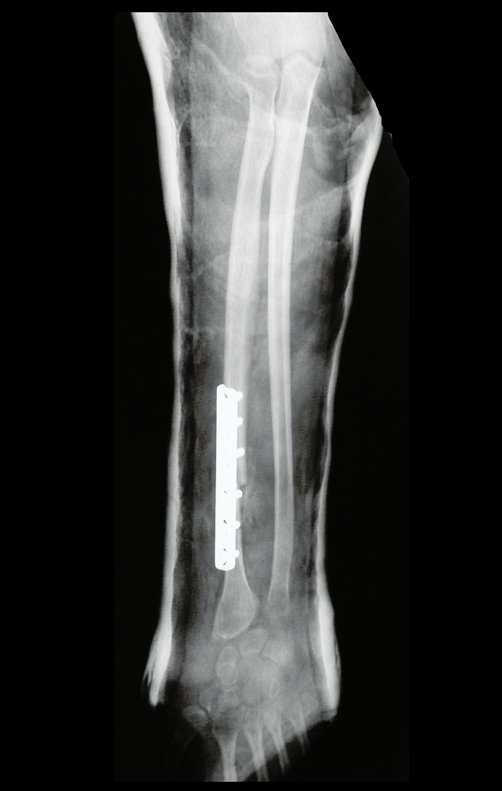
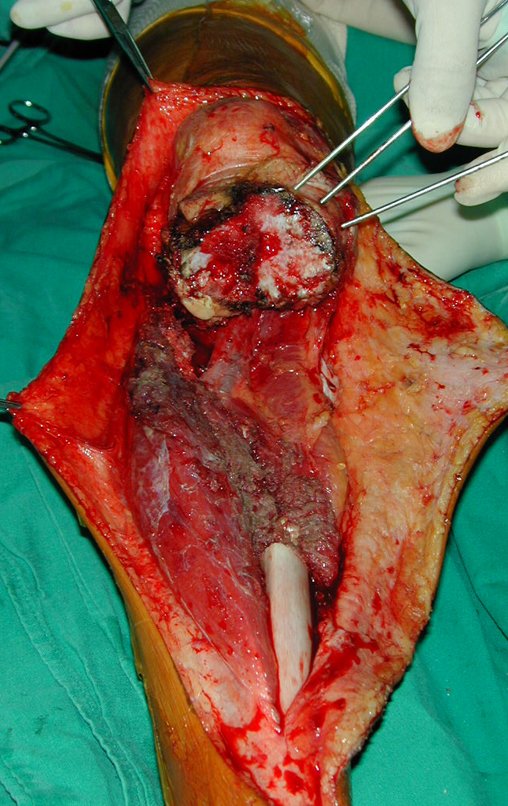
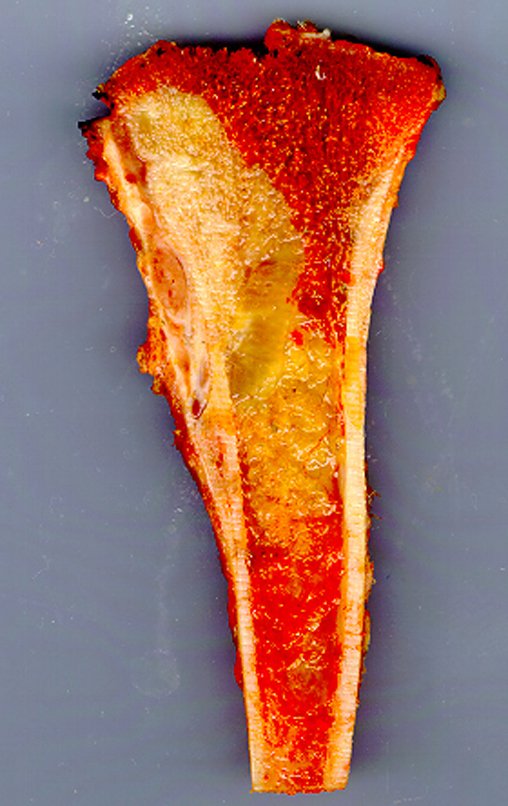
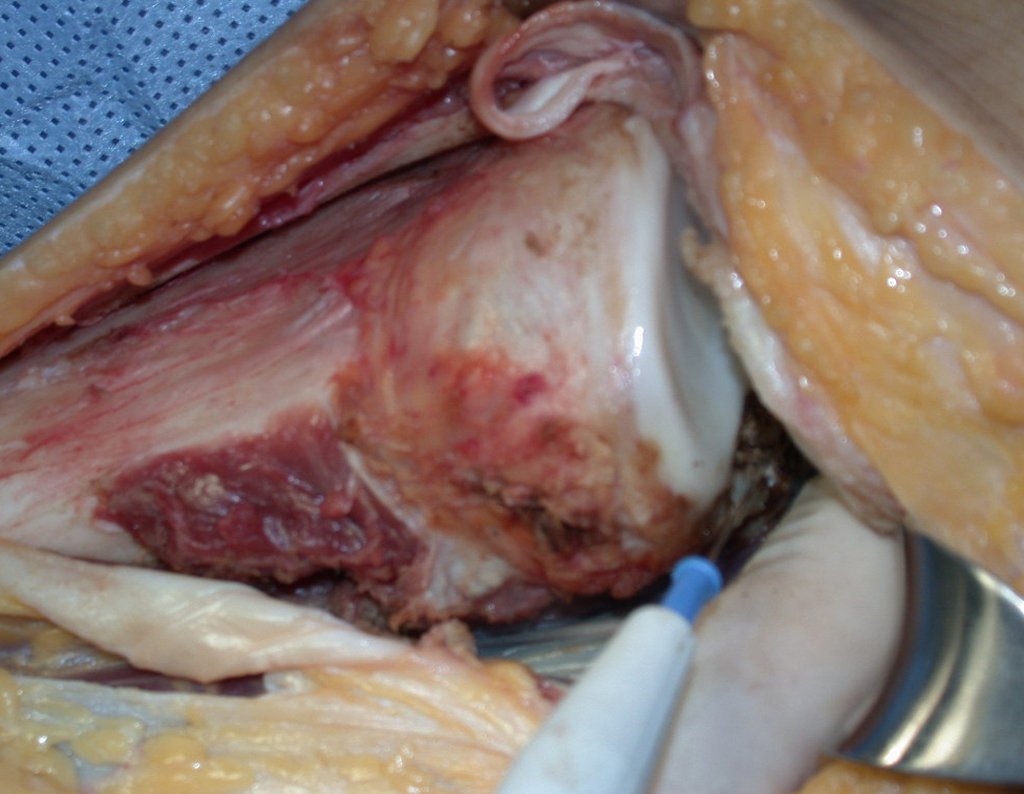
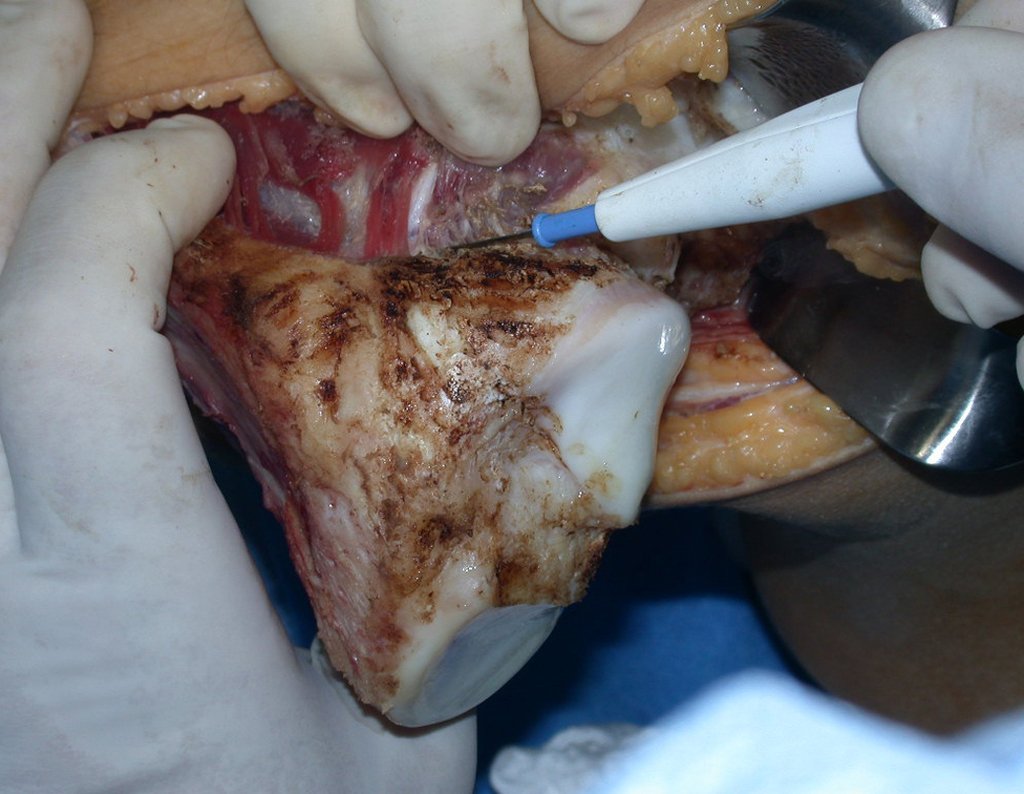
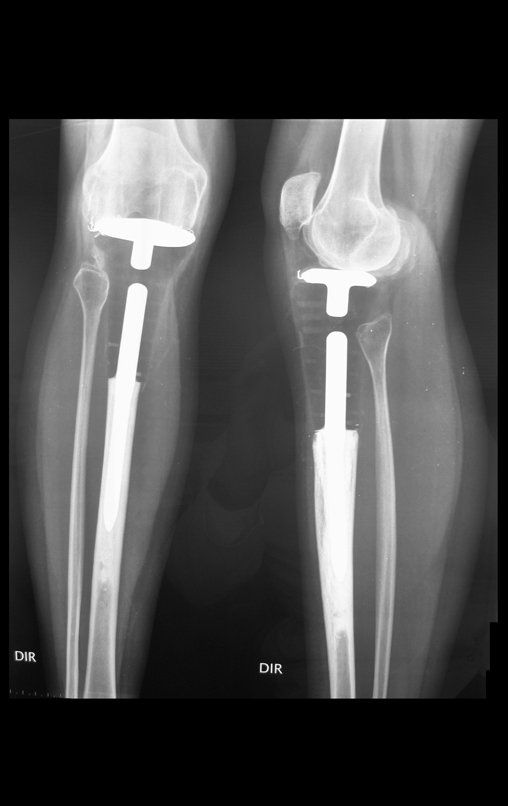
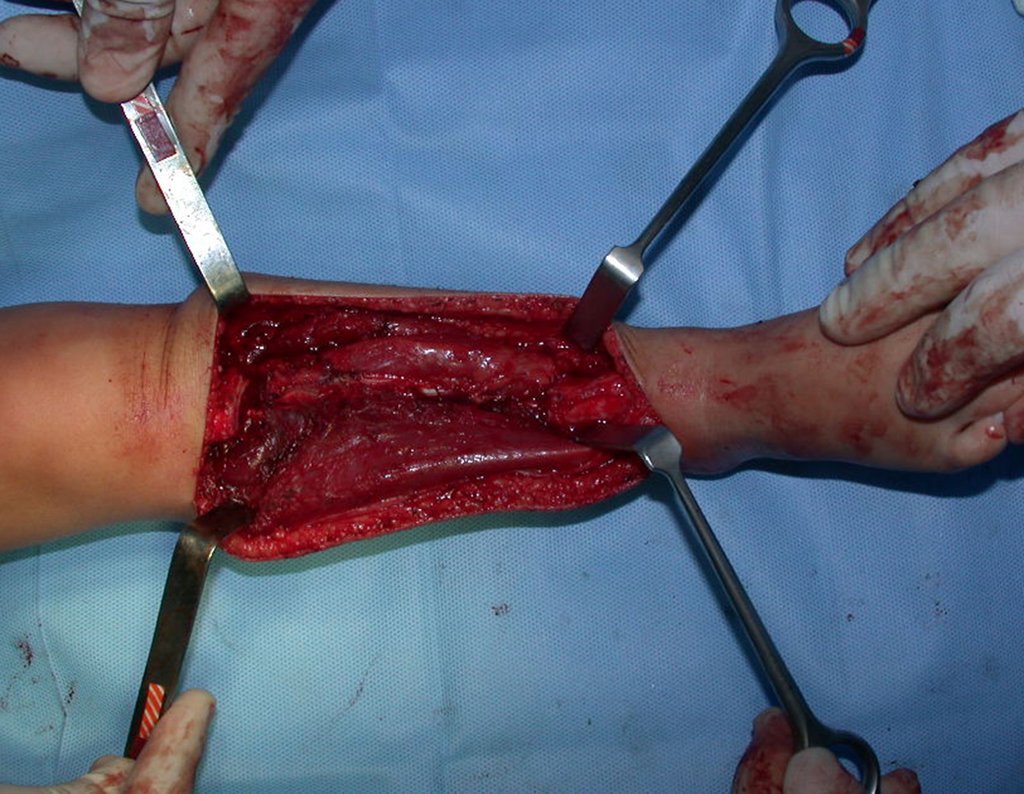
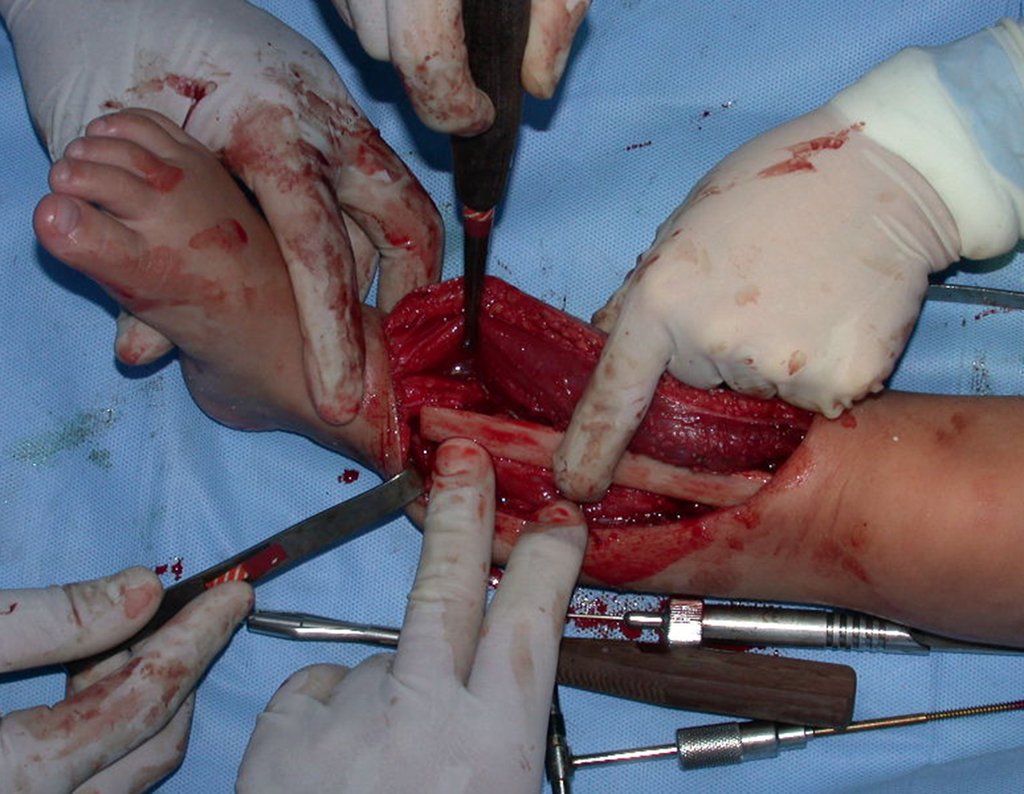
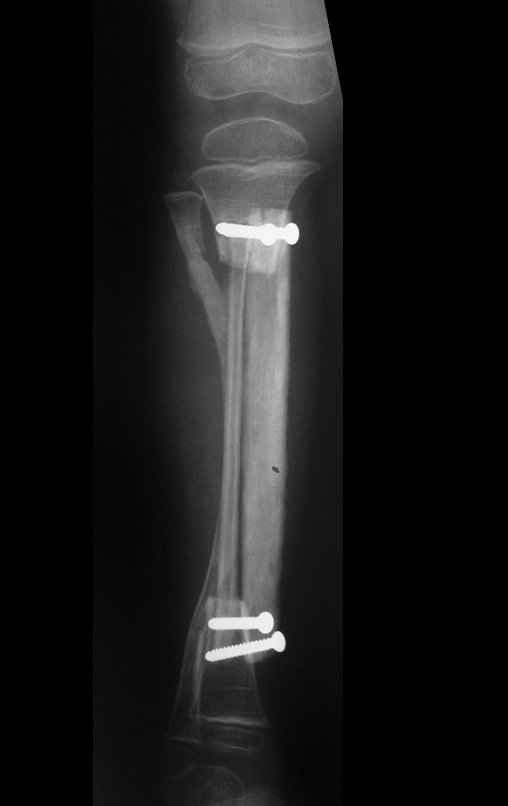
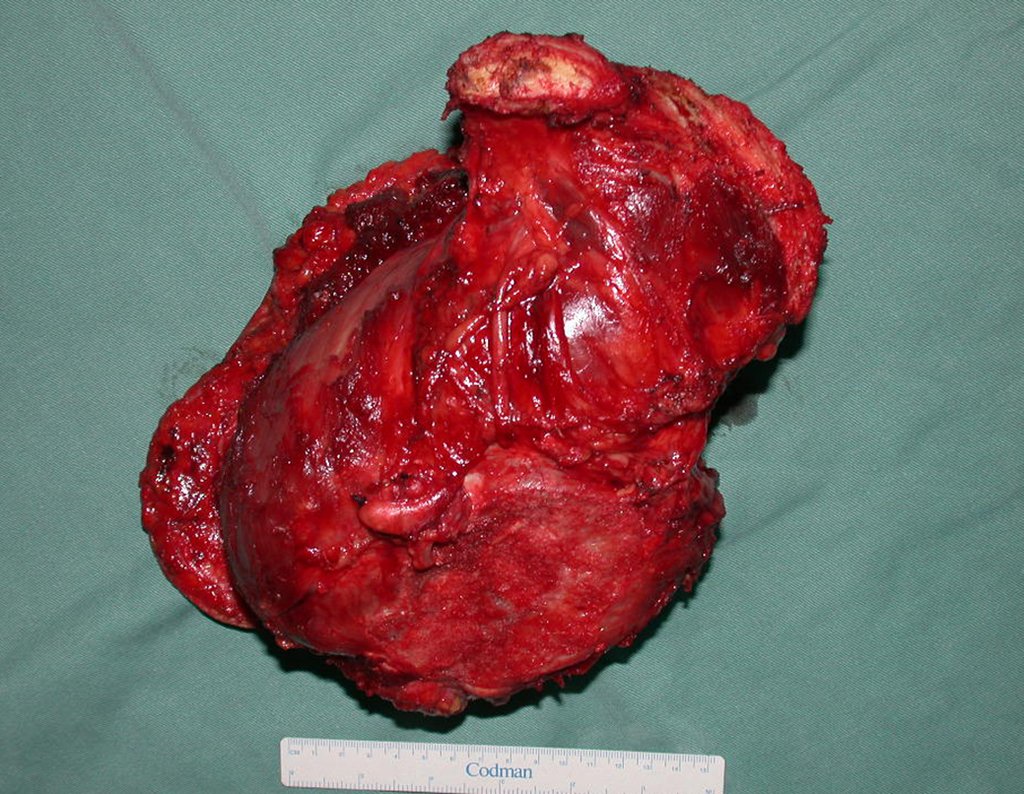
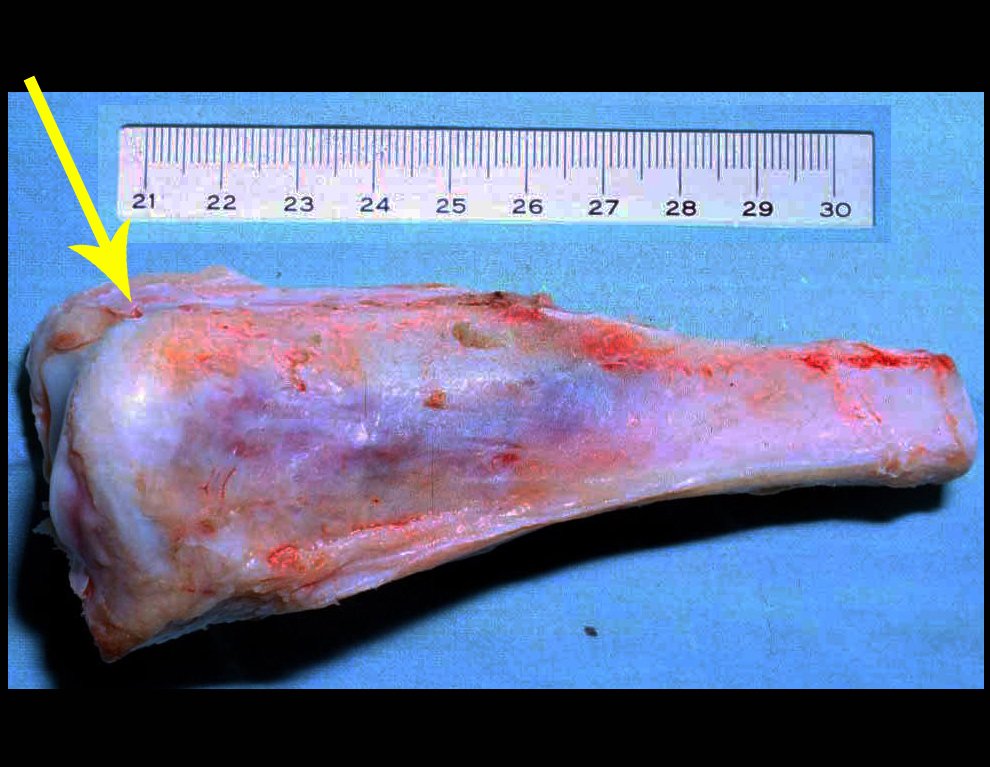
Com este estudo, confirmamos a agressividade local do tumor, e a grande destruição da extremidade distal do rádio esquerdo, com fratura por infracção, deformidade articular e encurtamento do rádio. Nesta situação o tratamento intralesional deve ser contraindicado, devido à alta possibilidade de recidiva local, além da perda da função. Oncologicamente está indicada a ressecção segmentar do rádio, e reconstrução do punho. A artrodese pode ser uma alternativa, mas preferimos preservar a função e a anatomia do punho, sempre que possível. Neste caso, optamos por reconstruir com enxerto autólogo não vascularizado, obtido do segmento proximal da fíbula ipsilateral, que mimetiza melhor o rádio.
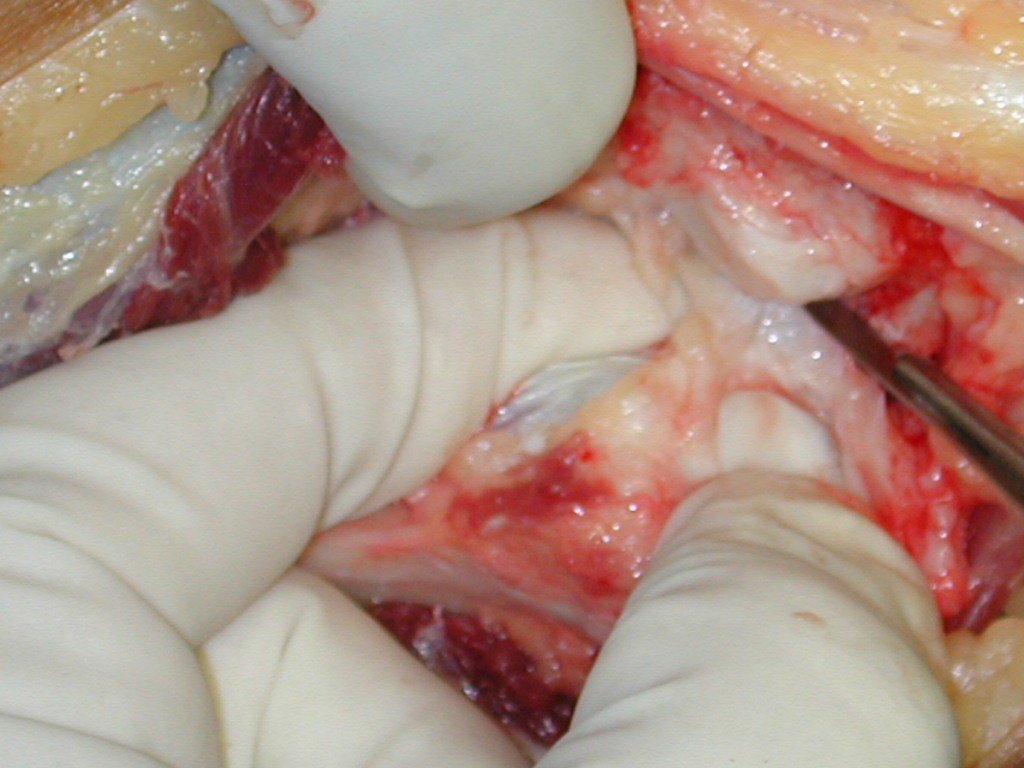
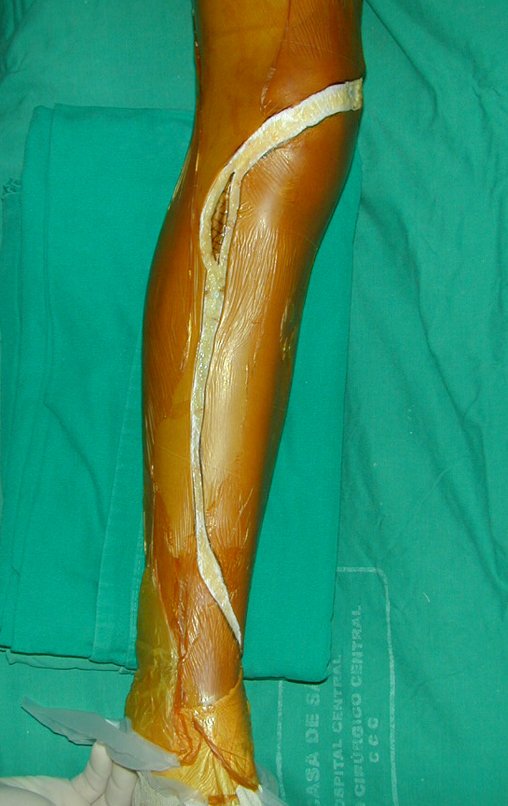
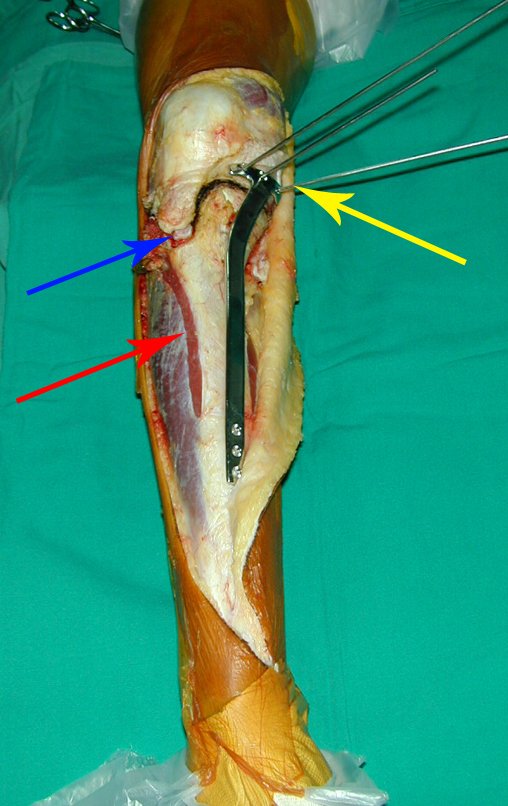
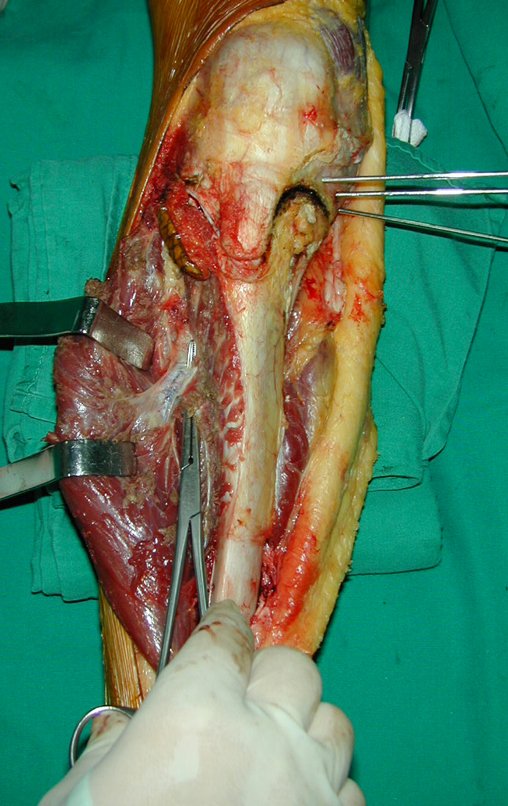
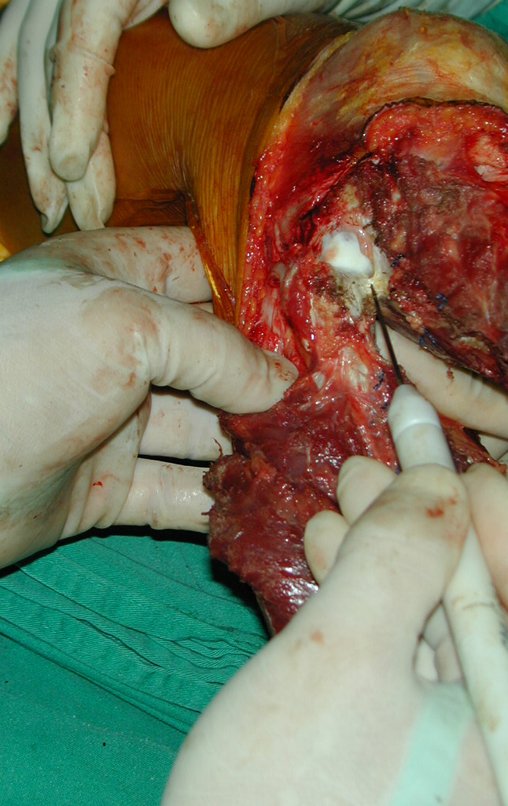
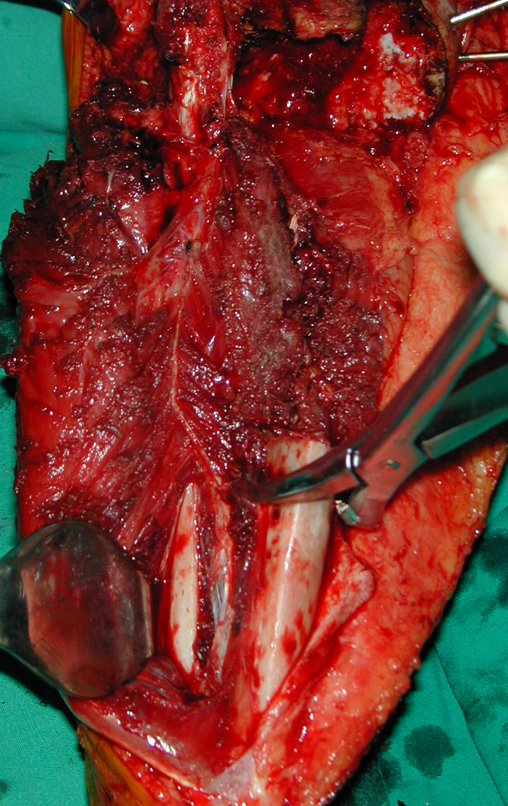
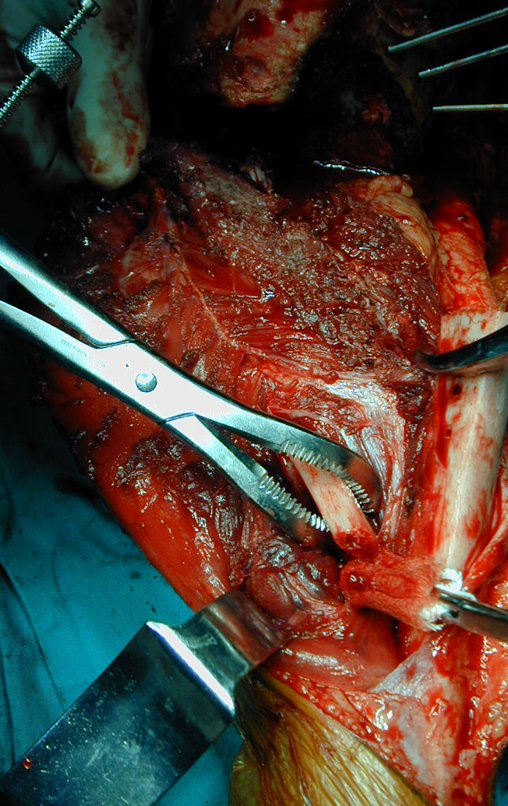
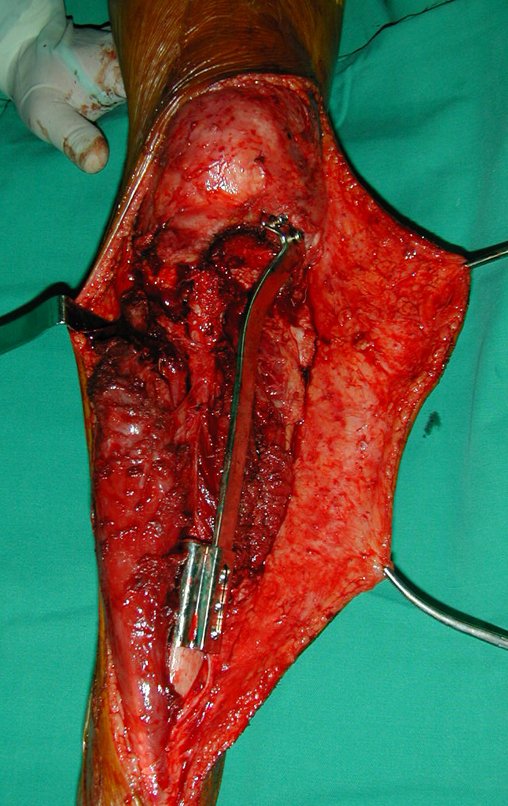
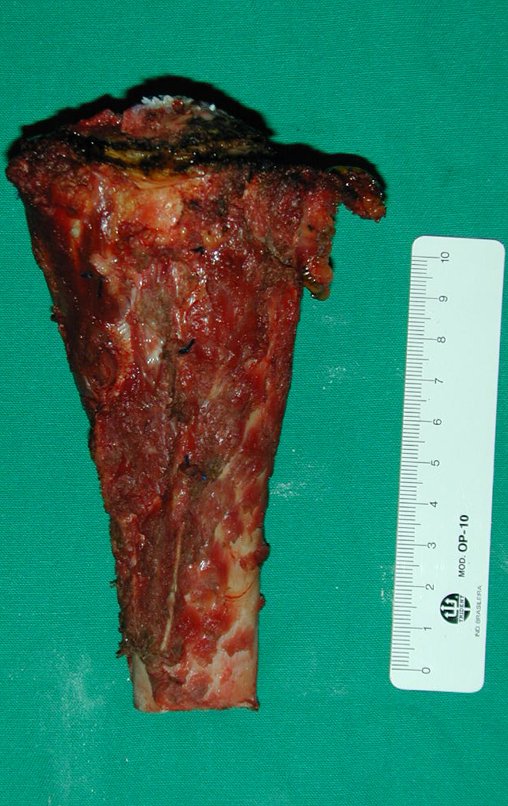
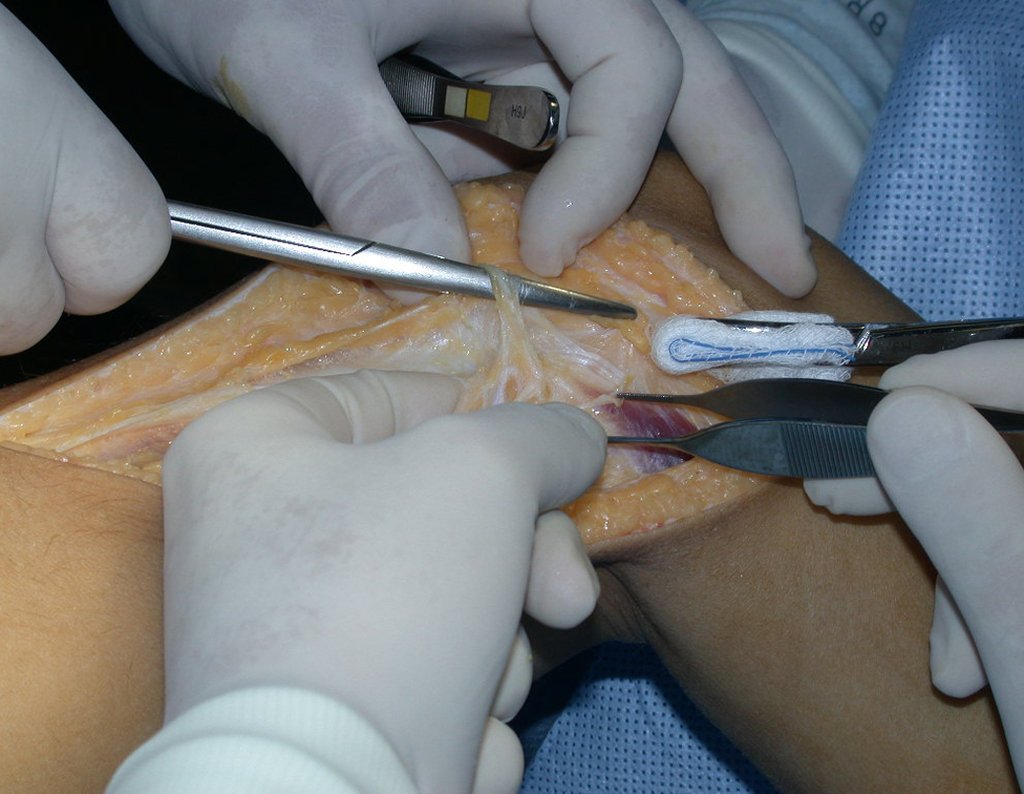
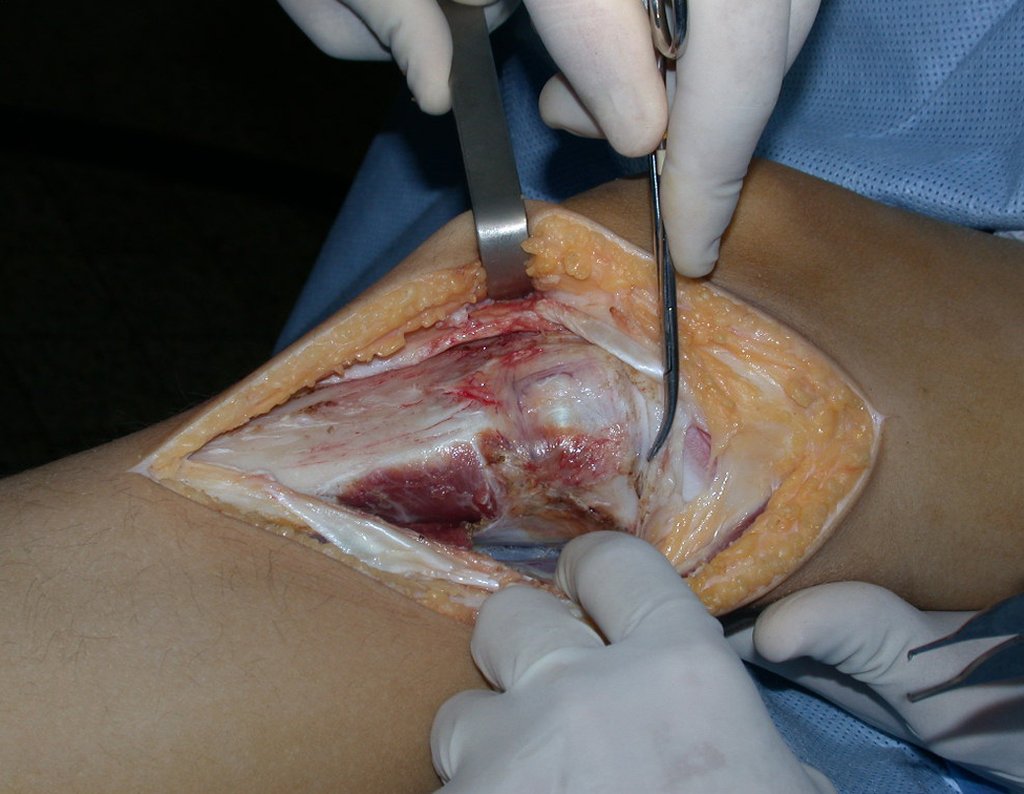
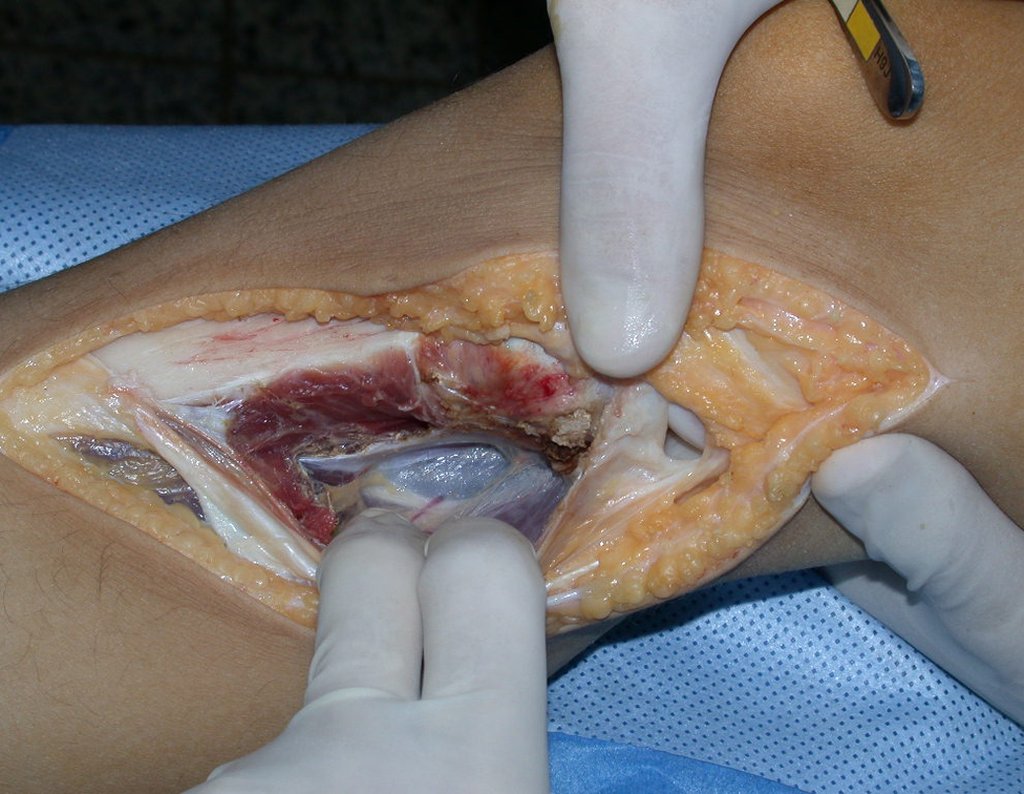
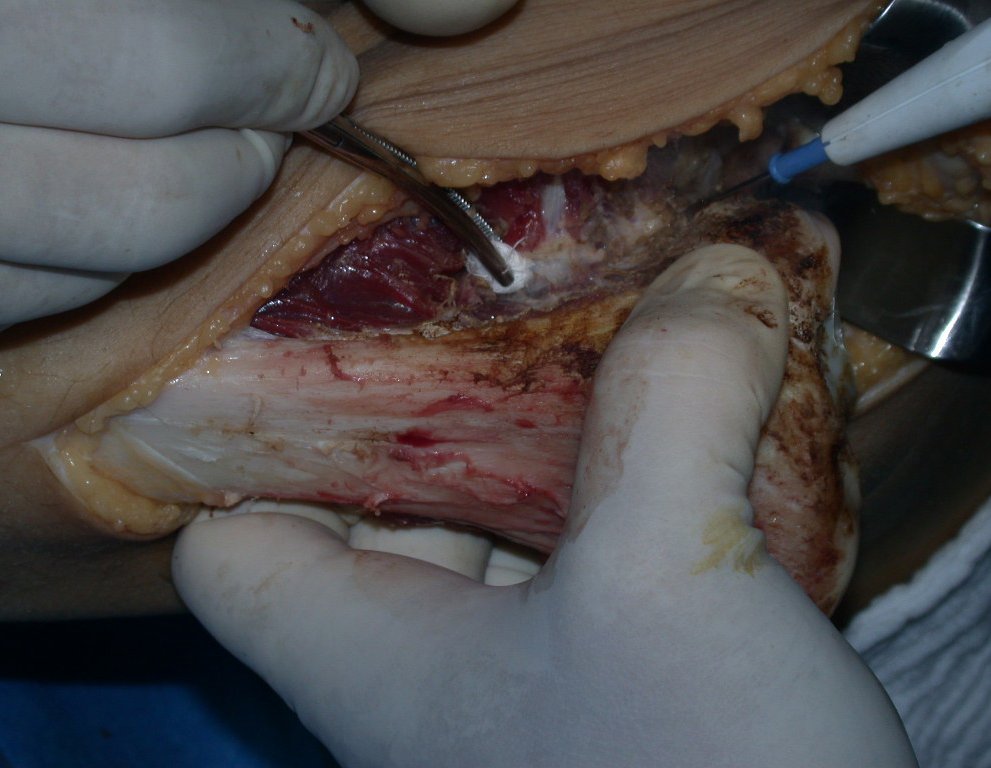
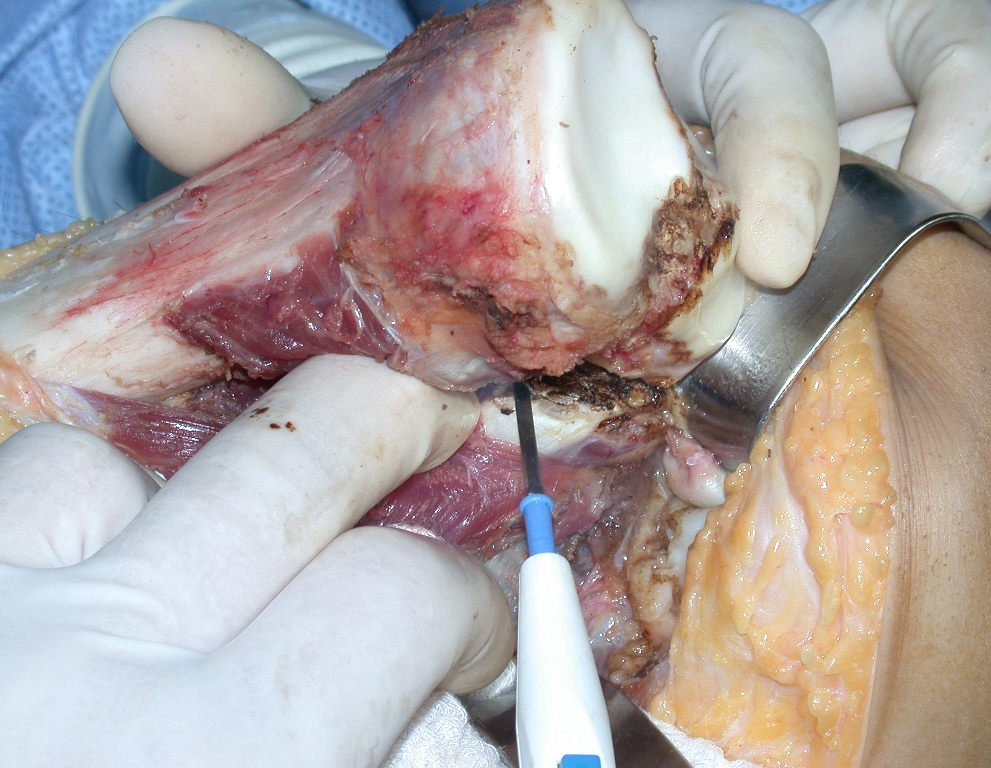
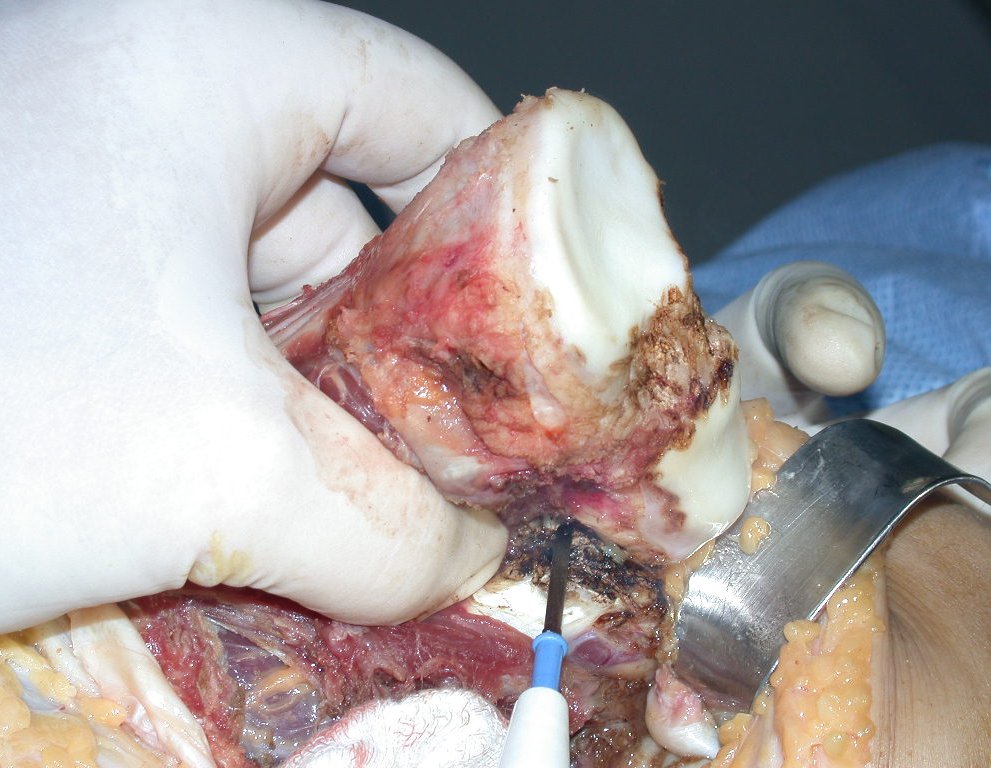
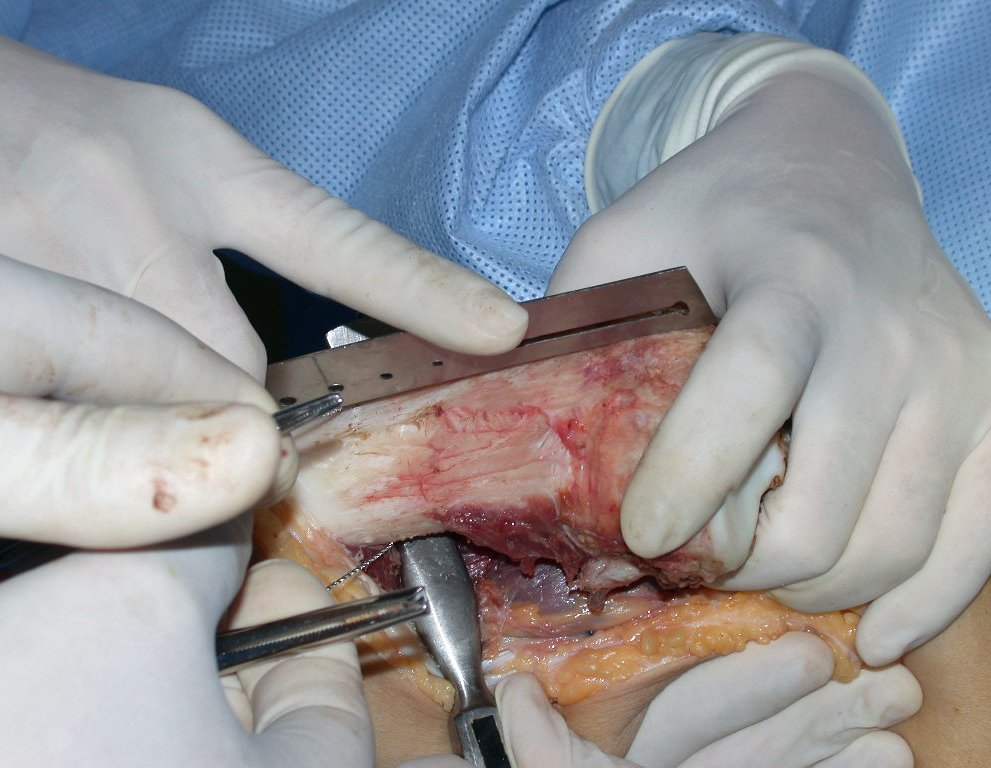
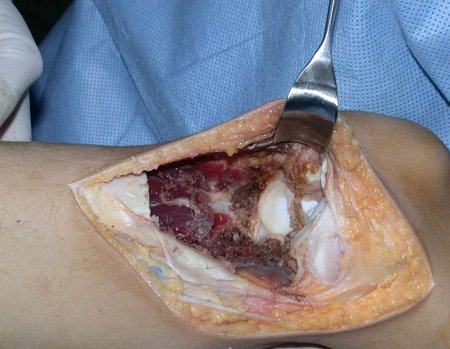
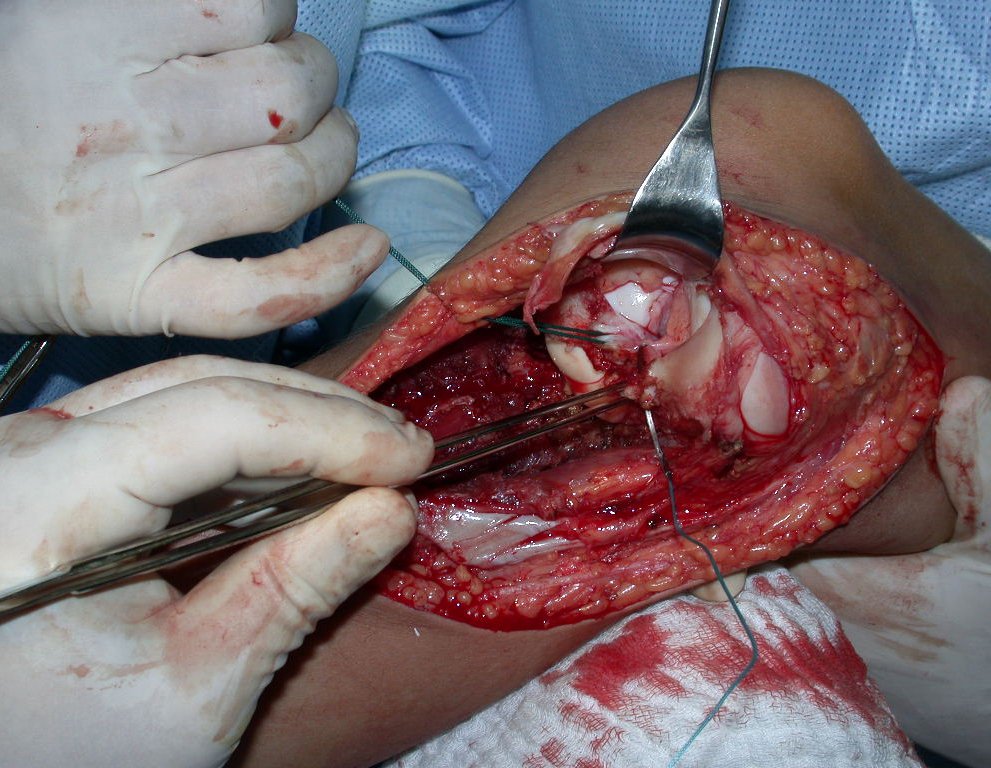
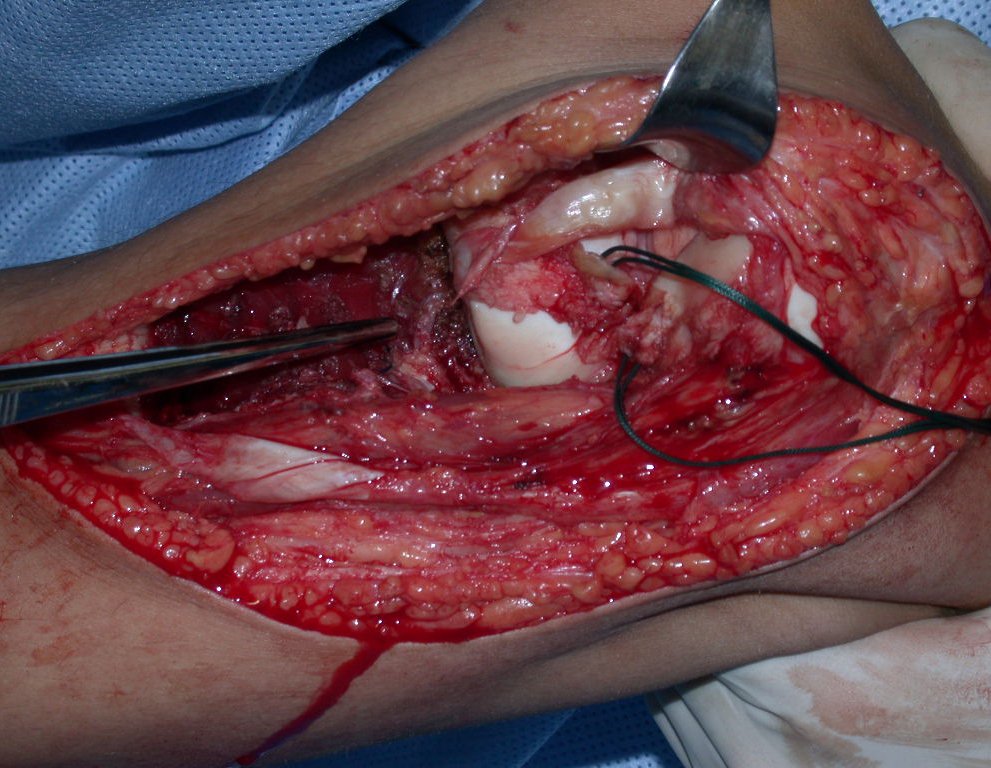
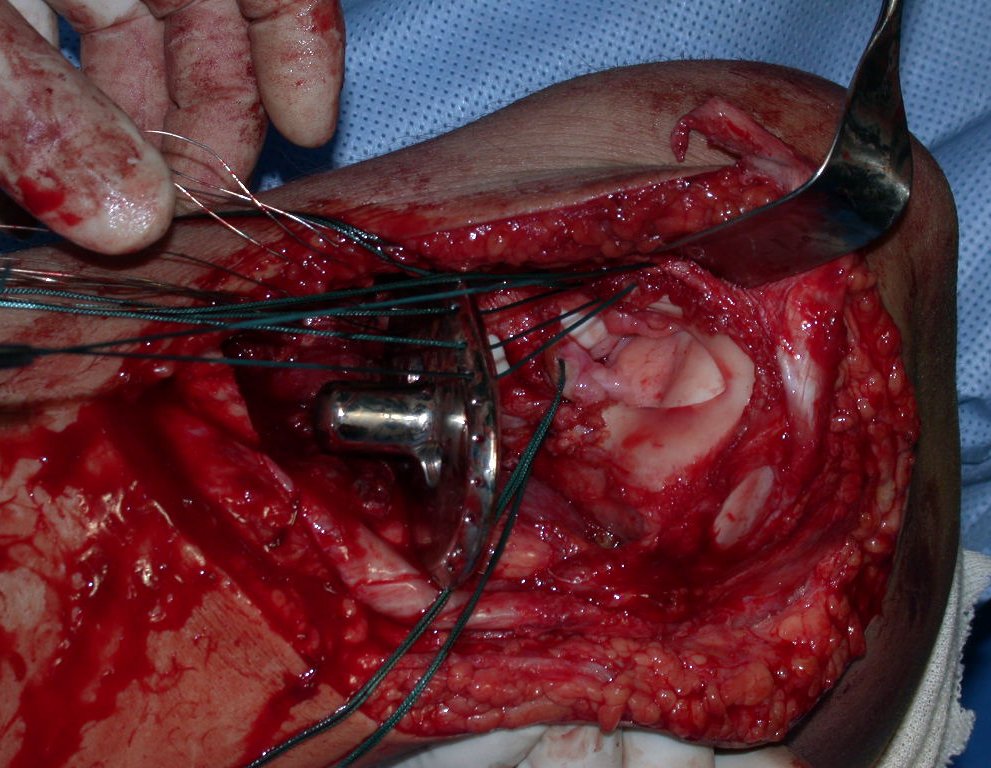
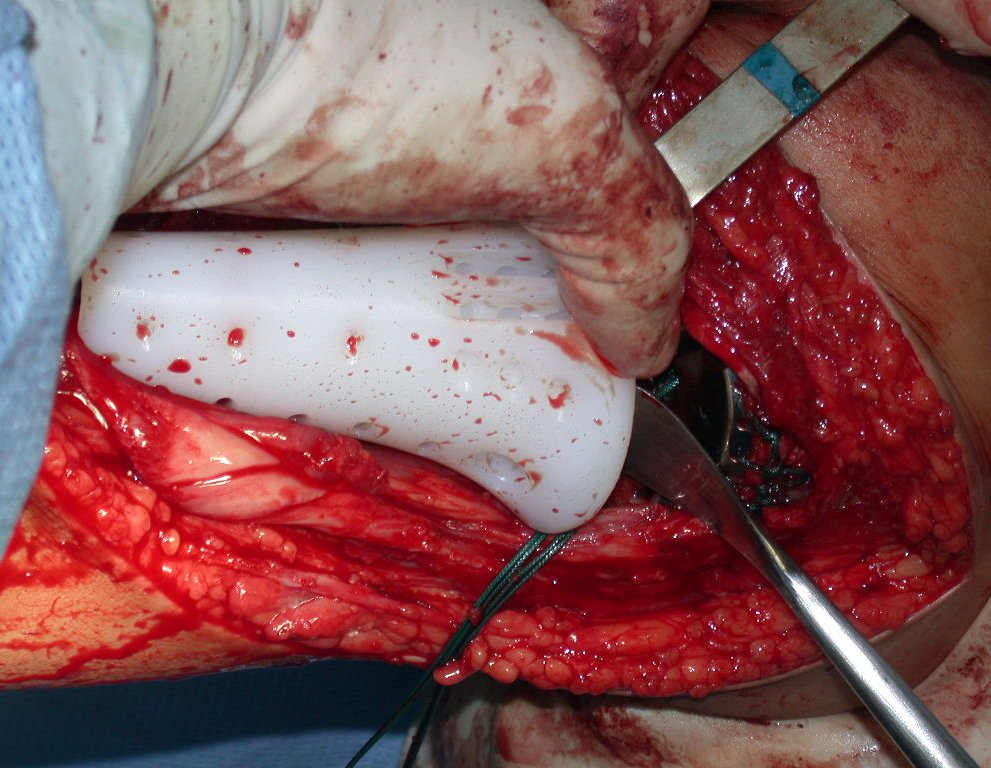
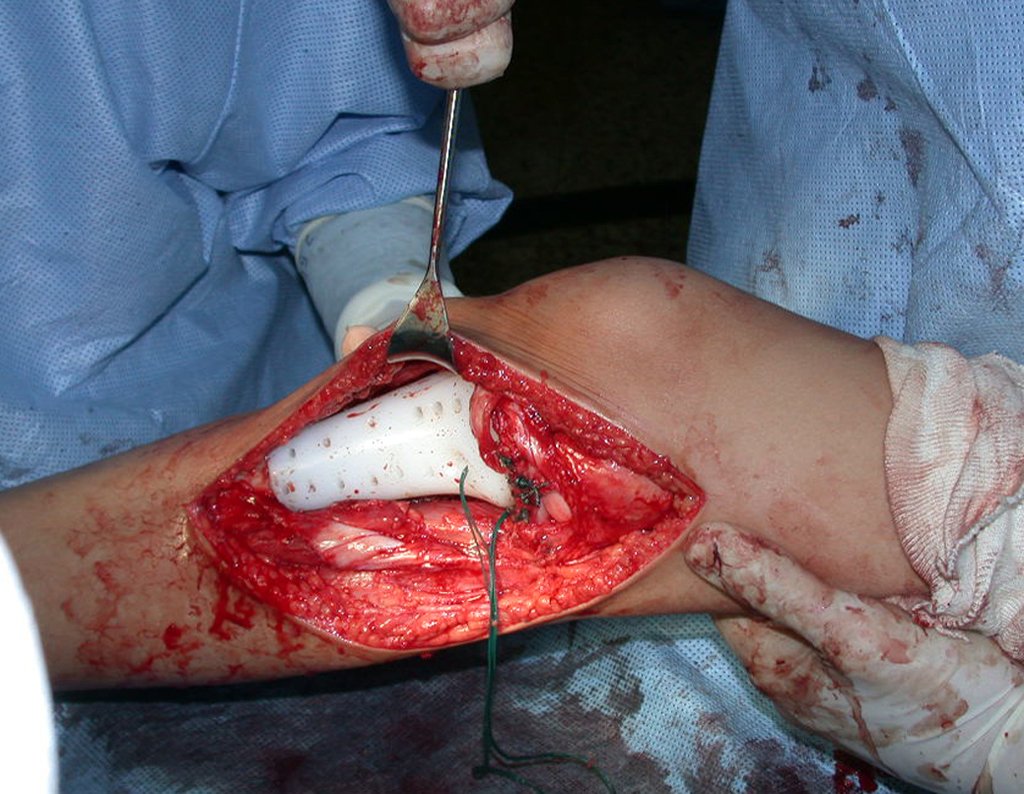
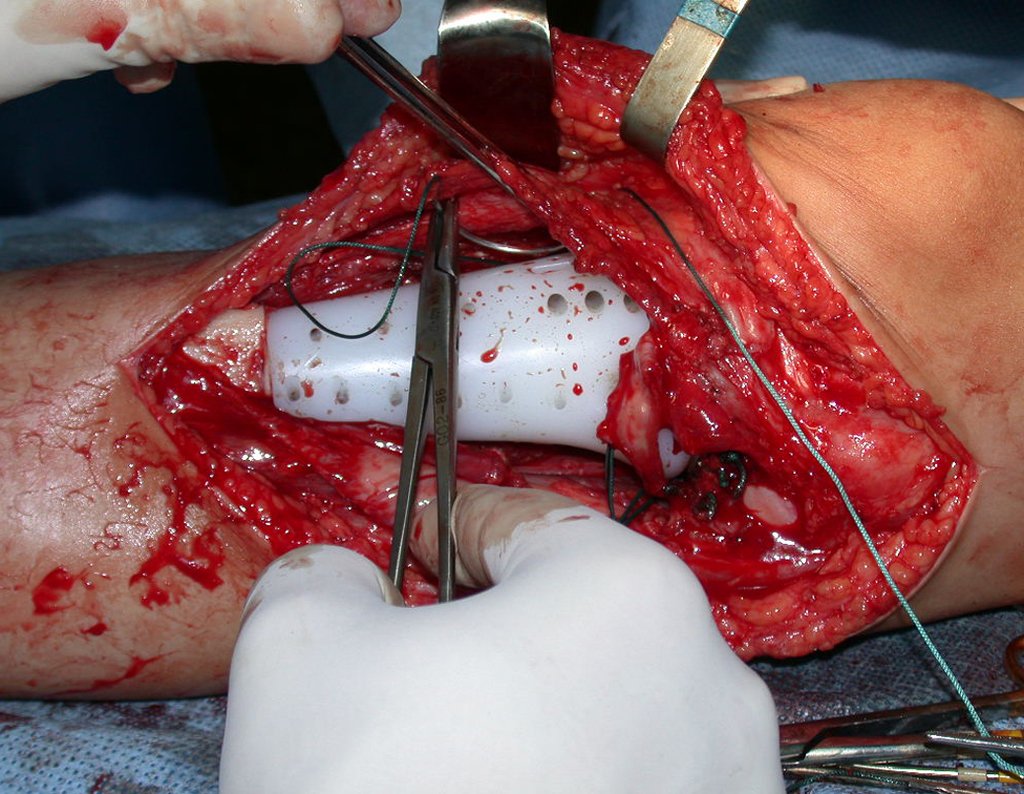
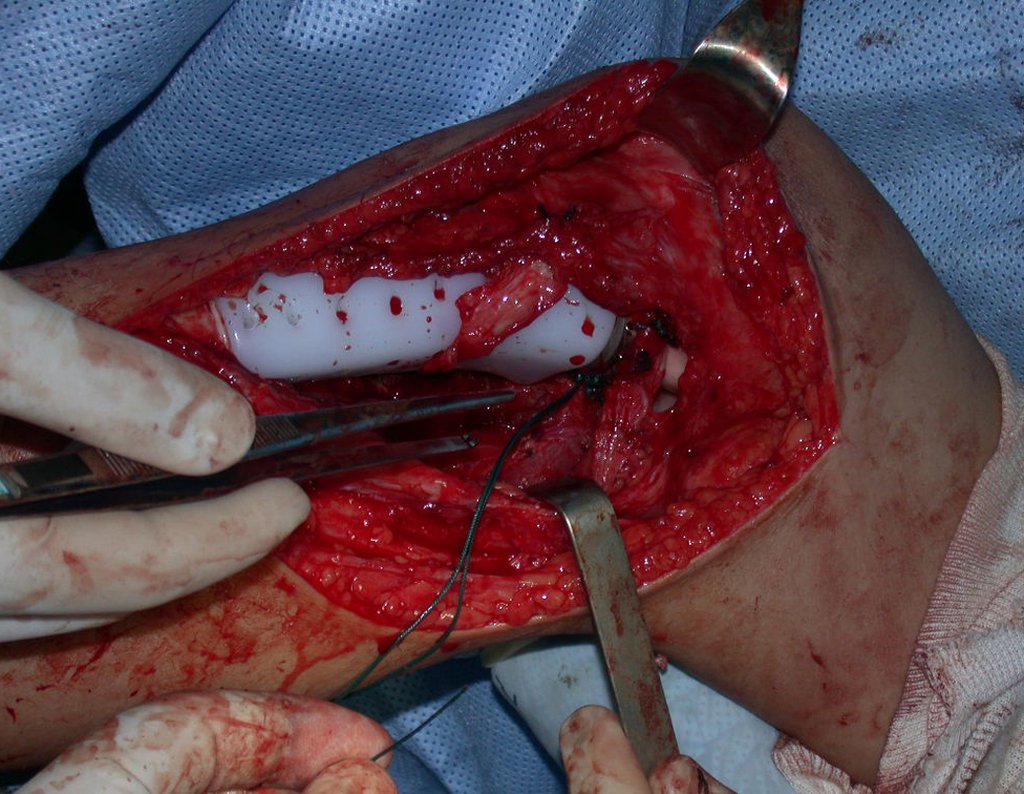
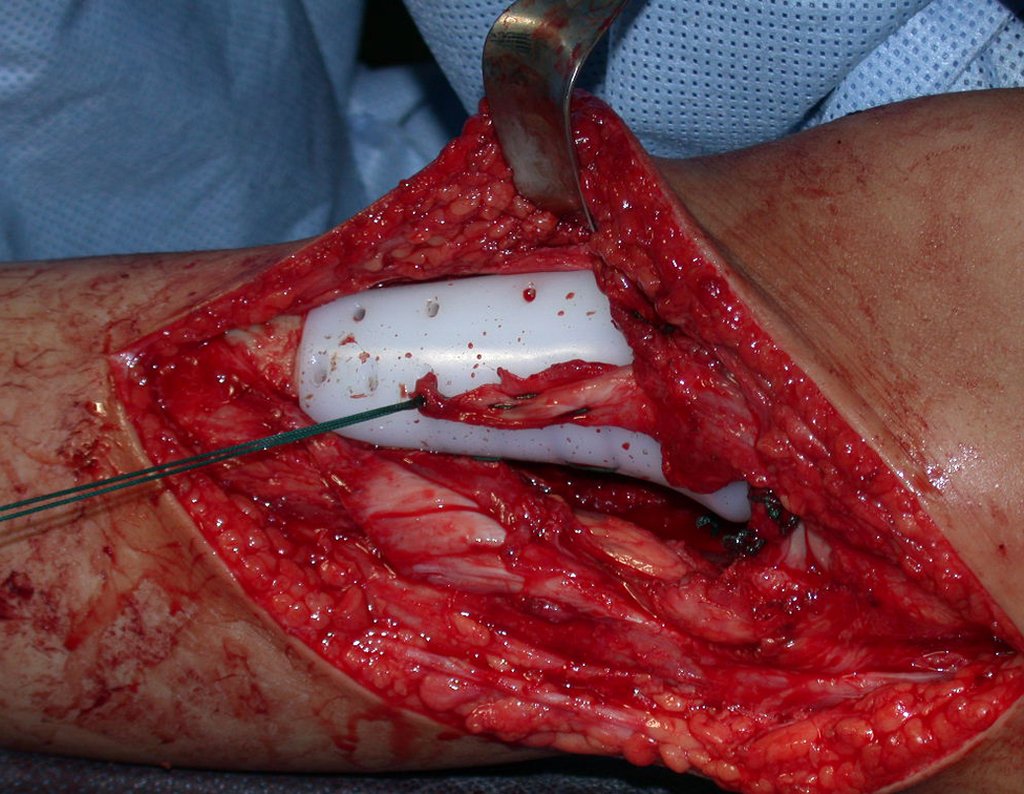
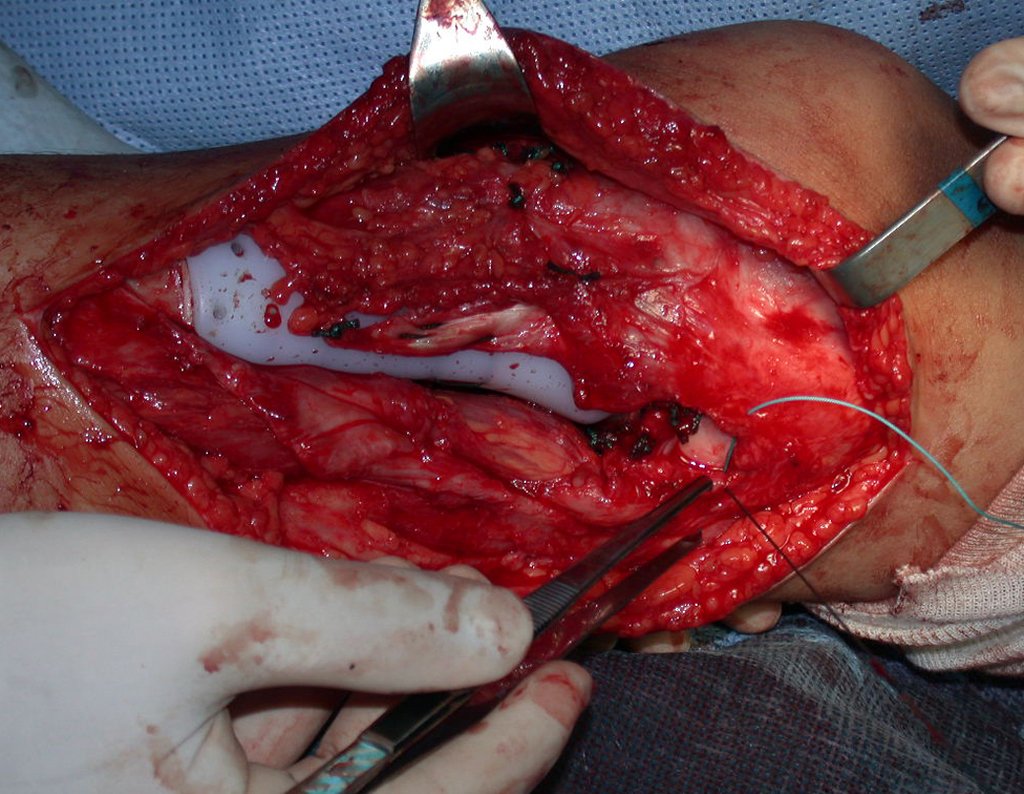
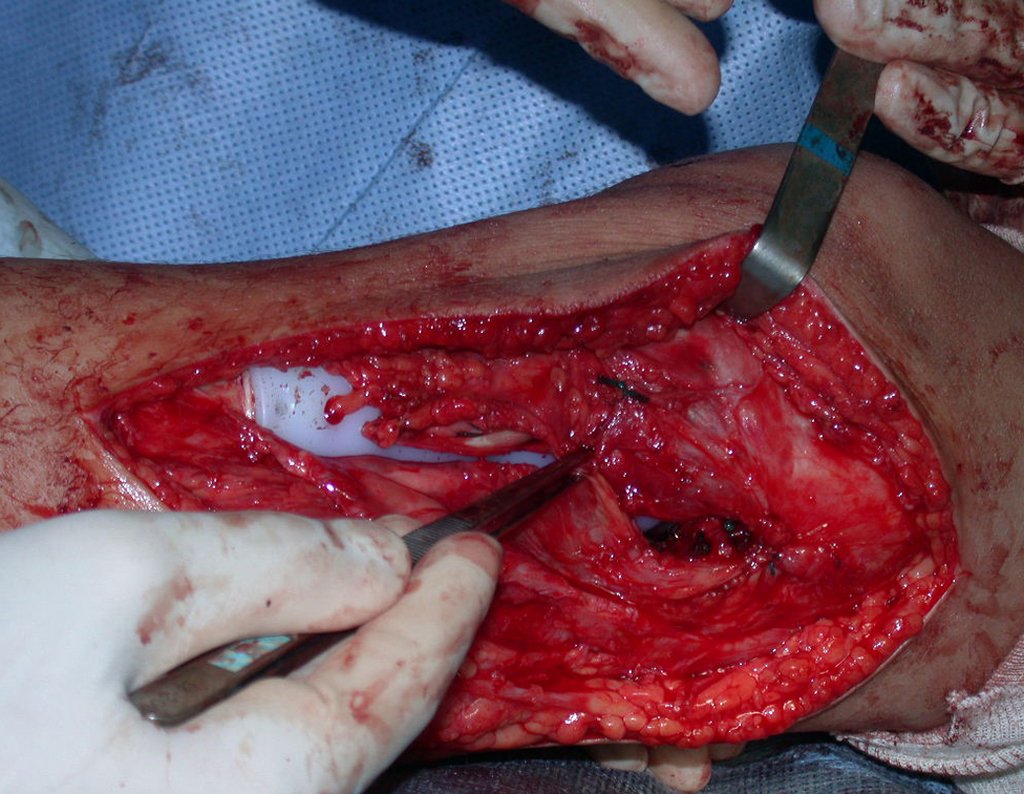
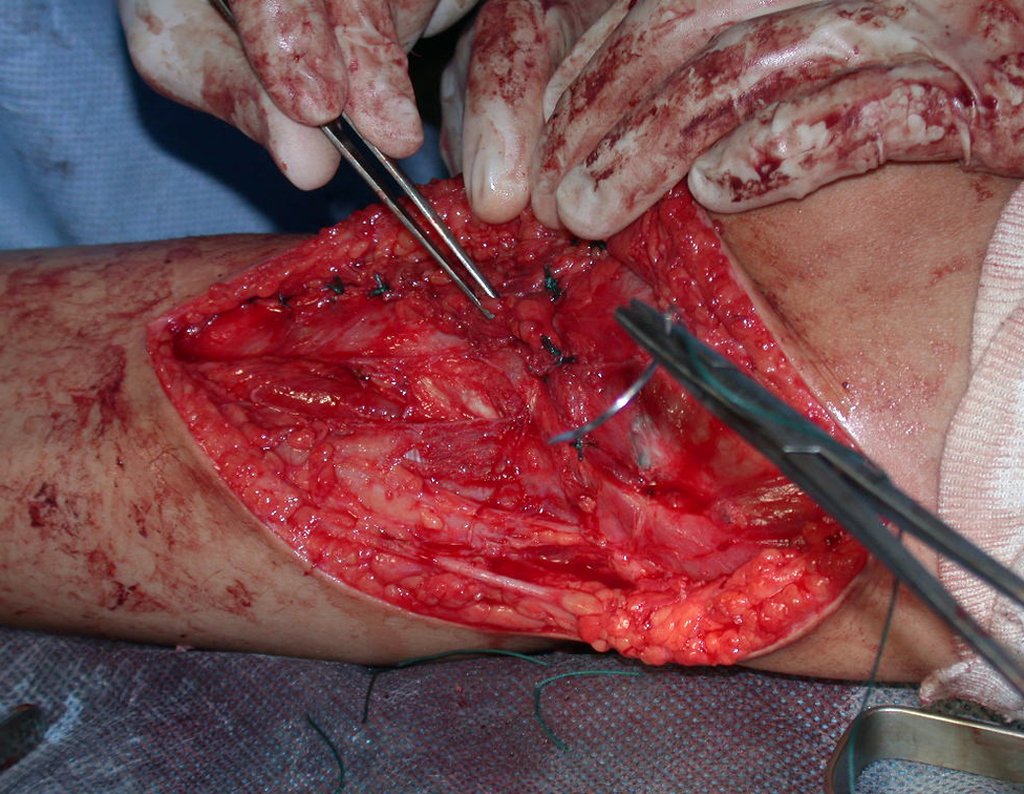
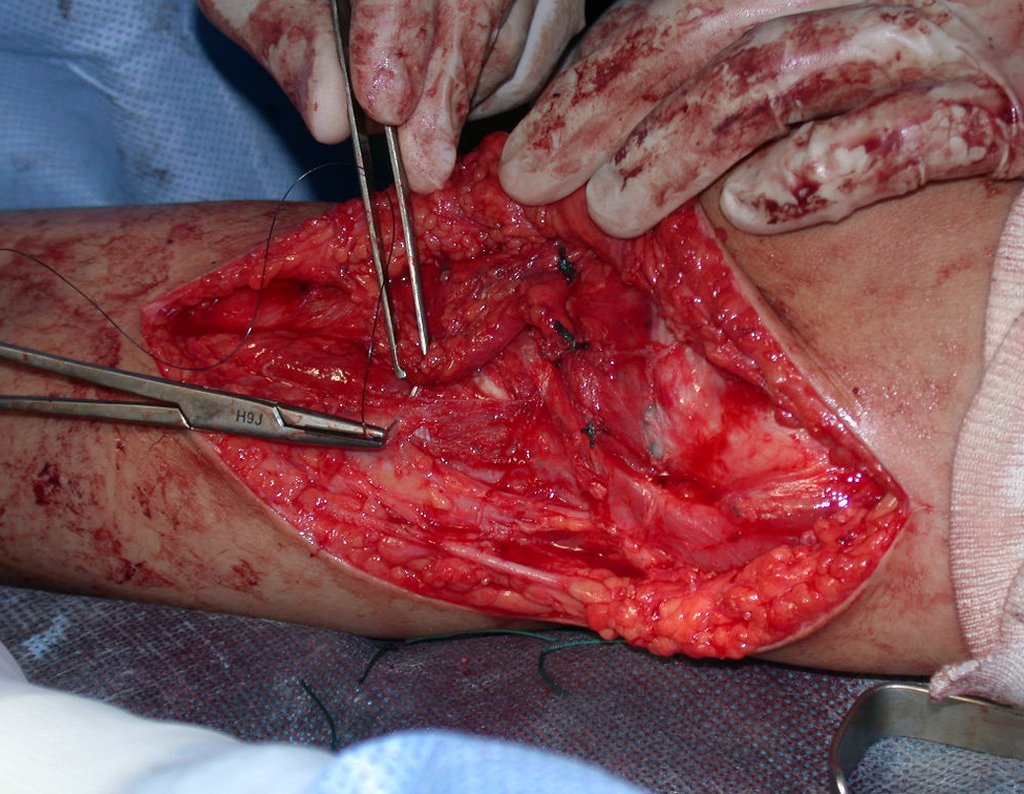
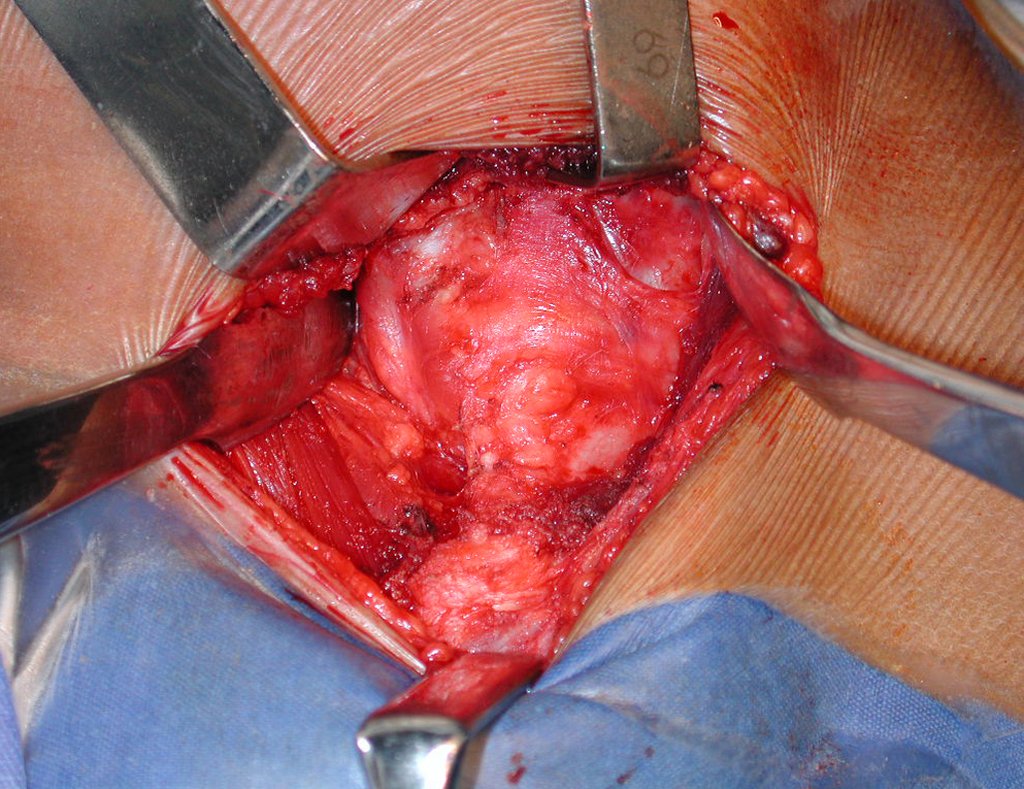
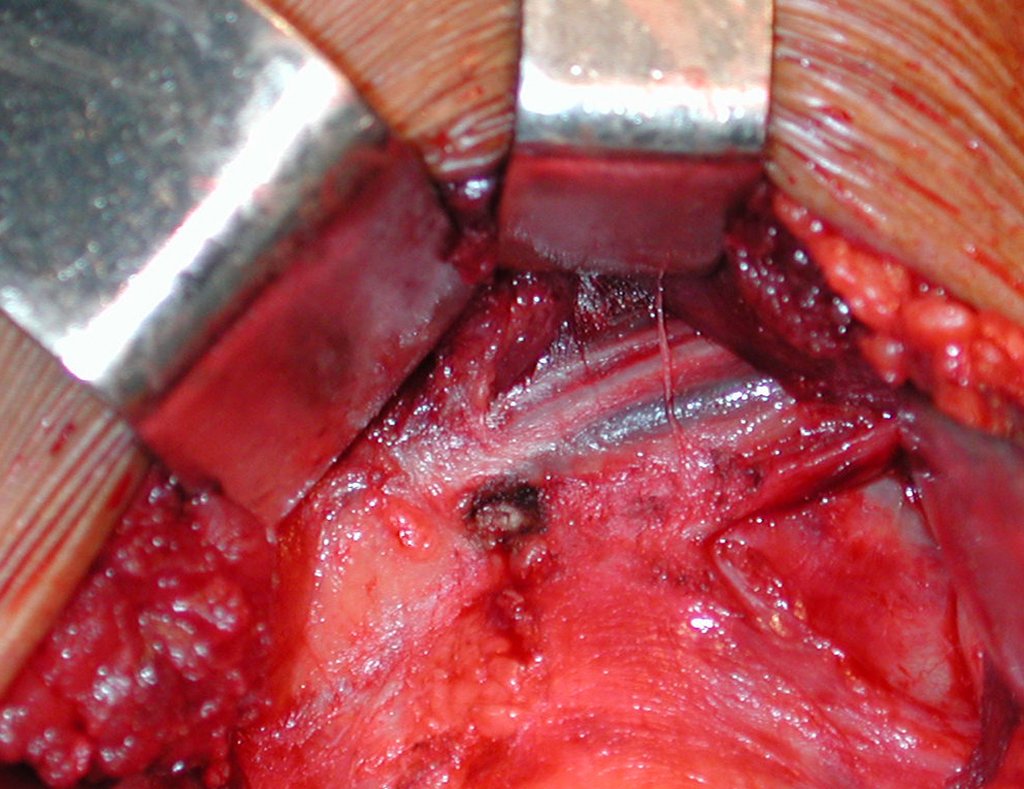
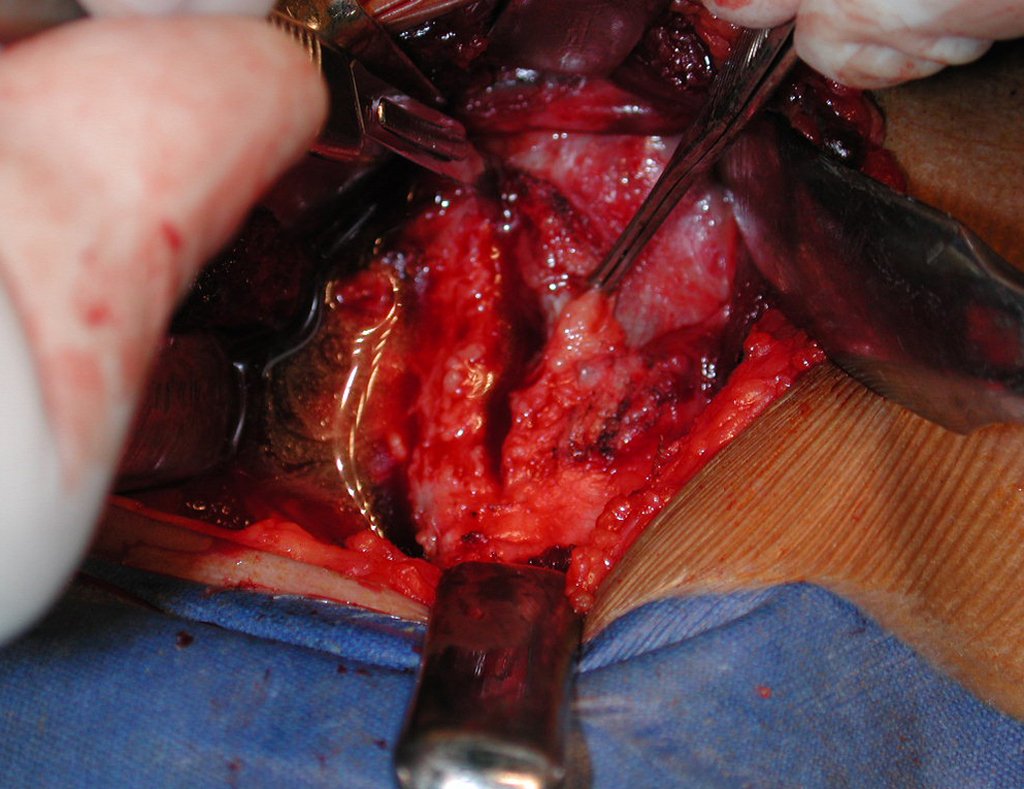
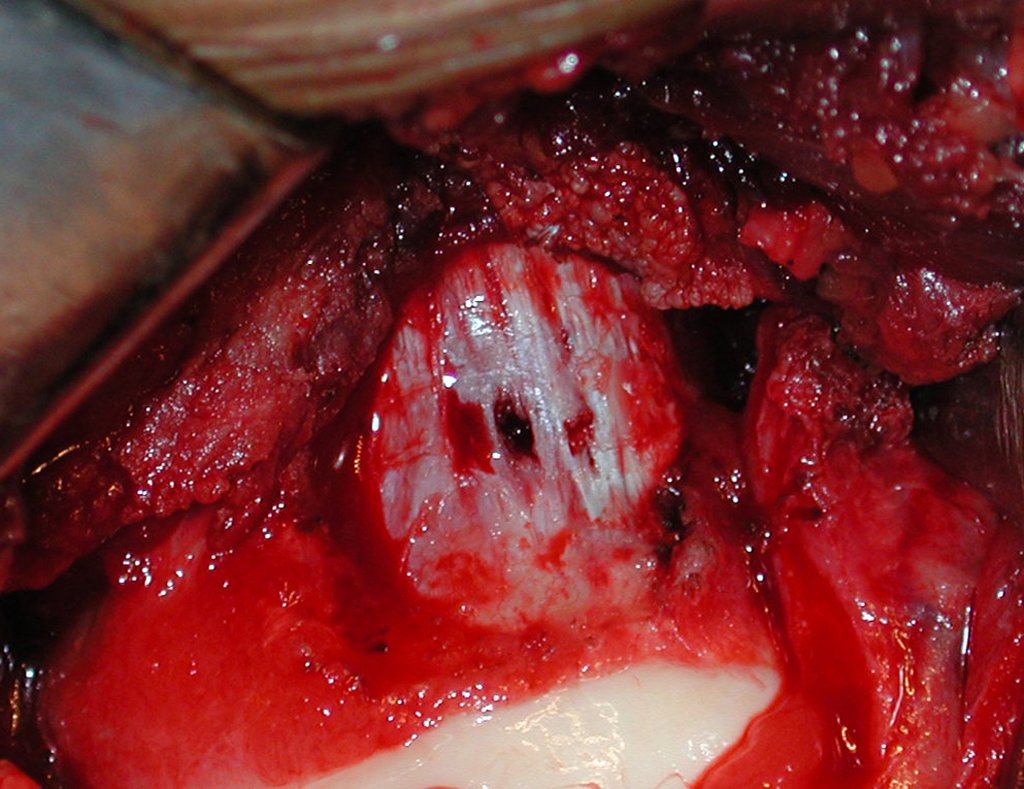
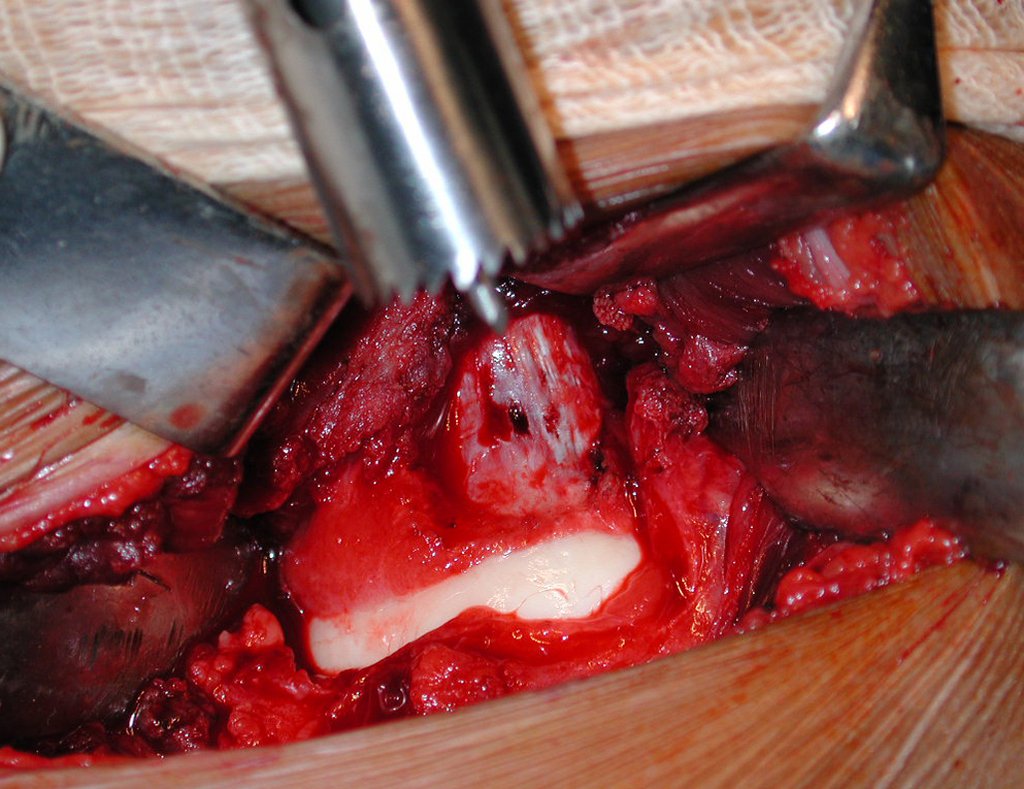
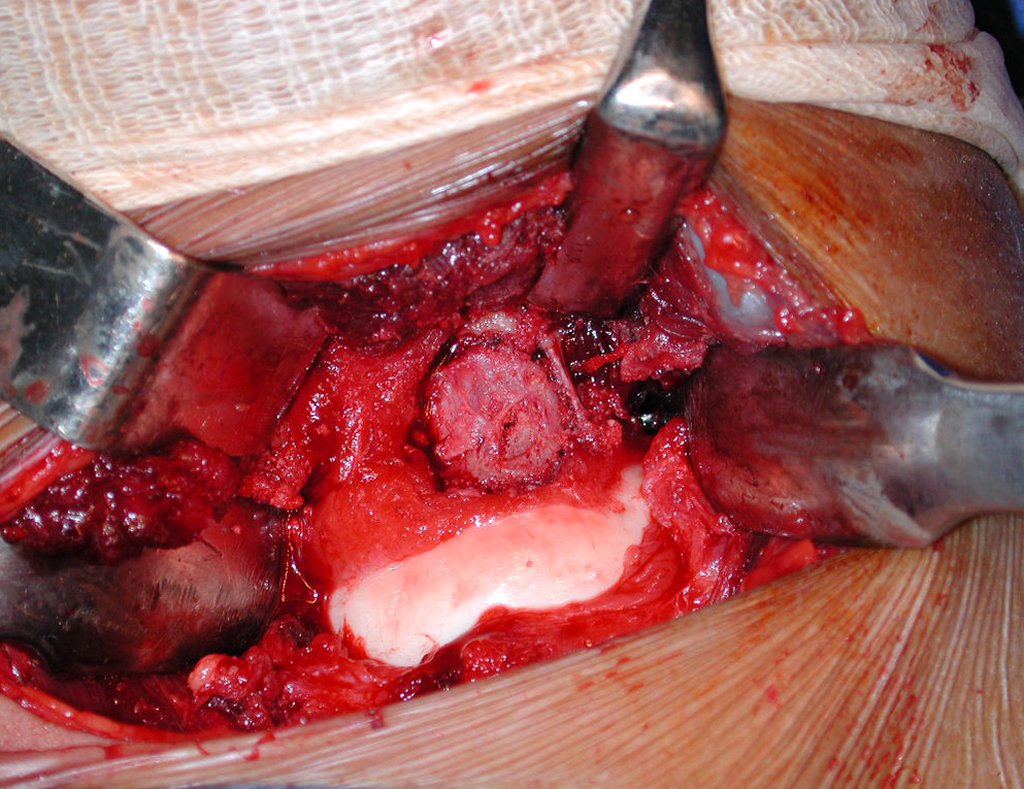
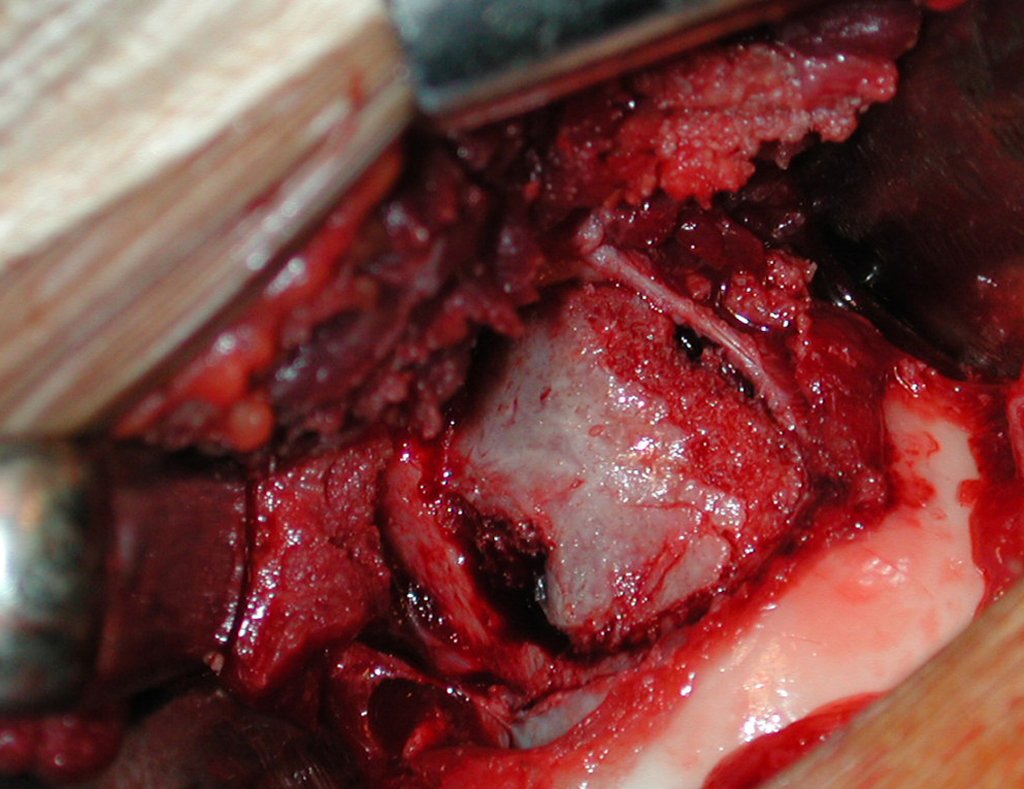
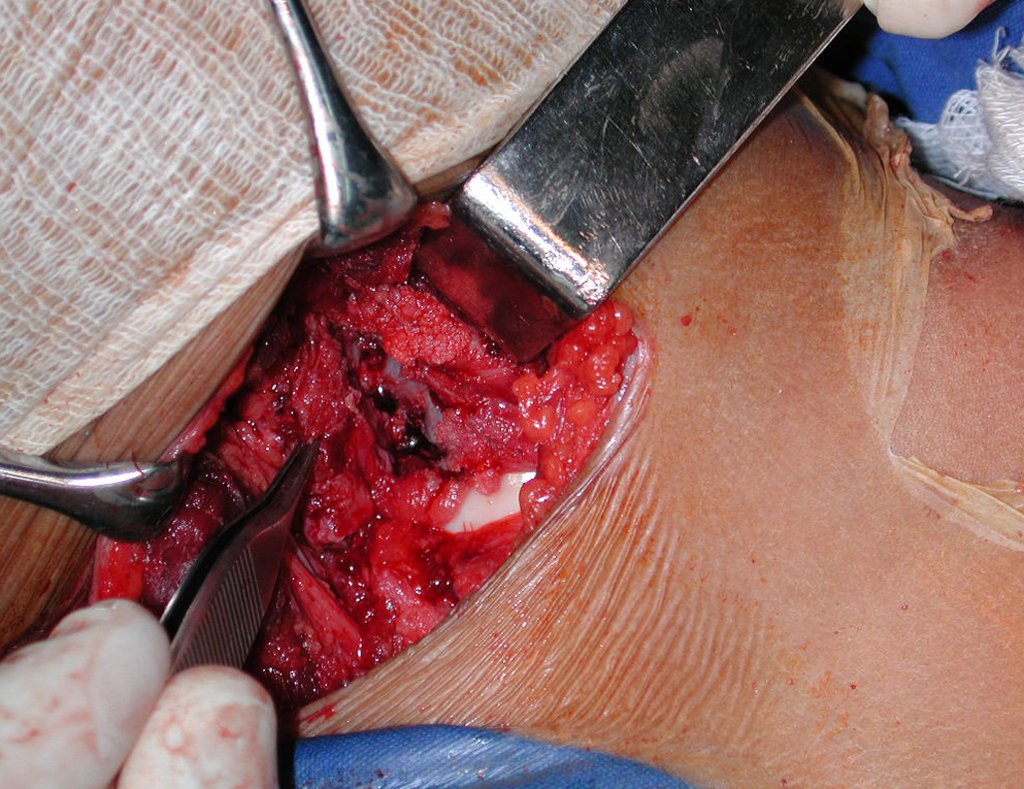
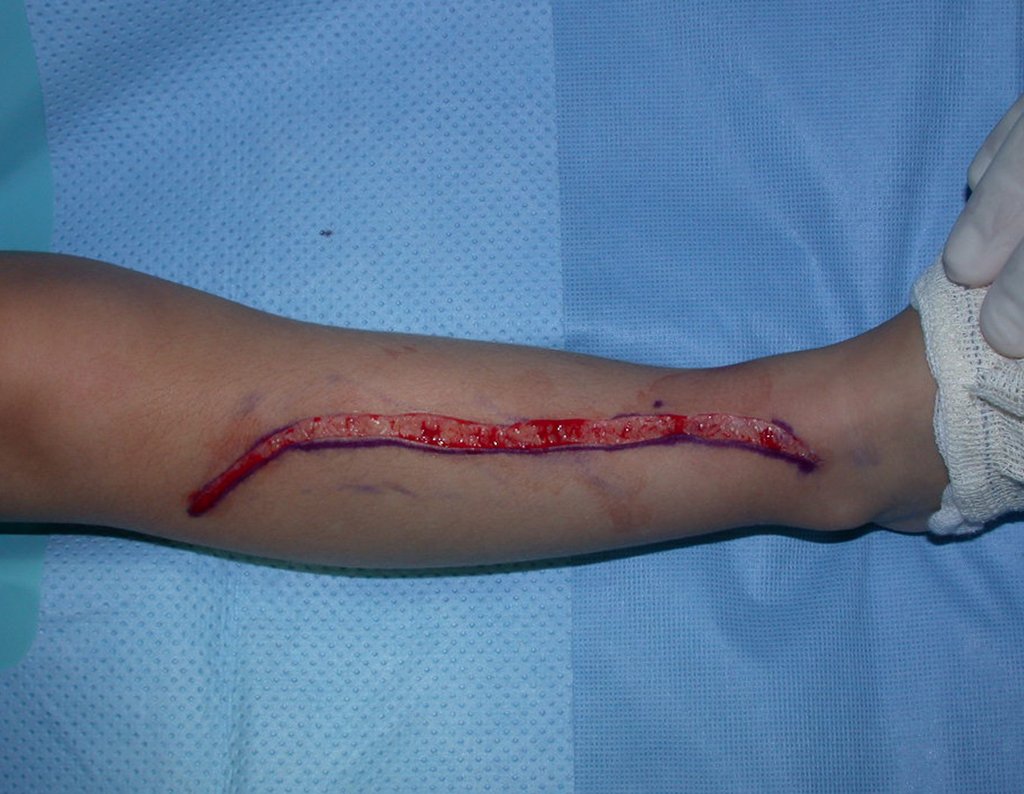
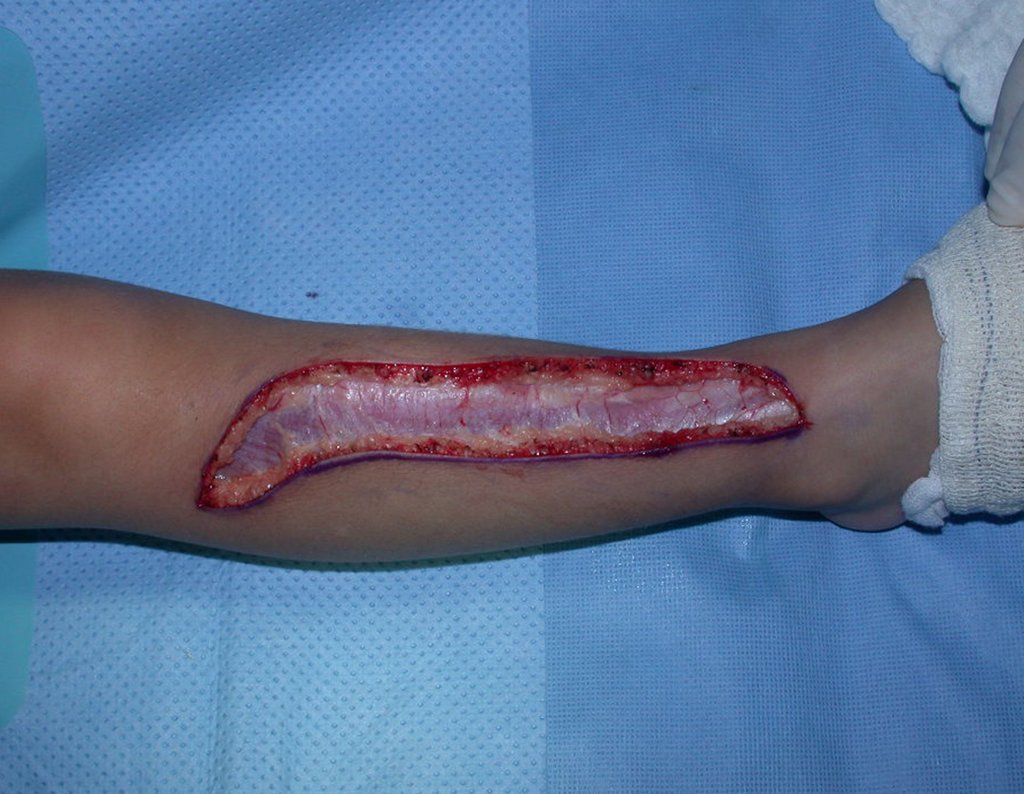
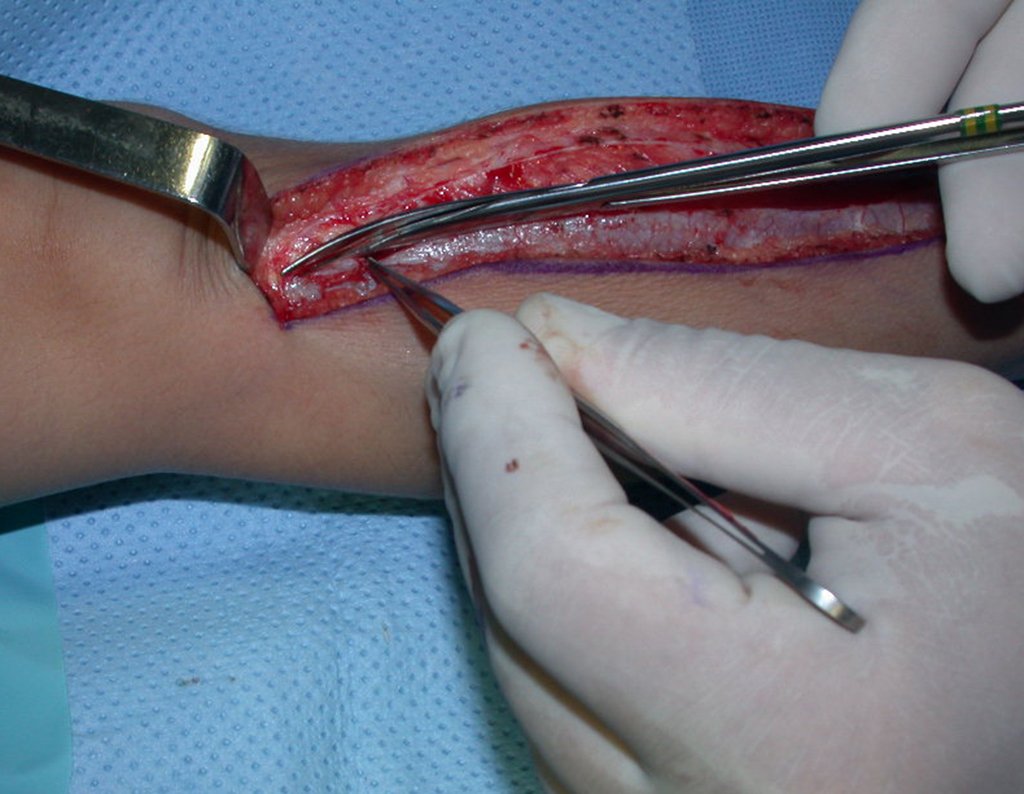
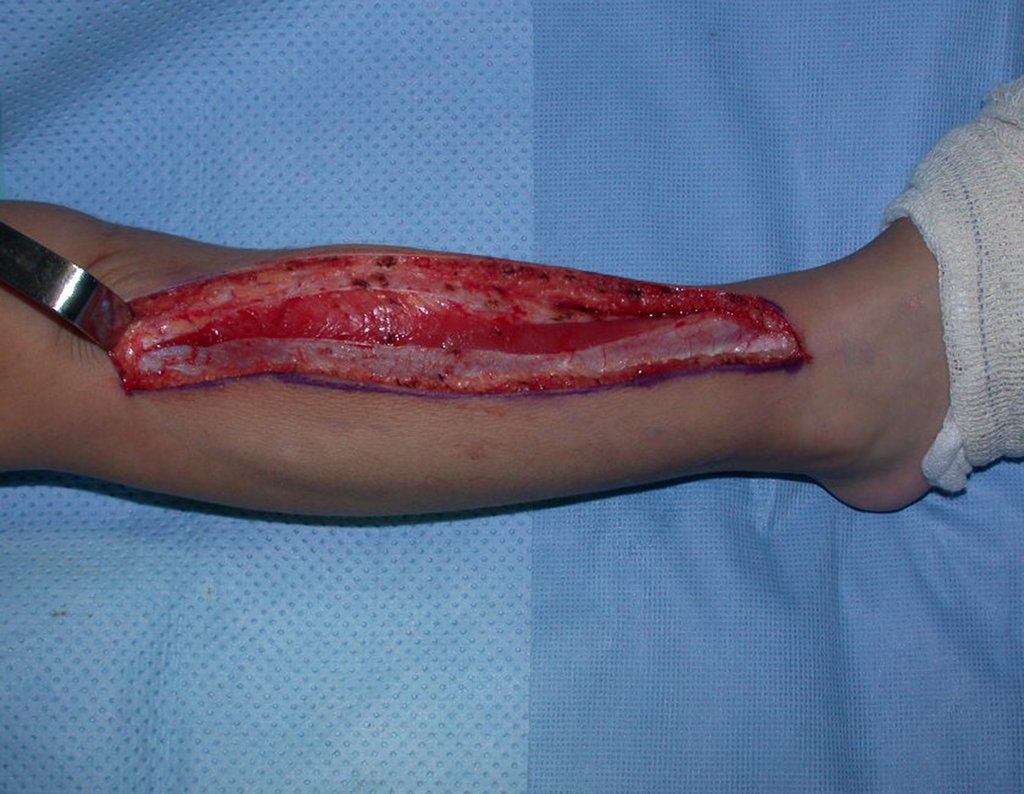
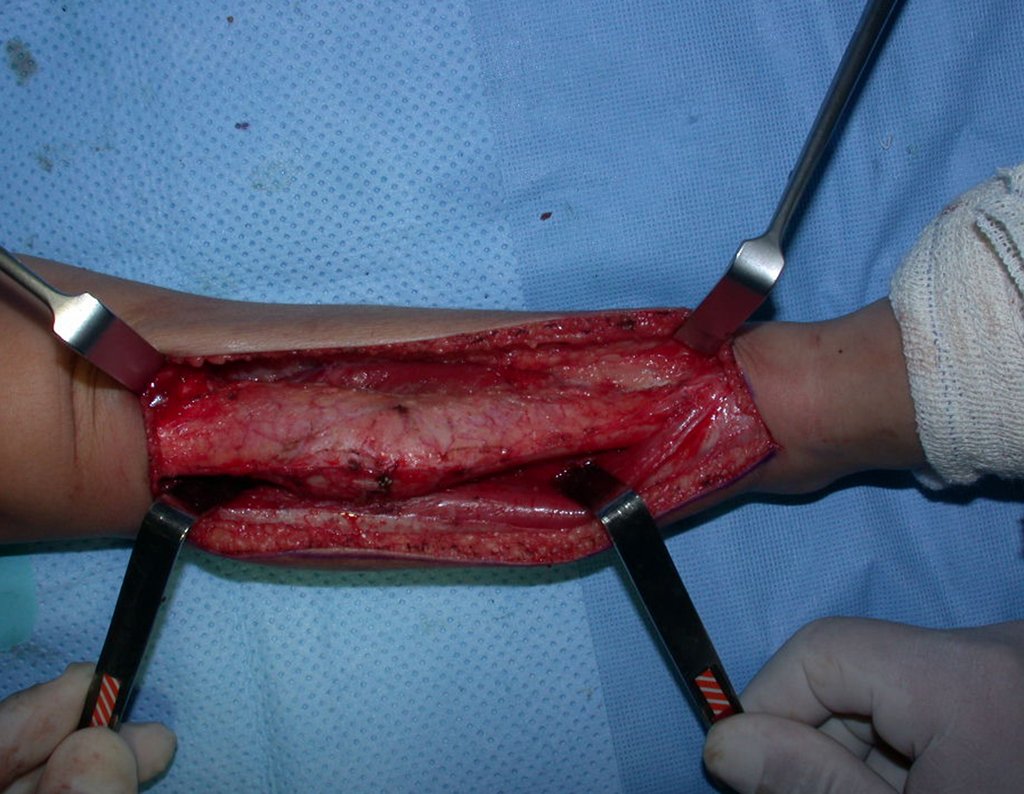
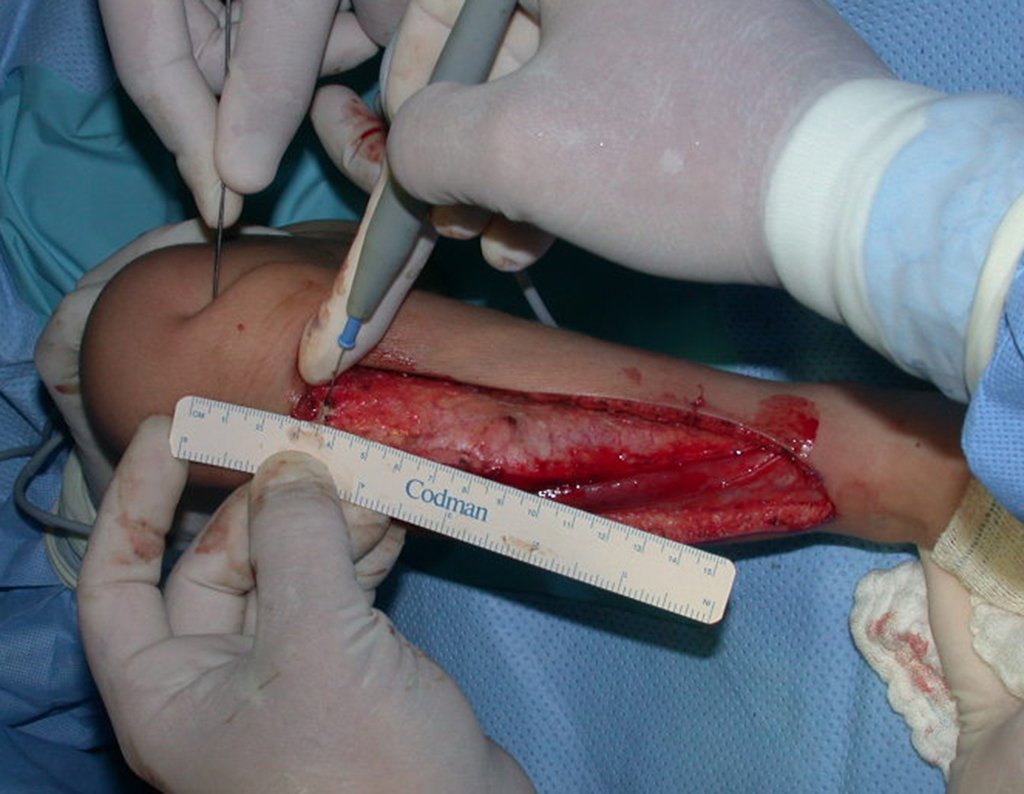
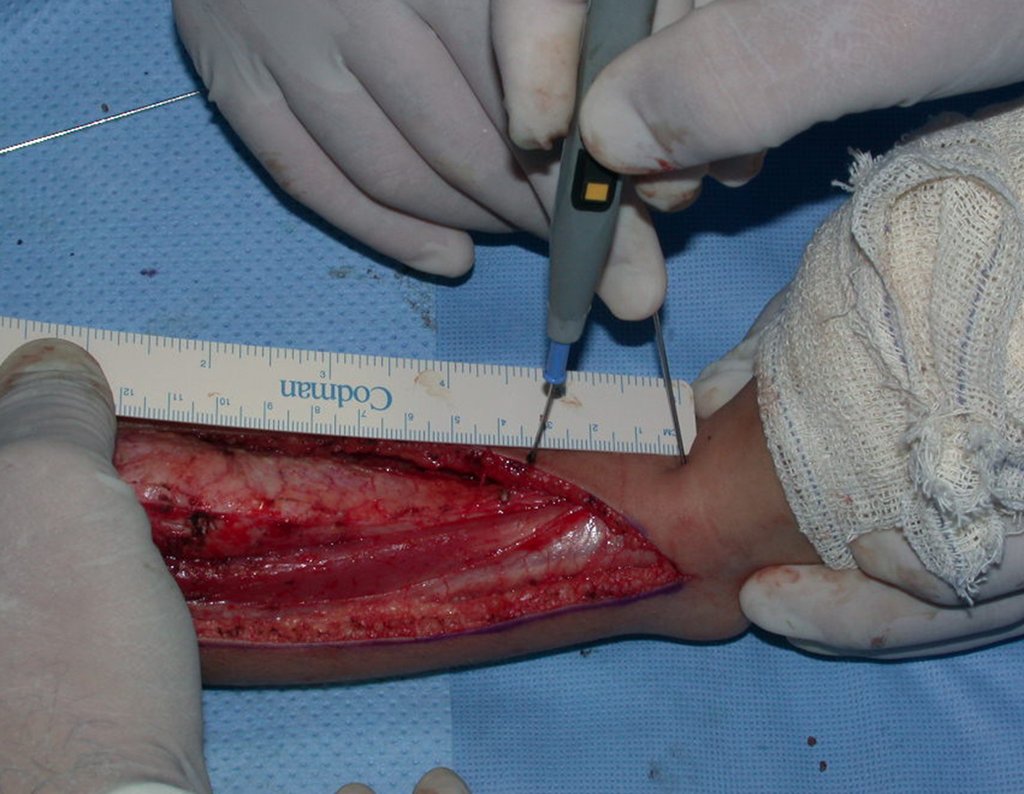
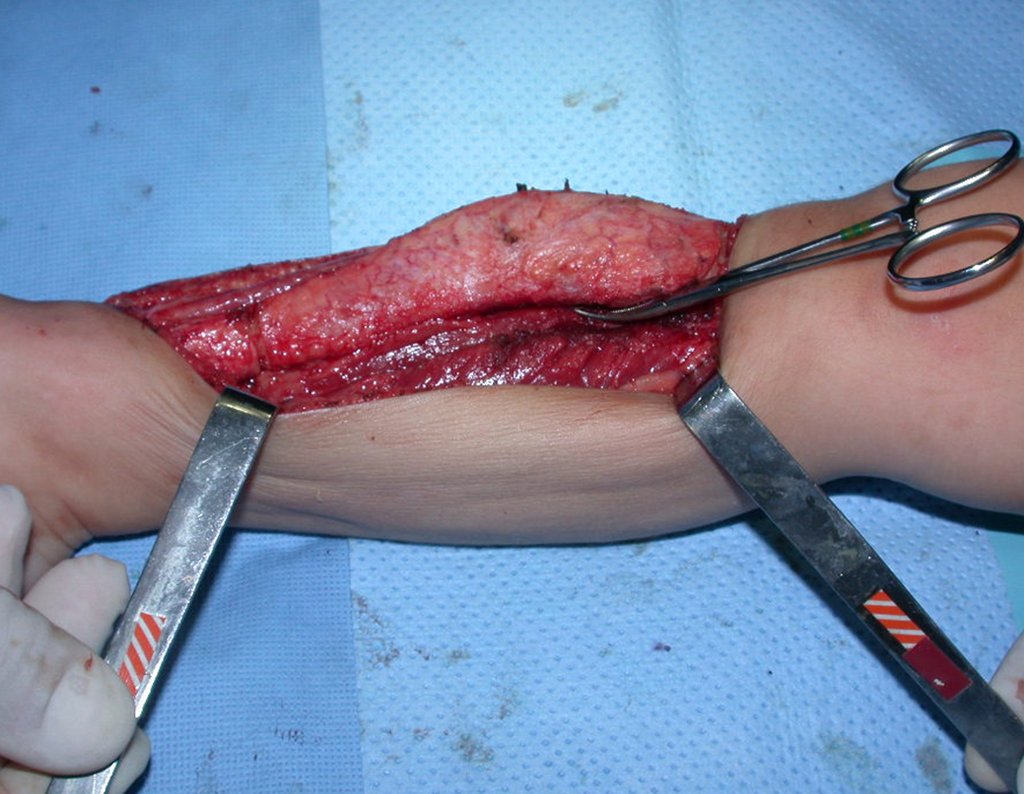
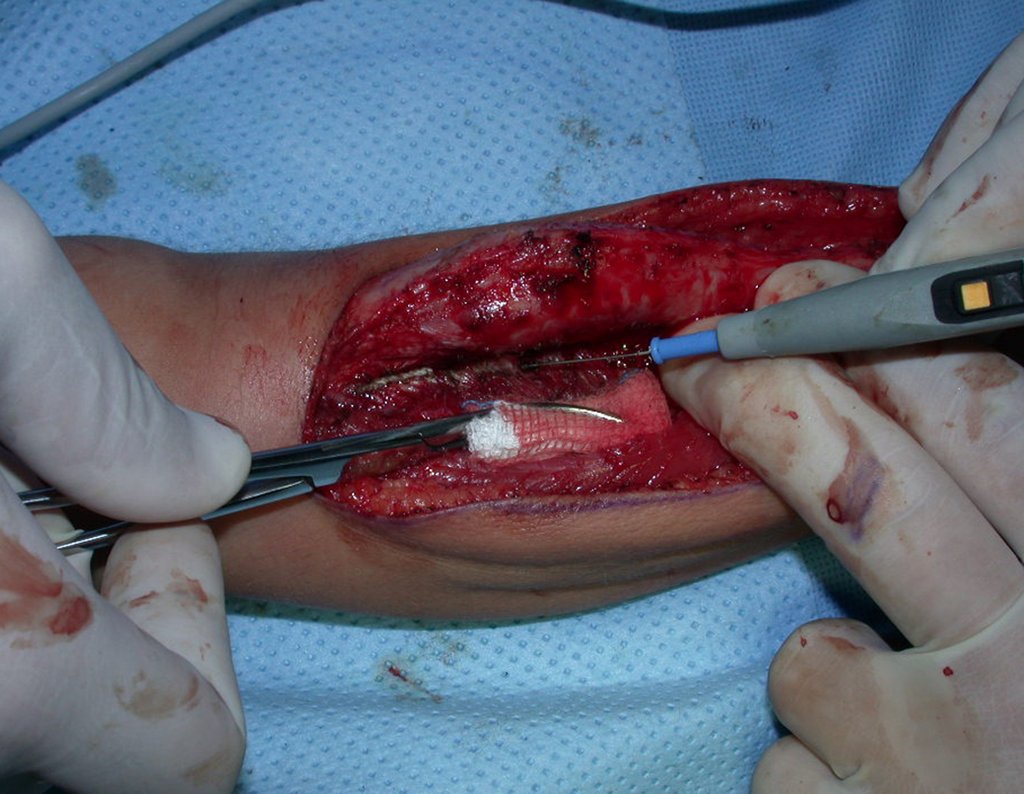
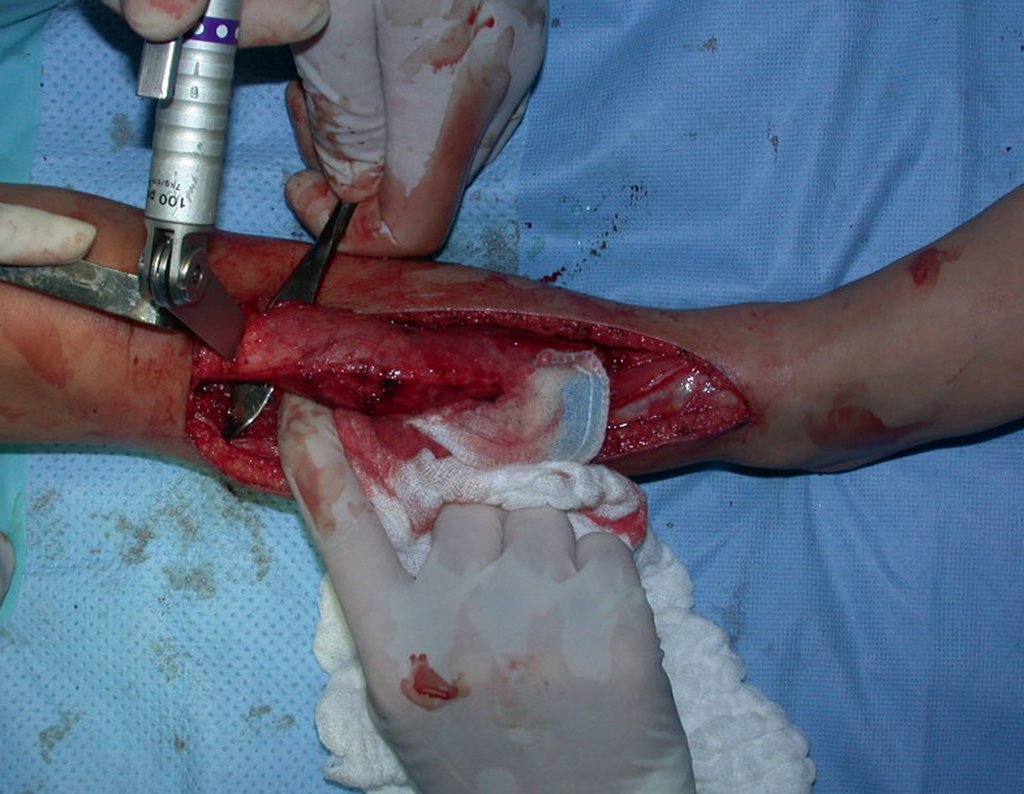
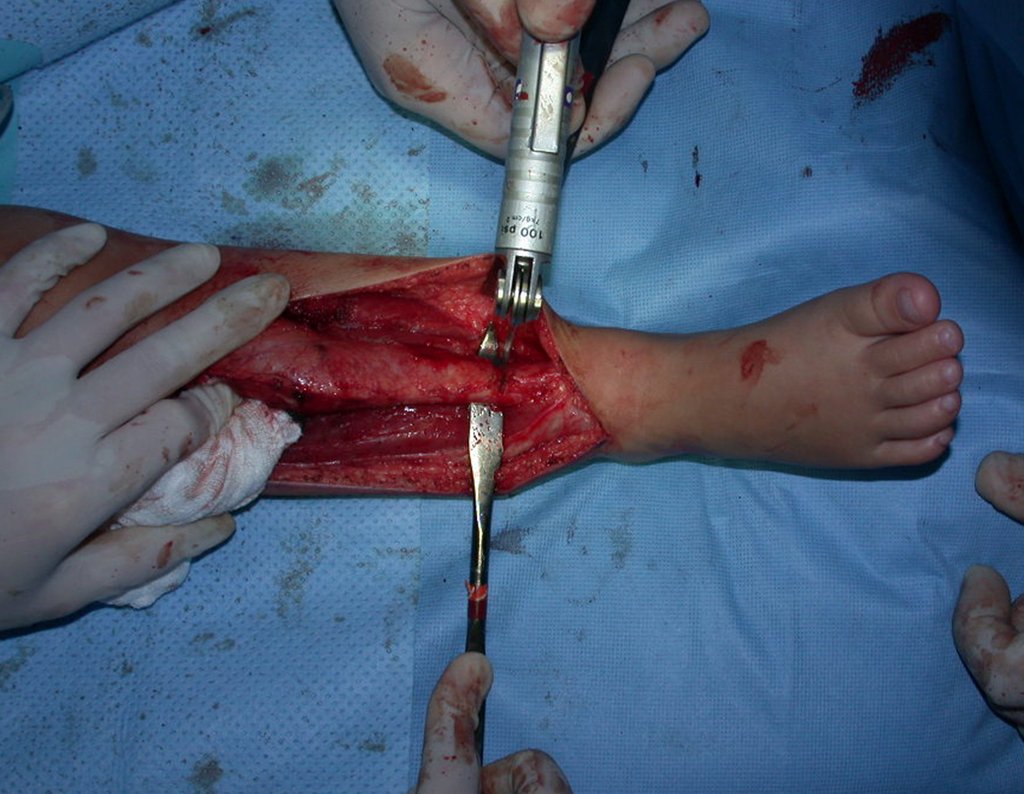
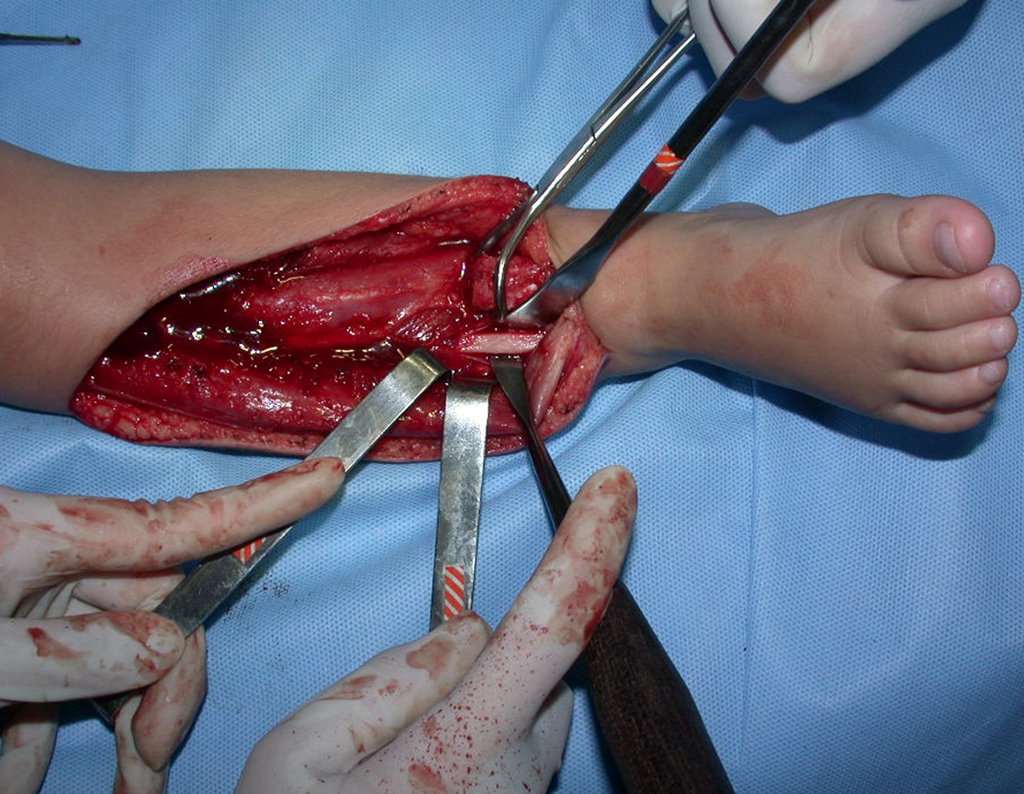
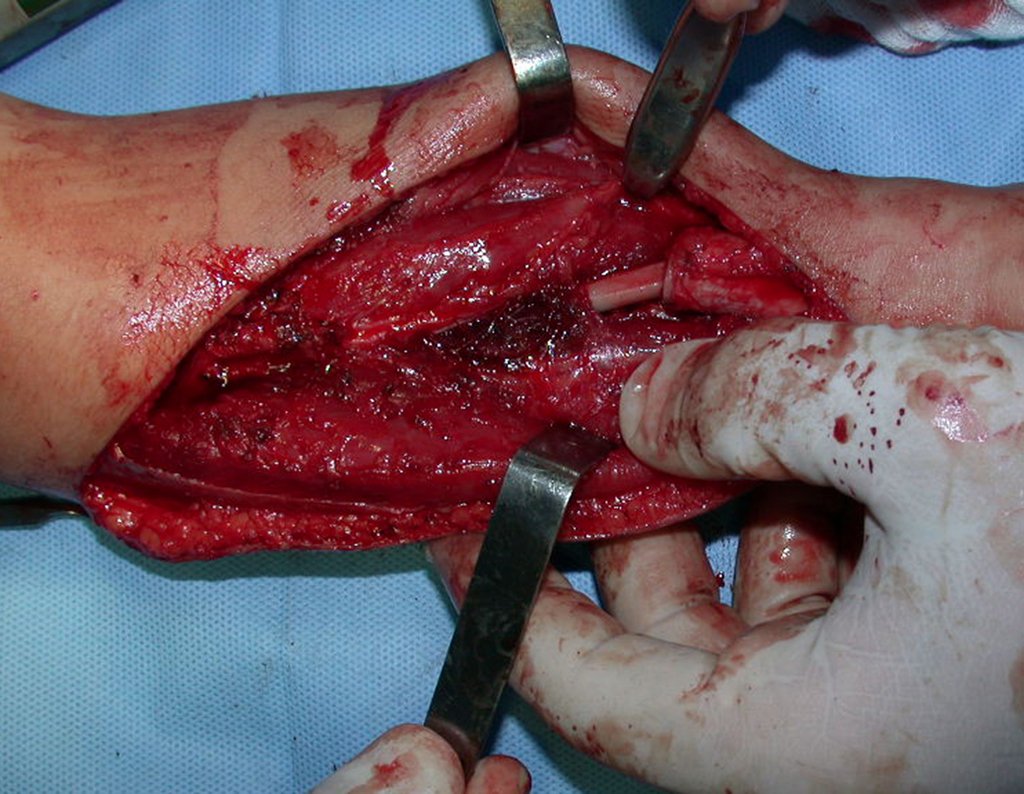
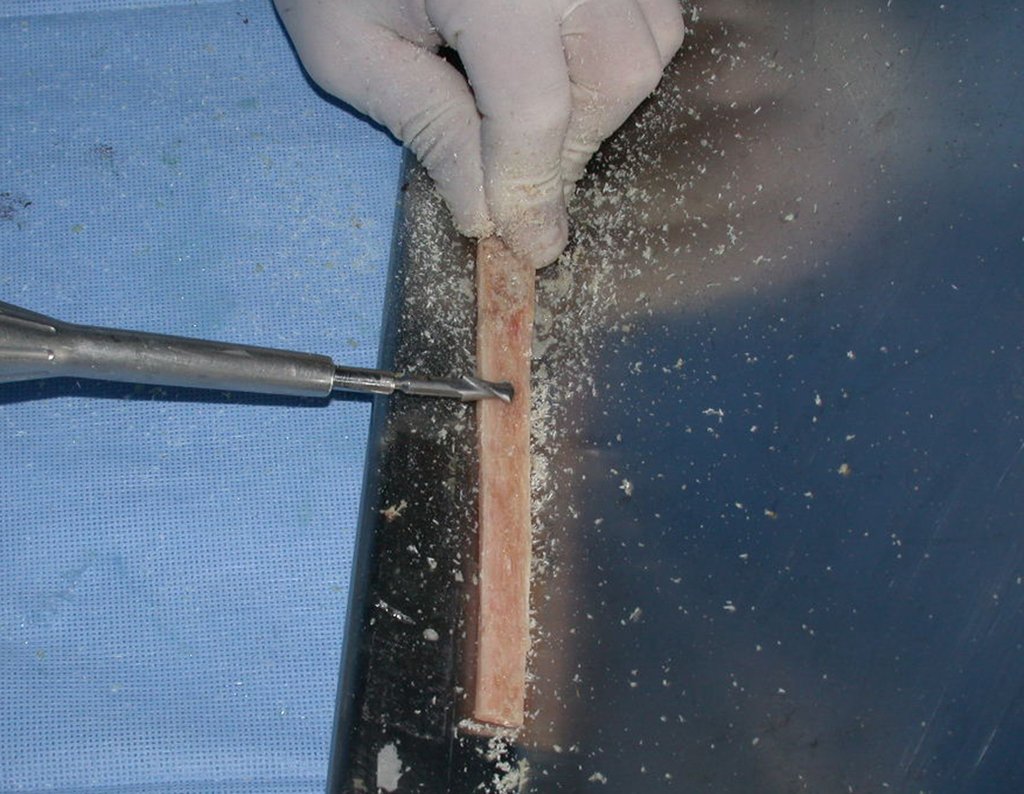
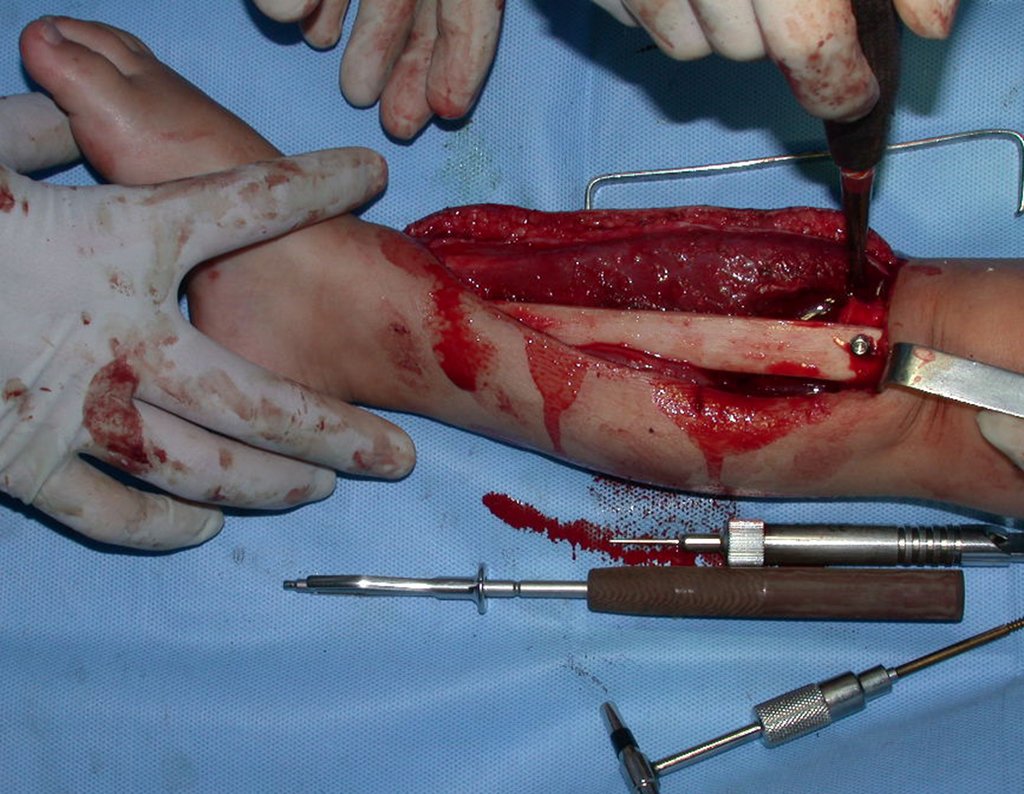
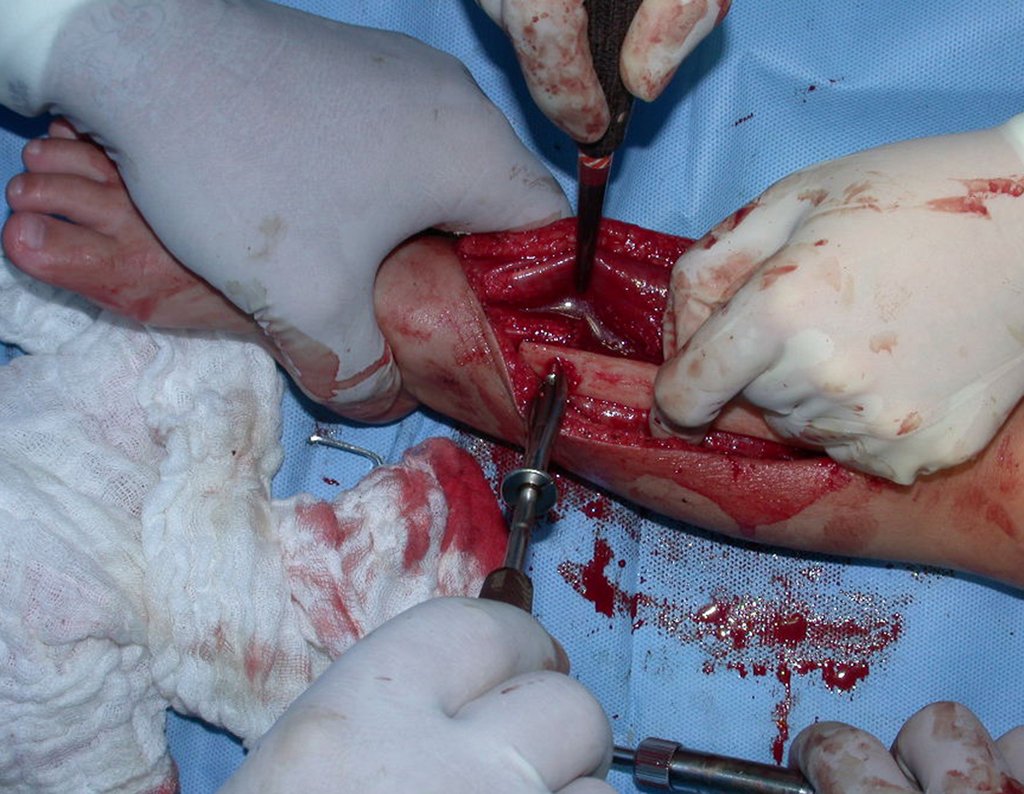
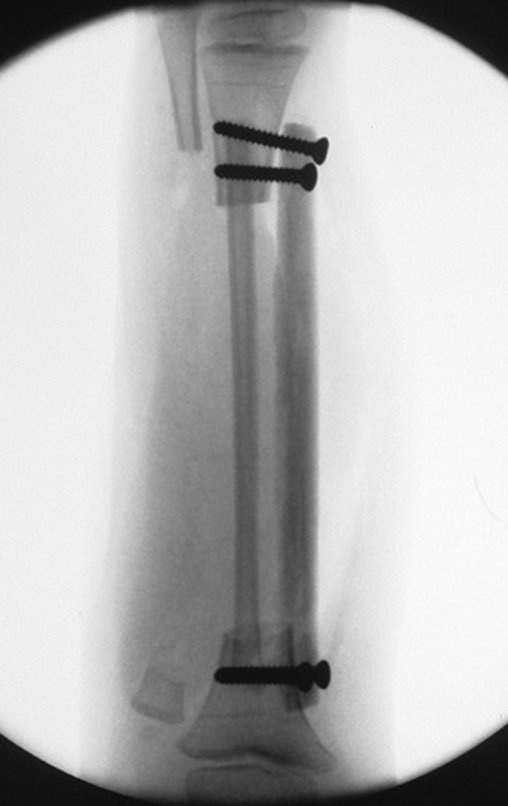
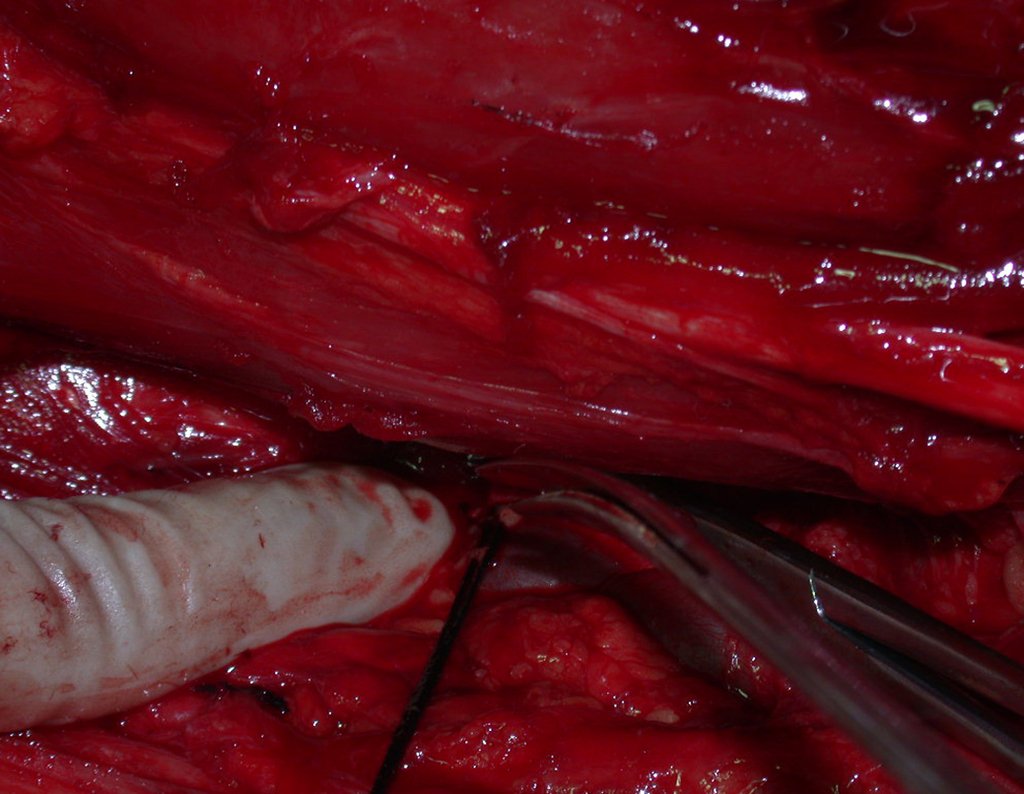
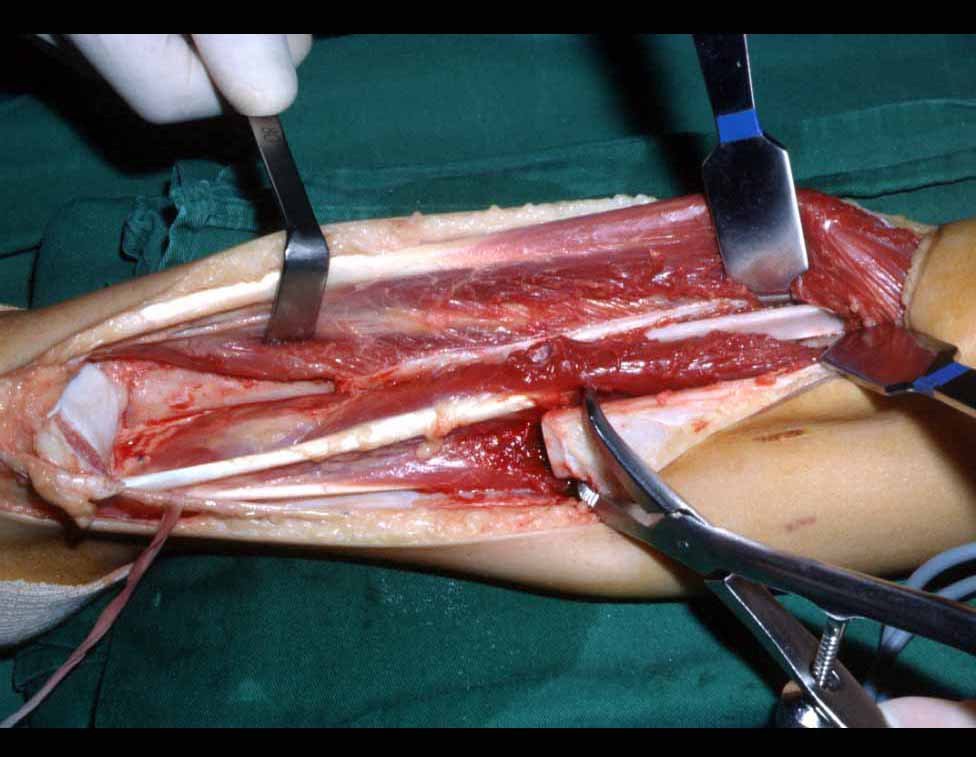
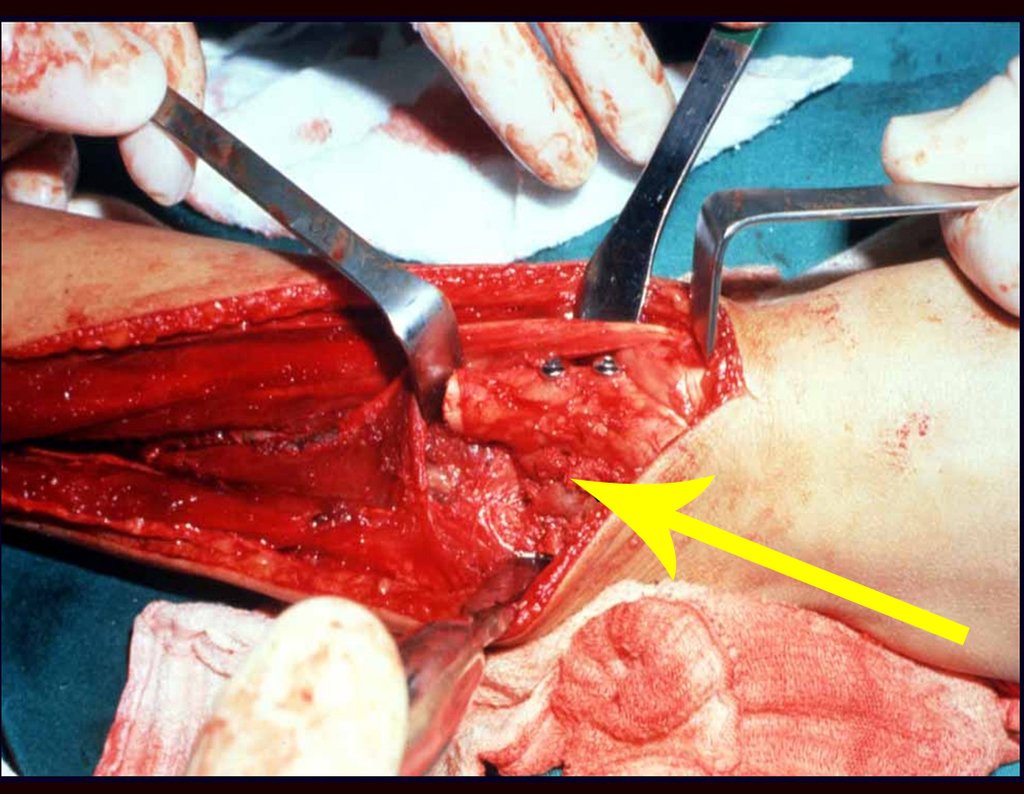
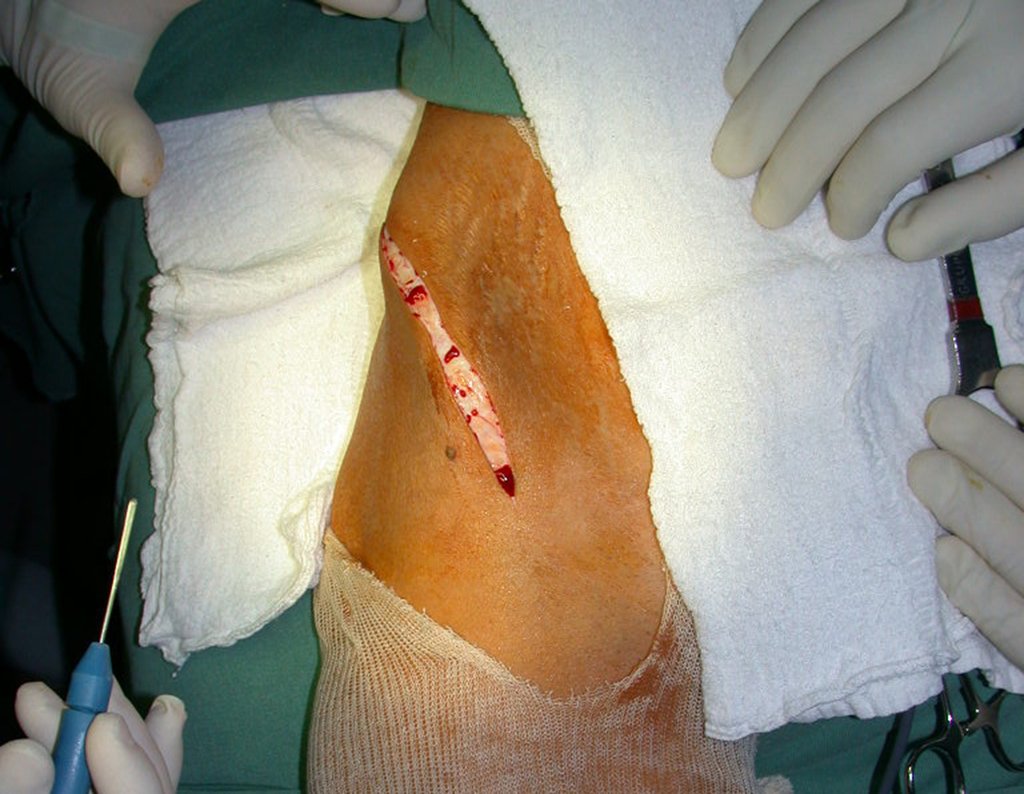
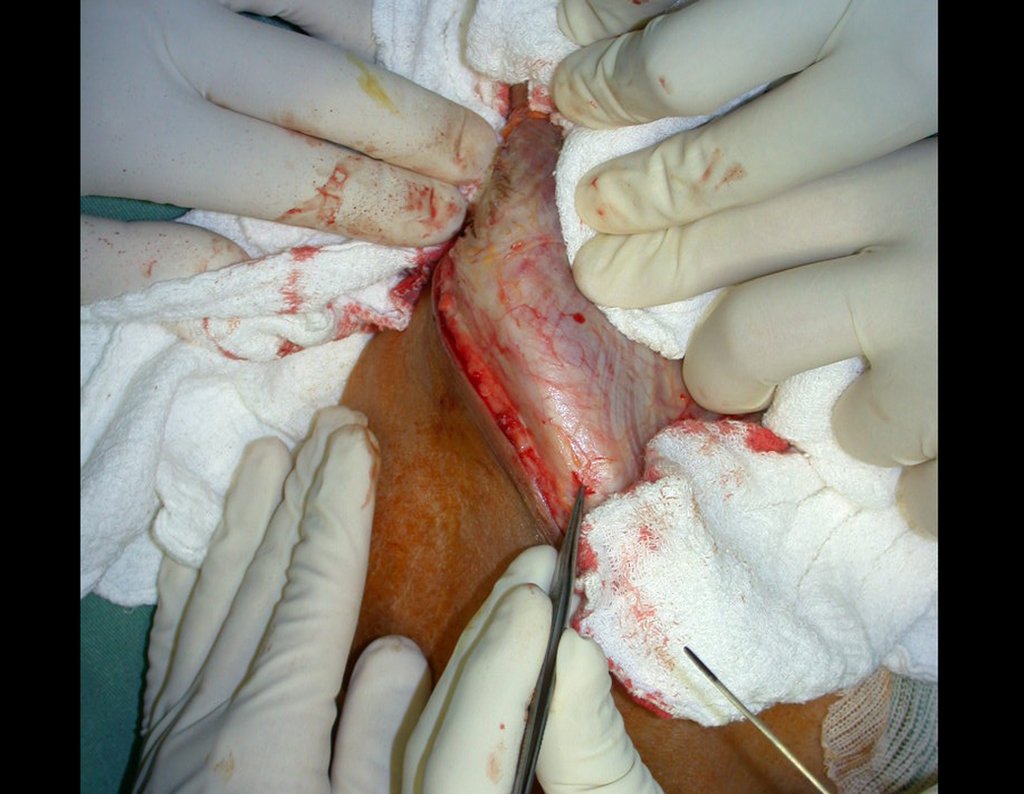
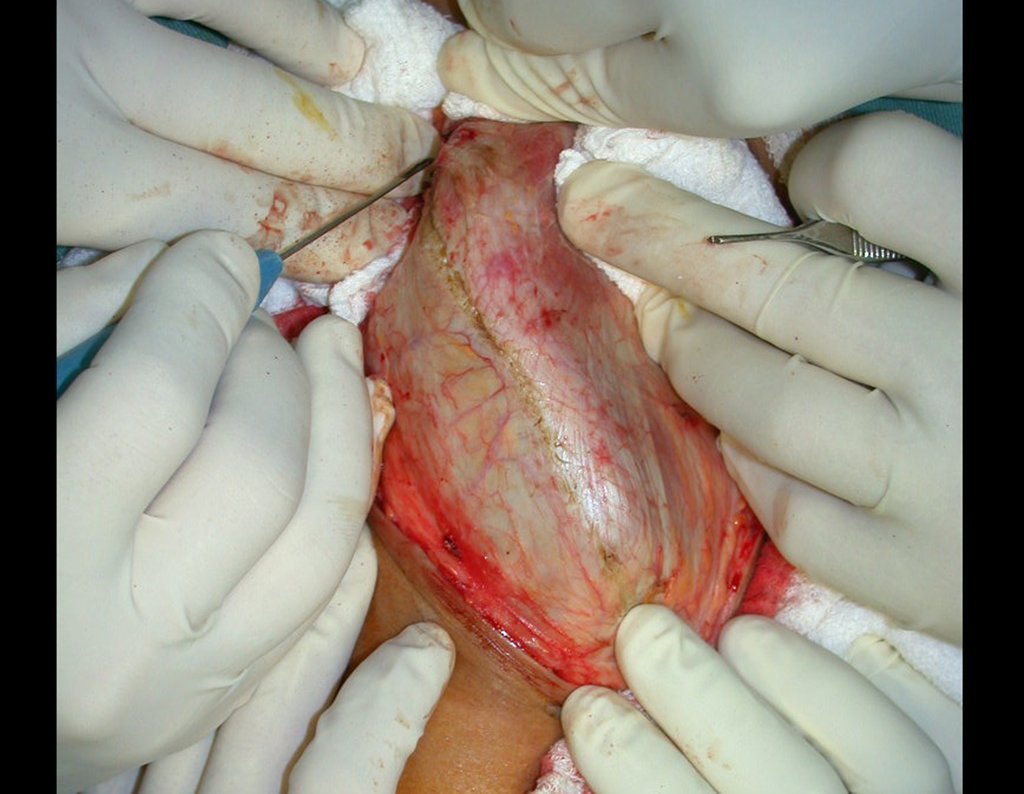
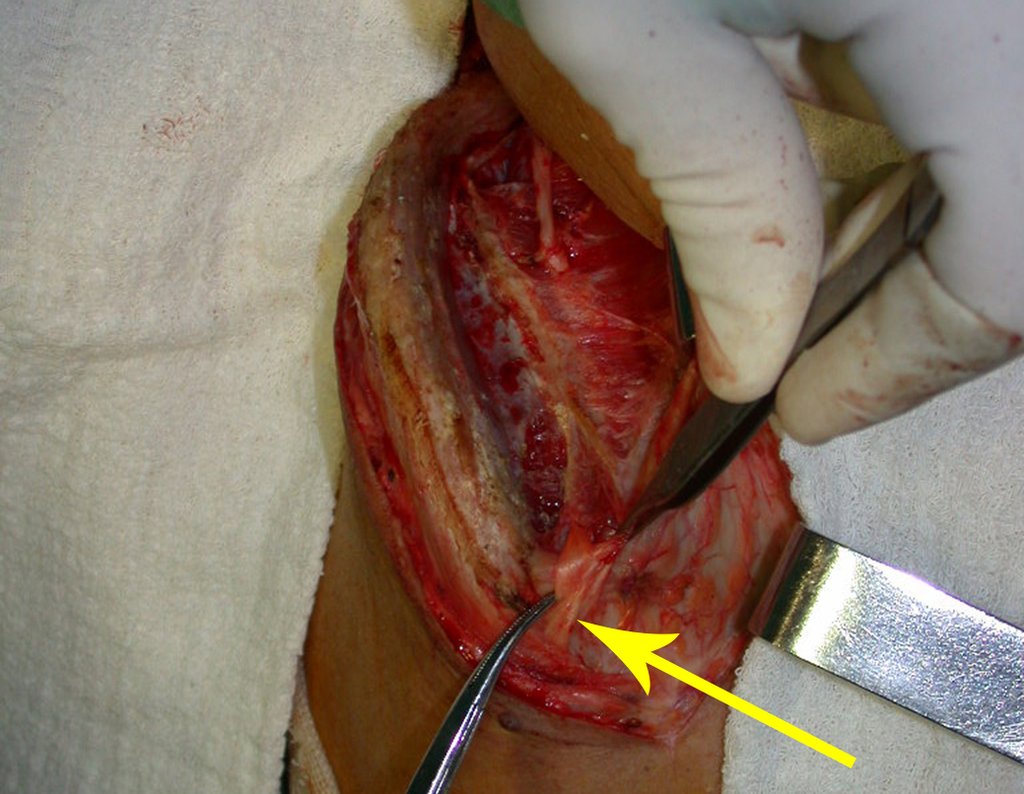
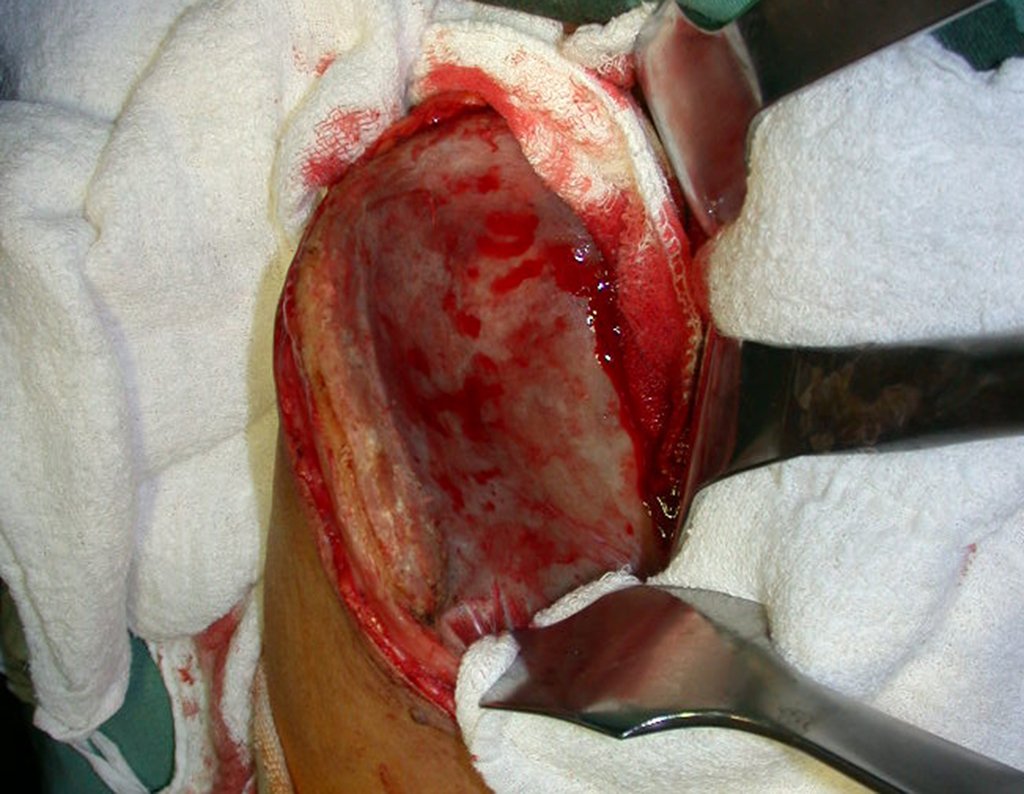
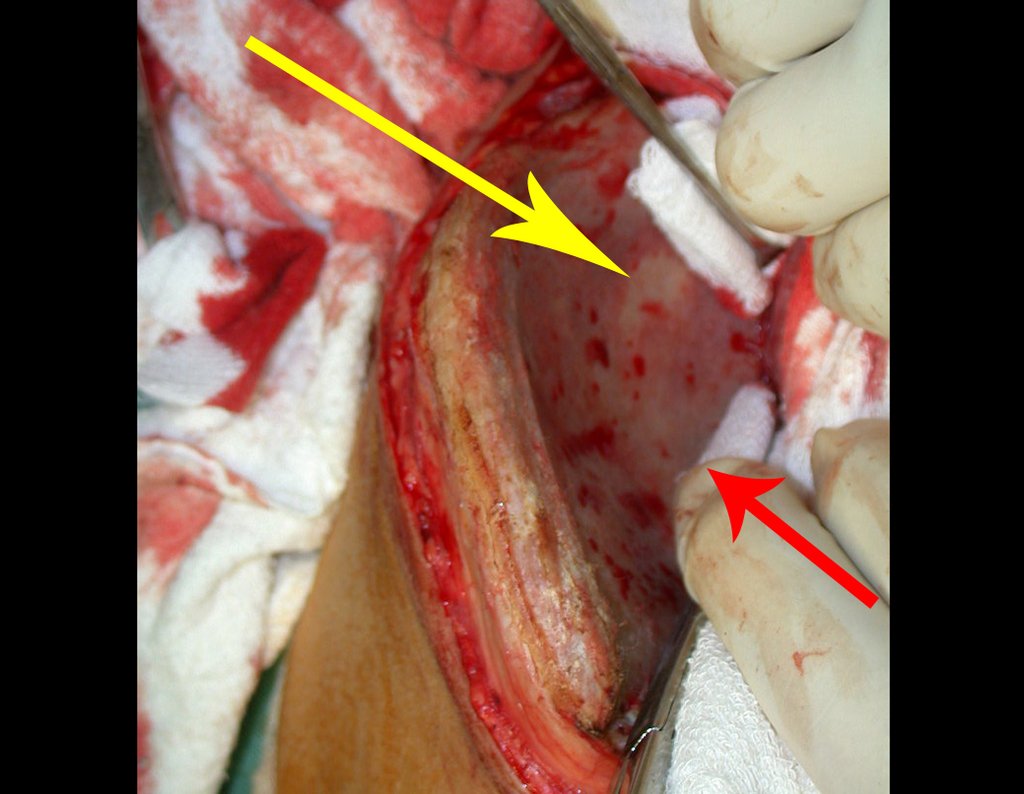
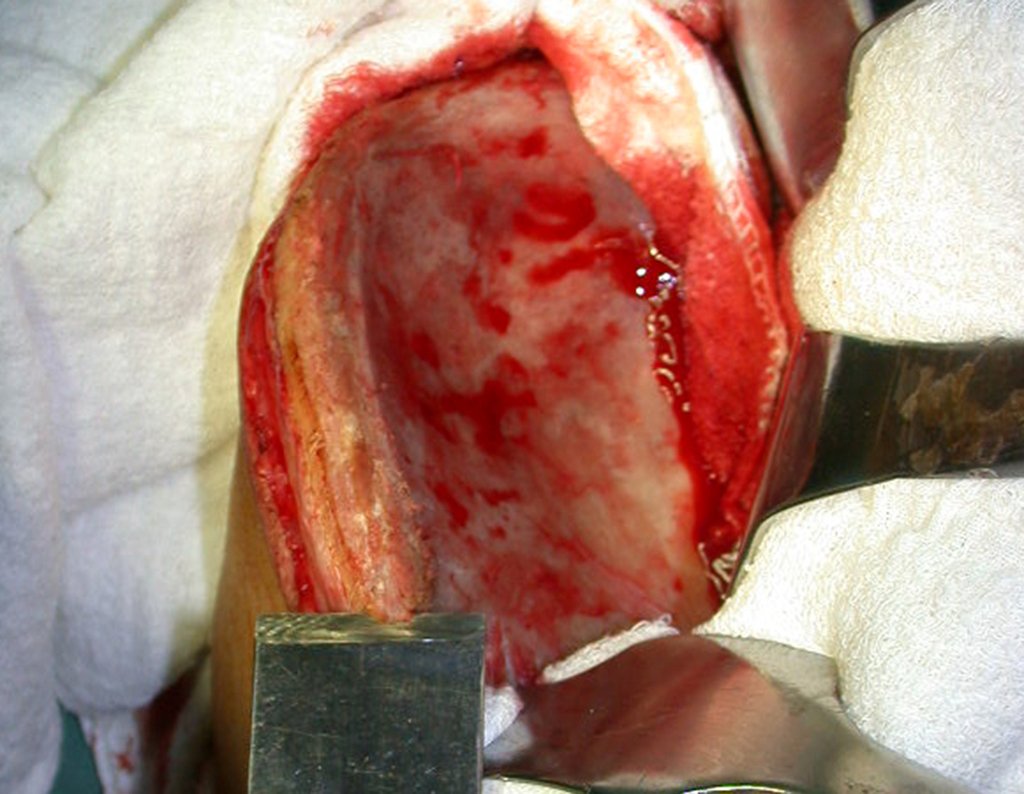
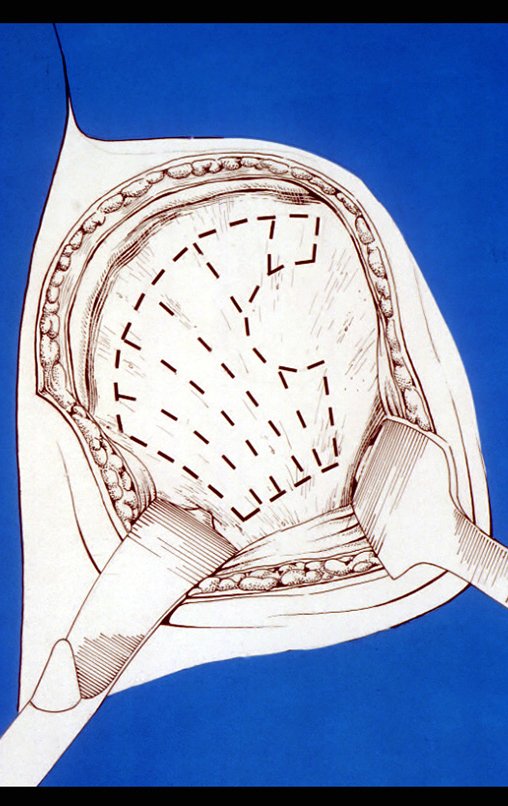
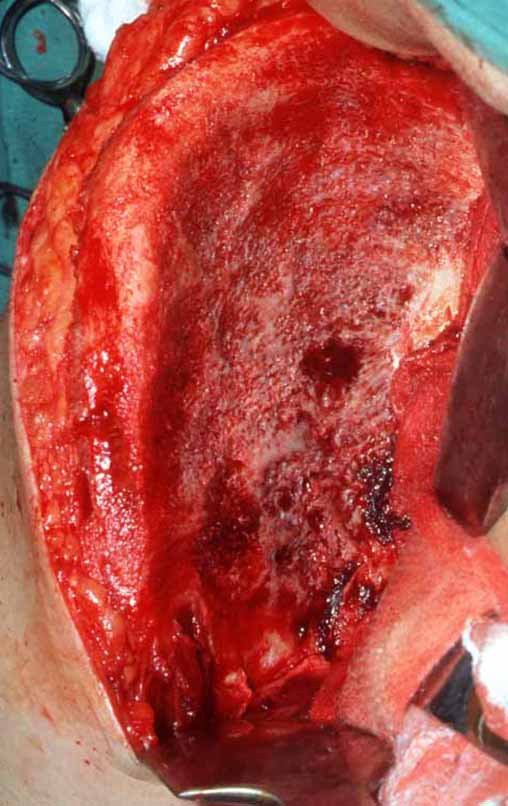
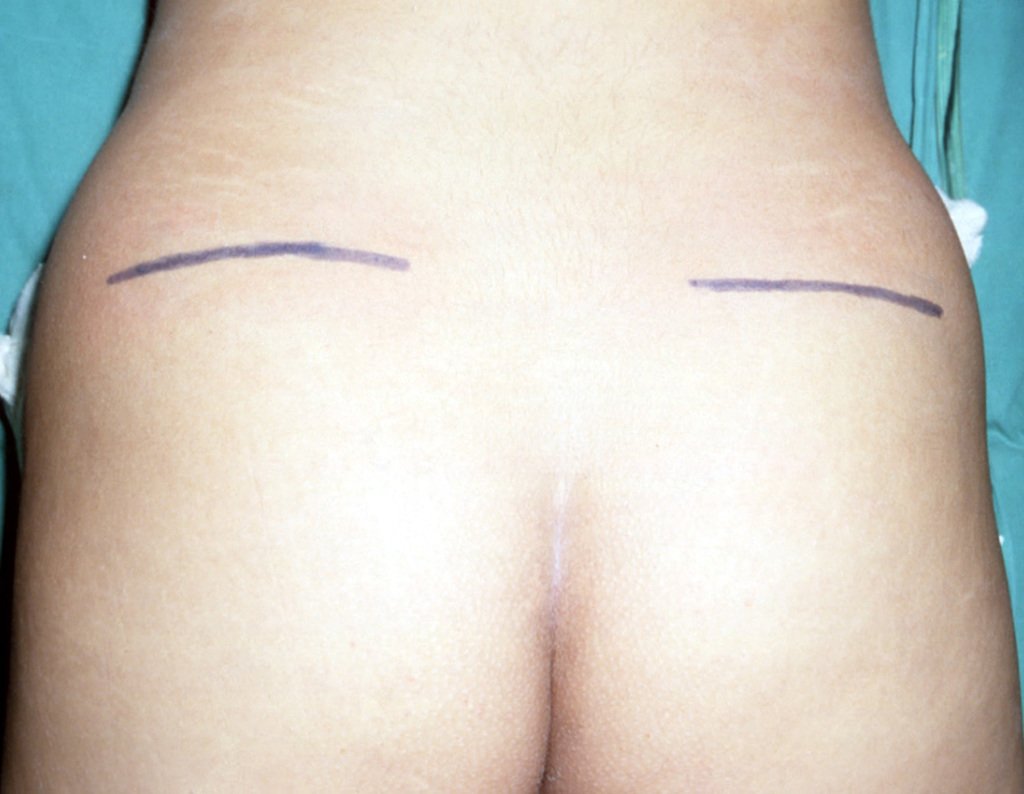
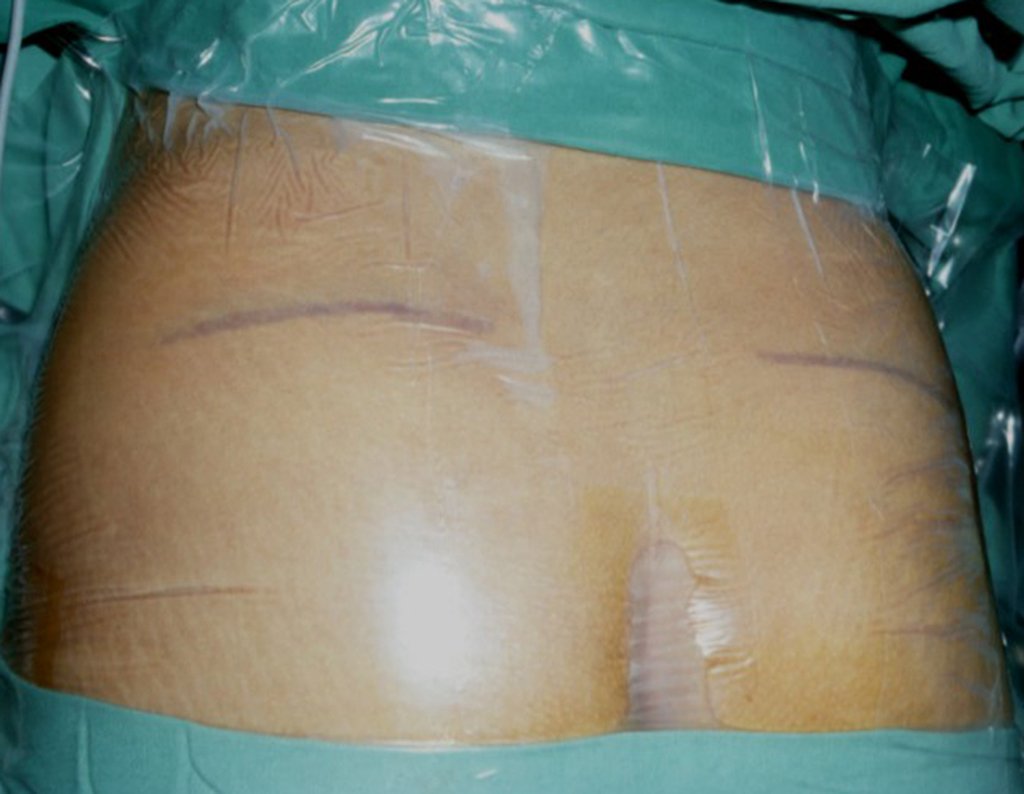
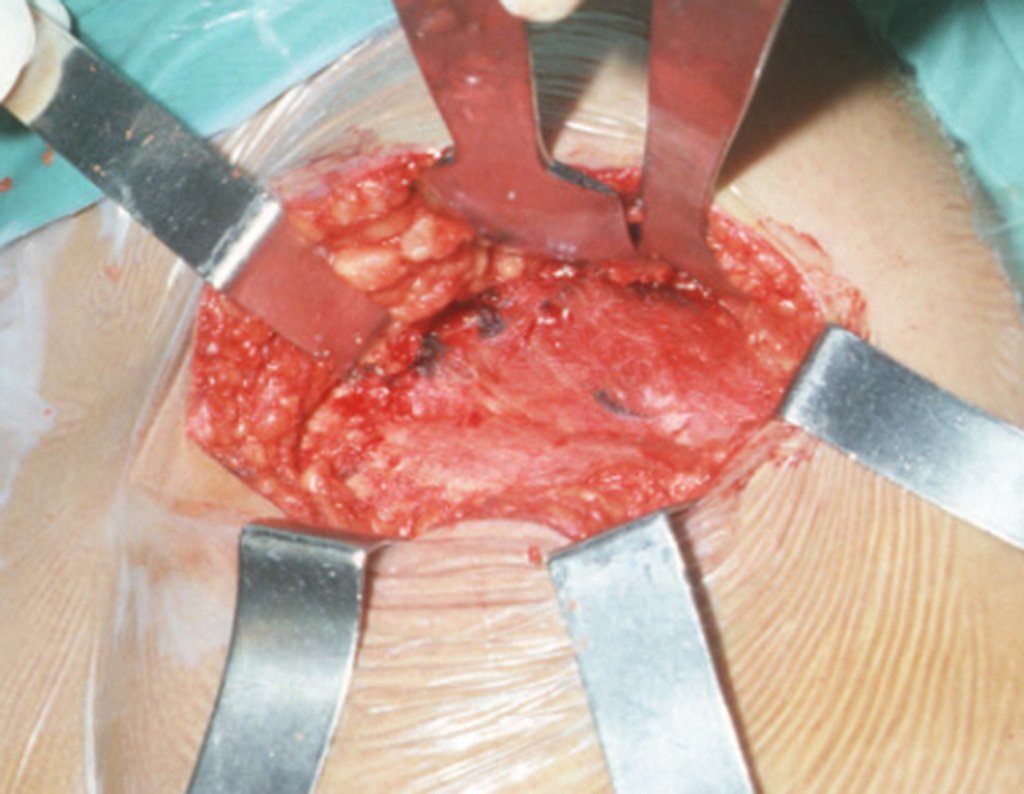
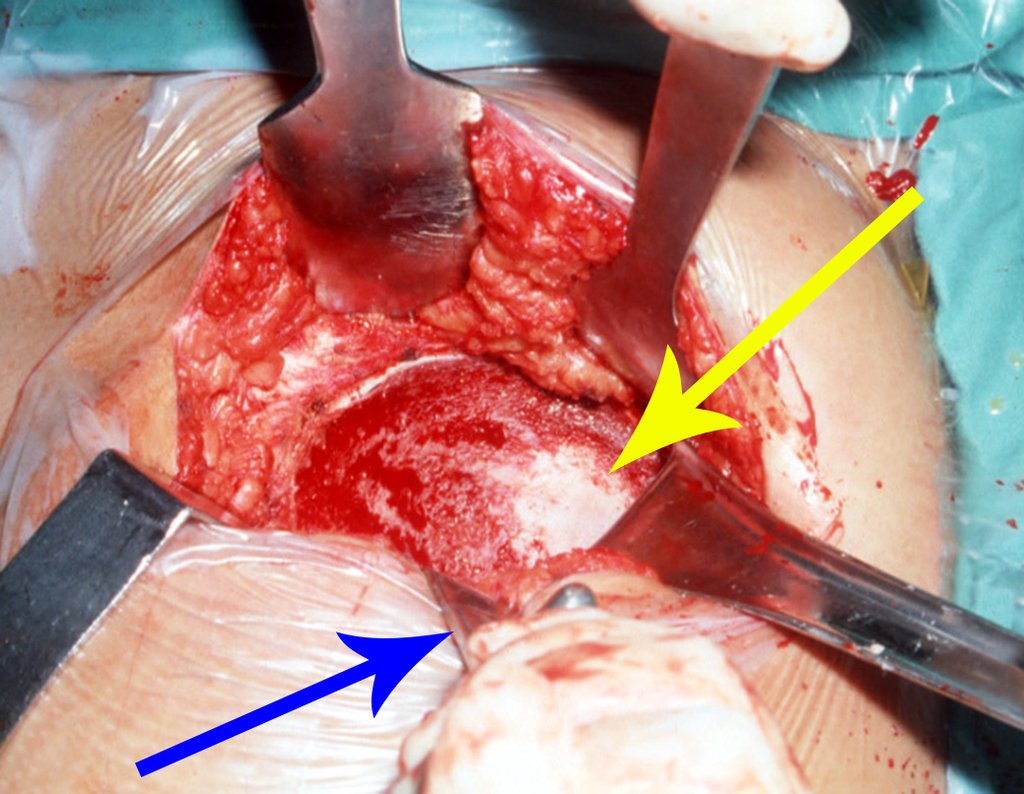
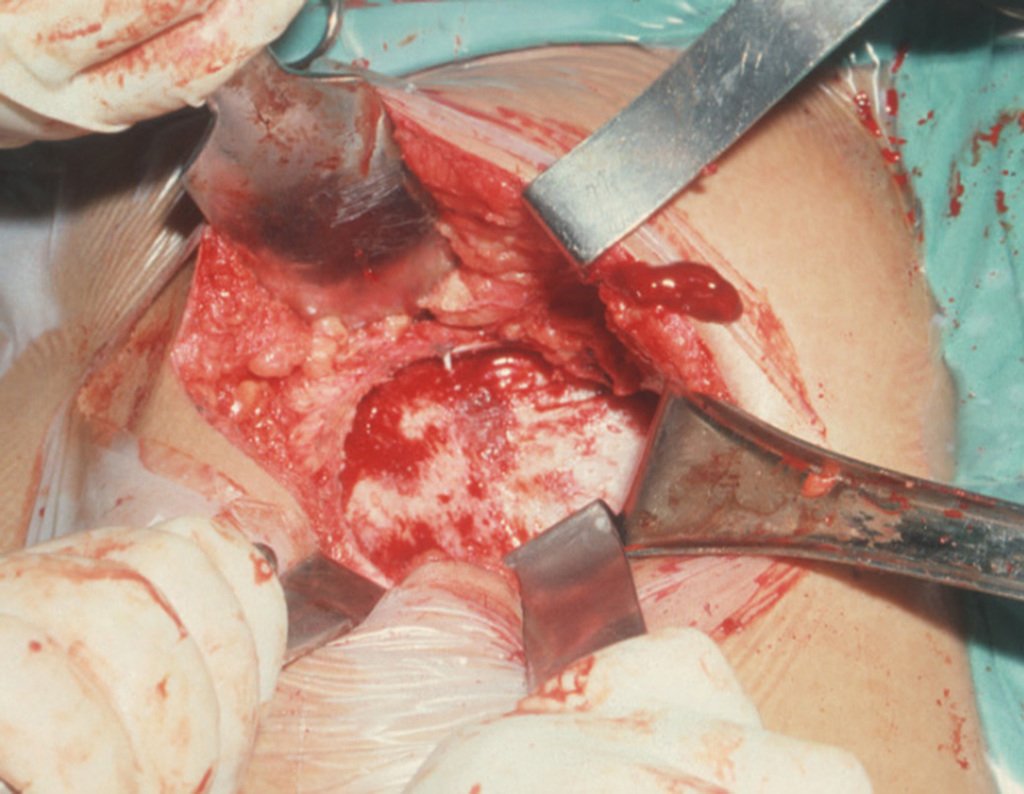
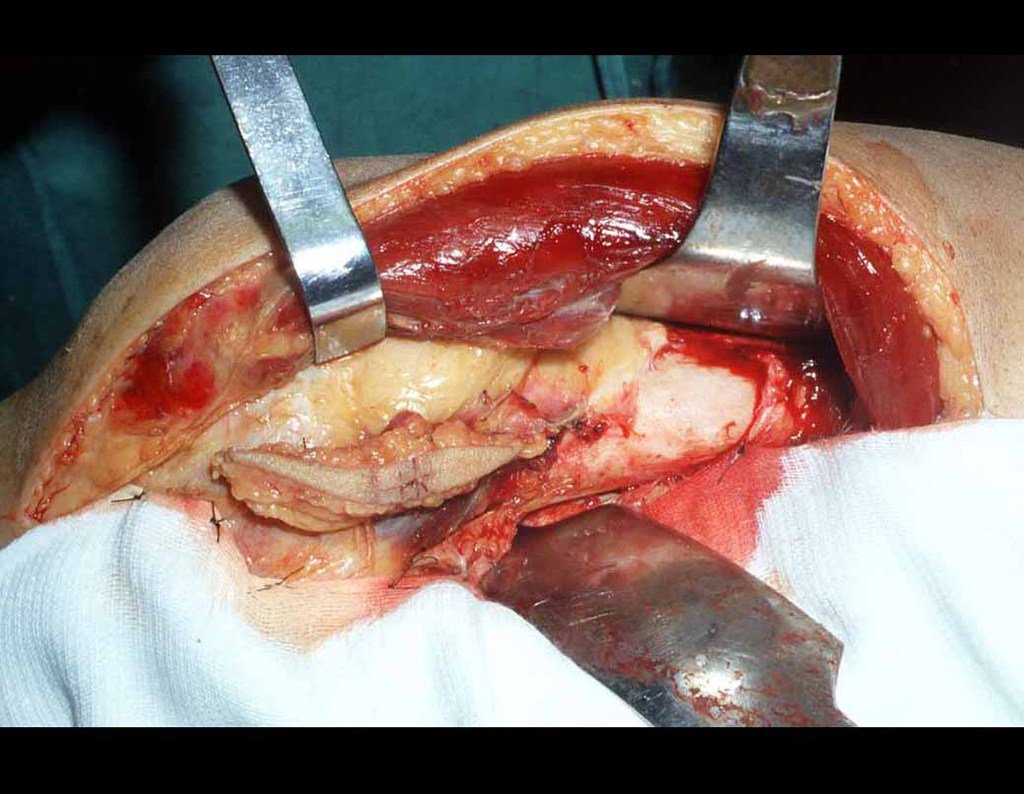
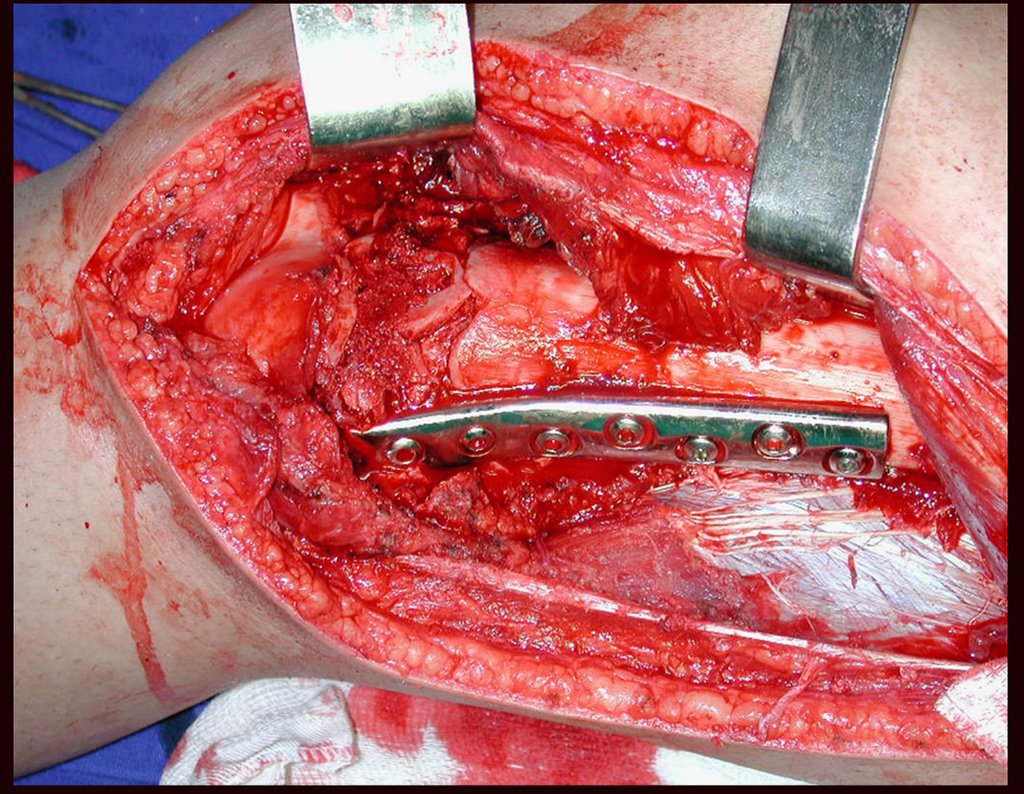
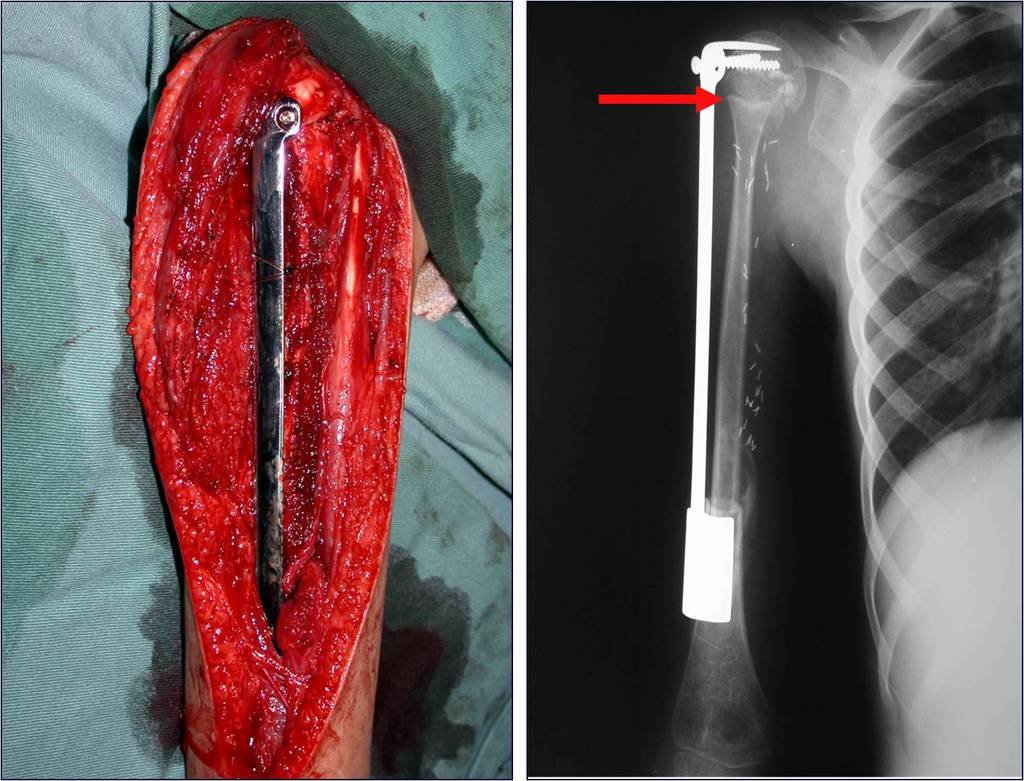
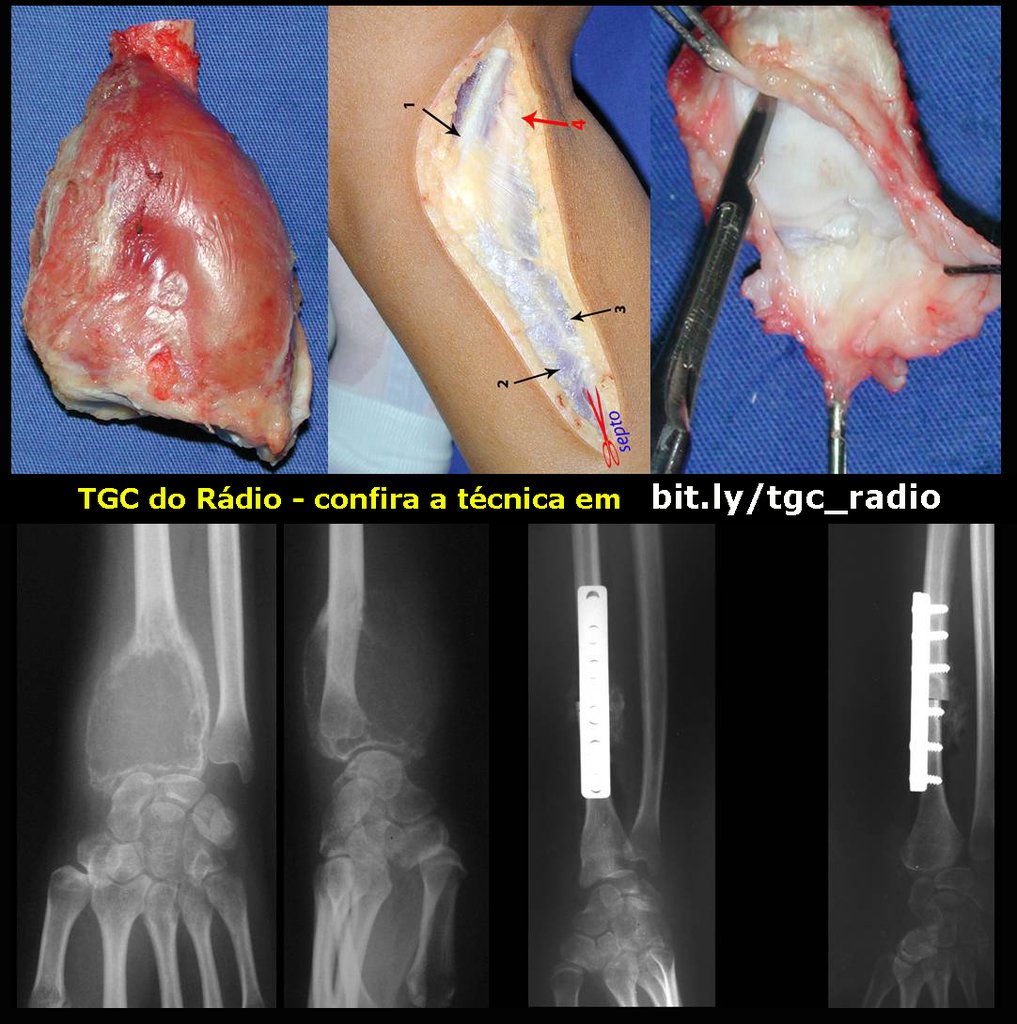
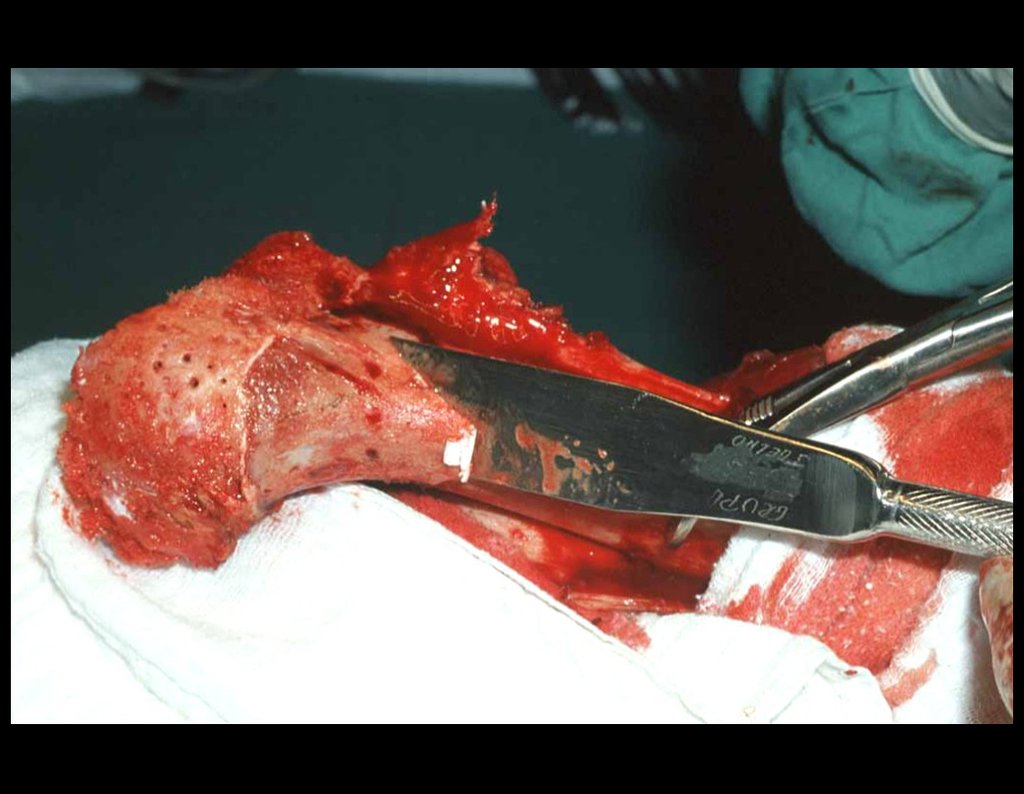
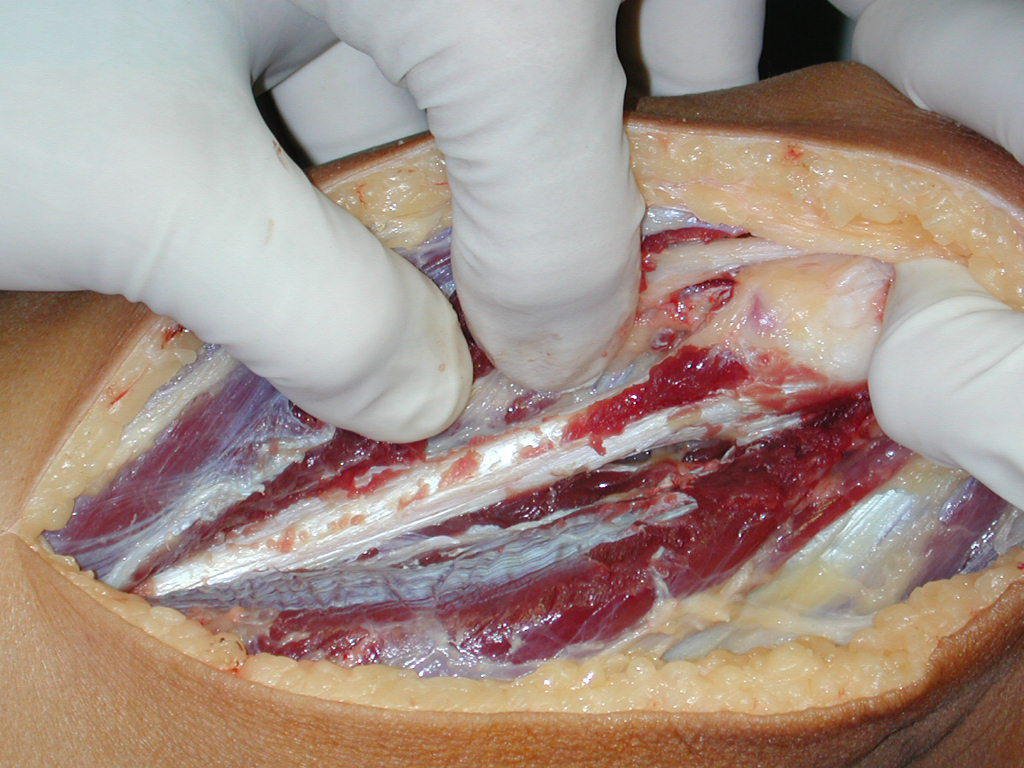
A cirurgia é realizada em decúbito dorsal horizontal, preferentemente sem uso de garroteamento do membro. Os detalhes da ressecção são mostrados nas figuras 38 a 57.
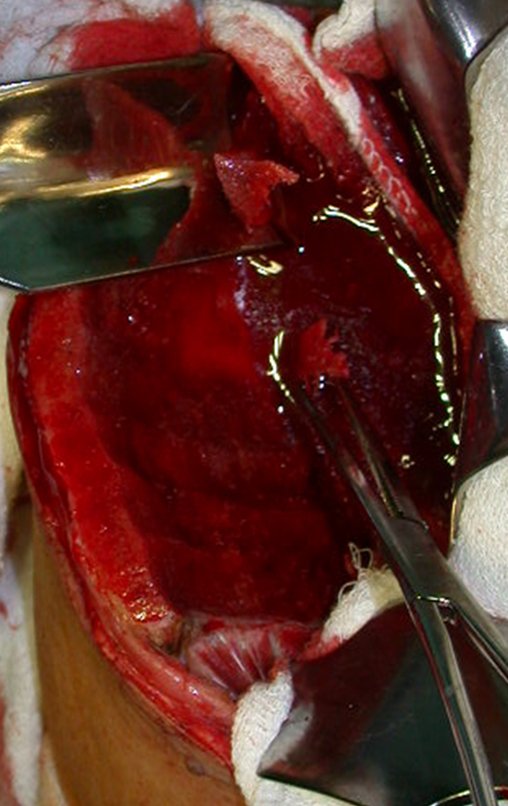
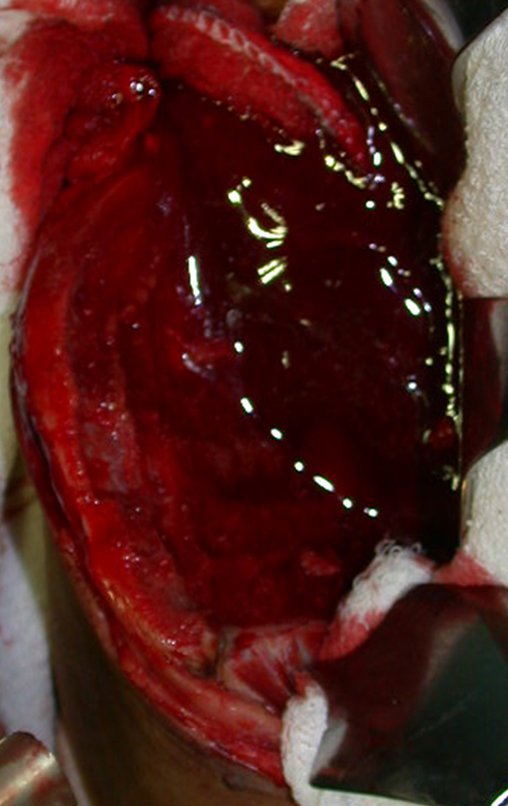
Após a ressecção do segmento distal do rádio e a revisão cuidadosa da hemostasia, colocamos compressa umedecida com soro fisiológico no leito cirúrgico, e enfaixamos temporariamente com faixa crepe.
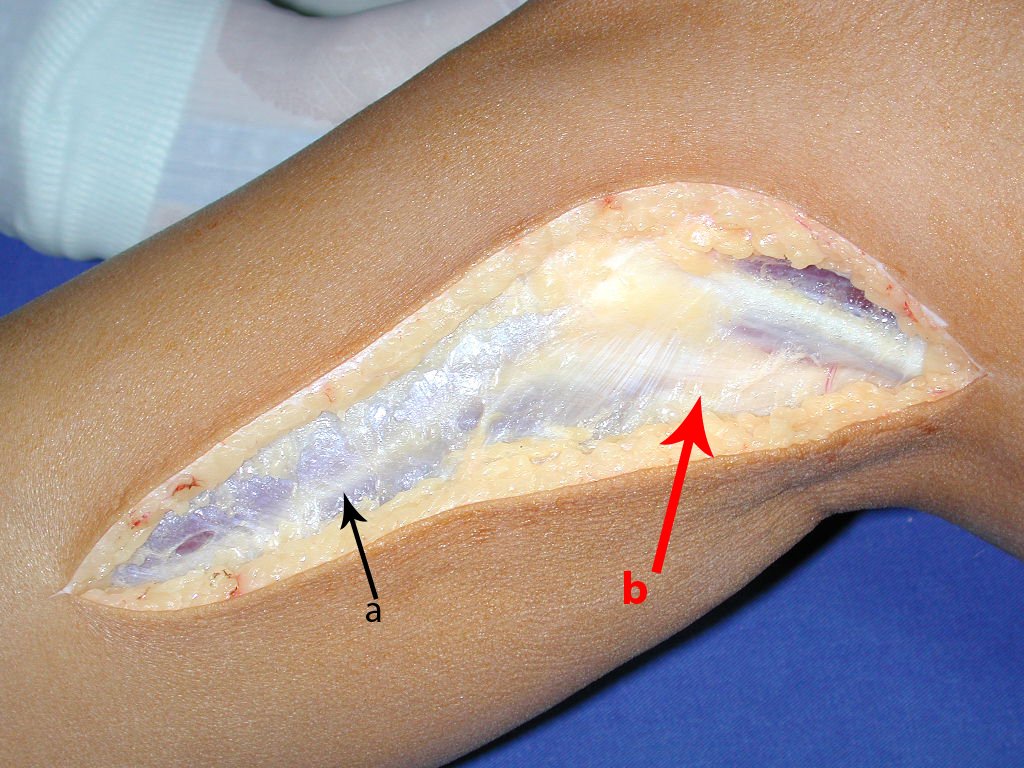
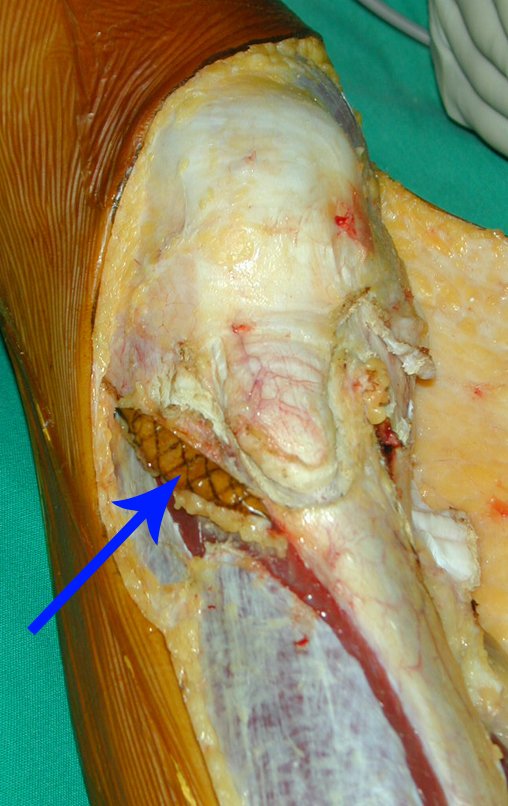
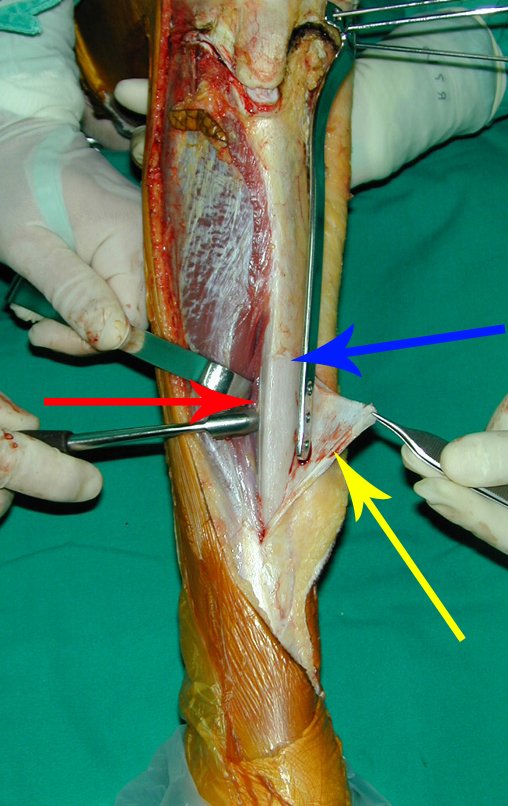
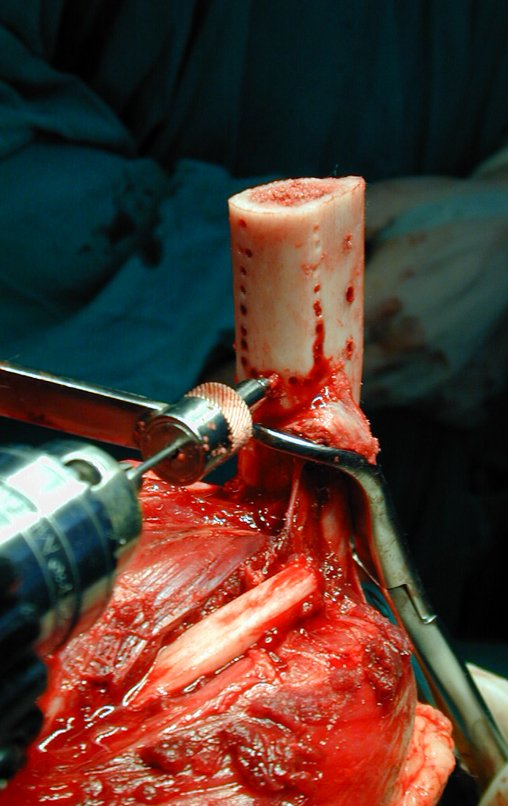
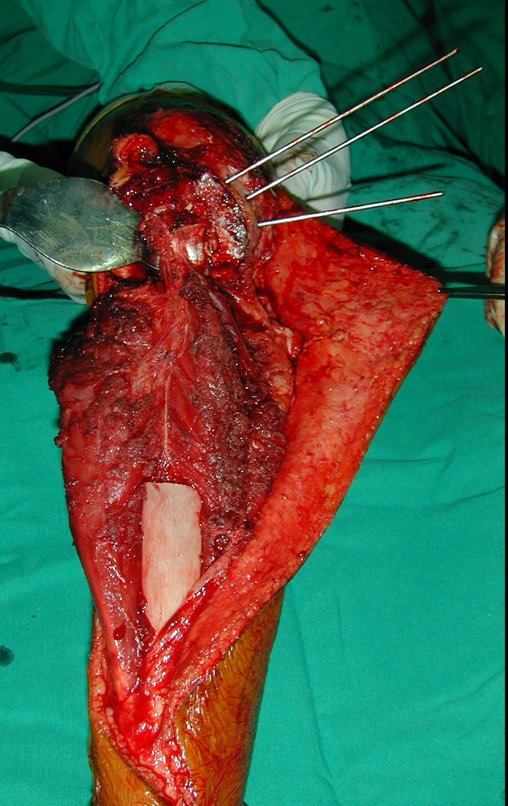
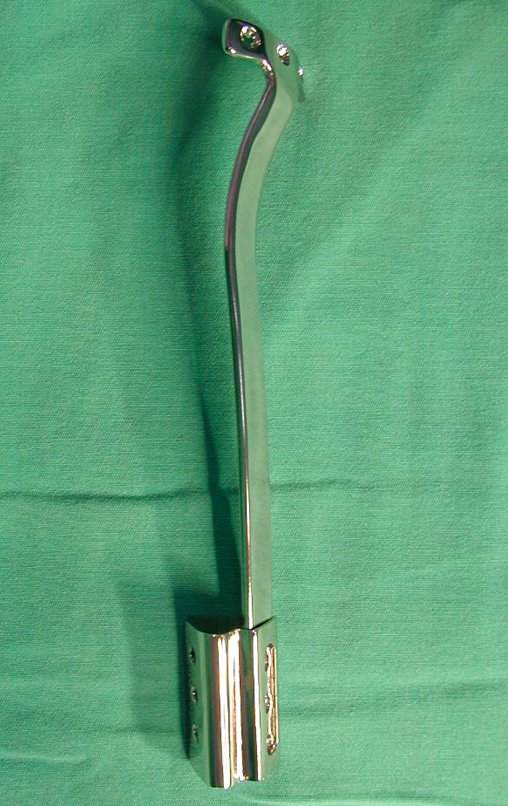
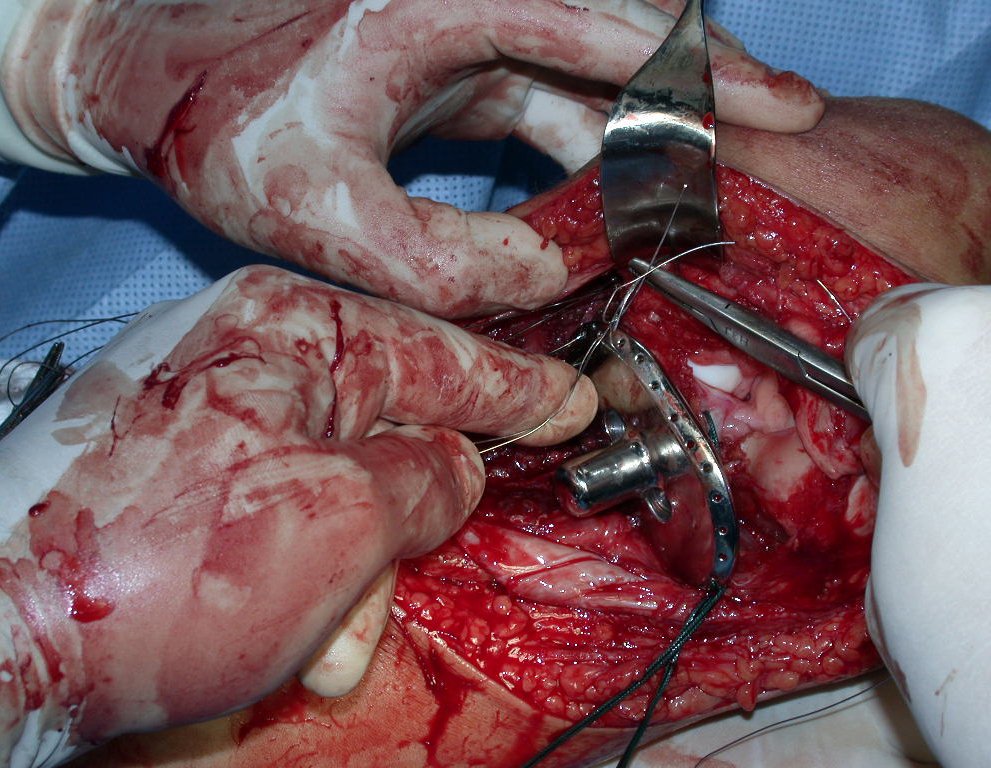
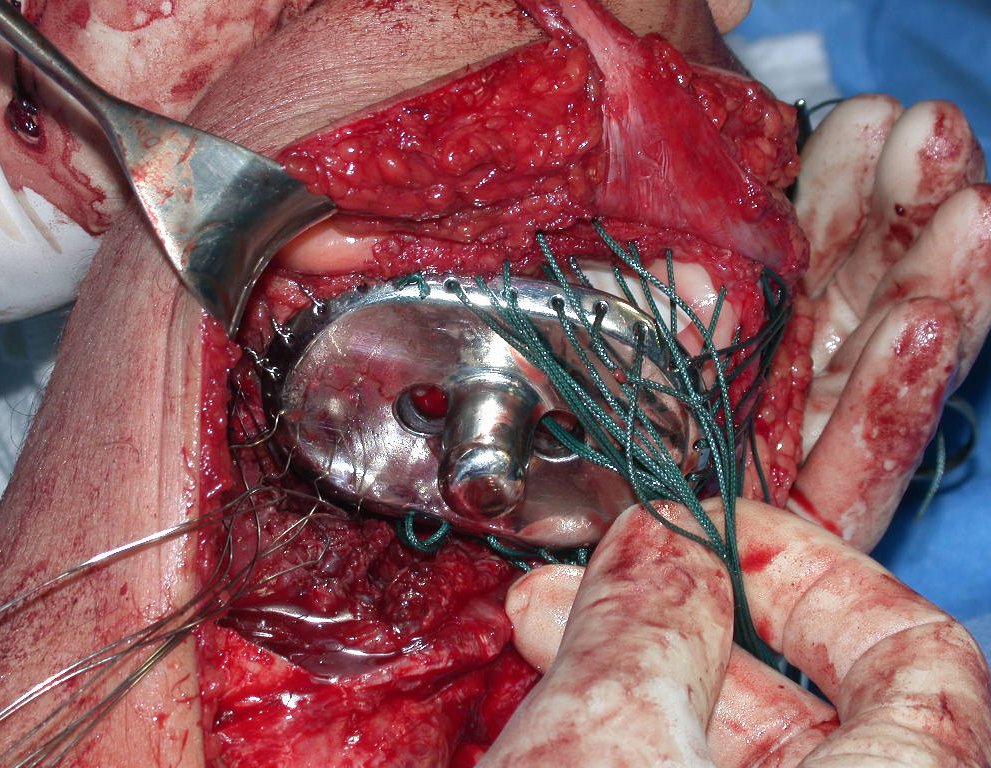
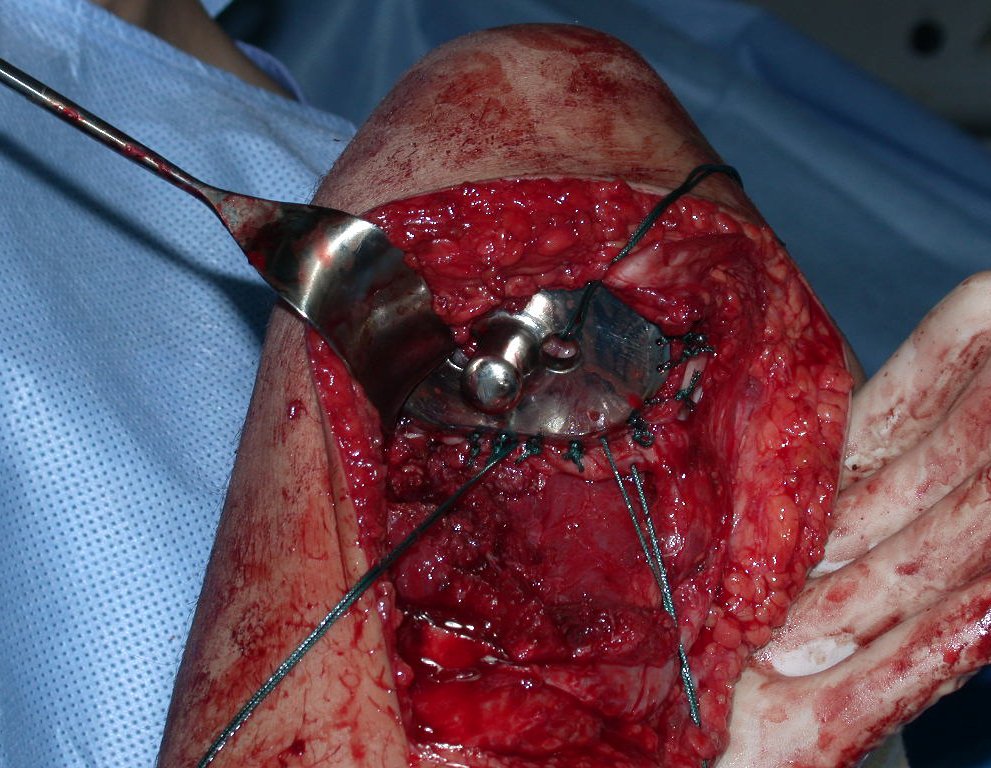
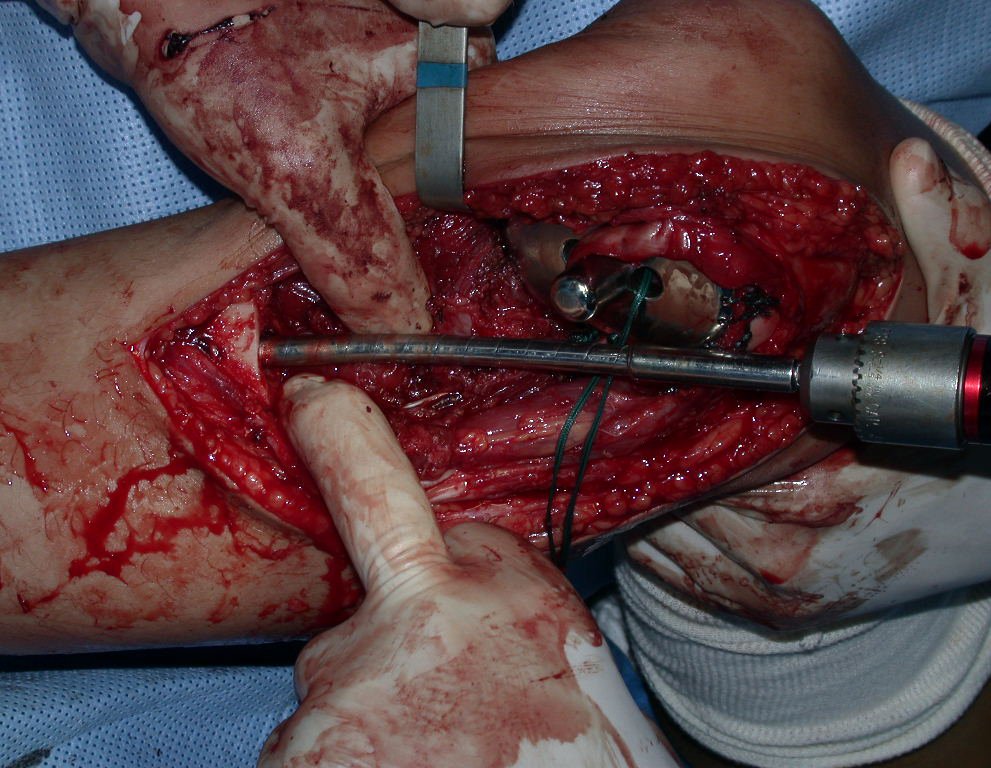
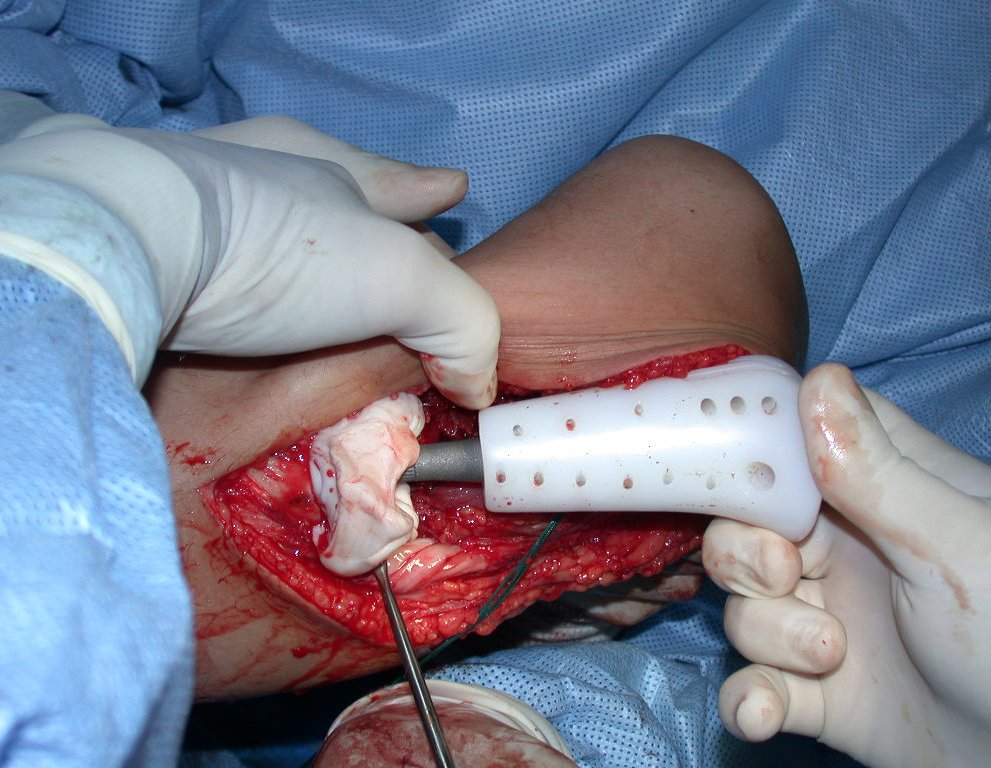
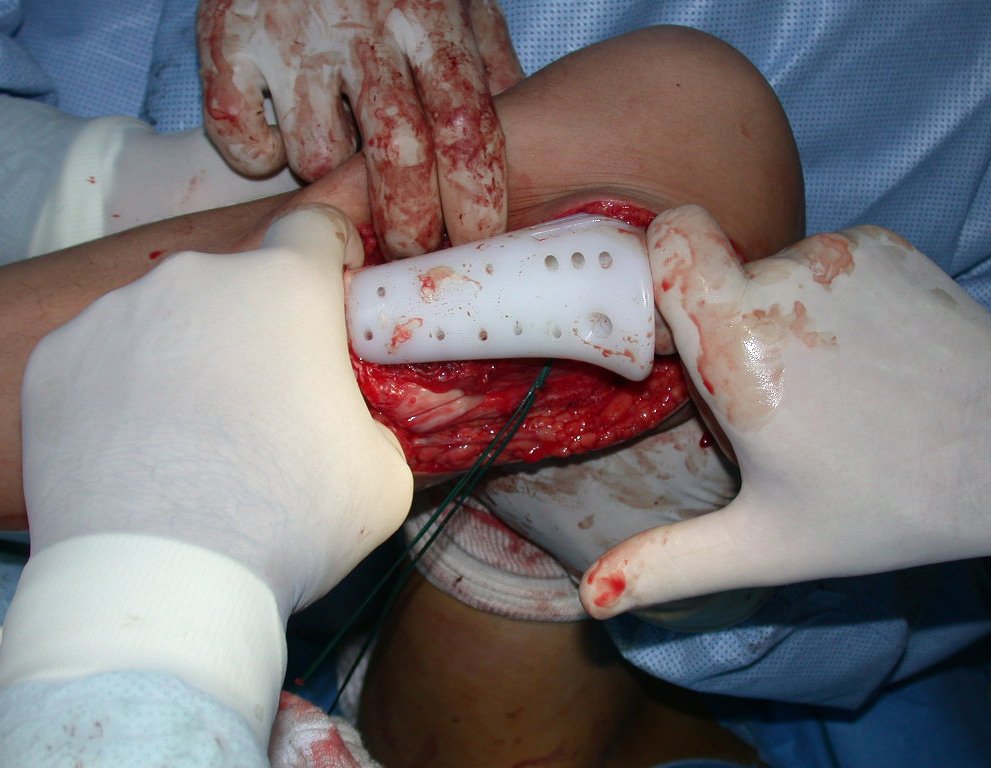
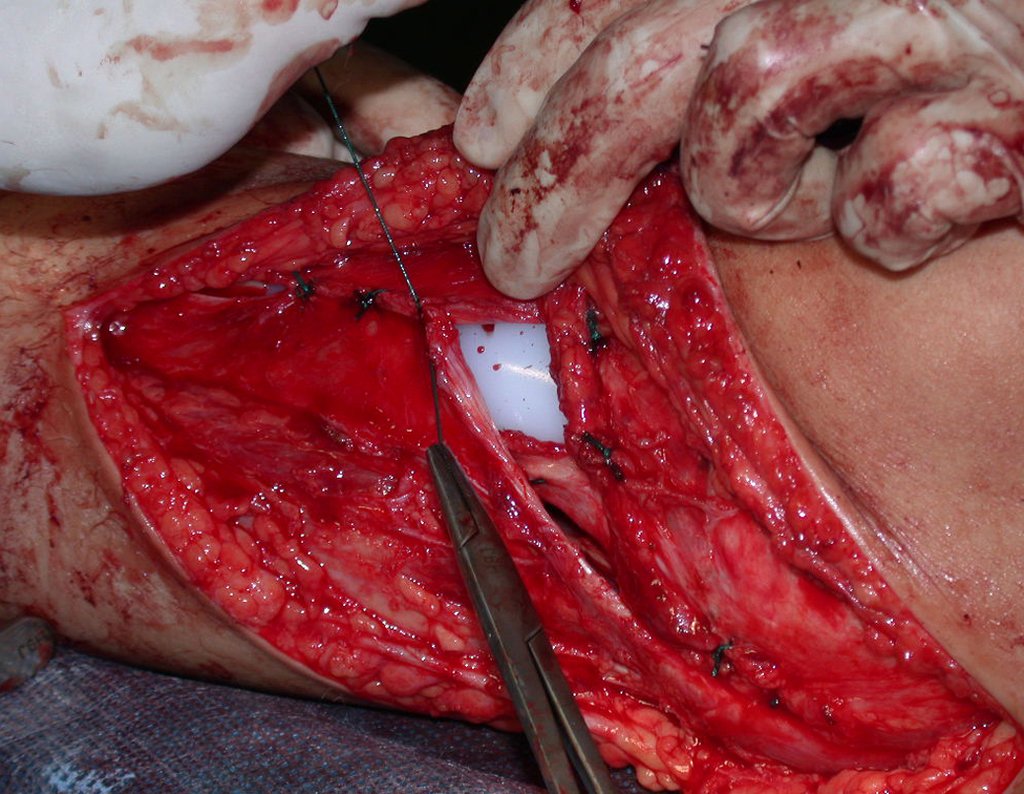
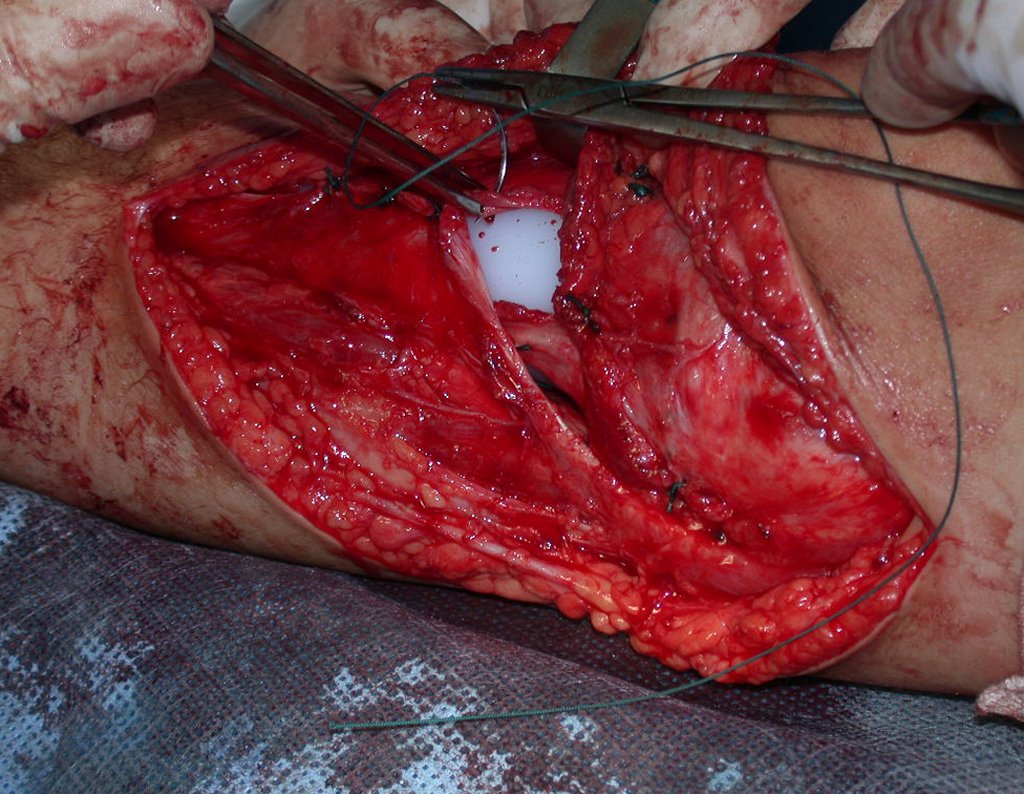
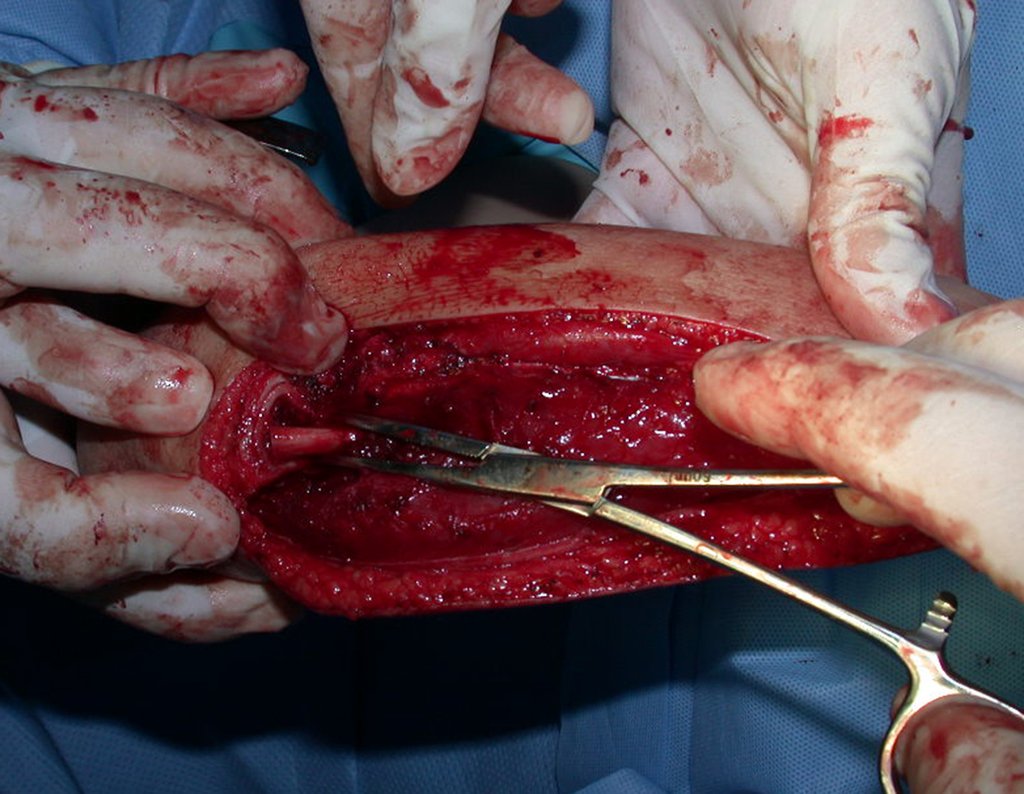
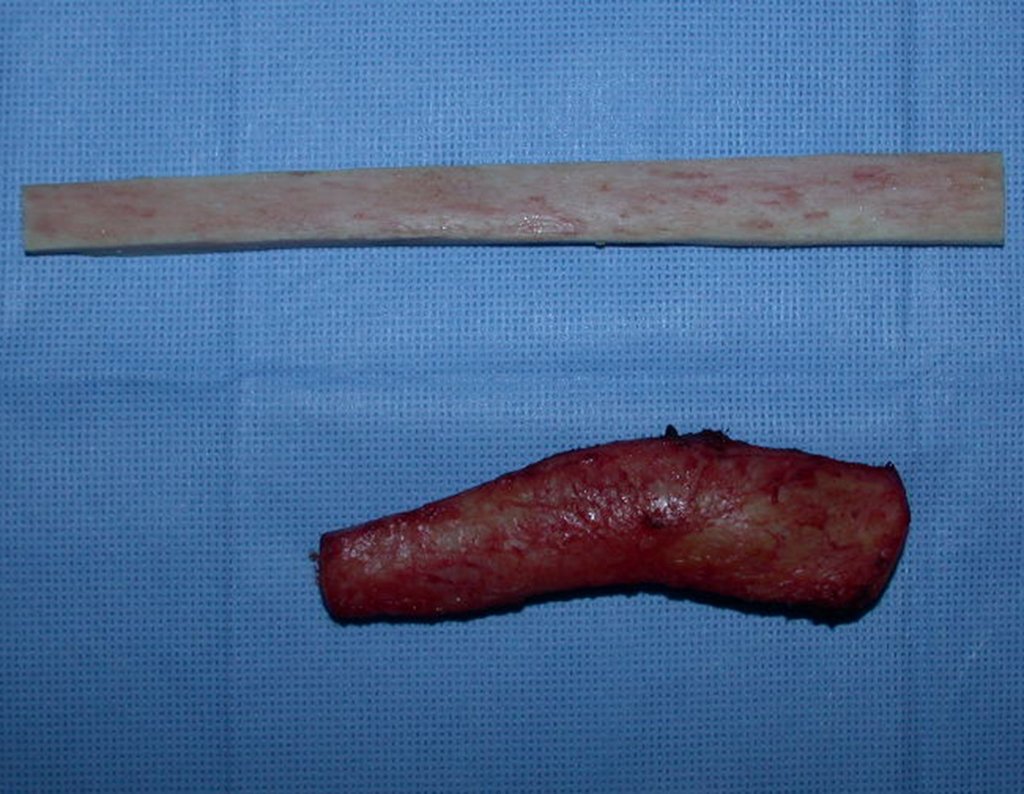
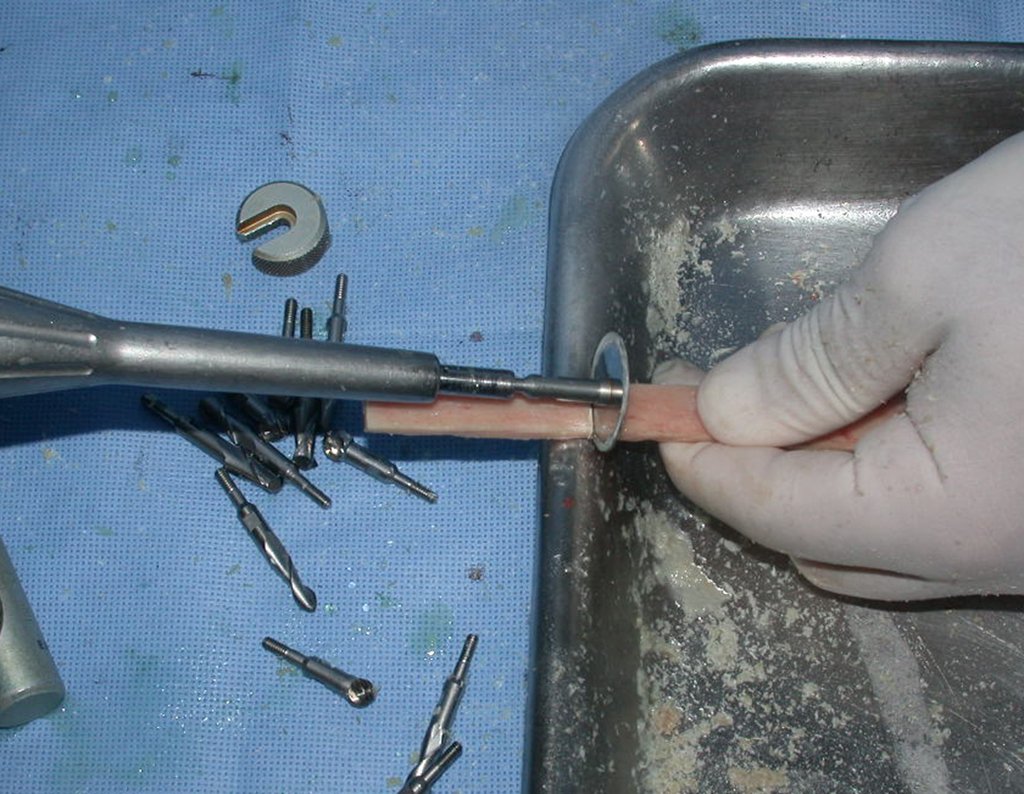
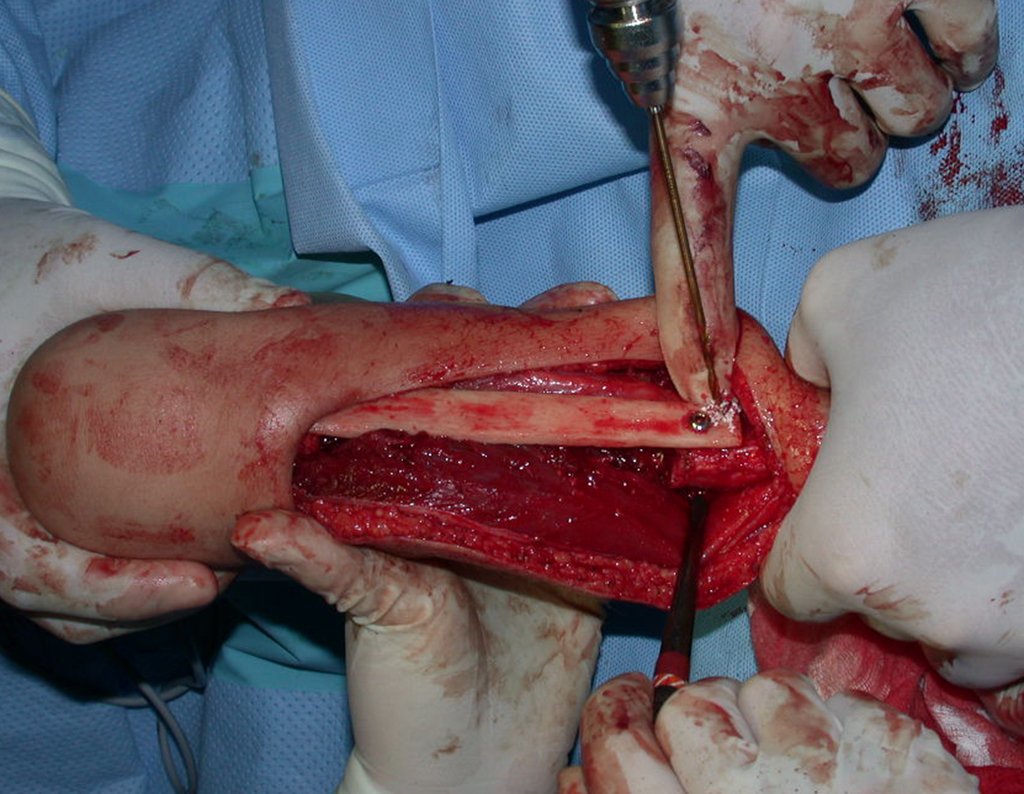
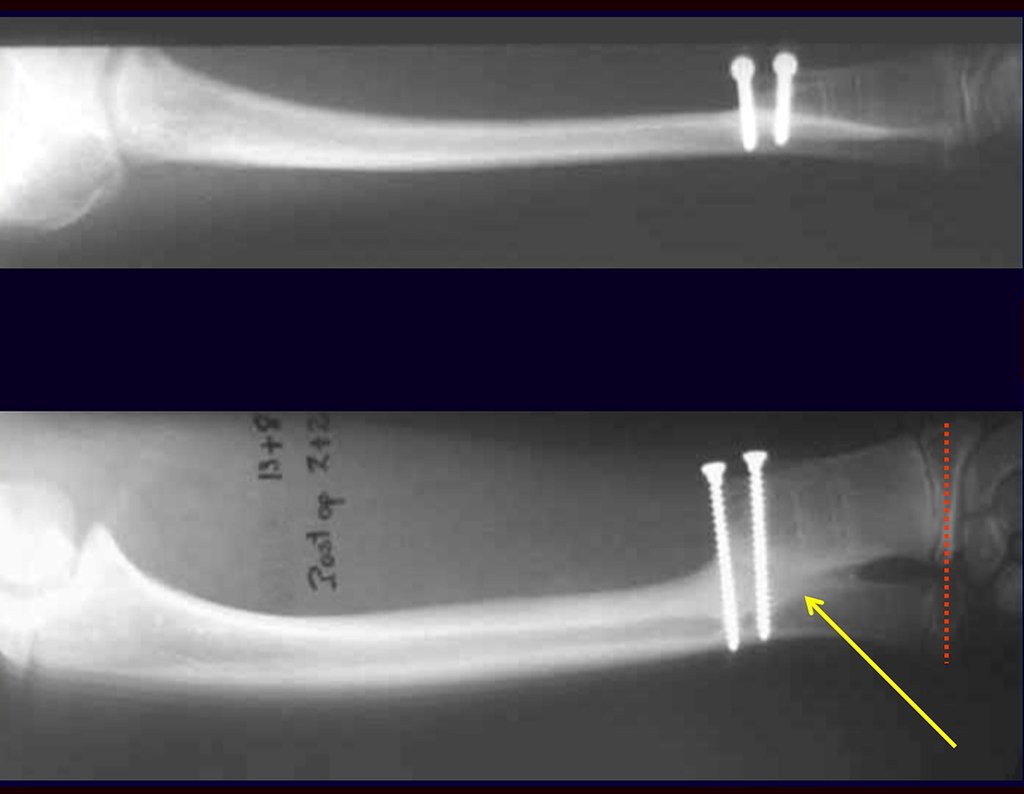
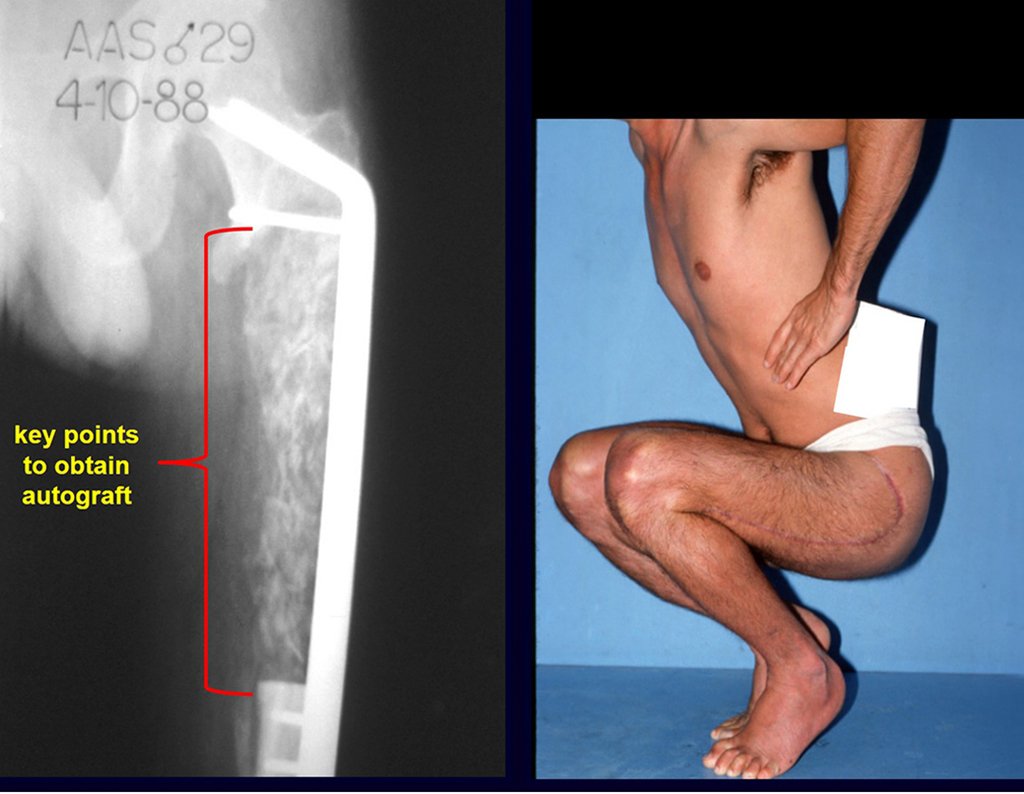
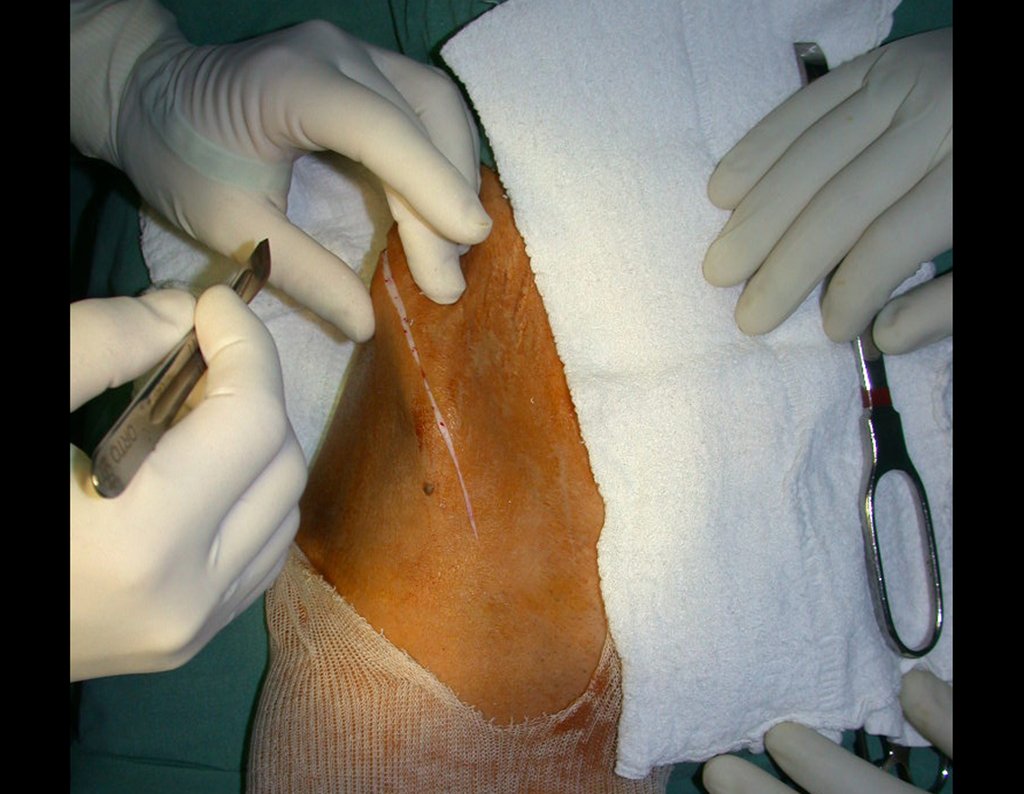
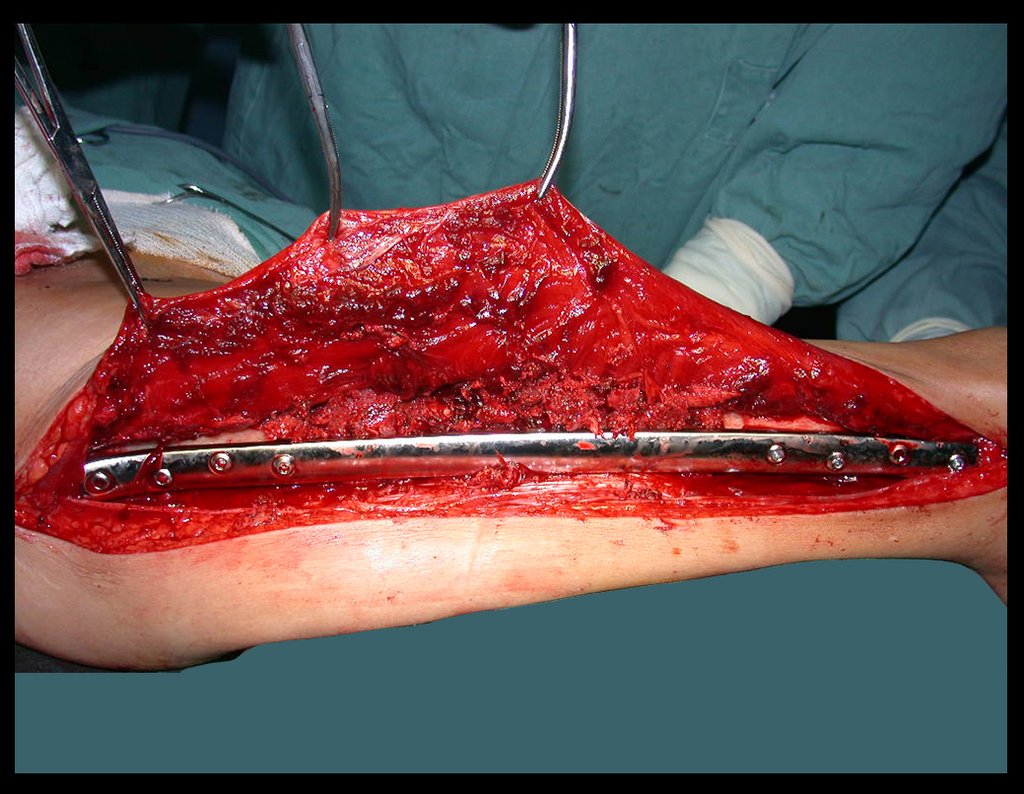
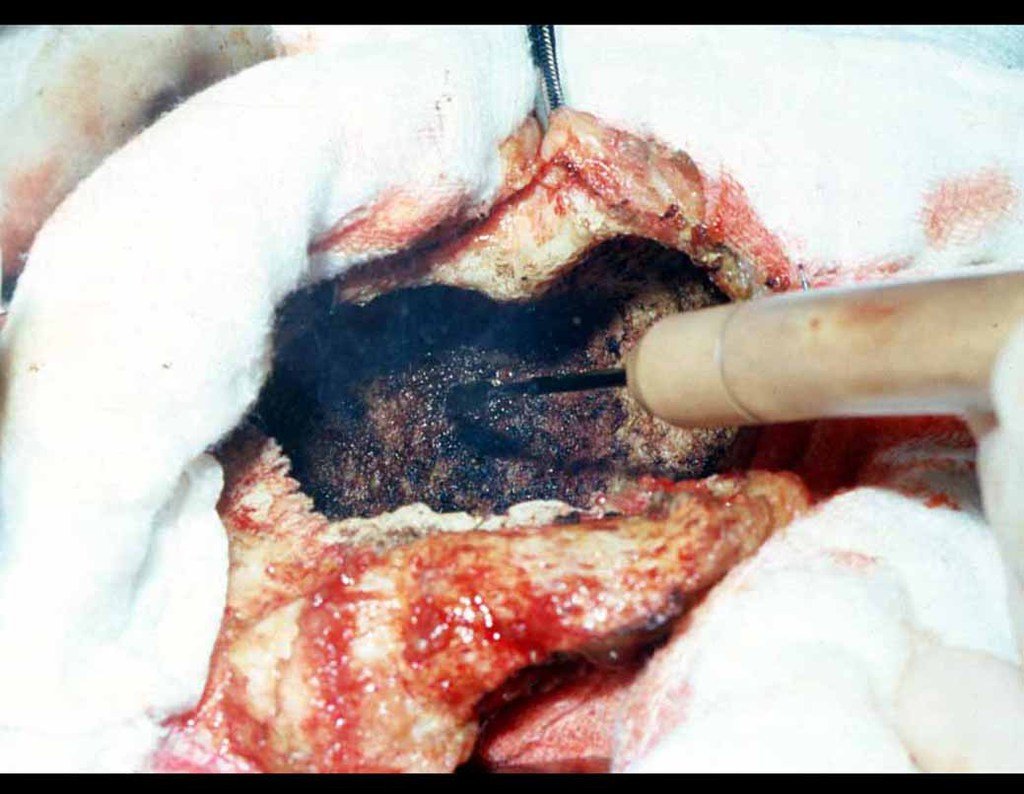
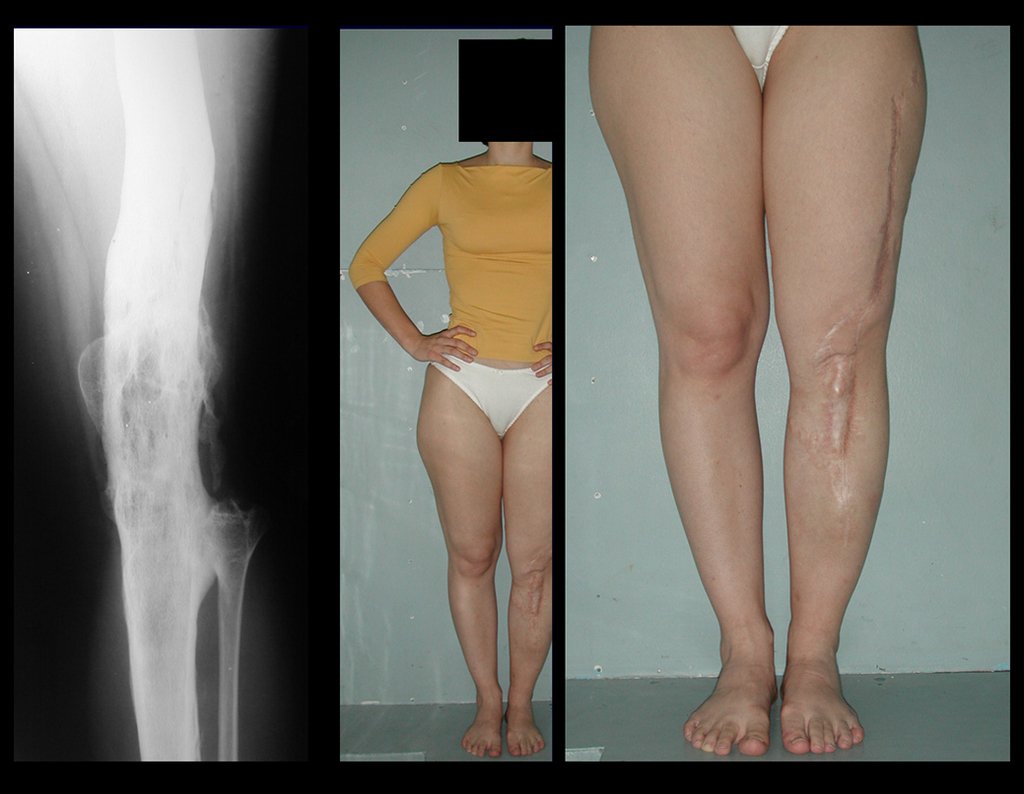
Passamos para a segunda etapa: A obtenção do enxerto autólogo, não vascularizado, obtido do segmento proximal da fíbula ipsilateral. É preferível utilizar o enxerto obtido do mesmo lado, pois a face lateral da fíbula e a tuberosidade de inserção do ligamento colateral lateral, mimetizam melhor a face dorsal do rádio do mesmo lado. Desta forma o ápice da fíbula substituirá a estiloide radial.
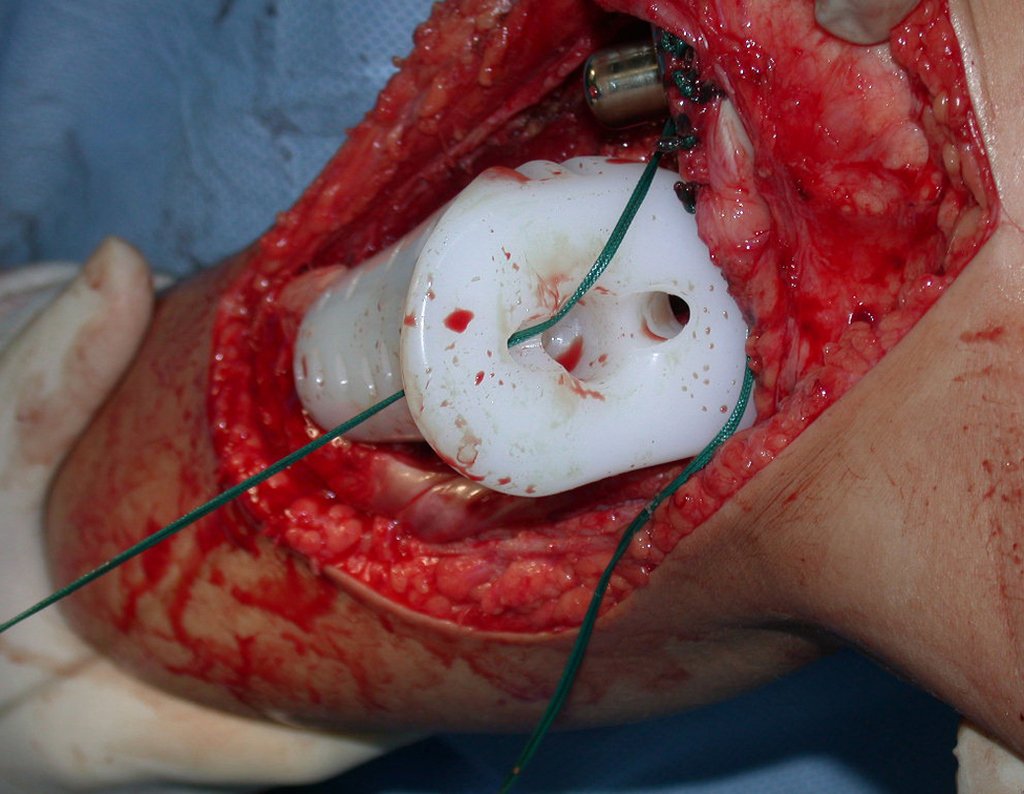
É importante obter este enxerto com cápsula articular, da articulação tíbio-fibular proximal, em toda a circunferência da epífise fibular.
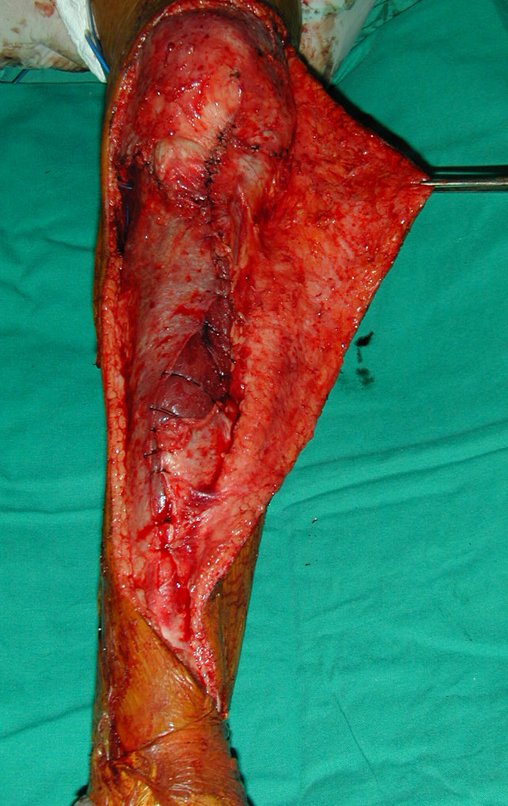
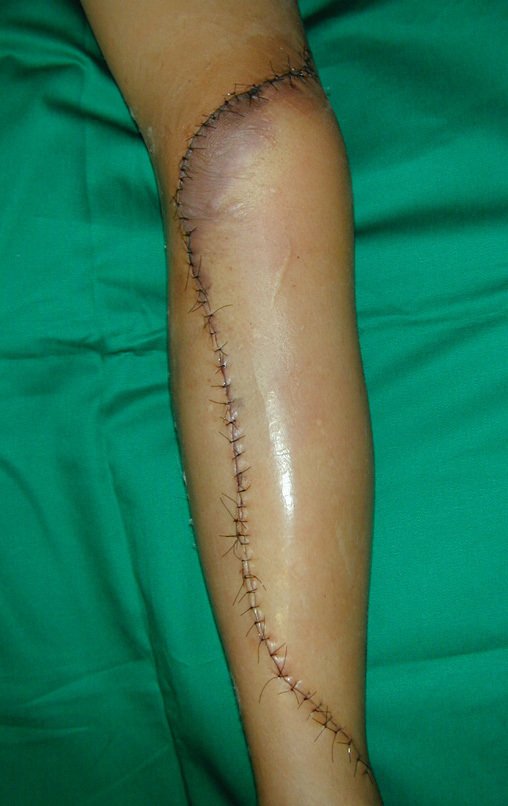
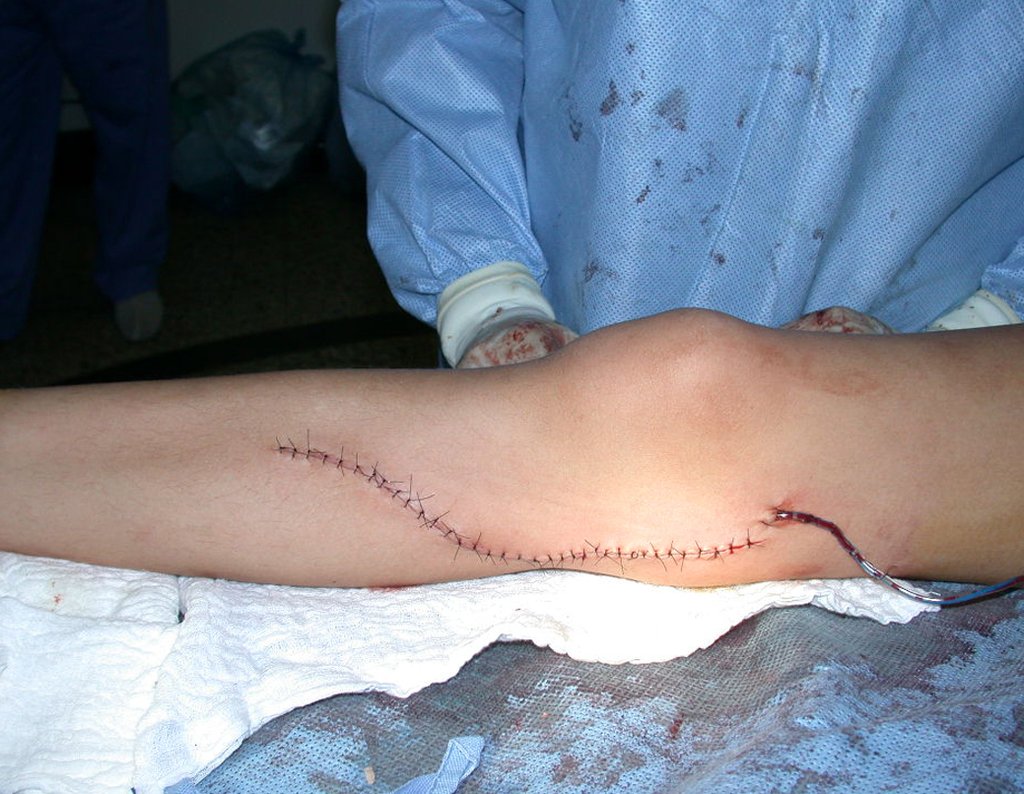
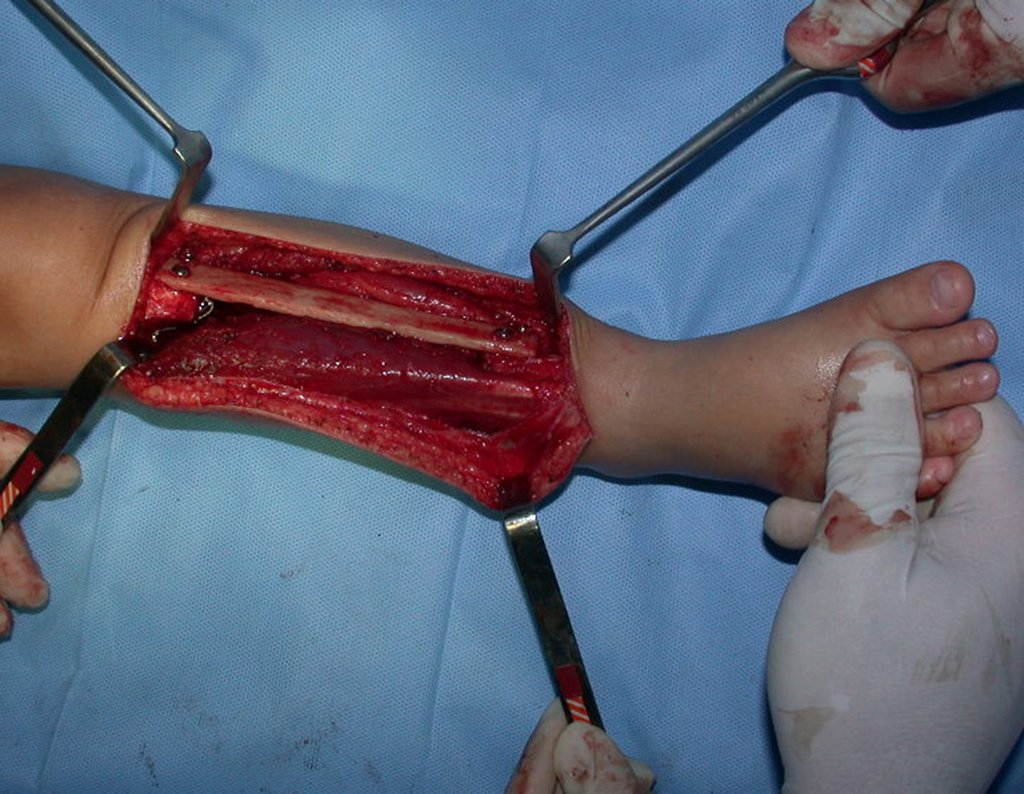
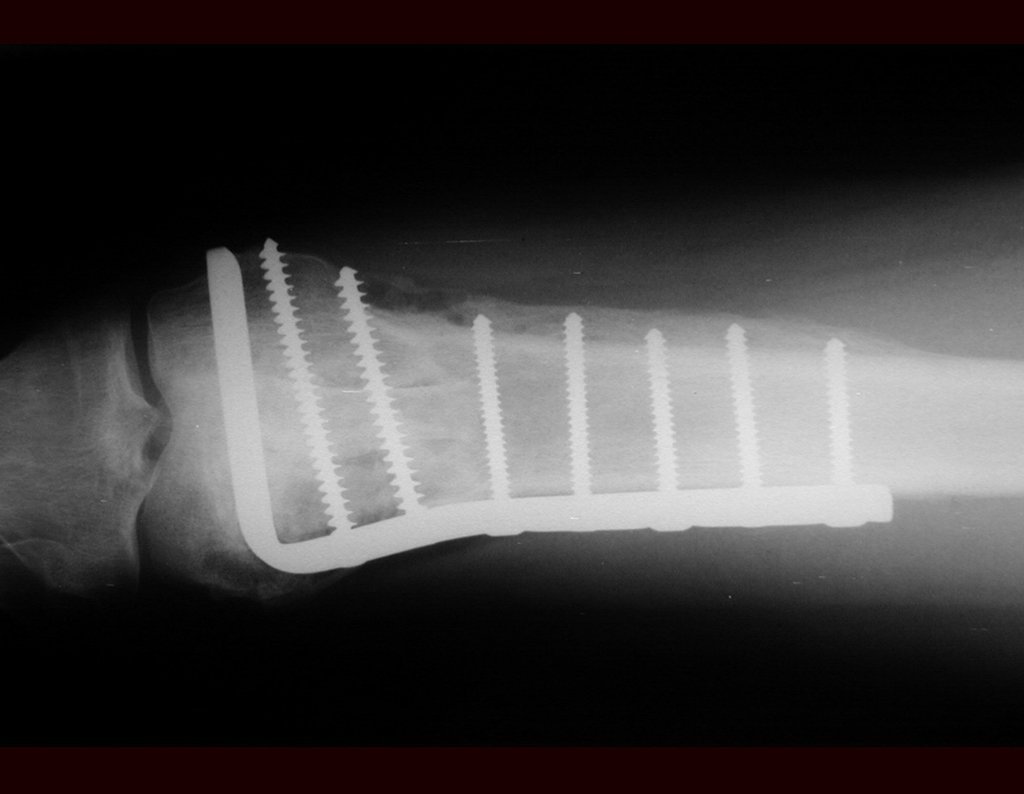
Desta maneira teremos tecidos moles para a reconstrução circunferencial da neo articulação fibulo-carpal. A seguir, detalhamos a obtenção do enxerto da fíbula (Figuras 58 a 75).
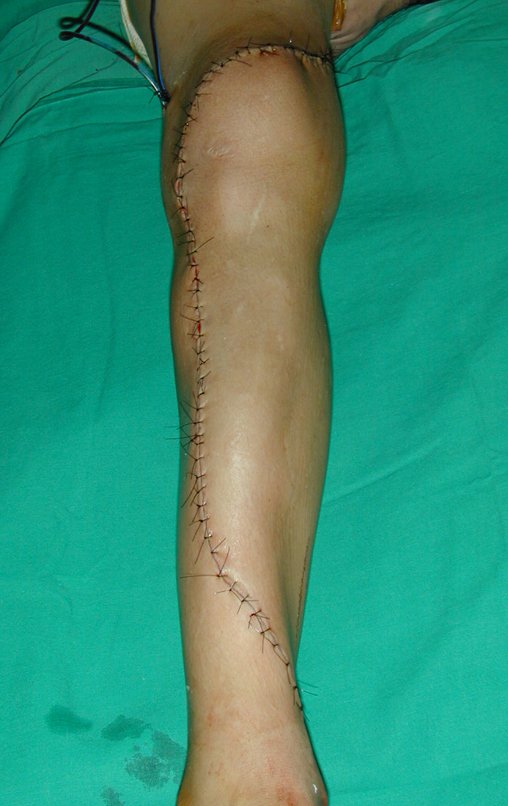
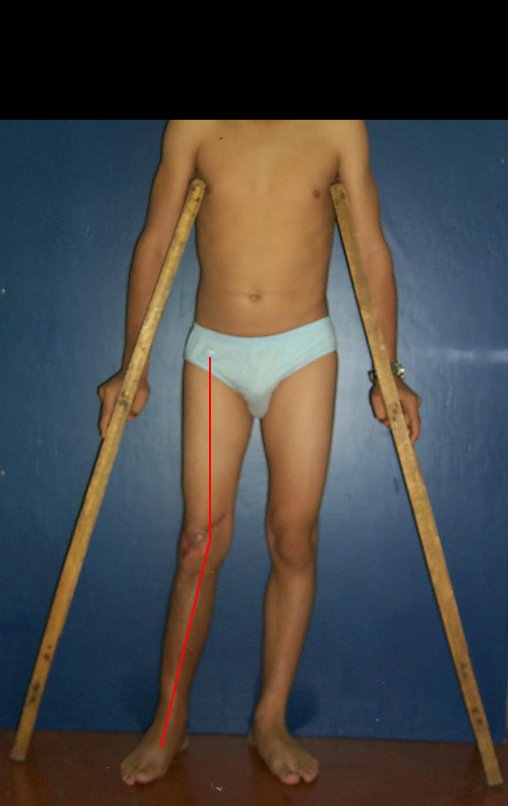
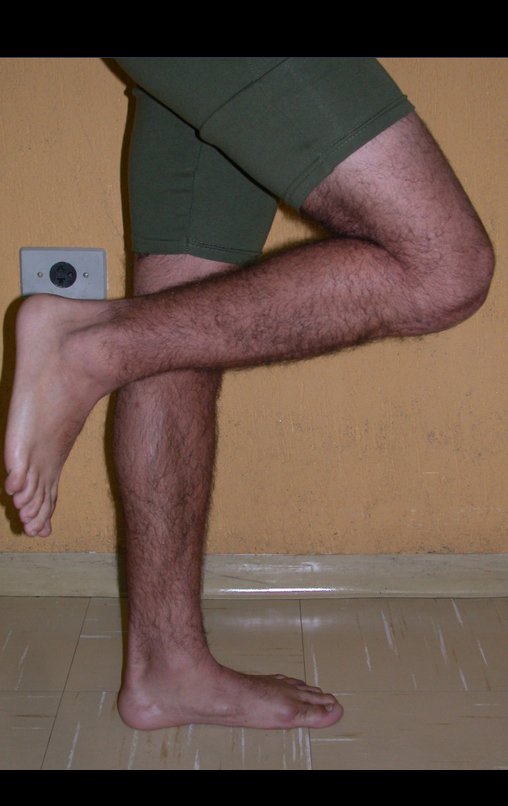
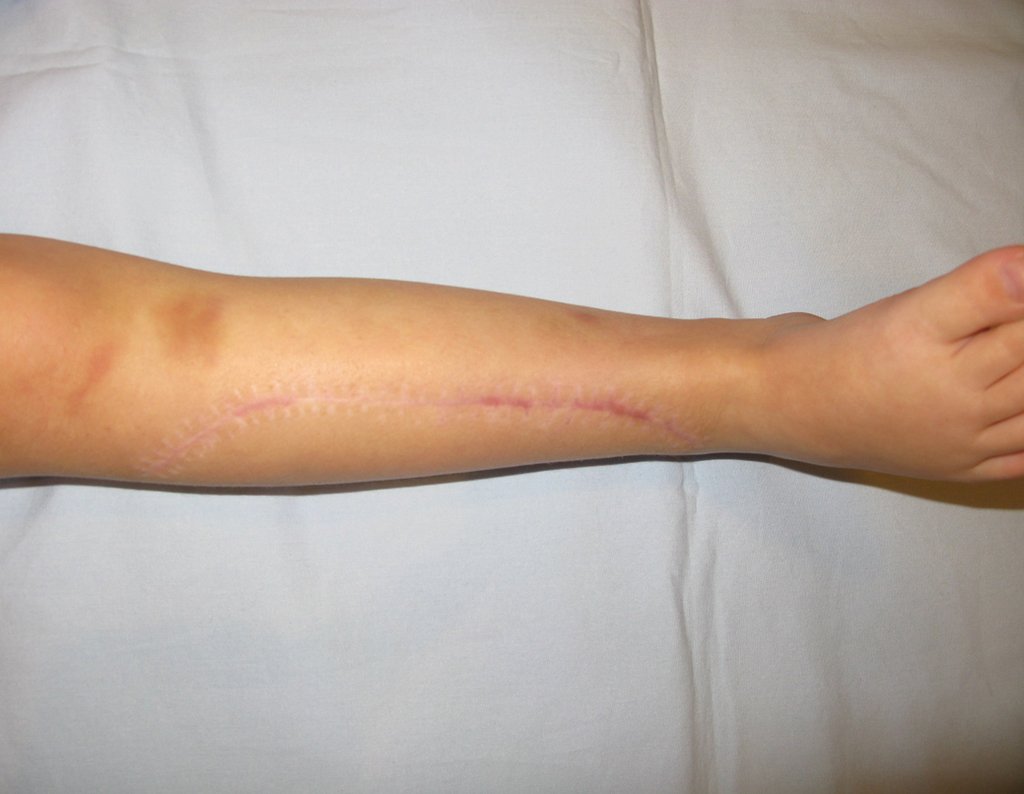
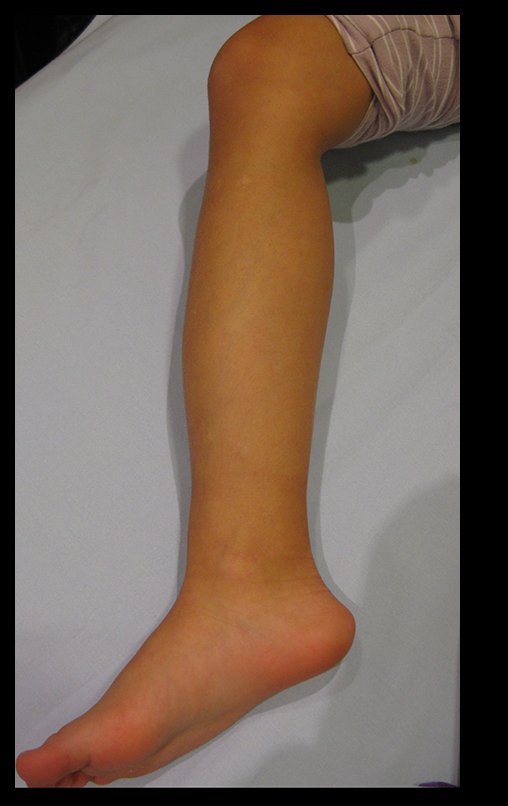
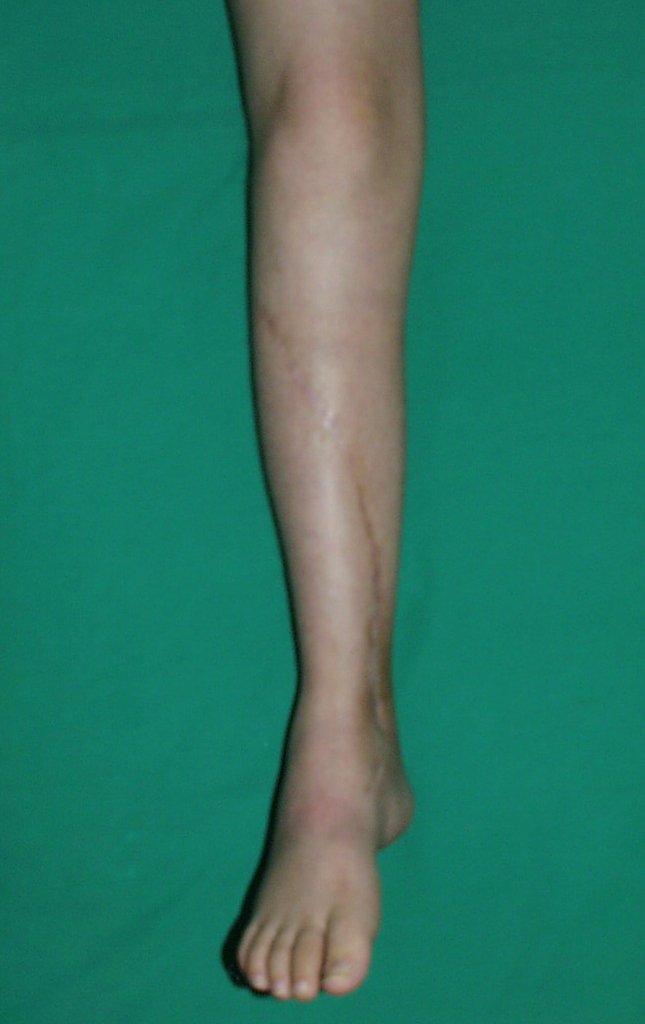
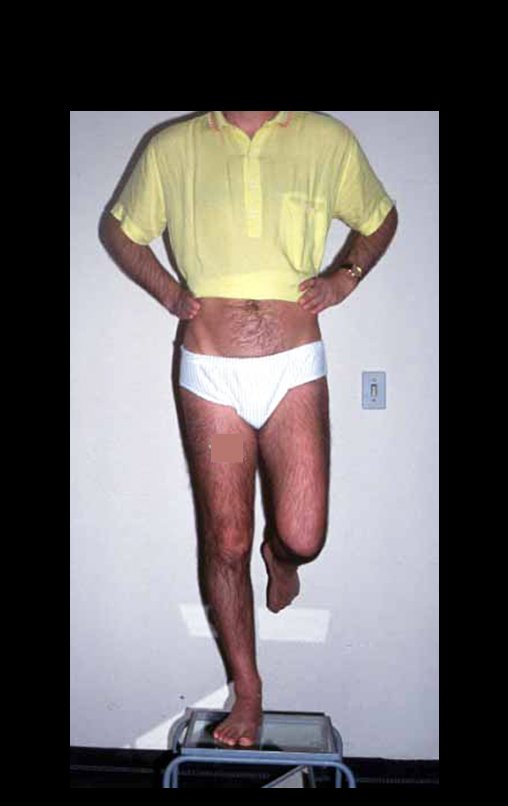
Vídeo 1: Supinação e pronação ativa e simétrica dos punhos, seis meses após a cirurgia. Boa função.
Vídeo 2: Flexão e extensão ativa e simétrica dos dedos, após seis meses. Boa função.
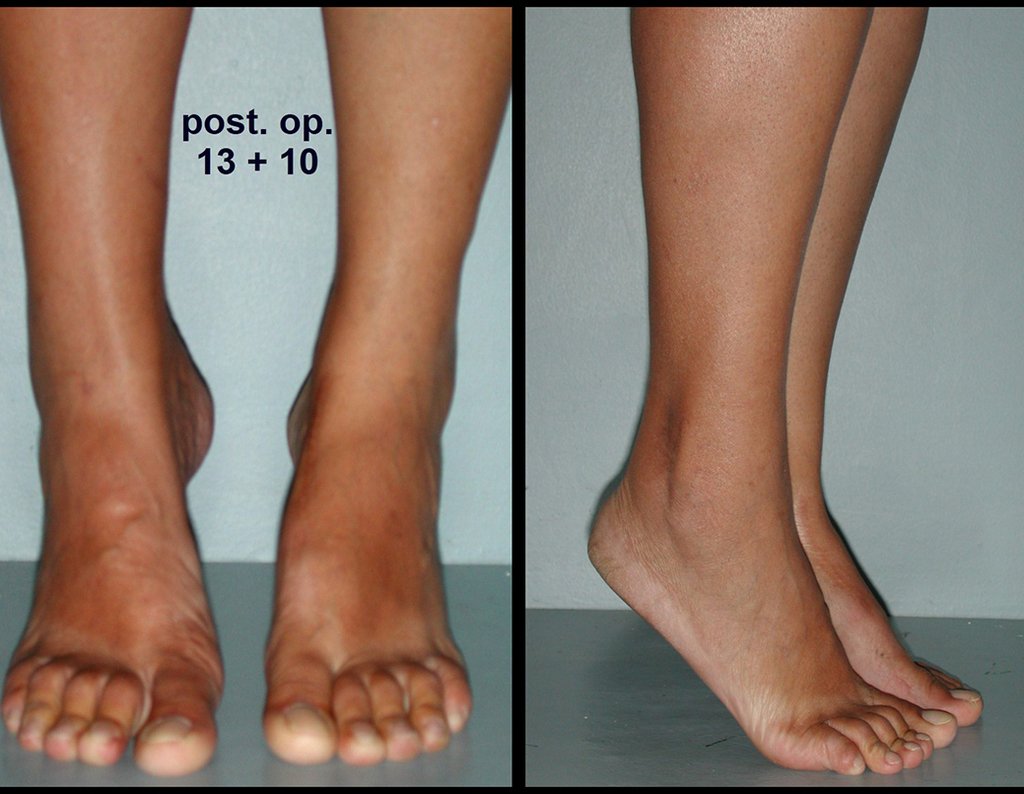
Vídeo 3: Pronação e supinação simétrica, após quinze anos da cirurgia.
Vídeo 4: Flexão e extensão em 29 de setembro de 2015, após quinze anos de pós-operatório.
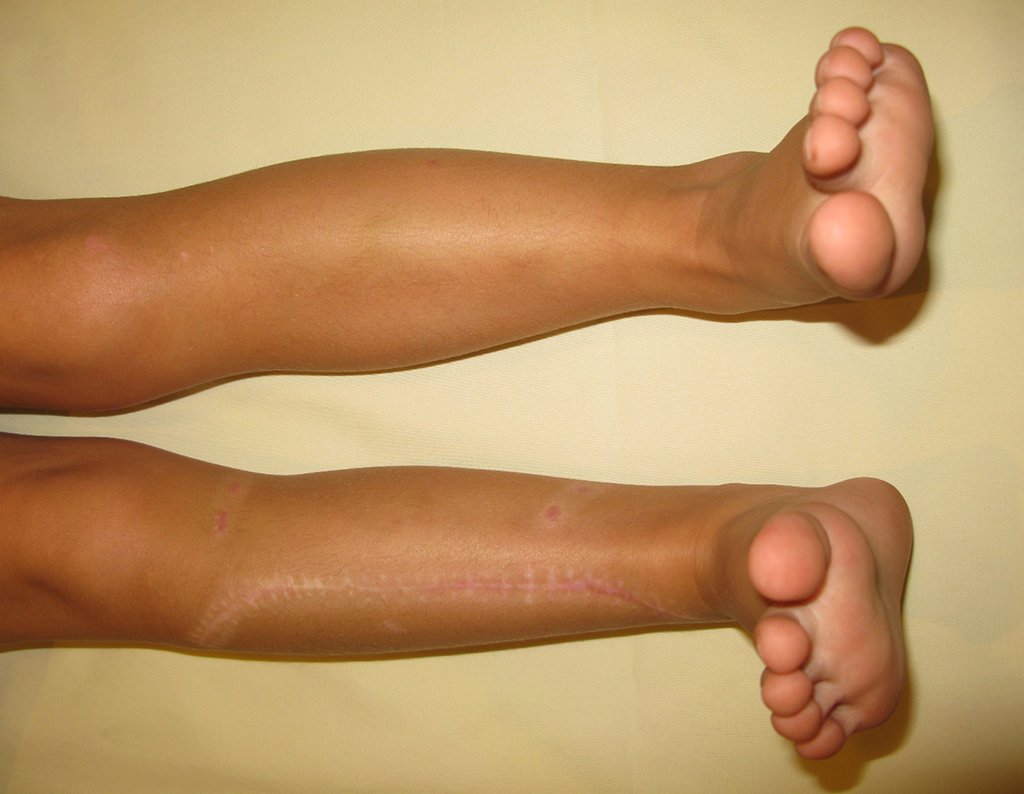
Vídeo 5: Atitude indiferente e espontânea dos punhos. Boa simetria e função em 29/15/2015. Pós-operatório de quinze anos.
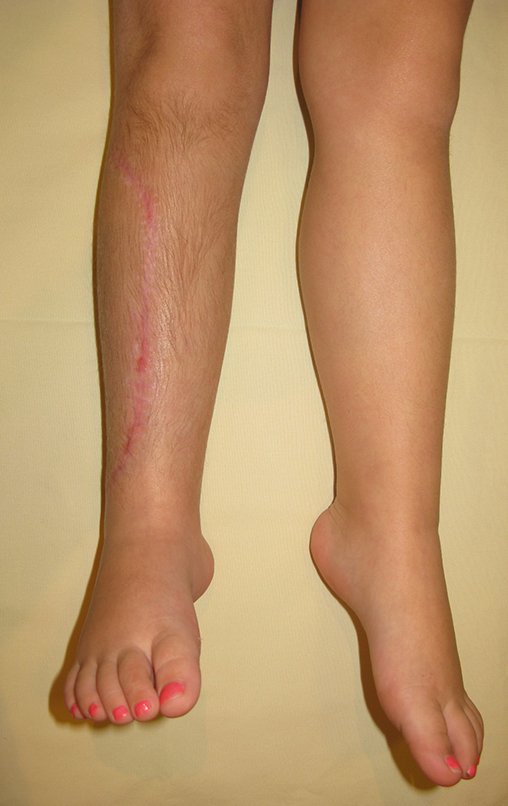
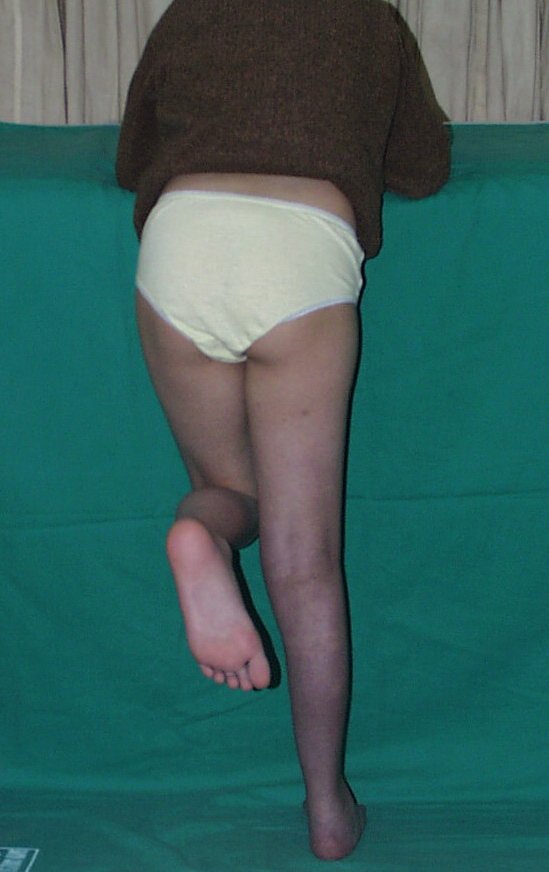
Vídeo 6: Boa força muscular e estabilidade do punho esquerdo, levantando significativo peso após 19 anos de cirurgia, em 22 de agosto de 2019.
Autor: Prof. Dr. Pedro Péricles Ribeiro Baptista
Oncocirurgia Ortopédica do Instituto do Câncer Dr. Arnaldo Vieira de Carvalho
Consultório: Rua General Jardim, 846 – Cj 41 – Cep: 01223-010 Higienópolis São Paulo – S.P.
Fone:+55 11 3231-4638 Cel.:+55 11 99863-5577 Email: drpprb@gmail.com