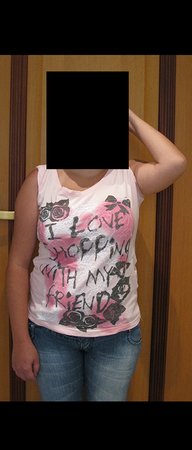O sarcoma de Ewing é tumor maligno composto por células indiferenciadas pequenas e redondas.
Sarcoma de Ewing
Apresenta incidência máxima na primeira e segunda décadas de vida, sendo raro após a terceira, com uma preponderância de 2:1 do sexo masculino sobre o feminino.
Há muita controvérsia quanto a célula de origem do sarcoma de Ewing, no entanto estudos mais recentes defendem a origem neuroectodérmica.
O tumor de Ewing acomete principalmente a região metafisária dos ossos tubulares longos e a pelve.
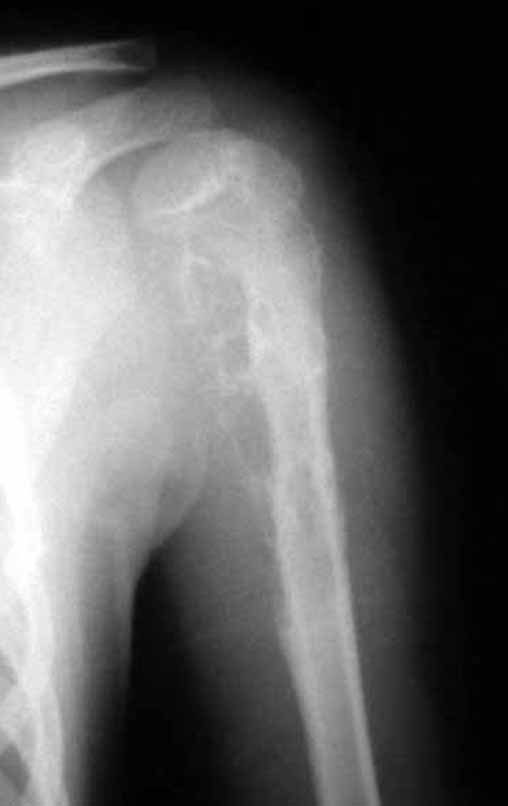
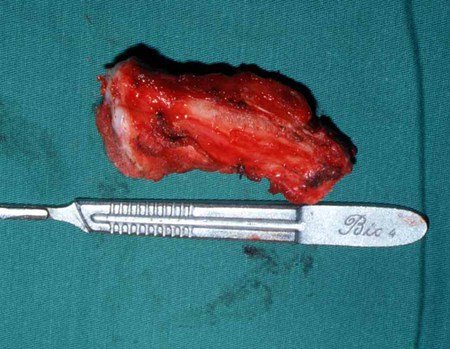
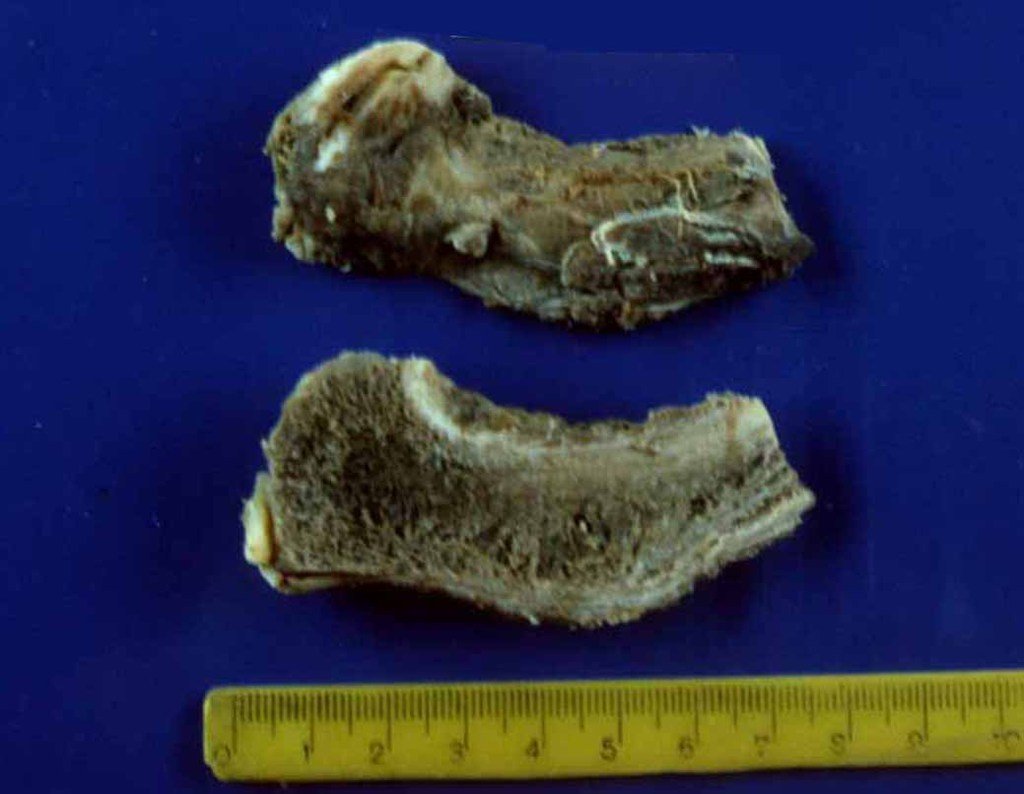
Macroscópicamente, a lesão óssea é caracterizada por um cinza esbranquiçado, de consistência mole. Este tumor ultrapassa precocemente a cortical, causando a elevação do periósteo com formação subperiosteal de osso novo, característico nessa doença, fornecendo uma imagem radiografica com aspecto de “casca de cebola”.
Histologicamente é composto por numerosas células uniformemente distribuídas, pequenas e redondas, semelhantes a linfócitos, porém de maior tamanho. A técnica de impregnação argêntica no estudo histológico revela escassez de fibras de reticulina, sendo estas encontradas apenas ao redor de vasos, ao contrário dos linfomas nos quais se observa rica trama de reticulina. No citoplasma das células do sarcoma de Ewing identifica-se abundante quantidade de glicogênio pela coloração de PAS.
As manifestações clínicas do sarcoma de Ewing são de dor, tumefação, hipersensibilidade da parte afetada, circulação colateral, temperatura local elevada e aumento na velocidade de hemossedimentação, podendo mascarar-se como quadro de osteomielite. No início é possível que não haja alterações radiográficas ou que as alterações sejam pequenas e mal definidas. Com a progressão da doença, o tumor induz formação de grandes áreas de lise óssea a corroerem as trabéculas esponjosas e, a seguir, a cortical de dentro para fora, dando à radiografia um aspecto de “roído de traça” . Muito precocemente apresenta massa tumoral extra cortical, em grande volume, contendo mais tumor fora do osso do que dentro dele.
O diagnóstico diferencial é feito com o osteossarcoma, o granuloma eosinófilo, o rabdomiossarcoma e a osteomielite
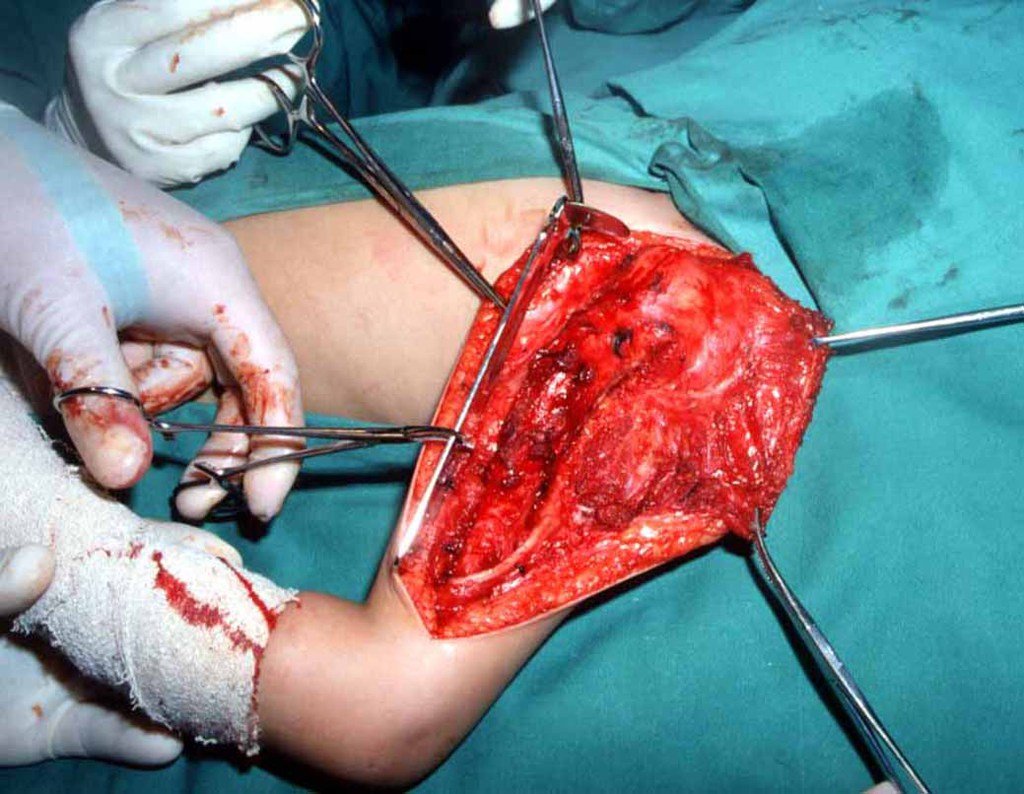
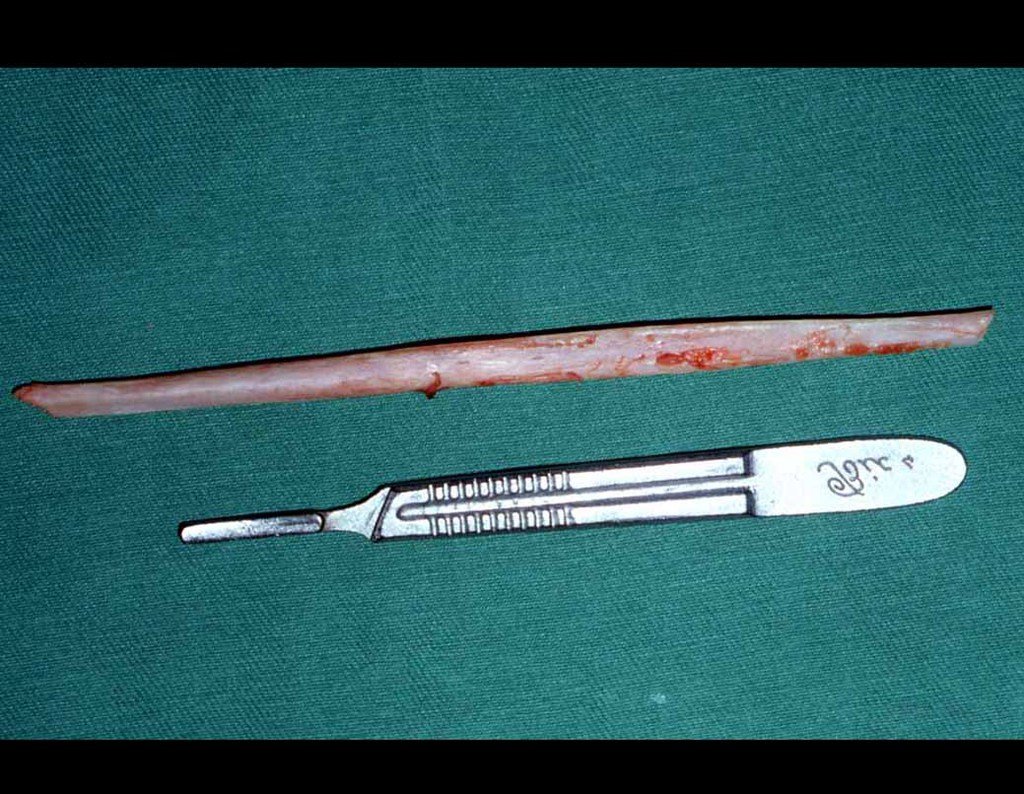
O tratamento atual consiste em poliquimioterapia pré-operatória, cirurgia de ressecção da lesão seguida de poliquimioterapia pós-operatória. No tratamento cirúrgico, após a ressecção da lesão, pode-se realizar a reconstrução do segmento com endopróteses, enxerto ósseo de banco e enxerto autólogo.
A avaliação da resposta à quimioterapia pré-operatória orienta o tratamento, tem valor prognóstico e é feita com o estudo do material ressecado na cirurgia. Essa avaliação é classificada em graus, a saber:
I – até 50% de necrose tumoral
II – entre 50% e 90% de necrose tumoral
III – acima de 90% de necrose tumoral
IV – ausência de neoplasia histologicamente viável
Atualmente com as excelentes respostas ao tratamento quimioterápico e às expectativas de “cura” da doença (pacientes com mais de quinze anos de tratamento, vivos e clinicamente bem), procura-se sempre que possível realizar tratamento cirúrgico com soluções biológicas, pois são definitivas e evitam as complicações decorrentes das endopróteses ou enxertos de banco, cuja durabilidade é limitada.
Autor : Prof. Dr. Pedro Péricles Ribeiro Baptista
Oncocirurgia Ortopédica do Instituto do Câncer Dr. Arnaldo Vieira de Carvalho
Consultório: Rua General Jardim, 846 – Cj 41 – Cep: 01223-010 Higienópolis São Paulo – S.P.
Fone:+55 11 3231-4638 Cel:+55 11 99863-5577 Email: drpprb@gmail.com
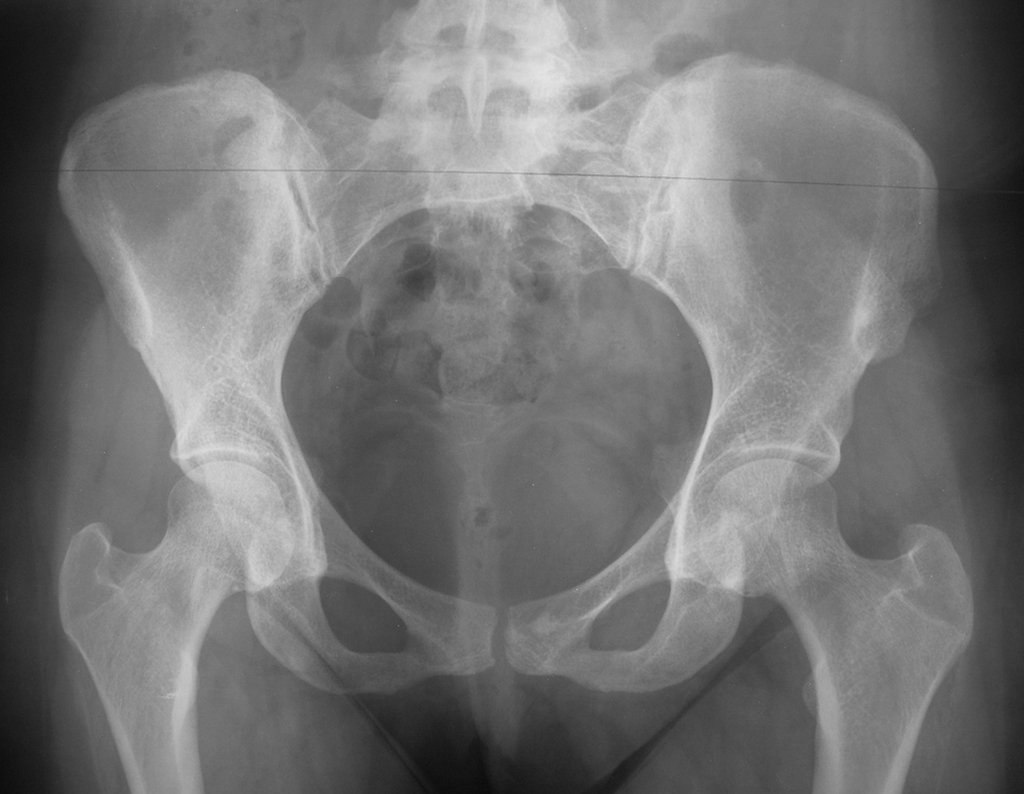
Técnica de Prótese Total do Úmero em Osteossarcoma. Paciente masculino, com 57 anos de idade, refere aparecimento de lombalgia, em final de outubro de 2014, com irradiação para o MIE. Devido a progressão dos sintomas, realizou uma ressonância da coluna que relatou presença de hérnia discal L5-S1. Iniciou fisioterapia e com a piora dos sintomas realizou uma tomografia em 18/02/2015, com relato de artrose facetaria L2-L3, L3-L4 e discopatia L5-S1 com protrusão ao canal medular e radiografias da bacia, figuras 1 e 2.
13. Técnica de Prótese Total do Úmero em Osteossarcoma.
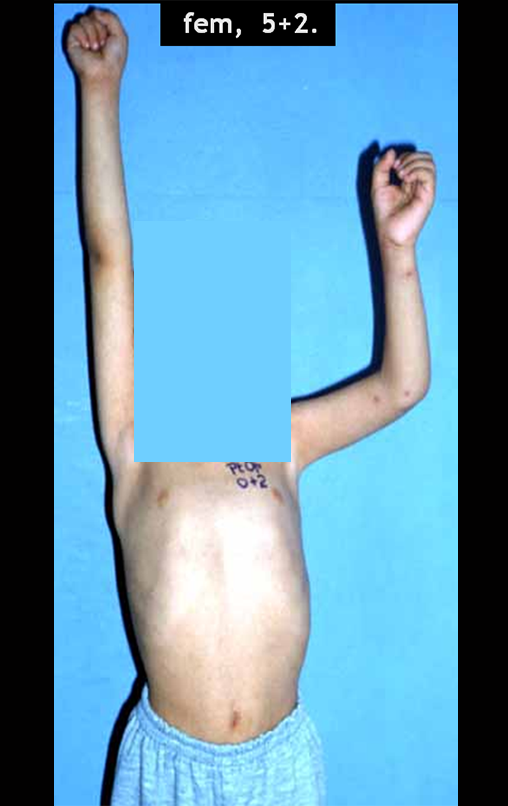
O aspecto clínico e a função do membro superior esquerdo, podem ser observados nas figuras 27 a 29.
O estudo das imagens e a análise do exame clínico, evidenciaram o comprometimento do músculo deltoide, porém com viabilidade de cirurgia conservadora, com margem, desde que se fizesse a ressecção completa do músculo envolvido e a substituição total do úmero por endoprótese modular de polietileno.
Apesar da necessidade do sacrifício funcional parcial do ombro, e da necessidade de reconstrução artroplástica, com tela de marlex para a cobertura proximal da prótese e estabilidade do ombro, a preservação do membro superior foi nossa indicação, visando oferecer um aspecto cosmético e funcional remanescente do membro satisfatório.
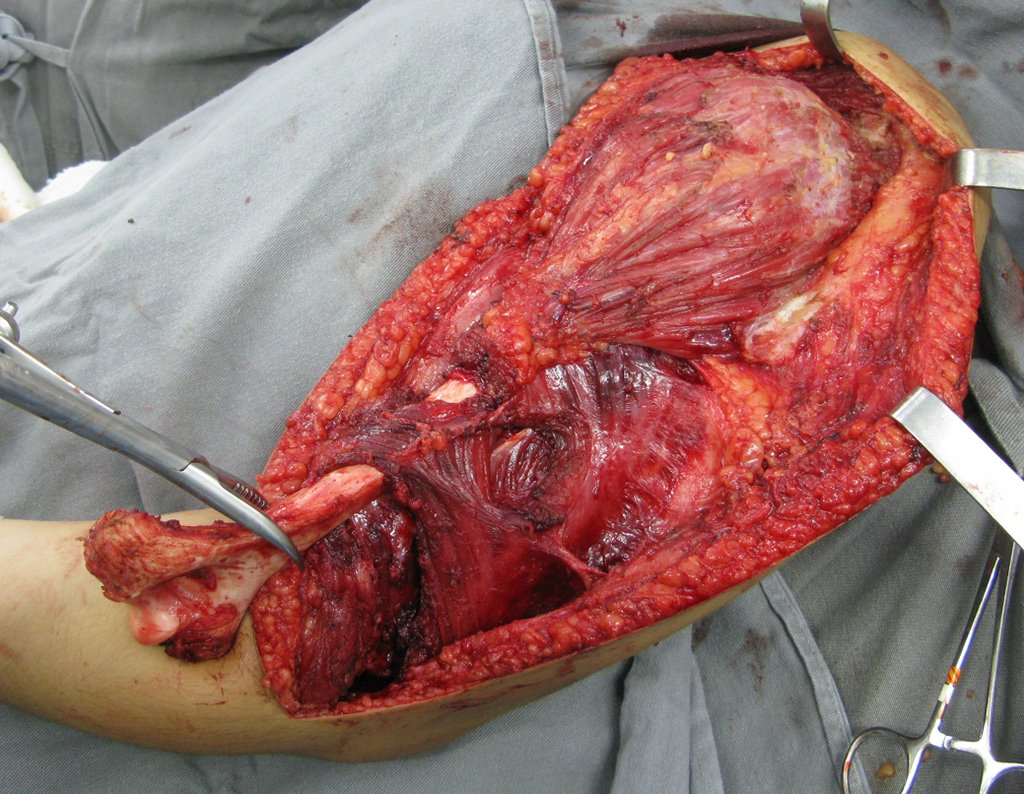
A cirurgia de resseção total do úmero esquerdo, incluindo todo o músculo deltoide e a reconstrução com endoprótese e tela de marlex podem ser estudadas nas figuras 31 a 75.
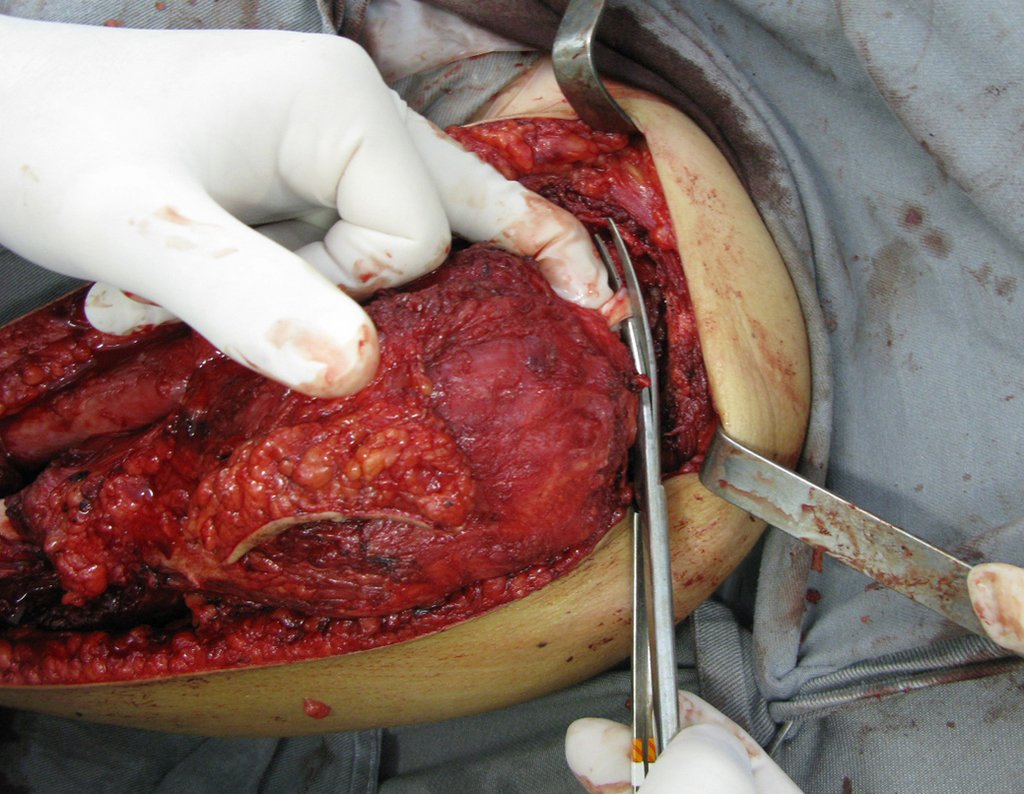
O vídeo 1 demonstra a reinserção do cabo longo do músculo bíceps braquial.
Vídeo 1: Sutura de tela de marlex ao redor da glenóide.
Como pudemos observar, todo o músculo deltoide e trajeto da biópsia, juntamente com a cápsula articular, foram ressecados. Restou apenas pele e tecido celular sub-cutâneo para a cobertura proximal da reconstrução umeral.
É preciso criar uma contenção ao redor da glenóide para estabilizar a prótese, evitando o seu deslocamento. Este mecanismo de contensão precisa permitir os movimentos rotacionais do úmero para propiciarmos uma função adequada.
Para obter este resultado vamos descrever em detalhes nossa técnica. O vídeo 2 ilustra a sutura de uma tela de marlex ao redor da glenóide, visando criar um ponto de fixação da porção proximal da prótese umeral que empregamos nesta reconstrução.
Vídeo 2: Fixação da tela de marlex na porção anterior da glenóide.
Vídeo 3: Cimentação e montagem da prótese de úmero proximal, definindo neste momento os 20 graus de rotação interna. Existe um respiro distal para a saída do excesso de cimento.
A prótese de polietileno é mais adequada por sua leveza em relação à uma totalmente metálica. O polietileno tem a elasticidade semelhante à do osso e permite que realizemos orifícios em pontos estratégicos para a reinserção de tendões e ligamentos, que eventualmente restaram mais encurtados, devido a necessidade de margem cirúrgica na ressecção.
Vídeo 4: Evidenciamos a boa fixação dos fios e da tela de marlex na região proximal da prótese total de úmero. Esta sutura é realizada com um pregueamento semelhante à saia escocesa, para permitir os movimentos de rotação.
Vídeo 5: Paciente no pós-operatório de uma semana, bom aspecto cosmético, iniciando fisioterapia.
Vídeo 6: Função do punho após 15 dias da cirurgia. Realiza por enquanto, apenas movimentos da mão e punho.
Vídeo 7: Função em agosto de 2015, após nove meses da cirurgia de ressecção total do úmero esquerdo, com exérese de todo o deltoide e reconstrução com endoprótese total de úmero com emprego de tela de marlex, para estabilização da articulação gleno protésica. Boa flexão do cotovelo, excelente função da mão e prono-supinação e boa rotação do úmero.
Vídeo 8: Paciente em fisioterapia, fazendo flexão do ombro com ajuda do membro contralateral, em 09-09-2015
Vídeo 9: Elevação do ombro com ajuda da bola e apoio na parede, em 09-09-2015
Autor: Prof. Dr. Pedro Péricles Ribeiro Baptista
Oncocirurgia Ortopédica do Instituto do Câncer Dr. Arnaldo Vieira de Carvalho
Consultório: Rua General Jardim, 846 – Cj 41 – Cep: 01223-010 Higienópolis São Paulo – S.P.
Fone:+55 11 3231-4638 Cel.:+55 11 99863-5577 Email: drpprb@gmail.com
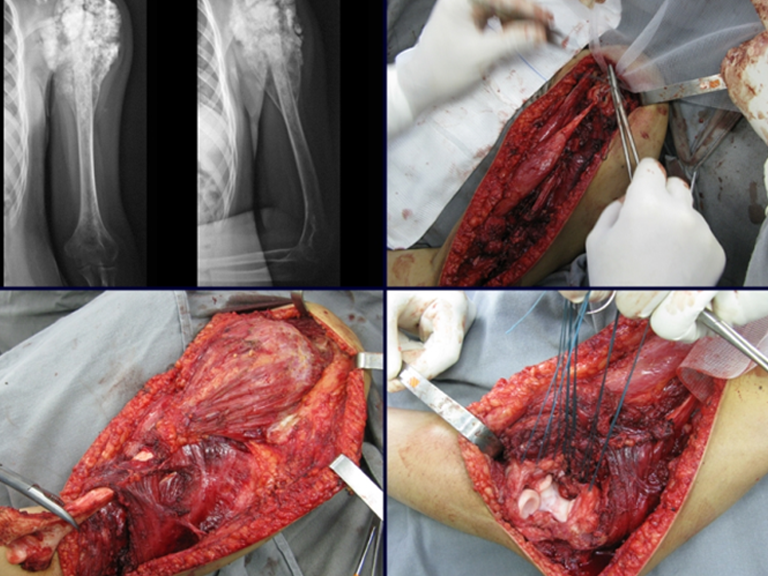
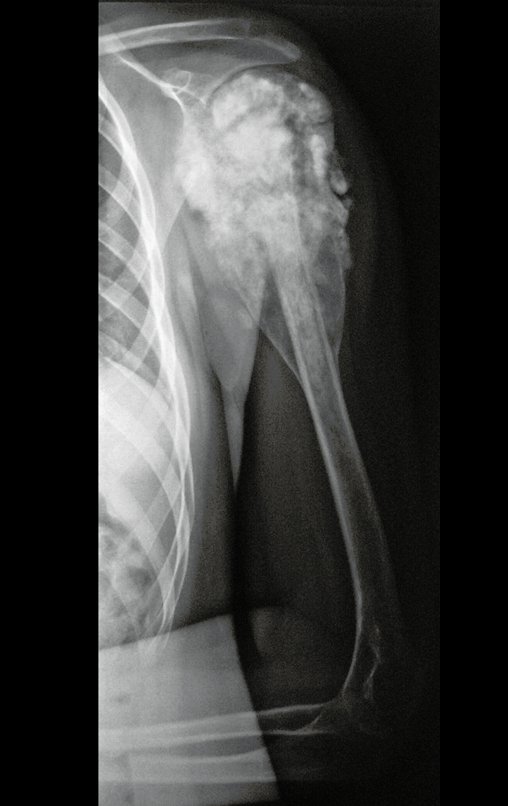
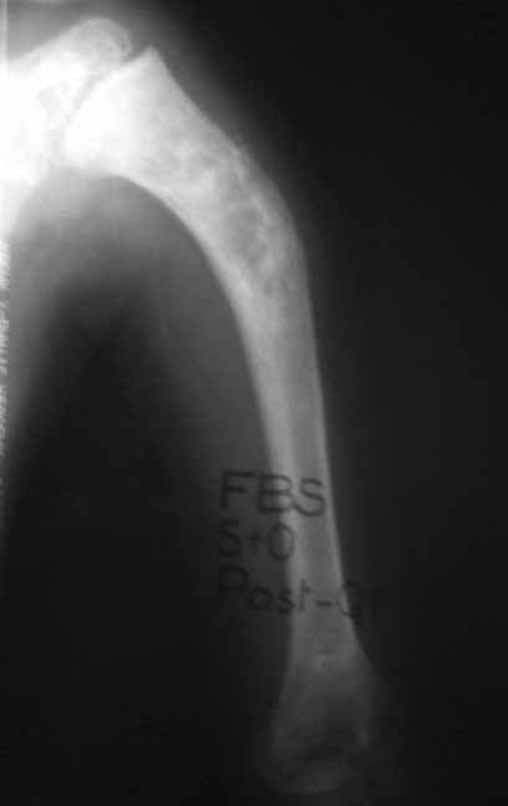
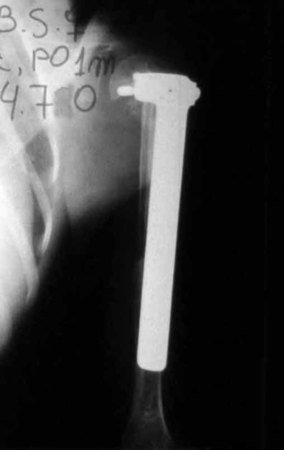
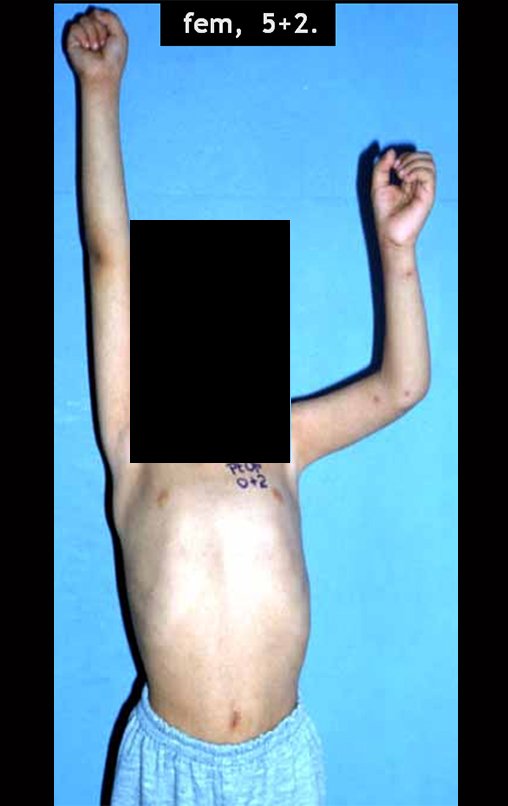
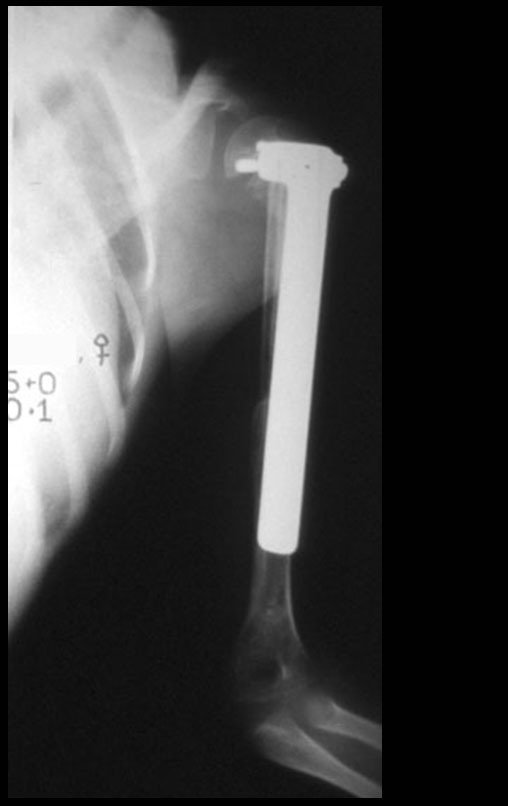
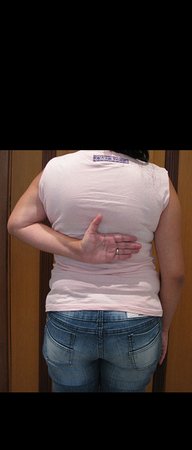
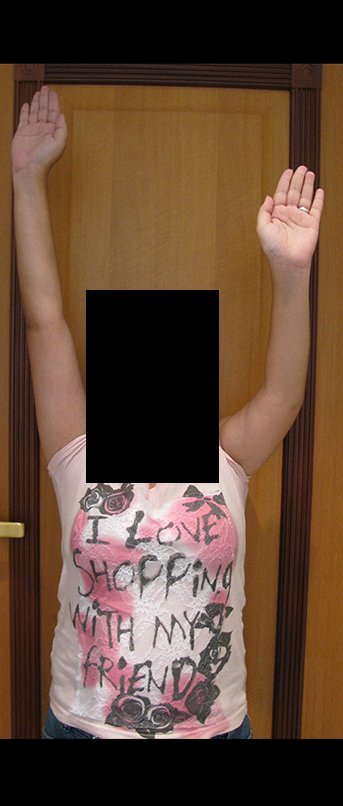
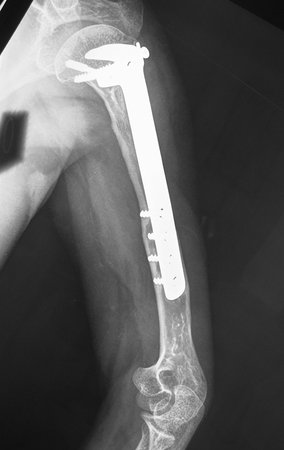
Sarcoma de Ewing do Úmero em Criança. Paciente com quatro anos e cinco meses de idade, apresentou dor e tumor no úmero esquerdo, em janeiro de 1991. A biópsia revelou tratar-se de Sarcoma de Ewing. O estadiamento não revelou outro foco. Submeteu-se a tratamento com quimioterapia neoadjuvante, apresentando boa resposta radiográfica ao tratamento, ocorrendo mineralização da lesão e deformidade angular pela plasticidade neoplásica, figuras 1 a 4.
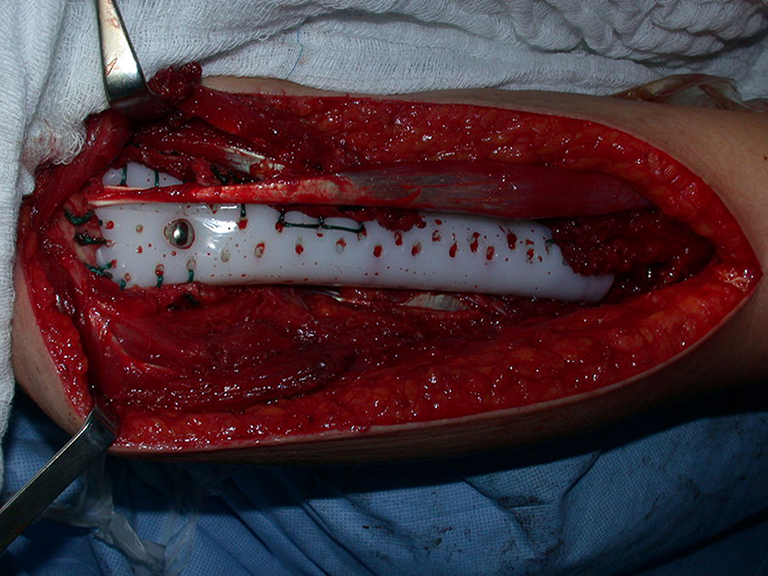
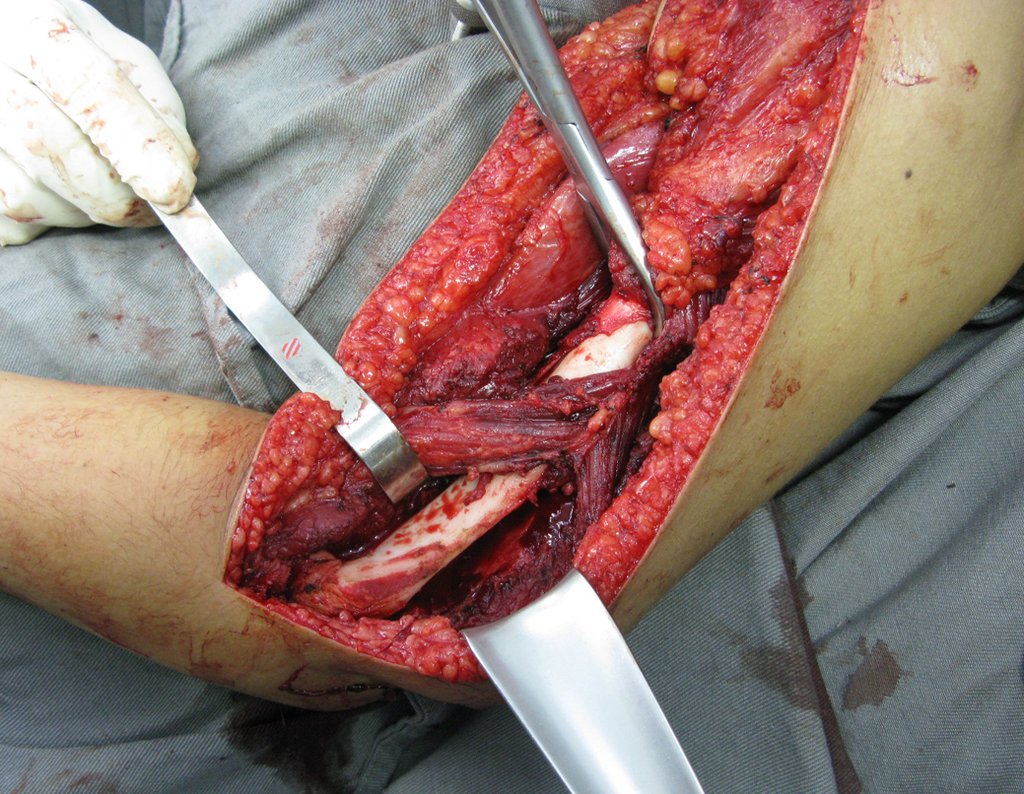
10. Sarcoma de Ewing do úmero em criança – Conduta – Técnicas de ressecção e de reconstrução com placa especial – Enxerto autólogo combinado de fíbula e ilíaco
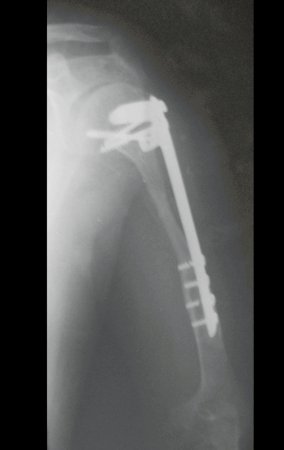
A radiografia de controle com um mês de pós-operatório e a função do membro operado são mostradas nas figuras 11 a 14.
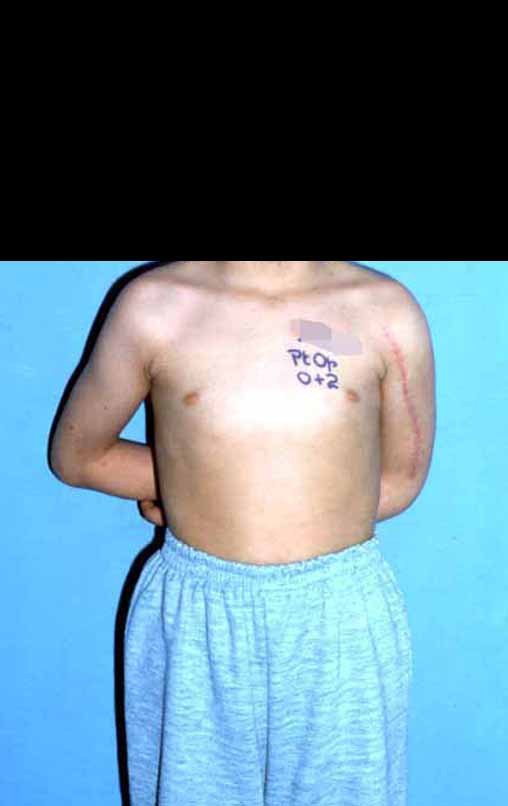
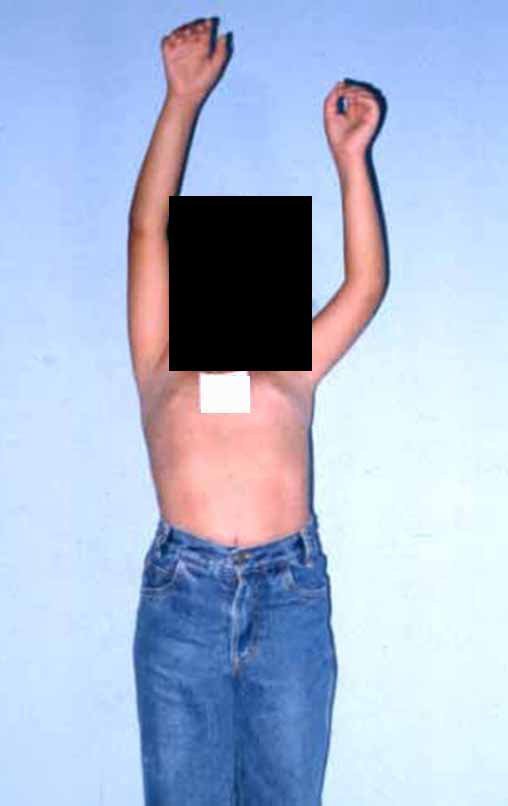
Vídeo 1: Boa estética, apesar do encurtamento, boa função, após 22 anos da cirurgia, em 11/01/2012.
As figuras 37 a 42, ilustram etapas da evolução deste caso de Sarcoma de Ewing, tratado cirurgicamente com uma solução biológica.
Em maio de 2015, a paciente teve o seu primeiro filho, dando luz à um menino. Em 1991 ainda não realizavamos o autotransplante de cartilagem de crescimento, reconstruindo este segmento com fíbula vascularizada com a placa de crescimento, para substituir a placa do úmero que quando esta é ressecada. Entretanto, o membro superior aceita melhor a discrepância de comprimento, coroando a alternativa que empregamos na época.
Autor: Prof. Dr. Pedro Péricles Ribeiro Baptista
Oncocirurgia Ortopédica do Instituto do Câncer Dr. Arnaldo Vieira de Carvalho
Consultório: Rua General Jardim, 846 – Cj 41 – Cep: 01223-010 Higienópolis São Paulo – S.P.
Fone:+55 11 3231-4638 Cel.:+55 11 99863-5577 Email: drpprb@gmail.com