Condrossarcoma: Histórico, Aspectos Clínicos. Histórico: Em 1920, o Comitê de Registro de Sarcomas Ósseos, do Colégio Americano de Cirurgiões, composto por Ewing, Codman e Bloodgood, publicou a primeira classificação sistemática dos tumores ósseos. Esta classificação englobava uma grande variedade de entidades clínicopatológicas que subdividiam-se basicamente em:
Condrossarcoma: Histórico, Aspectos Clínicos, Classificação, Diagnóstico Diferencial, Tratamento, Complicação e Prognóstico
– tumores primários dos ossos
– tumores desenvolvidos em lesões ósseas pré–existentes
– tumores decorrentes de radiação ionizante
– tumores que invadem os ossos, oriundos dos tecidos moles
– tumores primários das articulações
– tumores metastáticos no esqueleto23.
Em 1925, Keiller e posteriormente Phemister, 1930, foram os primeiros a separar o condrossarcoma dos sarcomas osteogênicos, considerando a distinção entre a suas características morfológica e clínico-radiológica, bem como sua evolução mais lenta e de melhor prognóstico. Em 1939 o “Committee of the bone sarcoma registry” incluiu o condrossarcoma como uma entidade distinta.
Lichtenstein e Jaffe, em 1943, estabeleceram a clara distinção entre o osteossarcoma e condrossarcoma. O osteossarcoma é um tumor produtor de osteóide neoplásico, enquanto, o condrossarcoma, ocorre a partir de cartilagem totalmente desenvolvida, muitas vezes apresentando calcificação ou ossificação, porém nunca produzindo osteóide neoplásico2.
Definição: O condrossarcoma é uma neoplasia maligna de natureza mesenquimal, produtora de substância intersticial e células que assumem aspecto de cartilagem hialina, com graus variados de imaturidade e focos de calcificação frequentes. É a lesão maligna primária do osso mais frequente depois do osteossarcoma23,24 e do tumor de Ewing (silabus), pode acometer qualquer idade, com predomínio entre os 30 e 40 anos7,11,22, com relatos na literatura entre três e 73 anos15.
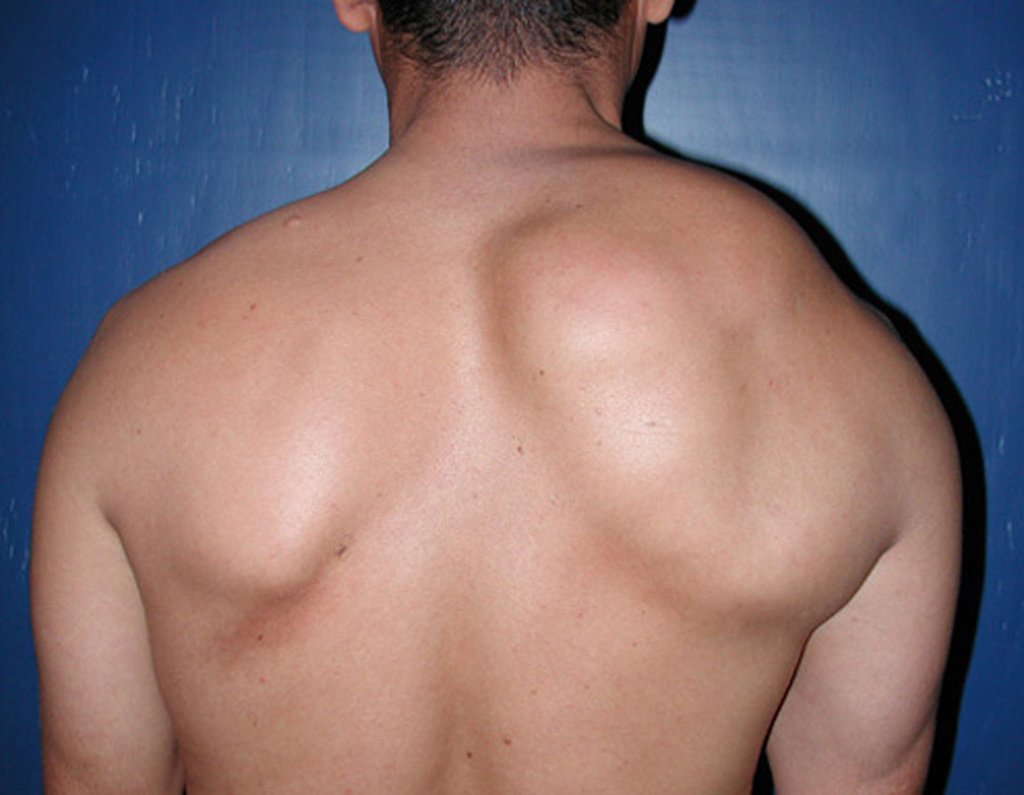
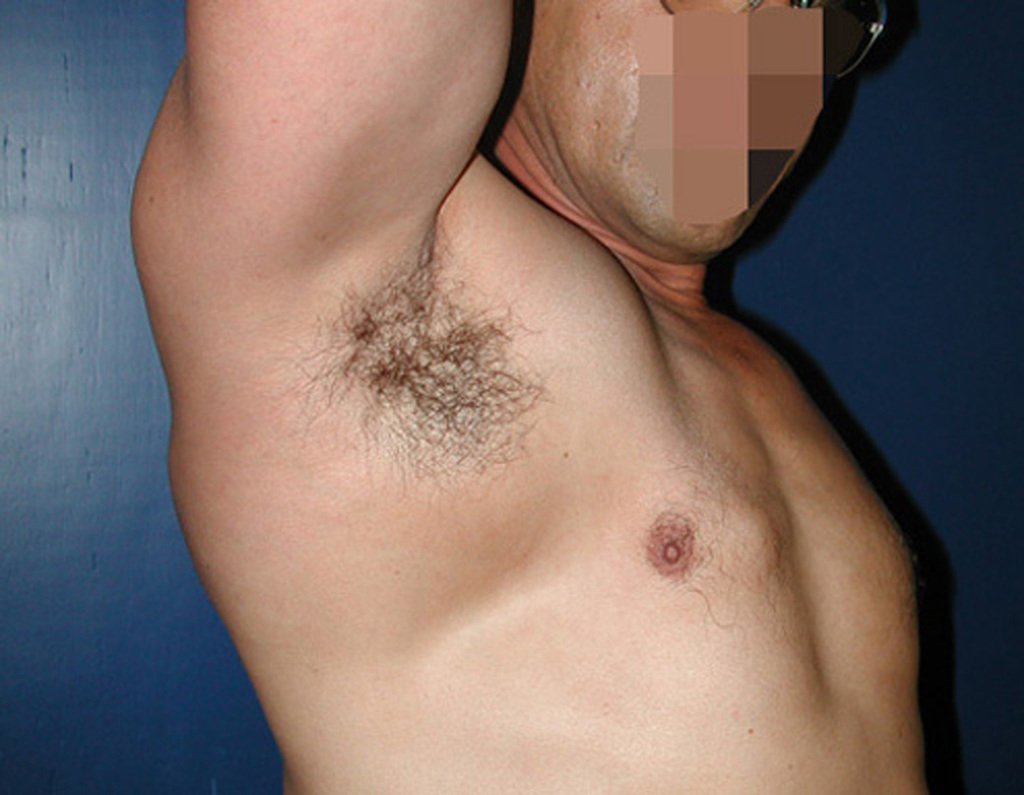
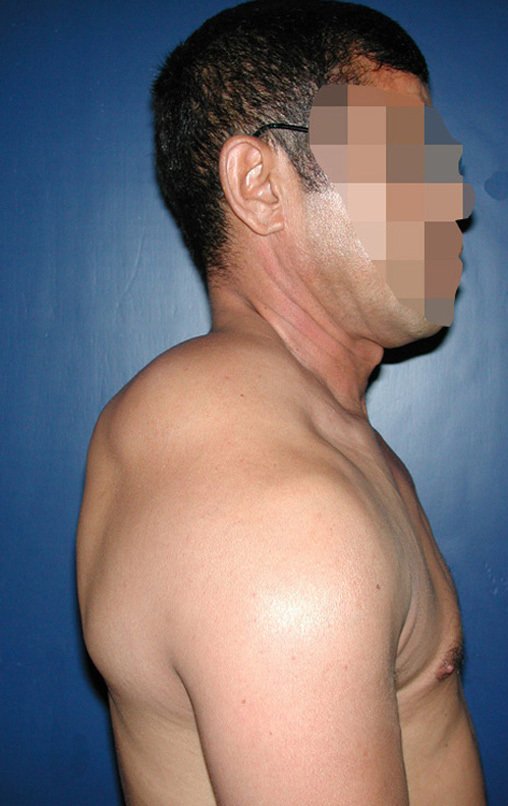
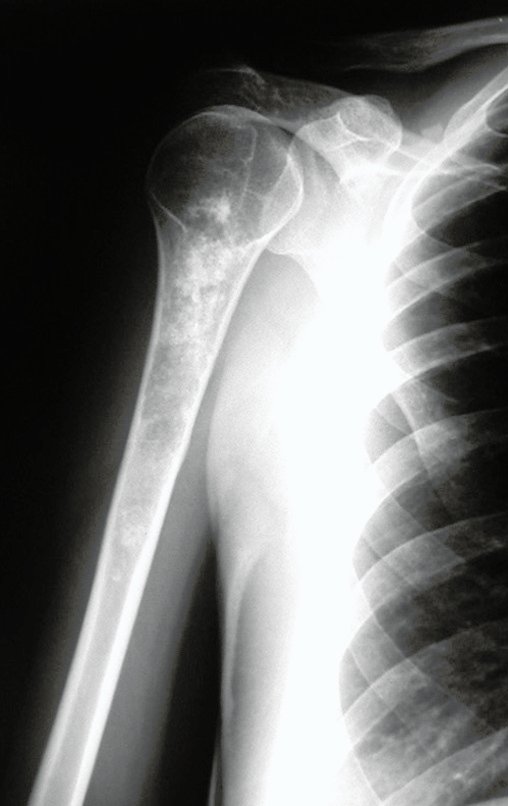
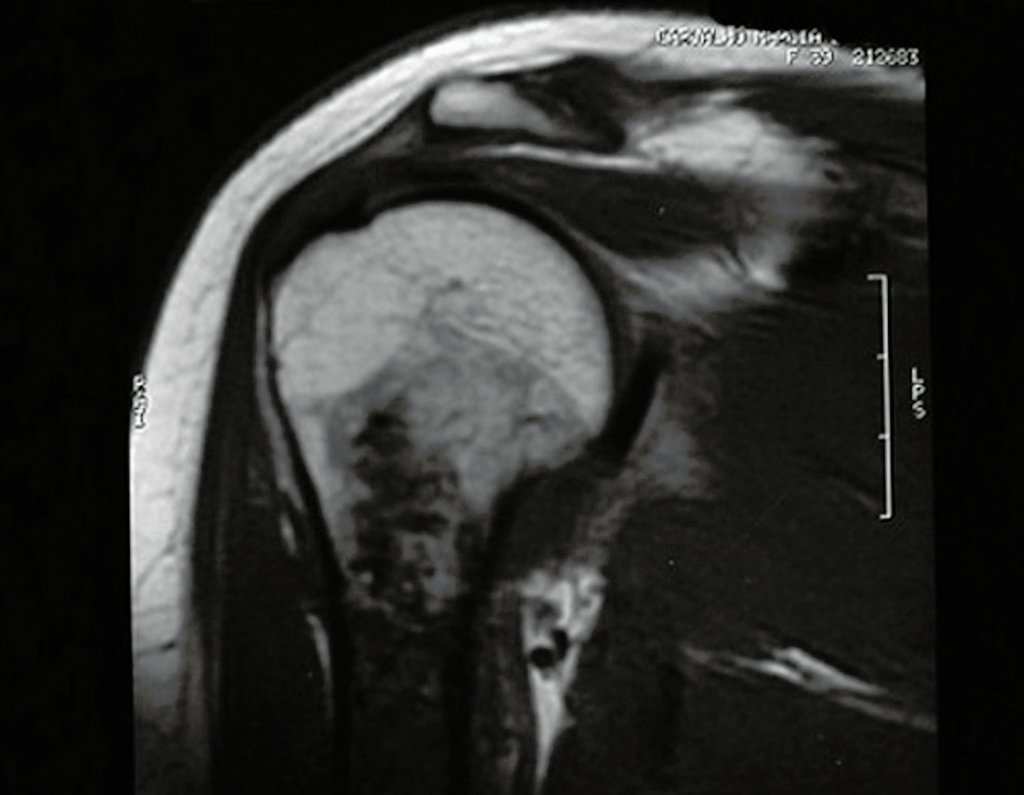
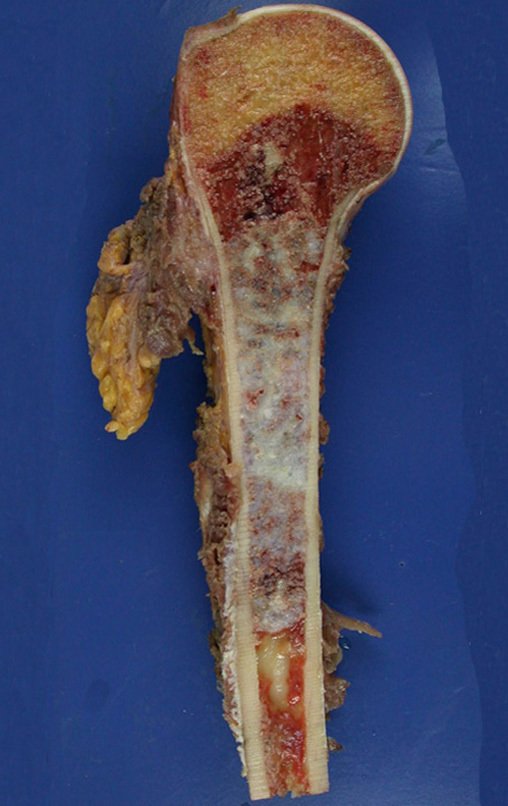
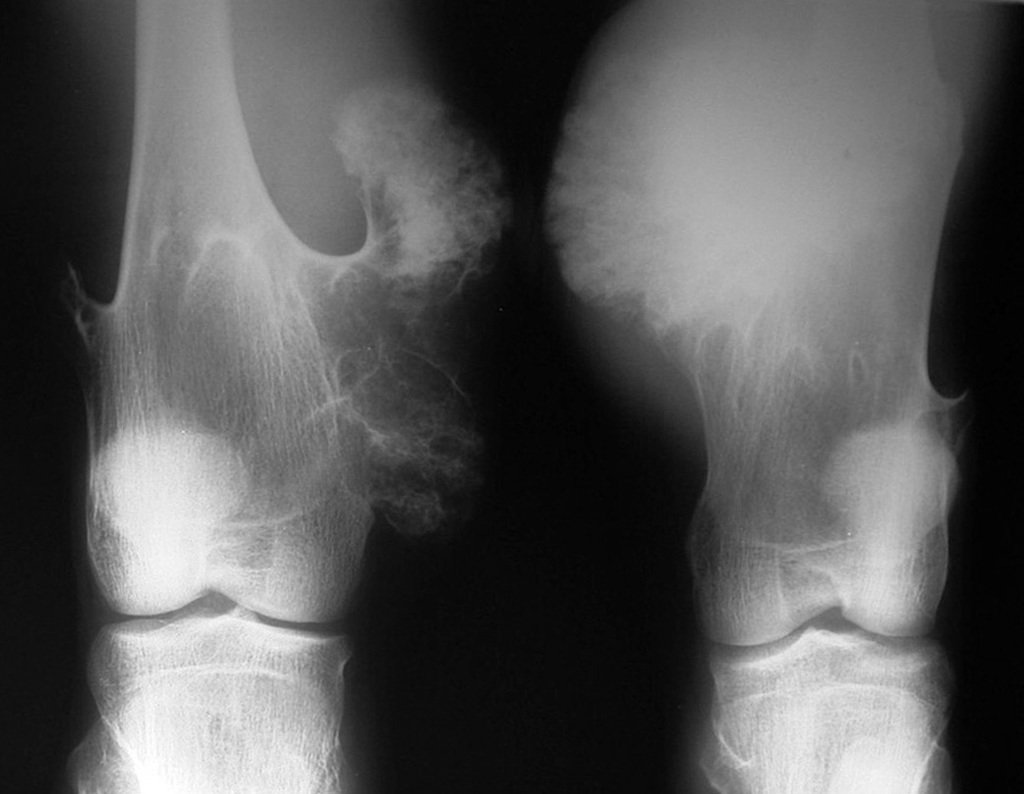
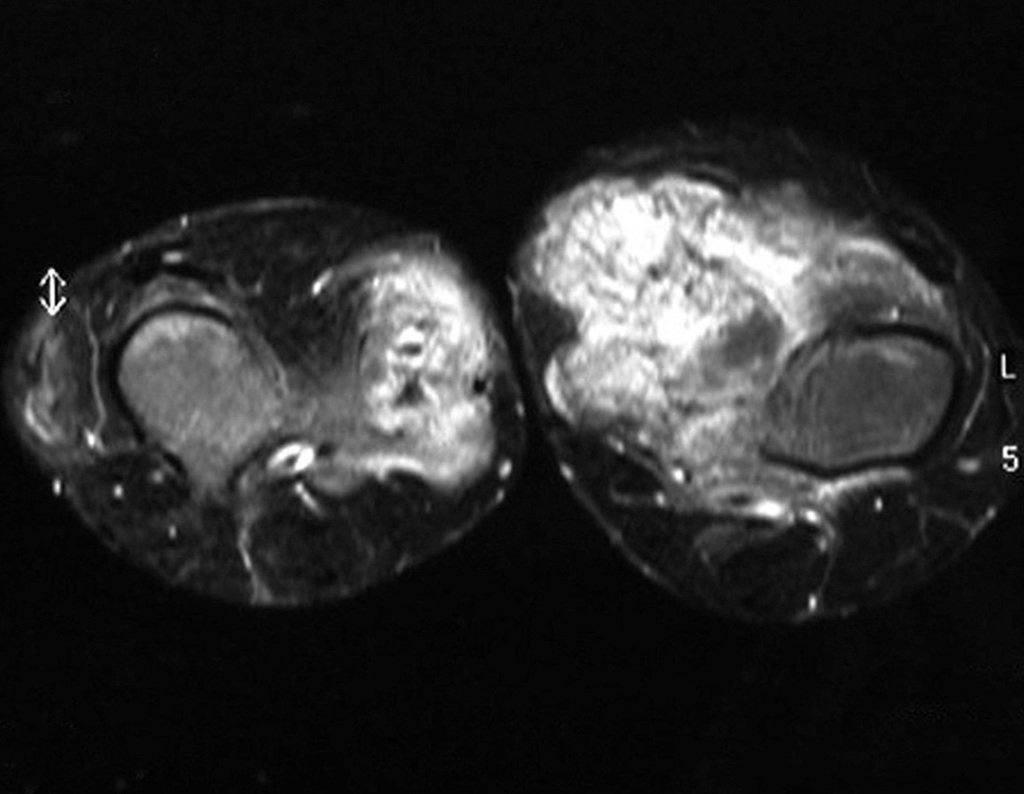
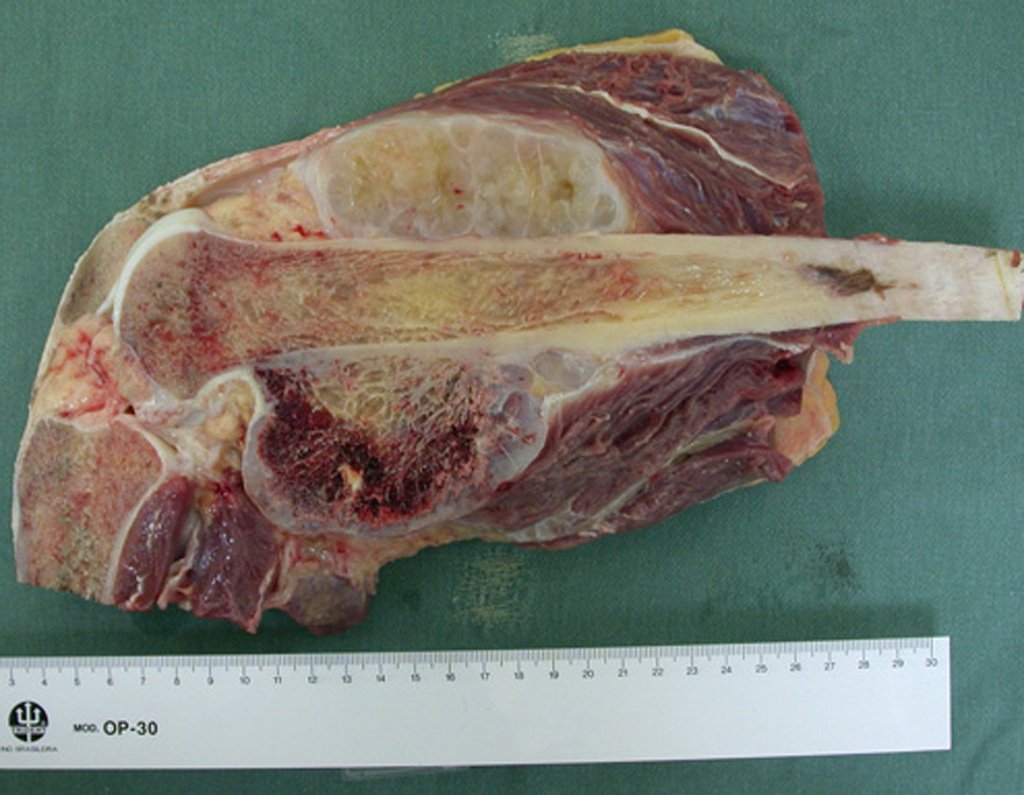
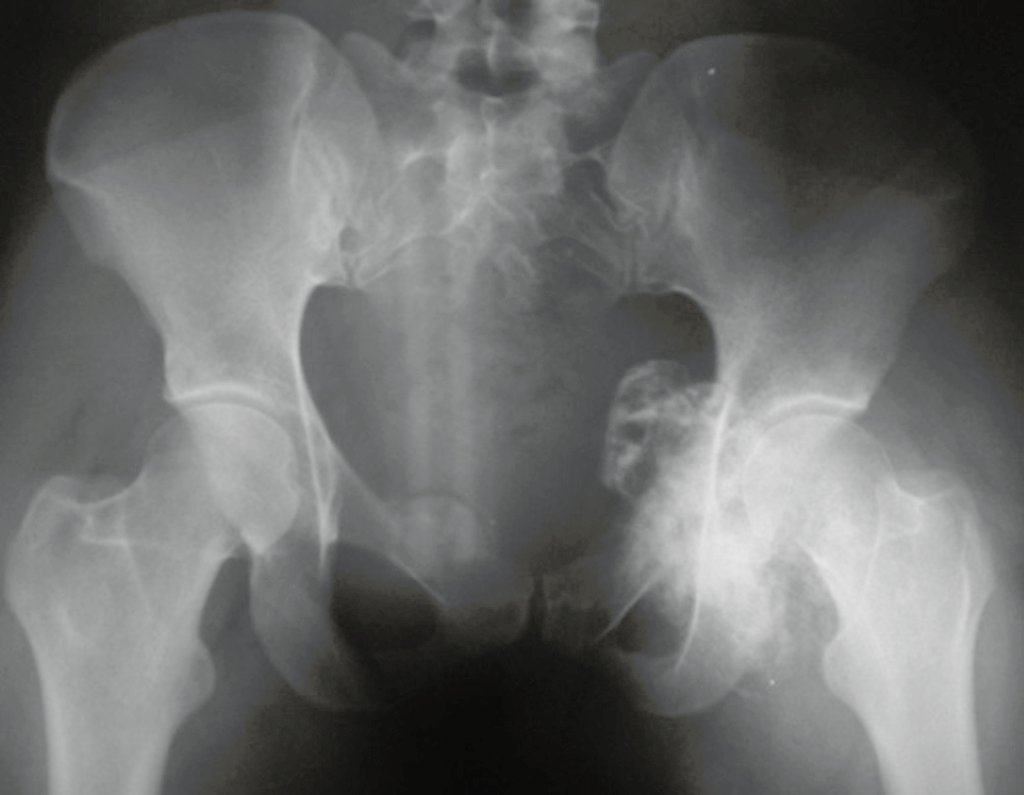
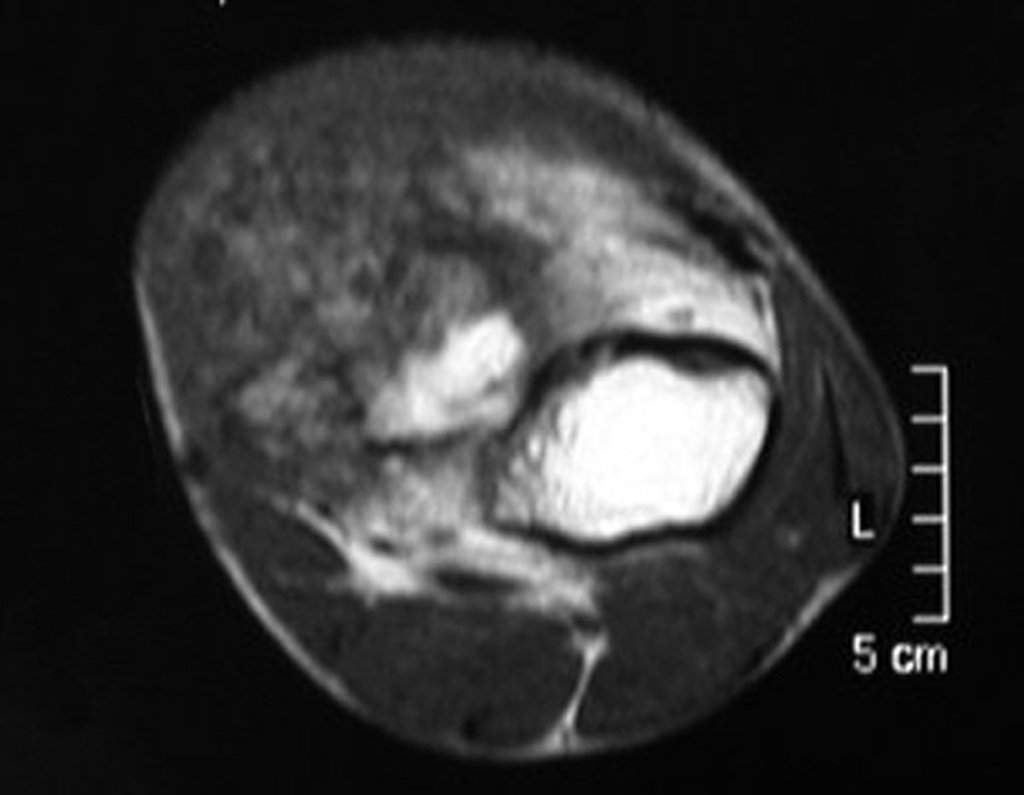
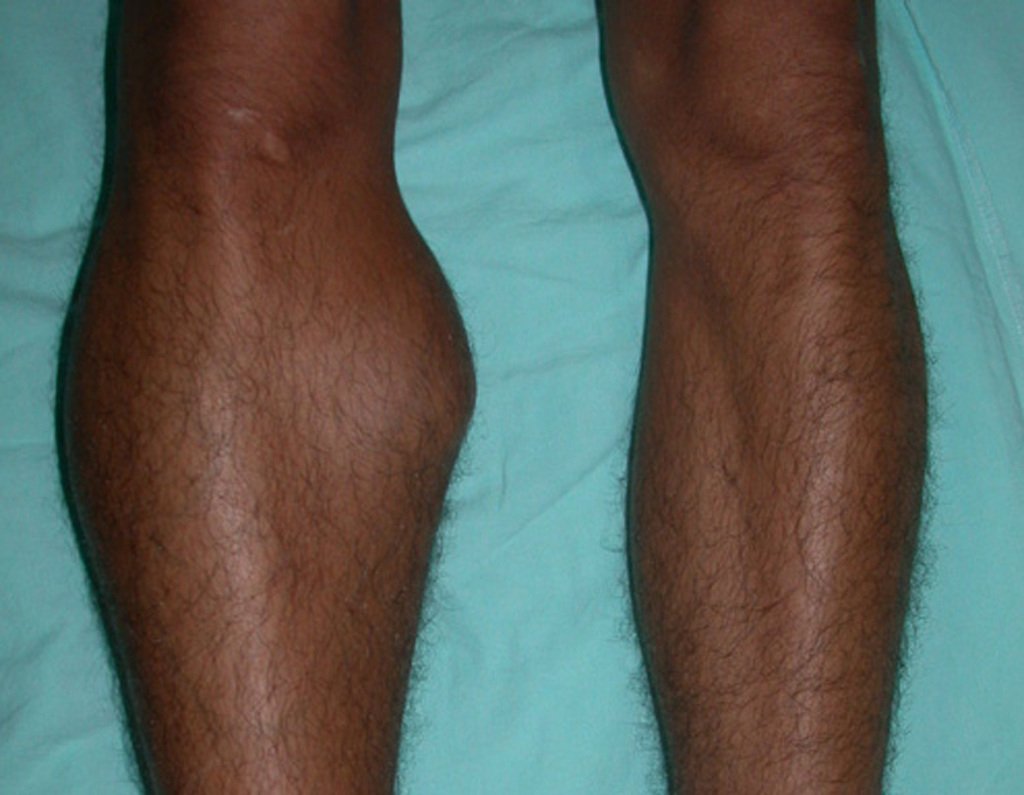
O condrossarcoma ocorre nos ossos de origem endocondral, principalmente na raiz dos membros: ombro (Figuras 1 a 3), pelve (Figuras 4 a 10), costelas e esqueleto axial1, sendo raro nos os ossos de origem membranosa11,14,15,24.
Na maioria dos casos sâo indolores e não causam déficits motores. A ocorrência de fratura é pouco freqüente7,10,13,22 e os pacientes procuram tratamento muitos anos após o aparecimento do tumor, pois os sintomas surgem tardiamente. Huvos11 relatou um caso de condrossarcoma da costela que progrediu durante quinze anos, antes do paciente procurar tratamento.
As figuras 1 a 10 ilustram grandes condrossarcomas da cintura escapular e cintura pélvica, que evoluiram lentamente.
Classificação: Podem ser classificados quanto à localização, histologia e origem.
Quanto à localização podem ser:
A- central (Figuras 11 a 15);
B- justacortical, paraosteal, ou periostal2,6,23,24 (Figuras 16 e 17);
C- periférico ou exofítico, que ocorre sobre um osteocondroma 28 (Figuras 18 e 19) e
D- de tecidos moles13 (Figuras 20 a 31).
Quanto à HISTOLOGIA apresentam diferentes aspectos, podendo ser separados em:
A) Grau de Anaplasia: classificam-se em graus I,
II e III, dependendo da celularidade e mitoses atípicas11,24, sendo:
-Condrossarcoma grau I, bem diferenciado, estrutura semelhante à cartilagem hialina mas com celularidade aumentada, distribuição irregular das lacunas e número variado de células por lacuna, por vezes binucleadas, hipercoradas e polimórficas (Figura 10.32);
-Condrossarcoma grau II, moderadamente diferenciado, maior número de células por lacunas com grande polimorfismo e desarranjo celular (Figura 10.33);
–Condrossarcoma grau III, indiferenciado, acentuada anaplasia, áreas mixóides, células indiferenciadas e escassa matriz hialina (Figura 34).
B) Desdiferenciado: áreas nítidas de cartilagem madura e outras áreas com imaturidade, apresentando alta celularidade e mitoses atípicas8 (Figura 35);
C) Mesenquimal: raro, apresentando campos de cartilagem hialina entremeada por neoplasia indiferenciada de células pequenas e redondas8 (Figura 36), e
D) Células Claras: raro, apresenta células redondas com citoplasma claro ou vacuolizado e com pouca atipia celular2 Figura 37).
Quanto à ORIGEM podem ser:
1- Primário, quando ocorre em tecido que não havia lesão prévia (Figuras 38 e 39).
2- Secundário, que se origina sobre uma lesão cartilaginosa benigna preexistente2,3,6.8,13,14,23,24 (Figuras 40 a 44).
O condrossarcoma secundário ocorre na doença de Ollier ou na Síndrome de Maffucci em 20 à 30% dos casos2,29, podendo ocorrer também a partir de encondroma único, embora seja raro nesta situação.
Pode ainda desenvolver-se a partir da capa cartilaginosa de um osteocondroma solitário, menos de 1%, ou osteocondromatose múltipla, cerca de 10%2 e mais raramente secundário à doença de Paget.
No osteocondroma, quando se observa aumento da lesão após a maturidade esquelética, deve-se pensar na possibilidade de malignização.
Esta malignização é caracterizada por aumento da espessura da capa cartilaginosa maior do que 2 cm29, calcificações irregulares, aparecimento de dor e aspecto heterogêneo da lesão2,6.
Devido às características morfológicas e de comportamento clínico distinto dos subtipos de condrossarcomas, julgamos didático discorrer individualmente sobre a incidência, os aspectos clínicos, radiográficos e anatomopatológicos de cada subtipo:
1. Condrossarcoma Central ou Convencional
É o mais freqüente dos condrossarcomas, correspondendo a 90%8. Representa entre 10,0 a 14,5% de todos os tumores ósseos malignos primários2,23.
Segundo Dahlin e Jaffe afeta homens e mulheres igualmente, enquanto para outros autores há uma prevalência pelo sexo masculino que varia de 10%6,9,14,29 a cerca de 70%, conforme Schajowicz2.
Ocorre mais freqüentemente no adulto entre 30 e 60 anos2,14.24,29.
Sua localização é mais freqüente no segmento proximal do fêmur, do úmero e da tíbia; sendo raro em ossos curtos2,23.
A dor pode ser um sintoma insidioso por vários anos, evoluindo com crescimento lento, aumento de volume, restrição de mobilidade ficando a pele às vezes avermelhada e quente23. Por ser oligosintomático muitas vezes a fratura em osso patológico é a primeira manifestação da doença2,24.
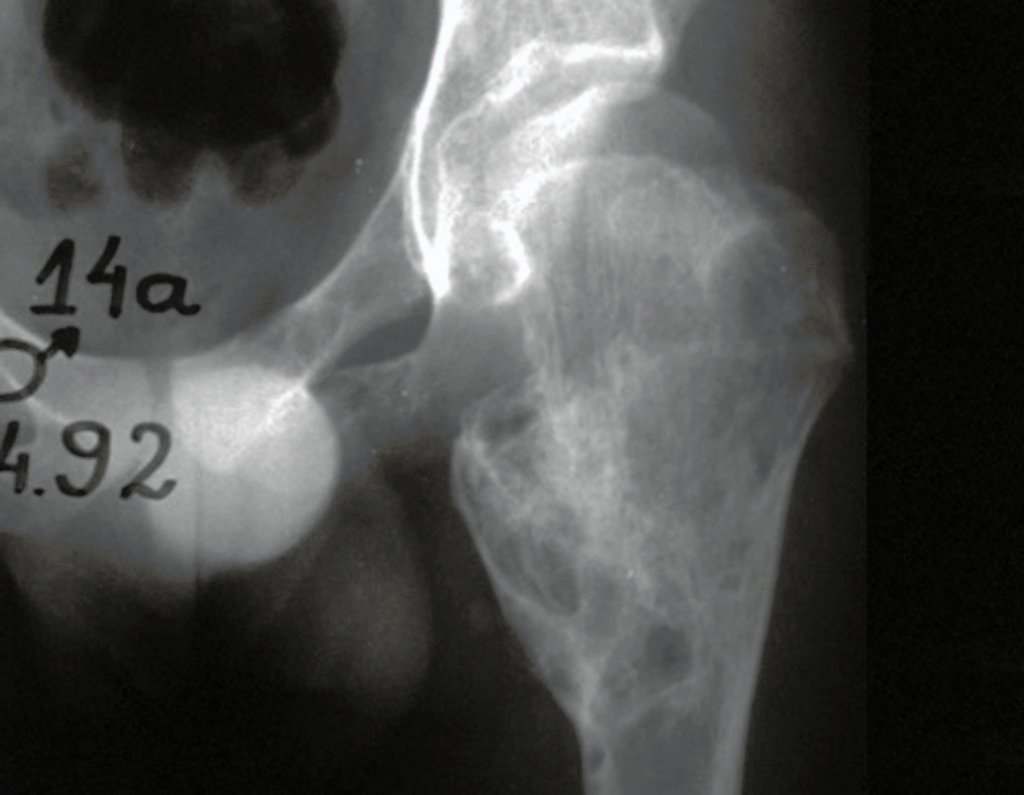
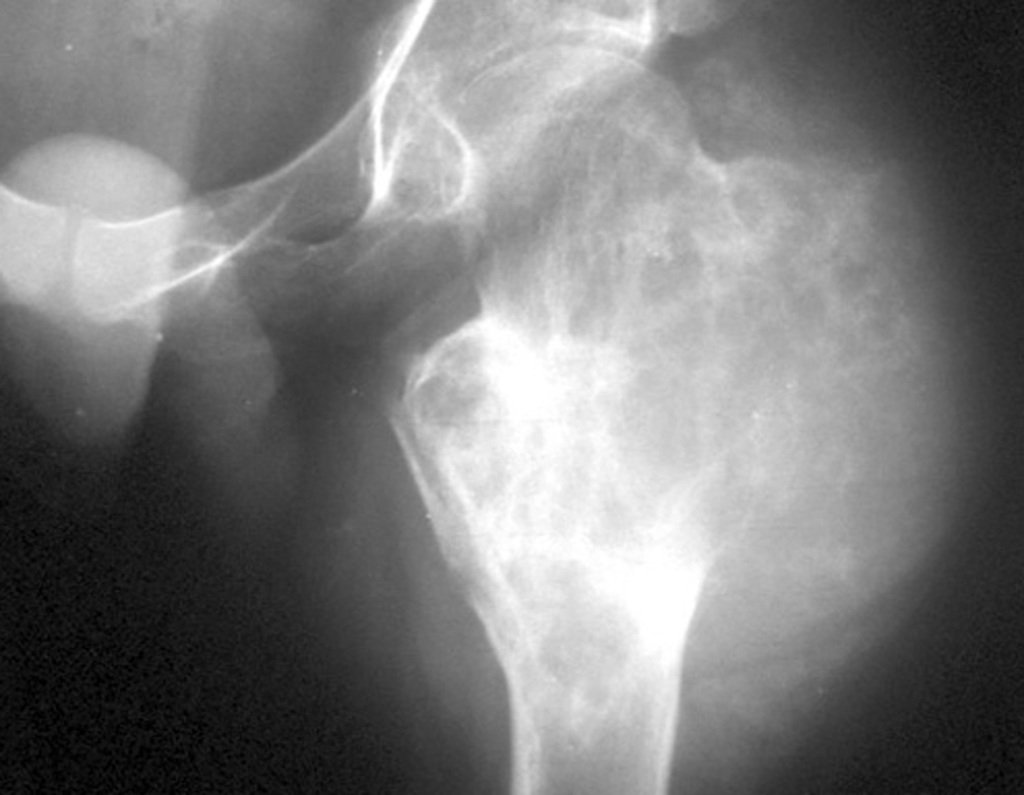
A radiografia mostra lesão metafisária radio transparente, substituindo a medular óssea. O tumor cresce em direção à epífise ou diáfise e erode a cortical interna, provocando lesões em saca-bocado. Pode ocorrer expansão da porção medular do osso, com insuflação da cortical (Figuras 45 e 46).
A radiografia evidencia calcificações frequentes (Figura 47 ). Esta decorre da neoangiogênese do tecido cartilaginoso, que se degenera. Este processo é acelerado nos condrossarcomas e lento nas lesões cartilaginosas benignas e de baixo grau. As calcificações podem ser salpicadas, em flocos de algodão ou anelares23,2,24,13,6,29,5.
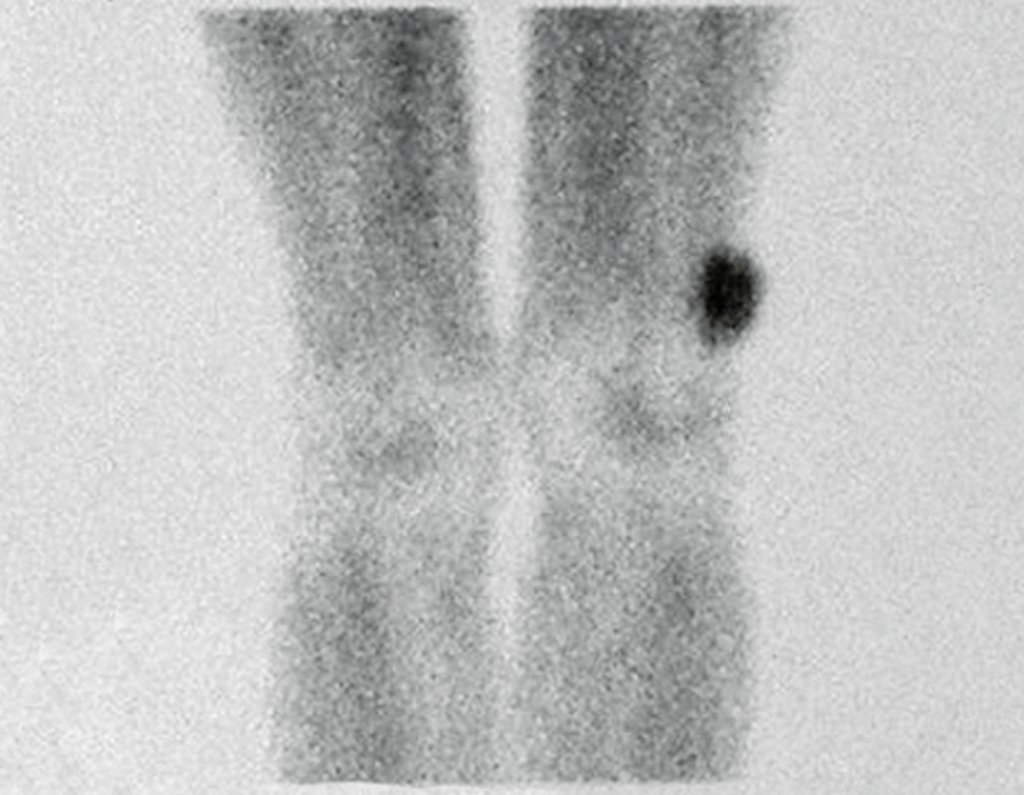
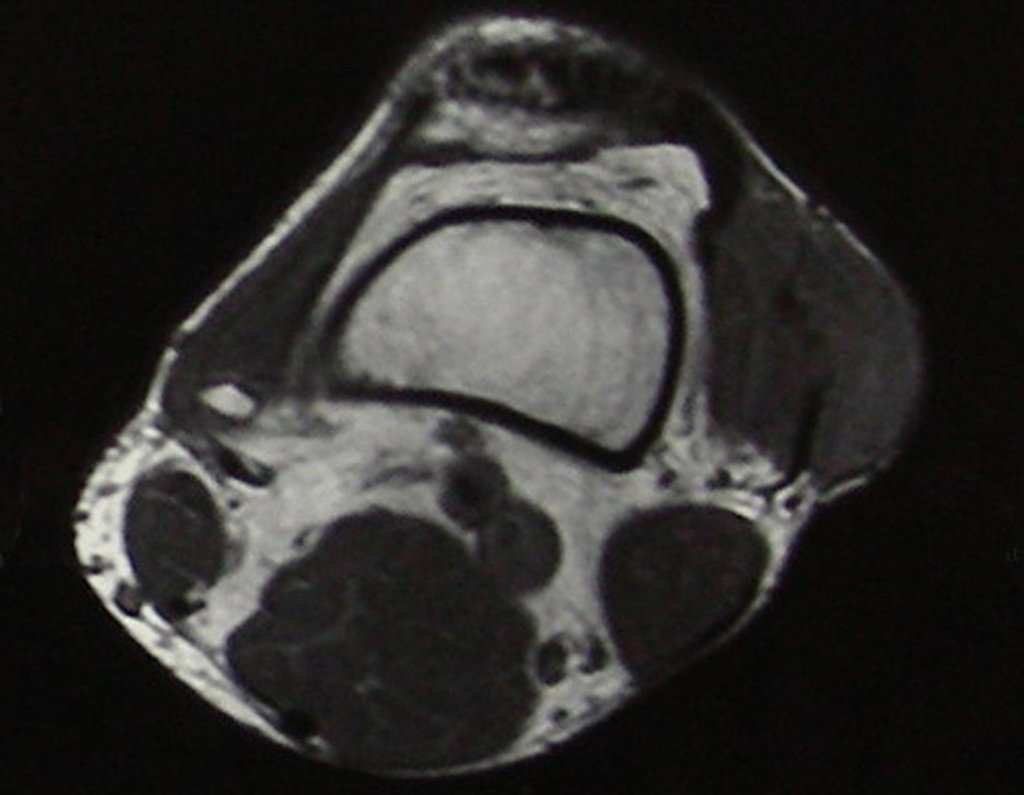
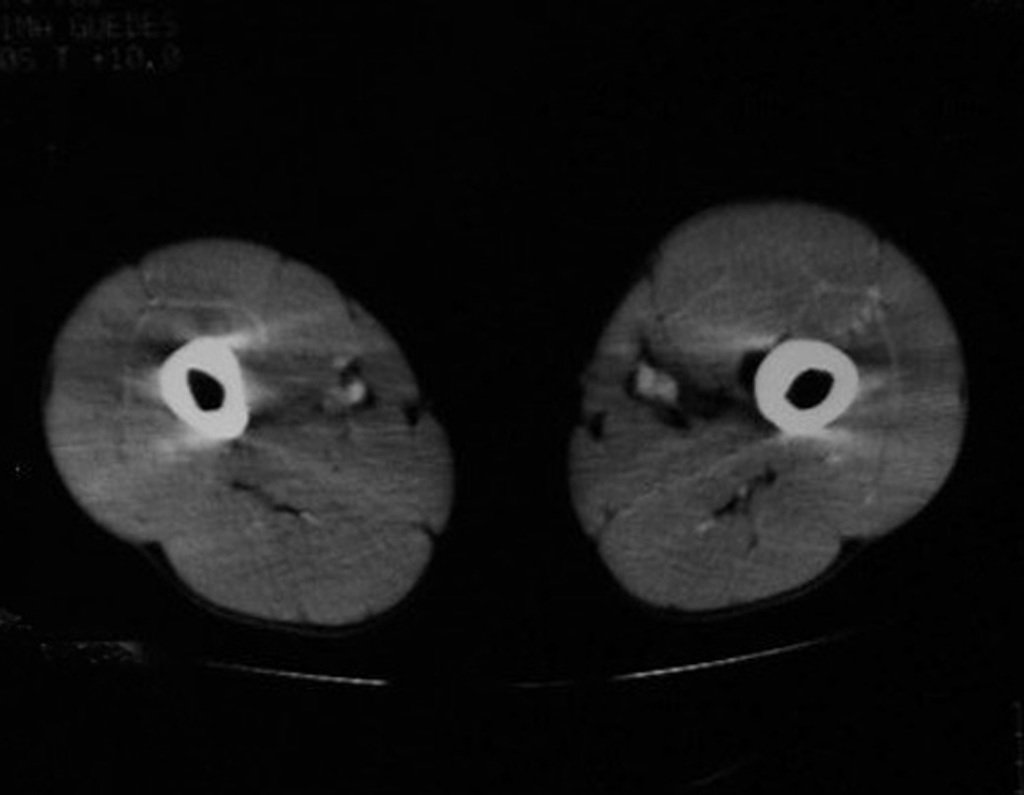
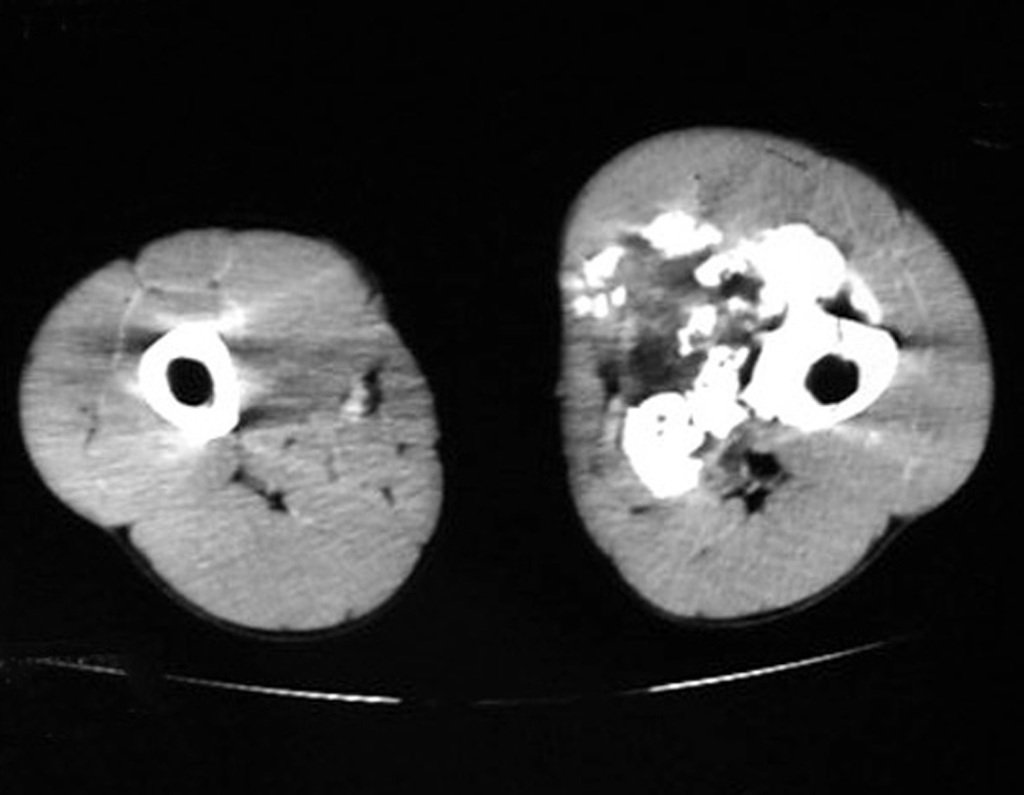
O mapeamento ósseo auxilia no estadiamento do tumor (Figura 48 ). A ressonância magnética e a tomografia são importantes para a avaliação da extensão intramedular e comprometimento extra-ósseo da lesão2.
A macroscópia apresenta coloração brancoazulada com focos de calcificação amarelada, formando lóbulos separados por septos de tecido conjuntivo e áreas de necrose2,24,6,14 (Figura 49 e 50).
Microscopicamente, o condrossarcoma central apresenta hipercelularidade, núcleos volumosos, às vezes binucleados, polimorfismo, atipias, matriz intercelular mixóide, invasão e destruição de trabéculas ósseas adjacentes. Esta histologia pode ainda apresentar, baixo ou alto grau de indiferenciação.
As lesões de baixo grau podem ser confundidas com tumores cartilaginosos benignos, já que a diferença histológica destes tumores é sutil. Considera-se lesão de baixo grau quando existe celularidade, atipias, polimorfismo e formas binucleadas em grau moderado12 (Figura 51).
No alto grau ocorre hipercelularidade, atipias e polimorfismo acentuado, com várias figuras mitóticas em matriz intercelular mixóide14,12.
2. Condrossarcoma justacortical (ou de superfície)
Também chamados de parosteal ou periosteal,estes tumores desenvolvem-se na superfície do osso.
São raros, representam 20 % dos condrossarcomas em geral são de baixo grau e incidem em adultos jovens23. Acometem a região metadiafisária dos ossos longos com preferência na região posterior e distal do fêmur, anterior e proximal da tíbia e proximal do úmero14.
A lesão envolve a cortical, com margens mal delimitadas e crescem de modo mais rápido que o condrossarcoma convencional. Apresentam consistência endurecida, geralmente indolores e sem sinais flogísticos na pele subjacente23 (Figuras 52 a 60).
Na variável altamente maligna há erosão da cortical, presença de tumor palpável, mole e doloroso2.
Radiograficamente pode ocorrer lesão de rarefação óssea, transparente, com focos de calcificação entre a cortical óssea erodida e o periósteo elevado.
Macroscopicamente, ao diagnóstico, é uma lesão maior que cinco centímetros, lobulada e aderida à superfície do osso.
A microscopia é similar ao condrossarcoma convencional. Nódulos do tumor podem invadir os tecidos moles periféricos.
3. Condrossarcoma periférico ou exofítico Diferencia-se do tipo justa cortical, pois surge a partir de um osteocondroma pré-existente. Deve-se considerar malignização de um osteocondroma quando ocorre crescimento da lesão após a maturidade esquelética, sem trauma prévio ou atrito repetitivo.
Radiograficamente apresentam tumores de grande volume, com áreas radiopacas na periferia, de aspecto globoso ou ovóide, superfície lisa ou multilobulada, calcificado na porção central, fortemente implantado no osso hospedeiro, aparentando ser um tumor vegetante o que nem sempre se confirma, pois tem limites externos bem definidos23.
Crescem mais lentamente do que o tipo central e freqüentemente são grandes ao diagnóstico12,14.
Este tipo de condrossarcoma cura-se somente com a ressecção adequada. Deve-se fazer uma ressecção parietal da porção óssea onde o osteocondroma encontra-se inserido29,12, evitando-se a dissecção romba da superfície da lesão.
Na degeneração sarcomatosa ocorre aumento da espessura da capa de cartilagem, com calcificações irregulares e dor onde anteriormente era indolor2,4.
São mais frerquentes no ilíaco e na escápula, seguido da região proximal do fêmur, distal do fêmur, proximal do úmero e proximal da tibia3,12,23,29.
As figuras 61 a 103 ilustram exemplos de condrossarcoma periférico, secundário a osteocondroma, com diferentes aspectos, nas principais localizações em frequência.
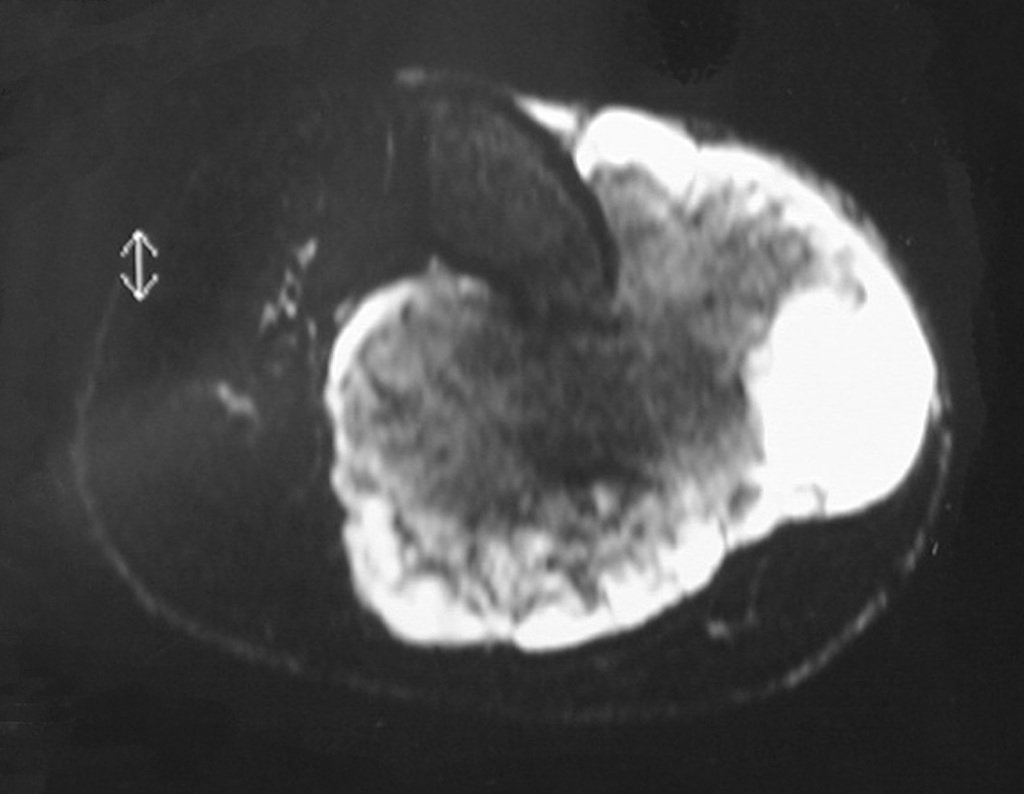
O diagnóstico histológico de condrossarcoma bem diferenciado é um desafio.
O mesmo aspecto histológico de irregularidade na disposição e no número das células dentro da matriz condróide, com alterações nucleares de hipercromasia, discreto polimorfismo e algumas mitoses atípicas, pode representar entidades diferentes: condrossarcoma, quando situados em raízes de membros e condroma quando encontrados nas mãos e pés.
Na microscopia a descrição dos condromas das mãos e dos pés, é semelhante à do condrossarcoma central23.
Os dados de história clínica, da localização e os aspectos de imagem devem ser valorizados para a conclusão do diagnóstico e a definição da conduta adequada12,14,23.
4. Condrossarcoma Mesenquimal
Descrito inicialmente por Lichtenstein e Bernstein em 195916, é extremamente raro24. A maior casuística, trinta casos, foi publicada por Salvador18.
Caracteriza-se por áreas de cartilagem diferenciada, entremeadas por tecido mesenquimatoso com células redondas ou fusiformes, altamente vascularizadas com padrão hemangiopericítico2 (Figura 104).
Apresenta discreto predomínio no sexo feminino, ocorre entre a segunda e terceira décadas de vida2,6,14, surge freqüentemente nas extremidades inferiores, nos maxilares, mandíbula e costelas. A dor e o aumento de volume são os principais sintomas clínicos2.
Pode assemelhar-se ao condrossarcoma convencional.
Radiograficamente tem aspecto agressivo29 com comprometimento de tecidos moles e metástases pulmonares freqüentes12.
Apresenta alto grau de malignidade, com pequenas células azuis redondas ou fusiformes que rodeiam ilhas de cartilagem, de aparência benigna bem diferenciada, padrão semelhante ao hemangiopericitoma24,29.
As células assemelham-se a condroblastos indiferenciados6.
Macroscopicamente apresentam áreas de coloração branco-acinzentada ou amarelada, de consistência amolecida, alternadas com áreas endurecidas, de aspecto cartilaginoso e focos de calcificação.
5. Condrossarcoma de Células Claras
Neoplasia rara, localizada nas epífises de ossos longos e composta por células redondas com citoplasma abundante, claro e numerosas células gigantes2,24, 29 (Figura 105).
Afeta essencialmente os adultos e envolve o fêmur proximal, úmero e tíbia2,29.
Na radiografia mostra-se como uma lesão epifisária, bem definida, semelhante ao tumor gigante celular (T.G.C.)2 ou ao condroblastoma, interpretado por alguns autores como a evolução maligna desta neoplasia4.
A dúvida diagnóstica com o condroma pode ocorrer, devendo-se sempre considerar a agressividade radiográfica para a definição da conduta adequada.
6. Condrossarcoma Desdiferenciado
É um sarcoma altamente anaplásico junto a um condrossarcoma maligno de baixo grau, apresentando transição abrupta entre ambos29 (Figura 106).
Pode ter aspecto de fibrohistiocitoma maligno, fibrossarcoma, osteossarcoma ou rabdomiossarcoma2,29.
Acomete a pelve e os ossos longos, particularmente o fêmur e o úmero. Ocorre nos pacientes acima dos vinte anos de idade e apresenta pico de incidência entre 40 e 50 anos, sem predileção entre homens e mulheres.
Na radiografia as lesões são semelhantes ao condrossarcoma comum, mas a presença de uma área maior de lise na cortical sugere lesão agressiva29.
Diagnóstico Diferencial:
Apresenta diagnóstico diferencial com a miosite ossificante, o fibroma condromixóide, o T.G.C., o linfoma não Hodgkin6,23,29 e com o cisto ósseo aneurismático, por seu caráter multiloculado. Histológicamente, o subtipo justacortical assemelha-se ao condroma, ao osteocondroma, ao condroblastoma e ao osteossarcoma de superfície16.
O condrossarcoma de células claras tem condrócitos malignos com citoplasma claro, células gigantes tipo osteoclasto e formação de osso reativo intralesional causando confusão com osteossarcoma.
O condrossarcoma mesenquimal é formado por ilhas de cartilagem hialina bem diferenciada circundada por lâminas de células pequenas e redondas, que lembram hemangiopericitoma e sarcoma de Ewing 14.
O condroma central dos ossos longos, o condrossarcoma e o infarto ósseo são muitas vezes de difícil diferenciação, necessitando acompanhamento clínico e radiográfico para avaliar a progressão ou não da lesão, antes de definir a conduta. A biópsia muitas
vezes não é definitiva para o diagnóstico12,23,29.
Tratamento:
O tratamento do condrossarcoma é cirúrgico25, devendo-se eleger uma ressecção ampla, incluindo o trajeto da biópsia13,21.
A radioterapia é ineficaz6 no controle desta neoplasia. Para as lesões de alto grau pode-se discutir indicação de quimioterapia utilizando o protocolo para sarcomas de grandes células, baseada em antraciclicos9999. Para o condrossarcoma mesenquimal, que apresenta predomínio de células pequenas e indiferenciadas, a quimioterapia quando indicada recai sobre o protocolo de tratamento do Tumor de Ewing.888
Em ambos os casos a resposta à quimioterapia costuma ser ruim6. O tratamento desta neoplasia deve ser particularizado para cada subtipo clínico:
– Condrossarcoma central apresenta altos índices de cura com a cirurgia adequada, portanto não se pode subestimar o seu tratamento com curetagem intralesional,mesmo seguida de métodos adjuvantes complementares, seja com fenol, nitrogênio líquido, eletrotermia ou laser CO2 21.
Desta maneira, nos casos de dúvida diagnóstica entre condroma e condrossarcoma grau I é preferível observar a evolução desta lesão, pois é sabido que a biópsia não será conclusiva, já que o diagnóstico diferencial histológico entre condroma e condrossarcoma grau I é difícil.
Em alguns casos, estas lesões podem ser tratadas com cirurgias conservadoras sem a realização de biópsia prévia21.
Quando os exames de imagem: radiografia, tomografia e ressonância magnética, mostram uma lesão central, sem erosão da cortical interna, de achado casual e indolor deve-se reavaliar inicialmente dentro de três meses, estando inalterado repete-se no período de seis meses e se a lesão permanecer inalterada, programa-se reavaliações anuais.
Se, em qualquer momento, houver alteração do quadro clínico ou de imagem, deve-se tratar como condrossarcoma central, realizando-se a ressecção ampla da lesão e reconstrução com endoprótese não convencional, osteossíntese com enxerto autólogo ou homólogo ou cirurgia ablativa conforme a necessidade de cada caso.
Na experiência destes autores é desnecessário operar um condroma indolor, quando é achado casual, sem caracteres de agressividade radiográfica. Realizar uma curetagem intralesional, com adjuvante local e enxerto ou cimento, não dispensará a necessidade de observação cuidadosa. Caso o exame anatomopatológico de toda a curetagem revele que se tratava de condrossarcoma, será muito pior re-operar esta região já manipulada cirurgicamente.
Há vários casos de “condroma” em que a histologia da curetagem intralesional corroborou o aspecto da biópsia de “condroma” e no entanto tiveram evolução desfavorável. No acompanhamento destes pacientes os exames de imagem revelaram que estava havendo “nova” lesão no local e que se tratava agora de condrossarcoma.
Nestas curetagens pode ocorrer disseminação local, à distância e até desdiferenciação do condrossarcoma, piorando significativamente o prognóstico.
– Condrossarcoma justacortical, o tratamento é essencialmente cirúrgico, podendo-se realizar a ressecção parcial parietal EXEMPLO quando possível, procedimento eficaz e de menor morbidade em relação a ressecção segmentar.
– Condrossarcoma periférico, secundário à osteocondroma, deve-se tomar cuidado principalmente com a superfície da lesão, que apresenta anaplasia.
O perimísio dos tecidos moles ao redor deve ser removido como margem oncológica, para evitar a recorrência local.
É importante ressaltar que quando ocorre crescimento de uma exostose óssea após a maturidade esquelética, calcificação heterogênea, capa cartilaginosa espessa, sem relação com atrito ou trauma, provavelmente trata-se de um condrossarcoma.
Nesta situação, uma amostra de biópsia negativa não exclui a possibilidade de malignidade no restante da lesão, devendo-se realizar a cirurgia de ressecção com margem oncológica, com especial atenção à superfície da lesão.
– Condrossarcoma Mesenquimal, além da necessidade do controle local com a cirurgia ampla, podem eventualmente ter indicação de tratamento quimioterápico complementar9999.
– Condrossarcoma Desdiferenciado, como o Condrossarcoma de Células Claras, deve-se realizar o controle local com a cirurgia ampla e quimioterapia com cisplatina e doxorubicina9999.
Complicações:
A curetagerem intralesional de condrossarcoma pode levar a recorrência local da doença e a desdiferenciação histológica mais agressiva.
Nos casos de condrossarcomas desdiferenciados, as metástases hematogênicas para os pulmões são freqüentes, podendo apresentar disseminação linfática e recidiva local29. Muitos condrossarcomas apresentam tendência de disseminação local14, atingindo tamanhos enormes e tornando-se inoperáveis, causando a morte por compressão ou complicações desta propagação local.
A recidiva local aumenta a incidência de metástases pulmonares21.
Bibliografia
1. ACKERMAN, L.V.; SPJUT, H.J. Tumors of bone and cartilage. Atlas of tumor pathology. Washington,Air Force Inst. Pathology, 1962, fasc, 4.
2. CANALE, S.T. Cirurgia ortopédica de Campbell.Barueri: Manole; 2006
3. DAHLIN, D.C. Tumores óseos . Barcelona: Ediciones Toray S/A; 1982
4. DORFMAN, H.D.; CZERNIAK, B. Bone tumors. St Louis, C.V. Mosby Co., 1997, cap. 7, p.410.
5. EDEIKEN, J.; HODES, P.J. Diagnóstico radiológico de las enfermedades de los huesos. Buenos Aires, Panamericana, 1977, cap. 15.
6. ETCHEBEHERE, M. Tumores cartilaginosos malignos: Condrossarcomas. In: Camargo O.P. Clínica Ortopédica. Rio de Janeiro: Med si; 2002. p. 753-759
7. FELDMAN, F. Cartilaginous tumors and cartilage-forming tumor like conditions of the bonés and soft tissues. In: Diseases of the Skeleton System (Roentgen Diagnosis). Part. 6 – Bone Tumors, New York, Springer-Verlag, 1977,p.177.
8. FLETCHER, C.D.M., Unni K.K., OMS – Merters F. (Eds.): World Health Organization. Classification of Tumors. Pathology and Genetics of Tumors of Soft Tissue and Bone. IARC Press: Lyon 2002.
9. GREENSPAN, A. Radiologia ortopédica. Rio de Janeiro: Guanabara; 2001.
10. HENDERSON, E.D.; Le PAGE, G. A. Apud FELDAMAN, F. Cartilaginius tumors and cartilage forming tumor like conditions of the bone and soft tissues. In: Disease of the Skeletal System (Roentgen Diagnosis).
Part. 6 – Bone tumors, New York, Springer Verlag, 1977, p.182.
11. HUVOS, A.G. Bone tumors Diagnosis, Treatment and Prognosis. Philadelphia, W. B. Saunders Co., 1979, p. 13.
12. JAFFE, H.L. Tumores y estados tumorales oseos y articulares. México: La Prensa Medica Mexicana;1966.
13. JESUS-GARCIA, R. – Reynaldo Jesus-Garcia
14. LICHTENSTEIN, L. Barcelona: Talleres Gráficos Ibero-Americanos; 1975.
15. LICHTESTEIN, L. Bone Tumor. 4 Ed St. Louis,C.V. Mosby Co., 1972, cap. 15.
16. LICHTESTEIN, L.; BERNSTEIN, D. Unusual benign and malignant chondroid tumors of bone. Cancer, 12:1142, 1959.
17. MARCOVE, R.C. Condrosarcoma: Diagnóstico y tratamiento. In: Clínicas Ortopécias de Norteamérica. Tumores del aparato musculosquelético. Buenos Aires, Panamericana, 1977, cap. 7.
18. MARCOVE, R.C. et al. Chondrosarcoma of the pélvis and upper end of the femur. Na analisys of factors influencing survival time in113 cases. J. Bone Joint Surg., 54A:61, 1972.
19. MARCOVE, R.C.; SHOJI, H,; HARLEN, M. Altered carbohidrate metabolism in cartilaginous tumors. Contemp. Surg. 5:53, 1974.
20. McFARLAND, G.B.Jr.; McKINLEY, L.M.; REED, R.J. Dedifferentiation of low grade chondrosarcomas. Clin. Orthop., 122:157, 1971.
21. MENENDEZ, L.R. Orthopaedic knowledge update: Actualizaciones en cirugía ortopédica y traumatología. Barcelona: Ars Medica; 2003.
22. O’NEAL, L.W.; ACKERMAN, L. V. Chondrossarcoma of boné. Cancer, 5:551, 1952.
23. PRÓSPERO, J.D. Tumores Ósseos. São Paulo, Roca, 2001, cap. II.
24. ROBBINS. Patologia estrutural e funcional. Rio de Janeiro: Guanabara; 1996.
25. ROMSDAHL, M.; EVANS, H.L.; AYALA, A.G. Surgical treatment of chondrosarcoma. In: Managment of primary bone and soft tissue tumors. Chicago, Year book med. Publisher Inc., 1977, p. 125.
26. ROMSDAHL, M.; Evans, H.L.; Ayala, A.G. Surgical treatment of chondrosarcoma. In: Managment of primary bone and soft tissue tumors. Chicago. Year book med. Publisher Inc., 1977, p.125.
27. SALVADOR, A.H.; BEABOUT, J.W.; DAHLIN, D.C. Mesenchimal chondrosarcoma. Cancer, 28:605, 1971.
28. SCHAJOWICZ, F. Justacortical Chondrosarcoma. J. Bone Joint. Surg., 59B:473, 1977.
29. SCHAJOWICZ, F. Tumores y Lesiones Seudotumorales de Huesos y Articulaciones. Buenos Aires: Editora Médica Panamericana; 1982.
30. TORNBERG, D.N.; RICE, R.W.; JOHNSTON, A.D. The ultrastructure of chondromyxoid fibroma.Clin. Orthop. Rel. Research, 95:295, 1973.
999. J Clin Oncol 30:abstrat 100:23,2012(maluf)
888. Buzaide, A.C.; Maluf, F.C.; Rocha Lima, C.M.
Manual de Oncologia Clinica do Brasil. Dendrix Edição e Design ltda. São Paulo (XI) Sarcomas Ósseos do Adulto, 560-79. 2013
Autor : Prof. Dr. Pedro Péricles Ribeiro Baptista
Oncocirurgia Ortopédica do Instituto do Câncer Dr. Arnaldo Vieira de Carvalho
Consultório: Rua General Jardim, 846 – Cj 41 – Cep: 01223-010 Higienópolis São Paulo – S.P.
Fone:+55 11 3231-4638 Cel:+55 11 99863-5577 Email: drpprb@gmail.com