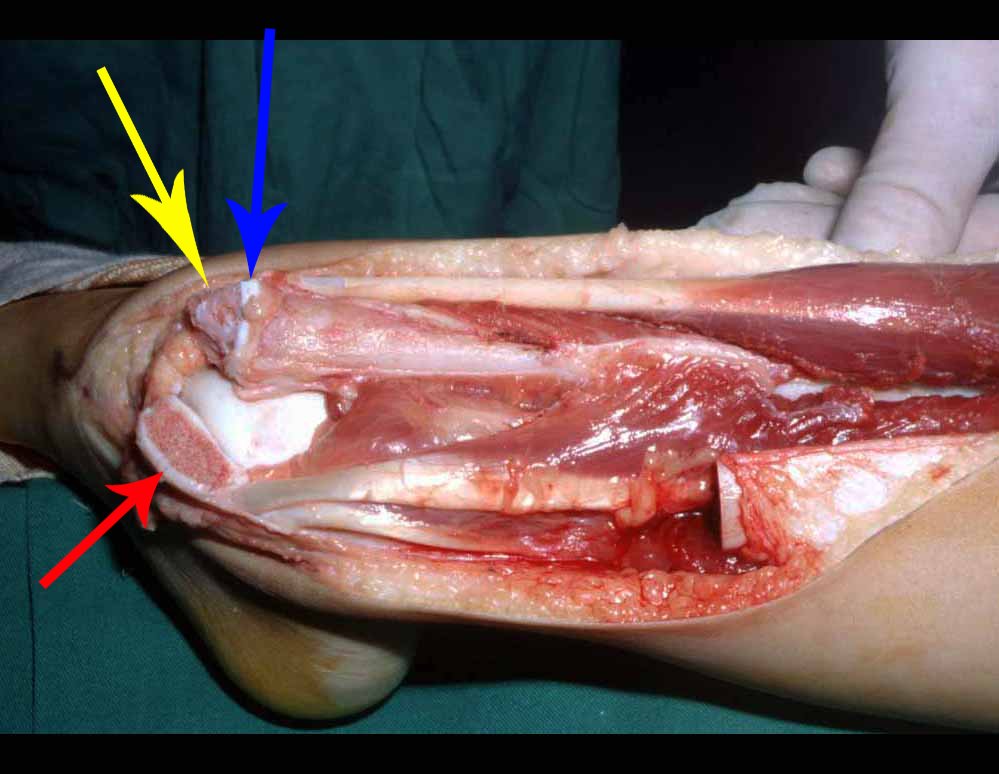
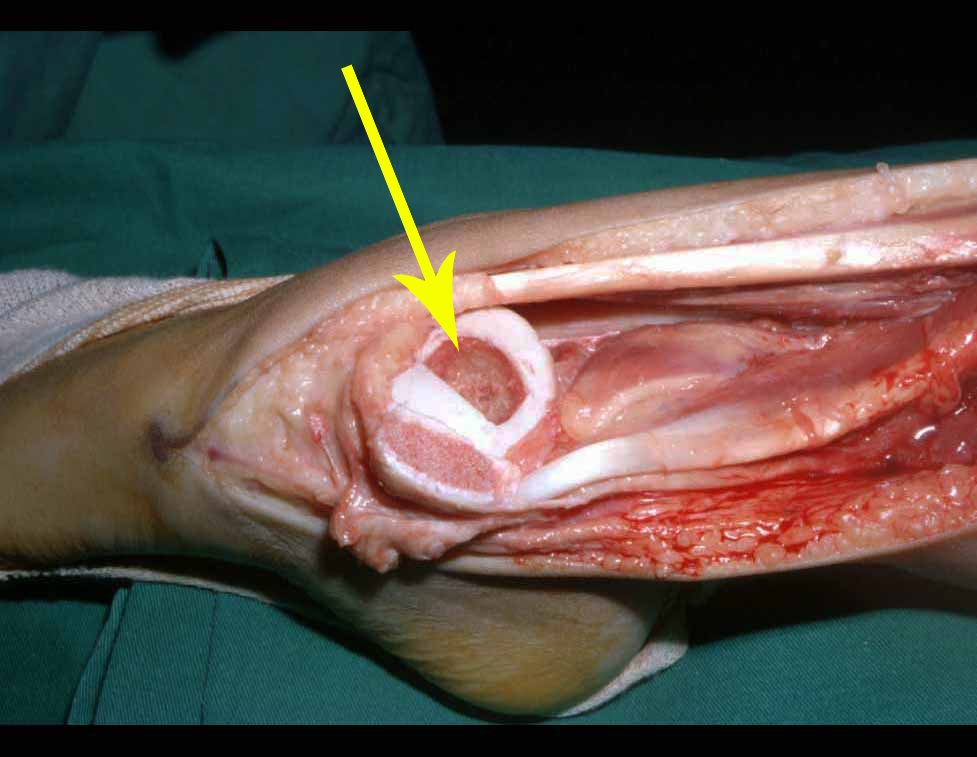
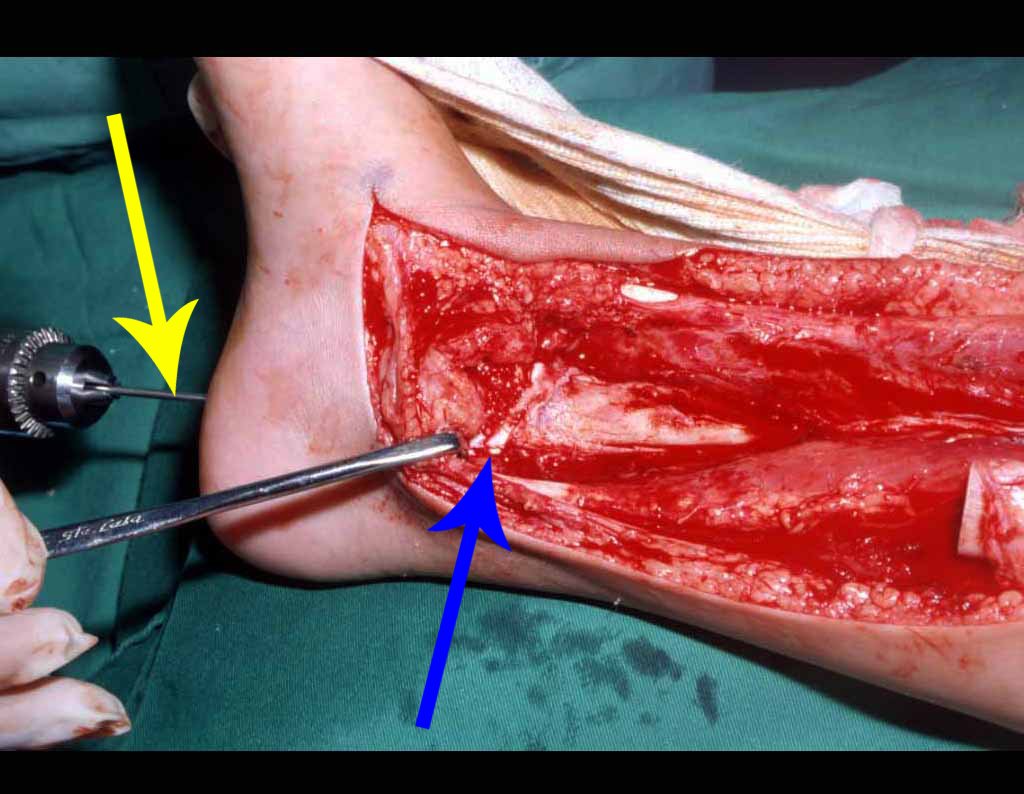
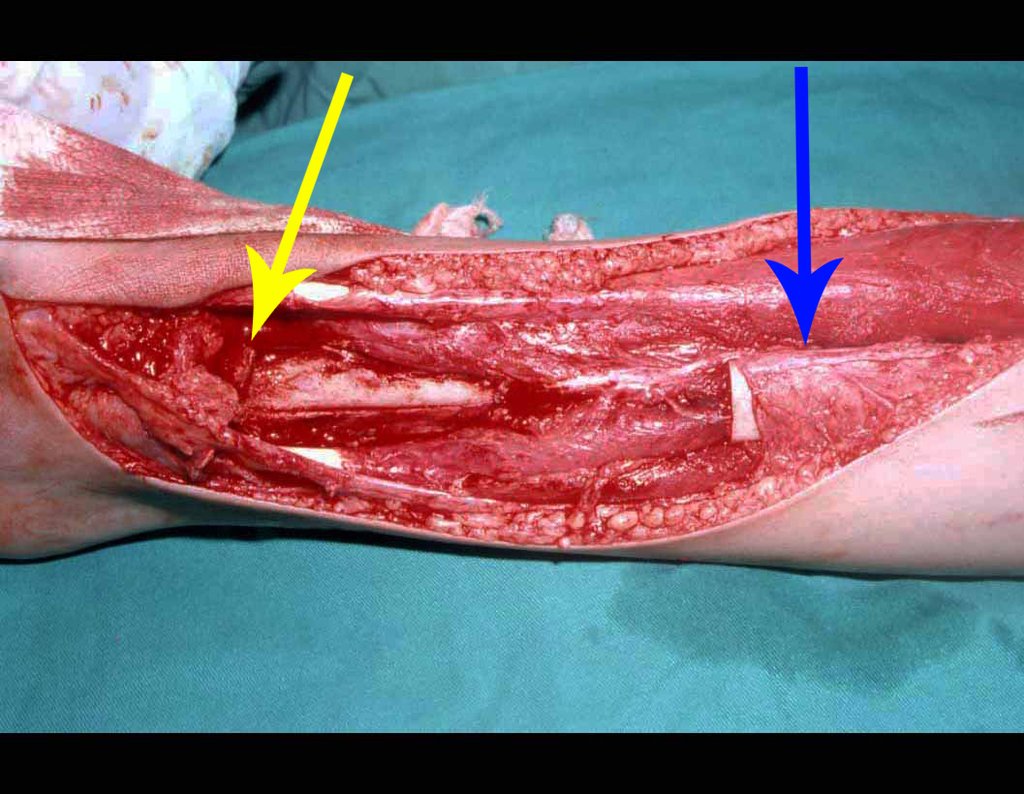
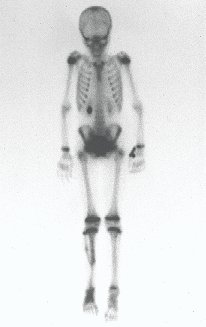
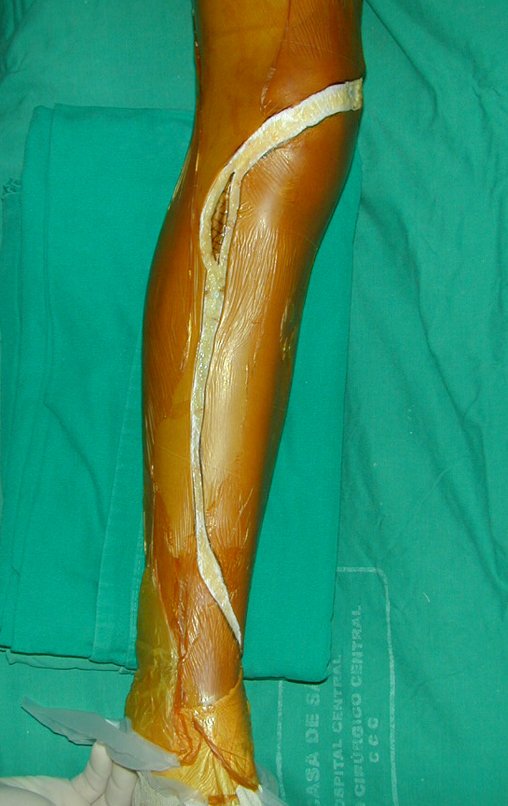
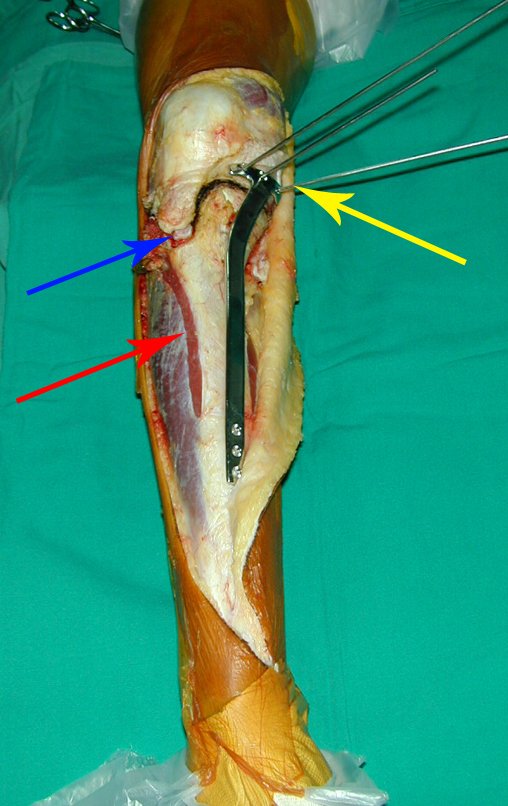
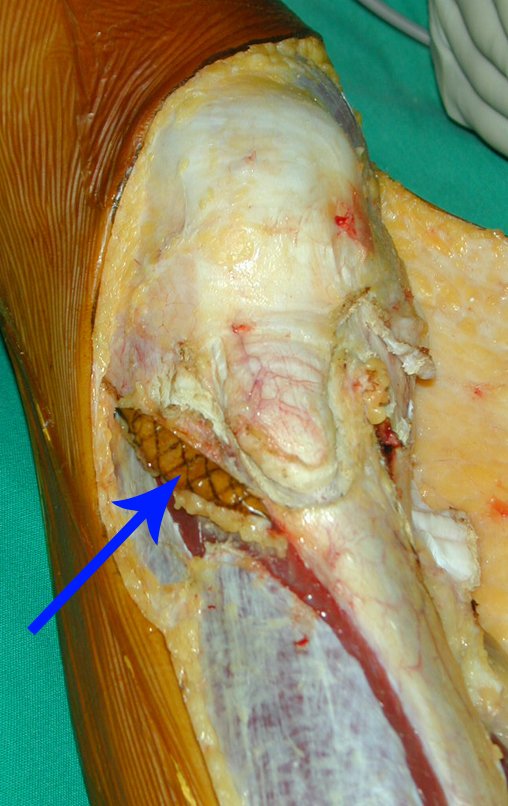
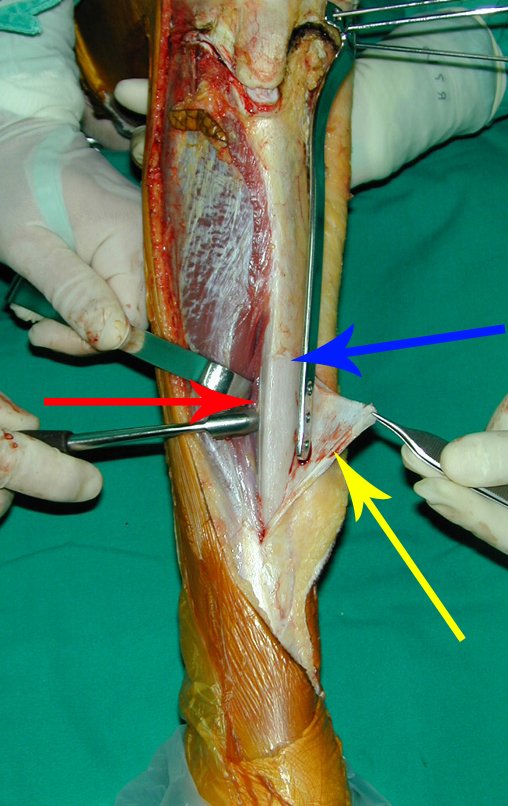
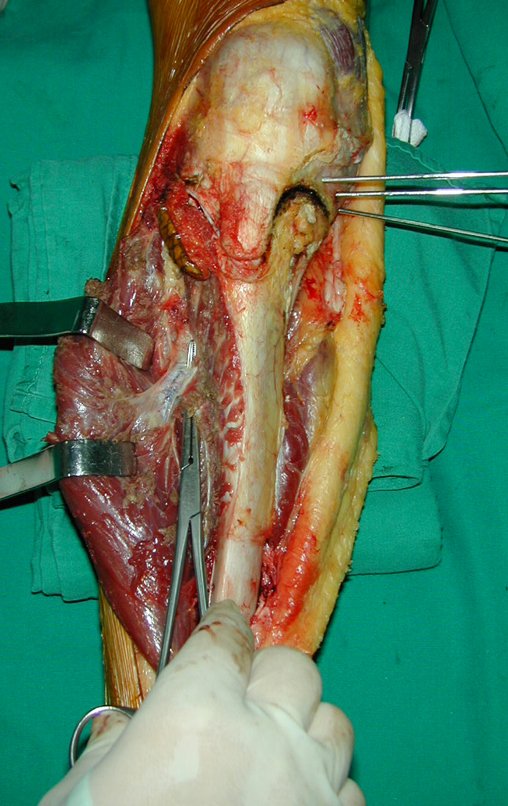
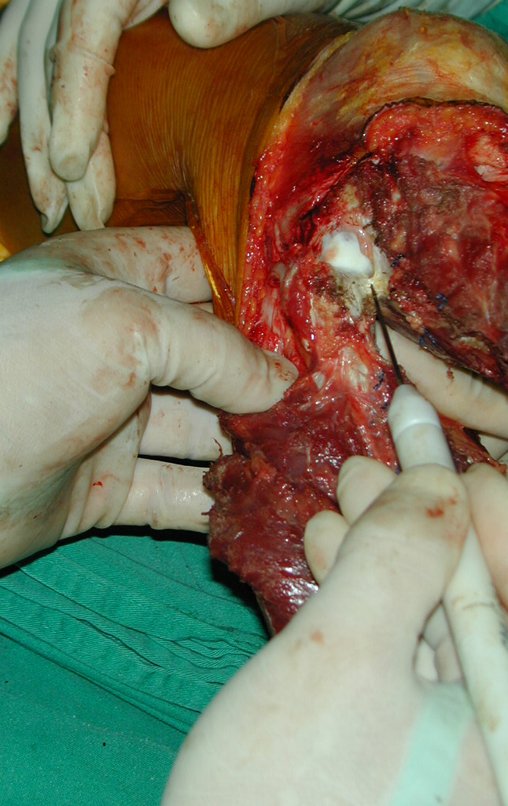
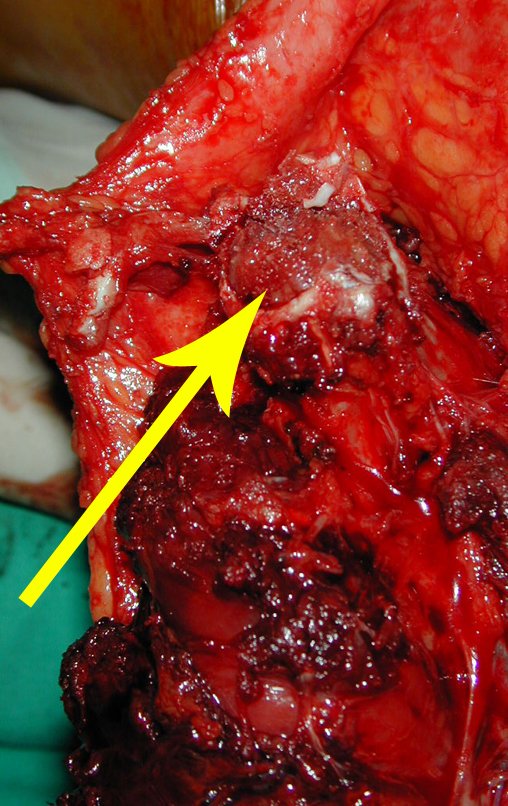
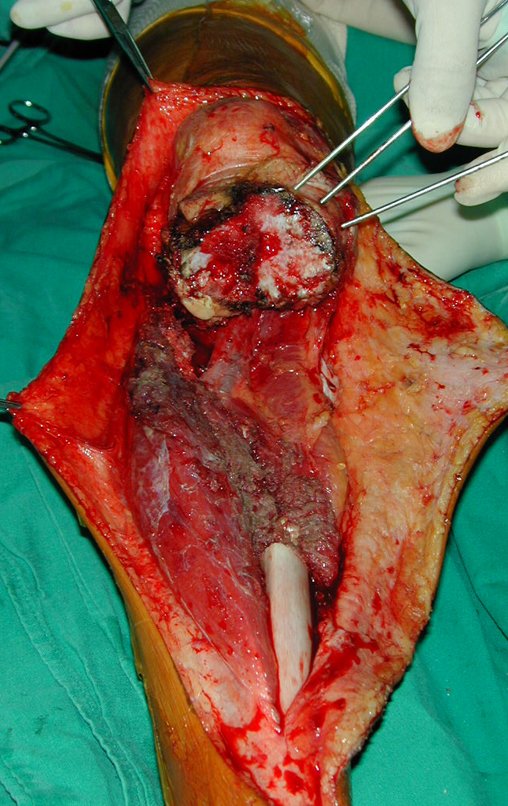
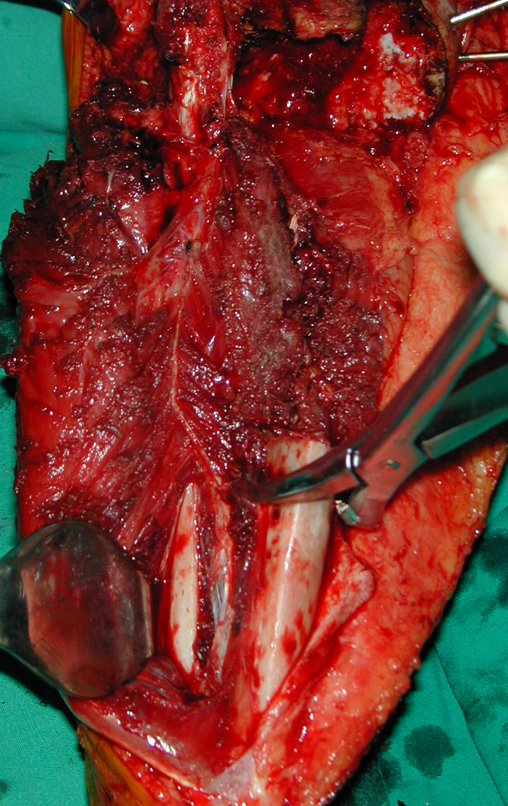
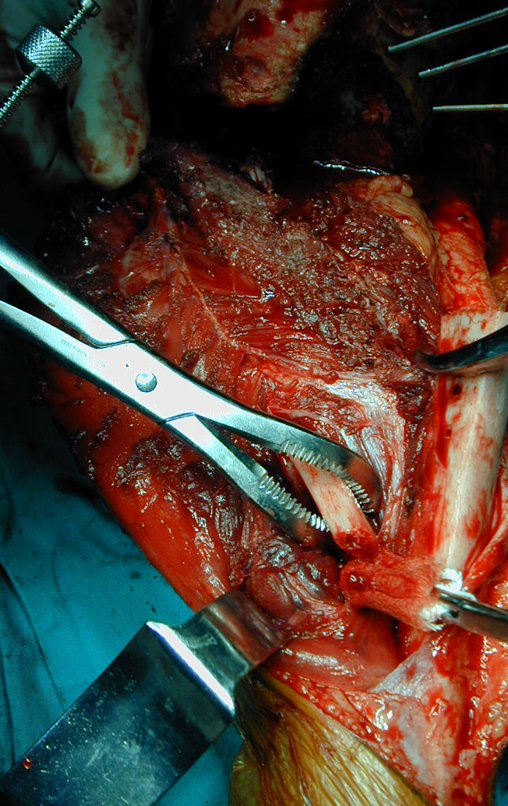
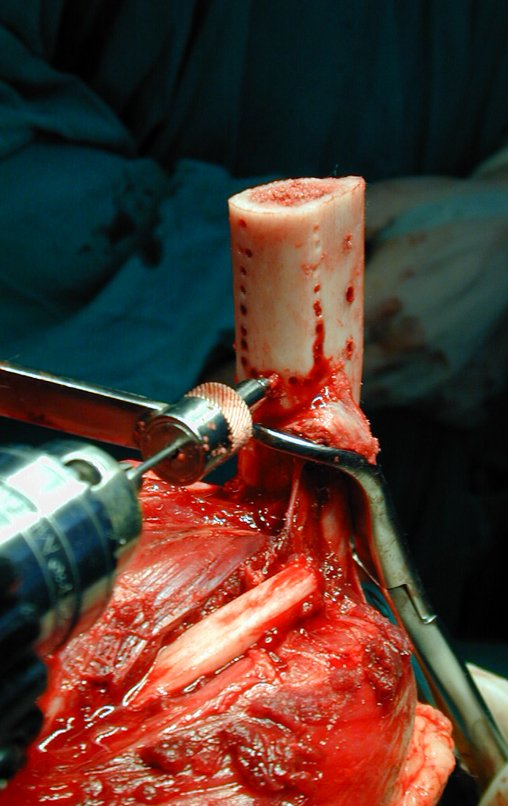
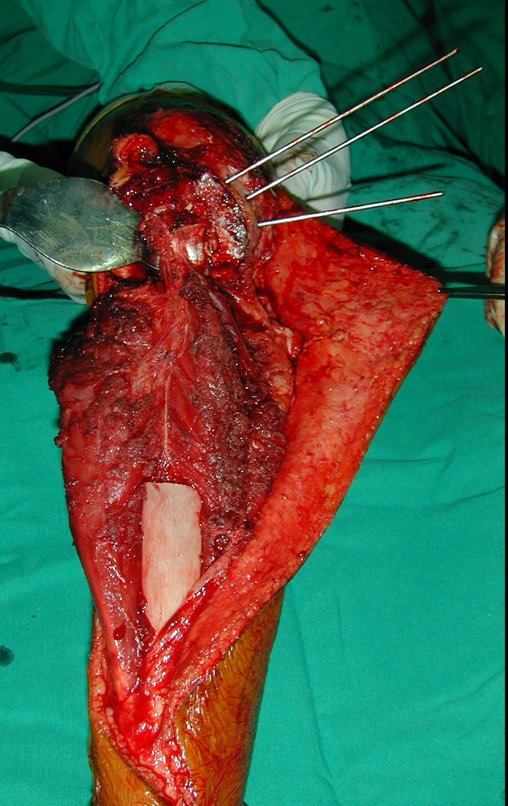
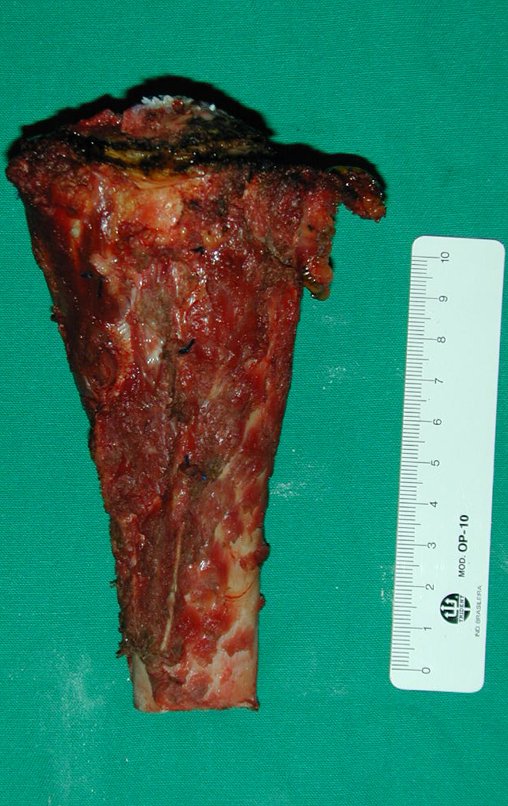
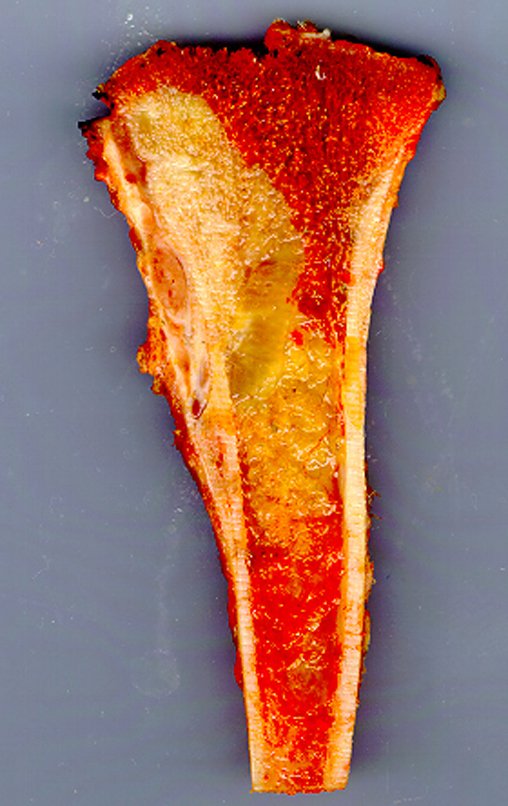
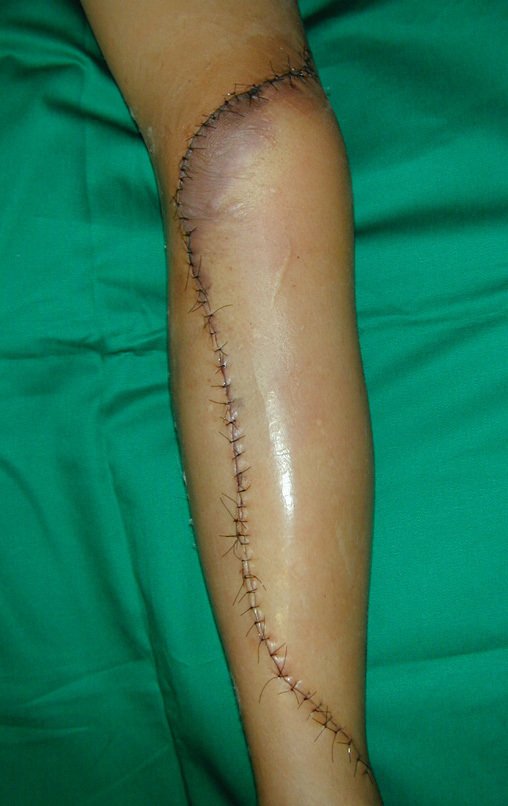
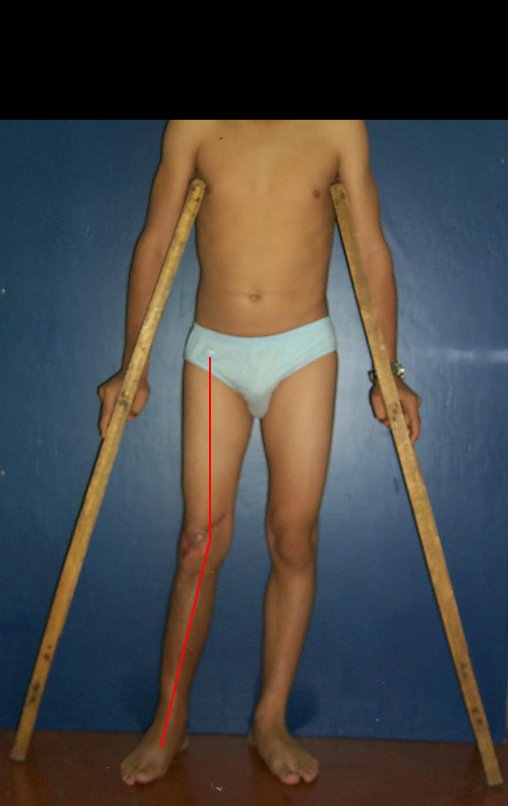
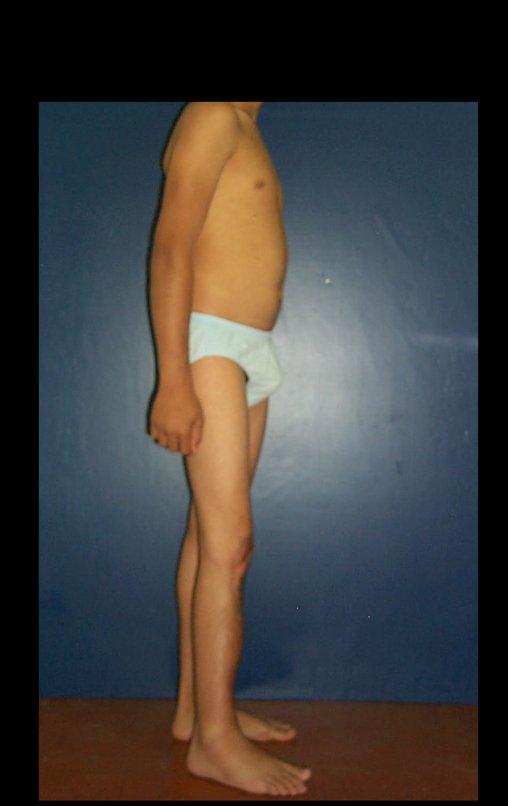
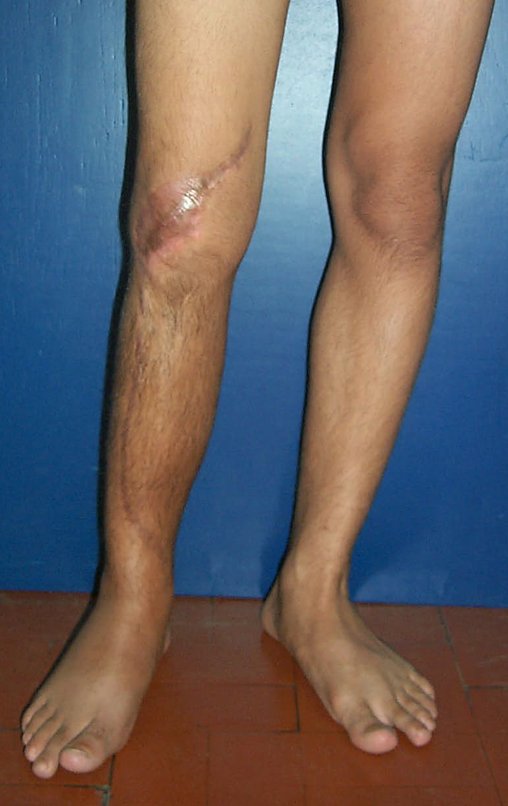
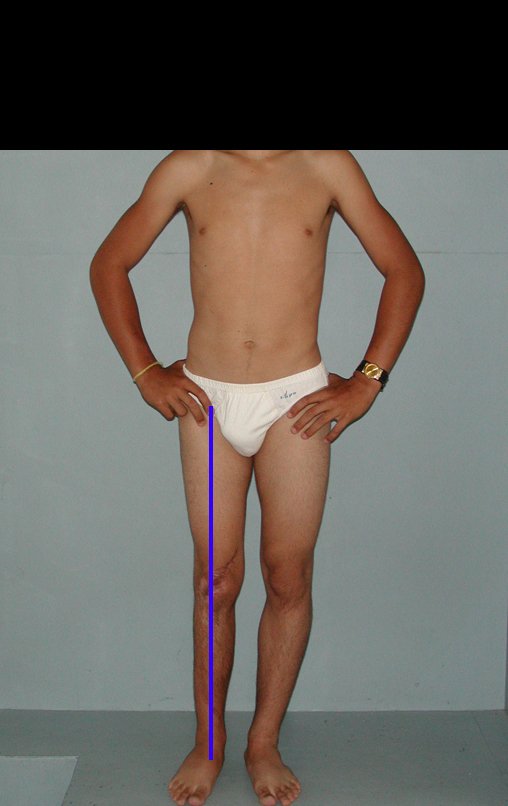
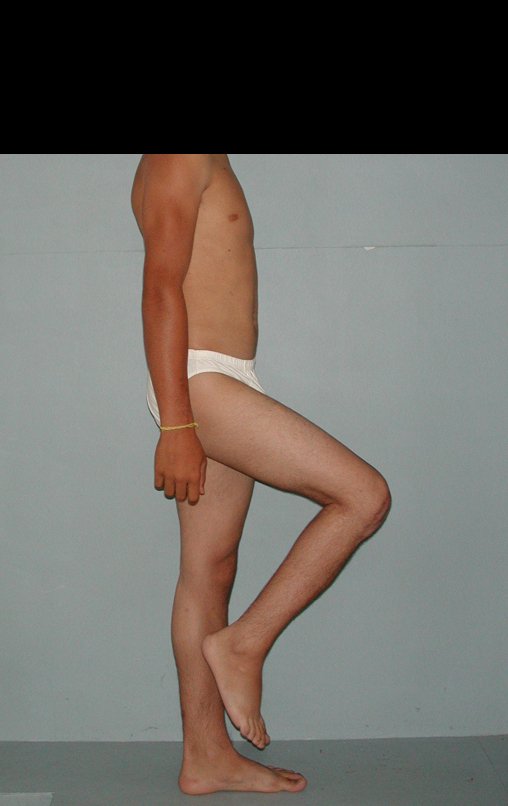
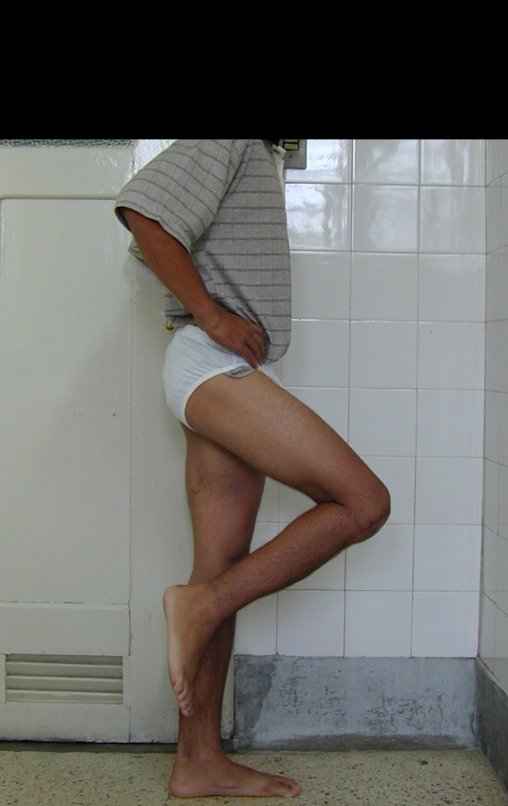
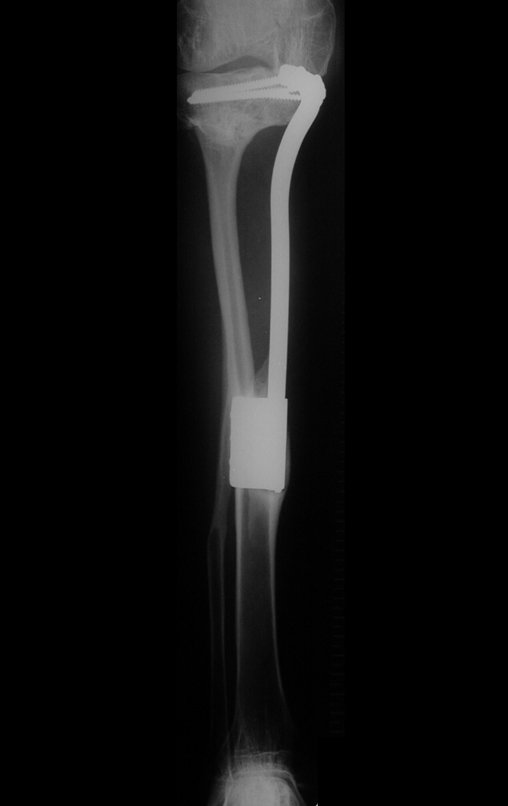
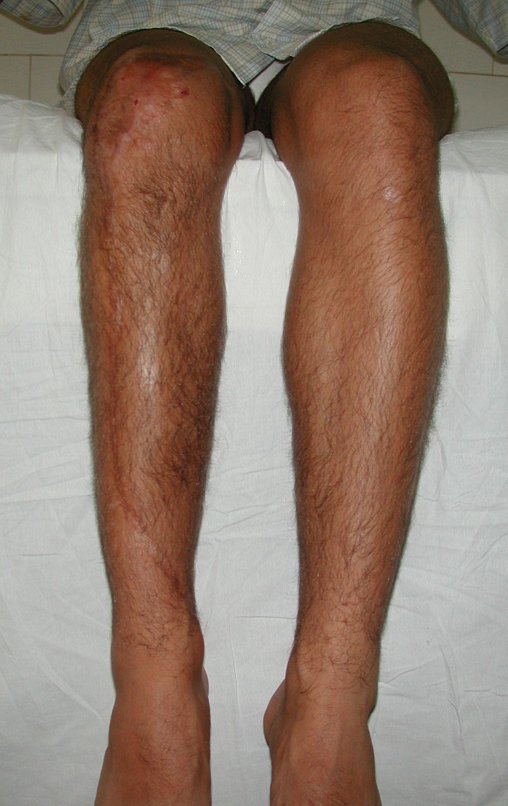
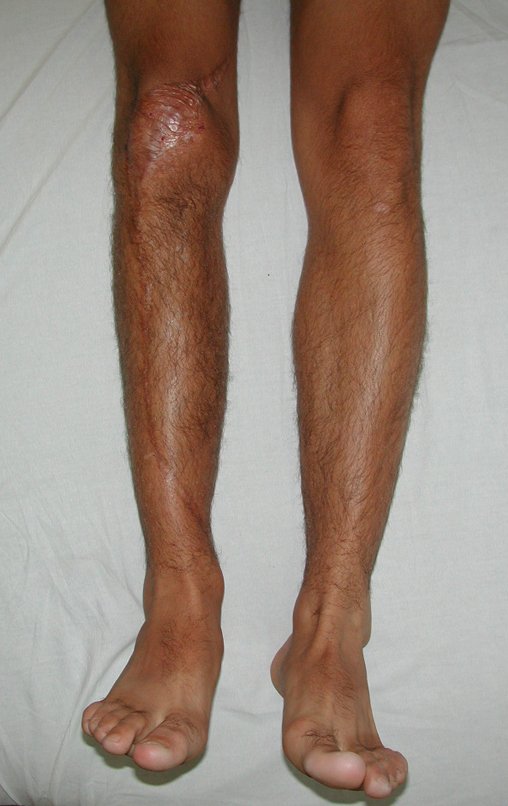
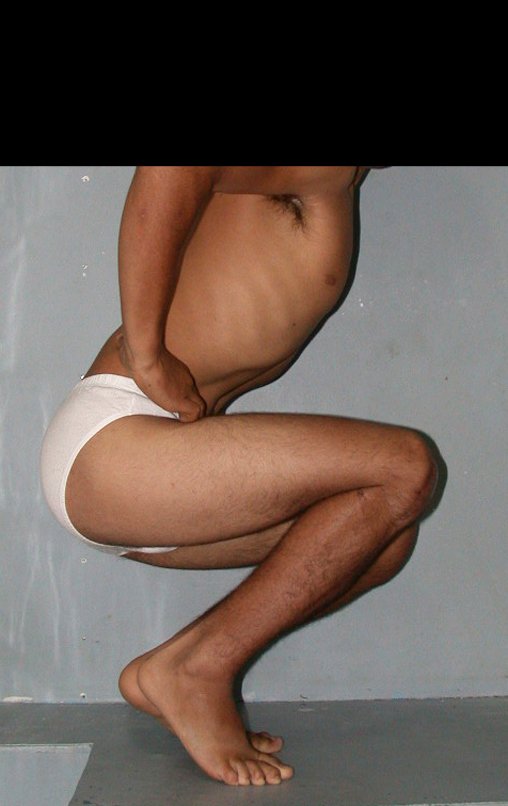
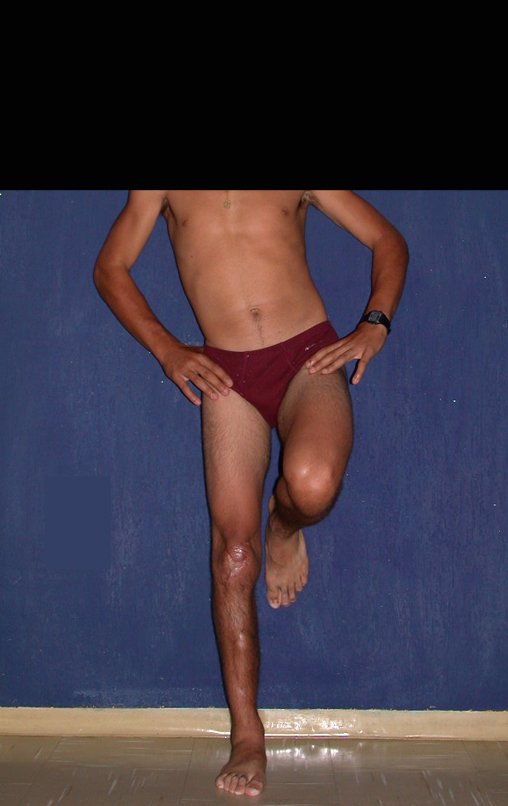
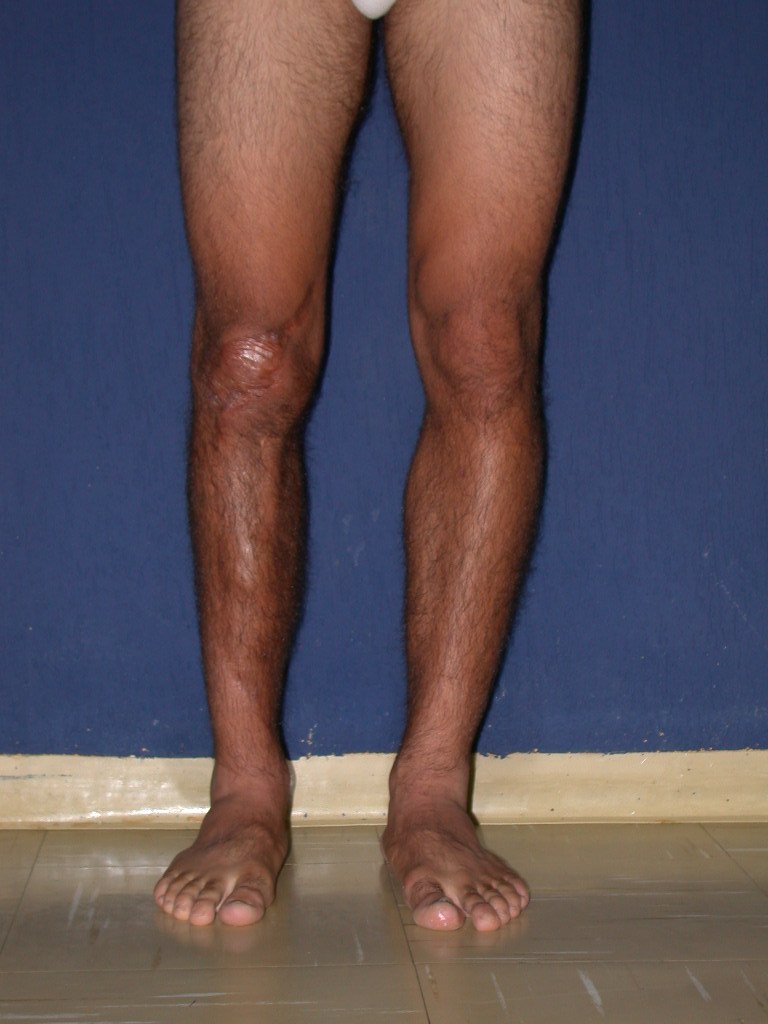
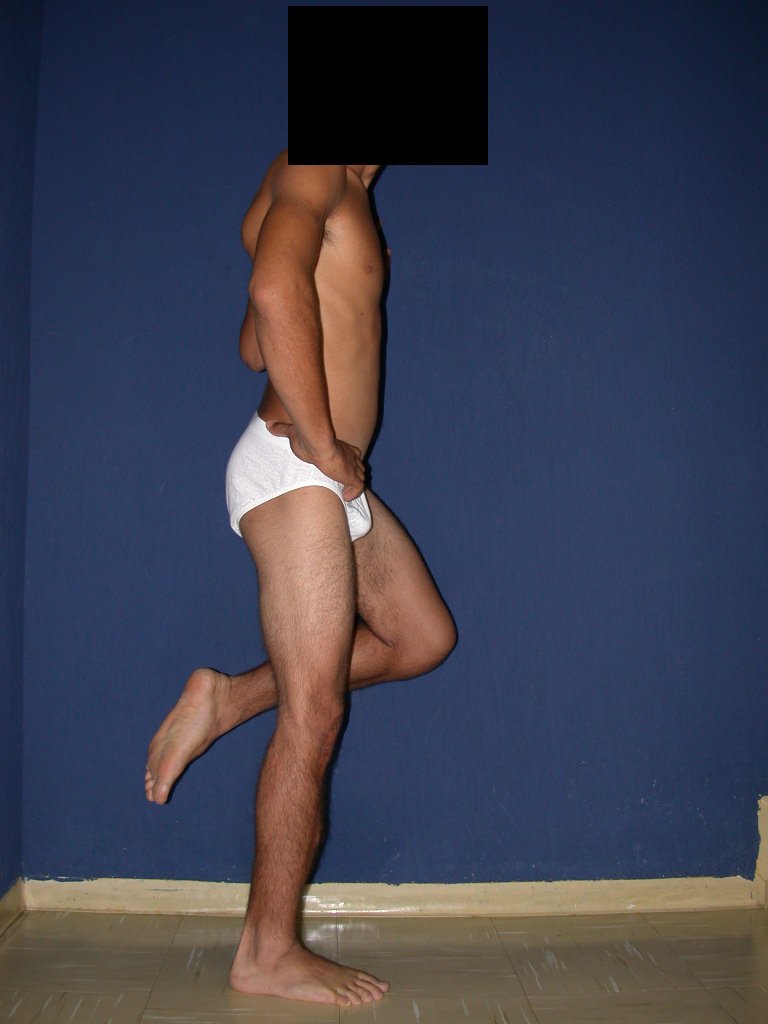
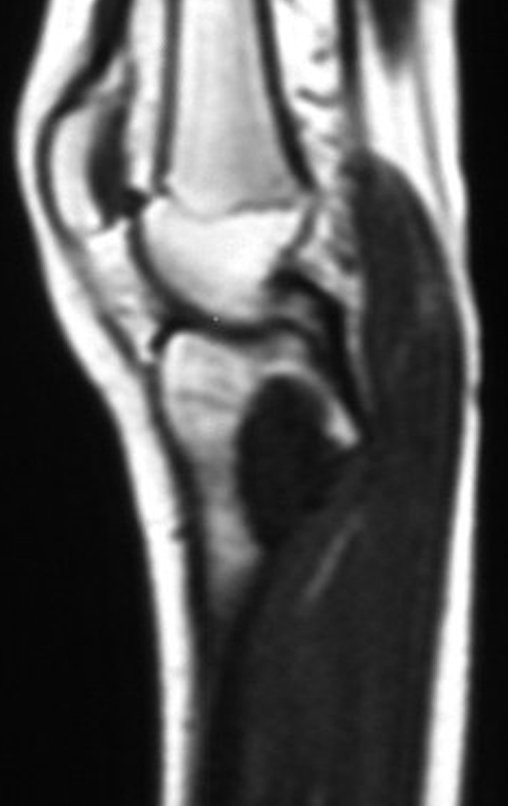
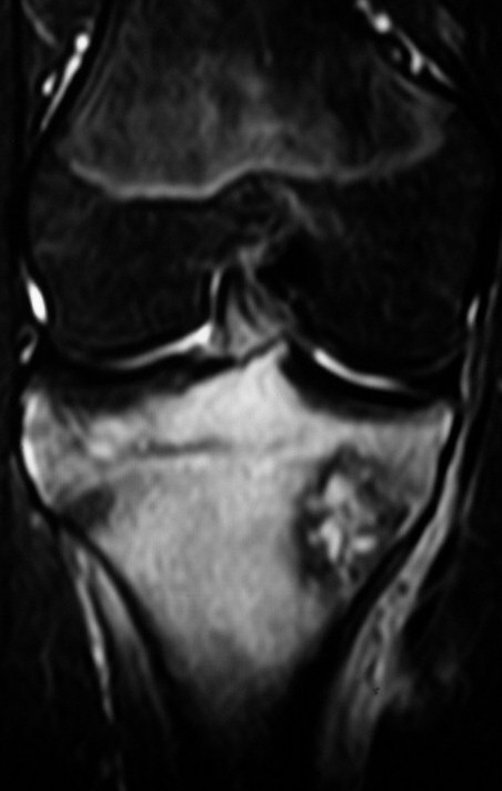
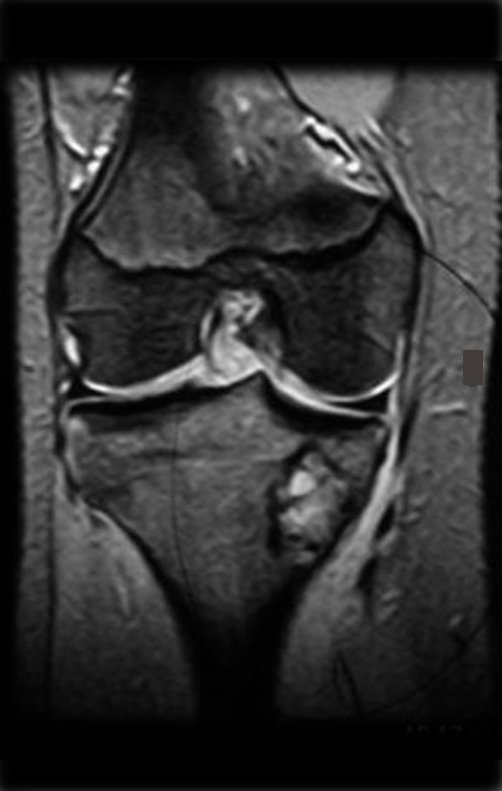
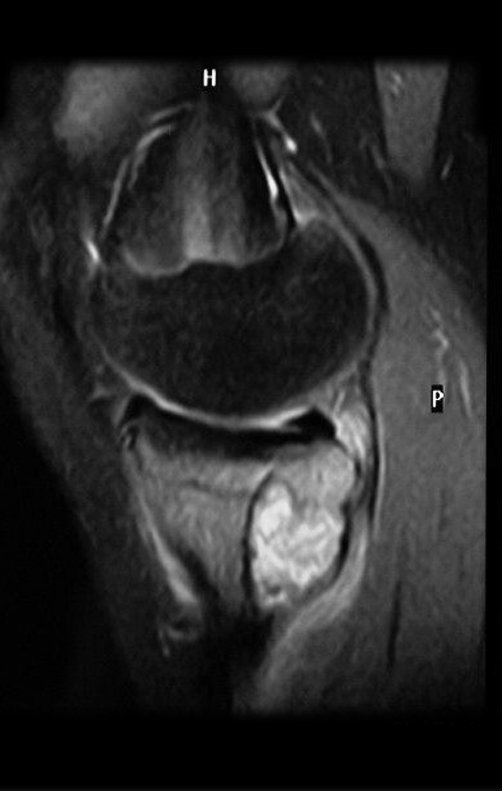
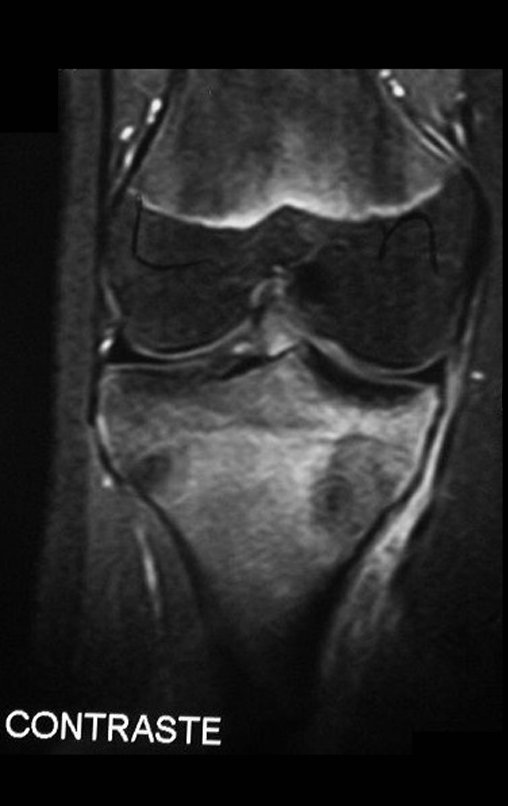
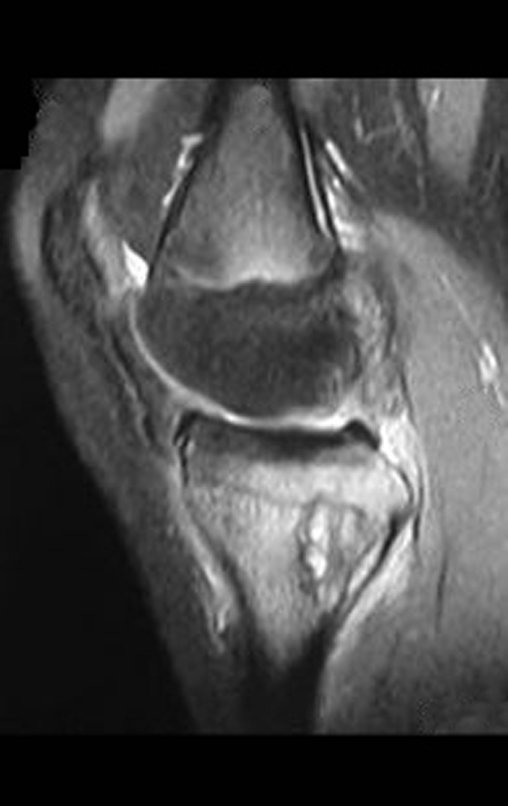
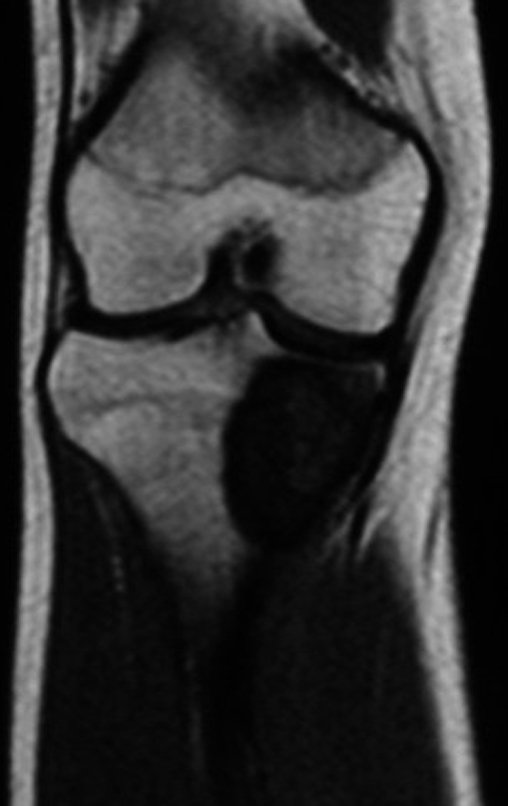
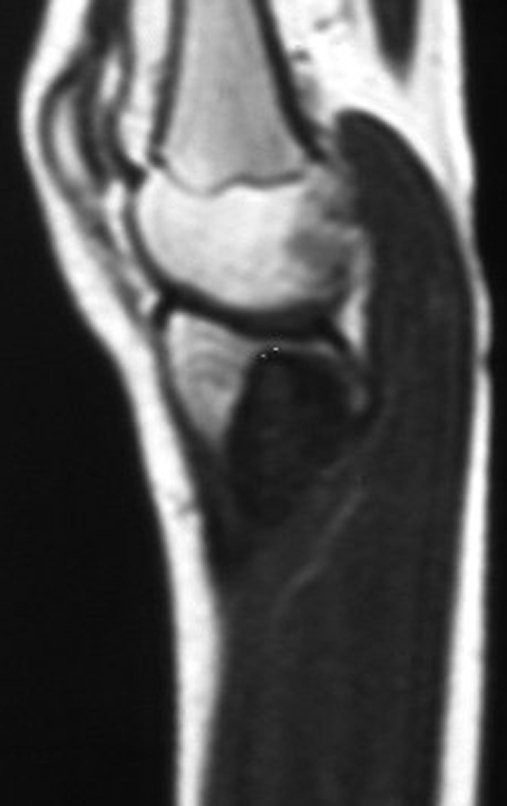
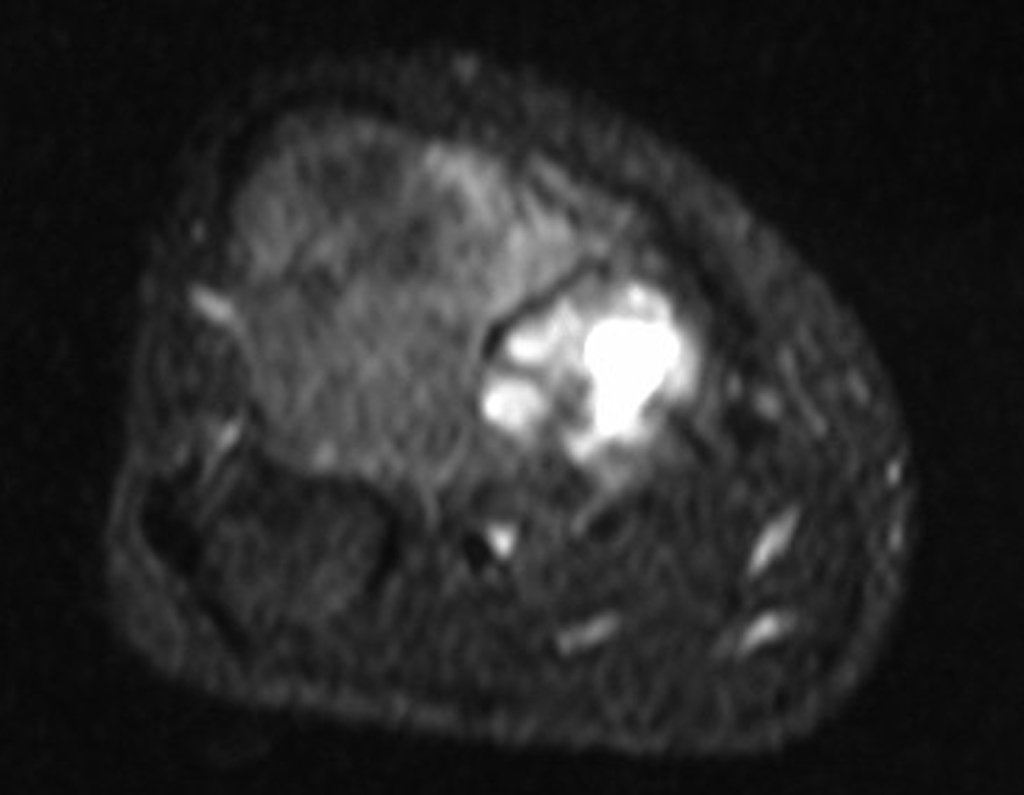
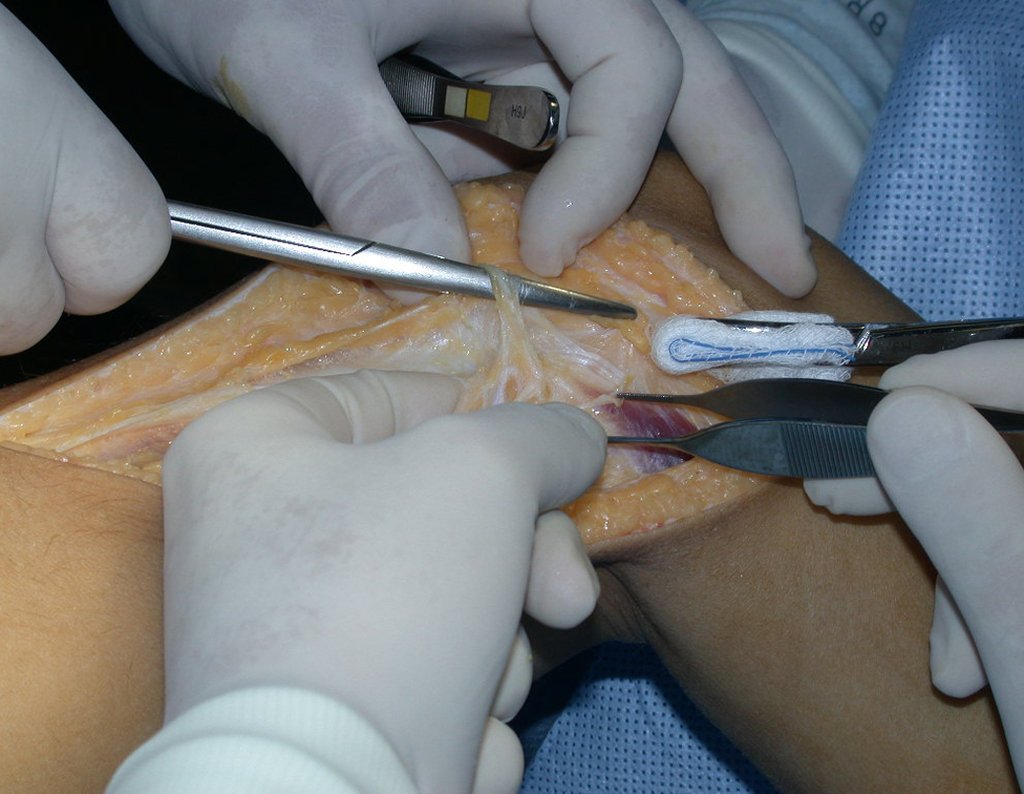
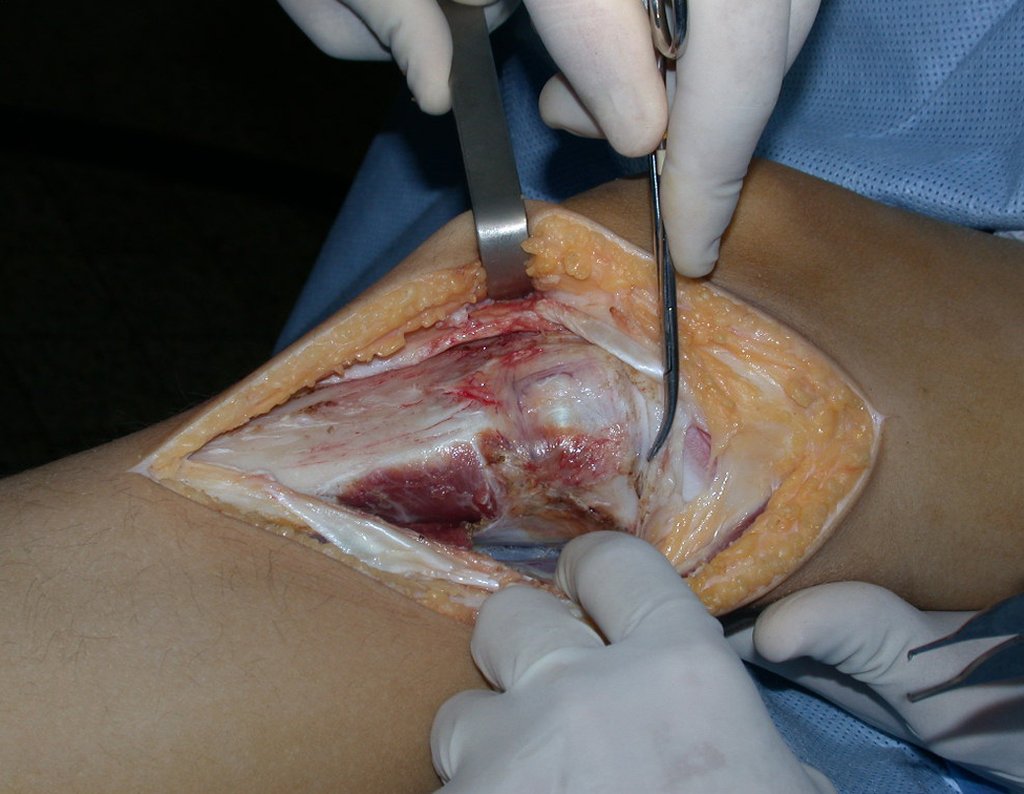
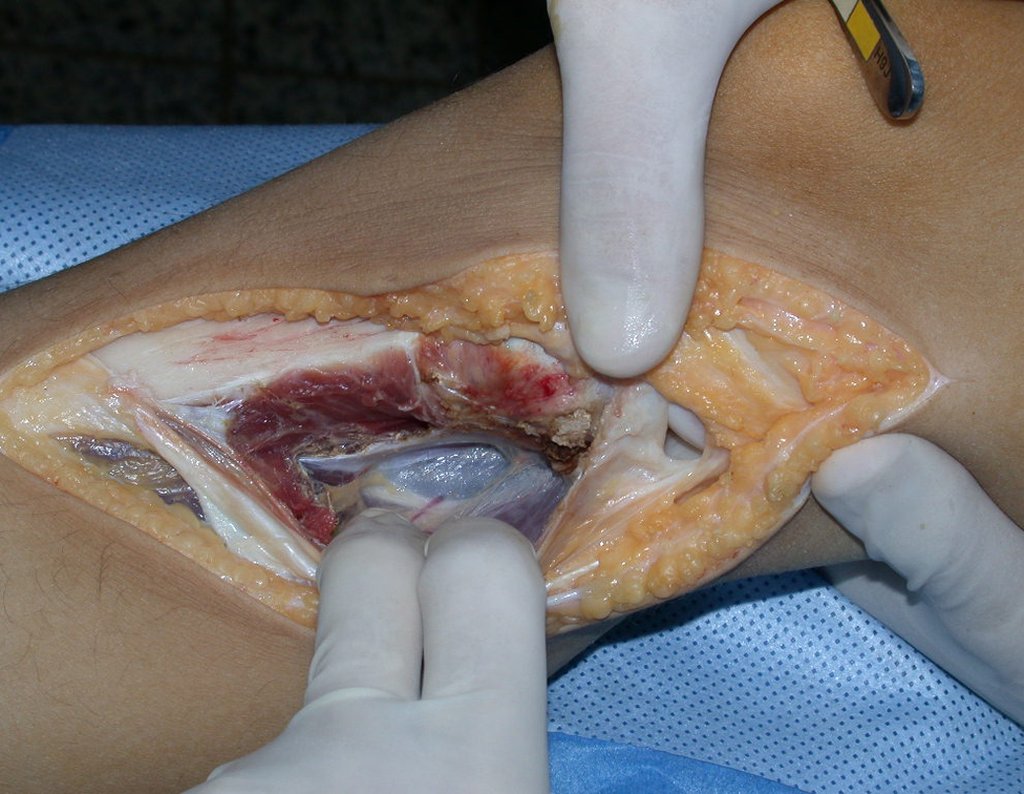
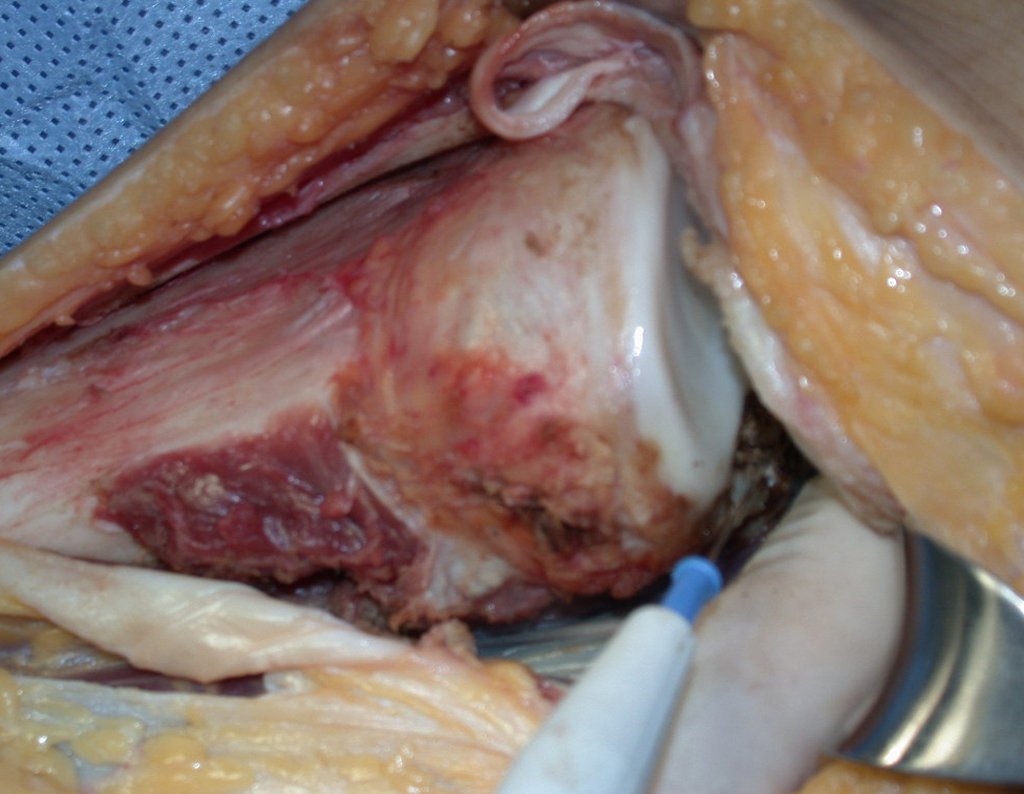
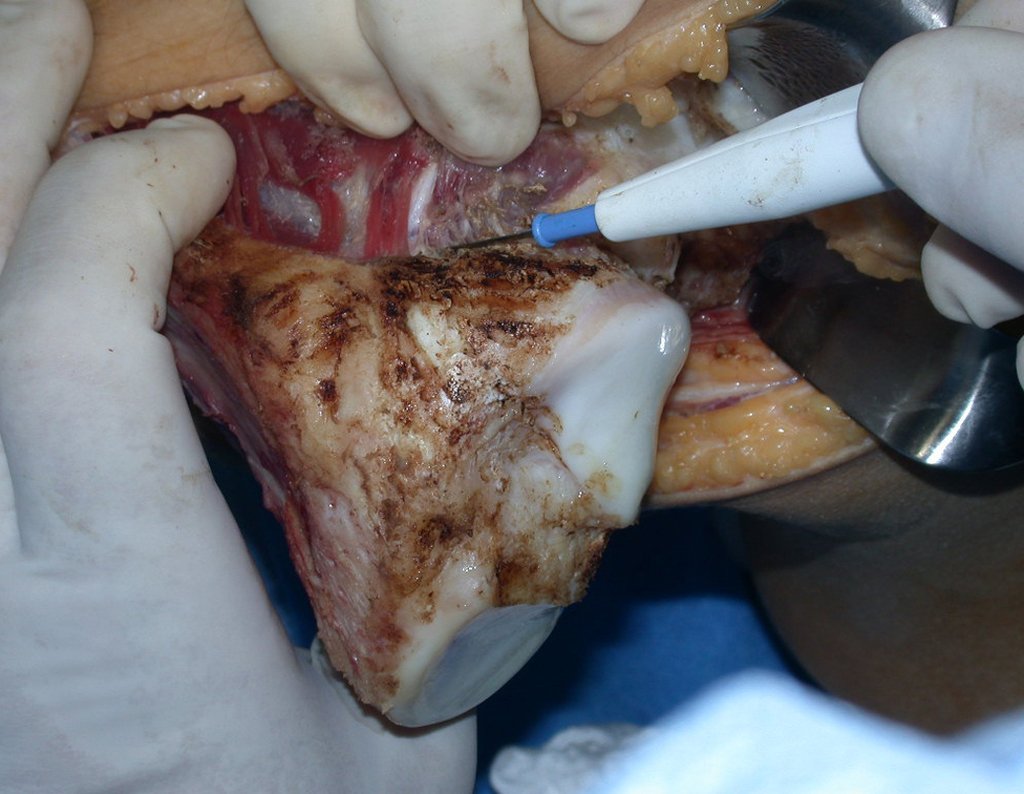
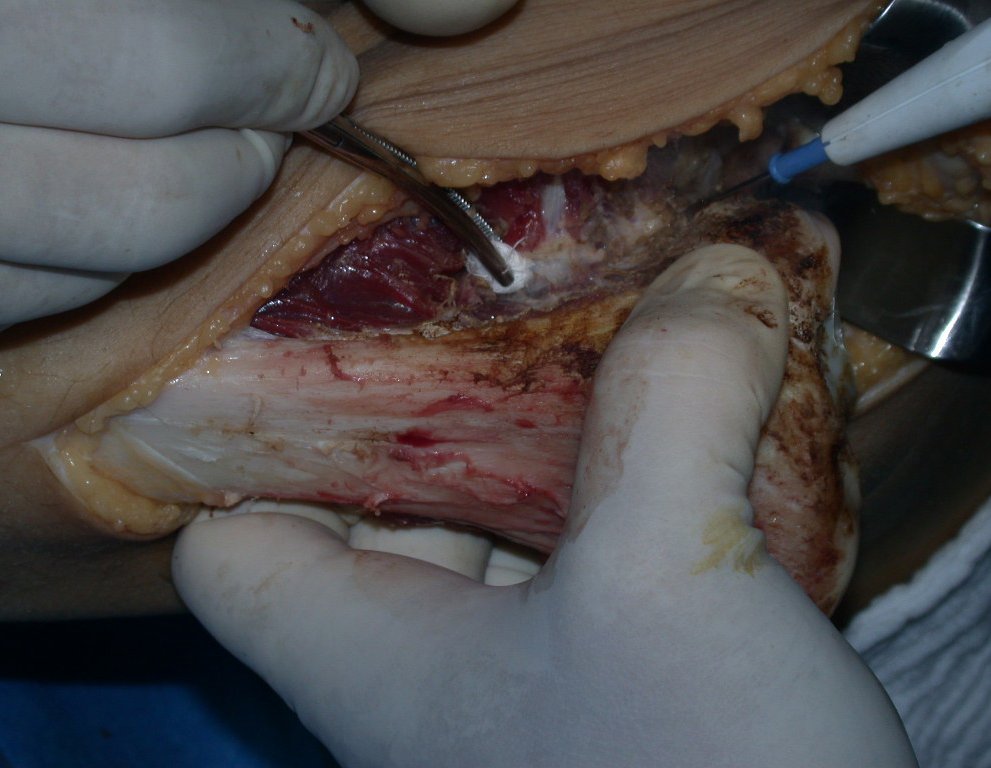
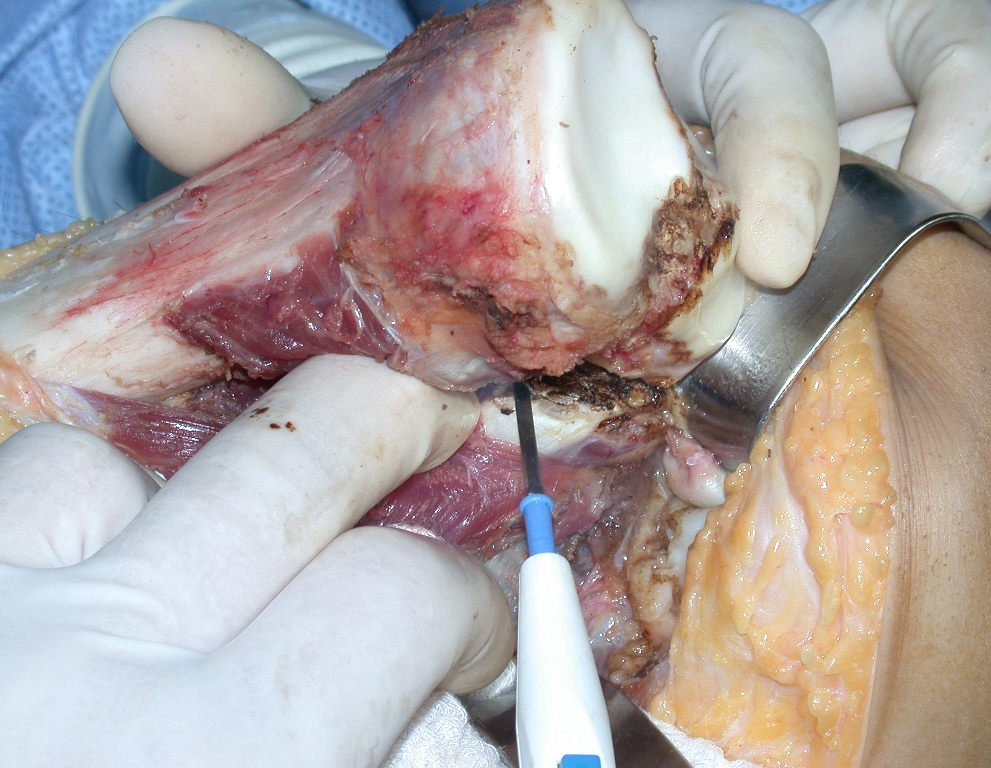
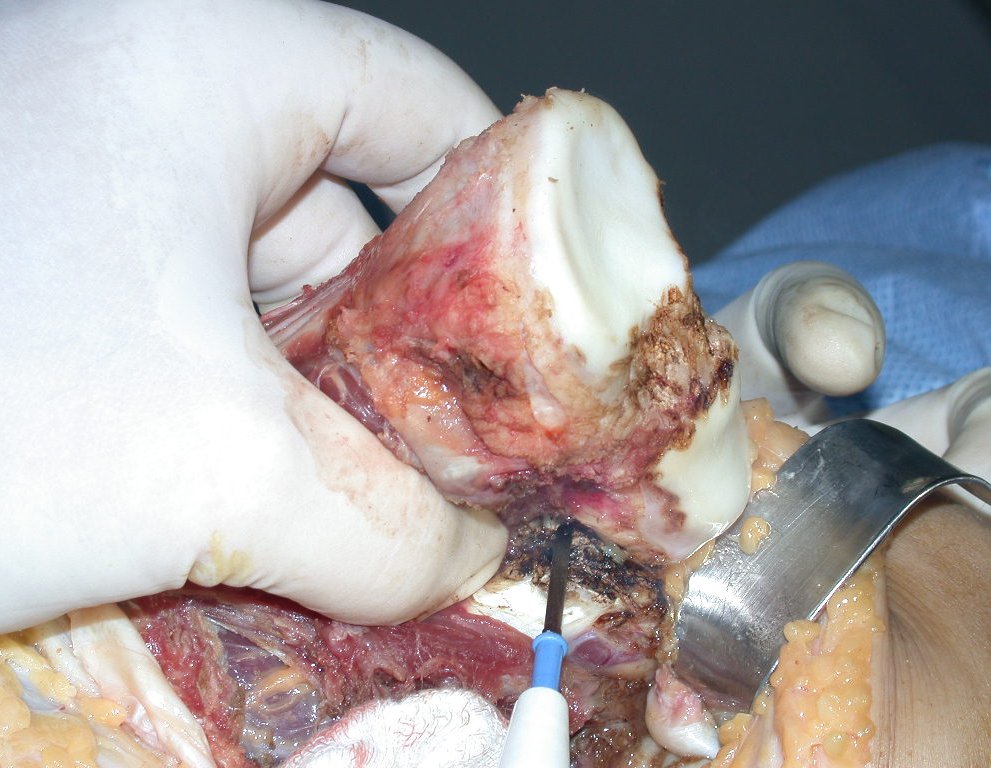
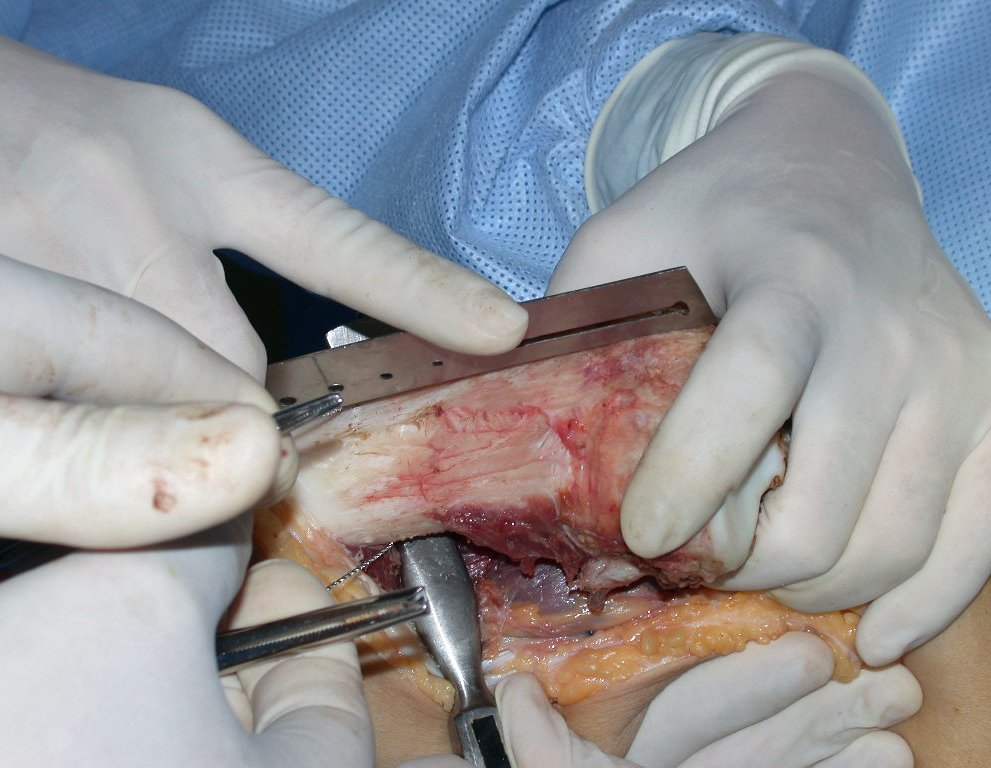
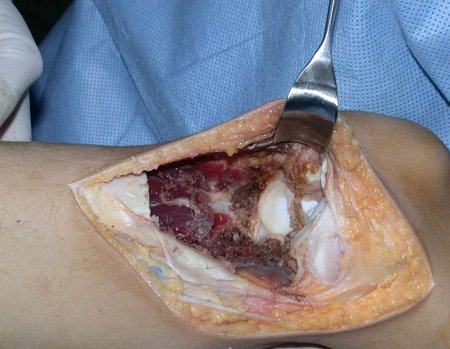
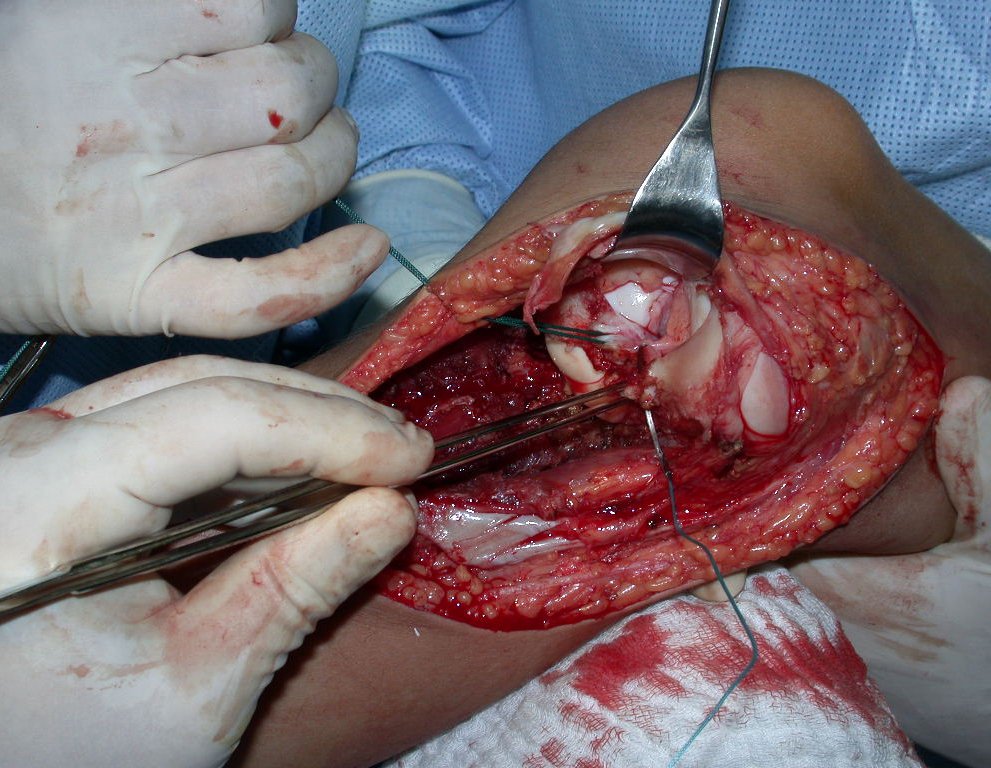
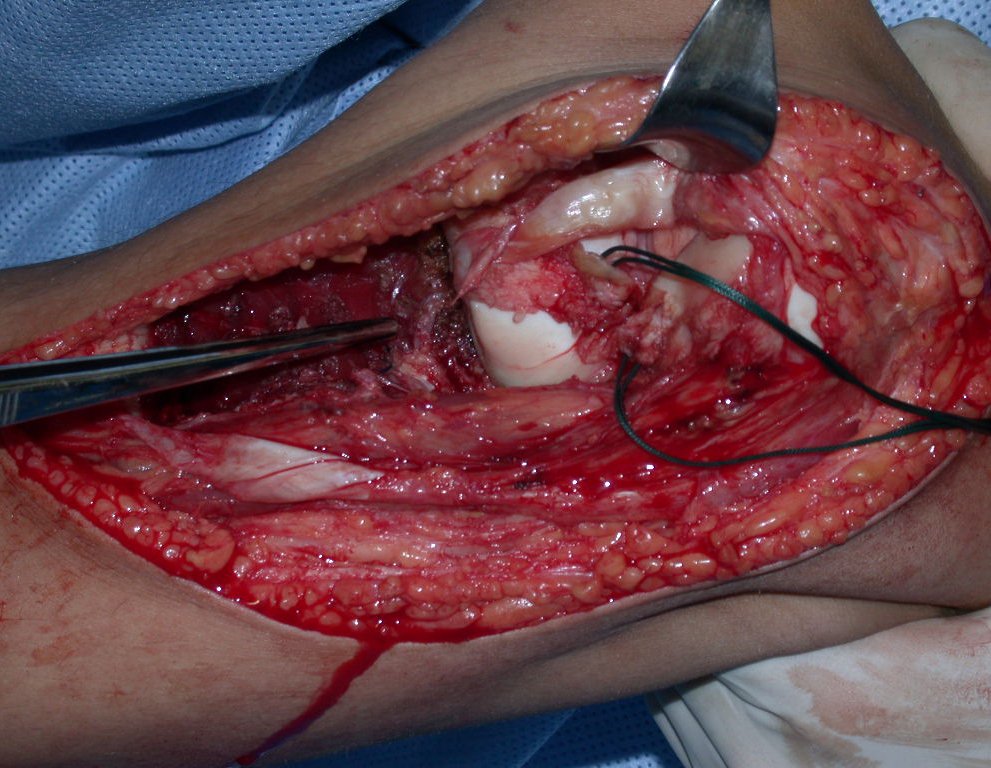
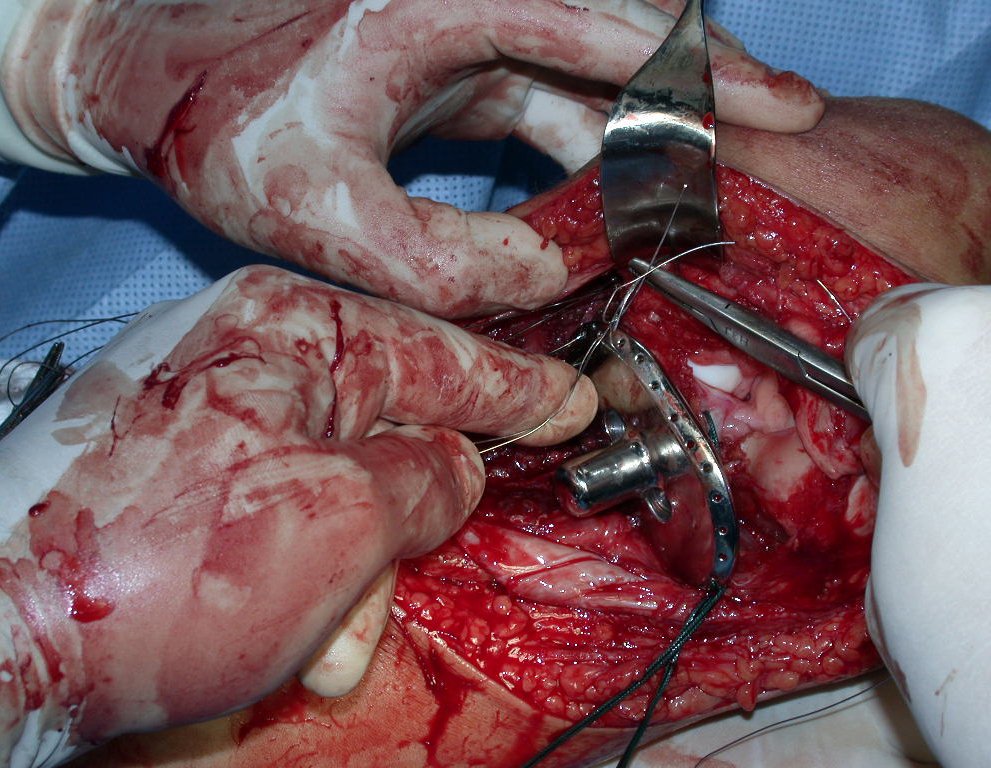
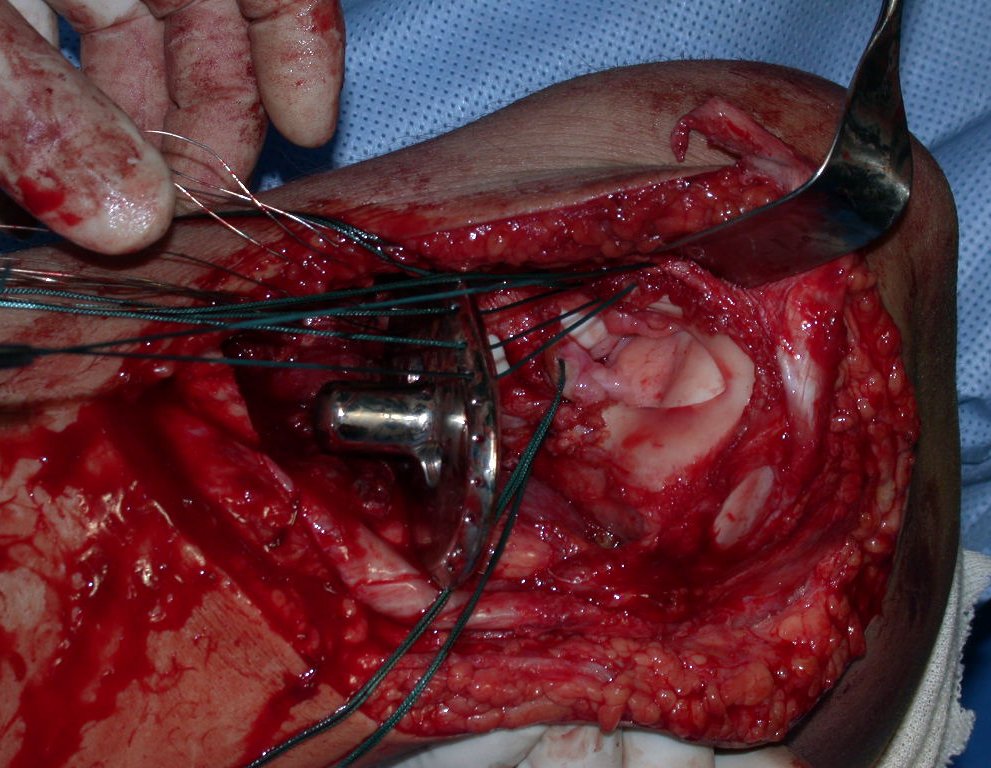
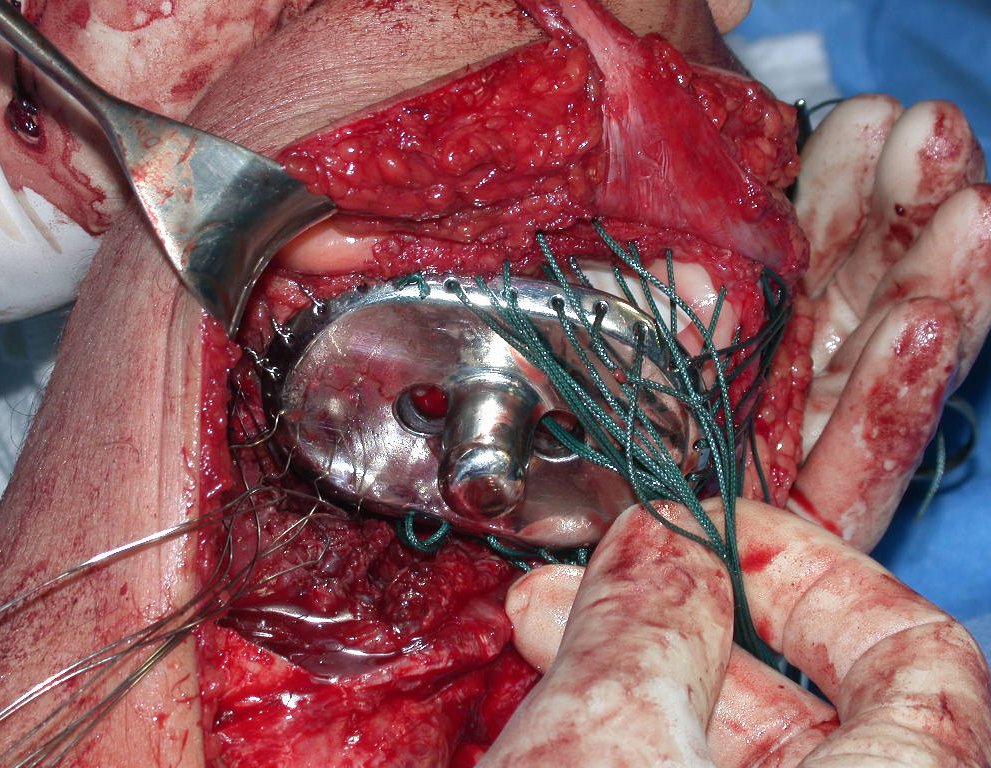
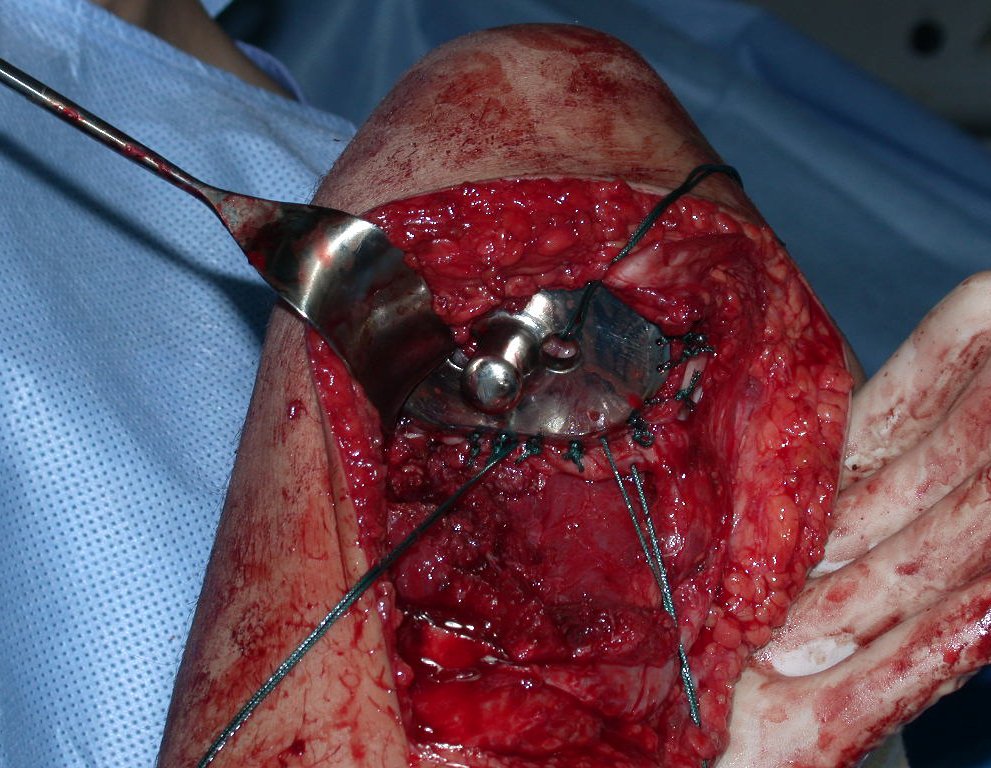
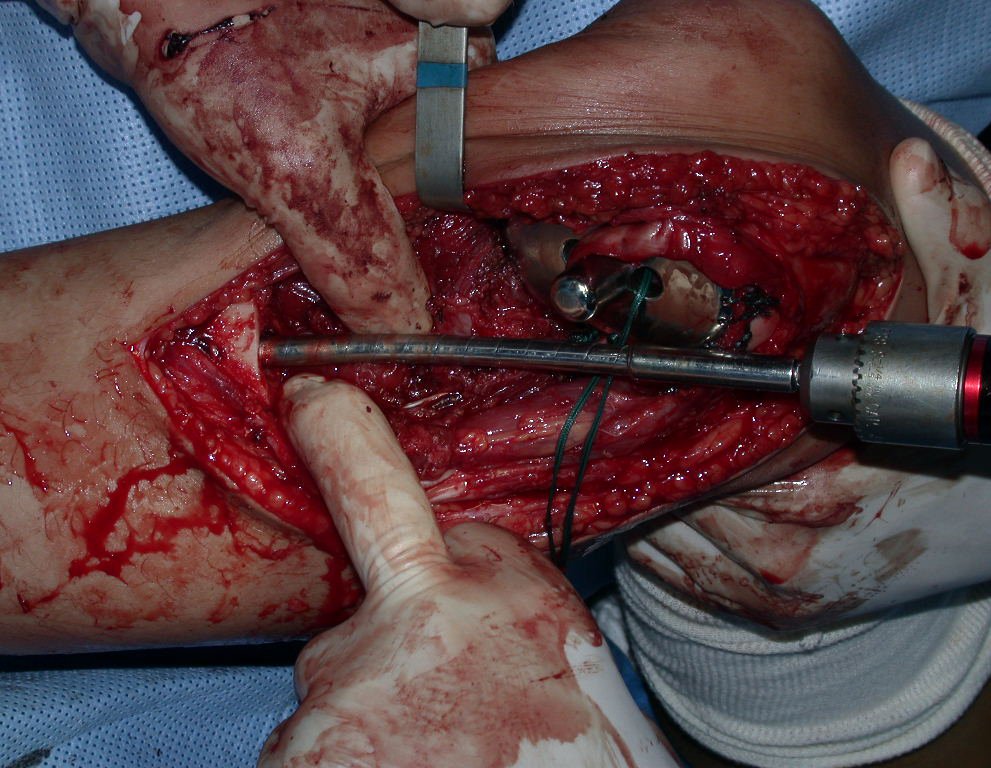
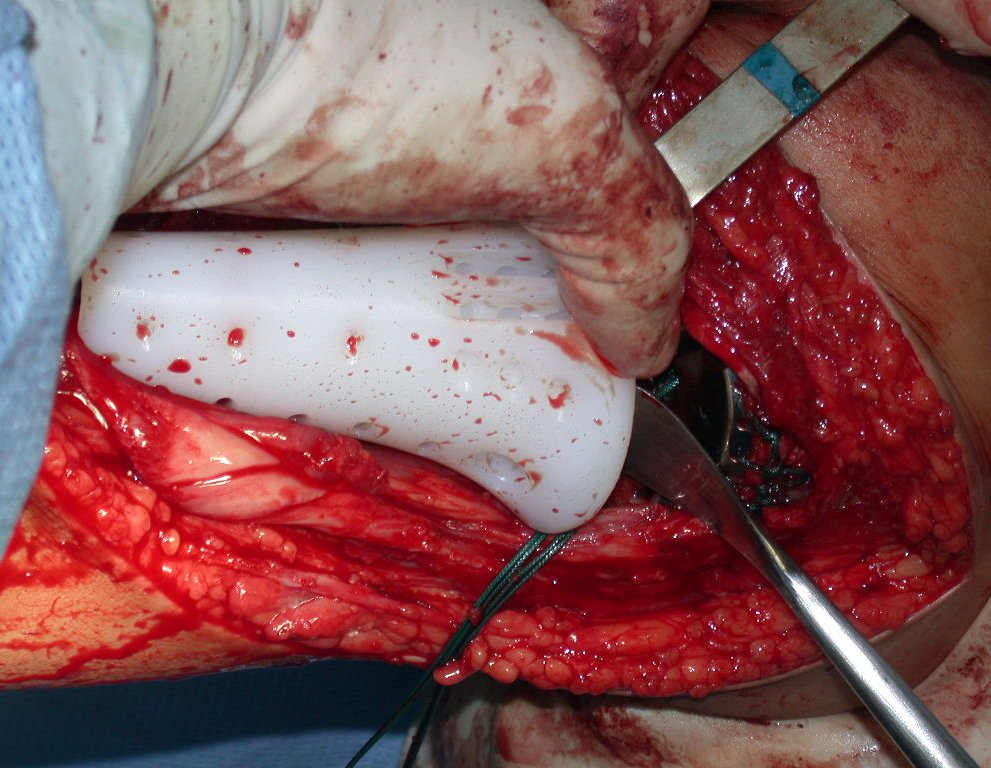
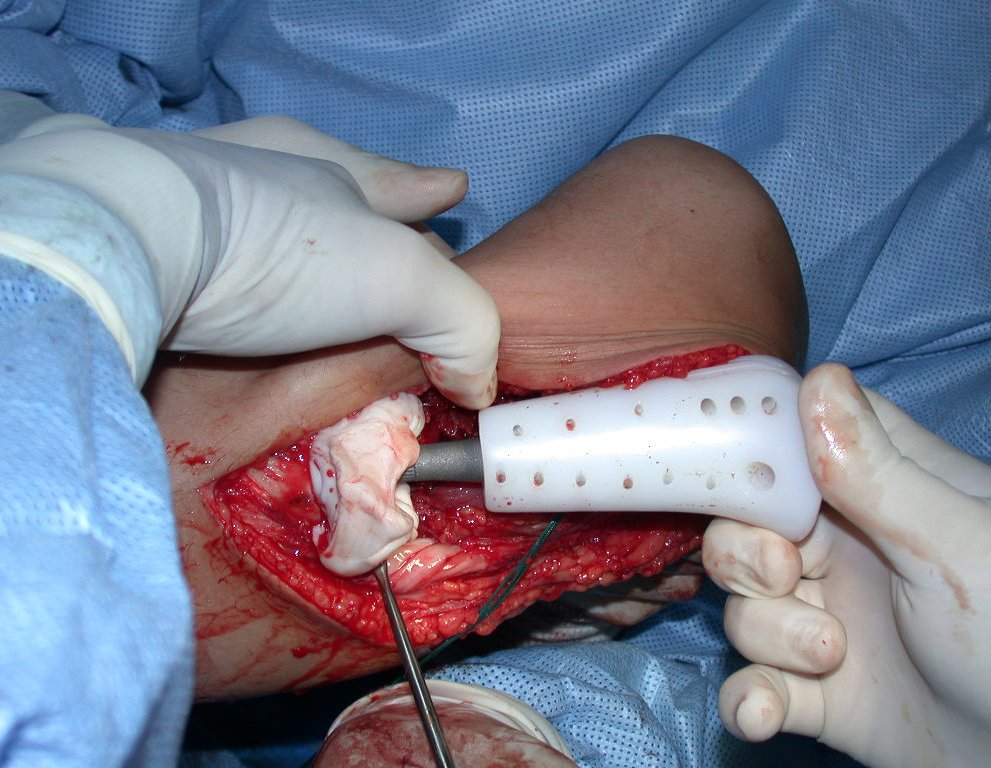
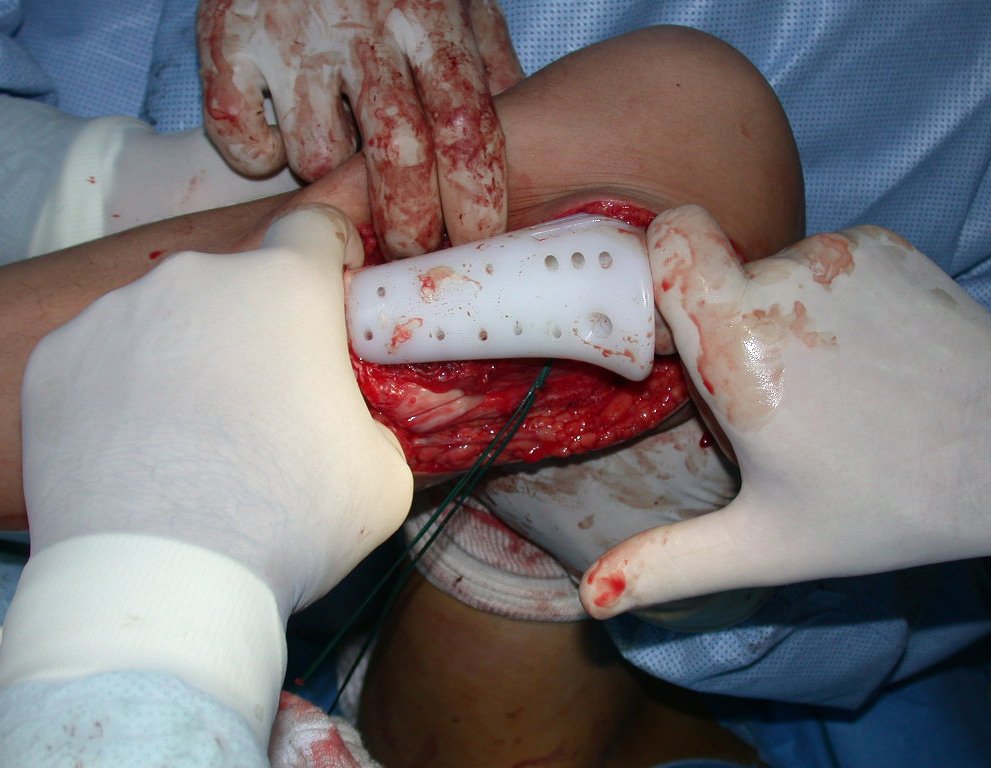
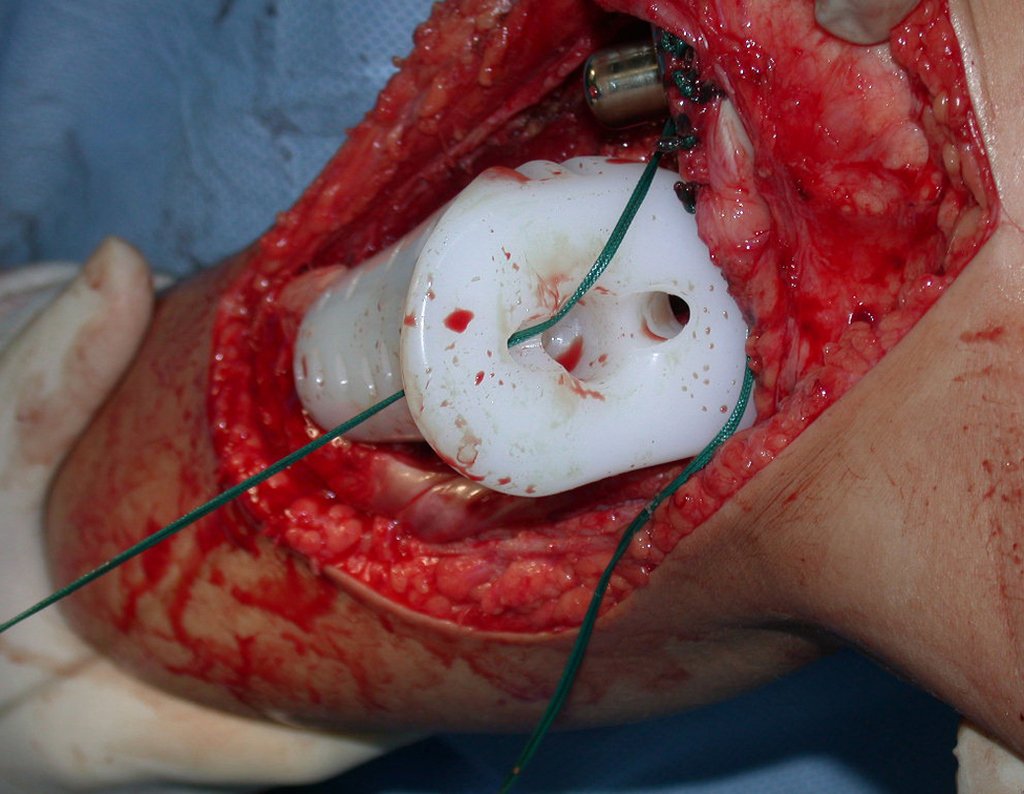
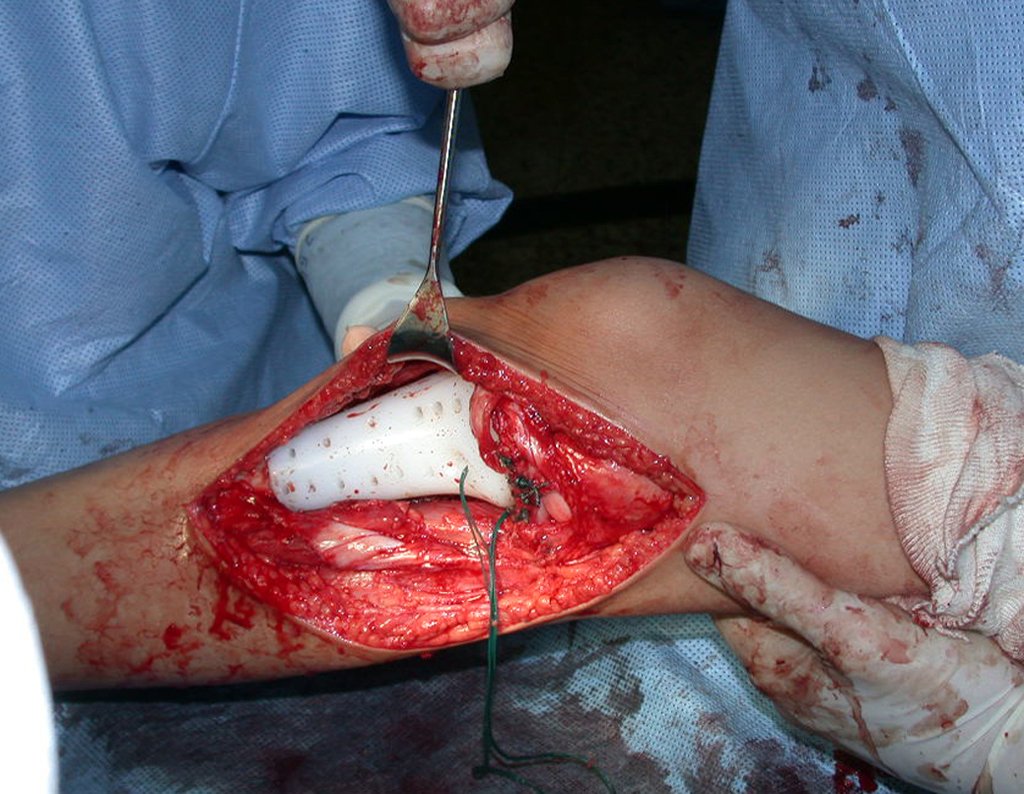
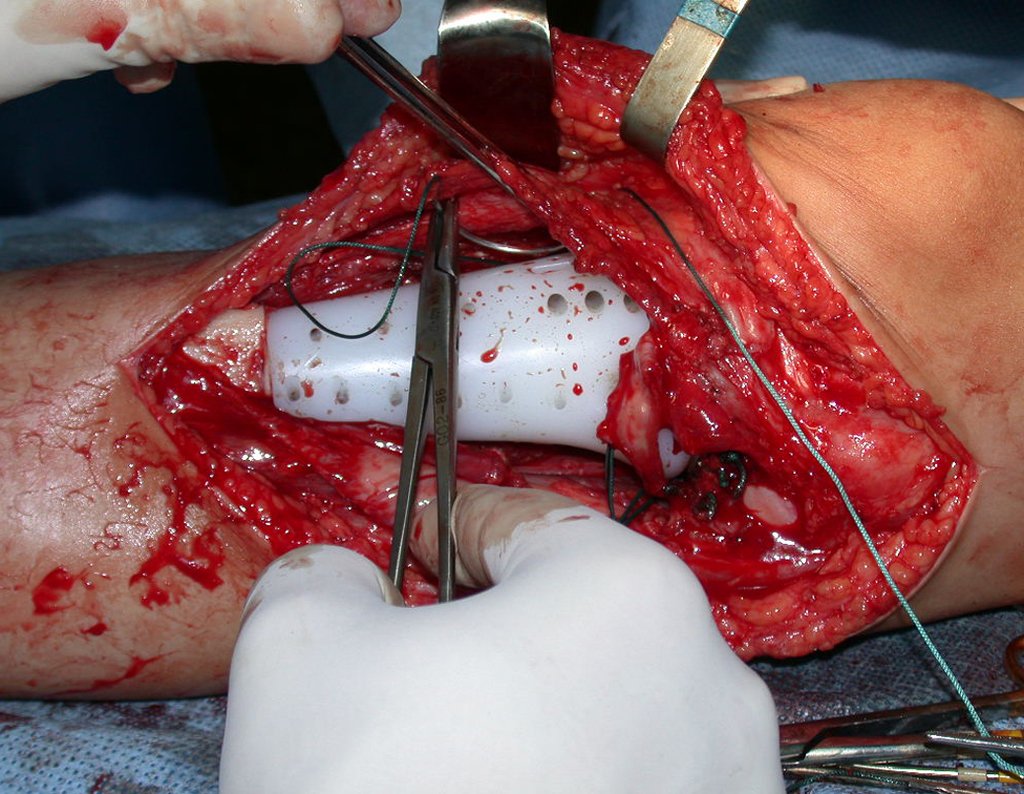
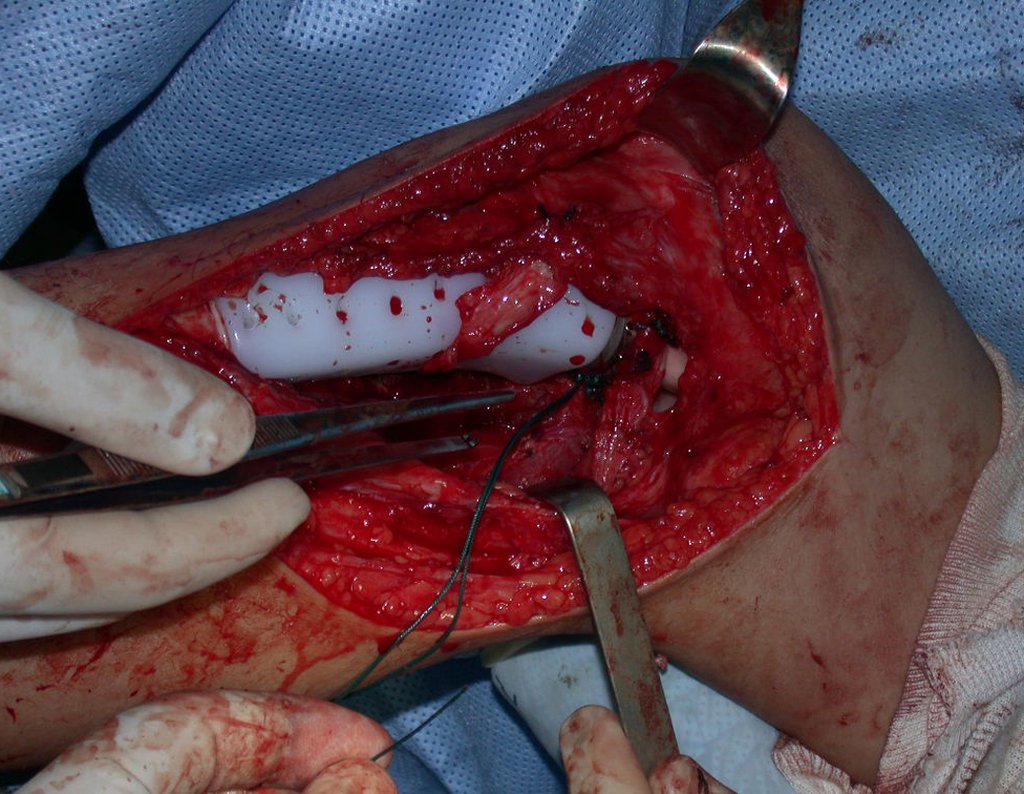
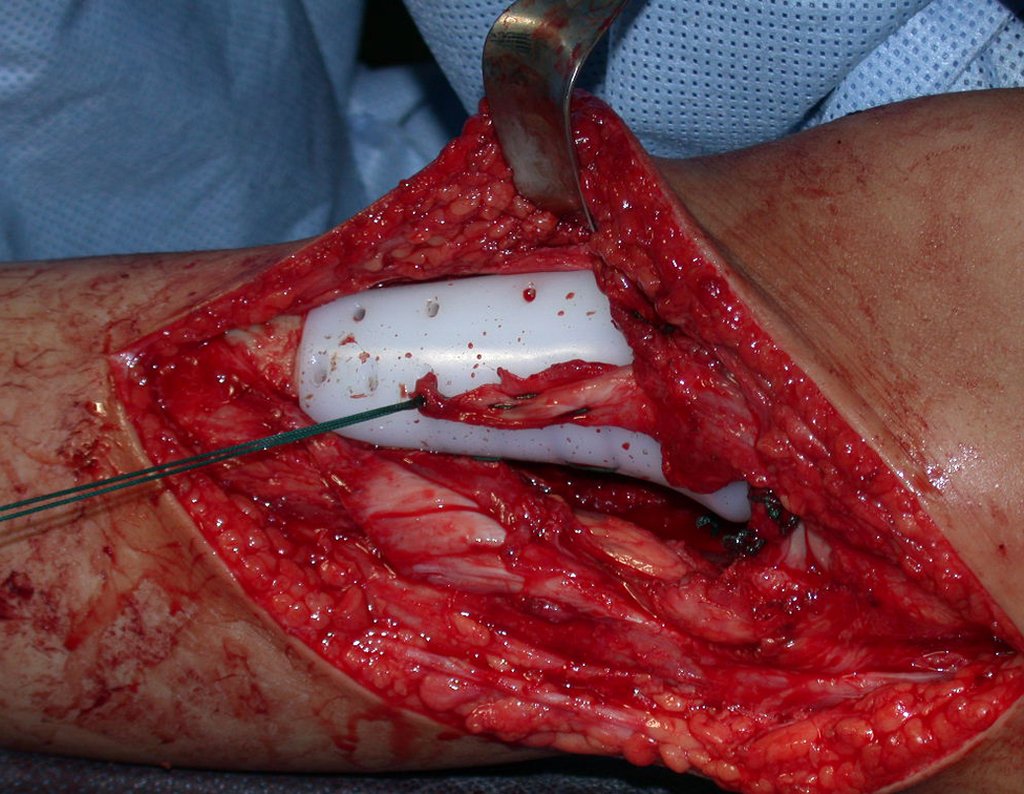
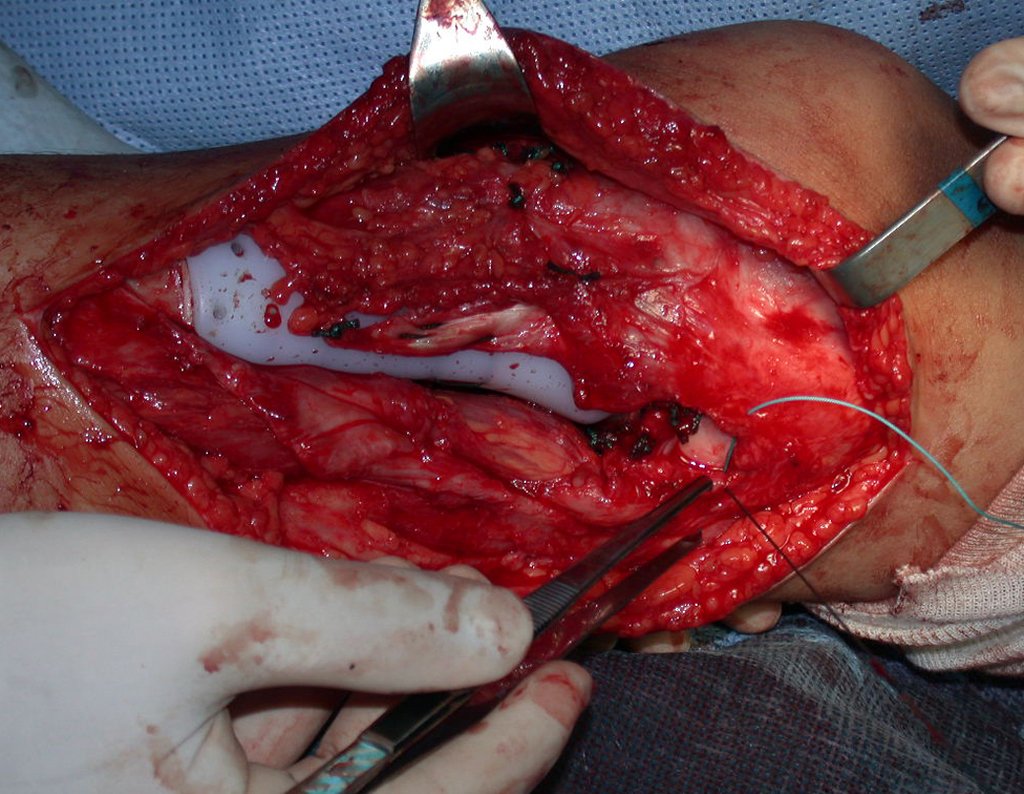
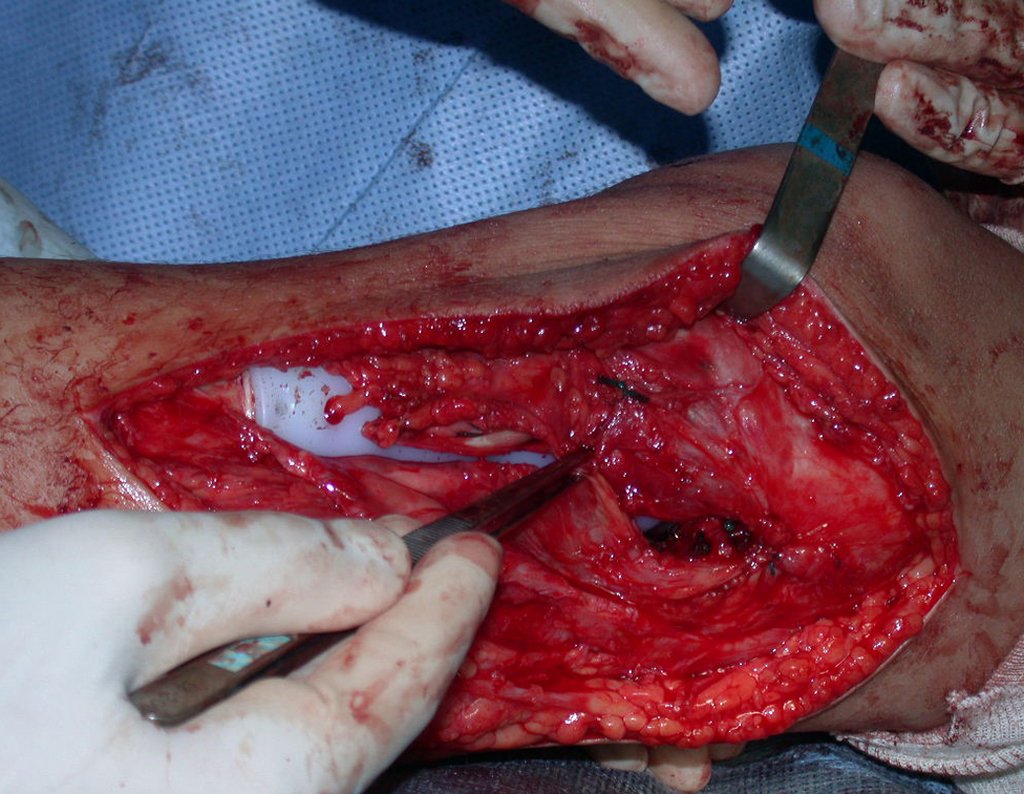
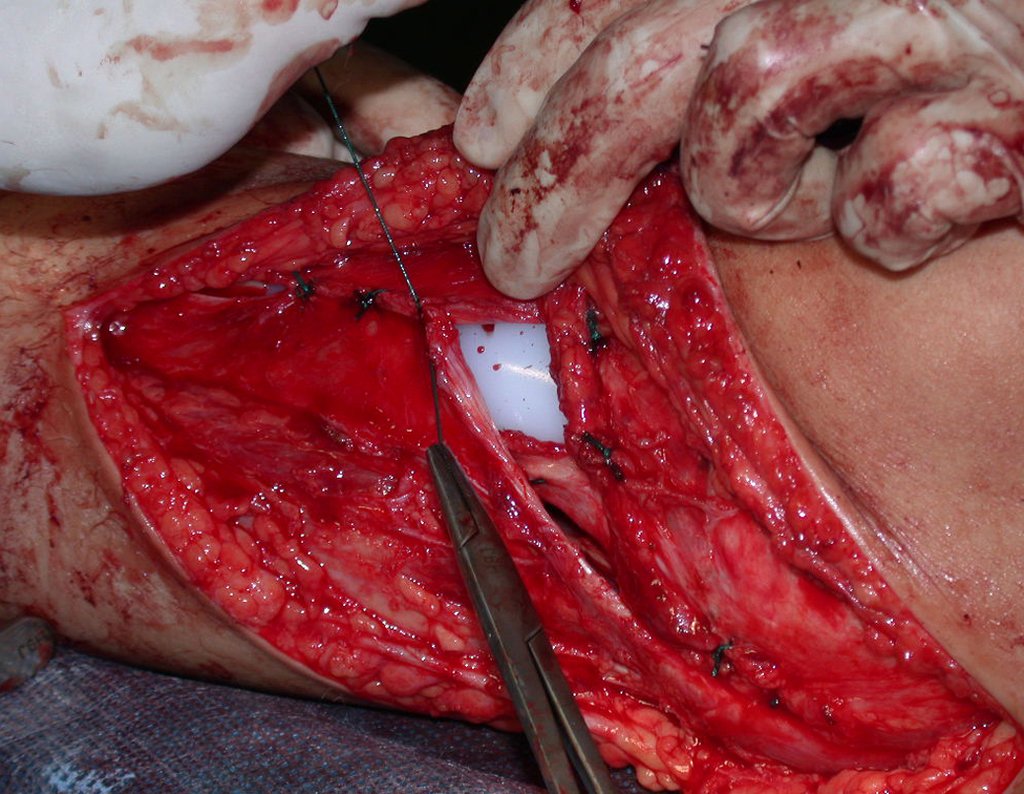
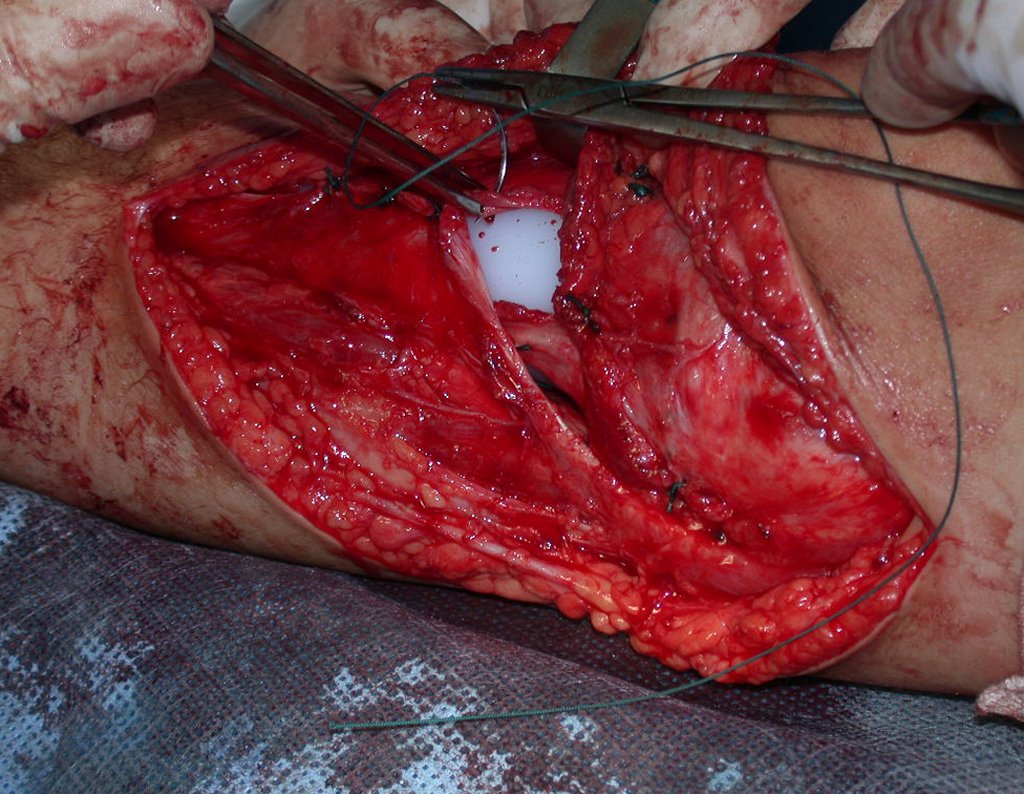
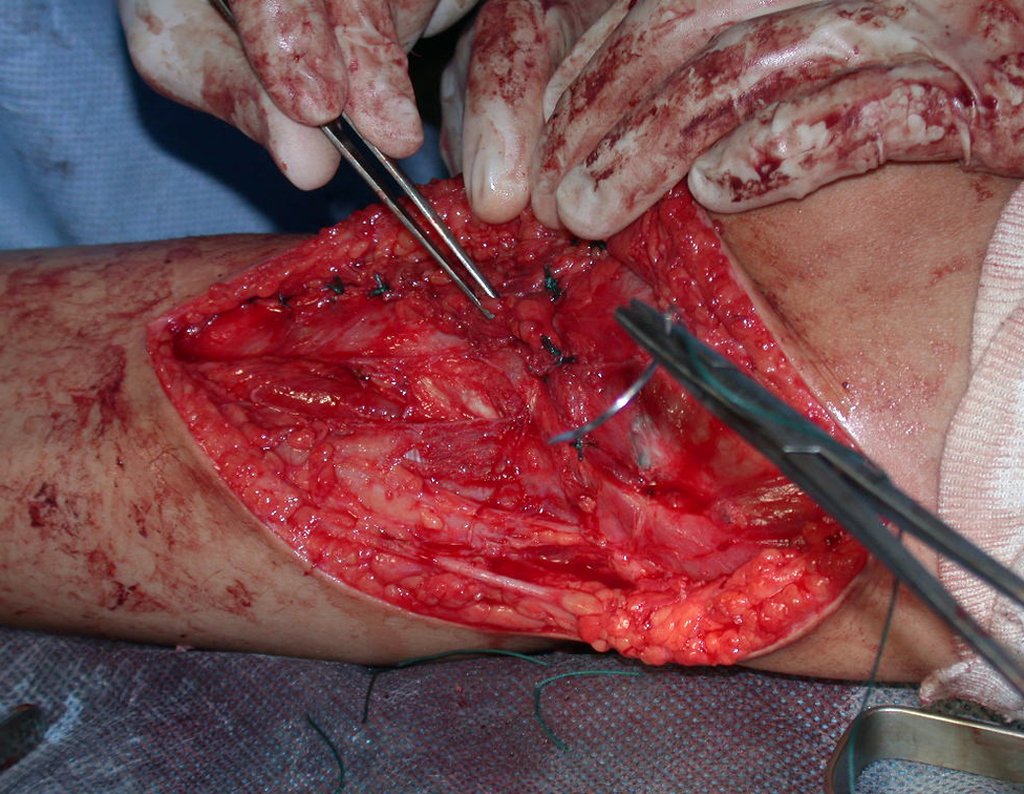
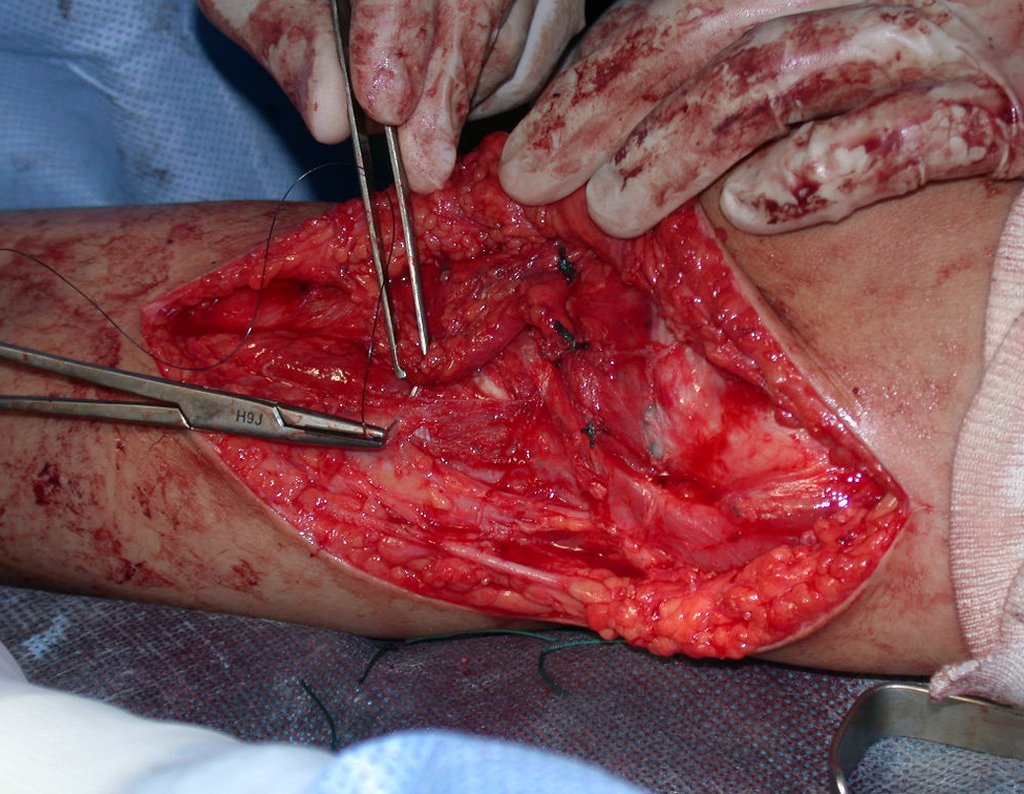
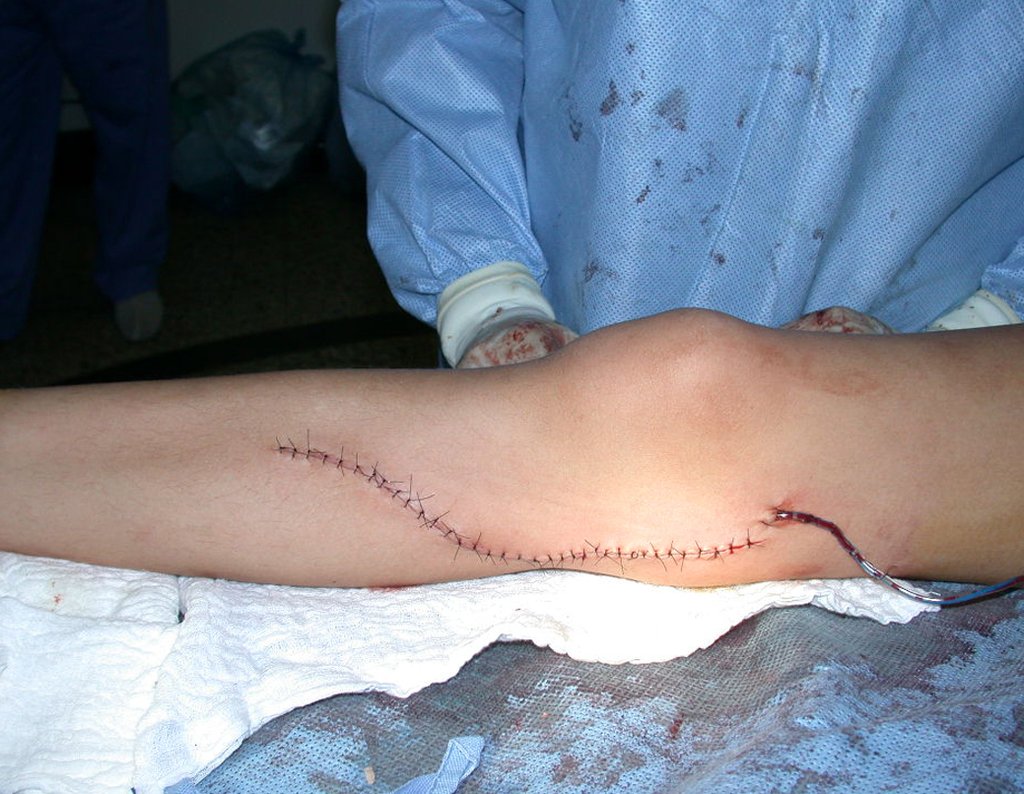
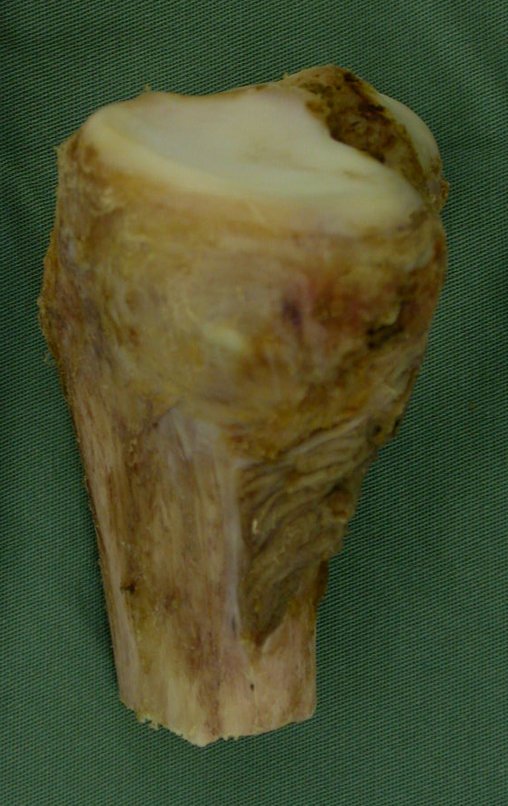
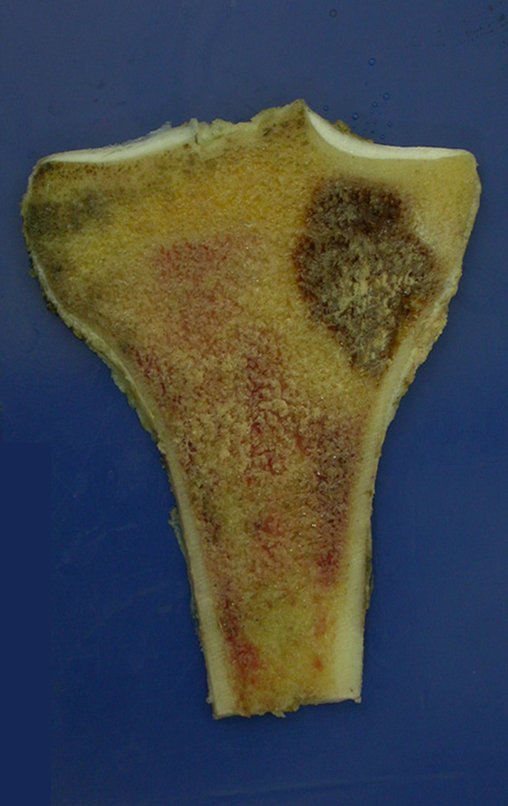
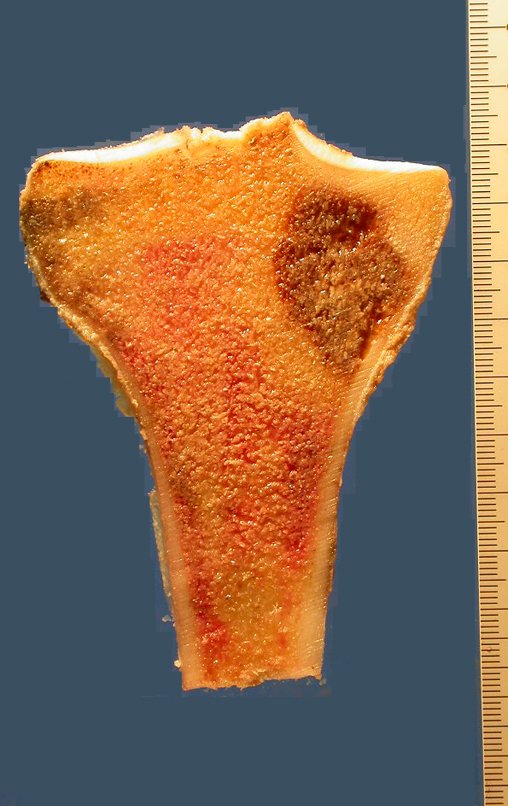
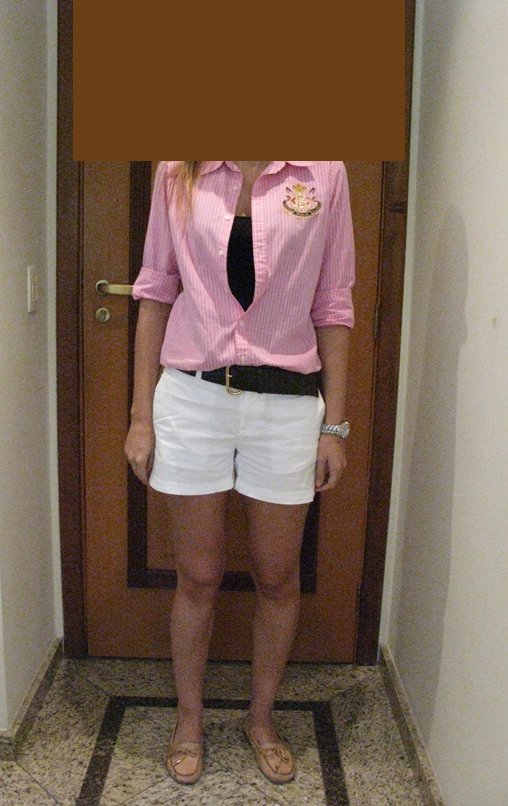RESULTADOS
CONSIDERAÇÕES FINAIS
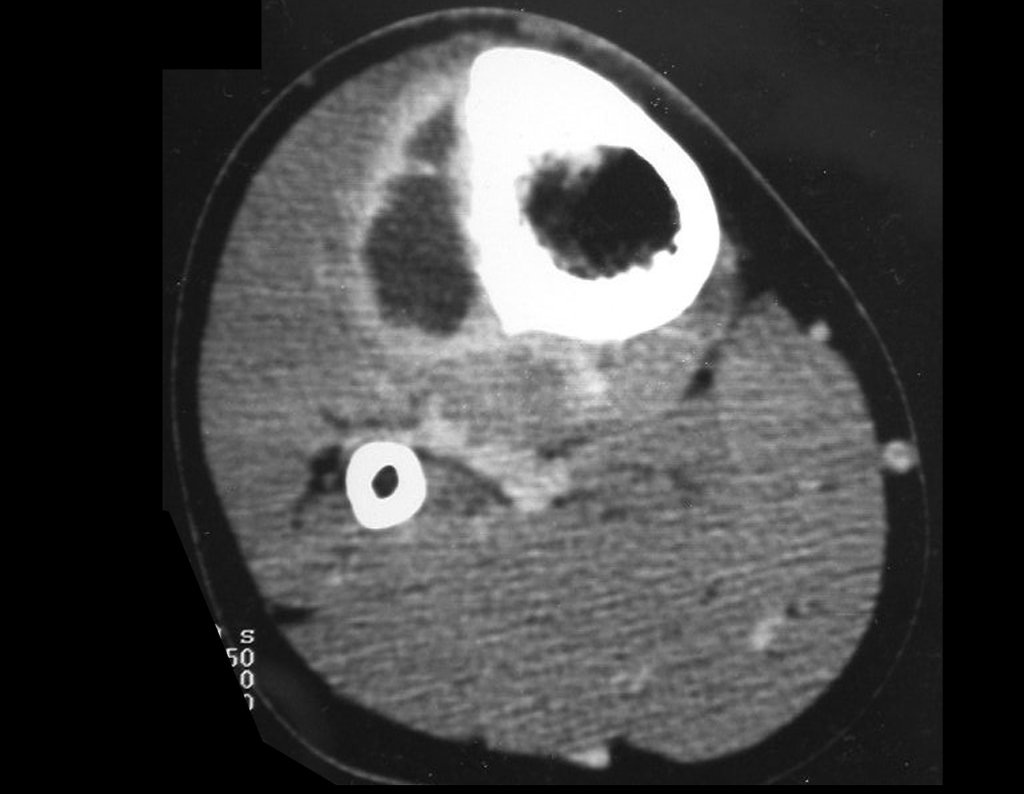
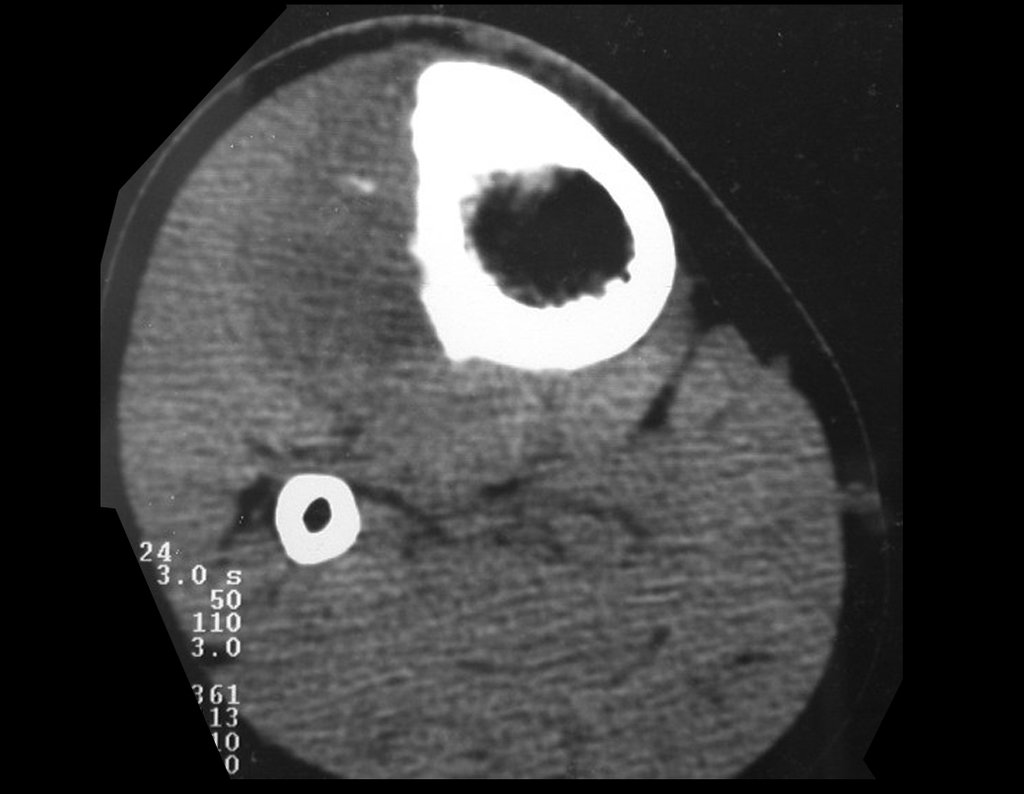
As reconstruções dos defeitos ósseos, na região proximal da tíbia, representam um desafio ao cirurgião, especialmente quando estas lesões comprometem a cartilagem de crescimento.
A amputação transfemoral é, por vezes, indicada como método de escolha em crianças de baixa idade, pela dificuldade na reconstrução e pela discrepância no comprimento final dos membros inferiores. O uso de órtese protética, adaptada ao coto da amputação, pode permitir reabilitação precoce e autonomia de marcha.
Este método, porém, vem atrelado a importante impacto psicológico e social, devido à mutilação de uma grande articulação, com aumento do gasto energético para a execução da marcha.
As dificuldades de adaptação ao uso da órtese protética, seu alto custo e a necessidade de adquirir novas próteses, ao longo do crescimento do paciente, são outros aspectos negativos da amputação.
A reconstrução do segmento proximal da tíbia com endoprótese não convencional é uma alternativa para esses pacientes. Ela permite a preservação do membro e a deambulação precoce. No entanto, são relatados altos índices de complicações relacionados ao método, tais como infecção, soltura asséptica, falhas mecânicas, fraturas e limitação para atividades físicas, entre outros4,5,17.
Outro importante ponto a ser destacado é o crescimento dos membros, tanto do membro operado, causando dificuldades na adaptação da endoprótese, quanto no membro oposto, causando discrepância do comprimento entre eles. Jeys e colaboradores relatam uma série de 661 pacientes submetidos a endoprótese não convencional para tratamento de tumores ósseos, dentre os quais 42% apresentaram falha do implante em 10 anos de seguimento18.
A exposição da endoprótese no terço proximal da tíbia e consequente infecção estão relacionados com a dificuldade de cobertura do implante pelos tecidos moles nesse região. Wang e colaboradores, relatam a utilização de retalhos de gastrocnêmio e sóleo para a cobertura da prótese em 11 pacientes com o objetivo de evitar tais complicações. Tiveram, no entanto, 3 casos de discrepância entre os membros inferiores que foram tratadas com epifisiodese contralateral19.
A técnica de transferência da fíbula juntamente com a sua fise de crescimento apresenta uma reabilitação mais lenta, especialmente para o início da marcha, pois é necessário aguardar a consolidação óssea entre a tíbia e a fíbula transposta. Posteriormente ocorre a hipertrofia da fíbula, observada nos casos apresentados, o que torna este segmento resistente.
Este método representa uma reconstrução biológica e, portanto, uma vez que ocorra a consolidação e a hipertrofia, podemos considerá-la como método de reconstrução definitivo, realizado com uma única intervenção cirúrgica.
A preservação da epífise proximal da tíbia permite que a superfície articular do joelho seja mantida, isso representa uma vantagem do método, quando a osteotomia transepifisária puder ser realizada e também é uma condição necessária para a utilização deste.
A capacidade de crescimento longitudinal do segmento fibular transposto, observado nos casos apresentados, também é um fator importante a ser mencionado, visto que pode evitar ou minimizar a discrepância dos membros inferiores.
Os enxertos ósseos também podem ser utilizados no tratamento deste tipo de lesão, especialmente nos casos em que a epífise tibial pode ser preservada, o que ocorre em até 20% dos casos20.
Entretanto, por não ser um osso vascularizado, o enxerto pode não sofrer integração e o método fica sujeito a falhas, podendo apresentar altos índices de fraturas ou não consolidação, além de não resolver o problema da discrepância21. Há dificuldade de obtenção de grande quantidade de enxerto autólogo em criança de baixa idade e os enxertos homólogos apresentam maior dificuldade de integração, além da antigenicidade.
Weitao e colaboradores, relataram a utilização de aloenxerto em 15 pacientes com sarcomas ósseos, apresentando idade média de 11,75 anos ( sete a 24) na região distal do fêmur ou proximal da tíbia, onde pôde ser preservada a epífise do osso. Tiveram como resultados discrepância de crescimento em 4 pacientes, retardo de consolidação em 15 pacientes, rejeição do enxerto em 2 casos, infecção em 1 caso e quebra do material de síntese com reabsorção parcial do enxerto em 1 caso7.
Campanacci e colaboradores relataram a utilização de aloenxerto osteoarticular na reconstrução de osteosarcomas da região distal do fêmur e proximal da tíbia em que a superfície articular foi preservada com o tumor. Ao final de 5 e 10 anos de seguimento, as taxas de sobrevivência dos enxertos colocados na tíbia eram de apenas 45% e 20% respectivamente, com melhores resultados na região femoral6.
A transposição da fíbula tem como vantagens sobre o enxerto, o fato de ser um retalho ósteo-muscular, ou seja, possui vascularização e “turn over“ ósseo, participando ativamente da consolidação, além de manter o potencial de crescimento da fise.
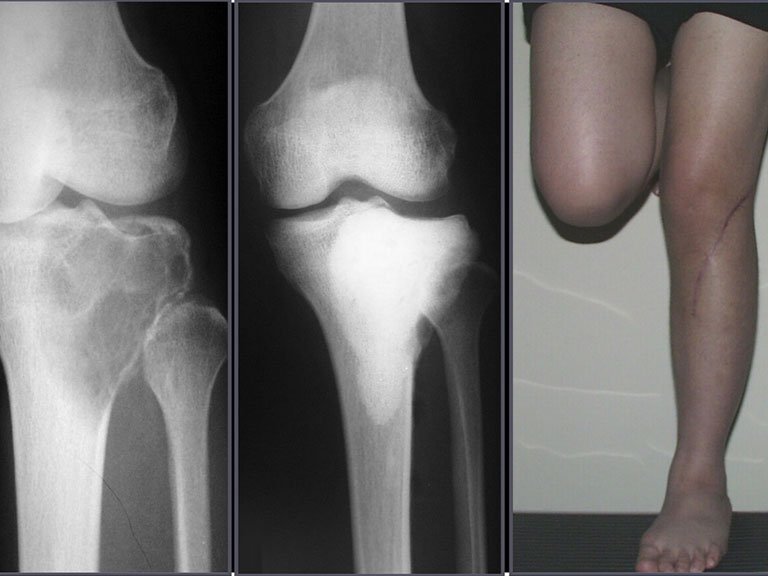
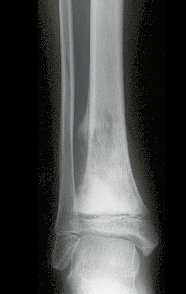
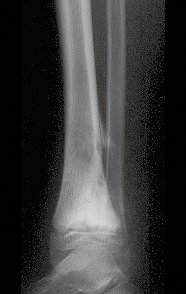
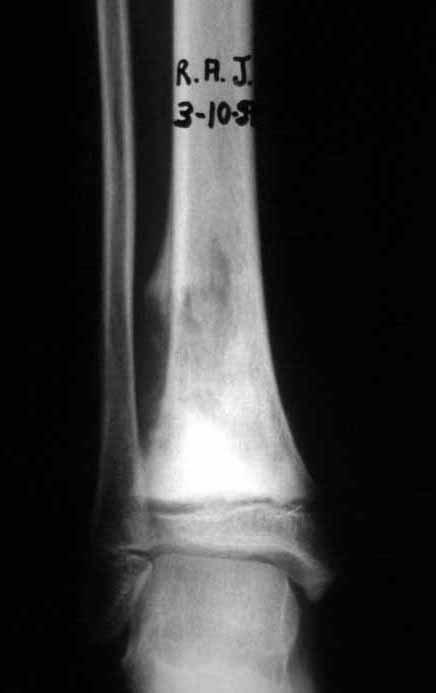
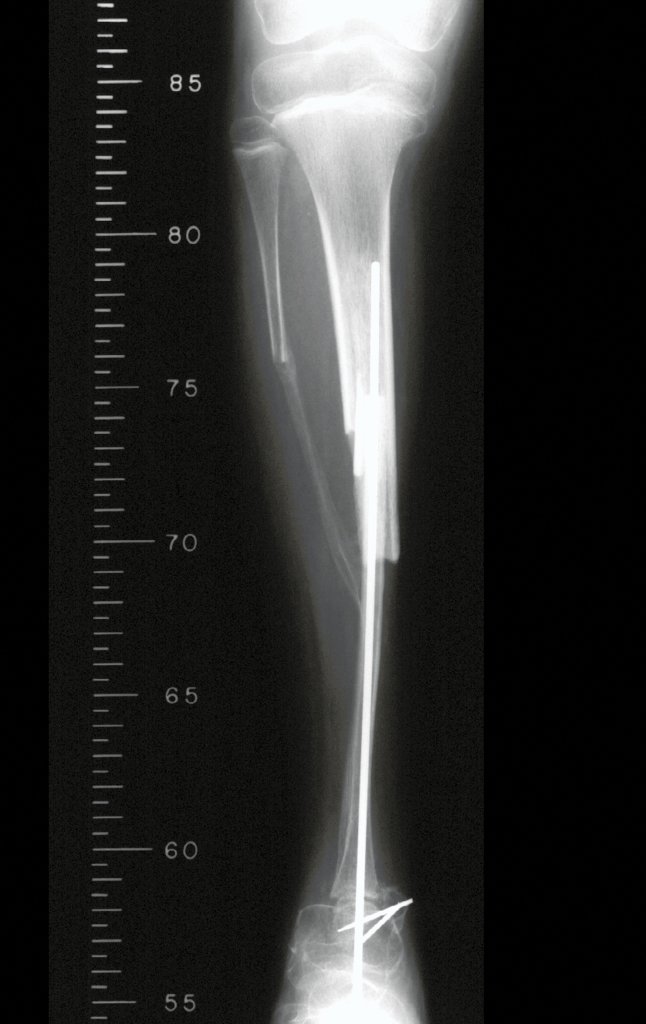
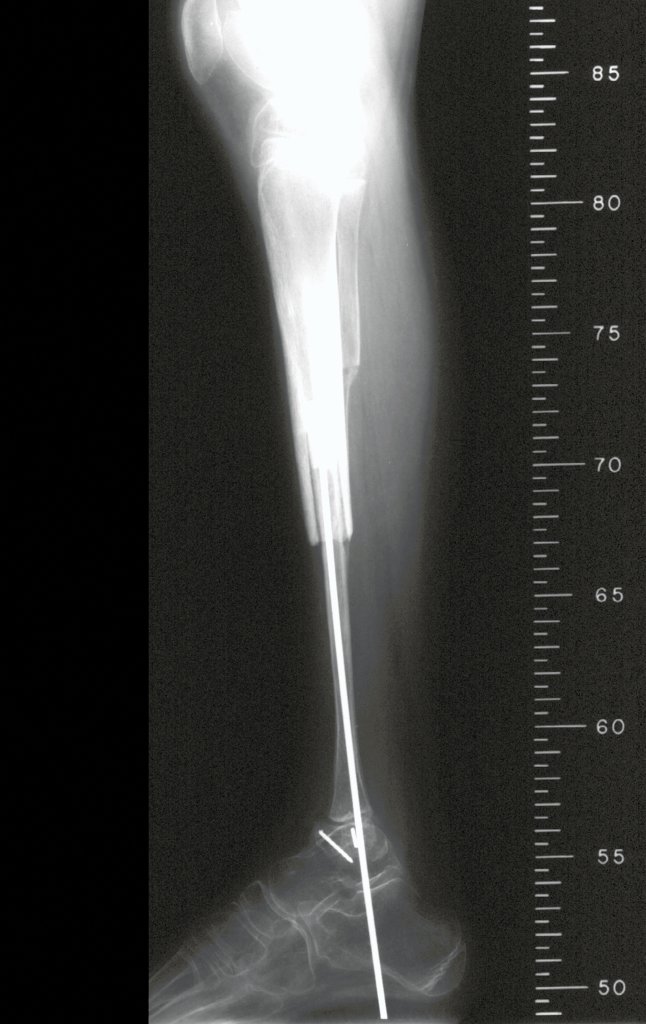
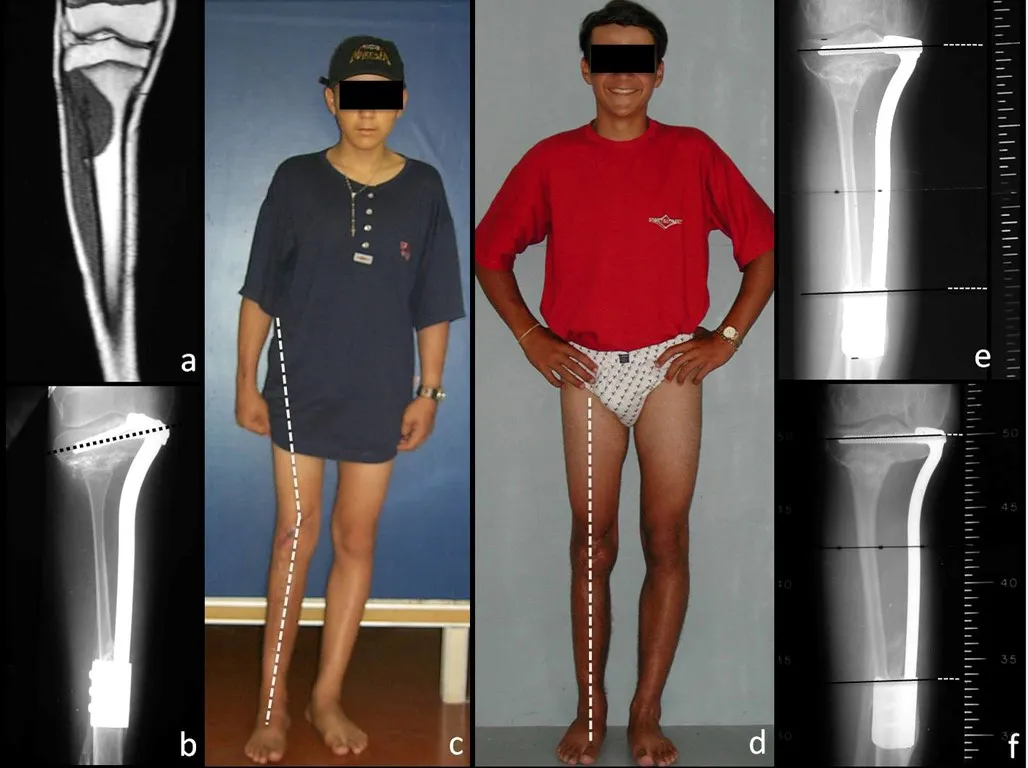
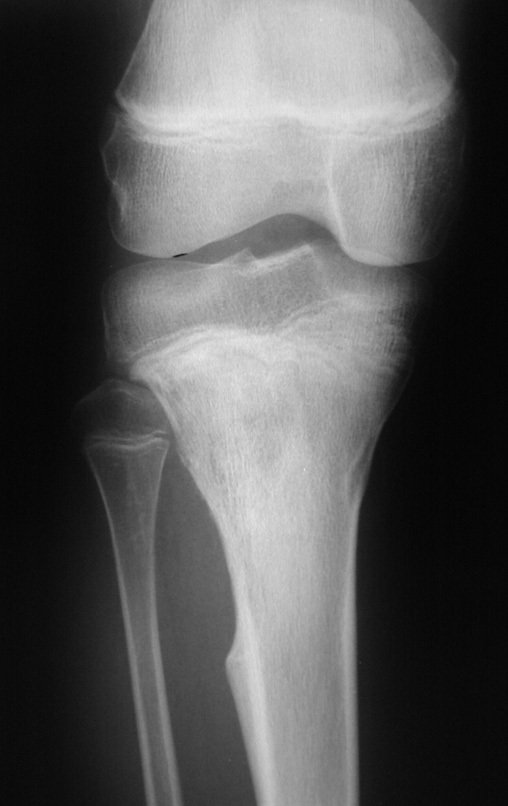
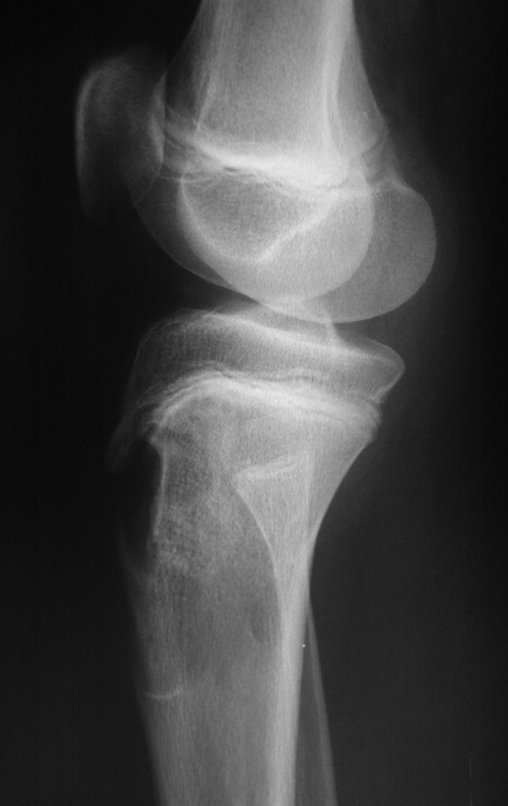
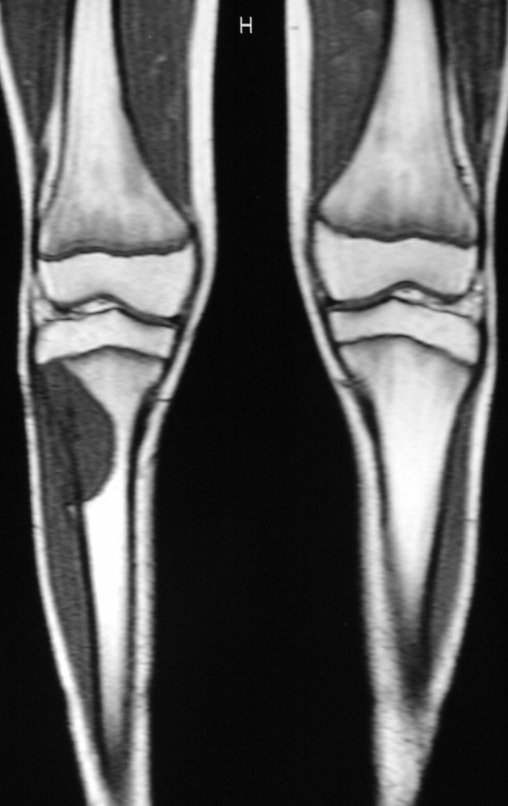
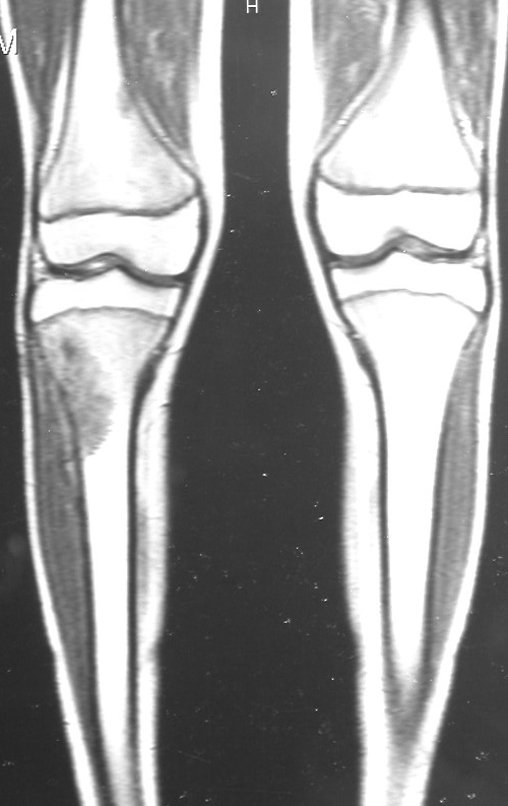
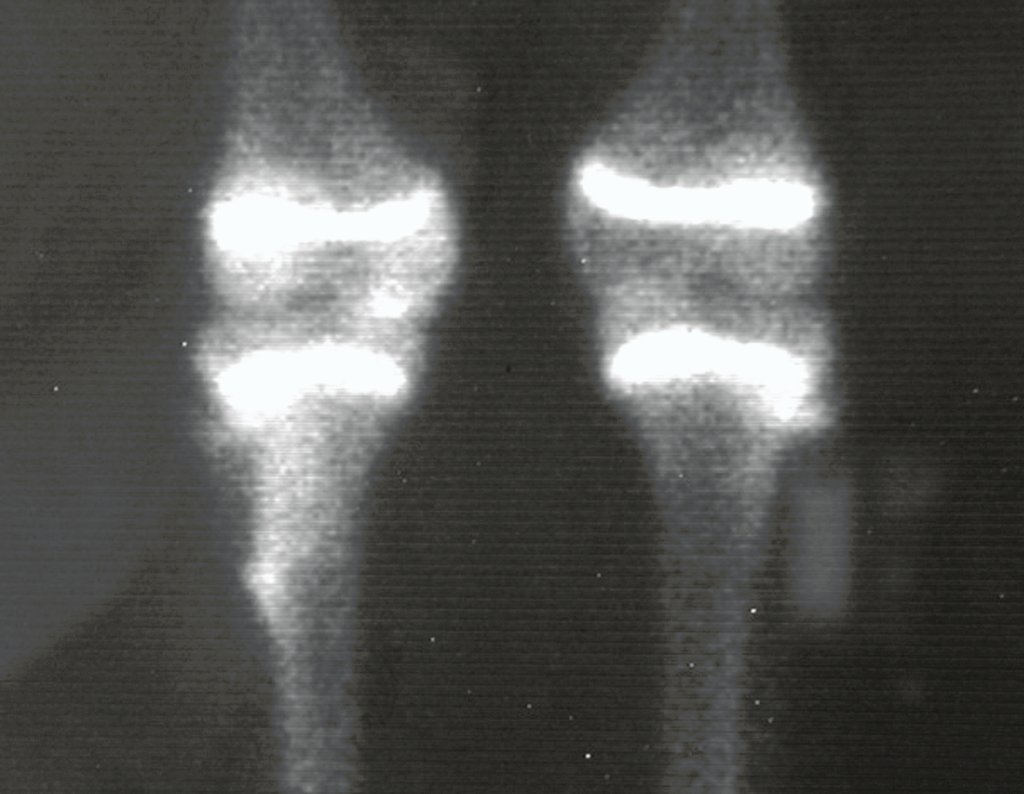
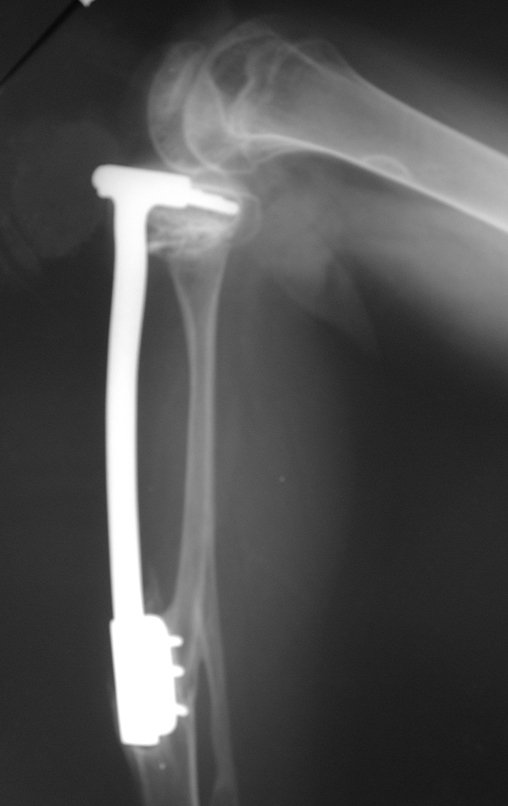
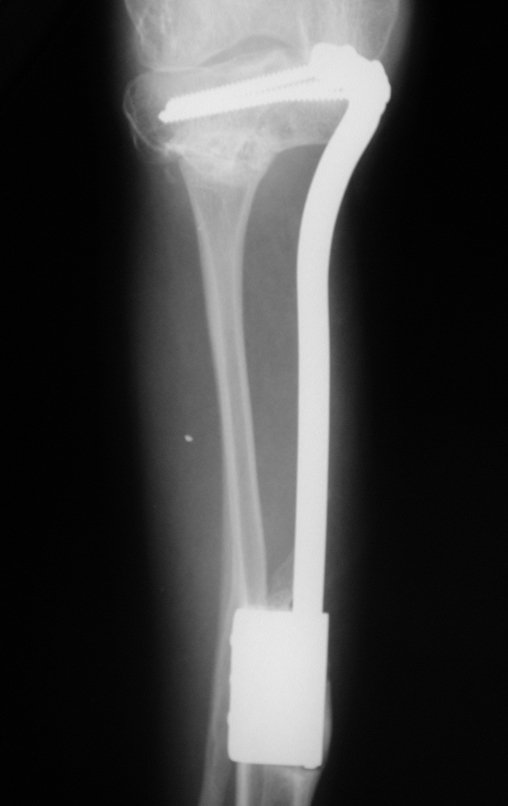
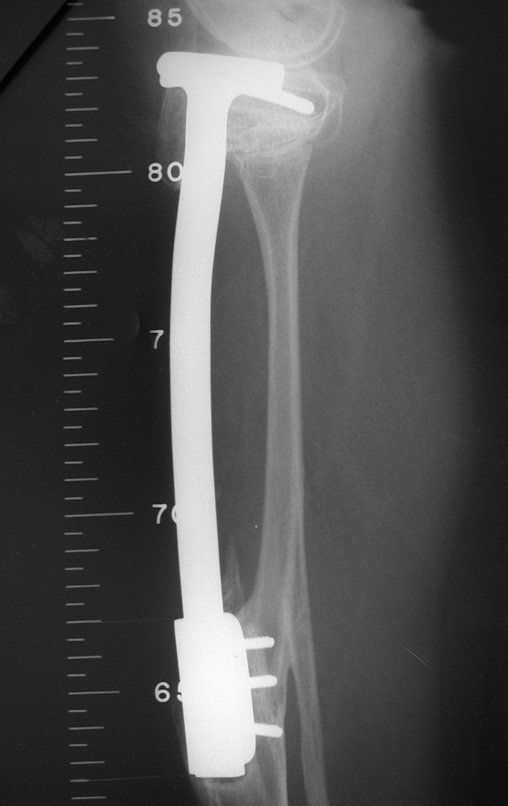
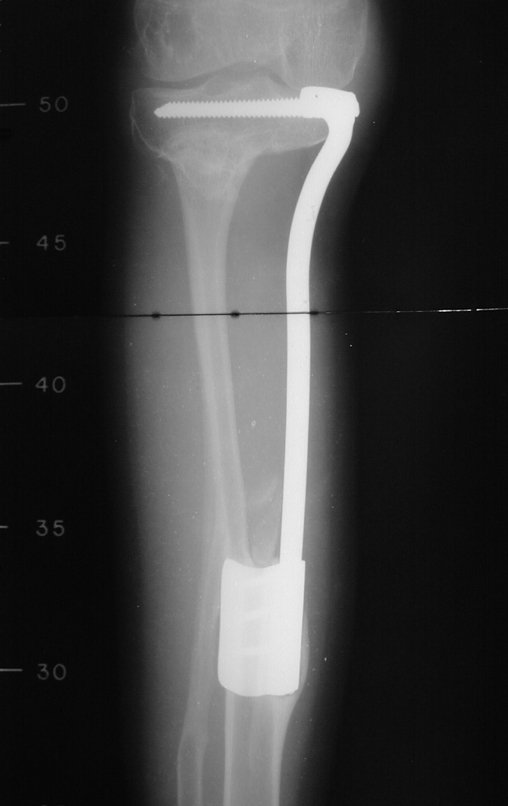
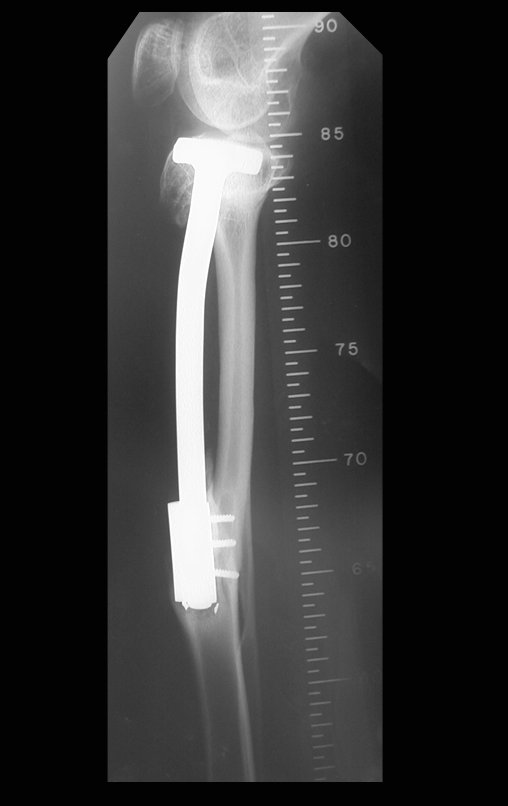
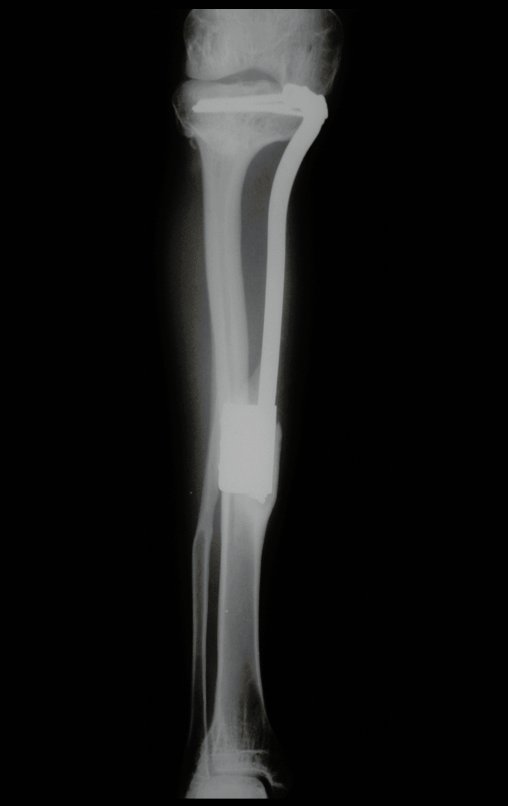
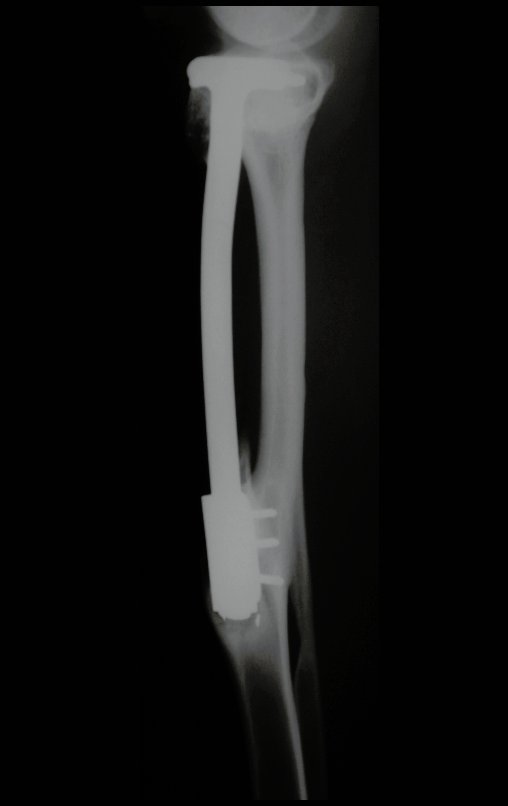
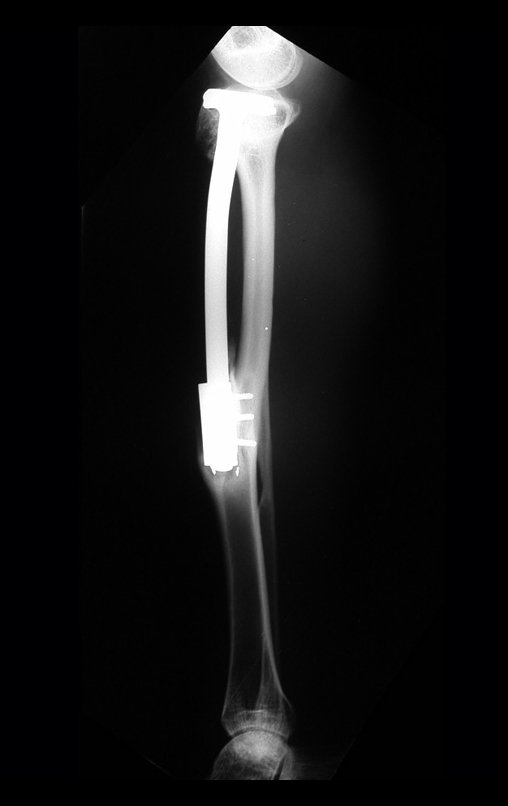
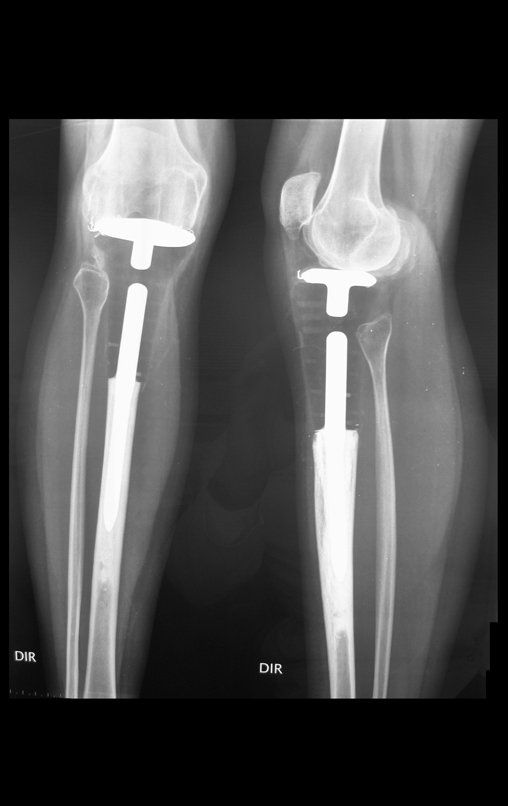
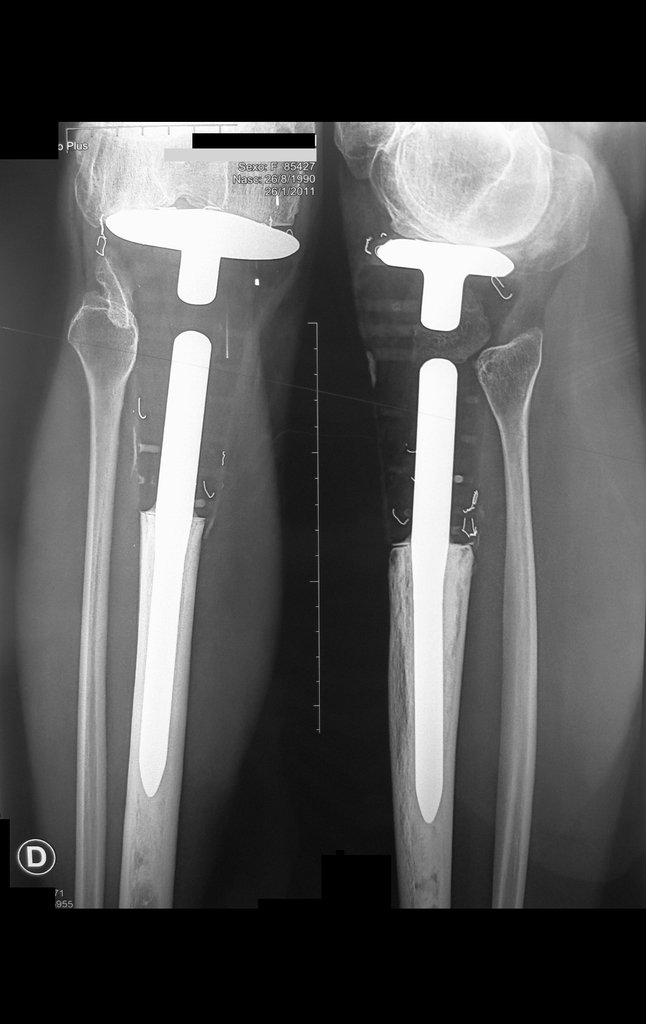
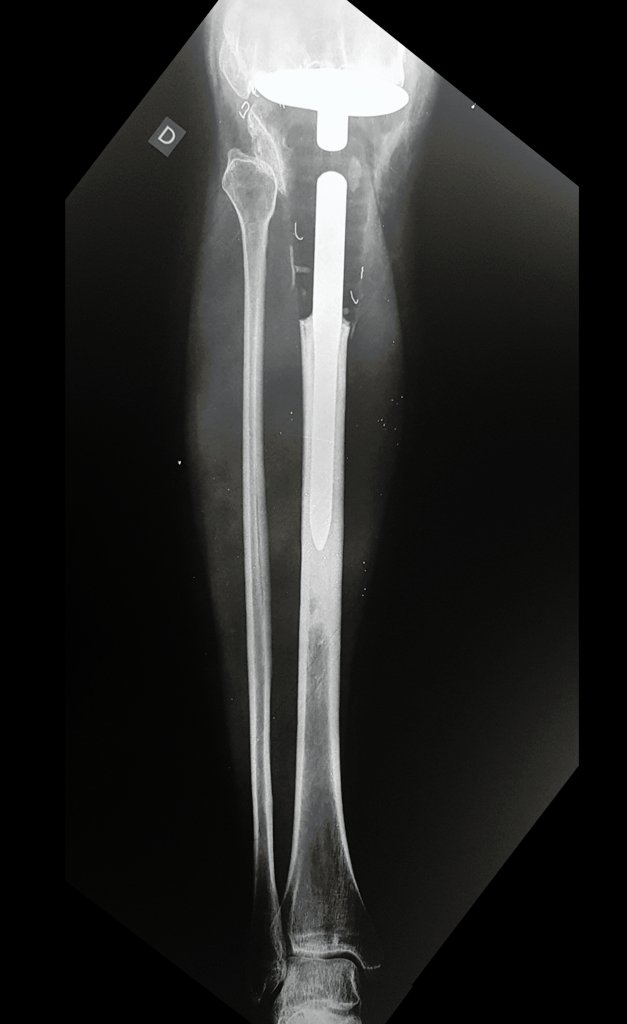
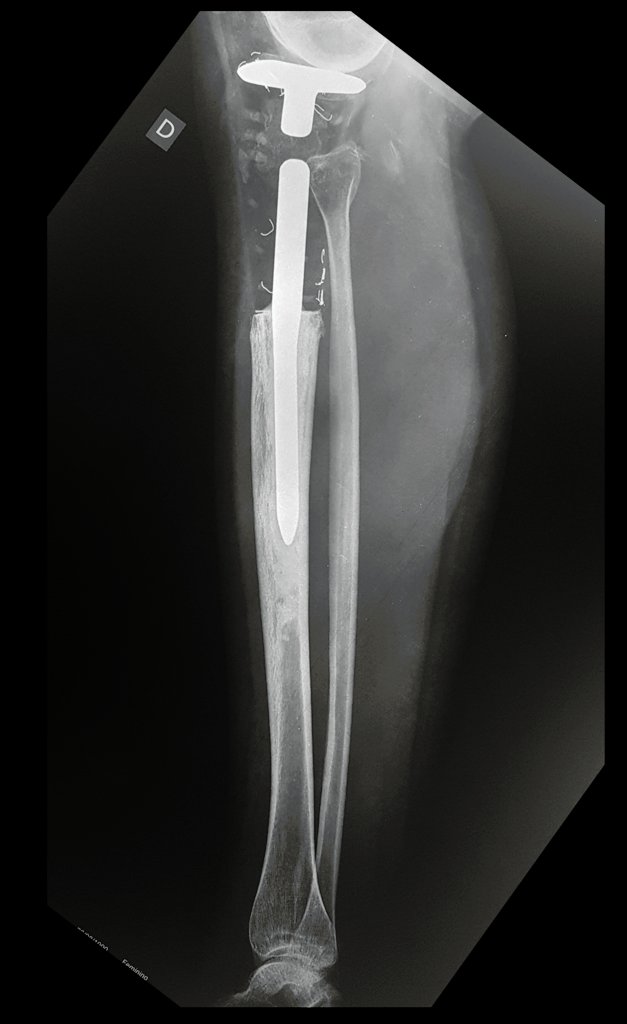
Como pode ser observado nas figuras 7 e 8, a fíbula sofre uma hipertrofia progressiva, fato que aumenta sua resistência, ao contrário dos aloenxertos, os quais podem falhar mesmo após anos de integração12,22.
A osteogênese por distração com fixador externo pode ser considerada como opção de reconstrução. Dispensa o uso de enxerto e possibilita o preenchimento da falha óssea criada pela ressecção do tumor por meio do transporte ósseo, porém, demanda tempo prolongado de uso do fixador externo e risco de infecção23.
Fang e colaboradores, relataram três casos de osteossarcoma em crianças de 10 a 14 anos, sendo um na região distal do fêmur e dois na região proximal da tíbia, que foram submetidos a ressecção tumoral e montagem de aparelho de Ilizarov, seguindo o princípio de osteogênese por distensão8. Em um dos pacientes houve necessidade de re–intervenção cirúrgica por perda do alinhamento ósseo. Dois pacientes obtiveram consolidação, em oito meses, e o fixador foi retirado. O terceiro paciente foi submetido a compressão e nova distensão para alcançar a consolidação óssea. Dois casos apresentaram infecção no trajeto dos fios do fixador. Ao final de dois anos de seguimento, a discrepância dos membros inferiores era de 1,0 a 1,5cm.
A utilização da fíbula ipsilateral para o tratamento das lesões da tíbia, especialmente nas sequelas de trauma, surgiu em 1884, quando Hahn descreveu seu emprego para o tratamento de uma pseudoartrose da tíbia11.
Desde então, diversas técnicas de utilização da fíbula ipsilateral foram descritas e a ocorrência de consolidação óssea, com hipertrofia da fíbula, consagraram esses métodos como alternativa no tratamento das falhas da tíbia9,10,11,12,24,25,26,27,28.
Entretanto tais trabalhos não utilizavam a região epifisária da fíbula, limitando seu uso preferencialmente para as lesões diafisárias da tíbia.
O desenvolvimento da microcirurgia trouxe nova dimensão ao tratamento das falhas ósseas. Taylor e colaboradores descreveram a utilização da fíbula para restaurar defeitos segmentares em diversos ossos além da tíbia, utilizando a reconstrução vascular microcirúrgica da fibula13.
Porém, a necessidade de equipe cirúrgica especializada, o alto custo e a possibilidade de trombose arterial ou venosa pós-operatórias na microcirurgia constituem importantes desvantagens em relação as técnicas que não requerem microcirurgia 29,30.
A microcirurgia, porém, abriu o caminho para a possibilidade de se incluir a fise em um retalho ósseo, preservando sua irrigação sanguínea e consequentemente o potencial de crescimento longitudinal do segmento ósseo14,31.
Entretanto, os primeiros relatos de transposição de cartilagem de crescimento apresentavam resultados inconsistentes ou ruins, sendo que Straub relatou algum crescimento ósseo no seu trabalho, em 1929, pois fragmentos de cartilagem com ou sem osso eram utilizados sob a forma de enxertos32-35.
A partir da descrição de Pho e colaboradores14, vários trabalhos utilizando técnica microcirúrgica de transposição da fíbula com a fise e a epífise proximais mostraram que o potencial de crescimento da fise poderia ser preservado36-39. Estes trabalhos, no entanto, envolvem técnica microcirúrgica para a reconstrução vascular da fíbula, com as desvantagens e complicações que o método apresenta.
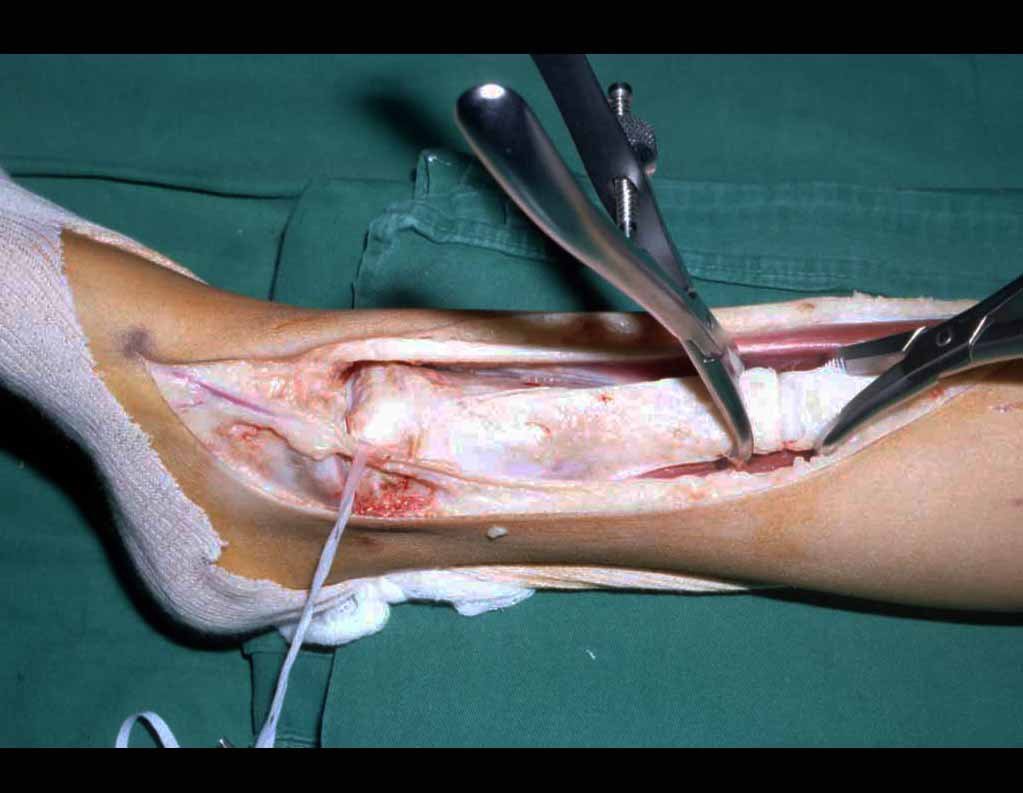
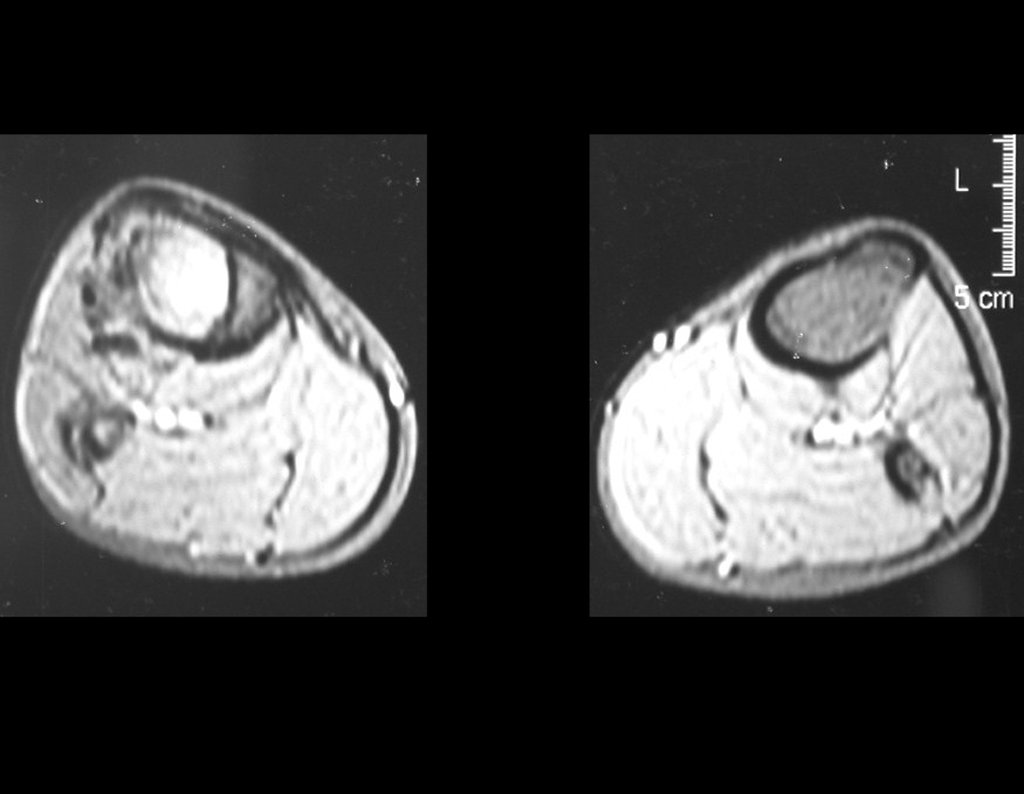
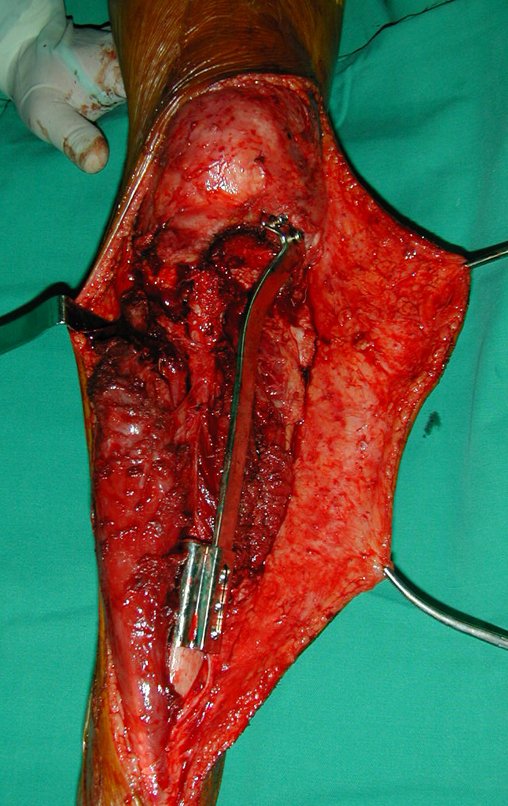
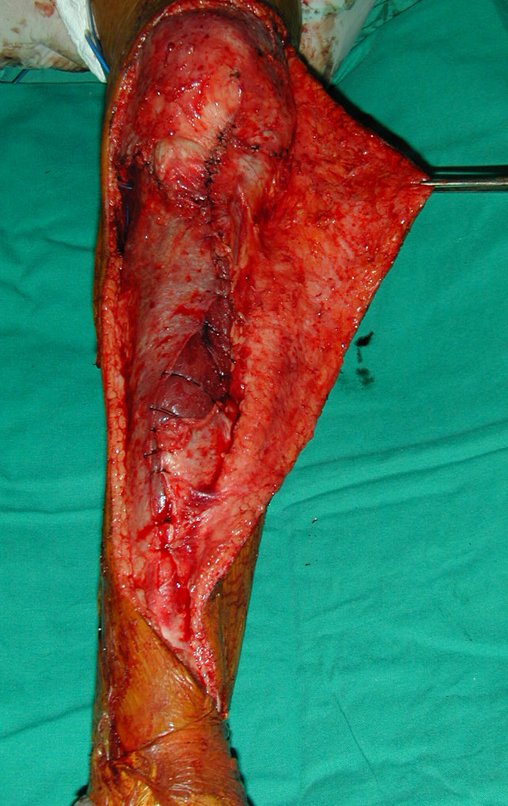
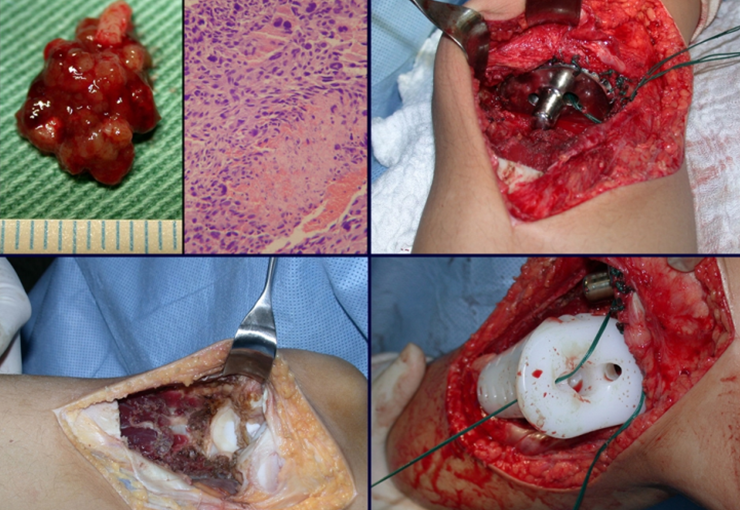
A técnica apresentada neste trabalho tem a vantagem de dispensar qualquer método para reconstruir a vascularização do segmento fibular, com sua fise e sua epífise, pois os vasos são preservados, tratando-se de um retalho local que é posicionado sob a epífise da tíbia.
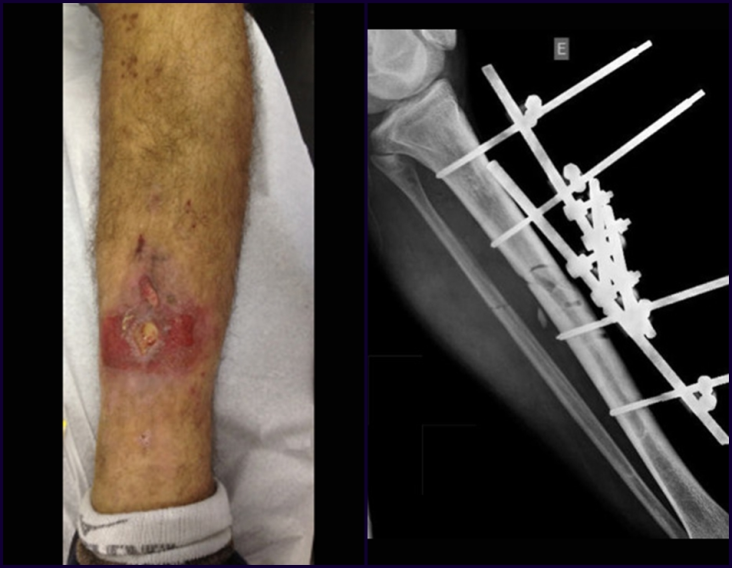
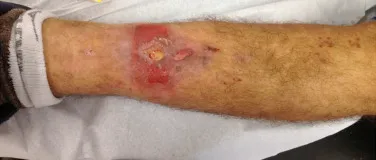
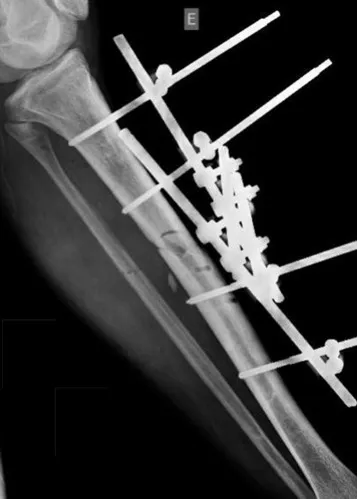
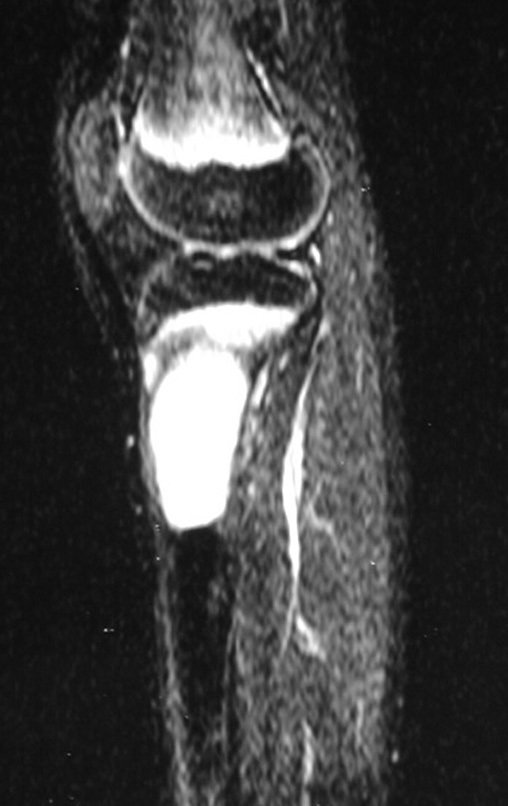
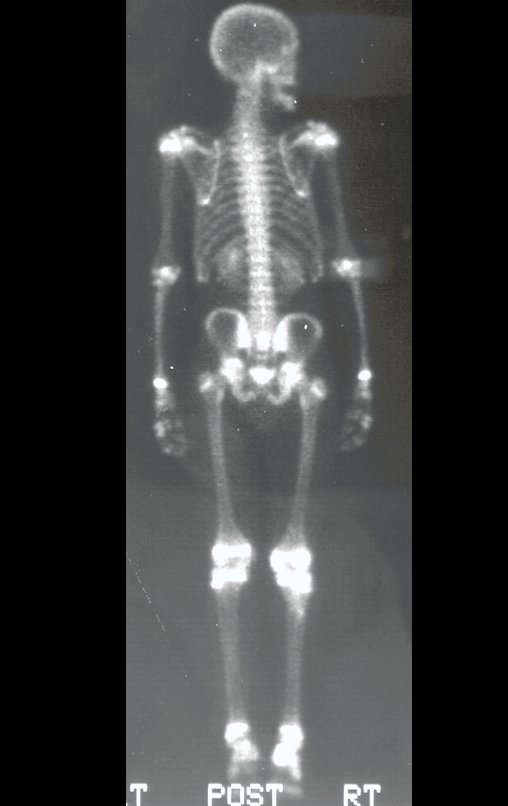
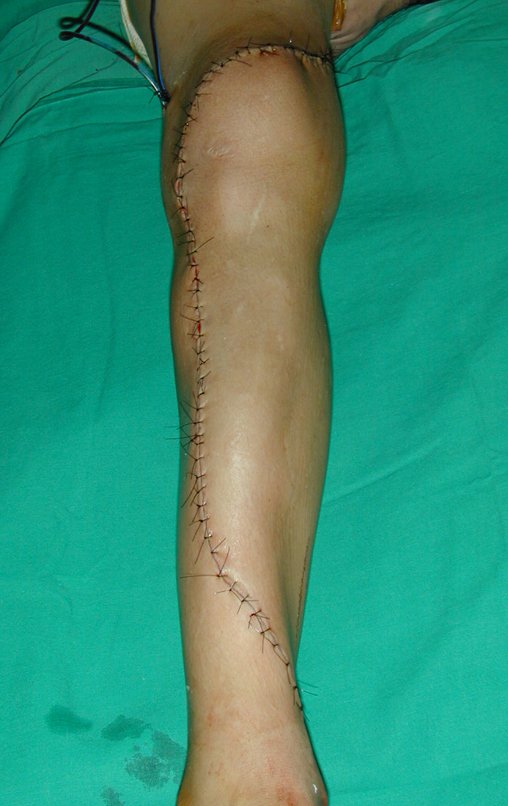
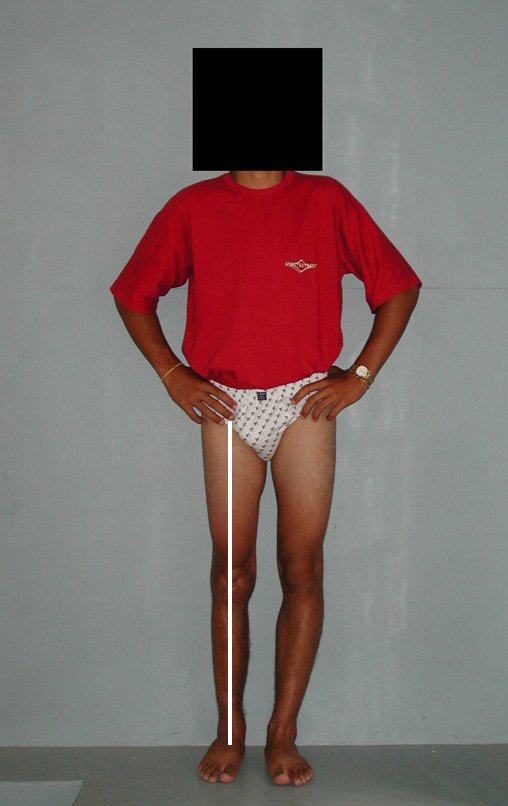
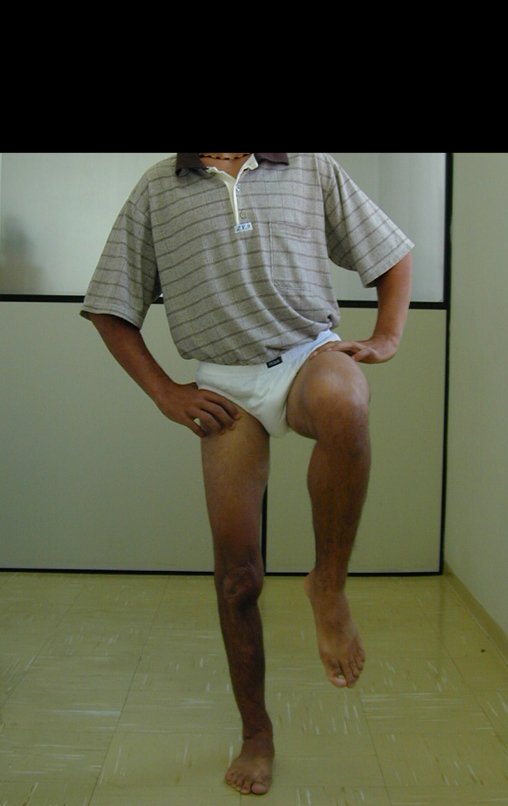
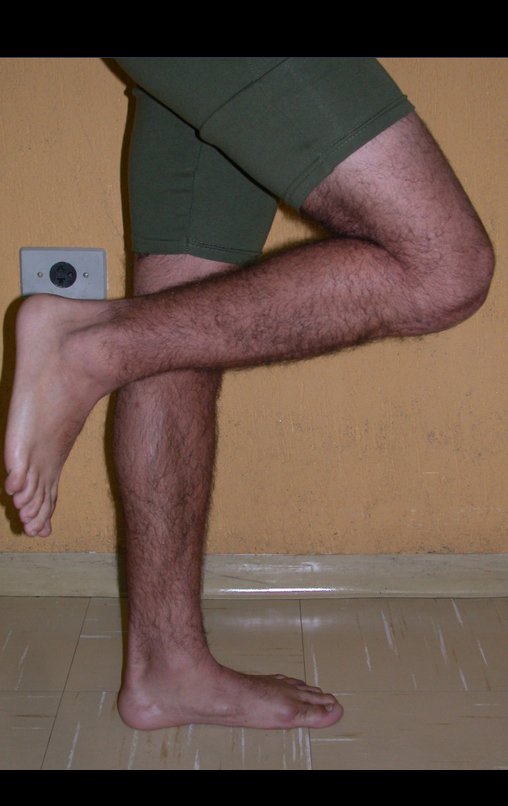
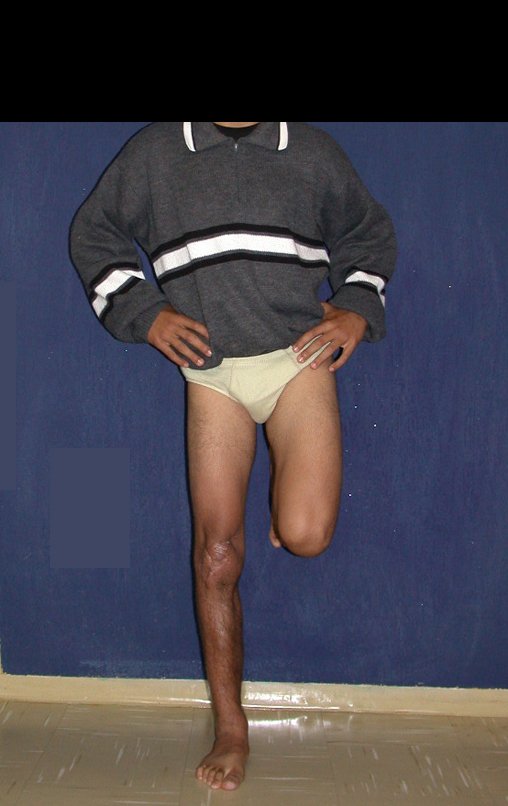
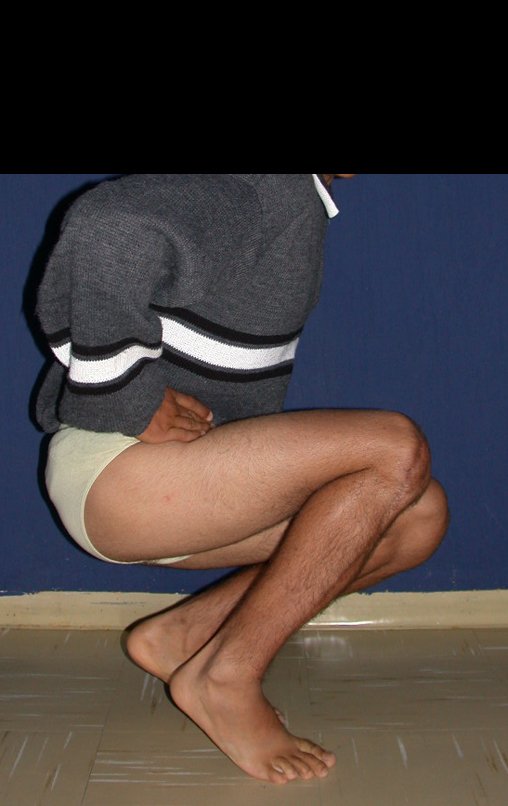
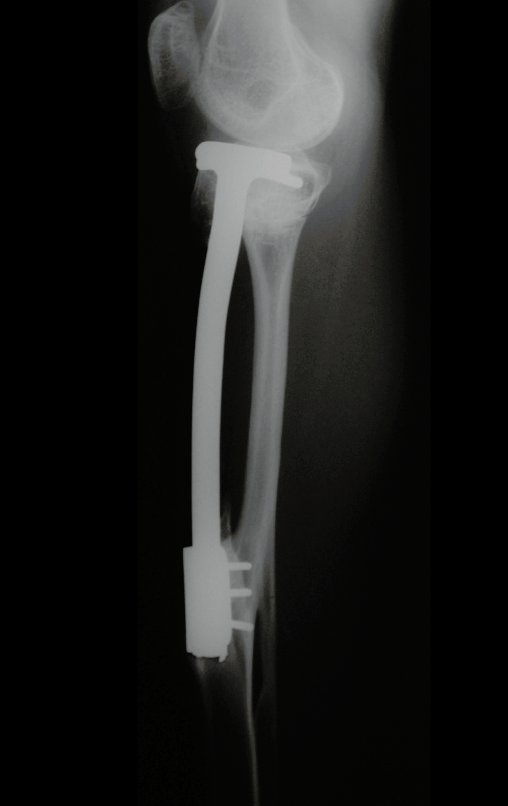
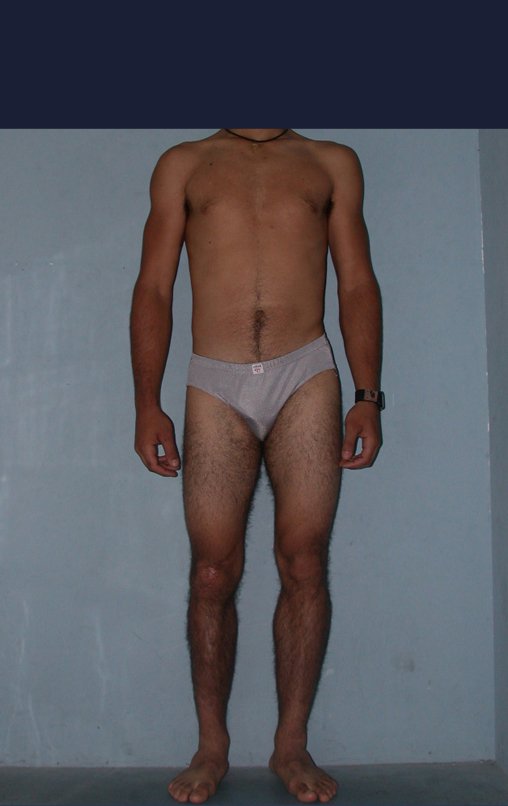
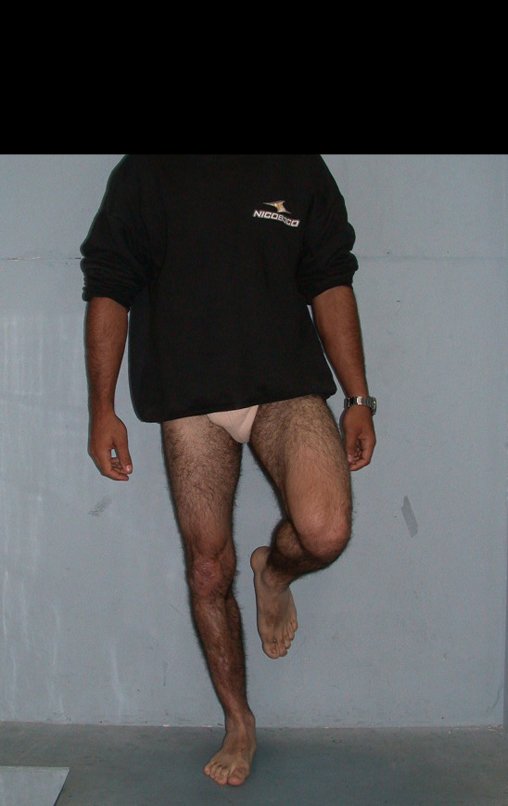
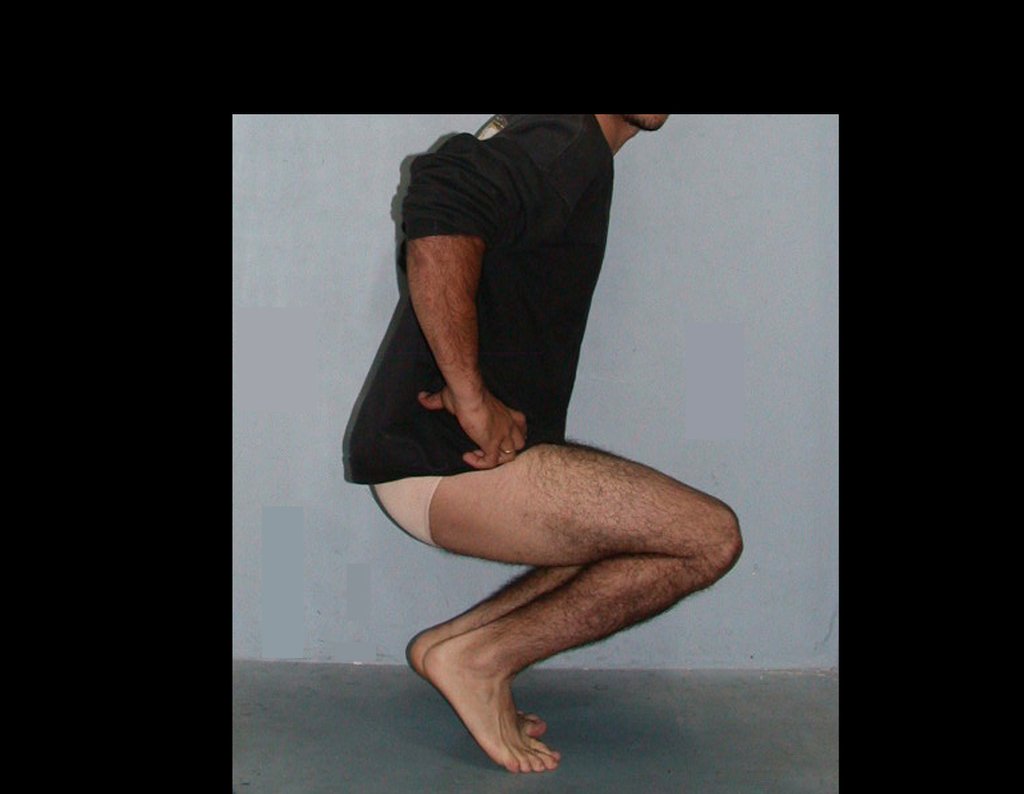
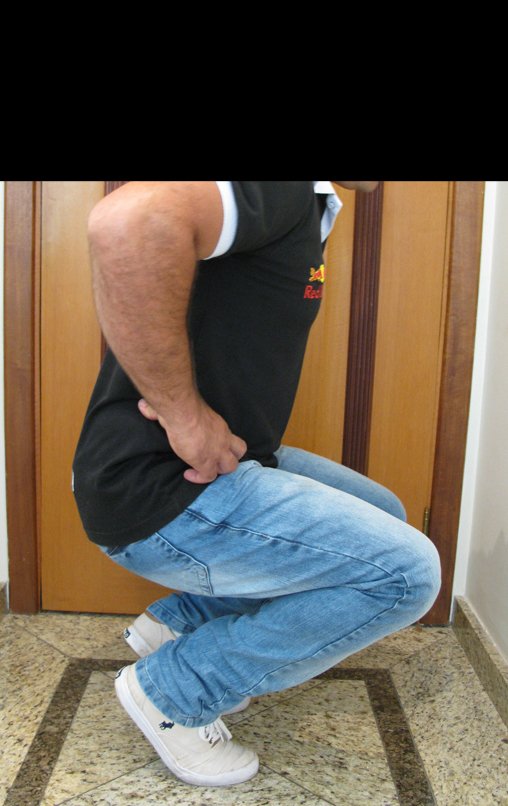
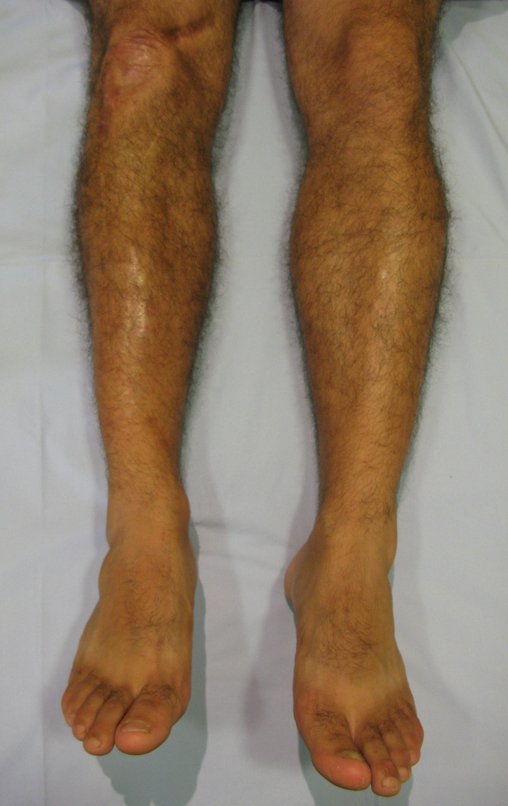
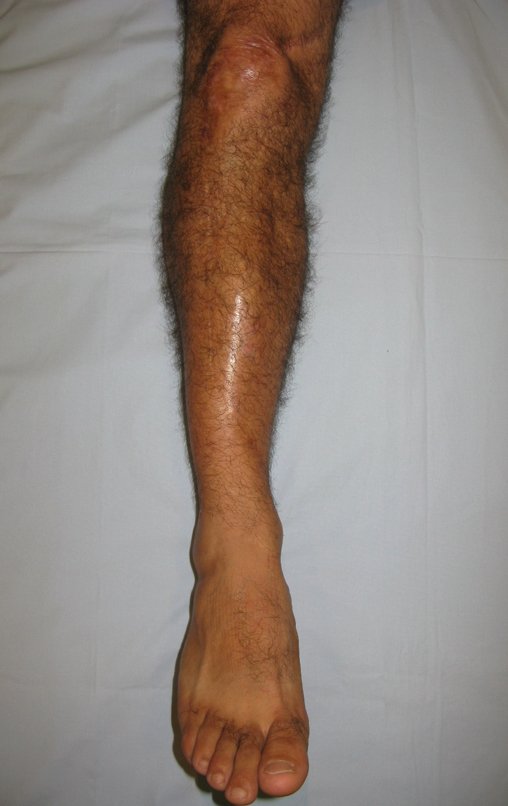
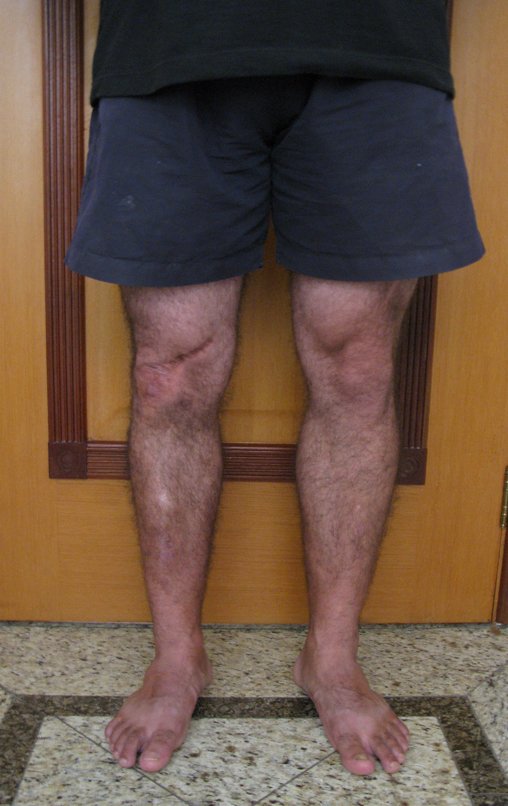
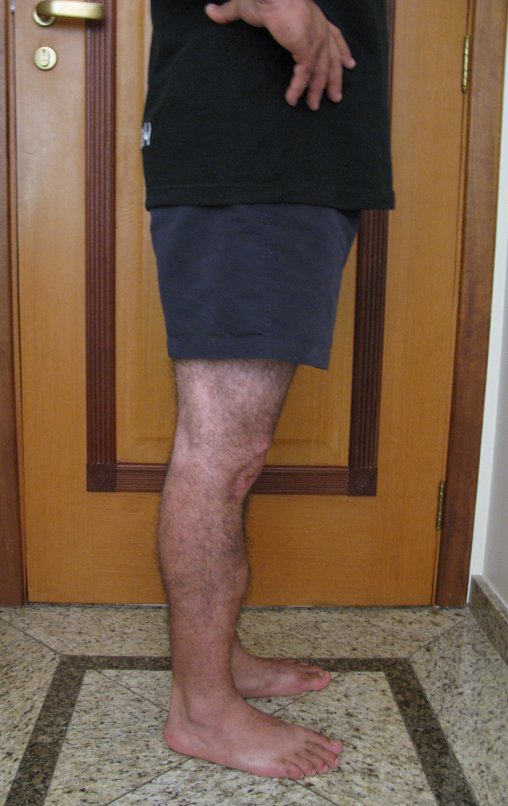
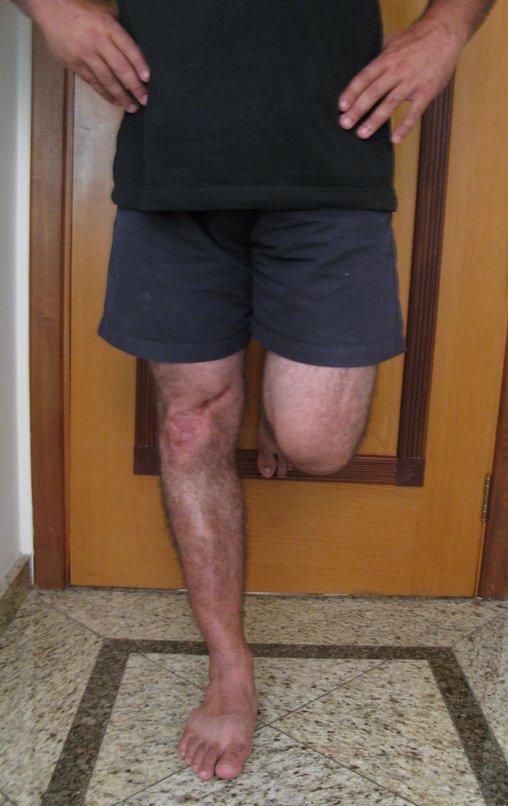
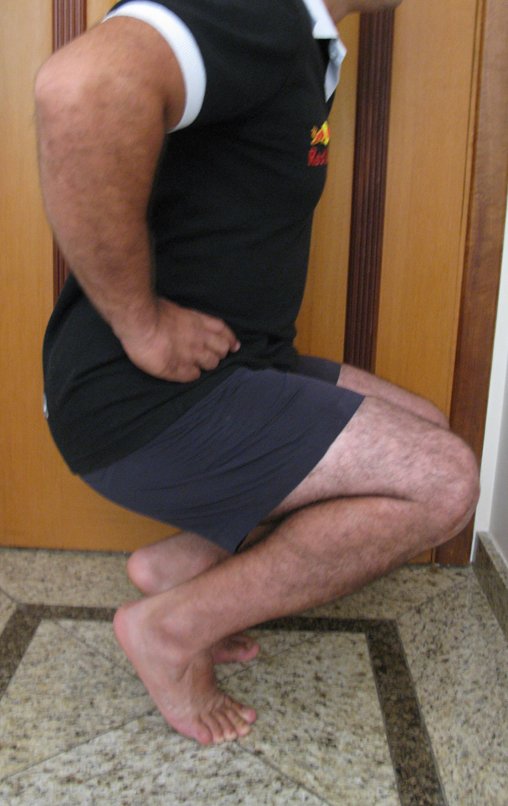
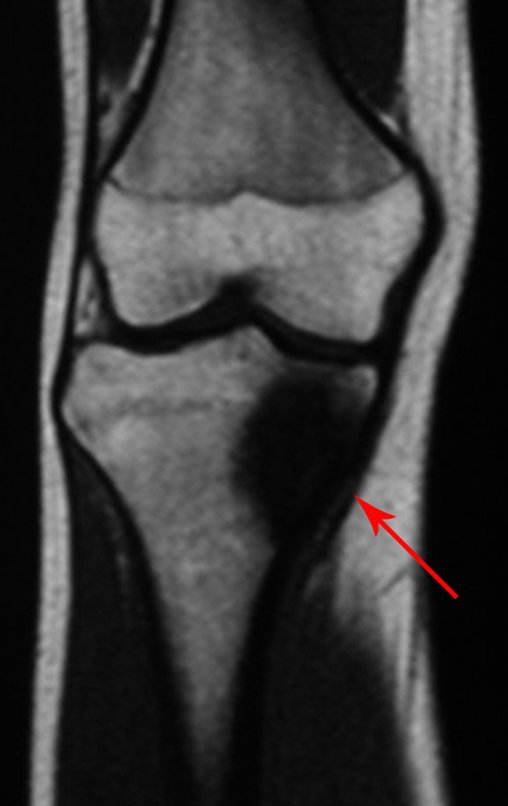
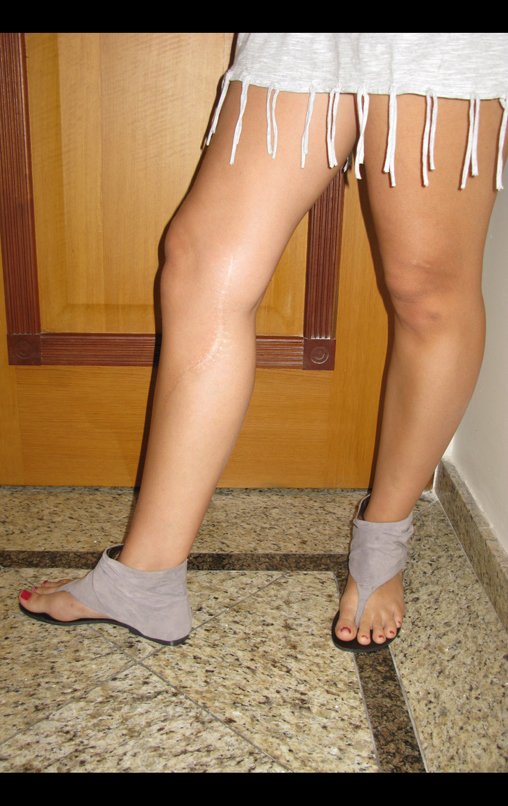
Constatamos a consolidação óssea, a hipertrofia da fíbula e o crescimento longitudinal dos segmentos transplantados nos 2 casos apresentados. No primeiro caso, o paciente apresentou uma deformidade em valgo do joelho direito no período pós-operatório imediato. Com o crescimento, que ocorreu no primeiro ano, houve correção tanto da deformidade em valgo quanto da inclinação dos parafusos, sinais de crescimento do segmento fibular. Nos próximos quatorze meses houve crescimento de mais 1,2cm do segmento fibular transposto (Figura 7). Este paciente, que era adolescente, na época com 12 anos, encontra-se com 26 anos de idade, esta funcionalmente bem e com os membros inferiores equalizados.
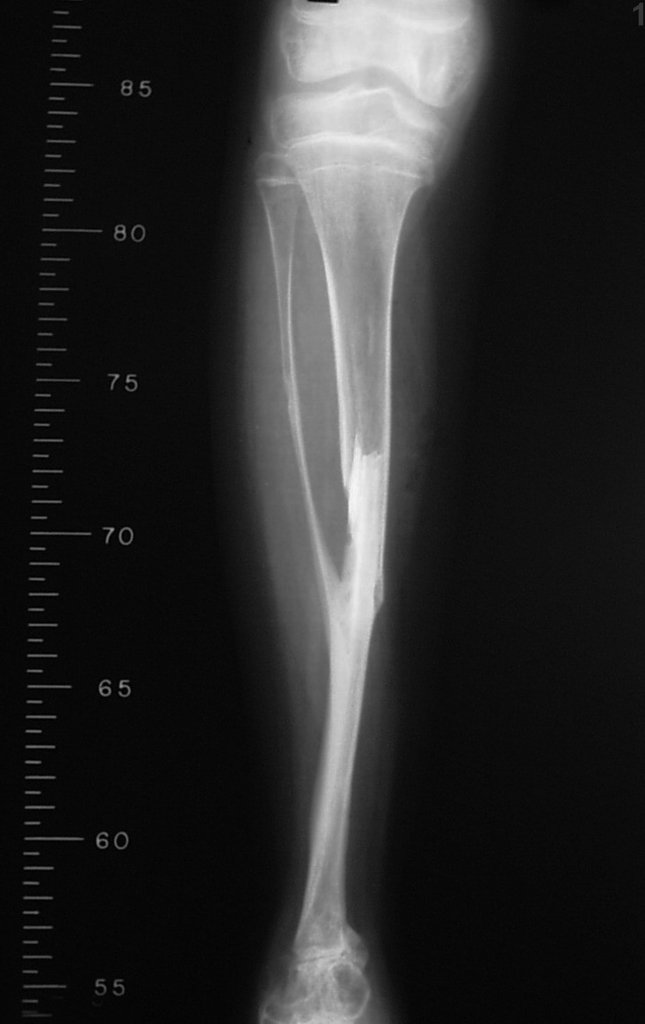
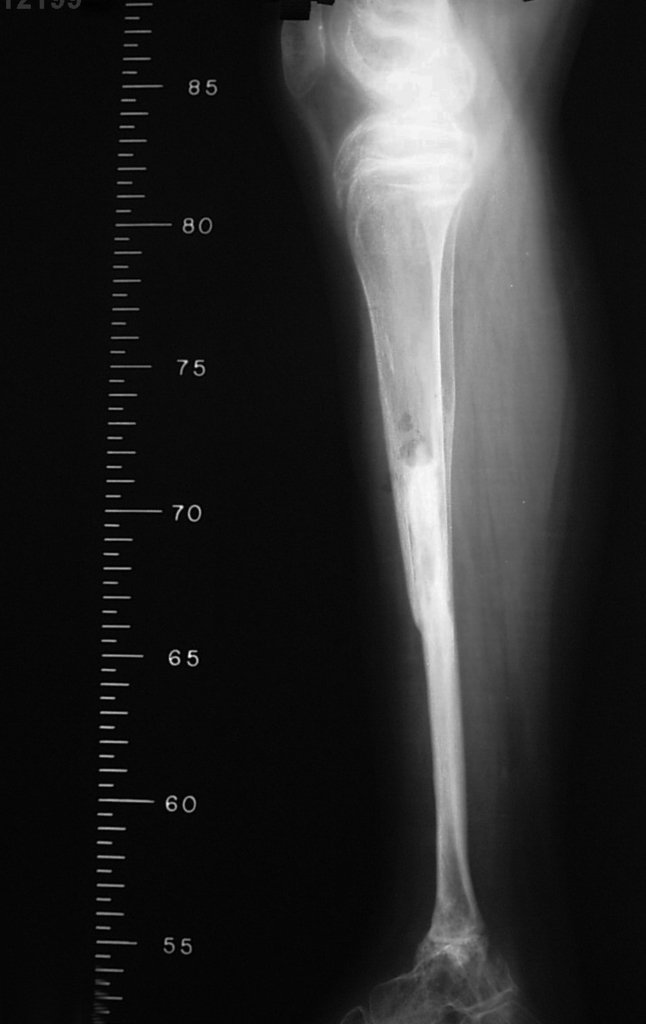
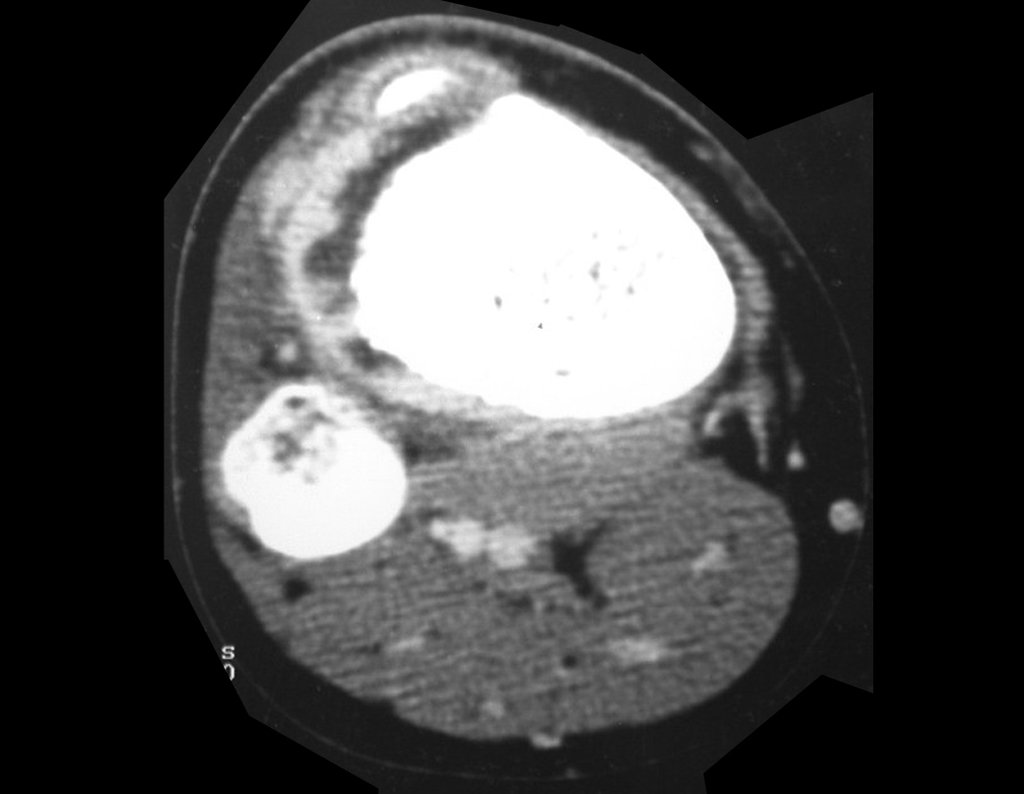
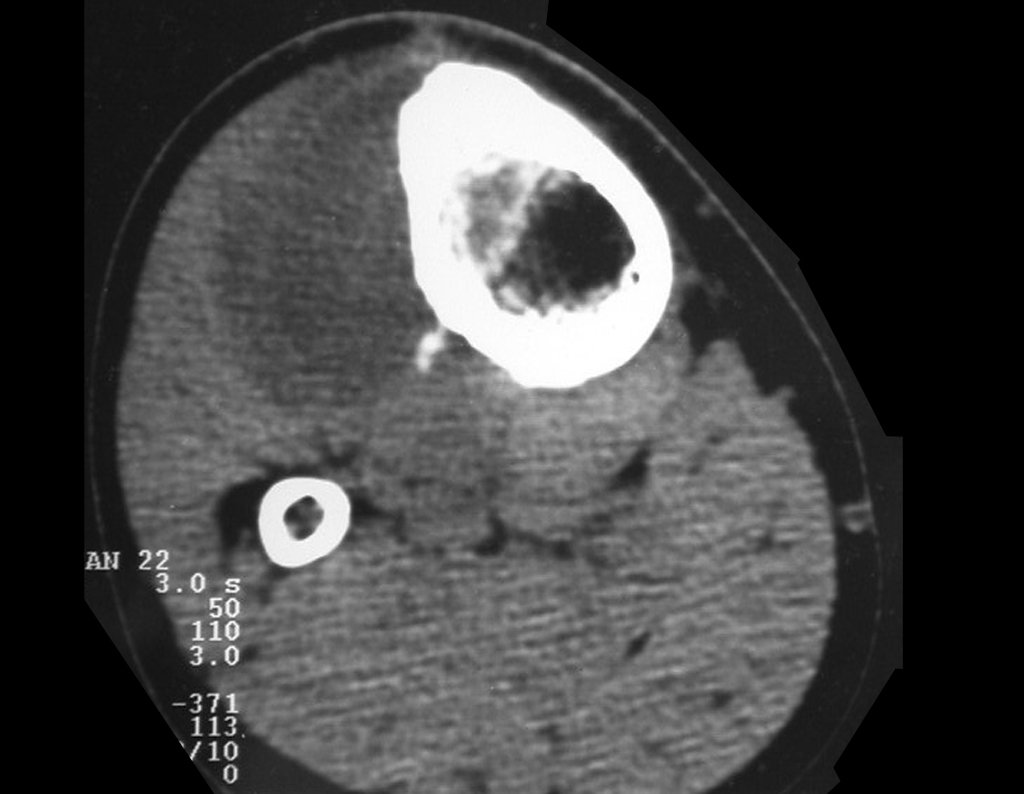
No segundo caso, uma criança com aproximadamente três anos de idade, que poderia ter sido ideal para o acompanhamento do crescimento por mais longo período, houve complicação clínica que determinou o óbito. Entretanto, nos primeiros 8 meses após a cirurgia, pudemos observar crescimento de pelo menos 0,3cm no segmento da fíbula transposta, o que indica que o potencial de crescimento havia sido preservado.
CONCLUSÕES
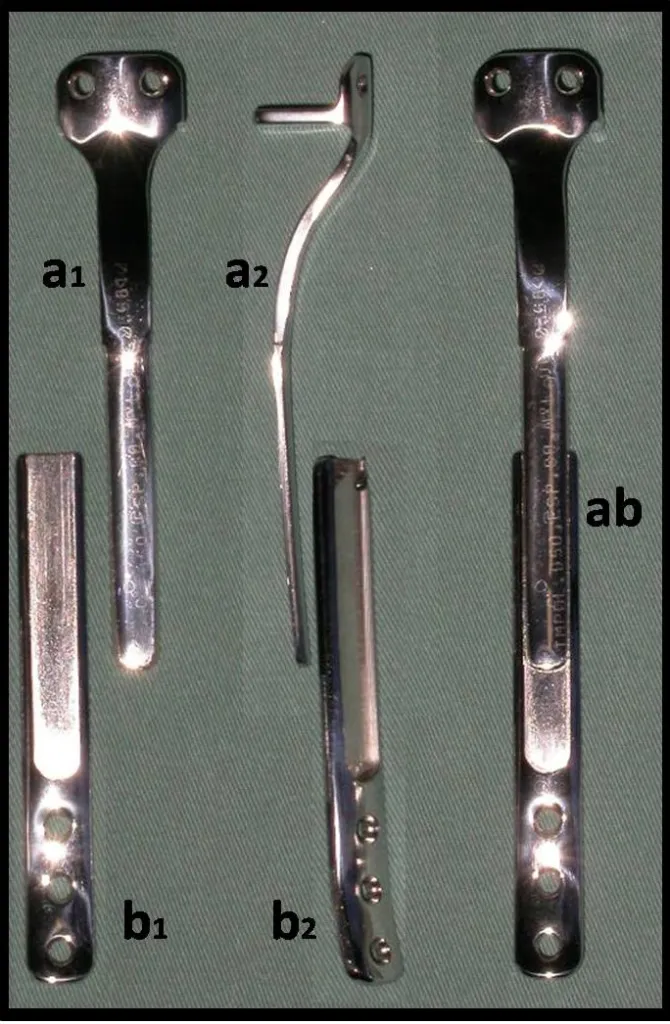
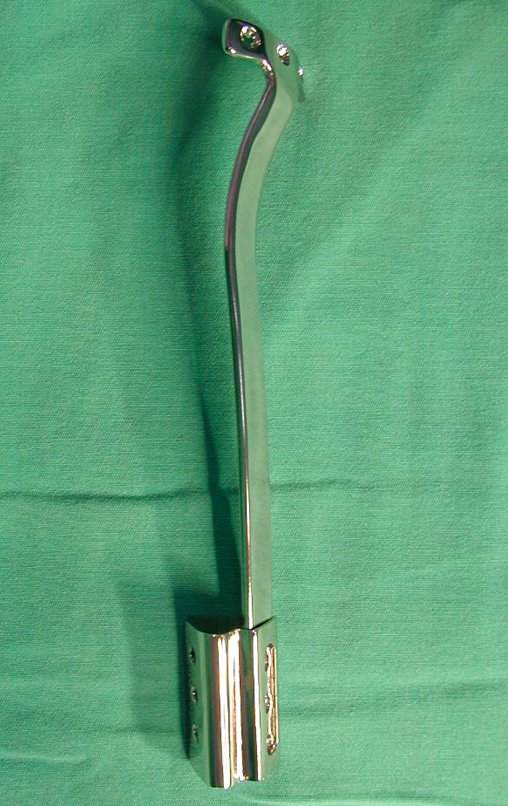
O dispositivo de fixação interna extensível estabiliza a reconstrução e possibilita o crescimento, através do mecanismo de deslizamento entre as placas.
O segmento fibular proximal, transferido por esta técnica, tem preservada a sua irrigação sanguínea e a função de crescimento da fise transplantada.
Consideramos que esta técnica, de transferência da fíbula com sua cartilagem de crescimento, pode ser utilizada na reconstrução de lesões que acometem o segmento metadiafisário proximal da tíbia em crianças, onde a epífise da tíbia puder ser preservada.
Artigo Original
AUTOTRANSPLANTE DA FÍBULA PARA A TÍBIA COM A PLACA EPIFISÁRIA PROXIMAL
FIBULAR TRANSPLANT TO TIBIA WITH PROXIMAL EPIPHYSEAL PLATE
Autores
Cassiano Leão Bannwart1
Pedro Péricles Ribeiro Baptista2,3,4
Davi Gabriel Bellan4,5
- 1 Médico Ortopedista e Cirurgião de Mão . Assistente do Grupo de Cirurgia da Mão da Santa Casa de São Paulo
- 2 Professor Adjunto da Faculdade de Ciências Médicas da Santa Casa de São Paulo
- 3 Médico Chefe de Clínica da Santa Casa de Misericórdia de São Paulo
- 4 Médico Ortopedista da Oncocirurgia do Hospital São José da Beneficência Portuguesa de São Paulo
- 5 Médico Ortopedista do Grupo de Oncologia Ortopédica da Universidade Federal de São Paulo UNIFESP
Trabalho desenvolvido no Departamento de Ortopedia e Traumatologia da Santa Casa de Misericórdia de São Paulo.
Autor correspondente: Pedro Péricles Ribeiro Baptista, R. General Jardim, 846 conjunto 41. CEP 01223010. São Paulo – SP Brasil. (11) 3231-4638. drpprb@gmail.com
Resumo
As lesões ósseas que ocorrem na região proximal de tíbia em crianças podem acometer a fise de crescimento e representam um desafio ao tratamento ortopédico, para reconstrução do defeito ósseo criado. Os métodos de reconstrução nem sempre contemplam o potencial de crescimento ósseo deste segmento. O objetivo deste trabalho é apresentar uma nova técnica cirúrgica de reconstrução óssea baseada na transposição da fíbula ipsilateral, com sua fise de crescimento, sem a necessidade de técnica microcirúrgica e utilizando dispositivo de fixação interna deslizante. Material e Método: Os autores relatam dois casos, de pacientes portadores de sarcoma ósseo, na região proximal da tíbia, com comprometimento da cartilagem de crescimento, os quais foram tratados pela técnica proposta. Resultados: Em ambos os casos houve consolidação óssea, hipertrofia e crescimento longitudinal da fíbula transposta. Conclusão: A técnica, proposta pelos autores, manteve a vascularização do segmento ósseo auto-transplantado, sem a necessidade de microcirurgia e preservou o potencial de crescimento fisário. O implante utilizado permitiu a crescimento longitudinal do osso, evidenciado radiograficamente. Nível de evidência IV. Série de casos.
Descritores: crescimento, deslizante, dispositivo, fíbula, fise, fixação, sarcoma tibialização, transplante.
Abstract
Bone lesions, which occur in the proximal tibia in children, can affect the growth plate and represent a challenge to the orthopedic treatment for reconstruction of bone defects created. Reconstruction methods do not always compensate the potential for bone growth in this segment. The objective of this paper is to present a new surgical technique of bone reconstruction, based on the transposition of the ipsilateral fibula with it’s growth plate, without the need for microsurgical technique and using a sliding internal fixation device. Material and Method: The authors report two cases of patients with bone sarcoma at the proximal tibia, affecting the growth cartilage, which were treated by the proposed technique. Results: In both cases, there were bone healing, hypertrophy and longitudinal growth of the fibula transposed. Conclusion: The technique proposed by the authors, kept the vascularization of bone segment auto-transplanted without the need for microsurgery and preserves physeal growth potential. The implant used allowed the longitudinal bone growth, as radiographically seen. Levels of evidence IV. Case series.
Keywords: growth, sliding, device, fibula, physis, fixation, sarcoma, tibialisation, transplant.
CONFLITOS DE INTERESSE
Os autores declaram não haver conflito de interesse.
REFERÊNCIAS BIBLIOGRÁFICAS
- Digby KH. The measurement of diaphysial growth in proximal and distal directions. J Anat Physiol 1916 Jan;50(Pt 2):187-8.
- Mercuri M, Capanna R, Manfrini M et al. The management of malignant bone tumors in children and adolescents. Clin Orthop Related Res 1991; 264:156-68.
- Boyer MI, Bray PW, Bowen CVA. Epiphyseal plate transplantation: an historical rewiew. Br J Plast Surg 1994; 47:563-9.
- Saghieg S, Abboud MR, Muwakkit SA, Saab R, Haidar R. Seven-year experience of using Rephiphysis expandable prosthesis in children with bone tumors. Pediatr Blood Cancer. 2010; 55(3): 457-63.
- Gosheger G, Gebert C, Ahrens H, Streitbuerger A, Winkelmann W, Hardes J. Endoprosthetic reconstruction in 250 patients with sarcoma. Clin Orthop Relat Res 2006; 450:164-71.
- Campanacci L, Manfrini M, Colangeli M, Ali N, Mercury M. Long-term results in children with massive bone osteoarticular allografts of the knee for high-grade osteosarcoma. J Pediatr Orthop 2010; 30(8): 919-27.
- Weitao Y, Qiqing C, Sogtao G, Jiaqiang W. Epiphysis preserving operations for the treatment of lower limb malignant bone tumors. Eur J Surg Oncol 2012: 38(12)1165-70.
- Fang B, Yi C, Zhang Q, Li Y, Wei Q, He W Zeng Z. Combined epiphyseal preservation and autograft bone transfer in treatment of children osteosarcoma. Zhongguo Xiu Fu Chong Jian Wai Ke Za Zhi 2013: 27(1): 45-9.
- Davis A G. Fibular substitution for tibial defects. J Bone Joint Surg 1944; Vol XXVI. NO. 2. April.
- Agiza ARH. Treatment of tibial osteomyelitic defects and infected pseudoarthroses by the Huntigton fibular transference operation. J Bone Joint Surg 1981; 63-A(5):814-9.
- Langenskiöld A. Hahn’s operation for pseudoarthrosis after osteomyelitis of the tibia in children: A report of three cases. Acta Orthop Scand 1983; 54:714-20.
- Date AS, Solanki SB, Badhe NP, Sonsale PD, Pandit HG. Management of gap non-union of tibia by tibialisation of ipsilateral vascular fibula. J Postgrad Med 1996; 42(4):109-11.
- Taylor GI, Miller GDH, Ham FJ. The free vascularized bone graft: A clinical extension of microvascular techniques. Plast Reconstr Surg 1975; 55(5):533-44.
- Pho RWH, Patterson MH, Kour AK, Kumar VP. Free vascularised epiphyseal transplantation in upper extremity reconstruction. J Hand Surg 1988; 13B:440-7.
- Baptista PPR, Yonamine ES. Dispositivo para fixação interna extensível. Rev Bras Ortop 2001; 36(7): 273-8.
- Justolin LT, Rahal SC, Baptista PPR, Yonamine MJ, Mamprim J, Balieiro CC. Use of extensible internal device in the femur of Young dogs. Veterinary and Comparative Orthopaedics and Traumatology 2008 21 2: 133-139.
- Holzapfel BM, Pilge H, Toepfer A, Jakubietz RG, Gollwitzer H, Rechl H, von Eisenhart-Rothe R, Rudert M. Proximal tibial replacement and alloplastic reconstruction of the extensor mechanism after bone tumor resection. Oper Ortuop Traumatol 2012; 24(3):247-62.
- Jeys LM, Kulkami A, Grimer RJ, Carter SR, Tilman RM, Abudu A. Endoprosthetic reconstruction for the treatment of musculoskeletal tumors of the appendicular skeleton and pelvis. J Bone Joint Surg Am 2008: 90(6): 1265-71.
- Wang TY, Dormand JP, Chang B. Soft-tissue optimization of limb salvage with knee endoprosthesis: 10 year experience at the Children‘s Hospital of Philadelphia. Ann Plast Surg, 2012: 69(5): 560-64.
- Honoki K, Kobata Y, Miyauchi Y et al. Epiphyseal preservation and an intercalary vascularized fibular graft with hydroxypatite composites: Reconstruction in metaphyseal osteosarcoma of the proximal tibia: A case report. Arch Orthop Trauma Surg 2008; 128(2):189-93.
- Muscolo DL, Ayerza MA, Aponte-Tinao LA, Ranalletta M. Partial epiphyseal preservation and intercalary allograft reconstruction in high-grade metaphyseal osteosarcoma of the knee. J Bone Joint Surg Am 2004 Dec;86-A(12):2686-93
- Hriscu M, Mojallal A, Breton P, Bouletreau P, Carret J-P. Limb salvage in proximal humerus malignant tumors: The place of free vascularized fibular graft. J Reconstr Microsurg 2006; 22(6):415-21.
- Kapukaya A, Subasi M, Kandiya E, Ozates M, Ylmaz F. Limb reconstruction with the callus distraction method after bone tumor resection. Arch Orthop Trauma Surg. 2000;120(3-4): 215-8.
- Baptista PPR, Guedes A, Reggiani R, Lavieri R, Pires CEF. Tibialização da fíbula: Descrição de abordagem cirúrgica. Rev Bras Ortop 1998; 33(11):861-6.
- Campbell WC. Transference of the fibula as an adjunct to free bone graft deficiency: Report of three cases. J Orthop Surg 1919; 1:625.
- Carnesale PL, Guerrieri AG. Fibular transplant for loss of substance of tibia. J Bone Joint Surg 1955; 37A(1):204-6.
- Chung YK, Chung S. Ipsilateral island fibula transfer for segmental tibial defects: Antegrade and retrograde fashion. Plast Reconstr Surg 1998; 101(2):375-82.
28.Shapiro MS, Endrizzi DP, Cannon RM, Dick HM. Treatment of tibial defects and nonunions using ipsilateral vascularized fibular transposition. Clin Orthop Related Res 1993; 296:207-12.
- Weiland AJ, Moore JR, Daniel RK. Vascularized bone autografts: Experience with 41 cases. Clin Orthop Related Res 1983; 174:87-95.
- Arai K, Toh S, Tsubo K, Nishikawa S, Narita S, Miura H. Complications of vascularized fibula graft for reconstruction of long bones. Plast Reconstr Surg 2002; 109:2301-6.
- Tsai TM, Ludwig L, Tonkin M. Vascularized fibular epiphyseal transfer. Clin Orthoped 1986; 210:228-34.
- Helferich U. Versuche über die Transplantation des Intermediarknorpels wachsender Rohrenknochen. Deutsche Z Chir 1899; 51:564-73.
- Heller E. Experimentelle Utersuchungen über die Transplantation des Intermediarknorpels in Form der halbseitigen Gelenktransplantation. Arch Klin Chir 1914; 104:843-954.
- Haas SL. Further observations on the transplatation of the epiphyseal cartilage plate. Surg Gynecol Obstet 1931; 52:958-63.
- Straub GF. Anatomic survival, growth and physiological function of an epiphyseal bone transplant. Surg Gynecol Obstet 1929; 48:687-90.
- Sawaizumi M, Maruyama Y, Okajima K, Motegi M. Free vascularized ephiphyseal transfer designed on the reverse anterior tibial artery. British Journal of Plastic Surgery(1991, 44, 57-59.
- Concannon MJ, Croll GH, Boschert MK, Gaines RW, Puckett CL. Free fibular transfer in a growing individual (long-term results). Microsurgery 1993; 14:624-7.
- Becker LM, Zuker RM. Vascularized fibular epiphyseal transplantation for limb salvage following bone tumour excision. Can J Plast Surg 1999; 7(2):65-73.
- Menezes-Leite MC, Dautel G, Duteille F, Lascombes P. Transplantation of the proximal fibula based on the anterior tibial artery: Anatomical study and clinical application. Surg Radiol Anat 2000; 22:235-8.
Clique aqui para baixar o PDF